Дайджест - Промышленная безопасность. Алкилфениловый эфир
Алкилфениловой эфир - Большая Энциклопедия Нефти и Газа, статья, страница 4
Алкилфениловой эфир
Cтраница 4
Циклогексиловый эфир о-хлорфенола является очень стойким и не изомеризуется при нагревании его в присутствии 25 % эфирата фтористого бора в течение 8 час. Этим, вероятно, и можно объяснить отсутствие в продуктах реакции фенольных соединений, которые обычно образуются путем изомеризации алкилфениловых эфиров. [46]
Циклогексиловый эфир о-хлорфенола является очень стойким и не изомеризуется при нагревании его в присутствии 25 % эфи-рата фтористого бора в течение 8 час. Этим, вероятно, и можно объяснить отсутствие в продуктах реакции фенольных соединений, которые обычно образуются путем изомеризации алкилфениловых эфиров. [48]
Установлено, что, изменив условия жидкостной адсорбционной хроматографии, гможно во фракциях алкилсалициловых кислот в виде натриевых солей определить группы алкилсалициловых кислот. Причем не вошедшие в реакцию карбоксилирования алкилфенолы выходят из слоя силикагеля двумя фракциями: в виде алкилфенолятов натрия в смеси с парафино-олефиновыми углеводородами и алкилфенолов с алкилфениловыми эфирами. Практически полное протекание реакции замещения катионов натрия, содержащихся в исходной пробе алкилсалицилатов, на ион водорода происходит за счет наличия необходимого числа парных ОН-групп, связанных с атомом кремния на поверхности силикагеля. [49]
В настоящее время является почти общепризнанным, что при взаимодействии фенолов с оле-финами, спиртами, эфирами или галоидными ал килами в присутствии кислых катализаторов при сравнительно мягких условиях вначале образуются алкилфениловые эфиры, которые затем изомеризуются в алкилфенолы. [50]
Алкилфениловые эфиры могут изомеризоваться в алкилфенолы. Способность к этой реакции в значительной степени определяется природой алкиль-ной группы. Для изомеризации вторичных и первичных алкилфениловых эфиров необходим катализатор. [51]
Согласно [1] ПП 830 см-1 соответствует колебаниям связей в и-алкилфенолах, 755 - о-алкил-фенолах, 695 - монозамещенных бензолах. В изучаемой смесп присутствовали алкилфениловые эфиры, дающие характерное поглощение при 1245 см-1, но алкилфенолы также поглощают в этой области. [52]
Особенное значение этот метод синтеза имеет при получении сульфохлоридов из фенолов [7] и аминов [8], так как в этом случае реакция соли сульфокислоты с пятихяористым фосфором неприменима. Синтез моносульфохлоридов действием хлорсульфоновой кислоты на алкилфениловые эфиры не всегда возможен [9, 10], так как образуются 2 4т - дисульфо хлориды. [53]
Механизм алкилирования фенолов олефинами в присутствии катализаторов кислотного харакера сложен и неоднозначен. С одной стороны, может иметь место прямая атака кар-бениевых ионов ( возникающих из олефина под действием катализатора) на нуклеофильные центры ароматического ядра. С другой стороны, алкилирование можно рассматривать как реакцию присоединения фенола к олефину по правилу В. В. Марковникова с изомеризацией образующихся при этом алкилфениловых эфиров в о - или га-производные хиноидной структуры и перегруппировкой последних в более стабильные алкилфенолы. [54]
Давно известно, что добавки жирных масел или жирных кислот к углеводородным смазочным маслам значительно улучшают их смазочную способность при работе в условиях высоких давлений. Одним из первых синтетических веществ, служивших добавкой к маслам специально для повышения их маслянистости, был метиловый эфир дихлорстеариновой кислоты. После этого с той же целью было специально синтезировано и применено большое число разнообразных веществ, из которых типичными являются осерненные углеводороды, металлические мыла, например свинцовые, длинноце-почечные сложные эфиры и алкилфениловые эфиры фосфорной кислоты, а также хлорированные алкияароматические углеводороды. Для всех этих веществ характерна способность замасливать трущиеся металлические поверхности, предотвращающая непосредственный контакт их друг с другом. Этот процесс аналогичен смачивающему действию поверхностноактивных веществ в водных растворах. [55]
Все катализаторы, приведенные выше по убывающей активности, располагаются в следующий ряд: I V VI IVIIIII. Продуктами реакций являются га-алкилфенолы. Допускается, что образование их протекает через алкилфениловые эфиры. В случае реакции с додециленом получается додецилфенол наряду с дидодецилфе-нолом и эфирными продуктами. [56]
Страницы: 1 2 3 4
www.ngpedia.ru
Полиэтиленгликоли эфиры алкилфениловые - Справочник химика 21
Изучались фосфорорганические соединения, известные своей высокой холинэстеразной активностью и высокой токсичностью для насекомых и теплокровных животных. Соединения испытывали в виде коллоидных растворов для их изготовления был взят промежуточный растворитель, обладающий высокой поверхностной активностью (алкилфениловый эфир полиэтиленгликоля, или вспомогательное вещество ОП-7). ОП-7 вводили в раствор в двойном количестве по отношению к весу фосфорорганического вещества. Испытаны также два воднорастворимых фосфорорганических соединения в водных растворах без добавления ОП-7. Кроме этого, испытаны чистый ОП-7 и некоторые другие вещества. Токсичность соединений изучалась на инфузориях-парамециях. [c.128] Алкилфениловый эфир полиэтиленгликоля. . 197 [c.35]ВЛИЯНИЕ АЛКИЛФЕНИЛОВОГО ЭФИРА полиэтиленгликоля ОН-7 на всасывание фосфорорганических инсектицидов [c.111]
Влияние ОП-7, как и других алкилфениловых эфиров полиэтиленгликоля, на всасывание веществ через кожу не изучено. Неясно, в частности, играет ли ОП-7 роль транспортного агента по отношению к ФОС. В связи с этим были проведены специальные исследования. [c.111]
Для определения контактной сравнительной токсичности соединений были использованы 30%-ные растворы чистых соединений в алкилфениловом эфире полиэтиленгликоля (ОП-7), которые разбавляли водой до получения заданных концентраций действующего вещества. [c.14]
В исходные жидкие концентраты, кроме 15% действующего начала, входило 85% алкилфенилового эфира полиэтиленгликоля (вспомогательное вещество ОП-7). Для опрыскиваний из этих [c.105]
Для определения инсектицидности препаратов брали их растворы в алкилфениловом эфире полиэтиленгликоля (вспомогательное вещество ОП-7) и готовили водные эмульсии концентрация действующего начала в эмульсии не превышала 1%. Кроме того, три соединения (Л 9 9, 13, 14) были испытаны в виде водных э.мульсии, изготовленных из 50 ч.-ного спиртового раствора инсектицида, а шесть соединений (№ 11, 12, 41—44) испытаны в виде пылевидных тальковых препаратов. [c.122]
Препараты легко образовывали достаточно устойчивые водные суспензии. Физические свойства препаратов при воздействии температуры 40° и при хранении в течение 160 дней не изменялись. Испытания показали, что наилучшим гербицидом является препарат 2, в состав которого з качестве поверхностно-активного агента входит алкилфениловый эфир полиэтиленгликоля (ОП-10). [c.268]
Метафос получают по реакции (25) 4-нитрофенолята наг-рия с диметилхлортиофосфатом. Реакцию рекомендуется прово. дить в водной среде при интенсивном перемешивании в присутствии алкилфениловых эфиров полиэтиленгликоля в качестве эмульгаторов. Особенно важно контролировать pH среды, которая должна соответствовать pH водного раствора 4-нитрофенолята натрий. Конечный продукт не должен содержать свободного нитрофенола более допустимых норм, в противном случае препарат приобретает фитоцидные свойства. [c.444]
Некоторые неионогенные вещества (например, алкилфениловый эфир полиэтиленгликоля и другие), введенные в очень малых количествах (0,1 — 1 кг на 1 т), способствуют размягчению двойного суперфосфата [c.658]
Оксиэтилированный алкилфенол ОП-10, ОП-7, ОП-4 (ГОСТ 8433-81). Алкилфениловый эфир полиэтиленгликоля относится к классу неионогенных ПАВ. ОП-10 легко растворяется в воде (дистиллированной и пластовой) с обильным пенообразова-нием. Хорошо растворим в этаноле, бензоле и не растворим в уайт-спирите и дизельном топливе. ОП-10 имеет достаточно однородный состав с содержанием основного вещества около 99 и влаги 0,5 %, плотностью 1060-1080 кг/м . Товарный реагент ОП-10 представляет собой маслянистую жидкость светло-желтого, светло-ко-ричневого цвета с содержанием влаги не более 0,5 %. [c.263]
Большинство ФОС, применяемых в сельском хозяйстве в качестве инсектицидов, выпускаются промышленностью в виде концентратов с алкилфениловым эфиром полиэтиленгликоля ОП-7. Это продукт конденсации 7 молекул окиси этилена с ал-килфенолом. ОП-7 является неионогенным поверхностно-активным веществом. Применяется он как эмульгатор и как вещество, обладающее высокой смачивающей способностью. Концентрация ОП-7 в препаратах составляет от 40 до 70%. Из концентратов готовят водные эмульсии, чаще 0,05—1,0% по действующему началу. [c.111]
Возможности анализа высокомолекулярных вторичных алкилфенолов методом газо-жидкостной хроматографии ограничены их высокими температурами кипения и сложностью состава. Наиболее низкокипящими компонентами, присутствующими во фракции вторичных алкилфенолов, являются алкилфениловые эфиры и не вошедшие в реакцию фенол и нарафино-олефцновые углеводороды. При газо-жидкостном хроматографировании на полиэтиленгликоль- сукцинате при 190 °С фракции алкилфенолов, полученных алкилированием фенола фракцией а-олефинов Се—С , достигнуто разделение в виде последовательно выходящих из колонки групп пиков парафино-олефиновых углеводородов С —С , алкилфениловых эфиров, различающихся длиной алкильного радикала и местом при--соединения атома кислоррда к атомам углерода алкильного радикала, и в виде отдельного пика — фенола [280]. За пиком фенола выходят пики наиболее низкокипящей части алкилфенолов остальные алкилфенолы удерживаются в колонке и могут быть разделены на компоненты в иных условиях хроматографирования. Наиболее подходящими для этих целей являются высокотемпературные жидкие фазы, такие, как 8Е-30. [c.129]
В некоторых случаях в карбамидные смолы вводят ПАВ. Так, введение 0,1—0,5 % неионогенного ПАВ — алкилфениловых эфиров полиэтиленгликолей — в смолу СПМФ-4 снижает поверхностное натяжение на 25—30 %, увеличивает смачиваемость древесины в 1,8—2,0 раза и уменьшает работу растекания в 4—6 раз [45]. [c.41]
По наши-м работам, 0,02%-ный водный раствор дизтил-4-ни-трофенилтиофосфата (в присутствии 0,029о алкилфенилового эфира полиэтиленгликоля) после одногодичного хранения в условиях лаборатории на рассеянном свету по токсичности для амбарного долгоносика оказался почти таким же, как свежеприготовленный раствор (такой же концентрации). [c.67]
Эквитоксичные для парамеций концентрации испытанных веществ приведены в таблице. Обращает на себя внимание высокая токсичность алкилфенилового эфира полиэтиленгликоля (ОП-7), большая, чем токсичность фосфорорганических соединений. Для насекомых, а также для теплокровных животных, наоборот, токсичность ОП-7 ничтожна, а токсичность фосфорорганических соединений, например указанных под номерами 1—3, чрезвычайно велика. [c.128]
Активные антйхолинэстеразные фосфорорганические соеди нения—метафос, тиофос, изосистокс, карбофос, хлорофос и октаметил—оказывают на инфузорий-парамеций токсическое действие более слабое, чем такое вещество как алкилфениловый эфир полиэтиленгликоля (ОП-7). Хлорофос и октаметил менее токсичны для парамеций, чем хлористый натрий. [c.130]
chem21.info
Изомеризация алкилфениловых эфиров - Справочник химика 21
Циклогексиловый эфир о-хлорфенола является очень стойким и не изомеризуется при нагревании его в присутствии 25% эфирата фтористого бора в течение 8 час. при температуре 120 — 140° С. Этим, вероятно, и можно объяснить отсутствие в продуктах реакции фенольных соединений, которые обычно образуются путём изомеризации алкилфениловых эфиров. [c.210]Окончательные выводы о рациональной технологической схеме алкилирования фенола могут быть сделаны только на основании изучения механизма реакции и определения скоростей отдельных ее стадий. Исследования, касающиеся механизма алкилирования на окисноалюминиевом катализаторе, немногочисленны в основном они посвящены изомеризации алкилфениловых эфиров [108, 144—148]. Однако установленные этими исследованиями [c.242]
ИЗОМЕРИЗАЦИЯ АЛКИЛФЕНИЛОВЫХ ЭФИРОВ [c.220]Изомеризация алкилфениловых эфиров 221 [c.221]
Изомеризация алкилфениловых эфиров 267 [c.267]
Используя способность аллилфениловых эфиров в определенных условиях претерпевать п-изомеризацию, при наличии свободного о-положения, Брюсова и Иоффе разработали простой и удобный синтез ценного душистого вещества эвгенола путем описанной выше изомеризации, с выходом на эвгенол до 38%. Однако и в данном случае, как и при изомеризации алкилфениловых эфиров, наряду с основным продуктом изомеризации — эвгенолом, образуются и другие продукты гваякол, аллиловый эфир эвгенола и т. д. [c.268]
При алкилировании фенолов спиртами в паровой фазе в качестве катализаторов используют природные глины, алюмосиликаты, цеолиты, а также окислы алюминия, магния, титана, тория и их смеси. Обладает каталитической активностью также поли-фосфорная кислота, осажденная на термостойком носителе. Реакцию проводят при 250—500 °С, главным образом с низкомолекулярными спиртами С1—С4. Состав продуктов реакции зависит от условий процесса и селективности катализатора. Большинство известных катализаторов ориентируют алкильные заместители в орто-положение. Однако на многих из них при повышенной температуре также хорошо образуются м- и л-изомеры. Жесткие условия алкилирования способствуют протеканию побочных процессов. Так, при изучении превращений л-н-пропилфенола на алюмосиликатном катализаторе [98] при 300—350 °С отмечено образование фенола, ж-н-пропилфенола, ди- и триалкилфенолов ге-крезола и л-этилфенола, т. е. одновременно протекают деалкилирование, изомеризация, диспропорционирование и расщепление. При низких температурах основные продукты алкилирования— алкилфениловые эфиры, которые являются, по-видимому, промежуточными продуктами при образовании алкилфенолов. Выходы последних при парофазном алкилировании довольно высоки и при соответствующем подборе катализатора и оптимальных условий могут достигать 80—95%. [c.232]
Изомеризация этих эфиров в алкилфенолы изучалась многими исследователями в присутствии различных катализаторов. В настоящее время является почти общепризнанным, что при взаимодействии фенолов с олефинами, спиртами, эфирами или галоидными алкилами в присутствии кислых катализаторов при сравнительно мягких условиях вначале образуются алкилфениловые эфиры, которые затем изомеризуются в алкилфенолы. Легкость и порядок реакции изомеризации зависят от температуры. [c.220]
Наиболее простым и перспективным синтезом алкилфенолов и их эфиров, несомненно, является реакция алкилирования фенолов олефинами. Ее можно рассматривать как реакцию присоединения фенола к олефину по правилу В. В. Марковникова с последующей изомеризацией образующихся при этом алкилфениловых эфиров в о-или п-производные хиноидной структуры и перегруппировкой последних в более стабильные алкилфенолы [c.167]
Алкилирование является сложным процессом, включающим ряд последовательных и параллельных реакций. Очень часто наряду с целевыми реакциями протекают вторичные и побочные процессы— внутри- и межмолекулярные перегруппировки, деалкилирование и изомеризация полученных алкилфенолов. Замещение атомов водорода в ядре фенолов происходит последовательно с образованием MOHO-, ди- и полиметилфенолов. Наблюдается также образование алкилфениловых эфиров последние, однако, уже i [c.215]
Алкилфениловые эфиры могут изомеризоваться в алкилфенолы. Способность к этой реакции в значительной степени определяется природой алкильной группы. Например, трет-бутилфениловый эфир в отсутствие катализатора при кипячении превращается в п-трет-бутилфенол 15691. Для изомеризации вторичных и первичных алкилфениловых эфиров необходим катализатор. Так, н-бутилфениловый эфир в присутствии хлористого алюминия превращается в о- и л-бутилфенол [570]. Другими примерами могут служить реакции изомеризации вАпор-бутилфенилового эфира [570] и изопропил-лг-толило-вого эфира [571]. [c.179]
Изомеризациия этих эфиров в алкилфенолы изучалась многими исследователями в присутствии различных катализаторов. В настоящее время является почти общепризнанным, что при взаимодействии фенолов с олефинами, спиртами, эфирами или галоидными алкилами в присутствии кислых катализаторов при сравнительно мягких условиях вначале образуются алкилфениловые эфиры, которые затем изомеризуются в алкилфенолы. Легкость и порядок реакции изомеризации зависят от температуры, времени, катализатора, величины и строения алкильного радикала и от наличия заместителей в бензольном ядре. [c.266]
С. В. Завгородним [48—50] доказано, что алкилирование фенолов псевдобутиленом, пентеном-2 и циклогексеном в присутствии 5—10% ВРз-0(С2Н5)2 протекает через образование в качестве промежуточных продуктов алкилфениловых эфиров, изомеризующихся в алкилфенолы. Им же показано, что циклогексиловый эфир о-хлорфенола не претерпевает изомеризацию даже с 25% ВРз-0(С2Нб)2 при нагревании до 120—140°, в течение 8 часов, 1 [c.266]
Механизм алкилирования фенолов олефинами в присутствии катализаторов кислотного харакера сложен и неоднозначен. С одной стороны, может иметь место прямая атака кар-бениевых ионов (возникающих из олефина под действием катализатора) на нуклеофильные центры ароматического ядра. С другой стороны, алкилирование можно рассматривать как реакцию присоединения фенола к олефину по правилу В. В. Марковникова с изомеризацией образующихся при этом алкилфениловых эфиров в о- или га-производные хиноидной структуры и перегруппировкой последних в более стабильные алкилфенолы. [c.124]
chem21.info
Алкилфениловой эфир - Большая Энциклопедия Нефти и Газа, статья, страница 3
Алкилфениловой эфир
Cтраница 3
Метод жидкостного микрохроматографического анализа промышленных фракций вторичных алкилфенолов с длиной алкильного радикала С9 - С20 основан на их разделении на группы: 2 6-диалкил-фенолы и алкилфениловые эфиры, о-моноалкилфенолы и 2 4-диалкил-фенолы, и-моноалкилфенолы, не вошедшие в реакцию парафино-олефиновые углеводороды. [32]
Однако механизм алкили-рования с их участием позволяет объяснить многие экспериментальные данные, как, например, селективность орто-алкилирова-ния, возможность непосредственного метилирования фенолов в ядро, образование и превращения алкилфениловых эфиров. [33]
Литературные данные и наши систематические исследования в этой области показывают, что наиболее, простым, интересным и перспективным синтезом алкилфенолов и их алкиловых эфиров, как и описанных в главе II алкилбензолов, является реакция ал-килирования фенолов и алкилфениловых эфиров олефинами. [34]
Сложность состава фракций высокомолекулярных алкилфено-лов определяется различием в длине и строении алкильного радикала, различием в числе и положении алкильных радикалов по отношению к гидроксильной группе в бензольном кольце и различием в положении места присоединения бензольного кольца к одному из углеродных атомов алкильного радикала, а также наличием алкилфениловых эфиров и не вошедших в реакцию углеводородов и фенола. Для более высокомолекулярных алкилфенолов необходимо комплексное использование методов препаративного разделения и анализа, включая кроме вышеукаганных методов жидкостную адсорбционную хроматографию, а также ядерно-магнитный резонанс. [35]
По данным исследований фракций алкилфенолов, полученных алкилированием - фенола индивидуальными сс-олефинами и промышленными фракциями а-олефинов [5, 269-271 ], составляющие группы компонентов располагаются на силикагеле в следующем порядке возрастания ад-сорбируемости: не вошедшие в реакцию олефино-парафиновые углеводороды, 2 4 6-триалкил - и 2 6-диалкил-фенолы, 2 4-диалкилфенолы, о-моно-алкилфенолы, и-моноалкилфенолы. Группа алкилфениловых эфиров адсорбируется вместе с 2 4 6-триалкил - и 2 6-диалкил и частично с 2 4-диал-килфенолами. [37]
Эти моющие средства, известные сначала под названием игепалей, а позже - алипалей, были разработаны в лабораториях фирмы И. Г. Фарбенин-дустри; их производство базируется полностью на непищевом химическом сырье. В зависимости от степени оксиэтилирования алкилфениловые эфиры полиэтиленгликолей применяют в тскстильшш промышленности для различных целей. Так, например, изододециловый эфир, содержащий в молекуле семь оксиэтильпых групп, особенно пригоден для мойки шерсти, тогда как тот же эфир, но содержащий девять оксиэтилытых групп, наиболее широко используется для мойки хлопчатобумажных тканей. [39]
Эти моющие средства, известные сначала под названием игепалей, а позже - алипалей, были разработаны в лабораториях фирмы И. Г. Фарбенин-дустри; их производство базируется полностью на непищевом химическом сырье. В зависимости от степени оксиэтилирования алкилфениловые эфиры полиэтиленгликолей применяют в текстильной промышленности для различных целей. Так, например, изододециловый эфир, содержащий в молекуле семь оксиэтильных групп, особенно пригоден для мойки шерсти, тогда как тот же эфир, но содержащий девять оксиэтильных групп, наиболее широко используется для мойки хлопчатобумажных тканей. [41]
Эти модели обоснованы с помощью исследований свойств жидких систем, состоящих из сравнительно простых молекул, которые характеризуют поведение фрагментов сложных молекул ПАВ. В разбавленных водных растворах молекулы алкилфениловых эфиров полиоксиэтилен-гликолей ( АФПЭГ) образуют с молекулами воды клатратно-гидратные структуры. ПАВ, мицеллообразование представляет собой фазовый переход второго рода. При этом, в узком интервале концентраций ПАВ протекают коллективные реакции распада клатратно-гидратных структур с образованием агрегатов, имеющих структуру мицелл. [42]
Возможности анализа высокомолекулярных вторичных алкилфенолов методом газо-жидкостной хроматографии ограничены их высокими температурами кипения и сложностью состава. Наиболее низкокипящими компонентами, присутствующими во фракции вторичных алкилфенолов, являются алкилфениловые эфиры и не вошедшие в реакцию фенол и парафино-олефцновые углеводороды. За пиком фенола выходят пики наиболее низкокипящей части алкилфенолов; остальные ал кил-фенолы удерживаются в колонке и могут быть разделены на компоненты в иных условиях хроматографирования. [43]
Метафос получают по реакции ( 25) 4-нитрофенолята натрия с диметилхлортиофосфатом. Реакцию рекомендуется проводить в водной среде при интенсивном перемешивании в присутствии алкилфениловых эфиров полиэтиленгликоля в качестве эмульгаторов. Особенно важно контролировать рН среды, которая должна соответствовать рН водного раствора 4-нитрофенолята натрия. Конечный продукт не должен содержать свободного нитрофенола более допустимых норм, в противном случае препарат приобретает фитоцидные свойства. [44]
Метафос получают по реакции ( 25) 4-нитрофенолята натрия с диметилхлортиофосфатом. Реакцию рекомендуется прово - дить в водной среде при интенсивном перемешивании в присутствии алкилфениловых эфиров полиэтиленгликоля в качестве эмульгаторов. Особенно важно контролировать рН среды, которая должна соответствовать рН водного раствора 4-нитрофенолята натри. Конечный продукт не должен содержать свободного нитрофенола более допустимых норм, в противном случае препарат приобретает фитоцидные свойства. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Влияние алкилфенилового эфира полиэтиленгликоля ОП-7 на всасывание фосфорорганических инсектицидов
Влияние алкилфенилового эфира полиэтиленгликоля ОП-7 на всасывание фосфорорганических инсектицидов
Н. В. Лазарев (1938), Н. С. Правдин (1947) и другие исследователи, касаясь необходимости изучения действия не только основного вещества, но и смеси его с вспомогательным, подчеркивали важность максимального соответствия условий опыта производственным (выбор вспомогательного вещества, соотношение его с основным и др.)- Такая постановка исследований дает возможность определить, реальна ли опасность смеси, используемой в производственных условиях.[ ...]
Большинство ФОС, применяемых в сельском хозяйстве в качестве инсектицидов, выпускаются промышленностью в виде концентратов с алкилфениловым эфиром полиэтиленгликоля ОП-7. Это продукт конденсации 7 молекул окиси этилена с ал-килфенолом. ОП-7 является неионогенным поверхностно-активным веществом. Применяется он как эмульгатор и как вещество, обладающее высокой смачивающей способностью. Концентрация ОП-7 в препаратах составляет от 40 до 70%. Из концентратов готовят водные эмульсии, чаще 0,05—1,0% по действующему началу.[ ...]
Влияние ОП-7, как и других алкилфениловых эфиров поли-этиленгликоля, на всасывание веществ через кожу не изучено. Неясно, в частности, играет ли ОП-7 роль «транспортного агента» по отношению к ФОС. В связи с этим были проведены специальные исследования.[ ...]
ОП-7 представлял собой вещество пастообразной консистенции, коричневого цвета без запаха, со слабокислой реакцией (pH — 6,0). При встряхивании с водой образовывал устойчивую пену.[ ...]
В качестве подопытных животных использовали кошек. После наркоти-зирования кошек (уретан внутримышечно в дозе 1,0—1,2 г/кг) проводили их фиксацию, а затем на коже живота тщательно выстригали шерсть на площади 7X7 см н отмечали место аппликации 5X5 см. Чтобы исключить вдыхание животными паров мегилмеркаптофоса, их располагали под вытяжкой, голова находилась в атмосфере чистого воздуха.[ ...]
В первой серии исследований при аппликации на кожу технического метилмеркаптофоса в дозе 100 мг/кг через 2—3 ч была хорошо заметна фибрилляция на месте нанесения. Примерно через 3—4 ч появлялись и другие признаки отравления: учащение дыхания, слюнотечение. У всех животных уже через 15 мин после аппликации технического метилмеркаптофоса активность холинэстеразы заметно снижалась, со временем степень угнетения фермента нарастала. Через 3 ч после нанесения препарата холинэстераза была угнетена полностью.[ ...]
В этой серии фибрилляция на месте нанесения начиналась раньше, чем в первой и второй сериях. Она была отчетливо заметна у большинства животных уже через 1,5—2 ч. Раньше проявлялись и другие признаки отравления-— слюнотечение, резкое учащение дыхания возникали через 2,5—3 ч после аппликации.[ ...]
Угнетение фермента в этой серии происходило более резко по сравнению с предыдущими. Так, если угнетение холинэсте-разы в первой и второй сериях на 80—90% исходного уровня наблюдалось через 2 ч после аппликации, то в третьей такая же степень угнетения фермента отмечалась в пробах крови, взятых через 1 ч. Активность АХЭ-эритроцитов и ХЭ-сыворотки была угнетена почти полностью в первой и второй сериях исследований через 3 ч, а в третьей — через 2 ч после применения препарата. Гибель животных в третьей серии происходила в более ранние сроки (все пять кошек погибли в 1-е сутки).[ ...]
Фибрилляция на месте аппликации и другие признаки интоксикации в этой серии возникали примерно в те же сроки, что и во второй серии исследований, в которых на кожу кошкам наносили метилмеркаптофос с ОП-7 в соотношении 1:1.[ ...]
Активность холинэстеразы после аппликации препарата снижалась довольно резко. Однако полное угнетение фермента, как и в первых двух сериях, отмечалось через 3 ч после нанесения.[ ...]
Вернуться к оглавлениюru-safety.info
Способ получения @ -алкил-алкоксифенилдитиофосфановых кислот
1 .СПОСОБ ПОЛУЧЕНИЯ 0-АЛКИЛ- -АЛКОКСИФЕНИЛДИТИОФОСФОНОВЫХ КИСЛОТ, отличающийся тем, что, с целью упрощения процесса, алкилфениловый эфир подвергают взаимодействию с белым фосфором и элементарной серой при нагревании, с последующей обработкой образующегося комплекса спиртом в присутствии каталитических количеств органического основания,например пиридина, и вьзделением целевого продукта известными приемами.2.Способ по П.1, отличающийся тем, что алкилфениловый эфир, белый фосфор и серу используют в молярных соотношениях 4-6:2:5 соответственно.3.Способ по пп. 1 и 2, о т л ичающийся тем, что нагревание ведут до температуры 150-170"С.
СОЮЗ СОВЕТСНИХ
WUH
РЕСПУБЛИК (191 (И) ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABTOPCHOMV СВИДЕТЕЛЬСТВУ (2 1) 1450027/23-4 (22) 16.06.70 (46) 23.06.84. Бюл. ¹ 23
1(72) H.К. Близнюк, З.Н. Kaama, P.В. Стрепьцов, Г.А. Маджара и Л.Э. Кирилина (7i) Всесоюзный научно-исследовательский.институт фитопатологии (53) 547 .34 1.26 118.07 (088.8) . (54) (57) 1.СПОСОБ ПОЛУЧЕНИЯ О-АЛКИЛ-АЛКОКСИФЕНИЛЛИТИОФОСФОНОВЫХ КИСЛОТ, отличающийся тем, что, с целью упрощения процесса, алкилфениловый эфир подвергают взаимодействию с белым фосфором и элеэ(я) С 07 F 9/38 С 07 F 9/40 ментарной серой при нагревании, с последующей обработкой образующегося комплекса спиртом в присутствии каталитических количеств органического основания, например пиридина, и выделением целевого продукта известными приемами.
2. -Способ по п. 1, о т л и ч а юшийся тем, что алкилфениловый эфир, белый фосфор и серу используют в молярных соотношениях 4-6:2:5 соответственно.
3. Способ по пп. 1 и 2, о т л ич а ю шийся тем, что нагрев,з— ние ведут до температуры 150-170 С.
336986
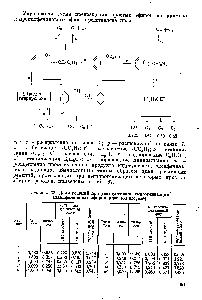
Изобретение относится к области фосфорорганических соединений, а именно к новому способу получения
0-алкил-алкоксифенилдитиофосфоновых кислот общей формулы
КО Р
1О где R u R — алкил.
Эти соединения являются полупродуктами синтеза разнообразных фосфорорганических соединений.
Известен способ получения 0-алкил15
-дитиофосфоновых кислот взаимодействием ангидридов дитиофосфоновых кислот со спиртами.
Недостаток этого способа заключается в относительной труднодоступ- >0 ности ангидридов дитиофосфоновых кислот, а также в том, что последние обычно высокоплавки и нерастворимы в обычных органических растворителях, что затрудняет их промьнпленное использование в качестве полупродуктов синтеза.
Предлагаемый способ получения
0-алкил-алкоксифенилдитиофосфоновых кислот заключается в том, что .алкил"
30 фениловый эфир подвергают взаимодействию с белым фосфором и элементарной серой при нагревании с последующей обработкой образующегося комплекса спиртом в присутствии каталитических количеств органического ос- З5 нования, например пиридина, и выделением целевого продукта известными приемами.
Алкилфениловый эфир, белый фосфор и серу используют в молярных соотно40 шениях 4-6:2:5 соответственно.
Первую стадию процесса проводят при нагревании до температуры 150о
170 С в течение 2-3 ч, вторую стадию — обработку спиртом при 60-120 С.
Применяя определенный избыток алкилфенилового эфира, весь процесс можно провести в гомогенных условиях, так как промежуточно образующийся комплекс при температуре реакции находится в расплаве или в растворе.
Для гомогенизации среды вместо избытка алкилфенилового эфира, можно использовать инертные органические 55 растворители, например алифатические углеводороды или их смеси.
Целевые продукты выделяют известными приемами.
Предлагаемый способ можно испольэовать и для получения эфиров других ароматических дитиофосфоновых кислот, используя вместо алкилфенилового эфира другие ароматические соединения, например бенэол, толуол, ксилолы или нафталин. Однако реакция в этом случае протекает значительно труднее.
Пример 1. Получение 0-бутил-этоксифенилдитиофосфоновой кислоты.
Смесь 0,2 г моль фенетола, 0,1 г;атом белого фосфора и
0,25 г.атом серы нагревают при перемешивании и температуре 150-160 С в течение 2,5 ч. К реакционной массе, охлажденной до 120 С, прибавляют 0,15 r моль абсолютного бутанола и 3 капли пиридина (0,5 г смоль %).
Смесь нагревают при 80 С в течение
30 мин, избыток бутанола и фенетола удаляют в вакууме и в остатке получают продукт в виде вязкой жидкости коричневого цвета, п в 1,5860.
Выход 92%.
Найдено, : P 10,16; S 22,60; кислотный экв. 278
С12 Н 1 02PS
Вычислено, : P 10,69; $22, 11 кислотный экв. 290.
Пример 2. Получение 0-бутил-бутоксифенилдитиофосфоновой кислоты.
Смесь 0,2 г.моль бутилфенилового, эфира, 0,1 г атом белого фосфора, 0,25 г атом серы и 15 мл керосина (т.кип. 160-190 С) нагревают при перемешивании и температуре 170180 С в течение 4 ч. К реакционной массе при 120 С добавляют
0,15 r моль бутанола и 3 капли триэтиламина (0,5 моль ), нагревают
30 мин при 80-90 С. Смесь вакуумио руют при 130-140 С 10 мм и в остатке получают продукт в виде вязкой окрашенной жидкости, и 11 1,5750.
Выход 91%.
Найдено,X: P 9,32, S 20,62 кислотный экв. 330.
С1 h 0 PS
Вычислейо, : P 9,77; S 20,1 ; кислотный экв. 318.
Пример 3. Получение О-этил-метоксифенилдитиофосфоновой кислоты.
Смесь 0,1 г моль анизола, 0,04 г. атом белого фосфора и
0,1 r атом серы кипятят 3 ч, затем, з охладив реакционную массу до 80 Се добавляют 0,06 г моль безводного этанола и 2 капли пиридина (1 г.моль 7). Смесь нагревают 30 мин при 60-70 С, избыток спирта и ани0 эола удаляют в вакууме и в остатке получают продукт очень вязкая жидкость. Выход
917..
336986
Выход,7
„2о
Соединение найдено вычислено
Г OCHý
СНО P З 855
$н
СН О X Р г З У 0
И
$н
cg p / Осзну-1
$H
3, Р
91
$ с) /,i Ос ркд-i
Э Р
" $н 91,5
S сн,о t i р "
И $Н 89,0
234
238
1,6570
1,6136
256
262
262
274
1,6115
1,5945
288
290
276
264
1,6110
Формула
Соединение
P S
P S
27,38
СВН 1102РБ2 12,34
12,93 28,0
24,41
С„, Н „,0,Р . 11,82
24, 11
11,63 снзо i
СН,О
caca o
11 70 24,61 С о Н„ 02РS2
24,41
10,59 21 90 о
23,15
С „Н„о PS 11,21
11, 10 23,48
Тираж 384 до@писное
ВНИИПИ Заказ 4007/3
Фиюоюел ППП Патент, г. Унгород, ул.Проентнае,4 осн>
Р
Р ,г0с3Н7
И
$ $н
P г 3 7" д
И $К
$, OCрНИ-1
И ЯН, S 0с4К9
Р
И $Н
Найдено,X: P 12,39, S 25,31 кислотный экв. 256. р 132
Вычислено, ): P 1 2, 5 1 j S 25,80; кислотный экв. 248.
В условиях примера 3 получают другие дитиофосфоновые кислоты,, выход и свойства которых приведены в таблице.
С Н, 02РЯХ 10,70 22,07



www.findpatent.ru
Алкилирование алкилфениловых эфиров олефинами - Справочник химика 21
При алкилировании фенолов нормальными олефинами и циклогексеном в большинстве случаев образуется смесь алкилфениловых эфиров и алкилированных в ядре фенолов. Относительные количества их и общий выход продуктов алкилирования зависят от химической природы и молярных соотношений реагентов и катализатора, от температуры, времени реакции и присутствия растворителя. [c.168] АЛКИЛИРОВАНИЕ АЛКИЛФЕНИЛОВЫХ ЭФИРОВ ОЛЕФИНАМИ [c.180]По алкилированию алкилфениловых эфиров олефинами в присутствии фтористого бора и его молекулярных соединений в литературе известно лишь одно оригинальное исследование реакции анизола с циклогексеном [52] и имеется несколько патентных сообщений. [c.180]
Алкилирование алкилфениловых эфиров олефинами. .............445 [c.306]
Алкилирование алкилфениловых эфиров олефинами [c.445]
Реакция изучалась аналогично алкилированию ароматических углеводородов (см. главу вторую) газообразными олефинами в приборе, представленном на рис. 12, и жидкими олефинами в приборе, представленном на рис. 13. В случае алкилирования фенолов после завершения реакции продукты обрабатывались водой с целью удаления катализатора, затем 5—10%-ным раствором щелочи до полного отделения фенольных соединений от эфирных (пока капля раствора, нанесенная на часовое стекло не давала мути с соляной кислотой), смесь обрабатывалась эфиром. Эфирный экстракт отделялся от щелочного, сушился хлористым кальцием и перегонялся. Из щелочного слоя путем обработки соляной кислотой выделялись алкилфенолы, сушились и фракционировались. При алкилировании алкилфениловых эфиров реакционная масса разбавлялась водой, нейтрализовалась содовым раствором, сушилась и перегонялась. Реакция изучалась при различных молярных отношениях реагентов, катализатора и температуре. В результате было показано, что алкилирование фенолов и алкил- [c.167]
Алкилирование фенолов и алкилфениловых эфиров олефинами [c.141]
По данным исследований фракций алкилфенолов, полученных алкилированием -фенола индивидуальными а-олефинами и промышленными фракциями а-олефинов [5, 269- 271 ], составляюш,ие группы компонентов располагаются на силикагеле в следующем порядке возрастания адсорбируемости не вошедшие в реакцию олефино-парафиновые углеводороды, 2,4,6-триалкил- и 2,6-диалкил-фенолы, 2,4-диалкилфенолы, о-моно-алкилфенолы, и-моноалкил фенолы. Группа алкилфениловых эфиров адсорбируется вместе с 2,4,6-триалкил- и [c.120]
Наиболее простым и перспективным синтезом алкилфенолов и их эфиров, несомненно, является реакция алкилирования фенолов олефинами. Ее можно рассматривать как реакцию присоединения фенола к олефину по правилу В. В. Марковникова с последующей изомеризацией образующихся при этом алкилфениловых эфиров в о-или п-производные хиноидной структуры и перегруппировкой последних в более стабильные алкилфенолы [c.167]
Минеральные кислоты, и прежде всего серная кислота, были первыми катализаторами алкилирования фенолов высшими моноолефинами [20]. Природа каталитического воздействия минеральных кислот в реакциях алкилирования состоит в их способности вносить в реакционную смесь протоны и образовывать с олефинами промежуточные структуры, способные к дальнейшему взаимодействию с фенолами. Механизм образования алкилфенолов в присутствии кислот весьма сложен и неоднозначен для различных условий. Прямому замещению в ядро часто сопутствуют образование алкилфениловых эфиров и перегруппировка последних в алкилфенолы. [c.23]
В условиях алкилирования фенолов высшими олефинами в присутствии кислот алкилфениловые эфиры, как правило, практи- [c.24]
Литературные данные и наши систематические исследования в этой области показывают, что наиболее простым, интересным и перспективным синтезом алкилфенолов и их алкиловых эфиров, как и описанных в главе П алкилбензолов, является реакция алкилирования фенолов и алкилфениловых эфиров олефинами. Что же касается алкилирования спщртами, галоидными алкилами и эфирами, то, по нашему мнению, оно не является перспективным для промышленного развития, так как не обеспечивается доступным сырьем (указанные алкилирующие агенты, как правило, получаются на основе олефинов) и не имеет каких-либо [c.163]
Систематические исследования по алкилированию различных фенолов и алкилфениловых эфиров олефинами в присутствии фтористого бора и его молекулярных соединений с этиловым эфиром и ортофосфорпой кислотой проведены С. В. Завгородним с сотрудниками [59, 60]. [c.435]
Серия работ, проведенных Э. В. Алисовой и Л. В. Харченко, относится к алкилированию фенолов, крезолов и алкилфениловых эфиров стиролом, а-метилстиролом и олефинами состава С3—Сц в присутствии ВРз и комплексов ВРд 0Et2 и В з Н3РО4. Эти исследования позволили разработать удобные методы синтеза алкилфенолов и алкилфениловых эфиров, которые применяются в качестве ингибиторов, анестезирующих, дезинфицирующих и бактерицидных препаратов. [c.161]
Возможности анализа высокомолекулярных вторичных алкилфенолов методом газо-жидкостной хроматографии ограничены их высокими температурами кипения и сложностью состава. Наиболее низкокипящими компонентами, присутствующими во фракции вторичных алкилфенолов, являются алкилфениловые эфиры и не вошедшие в реакцию фенол и нарафино-олефцновые углеводороды. При газо-жидкостном хроматографировании на полиэтиленгликоль- сукцинате при 190 °С фракции алкилфенолов, полученных алкилированием фенола фракцией а-олефинов Се—С , достигнуто разделение в виде последовательно выходящих из колонки групп пиков парафино-олефиновых углеводородов С —С , алкилфениловых эфиров, различающихся длиной алкильного радикала и местом при--соединения атома кислоррда к атомам углерода алкильного радикала, и в виде отдельного пика — фенола [280]. За пиком фенола выходят пики наиболее низкокипящей части алкилфенолов остальные алкилфенолы удерживаются в колонке и могут быть разделены на компоненты в иных условиях хроматографирования. Наиболее подходящими для этих целей являются высокотемпературные жидкие фазы, такие, как 8Е-30. [c.129]
Применение фтористого бора и его соединений с этиловым эфиром и ортофосфорной кислотой в качестве катализаторов алкилирования олефинами фенолов, галоидфенолов, нитрофенолов, алкилфениловых эфиров и тиофенола изучено С. В. Завгородним [164—168]. Им показано, что алкилирование фенолов нормальными олефинами в присутствии BFg-0( 2H5)2 протекает легче, чем алкилирование углеводородов, и не сопровождается побочными реакциями. В зависимости от условий в качестве конечных продуктов получаются алкилфенолы или их алкиловые эфиры, а чаще смесь тех и других. Соотношение между продуктами эфирного и фенольного характера и общий выход их зависят от химической природы реагентов, температуры, продолжительности реакции, присутствия растворителей и других факторов. [c.141]
Механизм алкилирования фенолов олефинами в присутствии катализаторов кислотного харакера сложен и неоднозначен. С одной стороны, может иметь место прямая атака кар-бениевых ионов (возникающих из олефина под действием катализатора) на нуклеофильные центры ароматического ядра. С другой стороны, алкилирование можно рассматривать как реакцию присоединения фенола к олефину по правилу В. В. Марковникова с изомеризацией образующихся при этом алкилфениловых эфиров в о- или га-производные хиноидной структуры и перегруппировкой последних в более стабильные алкилфенолы. [c.124]
chem21.info