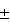Большая Энциклопедия Нефти и Газа. Метилмалоновый эфир
Эфир метилмалоновый - Справочник химика 21
Диэтиловый эфир метилмалоновой кислоты Диэтиловый эфир этоксиметиленмалоно-вой кислоты Диэтиловый эфир этилмалоновой кислоты То же [c.22]Приведите не менее трех схем синтеза диэтилового эфира метилмалоновой кислоты. Исходя из последней, получите а,а -диметилянтарную кислоту. [c.404]
Присоединение в i w -положение наблюдается при реакции конденсации малонового эфира, метилмалонового эфира и аце- [c.202]
Диэтиловый эфир метилмалоновой кислоты, содержащий лишь один активный атом водорода, может тем не менее реагировать в качестве адденда с этиленовыми и ацетиленовыми акцепторами [c.442]Получение аминокислот. Превращение ди- и поликарбоновых кнслот в аминокислоты можно осуществить несколькими различными путями. Наиболее удовлетворительные результаты дает применение моноэфиров и их солей. Они реагируют с гидразином, образуя гидразиды кислот, которые можно превратить через азиды кисло г в аминокислоты. Из эфиров замещенных малоновых кислот получаются а-аминокислоты. (О получении а-аминокислот из эфиров замещенных циануксусных кислот см. стр. 343.) Так, например, из калиевой соли моноэтилового эфира метилмалоновой кислоты, которую получают путем неполного гидролиза диэтилового эфира, образуется солянокислая соль этилового эфира аланина с выходом 670/д [45] [c.328]
Калиевая соль моноэтилового эфира метилмалоновой кислоты [c.377]
Такого рода обработка служит для удаления неизменившегося малонового эфира. Михаэль i показал, что такая обработка полностью удаляет неизменившийся малоновый эфир и почти совсем не затрагивает этиловый эфир метилмалоновой кислоты. В случае применения бромистого метила в качестве метилирующего агента этилового эфира диметилмалоновой кислоты не образуется. [c.591]
Наиболее широко распространенный метод получения этилового эфира метилмалоновой кислоты состоит в алкилировании малонового эфира иодистым метилом бромистым метилом или ди.ме-тилсульфатол Отделение конечного продукта от следов не изменившегося исходного продукта и от этилового эфира диметилмалоновой кислоты не может быть достигнуто перегонкой, так как точки кипения всех трех сложных эфиров лежат в пределах 3,5°. Михаэль 1 нашел, что не вступивший в реакцию малоновый эфир может быть полностью отделен, если воспользоваться тем, что он легче омыляется щелочью, а Гэн и Ингольд получили чистый продукт путем омыления, перекристаллизации метилмалоновой кислоты и последующей этерификацией. На основании опытов Сальковского мл. с ацетоуксусным эфиром можно сделать заключение, что в случае применения бромистого метила в качестве алкилирующего агента образование диметильного производного не имеет места. Методика Б, основанная на работе Михаэля описана в литературе [c.591]
Если перегонку вести при 10 мм, то заметного разложения этоксалилового эфира с образованием этилового эфира метилмалоновой кислоты не происходит. Чтобы избежать перегрева, рекомендуется нагревать колбу на масляной бане и обогревать дефлегматор. [c.605]
Алкилирование малоновыми эфирами. Бухта и Шлезингер [21 ] получили Сю-дикислоту(ССУ11) алкилированием 1,4-дибром-бутина-2 или 1,4-дибромбутена-2 двумя молями диэтилового эфира метилмалоновой кислоты. При омылении промежуточного тетраэфира и последующем декарбоксилировании образуется дикислота VII. [c.187]
С соединениями типа ВВ С=СНХ, в которых атом водорода связай с а-углеро-дом, протекает аномальная реакция Михаэля [151]. Эта реакция не характерна для соединений типа КВ С=СВ"Х. В результате аномальной реакции Михаэля один из заместителей в молекуле донора (аа исключением водорода), по-видимому, в результате перегруппировки промежуточного продукта переходит к атому углерода продукта реакции. При взаимодействии диэтилового эфира метилмалоновой кислоты с этиловым эфиром кротоновой кислоты в присутствии 1/6 моля этилата натрия получается нормальный аддукт 62, однако, если увеличить количество основания до одного эквивалента, то образуется соединение 64 [152], в котором метильная Группа связана с первым, а малонатная — со вторым атомом углерода [c.290]
Отщепление окиси углерода характерно для производных щавелевоуксусного эфира, получаемых конденсацией диэтилоксалата и соединений с активной метиленовой группой продуктами реакции декарбонилнрова-ния являются замещенные малоновые эфиры. Диэтиловый эфир метилмалоновой кислоты, например, может быть получен с выходами, близкими к теоретическим, из метилщавелевоуксусного (этоксалилпропионового) эфира (СОП, 2, 588) [c.577]
Малоновый эфир Метилмалоновый эфир Этиловый эфир циануксусной кислоты [c.468]
chem21.info
Метилмалоновая кислота, эфир - Справочник химика 21
Диэтиловый эфир метилмалоновой кислоты Диэтиловый эфир этоксиметиленмалоно-вой кислоты Диэтиловый эфир этилмалоновой кислоты То же [c.22]Приведите не менее трех схем синтеза диэтилового эфира метилмалоновой кислоты. Исходя из последней, получите а,а -диметилянтарную кислоту. [c.404]
Реакции с кислотами и сложными эфирами. При прове дении реа1щии Манниха с. первичными аминами и с кислой тами, содержащими активные атомы водорода, образуютс соединения топ) же типа, чго и описанные выше в случае вторичных аминов. Как и можно было ожидать, продукт первичной реакции часто вступает в дальнейшую конденсацию с образованием третичного амина. В качестве примера может служить реакция метилмалоновой кислоты с формальдегидом и метиламином [31]. [c.410]
Получение аминокислот. Превращение ди- и поликарбоновых кнслот в аминокислоты можно осуществить несколькими различными путями. Наиболее удовлетворительные результаты дает применение моноэфиров и их солей. Они реагируют с гидразином, образуя гидразиды кислот, которые можно превратить через азиды кисло г в аминокислоты. Из эфиров замещенных малоновых кислот получаются а-аминокислоты. (О получении а-аминокислот из эфиров замещенных циануксусных кислот см. стр. 343.) Так, например, из калиевой соли моноэтилового эфира метилмалоновой кислоты, которую получают путем неполного гидролиза диэтилового эфира, образуется солянокислая соль этилового эфира аланина с выходом 670/д [45] [c.328]Калиевая соль моноэтилового эфира метилмалоновой кислоты [c.377]
Чтобы не вступивший в реакцию этиловый эфир диэтокси-метилмалоновой кислоты, являющийся промежуточным продуктом, превратить в этиловый эфир этоксиметиленмалоновой кислоты, смесь к концу процесса необходимо нагревать. Этот промежуточный продукт трудно отделить перегонкой от этилового эфира этоксиметиленмалоновой кислоты, а потому очень -важно, чтобы он был по возможности полностью превращен в последний во время нагревания. [c.597]
Диэтиловый эфир метилмалоновой кислоты, содержащий лишь один активный атом водорода, может тем не менее реагировать в качестве адденда с этиленовыми и ацетиленовыми акцепторами [c.442]
Такого рода обработка служит для удаления неизменившегося малонового эфира. Михаэль i показал, что такая обработка полностью удаляет неизменившийся малоновый эфир и почти совсем не затрагивает этиловый эфир метилмалоновой кислоты. В случае применения бромистого метила в качестве метилирующего агента этилового эфира диметилмалоновой кислоты не образуется. [c.591]
Наиболее широко распространенный метод получения этилового эфира метилмалоновой кислоты состоит в алкилировании малонового эфира иодистым метилом бромистым метилом или ди.ме-тилсульфатол Отделение конечного продукта от следов не изменившегося исходного продукта и от этилового эфира диметилмалоновой кислоты не может быть достигнуто перегонкой, так как точки кипения всех трех сложных эфиров лежат в пределах 3,5°. Михаэль 1 нашел, что не вступивший в реакцию малоновый эфир может быть полностью отделен, если воспользоваться тем, что он легче омыляется щелочью, а Гэн и Ингольд получили чистый продукт путем омыления, перекристаллизации метилмалоновой кислоты и последующей этерификацией. На основании опытов Сальковского мл. с ацетоуксусным эфиром можно сделать заключение, что в случае применения бромистого метила в качестве алкилирующего агента образование диметильного производного не имеет места. Методика Б, основанная на работе Михаэля описана в литературе [c.591]
Если перегонку вести при 10 мм, то заметного разложения этоксалилового эфира с образованием этилового эфира метилмалоновой кислоты не происходит. Чтобы избежать перегрева, рекомендуется нагревать колбу на масляной бане и обогревать дефлегматор. [c.605]
Алкилирование малоновыми эфирами. Бухта и Шлезингер [21 ] получили Сю-дикислоту(ССУ11) алкилированием 1,4-дибром-бутина-2 или 1,4-дибромбутена-2 двумя молями диэтилового эфира метилмалоновой кислоты. При омылении промежуточного тетраэфира и последующем декарбоксилировании образуется дикислота VII. [c.187]
Бромид VI, конденсируясь с натриймалоновым эфиром, дает эфир пиран-4-метилмалоновой кислоты (X) соединение X последовательно гидролизуют, декарбокси лируют, этерифицируют и восстанавливают в карбинол XI, из которого можно получить 3-7-бромпропил-1,5-дибромпентан (XII). [c.296]
Основным соединением является тот из продуктов гидролиза, который расположен в справочнике позднее (наиболее далеко). Поэтому эфир следует искать среди функциональных производных метилмалоновой кислоты, то есть образованных за счет изменения в функциональных группах (т. П, стр. 630). [c.159]
С соединениями типа ВВ С=СНХ, в которых атом водорода связай с а-углеро-дом, протекает аномальная реакция Михаэля [151]. Эта реакция не характерна для соединений типа КВ С=СВ"Х. В результате аномальной реакции Михаэля один из заместителей в молекуле донора (аа исключением водорода), по-видимому, в результате перегруппировки промежуточного продукта переходит к атому углерода продукта реакции. При взаимодействии диэтилового эфира метилмалоновой кислоты с этиловым эфиром кротоновой кислоты в присутствии 1/6 моля этилата натрия получается нормальный аддукт 62, однако, если увеличить количество основания до одного эквивалента, то образуется соединение 64 [152], в котором метильная Группа связана с первым, а малонатная — со вторым атомом углерода [c.290]
Отщепление окиси углерода характерно для производных щавелевоуксусного эфира, получаемых конденсацией диэтилоксалата и соединений с активной метиленовой группой продуктами реакции декарбонилнрова-ния являются замещенные малоновые эфиры. Диэтиловый эфир метилмалоновой кислоты, например, может быть получен с выходами, близкими к теоретическим, из метилщавелевоуксусного (этоксалилпропионового) эфира (СОП, 2, 588) [c.577]
chem21.info
свойства и применение :: SYL.ru
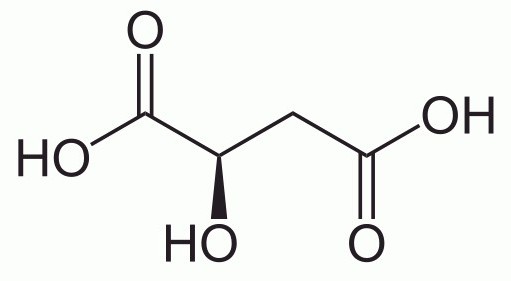
Малоновая кислота является кристаллическим бесцветным веществом, хорошо растворимым в воде, а также в этиловом спирте. Рассмотрим способы получения данного органического вещества, а также области еге применения.

Страницы истории
Малоновая кислота, которая относится к гидроксибутандионовым соединениям, была выделена в конце XVIII века химиком Карлом Шееле. На протяжении длительного времени она не находила масштабного практического применения. Только с XX века малоновая кислота стала активно использоваться в косметической отрасли, а также при проведении научных экспериментов.
В настоящее время данное вещество известно обычным потребителям в качестве вкусовой добавки Е296, используемой в пищевой промышленности в качестве усилителя вкуса и регулятора кислотности продукта.
В природе
В природе малоновая кислота достаточно широка распространена. Два ее стереоизомера D- и L-вида содержатся в незрелых яблоках, винограде, крыжовнике, ревене, плодах рябины, малине, барбарисе, плодах рябины.
Малоновая кислота, формула которой C3h5O4, содержится в виде солей никотина в растениях табака и махорки. В зрелых яблоках имеется около 0,35 процентов яблочной кислоты, а вот в незрелых плодах данного органического вещества гораздо больше.
Получение
L-Яблочная кислота является одним из важнейших промежуточных продуктов обменного процесса в живых организмах. Данное вещество синтезируется в результате трикарбонового цикла.
D-яблочная кислота получает химическим путем при восстановлении D-винной кислоты. В продуктах питания, предлагаемых современными производителями, есть D- и L-формы данного органического вещества. Малоновая кислота, получение которой осуществляется синтетическим путем, востребована при производстве кондитерских изделий, фруктовых вод, безалкогольных низкокалорийных напитков, косметики, вина, в медицине.
В настоящее время в химической промышленности яблочную (малоновую) кислоту получают путем гидролиза.

Пищевой консервант
Данное органическое соединение безопасно при употреблении в пищу. Но важно соблюдать осторожность в дозировке этого вещества, так как при попадании на кожу возможно раздражение, обостряется симптом герпеса. Добавку Е296 в промышленных объемах получают при гидратации фумаровой или малеиновой кислот при повышенной температуре.
Особенности и свойства
Какими отличительными особенностями обладает малоновая кислота? Химические свойства данного соединения подтверждают ее принадлежность к оксикислотам. Она вступает в реакции с активными металлами, основными оксидами, щелочами. Ее соли называют малатами. Именно в виде этой соли, образующейся в цикле трикарбоновой кислоты в ходе глюконеогинеза, данное вещество принимает активное участие в обмене веществ в живом организме.
При взаимодействии со спиртами данная кислота вступает в реакцию этерификации, образуя сложный эфир. В качестве добавки Е296 яблочная кислота разрешена на территории нашей страны. Этот пищевой консервант растворяется не только в воде и этаноле, но и пиридине и диэтиловом эфире.
Малоновая кислота, структурная формула которой представлена ниже, в незначительных количествах способна приносить пользу жизненно важным органам человека. Она участвует в процессах синтеза флавонов, незаменимых аминокислот, витаминов В1 и В6.
Яблочная кислота способна образовывать две группы солей: кислые и средние. В реакции с галогенами данная органическая кислота образует хлорангидрид. В зависимости от того, при каких условиях протекает взаимодействие, продуктами реакции может выступать полный хлорангидрид, а также полухлорангидрид.
При нагревании вещества выше температуры плавления происходит процесс декарбокисилирования малоновой кислоты, а продуктом взаимодействия будет уксусная кислота.
В реакции с оксидом фосфора (5), условием которой является повышенная температура, образуется недооксид углерода, имеющий формулу C3O2.
С бромом малоновая кислота образует диброммалоновую либо броммалоновую кислоту. В случае действия на яблочную кислоту азотистой кислоты наблюдается окисление до мезоксалевой кислоты, имеющей формулу OC(COOH)2.

Ограничения по применению
Среди ограничений, которые предъявляют к применению малоновой кислоты, относят индивидуальную непереносимость человека. При систематическом злоупотреблении продуктов питания, которые содержат консервант Е296, могут возникать серьезные проблемы со здоровьем. Помимо пищевой промышленности, данное вещество нашло свое применение в косметической промышленности.
В медицине это органическое соединение применяется в качестве слабительного, а также в качестве средства для лечения хрипоты.
Заключение
Эта двухосновная карбоновая предельная кислота благодаря своим химическим свойствам востребована не только в химическом синтезе, но и в пищевой и косметической промышленности. Именно яблочную кислоту косметологи называют эффективным ингредиентом современных кремов и лосьонов. Среди полезных свойств данного вещества специалисты отмечают подсушивающий, вяжущий, успокаивающий эффект. Малоновую кислоту применяют при создании масок, кремов, сывороток, эмульсий. Есть и специальные составы, которые помогают удалять с кожи ороговевшие клетки эпидермиса.
Как уже было сказано, вещество нашло широкое применение в современном мире. Но важно помнить, что при бездумном применении яблочной кислоты, содержащейся во многих косметических средствах, возможна аллергическая реакция.
www.syl.ru
Метилмалоновая кислота - Большая Энциклопедия Нефти и Газа, статья, страница 1
Метилмалоновая кислота
Cтраница 1
Метилмалоновая кислота могла образоваться при окислении гликоля только при условии, если гликоль имеет строение а-метилтриметиленгликоля. [1]
Этиловый эфир метилмалоновой кислоты перегоняют. Он кипит при 194 - 196 / 745 мм, причем выход составляет 288 г ( 97 % теоретич. [2]
Смесь 50 г метилмалоновой кислоты, 37 г паральдегида, 43 г уксусного ангидрида и 25 0 ледяной уксусной кислоты нагревают 48 час. Это последнее соединение подвергают перегонке при обыкновенном давлении и получают из него, как это было указано выше, еще некоторое количество тиглиновой кислоты, общий выход которой достигает приблизительно 70 % от теории. [3]
Чистый этиловый эфир метилмалоновой кислоты может быть также получен восстановлением метилиденмалонового эфира в присутствии никеля, приготовленного по Рэнею 8; из этилового эфира а-бромпропионового эфира через нитрил8 ( этот процесс следует признать дорогостоящим, учитывая стоимость исходных реагентов и низкие выходы) и пиролитическим разложением этилового эфира этоксалилпропионовой кислоты. [4]
Чистый этиловый эфир метилмалоновой кислоты может быть также получен восстановлением метилиденмалонового эфира в присутствии никеля, приготовленного по Рэнею 8; из этилового эфира а-бромпропионового эфира через нитрил9 ( этот процесс следует признать дорогостоящим, учитывая стоимость исходных реагентов и низкие выходы) и пиролитическим разложением этилового эфира этоксалилпропионовой кислоты. [5]
При использовании в реакции Бриггса - Раушера метилмалоновой кислоты было найдено [71], что увеличение концентрации Ю3 - и Н приводит к увеличению периода колебаний, а увеличение концентрации Н2О2, метилмалоновой кислоты и марганца ( II) - к уменьшению его. Тем же автором [73] исследовалась подсистема реакции Бриггса - Раушера ( Б - Р) без малоновой кислоты, в которой накопление иода осуществляется за счет введения кретоновой ( гранс-2 - бутеновой) кислоты, и хотя в этой системе и не наблюдались колебания, само исследование безусловно полезно для понимания механизма колебаний в реакции Бриггса - Раушера. [6]
III, 3), добавляют 100 г эфира метилмалоновой кислоты, смесь нагревают до 150 - 160 в течение 3 час. По охлаждении смесь взбалтывают с водой, ксилол отгоняют, пока температура не поднимется до ISO0 и остаток фракционируют в вакууме. Выход 60 - 70 г, что составляет 40 % теоретического количества. [7]
II, 2729 ] описана конденсация аценафтена с динитрилом метилмалоновой кислоты в присутствии А1С13 в хлорбензольном растворе. [8]
Какие структурные формулы имеют следующие дикарбо-новые кислоты и их производные: а) метилмалоновая кислота, б) диметилмалоновая кислота, в) этилмалоновая кислота, г) про-пилмалоновая кислота, д) метилизопропилмалоновая кислота, е) jj - метилглутаровая кислота, ж) адипиновая кислота, з) а а-димети л янтарная кислота, и) а-метил - 3-этилглутаровая кислота, к) а а - дибромянтарная кислота, л) пропандикарбоновая кислота, м) кальциевая соль щавелевой кислоты ( оксалат кальция), н) натриевая соль глутаровой кислоты, о) диэтиловый эфир малоновой кислоты ( малоновый эфир), п) моноэтиловый эфир щавелевой кислоты, р) амид глутаровой кислоты, с) диамид янтарной кислоты. [9]
Конденсация Михаэля была исследована на примере взаимодействия этилкротоната и этилфенилкрото-ната с диэтиловым эфиром метилмалоновой кислоты. [10]
Энергично встряхивают смесь 5 8 г ( 1 25 моля) метилового эфира метилмалоновой кислоты и раствора 10 г меркурацетамида ( 1 моль) в 50 мл воды. К полученной эмульсии прибавляют 3 мл 20 % - ного раствора соды, нагревают на водяной бане; при этом эфир переходит в раствор, из которого выделяется немного хлопьевидного белого осадка в том случае, если взятый метилмалоновый эфир содержал незамещенное соединение. [11]
С / 7 мм, с выходом 74 6 % получена декарбоксилированием а-этил-р-гексокси - метилмалоновой кислоты. [12]
Оксиизобутирил-кофермент А, по-видимому, превращается в р-оксиизомасляную кислоту, которая может переходить в полуальдегид метилмалоновой кислоты. Для последнего соединения возможно переаминирование с образованием р-аминоизомасляной кислоты ( являющейся также продуктом распада тимина) или окисление в метилмалоновую кислоту. [13]
При использовании в реакции Бриггса - Раушера метилмалоновой кислоты было найдено [71], что увеличение концентрации Ю3 - и Н приводит к увеличению периода колебаний, а увеличение концентрации Н2О2, метилмалоновой кислоты и марганца ( II) - к уменьшению его. Тем же автором [73] исследовалась подсистема реакции Бриггса - Раушера ( Б - Р) без малоновой кислоты, в которой накопление иода осуществляется за счет введения кретоновой ( гранс-2 - бутеновой) кислоты, и хотя в этой системе и не наблюдались колебания, само исследование безусловно полезно для понимания механизма колебаний в реакции Бриггса - Раушера. [14]
Михаэль г нашел, что не вступивший в реакцию малоновый эфир может быть полностью отделен, если воспользоваться тем, что он легче омыляется щелочью, а Гэн и Ингольд5 получили чистый продукт путем омыления, перекристаллизации метилмалоновой кислоты и последующей этерификацией. [15]
Страницы: 1 2 3
www.ngpedia.ru
Метилмалоновая кислота - Справочник химика 21
НООС—СН-СООН— метилмалоновая кислота [c.187]Среди соединений, которые приведены ниже, укажите вещества, существующие в виде оптических изомеров. Определите число изомеров, укажите диастереомеры 1) 2-окси-З-метилбутановая кислота, 2) метилмалоновая кислота, 3) хлоряблочная кислота, 4) , -ди-оксимасляная кислота. [c.83]
Метил-2,4-дикарбокси-5-пиррил-р-метилмалоновая кислота Ф3,334. [c.151]
В природе ионы кобальта встречаются в степени окисления II и III, однако наиболее важное биологическое соединение кобальта— это витамин В12, или кобаламин, в котором присутствует Со(1П) [256] (рис. 6.10). Кобаламин и близкие к нему вещества выполняют разнообразные биологические функции, особенно это касается бактерий. Он необходим для человеческого организма и, вероятно, для больщинства животных и растений. Важную роль он играет в реакциях с участием остатков углеводов, жиров и белков для выработки in vivo. Пернициозная анемия — тяжелое заболевание, встречающееся у пожилых людей. Эта болезнь у млекопитающих обычно сопровождается повышенным выделением с мочой метилмалоновой кислоты. В настоящее время эту болезнь успешно лечат инъекциями витамина В12. [c.381]
Таким же образом алкилмалоновые кислоты при нагревании до температуры выше точки плавления, теряя СО , превращаются в алкилуксусные кислоты. Так, метилмалоновая кислота дает метилуксусную, т. е. пропионовую кислоту [c.274]При гидролизе этого соединения получают этиловый спнрт и метилмалоновую кислоту [c.390]
Основным соединением является тот из продуктов гидролиза, который расположен в справочнике позднее наиболее далеко). Поэтому эфнр следует искать среди функциональных производных метилмалоновой кислоты, т. е. образованных за счет изменения в функциональных группах (т. II, стр. 630). [c.390]
Группы вместо -СЫ, СН -, ОН- групп, он имеет активированную связь углерод-кобальт, при диссоциации которой высвобождается карбанионный центр при рибозного фрагмента, участвует в катализе реакции изомеризации метилмалоновой кислоты в янтарную, в заключительном этапе процесса окисления некоторых липидов, боковой [c.288]
Реакции с кислотами и сложными эфирами. При прове дении реа1щии Манниха с. первичными аминами и с кислой тами, содержащими активные атомы водорода, образуютс соединения топ) же типа, чго и описанные выше в случае вторичных аминов. Как и можно было ожидать, продукт первичной реакции часто вступает в дальнейшую конденсацию с образованием третичного амина. В качестве примера может служить реакция метилмалоновой кислоты с формальдегидом и метиламином [31]. [c.410]
Получение аминокислот. Превращение ди- и поликарбоновых кнслот в аминокислоты можно осуществить несколькими различными путями. Наиболее удовлетворительные результаты дает применение моноэфиров и их солей. Они реагируют с гидразином, образуя гидразиды кислот, которые можно превратить через азиды кисло г в аминокислоты. Из эфиров замещенных малоновых кислот получаются а-аминокислоты. (О получении а-аминокислот из эфиров замещенных циануксусных кислот см. стр. 343.) Так, например, из калиевой соли моноэтилового эфира метилмалоновой кислоты, которую получают путем неполного гидролиза диэтилового эфира, образуется солянокислая соль этилового эфира аланина с выходом 670/д [45] [c.328]
Калиевая соль моноэтилового эфира метилмалоновой кислоты [c.377]
Чтобы не вступивший в реакцию этиловый эфир диэтокси-метилмалоновой кислоты, являющийся промежуточным продуктом, превратить в этиловый эфир этоксиметиленмалоновой кислоты, смесь к концу процесса необходимо нагревать. Этот промежуточный продукт трудно отделить перегонкой от этилового эфира этоксиметиленмалоновой кислоты, а потому очень -важно, чтобы он был по возможности полностью превращен в последний во время нагревания. [c.597]
Такого рода обработка служит для удаления неизменившегося малонового эфира. Михаэль i показал, что такая обработка полностью удаляет неизменившийся малоновый эфир и почти совсем не затрагивает этиловый эфир метилмалоновой кислоты. В случае применения бромистого метила в качестве метилирующего агента этилового эфира диметилмалоновой кислоты не образуется. [c.591]
Наиболее широко распространенный метод получения этилового эфира метилмалоновой кислоты состоит в алкилировании малонового эфира иодистым метилом бромистым метилом или ди.ме-тилсульфатол Отделение конечного продукта от следов не изменившегося исходного продукта и от этилового эфира диметилмалоновой кислоты не может быть достигнуто перегонкой, так как точки кипения всех трех сложных эфиров лежат в пределах 3,5°. Михаэль 1 нашел, что не вступивший в реакцию малоновый эфир может быть полностью отделен, если воспользоваться тем, что он легче омыляется щелочью, а Гэн и Ингольд получили чистый продукт путем омыления, перекристаллизации метилмалоновой кислоты и последующей этерификацией. На основании опытов Сальковского мл. с ацетоуксусным эфиром можно сделать заключение, что в случае применения бромистого метила в качестве алкилирующего агента образование диметильного производного не имеет места. Методика Б, основанная на работе Михаэля описана в литературе [c.591]
Если перегонку вести при 10 мм, то заметного разложения этоксалилового эфира с образованием этилового эфира метилмалоновой кислоты не происходит. Чтобы избежать перегрева, рекомендуется нагревать колбу на масляной бане и обогревать дефлегматор. [c.605]
При этой тяжелой, нередко фатальной болезни выделяется с мочой 1—2 г метилмалоновой кислоты в день (при норме менее 5 мг/день). Известны две формы этой болезни. Одна форма поддается лечению витамином В в культуре фибро-бластов таких больных содержание В12-кофермента очень мало (гл. 8, разд. М). Прием избытка витамина B12 нормализует синтез кофермента . Другая форма болезни не поддается лечению витамином В12 и, по-видимому, связана с дефектом метилмалонилмутазы. Весьма сходная болезнь развивается при недостаточной активности пропионил-СоА—карбоксилазы. [c.335]
В некоторых случаях при контакте с D2O может происходить обмен на дейтерий и Н-атомов, связанных с углеродом. Например, при нагревании из метилмалоновой кислоты получают h4 D( 00H)2. в аналогичных условиях H/D-обмен претерпевают и некоторые гетероциклические соединения, например [c.77]
Биохимия Том 3 (1980) -- [ c.474 ]Справочник биохимии (1991) -- [ c.47 ]
Большой энциклопедический словарь Химия изд.2 (1998) -- [ c.216 ]
Основы органической химии (1968) -- [ c.471 ]
Основы биохимии Т 1,2,3 (1985) -- [ c.564 ]
Курс органической химии (1967) -- [ c.270 ]
Основы органической химии 1 Издание 2 (1978) -- [ c.564 ]
Основы органической химии Часть 1 (1968) -- [ c.471 ]
ЭПР Свободных радикалов в радиационной химии (1972) -- [ c.352 , c.353 ]
Органическая химия (1972) -- [ c.249 ]
Органическая химия (1972) -- [ c.249 ]
Органическая химия Издание 2 (1976) -- [ c.254 ]
Систематический качественный анализ органических соединений (1950) -- [ c.135 , c.219 ]
Биохимия Издание 2 (1962) -- [ c.370 ]
Биологическая химия (2004) -- [ c.183 ]
chem21.info
Малоновая кислота
⇐ ПредыдущаяСтр 121 из 199Следующая ⇒
Малоновая кислота встречается в большом количестве в свекле.
При нагревании она неустойчива и образует уксусную кислоту, выделяя углекислый газ:


 t0
t0
 НООС – СН2 – СООН СН3 – СООН + СО2
НООС – СН2 – СООН СН3 – СООН + СО2
 |
У малоновой кислоты подвижны α-атомы водорода за счет отрицательного индуктивного эффекта двух карбоксильных групп. Поэтому атомы водорода метиленовой группы могут замещаться на атомы щелочных металлов:
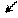
 H H
H H
 2HOOC ← C → COOH + 6Na 2NaOOC – NaCH – COONa + 3h3
2HOOC ← C → COOH + 6Na 2NaOOC – NaCH – COONa + 3h3
Особенно легко идет отщепление атомов водорода в метиленовой группе в малоновом эфире, у которого сложноэфирные группы обладают большим отрицательным индуктивным эффектом по сравнению с карбоксильными группами. Поэтому малоновый эфир называют СН-кислотой, у которого подвижный атом водорода идет от радикала:

 СООС2Н5спирт СООС2Н5
СООС2Н5спирт СООС2Н5


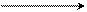 2 СН – Н + 2 Na 2 CH – Na + h3
2 СН – Н + 2 Na 2 CH – Na + h3
COOC2H5 COOC2H5
диэтиловый эфир малоновой кислоты натрийдиэтиловый эфир малоновой кислоты
(малоновый эфир) (натриймалоновый эфир)
Натриймалоновый эфир широко используется в органическом синтезе, например для получения моно- и дикарбоновых кислот.
1-й пример:

 Na Ch4Br Ch42НОН
Na Ch4Br Ch42НОН
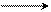
 H5C2OOC–CH–COOC2H5 H5C2OOC–CH–COOC2H5
H5C2OOC–CH–COOC2H5 H5C2OOC–CH–COOC2H5
–NaBr α- метилдиэтиловый эфир –2С2Н5ОН
малоновой кислоты
 Ch4t0
Ch4t0

 HOOC – CH – COOH Ch4 – Ch3 – COOH + CO2
HOOC – CH – COOH Ch4 – Ch3 – COOH + CO2
α-метилмалоновая кислота пропионовая кислота
2-й пример:

 COOC2H5 Ch4
COOC2H5 Ch4


 Na – CH + Ch4–CH–COOC2H5 H5C2OOC–CH–CH–СООС2Н5
Na – CH + Ch4–CH–COOC2H5 H5C2OOC–CH–CH–СООС2Н5
COOC2H5 Br – NaBr COOC2H5
этиловый эфир α-бромпропионовой α-метил-β-карбоэтоксидиэтиловый
кислоты эфир янтарной кислоты


 3НОН СН3 СООН t0 Ch4
3НОН СН3 СООН t0 Ch4


 НООС – СН – СН HOOC – CH – Ch3 – COOH
НООС – СН – СН HOOC – CH – Ch3 – COOH
–3C2H5OH СООН – CO2
α-метил-β-карбоксиянтарная кислота α-метилянтарная кислота
Тесты для самоконтроля знаний по теме: «Карбоновые кислоты и их производные»
1. Функциональной группой карбоновых кислот является:
A) карбонил
B) карбоксил
C) гидроксил
D) алкокси – группа
2. В карбоксильной группе присутствует эффект сопряжения
A) р - p
B) p − p
C) t − p
D) d − p
3. Кислотные свойства уменьшается в ряду
A) НСООН > Ch4COOH > C2Н5COOH
B) C2Н5COOH > Ch4COOH > HCOOH
C) Ch4COOH > HCOOH > C2H5COOH
D) HCOOH > C2H5COOH > Ch4COOH
4. Кислотные свойства уменьшается в ряду
A) Сl3C – COOH > Cl2CHCOOH > ClCh3COOH > HCOOH > Ch4COOH
B) HCOOH > Cl3C – COOH > Cl2CН – COOH > ClCh3 – COOH > Ch4COOH
C) Ch4COOH > HCOOH > ClCh3COOH > Cl2CH-COOH > Cl3C – COOH
D) Cl – Ch3 – COOH > Cl2СН-COOH > Cl3С-СООН > Ch4 -COOH > HCOOH
5. Качественной реакцией на карбоновые кислоты является взаимодействие с
A) NaOH
B) FeCl3
C) Na2CO3
D) C2H5OH
6. Назвать продукты реакции в цепочке превращений:
NaOH Cl2

 СН3 – СН2 – СООН А В
СН3 – СН2 – СООН А В
A) А – пропионат натрия, В – α – хлорпропионат натрия
B) А – пропионат натрия, В - b - хлорпропионат натрия
C) А – натрий пропионовая кислота, В – натрий хлор пропионовая кислота
D) А – бутират натрия, В – хлорбитурат натрия
6. Продуктом реакции являются:
NaOH
 А
А
 СН3СООН Ch4COOH
СН3СООН Ch4COOH
 В
В
 PCl5
PCl5
C2H5OH С
 Д
Д
Nh4
 Е
Е
A) A – Ch4COONa, B – (Ch4CO)2O, C – Ch4COCl, Д – Ch4COOC2O5,
E – Ch4CONh3
B) A – Ch4COONa, B–Ch4–COOCh4, C–Ch3ClCOOH, Д – Ch4 – COOC2H5,
E – Ch4CONh3
C) A – Ch4COONa, B – (Ch4CO)2O, C – ClCh3COCl, Д – Ch4COOC2H5,
E – Ch4CONh3
D) A – Ch4COONa, B – Ch4COOCh4, C – Cl2CHCOOH, Д – Ch4COOC2H5,
E – Ch4CONh3
7. Назвать соединение по исторической номенклатуре
СН3 – СН – СООН
½
СН3
A) бутановая кислота
B) 2-метилпропановая кислота
C) валерьяновая кислота
D) изомасляная кислота
8. Назвать соединение по исторической номенклатуре
СН3 – СН2 – СН2 – СН2 – СООН
A) валерьяновая кислота
B) масляная кислота
C) капроновая кислота
D) энентовая кислота
9. Назвать соединение по систематической номенклатуре
СН3 – СН – СН2 – СН – СН2СООН
½ ½
СН3 СН3
A) 3,5-диметилгексановая кислота
B) 2,4-диметилгексановая кислота
C) изогексилуксусная кислота
D) изооктановая кислота
10. Назвать соединения по систематической номенклатуре
СН3 – СН – СН – СН2 - СООН
½ ½
СН3 СН3
A) 3,4 – диметилпентановая кислота
B) 2,3-диметилпентановая кислота
C) изогептиловая кислота
D) изоамилуксусная кислота
11. Указать продукты реакций в цепочке превращений:
PCl5 Ch4COOH Nh4

 СН3СООН A B C
СН3СООН A B C
A) А-хлористый ацетил, В – уксусный ангидрид, С – ацетамид
B) А-хлоруксусная кислота, В – уксусный ангидрид, С – аминоуксусная кислота
C) А_хлористый ацетил, В – хлорангидрид уксусной кислоты, С – ацетамид
D) А-хлоруксусная кислота, В – хлорангидрид этановой кислоты,
С – аминоуксусная кислота
13. Указать изомеры среды веществ
1) СН3 – СН2 – СН – СООН 2) СН3 – СН –СН – СООН

 ½
½
СН3 СН3 СН3
3) СН3 – СН – СН – СООН 4) СН3 – СН – СН2 – СН2 – СН2 – СООН
½ ½
СН3 СН3
5) СН3 – СН2 – СН2 – СН2 – СООН 6) СН3 – (СН2)7 – СООН
A) 1,2,4
B) 1,2,3
C) 1,3,5
D) 4,5,6
14. Указать изомеры среди веществ
1) НСООН
2) СН3СООН
3) СН3 – СН – СООН
½
СН3
4) СН3 – СН2 – СН2 – СООН
5) СН3 – СН – СН2 СООН
½
СН3
A) 3,4
B) 1,2
C) 1,5
D) 3,5
15. Гомологами веществ являются
1) СН3 – СН2 – СООН
2) СН3 – СН – СООН
½
СН3
3) СН3 – СН2 – СН2 – СООН
4) СН3 – СН2 – СН – СООН
½
СН3
A) 1 и 2, 1 и 3, 1 и 4, 2 и 4, 3 и 4
B) 1 и 2, 2 и 3, 3 и 4, 1 и 3, 2 и 4
C) 1 и 4, 2 и 4, 2 и 3, 3 и 4, 1 и 3
D) 2 и 3, 1 и 2, 1 и 3, 1 и 4, 2 и 4
16. Ацилирующая активность уменьшается в ряду:
A) СН3 COCl > (Ch4CO)2O > Ch4COOCh4 > Ch4COOH > Ch4CONh3
B) СН3 COCl > Ch4COOCh4 > (Ch4CO)2O > Ch4CONh3 > Ch4COOH
C) Ch4CONh3 > Ch4COOCh4 > Ch4COOH > (Ch4CO)2O > СН3 COCl
D) Ch4COOH > СН3 COCl > Ch4CONh3 > (Ch4CO)2O > Ch4COOCh4
17. Назвать соединение по систематической номенклатуре
СН2 = СН – СООН
A) пропен – 2 – овая кислота
B) акриловая кислота
C) пропен – 1 – овая кислота
D) винилмуравьиная кислота
18. Назвать соединение по исторической номенклатуре
СН2 = СН – СН2 – СООН
A) винилуксусная кислота
B) бутен – 2 – овая кислота
C) бутен – 3 – овая кислота
D) кротоновая кислота
19. Определить продукты реакции в цепочке превращений:
HBr HOH

 СН2 = СH - CООН A B
СН2 = СH - CООН A B
H+ OH-
A) A – 3 – бромпропановая кислота, В – 3 – оксипропановая кислота
B) А – 2 – бромпропановая кислота, В – 2 – оксипропановая кислота
C) А – 3 – бромпропановая кислота, В – 2 – оксипропановая кислота
D) А – 2 – бромпропановая кислота, В – 2 – оксипропановая кислота
20. Назвать соединение по систематической номенклатуре
НООС – СН2 – СН2 – СН – СООН
½
СН3
A) 2 – метилпентандиовая кислота
B) 4 – метилпентадиовая кислота
C) α – метилглутаровая кислота
D) изоадипиновая кислота
21. Назвать соединение по исторической номенклатуре
НООС – СН2 – СН2 – СООН
A) янтарная кислота
B) глутаровая кислота
C) адиниовая кислота
D) малоновая кислота
22. Определить продукты реакций в цепочке превращений:
t0 Cl2

 HOOC - СН2 - CООН A B
HOOC - СН2 - CООН A B
A) А – уксусная кислота, В – хлоруксусная кислота
B) А – метан, В - хлорметан
C) А – уксусная кислота, В – хлористый ацетил
D) А – этан, В – хлорэтан
22. Определить продукты реакций в цепочке превращений:
t0 Ag(Nh4)2OH
 HOOC - CООН A B
HOOC - CООН A B
A) А – муравьиная кислота, В – угольная кислота
B) А – уксусная кислота, В – углекислый газ
C) А – водород, В – вода
D) А – муравьиная кислота, В – уксусный альдегид
24. Определить продукты реакций в цепочке превращений:
t0 [H]

 СН2 – СН2 – СООН А B
СН2 – СН2 – СООН А B
½
СН2 – СН2 - СООН
A) А – циклопентанон, В – циклопентан
B) А – циклогексанон, В – циклогексан
C) А – циклопентаналь, В – циклопентанол
D) А – циклогексаналь, В – циклогексанол
25. Продуктами реакций цепочки превращений являются:
C2H5ONa Ch4Br 2 HOH t0



 Ch3 – COOC2H5 A B С Д
Ch3 – COOC2H5 A B С Д
½
COOC2H5
A) А – натриймалоновый эфир, В – α – метилмалоновый эфир, С – α – метилмалоновая кислота, Д – пропионовая кислота
B) А – натрицмалоновая кислота, В – этилнатрий, С – этанол, Д – этан
C) А – натриймалоновый эфир, В – α – метилмалоновый эфир, С – α – метилуксусная кислота, Д – малеинат натрия
D) А – натрий малоновая кислота, В – маленнат натрия, С – малеиновая кислота, Д – малеиновый ангидрид
26. Щавелевую кислоту от уксусной кислоты можно отличить реакцией
A) нейтрализации
B) окисления
C) по изменению цвета лакмуса
D) полимеризации
27. Ацетоуксусный эфир образует амбидентный ион в присутствии
A) С2Н5ОNa
B) HCl
C) Ch4COOH
D) h3SO4
28. Указать продукты реакций в цепочке превращений:
HОН t0

 СН3 – С - СН2 – СООС2Н5 А B
СН3 – С - СН2 – СООС2Н5 А B
½ê
О
A) А – ацетоуксусная кислота, В – ацетон
B) А – ацетоуксусный эфир, В – уксусная кислота
C) А – ацетон, В – уксусная кислота
D) А – ацетоуксусная кислота, В – уксусная кислота
29. Указать продукты реакций:
HСN

 А
А

 СН3 - С – СН2 – СООС2Н5
СН3 - С – СН2 – СООС2Н5
О
(CН3)2 С = О
 В
В
A) А – оксинитрилацетоуксусного эфира,
В – диметилметиленацетоуксусный эфир
B) А – цианидацетоуксусного эфира, В – ацетонуксусный эфир
C) А – кетонитрилацетоуксусный эфир, В – ацетальацетоуксусный эфир
D) А – оксинитрилацетоуксусной кислоты, В – диметиленацетоуксусный эфир
30. Таутомерия – это
A) перемещение протона и π – связи у рядом стоящих атомов
B) перемещение групп атомов кроме изотопа
C) изомерия положения двойного связи
D) изомерия углеродного скелета
31. Для получения монокарбоновых (а) и дикарбоновых (б) кислот из натрий малонового эфира используют реагенты:
А) а- Ch4-CH(Br)-COOC2H5; б- Ch4Br;
В) а-Ch4 СОBr; б-Ch4-CH(Br)-COOC2H5;
С) а-Ch4Br; б-Ch4-CH(Br)-COOC2H5;
D) а-Ch4Br; б-Ch4-Ch3-COOC2H5.
mykonspekts.ru
Метилмалоновая кислота, диэтиловый - Справочник химика 21
Диэтиловый эфир метилмалоновой кислоты Диэтиловый эфир этоксиметиленмалоно-вой кислоты Диэтиловый эфир этилмалоновой кислоты То же [c.22]Приведите не менее трех схем синтеза диэтилового эфира метилмалоновой кислоты. Исходя из последней, получите а,а -диметилянтарную кислоту. [c.404]
Диэтиловый эфир метилмалоновой кислоты, содержащий лишь один активный атом водорода, может тем не менее реагировать в качестве адденда с этиленовыми и ацетиленовыми акцепторами [c.442]
Условия протекания этой важной реакции не изучались систематически, однако известно, что М-галогенметильные производные алифатических амидов обычно дают более низкие выходы, чем Ы-галогенметилбензамиды и Ы-галогенметилфталимиды. Например, при реакции диэтилового эфира метилмалоновой кислоты с Ы-хлор- [c.91]Диэтиловый эфир метилмалоновой кислоты наряду с диолом дает также в результате отщепления воды металиловый спирт с 5%-ным выходом [208]. [c.165]
Получение аминокислот. Превращение ди- и поликарбоновых кнслот в аминокислоты можно осуществить несколькими различными путями. Наиболее удовлетворительные результаты дает применение моноэфиров и их солей. Они реагируют с гидразином, образуя гидразиды кислот, которые можно превратить через азиды кисло г в аминокислоты. Из эфиров замещенных малоновых кислот получаются а-аминокислоты. (О получении а-аминокислот из эфиров замещенных циануксусных кислот см. стр. 343.) Так, например, из калиевой соли моноэтилового эфира метилмалоновой кислоты, которую получают путем неполного гидролиза диэтилового эфира, образуется солянокислая соль этилового эфира аланина с выходом 670/д [45] [c.328]
Алкилирование малоновыми эфирами. Бухта и Шлезингер [21 ] получили Сю-дикислоту(ССУ11) алкилированием 1,4-дибром-бутина-2 или 1,4-дибромбутена-2 двумя молями диэтилового эфира метилмалоновой кислоты. При омылении промежуточного тетраэфира и последующем декарбоксилировании образуется дикислота VII. [c.187]
С соединениями типа ВВ С=СНХ, в которых атом водорода связай с а-углеро-дом, протекает аномальная реакция Михаэля [151]. Эта реакция не характерна для соединений типа КВ С=СВ"Х. В результате аномальной реакции Михаэля один из заместителей в молекуле донора (аа исключением водорода), по-видимому, в результате перегруппировки промежуточного продукта переходит к атому углерода продукта реакции. При взаимодействии диэтилового эфира метилмалоновой кислоты с этиловым эфиром кротоновой кислоты в присутствии 1/6 моля этилата натрия получается нормальный аддукт 62, однако, если увеличить количество основания до одного эквивалента, то образуется соединение 64 [152], в котором метильная Группа связана с первым, а малонатная — со вторым атомом углерода [c.290]
Отщепление окиси углерода характерно для производных щавелевоуксусного эфира, получаемых конденсацией диэтилоксалата и соединений с активной метиленовой группой продуктами реакции декарбонилнрова-ния являются замещенные малоновые эфиры. Диэтиловый эфир метилмалоновой кислоты, например, может быть получен с выходами, близкими к теоретическим, из метилщавелевоуксусного (этоксалилпропионового) эфира (СОП, 2, 588) [c.577]
Диэтиловый эфир 4-метил-5-карбэтокси-3-(2-карбоксиэтил)-2-пиррил(Р-метилмалоновой кислоты) ФЗ, 334. [c.307]
Такегами и др. [25] сообщили, что при обработке этилового эфира а-бромпроиионовой кислоты раствором КСо(СО)4 в толуоле при 0° в атмосфере СО (1 атм) и расщеплении образующегося продукта иодом получают оба ожидаемых эфира — этиловый эфир метилмалоновой кислоты и возникший в результате перегруппировки диэтиловый эфир янтарной кислоты, причем последний в меньшем количестве. Однако при 25° преобладает эфир янтарной кислоты. [c.33]
Для получения триметильного деривата 5-амино-1-метилнафталин был превращен по способу Зандмейера в 5-циан-1-метилпроизводное, давшее с иодистым магний-метилом соответствующий метилкетон, а именно — 5-метилнафталин-1-метилкетон. Последний бронировался, и образовавшийся при этом ш-бром-Дериват вводился в реакцию с диэтиловым эфиром натрий-метилмалоновой кислоты, причем вследствие одновременного омыления получилась -(5-метил-1-нафтоилУизомасляная кислота (XVI). Восстановлением ее и замыканием кольца был приготовлен 1 -кето-2,8-диметил-1,2,3,4-тетрагидрофенантрен [c.107]
chem21.info