Большая Энциклопедия Нефти и Газа. Фениловый эфир
Фениловый эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Фениловый эфир
Cтраница 1
Фениловый эфир, загрязненный фенолом, желтеет на свету и не кристаллизуется. [1]
Фениловый эфир также получили Майер и Цютфен [765] при реакции хлористого р-хлорпропионила с фенолом в присутствии хлористого алюминия и сероуглерода. [2]
Фениловый эфир, а также изобутиловын и изоамиловый эфиры при нагревании с НС1 разлагаются с трудом. Лучших результатов достигают при помощи щелочи. Для этого фени-ловый эфир ортокремневой кислоты выпаривают досуха в серебряном тигле с несколькими каплями 10 % - ного NaOH, к остатку добавляют несколько капель НС1 ( 1: 1) и смесь снова выпаривают досуха. Далее реакцию проводят так же, как с метиловым и этиловым эфирами ортокремневой кислоты. [3]
Фениловый эфир, а также изобутиловъш и изоамиловый эфиры при нагревании с НС1 разлагаются с трудом. Лучших результатов достигают при помощи щелочи. Для этого фени-ловый эфир ортокремневой кислоты выпаривают досуха в серебряном тигле с несколькими каплями 10 % - ного NaOH, к остатку добавляют несколько капель НС1 ( 1: 1) и смесь снова выпаривают досуха. Далее реакцию проводят так же, как с метиловым и этиловым эфирами ортокремневой кислоты. [4]
Фениловый эфир, загрязненный фенолом, желтеет на свету и не кристаллизуется. [5]
Фениловый эфир 3-хлор - 4-метоксибензойной - С136 кислоты. Полученный в остатке неочищенный хлорангидрид З - хлор-4 - ме-токсибензойной - С136 кислоты нагревают с обратным холодильником в течение 30 мин. [6]
Фениловый эфир в большинстве случаев получается обратно неизмененным и расщепляется очень трудно. [7]
Фениловый эфир глицина вступает в реакцию с аланином ( конфигурация не указана) в присутствии бикарбоната, но не в присутствии пиридина. [8]
Фениловый эфир флуорантен-4 - сульфокислоты. Смесь 0 005 моля флуорантен-4 - сульфохлорида, 0 005 моля фенолята натрия и 0 1 моля фенола нагревают в течение 5 часов при 95 С. Отгоняют фенол с водяным паром. Полученный продукт растворяют в 30 мл метилового спирта, фильтруют, к горячему фильтрату добавляют 10 мл воды и оставляют раствор на ночь. Выпавший эфир отделяют на фильтре, промывают метиловым спиртом и сушат. В ультрафиолетовом свете флуоресцирует ярко-желтым. [9]
Фениловый эфир этан-1 1-дисульфокислоты, а также соответствующие N-этиланилид и фенетидид получаются метилированием натриевых производных [ 4506 в, 456 ] эфиров и амидов метионовой кислоты. [10]
Фениловый эфир муравьиной кислоты в присутствии BF3 не дает ожидаемого ге-оксибензальдегида, а образует более сложные продукты конденсации, получающиеся в результате изомеризации тг-оксиальдегида. Мезитилацетат, у которого нет активных положений для вступления ацетильного остатка, не претерпевает перегруппировки Фриса и при нагревании в течение 45 час. [11]
Фениловый эфир муравьиной кислоты в присутствии BF3 не дает ожидаемого п-оксибензальдегида, а образует более сложные продукты конденсации, получающиеся в результате изомеризации п-оксиальдегида. Мезитилацетат, у которого нет активных положений для вступления ацетильного остатка, не претерпевает перегруппировки Фриса и при нагревании в течение 45 часов до температуры его плавления ( 124 5) регенерируется в неизменном состоянии в виде борфторидного соединения. [12]
Фениловый эфир изофталевой кислоты получают взаимодействием хлорангидрида изофталевой кислоты с фенолом при 130 СС. Температура плавления эфира, перекристаллизованного из метанола, составляет 77 - 78 С. Смесь 3 188 г ( 0 01 М) дифенилизофталата и 2 140 г ( 0 01 М) 3 3 -диаминобензидина нагревают в атмосфере азота при 250 С, затем прогревают 30 мин при 270 - 280 С, 1 5 ч при 300 С и наконец, 30 мин при этой температуре в вакууме. [13]
Фениловый эфир этан-1 1-дисульфокислоты, а также соответствующие N-этиланилид и фенетидид получаются метилированием натриевых производных [ 4506 в, 456 ] эфиров и амидов метионовой кислоты. [14]
Фениловый эфир фосфористой кислоты был получен действием треххлористого фосфора на фенол и очищен перегонкой в вакууме. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Фениловый эфир уксусной кислот - Справочник химика 21
Фениловый эфир уксусной кислоты (фенилацетат). ..... [c.645]Фенилацетат см. Фениловый эфир уксусной кислоты [c.495]
Используя только неорганические реагенты и катализаторы, из метана получите фениловый эфир уксусной кислоты. [c.122]
Напишите схему реакции получения фенил-ацетата (фенилового эфира уксусной кислоты). [c.112]
Фениловый эфир уксусной кислоты см. Фенилацетат [c.474]
Фениловый эфир уксусной кислоты -Крезиловый эфир уксусной кислоты [c.88]
Фениловый эфир уксусной кислоты [c.500]Фениловый эфир уксусной кислоты Hg OO gHg. При гидролизе получают уксусную кислоту и фенол [c.158]
Фениловый эфир уксусной кислоты л-Крезиловый эфир уксусной кислоты Ацетилсалициловая кислота ) [c.391]
Достаточно доказано то обстоятельство, что реакции окисления чувствительны к кислотным катализаторам [4, 5, 91, 131]. С успехом могут применяться растворы, содержащие серную или фтористоводородную кислоты в высоких концентрациях [20]. Б реакциях окисления надуксусной и надбензойной кислотами применяли в каталитических количествах хлорную [6] и серную кислоты [4, 29] и и-толуолсульфокислоту [28, 91, 119], что приводило к заметному сокращению продолжительности реакции. Типичным примером может служить тот факт, что при окислении бензофенона надуксусной кислотой в ледяной уксусной кислоте до фенилового эфира уксусной кислоты последний был получен с выходом 44% через 192 часа, тогда как при прибавлении концентрированной серной кислоты (25%) реакция продолжалась 30 мин. н выход составил 82% [4]. [c.100]
Фенилацетат, фениловый эфир уксусной кислоты (сложный эфир) [c.596]
Фениловый эфир уксусной кислоты. ........ 1,251 -1,437 0.1654 [c.661]
Для каждой пары соединений предложите химические реакции, которые выявили бы а) их различие УУ-метиланилин и п-толуидин, Л -нитрозо-Л -метилани-лин и и-нитрозо-Л -метиланилин, фенокснуксусная кислота и фениловый эфир уксусной кислоты б) их сходство -фенил-З-метил-5-пиразолон и фенол, диазоами-нобензол и Л -нитрозо-Л -метиланилин, iV-нитрозоацетанилид и бензолдиазосуль-фонат. [c.268]
Были предложены два общих метода 1) взаимодействие двух молярных эквивалентов амида щелочного металла с одним молем метилпиридинового соединения и, по меньшей мере, с одним молем сложного эфира и 2) взаимодействие двух молекулярных эквивалентов амида щелочного металла и метилпиридинового соединения с одним молем сложного эфира. Применение первого метода не всегда приводит к успеху, однако второй, повидимому, имеет общее значение. При применении этих методов, которые по своей эффективности превосходят все описанные ранее, хинальдин, лепидин и а-пиколин были сконденсированы с этиловым эфиром бензойной кислоты, фениловым эфиром уксусной кислоты, уксусным ангидридом, фениловым эфиром пропионовой кислоты, пропионовым ангидридом, этиловым эфиром н-масляной кислоты, этиловым эфиром изомасляной кислоты, этиловым эфиром щавелевой кислоты или этиловым эфиром угольной кислоты с образованием кетонов, эфиров уксусной кислоты или эфиров пировиноградной кислоты. [c.66]
Фениловый эфир изоциановой кислоты 7H5NO, См. Фенилизоцианат Фениловый эфир уксусной кислоты 8Hs02. См. Фенилацетат [c.837]
В последней колонке табл. 34 приведены некоторые значения log ( / НгО) реакции фенилового эфира уксусной кислоты с нуклеофильными реагентами, подтверждающие это положение. Здесь видна отчетливал связь с основностью, тогда как никакого соответствия со значениями или п нет. Интересно, что из всех галогенид-ионов лишь наиболее основный фторид-ион способен вытеснить п-нитрофенильную группу от карбонильного углерода, тогда как другие галогенид-ионы совершенно инертны. [c.177]
Фенилендиамин сернокислый 200089 4-Фенилморфолин 200315 Фепиловый эфир пропионовой кислоты 200041 Фениловый эфир уксусной кислоты [c.344]
chem21.info
Фениловый эфир - бензойная кислота
Фениловый эфир - бензойная кислота
Cтраница 1
Фениловый эфир бензойной кислоты образуется в большем количестве, если реакция протекает в присутствии таких активирующих бензол катализаторов, как хлористый алюминий или хлорное железо. [1]
Фенилбензоат ( фениловый эфир бензойной кислоты): - бесцветное кристаллическое вещество; растворяется в этиловом спирте и диэтиловом эфире, трудно растворим в воде. [2]
Используя химические методы, приведите реакции, позволяющие различить и разделить приведенные ниже соединения: а) фениловый эфир бензойной кислоты, бензоилхлорид, / г-хлорбензонитрил; б) л-нитробензиловый спирт, я-ни-троацетофенон, л-нитробензойная кислота. [3]
Используя химические методы, приведите реакции, позволяющие различить и разделить приведенные ниже соединения: а), фениловый эфир бензойной кислоты, бензоилхлорид, л-хлорбензонитрил; б) л-нитробензиловый спирт, я-ни-троацетофенон, л-нитробензойная кислота. [4]
В ней показано, что при реакции диазоаминобензола с бензойной кислотой в бензоле, кумоле, а-метилстироле и в смеси кумола и стирола фениловый эфир бензойной кислоты не образуется. Ни в одном из опытов не были обнаружены вторичные амины и двуокись углерода. Оказалось, что система диазоаминобензол - бензойная кислота и органический растворитель инициирует полимеризацию стирола. При распаде диазоаминобензола в присутствии бензойной кислоты и соли Fe2 образуется 75 % соли Fe3, в присутствии бензойной кислоты и серы образуется дифенилполисульфид. При проведении реакции в растворе кумола выделены дикумил и бензол. [5]
Каталитическое действие ионов меди может быть усилено добавками ионов натрия, калия, лития, бария и особенно марганца и кобальта. Фениловый эфир бензойной кислоты гидро-лизуется водяным паром. [6]
В конической колбе приготовляют раствор 5 г едкого натра в 45 мл воды и растворяют в нем 3 г фенола. Выпадает фениловый эфир бензойной кислоты. Осадок отсасывают на воронке Бюхнера, тщательно промывают водой. [7]
Нами [210] было исследовано расщепление диазоаминобензола бензойной кислотой при нагревании в сухом бензоле. При этом фениловый эфир бензойной кислоты не был обнаружен. После реакции выделена значительная часть бензойной кислоты, анилин и азот ( с почти количественным выходом), n - аминоазобензол и в небольшом количестве бифенил и 4-аминодифенил. Высказано предположение о возможном механизме образования этих продуктов. Вероятно, вначале диазоаминобензол распадается на фенил-диазобензоат и анилин, а затем при их сочетании получается 4-ами-ноазобензол. Для образования бифенила и 4-аминодифенила нужно допустить действие на бензол и анилин фенильных радикалов, возникающих в результате превращения фенилдиазобензоазота. Бифенил может также получиться при рекомбинации фенильных радикалов. [8]
В конической колбе емкостью 750 мл приготовляют раствор 40 г ( 1 моль) едкого натра в 360 мл воды и растворяют в нем 23 5 г ( 0 25 моля) фенола. Во время встряхивания выпадает фениловый эфир бензойной кислоты. Осадок отсасывают на воронке Бюхнера, тщательно промывают водой и сушат. [9]
В конической колбе емкостью 750 мл приготовляют раствор 40 г ( 1 моль) едкого натра в 360 мл воды и растворяют в нем 23 5 г ( 0 25 моль) фенола. Во время встряхивания выпадает фениловый эфир бензойной кислоты. Осадок отсасывают на воронке Бюхнера, тщательно промывают водой и сушат. [10]
Способ Дау [17] предусматривает жидкофазное окисление толуола в присутствии солей марганца, активированных бромом, или солей кобальта, активированных кетонами. Окисление бензойной кислоты в фенол ( или в фениловый эфир бензойной кислоты) катализируется ионами Си2 и протекает с отщеплением двуокиси углерода. [12]
Разработан новый интересный метод получения фенола, исходя из бензойной кислоты, а также ряда других оксисоединений из соответствующих карбоновых кислот. Ранее было известно [382], что при нагревании бензоата меди образуется смесь продуктов, содержащая фенол, салициловую кислоту и фениловый эфир бензойной кислоты. [13]
Продукт перекристаллизовывают из этилового ( или метилового) спирта. Для этого сырой продукт растворяют в 95 мл этилового спирта ( примечание 1) и горячий раствор фильтруют через воронку с обогревом. По охлаждении раствора кристаллизуется фениловый эфир бензойной кислоты, который отсасывают на воронке Бюхнера и сушат. [14]
В большой пробирке растворяют 4 г фенола в 8 - 10 мл воды ( тяга. Хлористый бензоил вызывает раздражение слизистых оболочек. Смесь осторожно нагревают при встряхивании до исчезновения запаха хлористого бензоила, а затем выливают в стакан с 15 мл холодной воды. После охлаждения веществ выделившийся фениловый эфир бензойной кислоты в виде масла застывает в бесцветные кристаллы. [15]
Страницы: 1 2
www.ngpedia.ru
Фениловой эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Фениловой эфир
Cтраница 1
Фениловые эфиры считаются также безвредными при использовании их в качестве компонентов духов. [1]
Фениловые эфиры метан - и бензолсульфокислот получали аналогичным способом. [2]
Фениловые эфиры также способны к азосочетанию, хотя они вступают в эту реакцию не так легко, как фенолы. Реакция в этом случае протекает в уксуснокислом растворе н обычно лишь с достаточно реакционноспособными солями диазония, например с получающимися из р-нитранили а или из 2 4-динитр-анилина. Некоторые эфиры фенолов при этом гидролизуются. [3]
Фениловые эфиры также способны к азосочетанию, хотя они вступают в эту реакцию не так легко, как фенолы. Реакция в этом случае протекает в уксуснокислом растворе н обычно лишь с достаточно реакционноспособными солями диазония, например с получающимися из р-нитранилина или из 2 4-динитр-анилина. Некоторые эфиры фенолов при этом гидролизуются. [4]
Фениловые эфиры также способны к азосочетанию, хотя они вступают в эту реакцию не так легко, как фенолы. Реакция в этом случае протекает в уксуснокислом растворе н обычно лишь с достаточно реакционноспособными солями диазония, например с получающимися из р-нитранили а или из 2 4-динитр-анилина. Некоторые эфиры фенолов при этом гидролизуются. [5]
Фениловые эфиры ( 70) были предложены [314] для защиты карбоксильной группы в пептидном синтезе, так как их расщепление под действием высоконуклеофильного гидроперокси-аниона проходит в мягких условиях без рацемизации. [6]
Фениловые эфиры получают прямым путем, как отмечалось выше. Синтез эфиров енолов из альдегидов и кетонов, существующих в основном в кето-форме, требует в некоторых случаях специальных методов. [7]
Фениловые эфиры целлюлозы могут быть подвергнуты дальнейшим превращениям. Существенный интерес представляют продукты их нитрования. При обработке нитрующими агентами происходит этерификация свободных ОН-групп целлюлозы и нитрование фенильных группировок, причем в каждую фенильнуго группу может быть введено по две нитрогруппы. [8]
Фениловые эфиры целлюлозы могут быть подвергнуты дальнейшим превращениям. Существенный интерес представляют продукты их нитрования. При обработке нитрующими агентами происходит этерификация свободных ОН-групп целлюлозы и нитрование фенильных группировок, причем в каждую фенильную группу может быть введено по две нитрогруппы. [9]
Фениловые эфиры целлюлозы до настоящего времени не получены, хотя эти производные целлюлозы могут представлять теоретический и практический интерес. [10]
Фениловые эфиры фосфинистых кислот не реагируют с четыреххлористым углеродом по схеме Камая. [12]
Нитропроизводные смешанных фениловых эфиров, у которых нитрогруппа находится в о - или р-положении к алкоксиль-ной группе, так же как и нитрогалоидные производные бензола, легко превращаются в нитрофенолы при нагревании с водной щелочью. Скорость этой реакции повышается с увеличением числа нитротрупп в молекуле. Так, например, р-нитроанизол при кипячении с 10 % - ным водным раствором едкого натра лишь медленно превращается в р-нитрофенол, тогда как 2, 4, 6-три-нитроанизол гидролизуется холодными водными растворами карбонатов щелочных металлов с образованием солей ликриновок кислоты. [13]
Нитропроизводные смешанных фениловых эфиров, у которых нитрогруппа находится в о - или р-положении к алкоксиль-ной группе, так же как и нитрогалоидные производные бензола, легко превращаются в нитрофенолы при нагревании с водной щелочью. Скорость этой реакции повышается с увеличением числа нитрогрупп в молекуле. Так, например, р-нитроанизол при кипячении с 10 % - ным водным раствором едкого натра лишь медленно превращается в р-нитрофенол, тогда как 2, 4, 6-три-нитроанизол гидролизуется холодными водными растворами карбонатов щелочных металлов с образованием солей ликриновой кислоты. [14]
Хотя фениловые эфиры и омыляются в более мягких щелочных условиях, все же существует опасность рацемизации оптически активного С-терминального остатка, что, по-видимому, связано с катализируемым основаниями образованием оксазолона. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Фениловый эфир бензойной кислоты
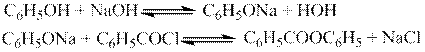
Реактивы: фенол, хлористый бензоил, гидроксид натрия, этиловый спирт.
Оборудование: колба плоскодонная вместимостью 50, пробка, нутч-фильтр.
Фенол, попадая на кожу, может вызывать сильные ожоги! Работы с фенолом проводят в вытяжном шкафу!
В плоскодонной колбе готовят раствор 1 г едкого натрия в 10 мл воды и растворяют в нем 0,6 г фенола. Затем туда же добавляют 1-2 мл хлористого бензоила и колбу энергично встряхивают в течение 15-20 мин до исчезновения запаха хлористого бензоила. При встряхивании постепенно выпадают кристаллы фенилового эфира бензойной кислоты. Осадок отфильтровывают, промывают водой и сушат.
Перекристаллизацию ведут из этилового спирта, не доводя его до кипения. Т. пл. 700С.
Определяют выход полученного вещества, температуру плавления, растворимость и сравнивают полученные результаты с теоретическими данными. Делают соответствующий вывод.
Использование реакций окисления и восстановления.
Лабораторная работа №19 «Окисление»
Процессы, сопровождающиеся отнятием от субстрата электронов, называют окислением. В этих реакциях окислителями являются соединения, обладающие большим сродством к электрону (электрофильностью), а субстратами – соединения, имеющие склонность к отдаче электронов (нуклеофильность).
Процессы окисления связаны либо с присоединением кислорода, либо с дегидрированием – отнятием водорода (точнее, двух электронов и двух протонов).
Наиболее распространенными окислителями являются вещества с сильно выраженными электрофильными свойствами: азотная кислота, кислород и пероксидные соединения (пероксид водорода, пероксиды металлов, неорганические и органические надкислоты), сера, бром, хлор. Кислородные кислоты галогенов и их соли. К эффективным окислителям относятся соединения металлов в высших степенях окисления: соединения железа (III), перманганат калия, диоксид марганца, хромовая кислота и ее ангидрид.
Практическая часть
Антрахинон
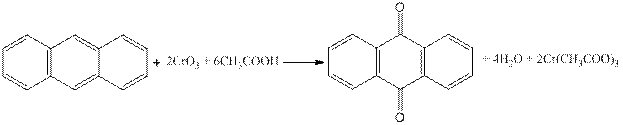
Реактивы: антрацен, оксид хрома (VI), уксусная кислота (ледяная).
Оборудование: колба двухгорлая вместимостью 50 мл; обратный холодильник, стакан на 100 мл, колба коническая на 100 мл.
Собирают прибор (рис.3.28.). В двугорлой колбе, снабженной капельной воронкой и обратным холодильником (или в колбе снабженной двурогим форштосом) (рис. 29), растворяют при нагревании 0.32 г (0,0018 моль) антрацена в 12 мл ледяной уксусной кислоты. Содержимое доводят до легкого кипения и из капельной воронки медленно приливают окислительную смесь. Ее готовят заранее из 1 г (0,01 моль) оксида хрома (VI), 1 мл воды и 4 мл уксусной кислоты. После введения всего раствора окислителя, на что требуется приблизительно 1 ч, реакционную массу выдерживают при температуре кипения 15 мин (на окончание реакции указывает окрашивание массы в зеленый цвет). Смесь выливают в стакан с 6 мл воды и оставляют на ночь. Выпавший за это время осадок отфильтровывают, промывают водой и влажный перекристаллизовывают из ледяной уксусной кислоты.
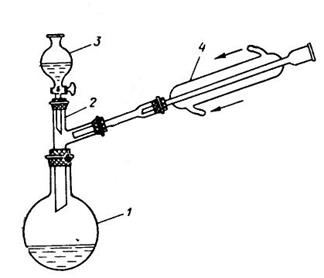
Рис.3.28. Установка для окисления антрахинона.
1 – реакционная колба;
2 – двурогий форштос;
3 – капельная воронка с окислительной смесью;
4 – обратный холодильник Либиха.
Антрахинон – кристаллическое вещество в виде светло-желтых ромбов, нерастворимых в воде, трудно растворим в спирте, эфире, хорошо – в анилине, горячем толуоле, концентрированной серной кислоте. Т. пл. 2860С. Хроматография: элюент: гексан – этилацетат (17:1). Rf=0.42.
Идентификации полученного соединения провести с помощью инфракрасной спектроскопии (см. раздел 3.5).
Определите выход полученного вещества, температуру плавления, растворимость и проведите ТСХ и сравните полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
Бензойная кислота
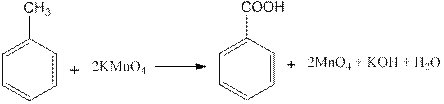
Реактивы: толуол, перманганат калия, соляная кислота.
Оборудование: круглодонная колба вместимостью 100 мл; обратный холодильник, стакан на 100 мл, песчаная баня, колба коническая на 100 мл.
В круглодонной колбе, снабженной обратным холодильником (рис. 3.29.), кипятят на песчаной бане в течение 3 ч 1,2 мл толуола с 40 мл воды и 3,4 г мелко растертого перманганата калия. Для равномерного кипения в колбу бросают несколько «кипелок». После завершения реакции раствор в колбе над осадком диоксида марганца должен быть бесцветным. Если реакционная смесь остается окрашенной, обесцвечивания достигают прибавлением 0,2 мл спирта или 0,1 г щавелевой кислоты при нагревании.
Горячий раствор фильтруют через складчатый фильтр, осадок диоксида марганца промывают небольшим количеством горячей воды. Фильтрат упаривают в стакане до объема 10-20 мл и отфильтровывают от вновь выпавшего оксида марганца (IV).
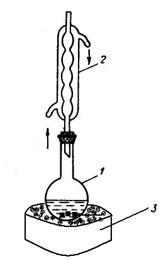
Рис.3.29. Установка для синтеза бензойной кислоты.
1 – реакционная колба;
2 - обратный холодильник.
3 – песчаная баня.
Промыв осадок 5 мл горячей воды, объединенный фильтрат подкисляют концентрированной соляной кислотой до кислой реакции по индикаторной бумаге. При этом осаждается бензойная кислота, которую отфильтровывают, промывают небольшим количеством холодной воды и сушат.
Бензойная кислота – белое кристаллическое вещество в виде пластинок, плохо растворяется в холодной воде, лучше – в горячей. Хорошо растворяется в хлороформе, ацетоне, бензоле. Т. пл. 1220С.
Хроматография: адсорбент: Sorbfil; элюент: петролейный эфир – этилацетат – ледяная уксусная кислота (17:2:1). Rf=0.2.
Определяют выход полученного вещества, температуру плавления, растворимость и проводят ТСХ и сравнивают полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
infopedia.su
Фениловый эфир, образование - Справочник химика 21
Изменение pH среды в ходе реакции может повлиять на формальную кинетику реакции из-за изменения адсорбционных коэффициентов компонентов реакционной среды. Так, при избытке щелочи реакция окисления фенилового эфира гликоля в феноксиуксусную кислоту на платиновом катализаторе идет ио первому порядку по реагенту, тогда как при недостатке щелочи имеет место значительное торможение продуктом реакции за счет образования свободной кислоты с высоким адсорбционным коэффициентом [19]. [c.55] Ряд смешанных ангидридов из алифатических кислот разлагается с образованием сложных эфиров по пути А, а смешанные ангидриды ароматических кислот разлагаются по пути либо А, либо Б. При 250 °С происходит также реакция В [74]. Трифторуксусная кислота и фениловый эфир хлормуравьиной кислоты при смешивании образуют. фениловый эфир трифторуксусной кислоты с выходом 75—80% [75]. Рассмотренные реакции декарбоксилирования, по-видимому, протекают через промежуточное циклическое состояние, причем происходит сдвиг электронов в цикле. [c.292]Эфиры, образованные за счет карбоксильной группы (метиловый н фениловый). [c.231]
Выбор сложного эфира и кетона. Поскольку при образовании [ -дикетона алкоксильная группа сложного эфира отщепляется, можно применять различные сложные эфиры кислот. Чаще всего пользуются этиловыми эфирами, о при одинаковой доступности могут оказаться предпочтительными более реакционноспособные метиловые эфиры. В тех случаях, когда даже и метиловые эфиры не обеспечивают получения удовлетворительных выходов, можно рекомендовать еще более реакционноспособные фениловые эфиры. Однако в последнем случае образующийся в качестве побочного продз кта фенол иногда бывает трудно отделить от -дикетона. [c.141]
Свейн [56] предположил образование водородных связей в тримолекулярной реакции замещения в галогено-производных трифенилметана. Аналогичное предположение высказано Свейном и Эдди [57] относительно тримолекулярных реакций замещения в ряду галогено-производных метана. Реакции замещения галогено-производных трифенилметанов описываются кинетическим уравнением третьего порядка. В бензольном растворе с избытком пиридина при 25° метанол реагирует с трифенил-хлорметаном или трифенилбромметаном, давая метиловый эфир. Если вместо метанола взять фенол, то фениловый эфир образуется с меньшей скоростью. Если в реакционной смеси присутствуют метанол и фенол одновременно, то метиловый эфир образуется со скоростью в семь раз большей, нежели суммарная скорость для метанола и фенола. В этом случае скорость пропорциональна концентрациям метанола, фенола и алкилгалогенида, несмотря на то что фенол не расходуется в быстрой стадии реакции. [c.217]
В качестве производных кислоты в реакциях Фриделя — Крафтса можно применять также эфиры карбоновых кислот. При этом появляется интересное различие в зависимости от строения сложных эфиров. А именно фениловые эфиры, вообще говоря, разлагаются в процессе реакции с расщеплением связи ацил — кислород, способствуя таким путем образованию бедного энергией фенолята [c.454]
Реакция е патрийамидом. Как можно было предвидеть по аналогии между водными и аммониевыми системами, натрийамид взаимодействует с солями сульфокислот с образованием аминов. Аналогично образованию фенилового эфира в результате побочной реакции нри сплавлении бензолсульфокислоты с щелочью с нат-рийамидом получается дифениламин. [c.247]
Реакции и применение арил сульфонатов. По своему отношению к гидролизующим агентам арилсульфонаты резко отличаются от алкилсульфонатов. Фениловый эфир бензолсульфокислоты медленно гидролизуется кипящим водным раствором едкого кали [250],однако алкоголят натрия энергично реагирует при комнатной температуре с фениловым эфиром п-толуолсульфокислоты в спиртовом растворе с образованием фенетола. Это превращение, вероятно, пдет в две стадии [251] [c.386]
Эфирная группа фенилового эфира 4-(4 -имидазолил) масляной кислоты (1-6) гидролизуется быстрее, чем соответствующий фе-ниловый эфир н-масляной кислоты. Если арильный остаток содержит м-нитрогруппу, скорость гидролиза при нейтральных значениях pH еще выше. Как и следовало ожидать, лучшая уходящая группа вызывает дальнейшее ускорение реакции. Эта реакция протекает через образование тетраэдрического промежуточного соединения (1-7). Подробно такого рода промежуточные [c.18]
В таблице 17 приведена рН-зависимоСть образования N-мeтил-2-бeнзoк aзoлинoнa при внутримолекулярной циклизации фенилового эфира Ы-(2-оксифенил)-Ы-метилкарбамата [17] [c.49]
Образование оксониевых соединений часто встречается в химии кислородсодержащих органических соединений, будучи промежуточным процессом многих реакций (кислотный гидролиз сложных эфиров, гликозидов и т. п.). Из ди-фенилового эфира методом диазораспада был получен химически крайне инертный борфторид трифенилоксония [c.37]
Объясните следующие факты а) фенетол расщепляется бромистым и иодистым водородом до фенола и этилгалогенида, а дифениловый эфир не реагирует с Н1 даже при 200 °С б) аллил-фениловый эфир при 200 °С изомеризуется с образованием о-ал-лилфенола, а пропилфениловый эфир в этих условиях не изменяется в) фенолят натрия реагируете хлористым аллилом в ацетоне с образованием фенилаллилового эфира, а в бензоле основным продуктом является о-аллилфенол. [c.167]
Окислительное декарбоксилирование. — 1кли медную соль бензойной кислоты нагревать несколько часов при 260— 300 °С, она разлагается с образованием фенилового эфира бензойной кислоты, двуокиси углерода и меди (Толенд, 1961) [c.366]
Фениловый эфир глицина вступает в реакцию с аланином (конфигурация не указана) б грисутствии бикарбоната, но не в присутствии пиридина. Для объяснения этих результатов было выдвинуто предположение об образовании р качестве промежуточного соединения оксазолидона [270]. [c.242]
Фтористый бор алкилирует фенолы через промежуточное образование фениловых эфиров, изомеризующихся в алкилфеполы. Повышение температуры увеличивает выход алкилфенолов [Завгородний, ЖОХ, 16, 1495 (1946) Завго-родний, Федосеева, ЖОХ, 16, 2006 (1946)]. [c.429]
По Менгеру и Смиту (1972 г.), при аминолизе фениловых эфиров в органических растворителях определяющей скорость стадией следует считать не образование тетраэдрических аддуктов, а скорее их разложение. [c.147]
Гидрирование фенилового эфира г мс-4[1-бензгидрил-3-(диизопропоксифосфорил)азиридин-2-ил]уксусной кислоты в метаноле в присутствии катализатора (10% Pd на угле) при 23-25 С протекает с селективным разрывом углерод-азотной связи со стороны ароматического ядра и образованием первичной аминогруппы. Целевой фосфорсодержаш,ий амин был получен с выходом 79% и его гидролиз 6N НС1 привел к соответствуюш,ему гидрохлорид[ 1 -амино-2-(4-гидроксифенил)-1 -этил]фосфорной кислоты с выходом 87%. [c.22]
СТВИИ щелочи [82]. Однако в присутствии серной кислоты образуется только фениловый эфир р-оксипропионовой кислоты с хорошим выходом [88]. Тиолы легко реагируют на холоду с р-пропиолактоном в водно-щелочной среде с образованием [c.228]
Нами была исследована реакция раскрытия азиридинового кольца в фениловом эфире г с-4[1-бензгидрил-3-(диизонропок-сифосфорил) азиридин-2-ил]уксусной кислоты. Гидрирование соединения в метаноле при 23-25 °С в присутствии катализатора (10% Рсвязи углерод-азот со стороны ароматического ядра и образованием первичной амино-группы. В результате был получен фениловый эфир [c.26]
Обессеривание фенилового эфира р-(2-пиперидил)тиолпропионовой кислоты не привело к образованию ожидаемого р-(2-пиперидил) про пионового альдегида. Единственным выделенным в этой реакции продуктом был 3-кетооктагидропирроколин [61). (См. также [164а1.) [c.301]
Хотя фениловые эфиры и омыляются в более мягких щелочных условиях, все же существует опасность рацемизации оптически активного С-терминального остатка, что, по-видимому, связано с катализируемым основаниями образованием оксазолона. Степень такого риска существенно возрастает с учетом чрезвычайно сильного ускорения расщепления в присутствии гидропероксид-аниона, который явно действует как высокоизбирательный нуклеофил -эффекта [34]. Фениловые сложные эфиры ввиду присущей им реакционной способности по отношению к аминонуклеофилам склонны к образованию дикетопнперазинов (40), что является серьезной побочной реакцией при превращении сложных эфиров дипептидов [c.380]
Нитропроизводные смешанных фениловых эфиров, у которых нитрогруппа находится в о- или р-положении к алкоксиль-ной группе, так же как и нитрогалоидные -производные бензола, легко превращаются в нитрофенолы при нагревании с водной щелочью. Скорость этой реакции повышается с увеличением числа нитрогрупп в молекуле. Так, например, р-нитроанизол при кипячении с 10%-ным водны.м раствором едкого натра лишь медленно превращается в р-нитрофенол, тогда как 2, 4, 6-три-нитроанизол гидролизуется холодными водными растворами карбонатов щелочных металлов с образованием солей пикриновой кислоты. Алкоксильная (группа может быть замещена группой [c.86]
В ходе исследования соединений, которые, как считалось ранее, содержат пятиковалентный азот, Тэйлор, Оуэн и Уиттекер [49] повторили работы Штаудингера [50] по взаимодействию дифенилкетена с Ы-фениловым эфиром бензальдоксима. Штаудингер считал, что реакция идет вначале через стадию образования продукта присоединения кетена к семиполярной связи эфира (азот—кислород) затем при более высокой температуре этот продукт присоединения теряет двуокись углерода с образованием соединения (названного нитреном ), содержащего пятиковалентный азот [c.84]
Убедительных доказательств образования указанных промежуточных соединений не имеется. Дисалицилид (IV) образуется при перегонке ацетата салициловой кислоты при уменьшенном давлении [7]. Фениловый эфир соединения V получается только [8] при пиролизе салола в присутствии небольших количеств соды [9]. Третий промежуточный продукт (VI) может получаться из салола с помощью перегруппировки Фриса, и его образование при высоких температурах происходит даже без кислого катализатора. [c.322]
Были предложены два общих метода 1) взаимодействие двух молярных эквивалентов амида щелочного металла с одним молем метилпиридинового соединения и, по меньшей мере, с одним молем сложного эфира и 2) взаимодействие двух молекулярных эквивалентов амида щелочного металла и метилпиридинового соединения с одним молем сложного эфира. Применение первого метода не всегда приводит к успеху, однако второй, повидимому, имеет общее значение. При применении этих методов, которые по своей эффективности превосходят все описанные ранее, хинальдин, лепидин и а-пиколин были сконденсированы с этиловым эфиром бензойной кислоты, фениловым эфиром уксусной кислоты, уксусным ангидридом, фениловым эфиром пропионовой кислоты, пропионовым ангидридом, этиловым эфиром н-масляной кислоты, этиловым эфиром изомасляной кислоты, этиловым эфиром щавелевой кислоты или этиловым эфиром угольной кислоты с образованием кетонов, эфиров уксусной кислоты или эфиров пировиноградной кислоты. [c.66]
Вейссман и Браун [31 показали, что в противоположность алкиловым сложным эфирам, которые инертны по отношению к реагенту, фениловые эфиры алифатических п алнциклических кнслот реагируют с образованием альдегидов. Одпако, так как фениловые [c.187]
Из проведенного обсуждения следует, что спирты реагируют с р-лактонами в нейтральных (очень медленно) или слабо кислых (быстро) условиях в направлении алкилкислородного раскрытия цикла с образованием р-алкоксипропионовых кислот и их э( иров, эфиров гидракриловой кислоты и полиэфиров [58]. Фенол и р-про-пиолактон медленно реагируют при комнатной температуре с образованием р-феноксипропионовой кислоты. Однако в присутствии каталитических количеств серной кислоты направление реакции резко меняется в этих условиях получен фениловый эфир гидракриловой кислоты, который образуется при ацилкислородном [c.88]
Фениловые эфиры фосфинистых кислот не реагируют с четыреххлористым углеродом по схеме Камая. Для них идет реакция с образованием смеси соответствующих дихлорфосфорана и дихлормети-лилида [53] [c.127]
Сведения о месте, к которому прикреплен атом углерода, получают из исследования влияния изменений pH на активность фермента [80]. Как показано на рис. 22 и 23, активность ферментов по отношению к различным эфирам уксусной кислоты низка в кислом растворе, возрастая до максимальной величины при зна- чении pH порядка 8 и затем либо остается почти постоянной (для тиоловых и фениловых эфиров), э либо быстро падает (для ацетил- холипа и сложных эфиров али- -фатических спиртов). Кислотная ветвь кривой, по существу, не зависит от субстрата. Эта часть 2 кривой, вероятно, соответствует го образованию в более кислых растворах кислотной формы группы, ответственной за связь с общей частью гидролизуемых сложных эфиров, т. е. с карбонильным углеродом. Менее вероятно, что этот углерод связывается с кислотным центром. [c.143]
Диоксидифенил, 1-хлор-З-оксипропен Уксусная кислота (I), этанол (II) бис-(у-Оксипропил)-фениловый эфир, H I Образование Этилацетат, HjO NaO jHs в этаноле в этаноле, кипячение 24 ч [581] сложных эфиров Na-силикат паровая фаза, 200° С, молярное соотношение I II = 1 1,5. Превращение 97% [582] [c.65]
Таким образом, образование оксифенилалкилкетонов из фено.лов и кислот в присутствии BFg, по-видимому, происходит не путем непосредственного введения ацильпого остатка в бензольное ядро, а через образование фениловых эфиров карбоновых кислот как промежуточных продуктов. [c.279]
Присоединение и конденсация, вероятно, проходят за счет водорода фенольного гидроксила и водорода бензольного ядра с образованием сложной смеси фенольных и эфирных соединений, из которых были идентифицированы в относительно чистом состоянии только -бромизонронил-фениловый эфир и аллилфенол [59]. [c.457]
chem21.info
Получение - фениловой эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Получение - фениловой эфир
Cтраница 1
Получение фениловых эфиров по реакции Ульмана является более трудной операцией, чем гладкое арилирование динитрофторбензолом. К тому жединитрофениловые эфиры лучше кристаллизуются, а днамннофеннльные эфиры легче растворяются в тех растворителях, которые применяются на стадии расщепления; наличие аминогрупп способствует также расщеплению эфира в требуемом направлении. [1]
Для получения фениловых эфиров следует отдать предпочтение безводным системам, а из всех исследованных металлов только соли меди ( Н) достаточно специфичны и имеют практическое значение. [2]
Для получения фениловых эфиров карбонов ых к и с л о т в качестве впдоотнимающего средства применяют хлорокись фосфора или, лучше, ведут этерификацию по одному из описанных ниже способов. [3]
Шоттена-Баумана реакция - получение фениловых эфиров карбоновых кислот взаимодействием фенолов с хлорангидридами карбоновых кислот в водном растворе щелочи или пиридине. [4]
В патенте [22] на получение фениловых эфиров метакриловой кислоты в качестве примеров даны фениловый, о-крезиловый и гс-циклогексилфениловый эфиры метакриловой кислоты и димет-акриловый эфир резорцина. Эти эфиры были получены нагреванием соответствующего фенола с хлорангидридом метакриловой кислоты. [5]
В работе, посвященной получению различных сложных эфиров, Адикес и Брукнер [498] описывают систематические опыты по получению фениловых эфиров муравьиной кислоты. [6]
Эти работы показали, что при сухой перегонке бензоата образуются фенол, бензол, бензойная кислота, салициловая кислота, фенилбензоат. В пятидесятые годы нашего столетия появилась серия патентов [66-71], предлагавших применение этого процесса для получения фениловых эфиров и фенолов из арилкарбоновых кислот и арилсульфокислот. Так, из о - и n - толуиловых кислот, а также из n - толуолсульфокислоты образуется ж-крезол; из ж-толуиловой - о - и n - крезолы; из о-хлор-бензойной и n - хлорбензойной кислот - ж-хлорфенол; из мезитиле-новой кислоты - 2 4-ксиленол, из а - и р-нафтойных кислот - р-нафтол. [7]
Если непосредственная этерификация кислоты спиртом не -, применима или неудобна с препаративной точки зрения, можно пользоваться для этой цели другими способами. Этот метод служит для получения фениловых эфиров кислот и часто применяется для идентификации небольших количеств спирта или же кислоты ( см. стр. [8]
Если непосредственная этерификация кислоты спиртом не -, применима или неудобна с препаративной точки зрения, можно пользоваться для этой цели другими способами. Этот метод служит для получения фениловых эфиров кислот и часто применяется для идентификации небольших количеств спирта или же кислоты ( см. стр. [9]
Фенолыше гидроксилыше группы: реагируют с окисью этилена так же гладко, как и спиртовые, причем образуются арильные эфиры этиленгликоля. Преимущественный выход моноэфира объясняется в данном случае тем, что фенольная гидроксильная группа вследствие своей значительно большей кислотности реагирует гораздо легче, чем спиртовая гидро-ксильиая группа образовавшегося монофенилового эфира этиленгликоля. Поэтому ожидаемые побочные реакции, приводящие к получению фениловых эфиров ди - и трнэтиленгликолей, совершенно отступают на задний план. [10]
Фенольные гидроксильные группы реагируют с окисью этилена так же гладко, как и спиртовые, пррхчем образуются арильные эфиры этиленгликоля. Преимущественный выход моноэфира объясняется в данном случае тем, что фенольная гидроксильная группа вследствие своей значительно большей кислотности реагирует гораздо легче, чем спиртовая гидроксильная группа образовавшегося монофенилового эфира этиленгликоля. Поэтому ожидаемые побочные реакции, приводящие к получению фениловых эфиров ди - и триэтиленгликолей, совершенно отступают на задний план. [11]
Хлорангидриды кислот также широко применяются для получения сложных эфиров. Спирты, обычно, легко реагируют с хлор-ангидридами кислот с выделением хлористого водорода. При применении хлористого ацетила рекомендуется охлаждать реакционную смесь во избежание слишком бурной реакции, особенно, при ацетилировании легколетучих спиртов. В случае хлористого бензоила или других хлорангидридов, сравнительно стойких по отношению к воде и к холодной водной щелочи, хлорангидрид кислоты нагревают с избытком спирта и по окончании реакции спирт отгоняют; еще удобнее, в случае если спирт, подвергаемый ацилированию, не очень летуч, применять небольшой избыток хлорангидрида кислоты в присутствии разбавленного раствора едкого натра. Последний способ прилуняется для получения фениловых эфиров ароматических кислот. [12]
Хлорангидриды кислот также широко применяются для получения сложных эфиров. Спирты, обычно, легко реагируют с хлор-ангидридами кислот с выделением хлористого водорода. При применении хлористого ацетила рекомендуется охлаждать реакционную смесь во избежание слишком бурной реакции, особенно, при ацетилировании легколетучих спиртов. В случае хлористого бензоила или других хлорангидридов, сравнительно стойких по отношению к воде и к холодной водной щелочи, хлорангидрид кислоты нагревают с избытком спирта и по окончании реакции спирт отгоняют; еще удобнее, в случае если спирт, подвергаемый ацилированию, не очень летуч, применять небольшой избыток хлорангидрида кислоты в присутствии разбавленного раствора едкого натра. Последний способ приме / - няется для получения фениловых эфиров ароматических кислот. [13]
Страницы: 1
www.ngpedia.ru