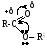Справочник химика 21. Краун эфир
Свойства краун-эфиров и фуллеренов
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
Высшего профессионального образования
ИВАНОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Физический факультет
КАФЕДРА ЭКСПЕРИМЕНТАЛЬНОЙ И ТЕХНИЧЕСКОЙ ФИЗИКИ
Специальность: 010701 – Физика
Специализация: Физическое материаловедение
Дипломная работа
на тему: Свойства краун-эфиров и фуллеренов
Выполнила: студентка 5 курса
Физического факультета
Шмыглева Л.В.
Научный руководитель: проф. к.ф.-м.н.
Александров А.И.
Иваново 2010
Содержание
Введение
1. Структура и свойства краун-эфиров и фуллеренов
1.1 Краун-эфиры
1.1.1 Историческая справка
1.1.2 Номенклатура краун-эфиров
1.1.3 Получение краун-эфиров
1.1.4 Применение краун-эфиров
1.2 Фуллерены
1.2.1 Фуллерены - новые элементарные формы углерода
1.2.2 Строение фуллеренов
1.2.3 Свойства фуллеренов
1.2.4 Получение фуллеренов
1.2.5 Применения фуллеренов
1.3 Монослой на поверхности воды
1.4 Монослои на основе фуллеренов и краун-эфиров
2. Постановка задачи
3. Аппаратура и методика эксперимента
3.1 Исследуемые соединения
3.2 Получение монослоев
3.2.1 Установка для получения монослоев
3.2.2 Расчет порогового значения поля Фредерикса
3.2.3 Расчет необходимого количества вещества
3.2.4 Приготовление растворов
3.2.5 Построение р-А изотерм
3.2.6 Уравнения Фольмера для анализа р-А изотерм
3.3 Молекулярное моделирование и определение площади, занимаемой молекулой в плавающем слое
4. Экспериментальные результаты и обсуждения
Основные результаты и выводы
Список используемой литературы
Введение
Нанотехнология и наноматериалы наряду с биотехнологией, информационными технологиями являются ключевыми технологиями 21 века. Это подтверждается и резким ростом финансирования данной отрасли в последние годы. Технологию Ленгмюра – Блоджетт (ЛБ) так же можно отнести к нанотехнологиям, так как она позволяет производить операции на уровне отдельных монослоев.
Мультислой, сформированный по ЛБ технологии, – принципиально новый объект современной физики, и потому любые их свойства (оптические, электрические, акустические и т.д.) совершенно необычны. Даже простейшие структуры, составленные из одинаковых монослоев, имеют ряд уникальных особенностей, не говоря уже о специально построенных молекулярных ансамблях.
Достаточно сравнить, например, двойные ленгмюровские слои (биослои) с биологическими мембранами. Благодаря этим обстоятельствам сегодня мы уже говорим о перспективах развития новой науки – молекулярной электроники. Эта наука своими первыми успехами обязана ленгмюровским пленкам, и прежде всего в том, что касается новых материалов. Уже созданы первые образцы высокопроводящих сверхтонких пленок на основе органических амфифильных молекул. Такие молекулы, как выяснилось [6], обладают донорными и акцепторными свойствами, то есть ведут себя фактически как миниатюрные полупроводники. Далее, полимеризация пленок Ленгмюра – Блоджетт, имеющих исключительно малую и к тому же калиброванную толщину (несколько монослоев), дает возможность вести филигранный литографический процесс с помощью электронного луча. Пространственное разрешение, которое ограничивает в электронной технологии минимальную толщину линий схемы, достигает в этом случае нескольких нанометров. Кроме того, ленгмюровские пленки предлагается использовать в качестве оптических волноводов со специально заданным по толщине профилем показателя преломления.
Еще один пример, демонстрирующий необычные физические свойства ленгмюровских пленок. Оказывается, на молекулярном уровне можно осуществить перенос информации от одного монослоя к другому, соседнему[7]. После этого соседний монослой можно отделить и, таким образом, получить копию того, что было «записано» в первом монослое. Такой копировальный процесс вполне аналогичен процессу репликации информации с молекул ДНК – хранителей генетического кода – на молекулы РНК, переносящие информацию к месту синтеза белков в клетках живых организмов.
Широкое развитие получают сейчас гибридные системы, где ленгмюровские пленки скомбинированы с традиционными транзисторными элементами. Высокая диэлектрическая прочность позволяет использовать такие пленки в полевых транзисторах[7]. Все это расширяет диапазон используемых полупроводниковых кристаллов. Диэлектрические монослои улучшают характеристики солнечных батарей и светоизлучающих (люминесцентных) диодов. Можно создать набор химических сенсоров – чувствительных датчиков.
Ну и, наконец, использование ориентированных молекулярных ансамблей позволяет на совершенно новой основе поставить вопрос о направленных электро- и фотохимических реакциях, таких, как фотосинтез, преобразование солнечной энергии или, скажем, фоторазложение воды[6]. Технология ленгмюровских пленок вскоре окажется замечательной основой для самой передовой области – молекулярной электроники.
Итак, мультислой обладает следующими полезными качествами: молекулярная ориентация в нем строго фиксирована; имеется резко выраженная зависимость от направления – структурная анизотропия – вдоль и поперек плоскостей монослоев, и, наконец, самое главное, – мультислой можно собрать из монослоев различных специально подобранных веществ. Каждому веществу (молекуле) можно поручить выполнение какой-то операции, и тогда можно получить многофункциональный мультислой.
Весьма перспективными материалами для технологии Ленгмюра-Блоджетт являются фуллерены и краун-эфиры. Фуллерены обладают интересными физическими свойствами, в частности полупроводниковыми и проводниковыми, а краун-эфиры могут использоваться не только для захвата ионов металлов, но и нейтральных молекул.
1. Структура и свойства краун-эфиров и фуллеренов
1.1 Краун-эфиры
1.1.1 Историческая справка
Краун-эфиры – макроциклы, содержащие в своем составе наряду с метиловыми звеньями (–СН2–СН2–) кислородные атомы, в некоторых случаях часть атомов О заменена атомами N или S. Открытие и синтез краун-эфиров – одна из наиболее ярких страниц в развитии органической химии последних десятилетий. Первый из этого класса макроциклических соединений – дибензо-18-краун-6 – был получен Ч. Педерсеном (США) в 1967 г. (За открытие нового класса соединений он был удостоен Нобелевской премии по химии в 1987г.) Педерсен изучал свойства различных стабилизаторов каучуков, нефтяных масел, резиновых материалов. Основное назначение этих стабилизаторов заключалось в предотвращении разрушения антиоксидантов, которое инициировалось присутствием следовых количеств металлов. Синтезируя дезактиватор катиона ванадия VO2+, Педерсен в качестве побочного продукта выделил макроцикл, содержащий в цикле 12 углеродных и 6 кислородных атомов. Впоследствии Педерсен получил в общей сложности 60 полиэфиров с числом кислородных атомов от 4 до 20 и размером цикла от 12 до 60-членного[13]. Все атомы кислорода как бы выведены из плоскости цикла и ориентированы в одну сторону, что очень облегчает их последующее полярное взаимодействие с катионом металла[24].
Обратив внимание на удивительную способность этих макроциклов заключать в свою полость катионы металлов – "короновать" их, Педерсен и предложил соответствующее название этому новому классу веществ – краун - соединения (от англ. crown – корона) [13].
Появление краун-эфиров заметно расширило возможности экспериментальной химии. Стало возможным переводить в органическую среду типичные неорганические соединения и проводить с ними различные реакции[24].
1.1.2 Номенклатура краун-эфиров
Формально все краун-эфиры можно отнести к классу гетероциклических соединений, однако необычные свойства таких соединений позволили выделить их в самостоятельный класс, в связи с чем для составления названий были предложены специальные правила. Название содержит слово «краун», цифра перед этим словом обозначает общее число атомов в цикле, а цифра в конце названия указывает на количество гетероатомов O, N и S (рис.1) [27].

Рис. 1. Структурные формулы и номенклатура типичных краун-эфиров.
В названии не указывают наличие в цикле атомов О (это подразумевается), но если в цикле есть иные гетероатомы (кроме кислорода), например, азот или сера, то их количество указывают, добавляя к названию приставки ди- или три - (азакраун - или тиакраун-эфирами [13]), а положение в цикле – с помощью числовых индексов, предварительно нумеруются все атомы в цикле[24].
Краун-эфиры содержат фрагмент С–О–С, характерный для простых эфиров, а также могут включать фрагменты амина C–NH–C, или тиоэфира C–S–C. Характерное свойство этих классов соединений – образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла. В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы.
Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 (рис. 2) наиболее прочно захватывает катион лития, 15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия (рис. 2) [24].

mirznanii.com
КРАУН-ЭФИРЫ | Энциклопедия Кругосвет
Содержание статьиКРАУН-ЭФИРЫ (от англ. crown корона) крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков СН2СН2 и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название (англ. crown корона).
Номенклатура краун-эфиров.

Рис. 1. СОСТАВЛЕНИЕ НАЗВАНИЙ ДЛЯ КРАУН-ЭФИРОВ
Свойства краун-эфиров.
Формально все краун-эфиры можно отнести к классу гетероциклических соединений, однако необычные свойства таких соединений позволили выделить их в самостоятельный класс, в связи с чем для составления названий были предложены специальные правила. Название содержит слово «краун», цифра перед этим словом обозначает общее число атомов в цикле, а цифра в конце названия указывает на количество гетероатомов O, N и S (рис.1). В названии не указывают наличие в цикле атомов О (это подразумевается), но если в цикле есть иные гетероатомы (кроме кислорода), например, азот или сера, то их количество указывают, добавляя к названию приставки ди- или три-, а положение в цикле с помощью числовых индексов, предварительно нумеруются все атомы в цикле.
Краун-эфиры содержат фрагмент СОС, характерный для простых эфиров, а также могут включать фрагменты амина CNHC, или тиоэфира CSC (см. СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ). Характерное свойство этих классов соединений образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла. В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы. Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 (рис. 1) наиболее прочно захватывает катион лития, 15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия (рис. 2).

Рис. 2. КОМПЛЕКСЫ КРАУН-ЭФИРОВ с катионами щелочных металлов (пунктирными линиями показаны координационные связи)
Более наглядно взаимосоответствие внутренней полости цикла и размера катиона можно показать с помощью объемных моделей (рис. 3).

У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживаеся. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда (рис. 4А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. 4Б).

Подобные комплексы менее устойчивы, чем те, у которых размер катиона точно соответствует величине внутренней полости.
Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т.е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMnO4 практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Получение краун-эфиров.
При конденсации дихлоралкилов, содержащих в цепи простые эфирны группировки СОС, с полиэтиленгликолями протекает циклизация, приводящая к образованию краун-эфира (рис. 5А). В зависимости от длины цепочки исходных соединений получают краун-эфиры с различной величиной цикла. Азотсодержащие краун-эфиры получают конденсацией диаминов, содержащих эфирные группировки, с хлорангидридами дикарбоновых кислот. В результате получаются циклические амиды, которые затем восстанавливают, при этом карбонильные группы С=О превращаются в метиленовые СН2 (рис. 5Б). Серосодержащие краун-эфиры получают по схеме А (рис. 5), при этом исходные соединения содержат тиоэфирные группировки СSС.
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Наибольшее распространение получили краун-эфиры, содержащие только гетероатомы О. Их применяют в технологических процессах, связанных с выделением и очисткой солей щелочных и щелочноземельных металлов, в аналитических исследованиях и работах, связанных с синтезом, когда нужно перевести неорганические соединения из водной фазы в органическую среду.
Краун-эфиры обладают противомикробной и противопаразитарной активностью, кроме того, из организма с их помощью выводятся ионы токсичных тяжелых металлов, а также радиоактивных изотопов цезия и стронция.
В радиохимии краун-эфиры помогают решать проблему переработки отходов ядерных производств. Первый этап удаление с помощью краун-эфиров из переработанного ядерного горючего наиболее активных изотопов (стронций-90, цезий-137, технеций-99), на этой стадии предпочтительны S-содержащие краун-эфиры, поскольку они обладают повышенной радиационной стойкостью. Извлеченные изотопы используются затем в установках радиодиагностики, заменяющих рентгеновские аппараты, а также при создании долговременных источников тока для метеостанций, метеозондов и космических аппаратов. Следующий этап переработки ядерного топлива извлечение с помощью краун-эфиров (специально подобранного состава) неизрасходованных урана и плутония, после чего объем подлежащих утилизации отходов становятся заметно меньше и к тому же отходы обладают слабой радиоактивностью.
На основе краун-эфиров созданы электропроводящие материалы нового типа (см. ЭЛЕКТРИДЫ).
За развитие химии макрогетероциклических соединений американский химик Ч.Педерсен, фактически создавший новый класс соединений краун-эфиры, в 1987 (совместно Д.Крамом и Ж.Леном) был удостоен Нобелевской премии.
Михаил Левицкий
www.www.krugosvet.ru
эфиры - Справочник химика 21
Образование сложных эфиров при реакции бензилхлорида с твердыми солями в толуоле, катализируемой третичными аминами или четвертичными аммониевыми солями, также проходит в органической фазе и имеет первый порядок по субстрату и катализатору [94]. Кинетика замещения 81—83] и этери-фикации с использованием краун-эфиров в качестве МФК в системах жидкость/жидкость [55, 81—83] и твердая фаза/жидкость [73] также подтверждает общую схему механизма МФК. Реакцию между твердым фенолятом калия и алкилгалогенида-ми в толуоле могут катализировать даже линейные полиэфиры, связанные с полимерным носителем, и кинетика реакции оказывается точно такой же, как и с растворенным катализатором. Эти наблюдения указывают на возможность тесного контакта между смолой-носителем катализатора и твердой солью [74]. [c.54] Краун-эфиры, криптанды и другие соединения [c.37]Даже простые краун-эфиры весьма дороги, хотя их получение в лабораторных условиях не так уж и трудно. 1,4,7,10,13,16-Гек-саоксациклооктадекан (18-краун-6) (1) может быть получен из триэтиленгликоля и его дитозилата несколькими способами с трег-бутоксидом калия в бензоле (выход 33%) [13], в ТГФ (выход 60%) [14] или же из того же самого гликоля и продажного дихлорида (1,8-дихлор-3,6-диоксаоктана) с гидрожидом калия в водном ТГФ (выход 40%) [15]. Наконец, обработка (2-хлорэтилового) эфира и тетраэтиленгликоля гидроксидом калия в ТГФ дает 18-краун-6 с выходом 30% [20]. Полученный сырой продукт очищается через комплекс с ацетонитрилом. (Методы синтеза см. в [1006], другие способы очистки — в [1881], методы получения гидроксиметил-18-крауна-6 — в [1380, 1745], а 2,6-диметил-18-крауна-6 — в [1707] недавние синтезы различных оптически активных краун-эфиров описаны в [1618, 1741, 1773, 1882], обзор дан в [1891].) [c.85]
Особенно большой интерес к краун-эфирам возник в последнее десятилетие. Были опубликованы работы, посвященные различным аспектам их получения и исследованию химических свойств [77—82]. Так как систематическая номенклатура этих соединений очень неудобна, обычно используются тривиальные названия. Примером служит 18-краун-6 (1), в котором 18 означает число атомов в кольце, краун — класс (в данном слу- [c.37]
Кроме краун-эфиров, криптатов и ониевых солей для катализа реакций между твердыми солями щелочных металлов и алкилирующими агентами могут быть использованы полиэфиры с открытой цепью, диамины и полиамины i[93, 94]. [c.43]
Краун-эфиры, криптанды и другие соединения, образующие хелаты, как экстрагенты [c.37]
СИЛЬНО зависит от стерических эффектов, связанных с катионом. Для контактных ионных пар стереоспецифичность более вероятна это проявляется, например, в реакциях Н/О-обмена [28]. Известно, что краун-эфиры превращают многие (но не все см., например, [17]) контактные ионные пары катионов щелочных металлов в разделенные растворителем ионные пары. Последние реагируют менее специфично [28]. Влияние различных эфирных растворителей (например, эфиров поли-этиленгликоля или добавленных краун-эфиров) на структуру ионных пар рассмотрено в обзоре [32]. [c.20]
Имеются сообщения о новых краун-эфирах, их азо-аналогах, полиокса-полиаза-микроциклах, аналогах, содержащих аннели-рованные гетероциклы, и о би- и полициклических аналогах. Один из них привлек особое внимание. Соединение 5, названное Леном и сотр. [83] криптат [2.2.2] , продается под названием криптофикс [222] . Общей чертой всех краунов и родственных веществ является наличие центральной дыры или полости. В результате хелатирования внутри этой дыры могут образовываться комплексы с другими частицами, различные по стабильности в зависимости от их радиуса и электронной конфигурации. Это могут быть катионы, анионы, нейтральные (нульвалентные) металлы и нейтральные молекулы, такие, как нитрилы [108]. [c.38]
Когда такие факторы, как природа субстрата, нуклеофила и уходящей группы, постоянны, активация аниона зависит от растворителя, а также от природы и концентрации лиганда. Бициклические криптанды, такие, как 5, оказывают более сильное влияние, так как они в большей степени охватывают катион, образуя тем самым более стабильные комплексы. В полярных апротонных растворителях крауны обусловливают усиление диссоциации. В других системах (например, грег-бутоксид натрия в ДМСО) ионные агрегаты разрушаются в результате комплексообразования с краунами, что приводит к увеличению основности алкоксида, измеряемой скоростью отщепления протона [101]. В менее полярной среде, такой, как ТГФ или диоксан, доминирующими частицами являются ионные пары. В этом случае краун-эфиры могут благоприятствовать образованию разделенных растворителем более свободных (рыхлых) ионных пар [38, 81] с более высокой реакционной способностью [102]. Даже в гидроксилсодержащих растворителях при добавлении краунов наблюдаются удивительные эффекты, так как изменяются структура и состав сольватной оболочки вокруг ионной пары и ионные агрегаты частично разрушаются. Например, сильно изменяется соотношение син1 анти-изомеров при элиминировании, катализируемом основаниями [103]. [c.40]
В разд. 1.1 межфазный катализ был определен как двухфазная реакция между солями (в твердой форме или в виде водных растворов), кислотами или основаниями и субстратами, находящимися в органических растворителях, протекающая в присутствии так называемых межфазных катализаторов. Типичными представителями таких катализаторов являются ониевые соли или вещества, образующие комплексы с катионами щелочных металлов, такие, как краун-эфиры, криптанды или их аналоги с открытой цепью. Как уже указывалось в разд. 1.1, определение МФК основано скорее на наблюдаемых эффектах, а не на каком-либо едином механизме. Впрочем, широкие исследования этих эффектов привели к выяснению механизма многих реакций МФК. [c.44]
В этом разделе будет сделан обзор имеющихся в литературе сравнительных данных об эффективности катализаторов. Вначале охарактеризуем различные классы ониевых солей и краун-эфиров — катализаторов, дающих комплекс с катионом. Затем обсудим селективность реакций, которая наблюдается при использовании некоторых типов катализаторов. [c.67]
При сравнении влияния даже очень широкой серии различных катионов катализаторов и краун-эфиров в той же самой реакции никаких ясных выводов сделать не удалось [45]. [c.73]
Многообещающими являются, по-видимому, такие комбинации, как твердый грег-бутоксид калия/краун-эфир/подходящий растворитель. Рассмотрим вначале некоторые лучше изученные гомогенные системы. Известно, что скорость депротонирования грег-бутоксидом калия зависит как от его концентрации, так и от типа растворителя. Сложность этой системы объясняется [c.95]
Наряду с четвертичными ониевыми солями в качестве катализаторов используются и краун-эфиры [43—45, 48]. В табл. 3.4 представлены данные об эффективности различных катализаторов при реакции 5-молярного избытка водного насыщенного раствора иодида щелочного металла с н-октилбромидом в присутствии 0,05 мол. экв. соответствующего катализатора. [c.110]
Для МФК представляют интерес катионные комплексы, образованные с катионами натрия и калия. Наиболее стабильные калиевые комплексы образуются с 18-членными кольцами (соединения 1, 2, 3 или 5), тогда как натрий образует комплексы преимущественно с соединением 4 и другими 15-членными крау-нами. Среди других катионов, образующих комплексы, имеются ион гидроксония Н3О+ [106], ионы аммония [84] и ионы ди-азония [91, 111]. Крам и сотр. [84] показали, что, когда такое комплексообразование типа хозяин — гость проводят с хи-ральными краун-эфирами и замещенными рацемическими первичными аммониевыми солями, такие комплексы можно использовать для разделения оптических изомеров. Они использовали оптически активные бинафтильные единицы, однако известны многие другие диастереомерные крауны, потенциально или в действительности оптически активные [85]. Во многих случаях физическими методами, включая рентгеновский анализ, были точно установлены структуры комплексов. [c.38]
В работе [65] было проведено сравнение каталитических характеристик типичной для МФК четвертичной аммониевой соли, аликвата 336, 18-крауна-6 и тетраметилэтилендиаминов в системе твердая фаза/жидкая фаза. Аммониевый катализатор показал одинаковые результаты или даже превосходил другие в реакциях замещения ацетатных, фторидных и аденильных анионов, однако в случае цианидного аниона реакция с краун-эфиром протекала по крайней мере в 100 раз быстрее, чем с аликватом 336 (разд. 1.5). [c.71]
Наряду с гидроксидами щелочных металлов в МФК используют также и другие основания твердые фториды щелочных металлов, бикарбонаты и карбонаты, гидриды и амиды. Вопросы о механизме участия в МФК первых двух анионов не представляют особого труда, так как эти анионы могут экстрагироваться в органические растворители при обычном проведении МФК в системе жидкая фаза/твердая фаза (о солюбилизации НСОз см. в [75]). Однако что касается остальных анионов, то в противоречии с предположениями, высказанными во многих статьях, оказалось, что они экстрагируются в неполярные среды достаточно трудно как с помощью ониевых солей, так и с помощью краун-эфиров. [c.66]
В работе [79] утверждается, что в присутствии чрезвычайно большого избытка 18-краун-6 происходит частичное растворение КН в ТГФ. Полученный при фильтровании в инертной атмосфере раствор был способен депротонировать углеводороды с рКа ниже 36,3. До этого было уже известно, что депротонирование такого типа проходит даже в толуоле под действием трет-аии-лата натрия в присутствии криптанда [2.2.2] [80]. Очень похоже, что гидроксилсодержащие примеси (например, открытый аналог краун-эфира — гексаэтиленгликоль), которые могут быть в использованном для реакции большом количестве 18-краун-6, привели к появлению растворимых алкоксидов, которые в свою очередь и депротонировали углеводороды. Следует отметить, что в системе КН/НСРНз может образовываться ионная пара [(К---18-краун-6)+СРЬз ], которая затем в зависимости от растворителя и примененного комплексанта может либо раствориться, либо дать тонкую суспензию [59]. [c.67]
Были определгчы выходы и время реакции замещения брома на иод в н-октилбромиде при использовании в качестве катализаторов различных краун-эфиров и трибутил-н-гексадециламмо-нийбромида (см. табл. 3.4). Лучше ониевой соли оказались только некоторые криптанды, имеющие боковую цепь. [c.70]
Недавпо были определены кинетические параметры для ряда реакций замещения, в которых использовали следующие катализаторы 2-тетрадецил[2.2.2] [82], пергидротрибензо[2.2.2] [93], дициклогексано-18-краун-6 [81], 2-децил[2.2.2], 18-краун-6, различные алкилзамещенные дибензо-18-крауны-6 (83] и гексаде-цилтрибутилфосфониевые соли [81]. Основной вывод из этих работ следующий обычные краун-эфиры достаточно липофильны сами по себе и добавочные боковые цепи не вносят существенного вклада в их свойства. Действительно, активность МФК снижается по мере удлинения боковой цепи [83]. В общем в реакциях МФК-замещения использование краун-эфиров не имеет преимуществ [81, 83]. Они работают особенно плохо в тех случаях, когда в качестве нуклеофилов используют С1 и СЫ [81]. Липофильные криптанды ведут реакцию в 2—5 раз быстрее, чем ониевые соли. В системе НгО/хлорбензол анионы по своей активности располагаются в следующий ряд [82] Ыз > > N >Br >I > l >S N . Сравнение изменений в гидро-фильности, влияющей на экстракцию и каталитическую активность в зависимости от липофильных факторов в молекуле катализатора, было исследовано только в японской работе [84]. [c.70]
В качестве катализаторов кроме ониевых солей и краун-эфиров можно использовать и другие соединения. Это и эфиры по-лиэтиленгликоля с открытой цепью, и такие молекулы, которые имеют несколько цепей такого же типа, прикрепленных к центральному ароматическому ядру (так называемые полиподы — многоножки). Их каталитические свойства и механизм действия аналогичны действию краун-эфиров. Хотя они иногда являются менее эффективными экстрагентами, этот недостаток часто можно устранить, используя их в более высоких концентрациях (гл. 3). [c.77]
Ряд авторов описали МФ-катализаторы, фиксированные на полимерных подложках. Такие катализаторы представляют большой интерес для промышленного применения, поскольку их легко отделять после окончания реакции и,. кроме того, можно использовать в непрерывных процессах. Этот метод МФК получил название трехфазный катализ [19, 21, 22]. Реакция замещения с 1-бромоктаном при использовании закрепленной аммониевой соли имеет первый порядок ло субстрату. Если полистирол содержит 1—21% групп — h3NRз+ у фенильных колец, то активность таких смол прямо пропорциональна числу этих групп. Увеличение количества фенильных колец, имеющих группы —СНг—NMeз+, в микропорах полистирола до 46—76% приводит к резкому снижению каталитической активности. Продажные анионообменные смолы обычно мало подходят в качестве МФ-катализаторов [19]. Результаты изучения действия иммобилизованных ониевых солей, краун-эфиров и криптандов [20] показали, что в основном механизм реакций с этими катализаторами сходен с нормальным механизмом МФК-реакций. [c.79]
В результате превращения цри действии краун-эфира агрегатов ионных пар или контактных ионных пар в сольватнораз-деленные ионные пары всегда образуется более реакционноспособный анион. Этот эффект был использован во многих случаях. Некоторые из них, относящиеся к МФК, будут рассмотрены в других разделах этой книги. Что же касается реакций, катализируемых основаниями, то следует помнить, что по сравнению с гомогенными реакциями применение краун-эфиров в МФК изменяет не только скорость реакции [434, 918, 1284], но даже отношение син-изомер/анги-изомер и региоселективность элиминирования НХ [220—222]. [c.96]
Активные группы А —КзЫ+ В —КзР+ С — краун-эфир О —криптанд Е — полиэтиленгликоль (эфир) Р — амид фосфорной кислоты О —эфир фосфо-ниевой кислоты Н — аминоксид I — азакраун-эфир К — АзОзНа Ь — Н(0)Кг [c.99]
Как видно из этих результатов, ониевые соли являются лучшими катализаторами, чем большая часть краун-эфиров, за исключением только модифицированных аза-макробицикли-ческих полиэфиров 6а и 6Ь, которые, однако, не являются доступными продажными препаратами. Скорости, полученные [c.110]
При применении аммониевых, фосфониевых, краун-эфирных и криптатных катализаторов, привитых к нерастворимым полимерам [775, 1023, 1026], а также краун-эфиров с липофильными боковыми цепями [776], не выходили из обычных границ. Эти трехфазные катализаторы легко отделяются от реакционной смеги, но их необходимо готовить специально (см. также разд. 3.1.4). [c.111]
Вместо дорогих краун-эфиров предлагают использовать в качестве катализаторов так называемые полиподные молекулы и технические смеси полиэфиров с открытыми цепями [46, 47]. [c.111]
Трифторметильные гетероароматические соединения медленно обменивают изотопы l F/I F при 100 С в присутствии краун-эфира [1424]. Известны также и другие примеры замещения Х/Р в бензильном положении в ароматических и гетероциклических соединениях [1436, 1446]. При нагревании хлортриметил-силана с системой КР/18-краун-6 в ацетонитриле образуется фтортриметилсилан, который конденсируется в охлаждаемой [c.115]
Использование обычных, четвертичных аммониевых или фосфониевых солей [4, 38, 39], краун-эфиров [44, 77] или полиподных молекул типа 7 [46] не привело к существенному улучшению процесса, за исключением тех случаев, когда вследствие чувствительности субстрата к воде в реакцию вводился твердый K N [1035]. Например, в случае аллильных и бензильных галогенидов при применении водных растворов цианидов гидролиз может подавлять реакцию замещения. Тем не менее в литературе можно найти методики проведения таких реакций с использованием водного K N [70, 71, 82, 897]. Если желательно избежать присутствия воды, то для получения замещенных бен-зилцианидов можно с успехом применять твердофазную МФК-систему с 18-краун-6 в качестве катализатора. Аналогично получаются триметилсилилцианид [65] и цианформиат (R = фенил. [c.119]
В другом синтезе триметилсилилцианида в твердофазной МФК-системе вместо краун-эфира в качестве катализатора с успехом были использованы ониевые соли (растворитель N-ме-тилпирролидон, Na N 36 ч, 100 X выход 60—70%) [1277]. [c.120]
Однако Симхен и Коблер [67] считают, что при синтезе чувствительных к гидролизу соединений лучше использовать предварительно полученный и выделенный цианид четвертичного аммония в апротонных растворителях, таких, как ДМСО, ацетонитрил или метиленхлорид [67]. Описано также применение анионообменных смол в N-форме [1507]. В обычном МФК-процессе вместо краун-эфира можно использовать более дешевый катализатор — эфир полиэтиленгликоля 8, хотя он и несколько менее активен [47, 61]. В более поздних работах рекомендуют применять трехфазный катализ [62, 64, 68, 775, 860]. Как уже указывалось в разд. 3.1.4, эта техника в принципе очень привлекательна. Так, выдан патент на получение адипопитрила из 1,4-дихлорбутана с использованием в качестве катализатора ионообменной смолы амберлит IRA-400 [69]. Однако недавно было показано, что каталитическая активность трехфазного катализатора на основе полистирола с поперечными связями зависит от числа имеющихся групп R4N+. Высокая степень замещения в кольцах, как это характерно для продажных ионообменных смол, снижает возможность их использования в МФК-реакциях [64]. [c.120]
Химические приложения топологии и теории графов (1987) -- [ c.42 ]Органический синтез. Наука и искусство (2001) -- [ c.5 , c.9 , c.82 , c.223 , c.225 , c.424 , c.456 , c.468 , c.469 , c.474 , c.475 , c.478 , c.498 ]
Натрий (1986) -- [ c.26 ]
Высокоэффективная жидкостная хроматография (1988) -- [ c.179 ]
Хроматографическое разделение энантиомеров (1991) -- [ c.74 , c.78 , c.140 , c.142 ]
Органическая химия (1979) -- [ c.615 ]
Органический синтез (2001) -- [ c.82 , c.223 , c.225 , c.424 , c.456 , c.468 , c.469 , c.474 , c.475 , c.478 , c.498 , c.509 ]
Краун-соединения Свойства и применения (1986) -- [ c.12 , c.14 , c.16 , c.120 ]
Биоорганическая химия (1991) -- [ c.244 , c.354 ]
Высокоэффективная жидкостная хроматография (1988) -- [ c.179 ]
Органическая химия (1990) -- [ c.74 , c.333 , c.340 ]
Биоорганическая химия (1987) -- [ c.597 ]
Химия Краткий словарь (2002) -- [ c.172 ]
Органическая химия Том2 (2004) -- [ c.99 , c.544 ]
Большой энциклопедический словарь Химия изд.2 (1998) -- [ c.34 , c.281 , c.285 ]
Равновесия в растворах (1983) -- [ c.169 , c.172 , c.280 , c.281 ]
Общая органическая химия Том 2 (1982) -- [ c.122 , c.134 , c.412 , c.813 ]
Возможности химии сегодня и завтра (1992) -- [ c.56 ]
Межфазный катализ в органическом синтезе (1980) -- [ c.24 , c.25 ]
общая органическая химия Том 2 (1982) -- [ c.122 , c.134 , c.412 , c.813 ]
Неорганическая химия (1987) -- [ c.360 , c.362 ]
Теоретические основы органической химии (1979) -- [ c.323 , c.358 ]
Стереохимия Издание 2 (1988) -- [ c.385 ]
Неорганическая химия Изд2 (2004) -- [ c.220 ]
Общая химия Изд2 (2000) -- [ c.434 ]
Ионы и ионные пары в органических реакциях (1975) -- [ c.0 , c.143 , c.154 ]
Жидкокристаллические полимеры с боковыми мезогенными группами (1992) -- [ c.98 , c.111 ]
Химия протеолиза Изд.2 (1991) -- [ c.39 ]
Введение в мембранную технологию (1999) -- [ c.340 ]
Искусственные генетические системы Т.1 (2004) -- [ c.370 ]
chem21.info