Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация. Гидролиз эфиров
Сложные эфиры
Сложные эфиры вступают в реакции нуклеофильного замещения алкокси-группы в условиях кислого или щелочного катализа. Ниже изображено распределение электронной плотности в молекулах сложных эфиров.
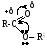
1. Реакции нуклеофильного замещения алкоксигруппы
а) Гидролиз
Для гидролиза сложных эфиров и всех остальных производных кислот необходим кислый или щелочной катализ. При кислом гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации), при щелочном гидролизе образуются соли карбоновых кислот и спирты.
Кислый гидролиз сложных эфиров:
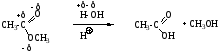
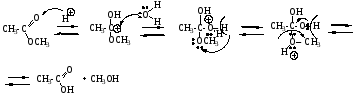
Механизм SN, нуклеофил - h3O, происходит замещение алкоксигруппы на гидроксил.
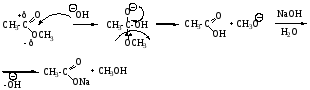
Щелочной гидролиз сложных эфиров: реакция идет в два этапа с 2-мя молями основания, образовавшаяся кислота превращается в соль.
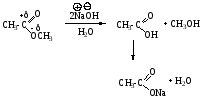
Механизм SN, Nu = OH
б) Переэтерификация - превращение одного сложного эфира в другой сложный эфир (молекулярный вес спирта, который используют в качестве реагента должен быть выше для сдвига равновесия реакции вправо).
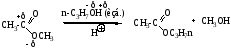
Механизм SN, нуклеофил - н-C3H7OH, аналогичен кислому гидролизу сложных эфиров.
в) Аммонолиз – взаимодействие с Nh3X (X=H, Nh3), синтез амидов и гидразидов кислот.
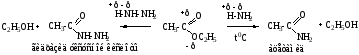
Механизм SN, нуклеофил = Nh3-Nh3 (Nh3-X), идет замещение алкокси-группы на азотсодержащую группу.
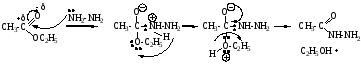
Соли карбоновых кислот
Соли карбоновых кислот применяют в синтезе сложных эфиров, если карбоновые кислоты и спирты мало доступны. Из солей получают алканы (реакция Дюма) и кетоны.
1. Синтез сложных эфиров
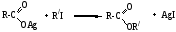
Эта реакция используется, если кислоты и спирты труднодоступны.
2. Реакция Дюма (см. тему “Алканы”, синтез алканов)
3. Синтез кетонов пиролизом солей Ca+2 , Mg+2, Mn+2 карбоновых кислот (см. тему “Альдегиды, кетоны”).
Амиды карбоновых кислот
Амиды менее реакционноспособны в реакциях нуклеофильного замещения, чем сложные эфиры, что является следствием более сильного p, -сопряжения НПЭ атома азота аминогруппы и -связи карбонила. Следствием этого сопряжения является отсутствие основных свойств у амидов и более выраженная NH-кислотность по сравнению с аминами.
Амиды муравьиной кислоты получают из оксида углерода и аммиака (аминов).
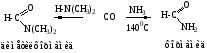
Синтез амидов остальных кислот описан в теме «Карбоновые кислоты».
1. Гидролиз
При кислом гидролизе амидов получают карбоновые кислоты и аммиак или амины в случае N-алкил и N,N-диалкиламидов, при щелочном гидролизе образуются соли карбоновых кислот.
а) кислый гидролиз, SN-замещение амино-группы на гидроксил.
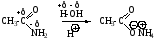
б) щелочной гидролиз
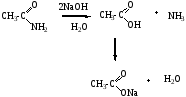
2. Кислотно-основные свойства
а) NH-Кислотность амидов
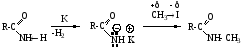
б) Основность амидов
Основные свойства у амидов в отличие от аминов практически отсутствуют, так как НПЭ атома азота находится в сопряжении с -связью карбонила.
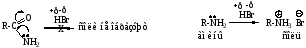
3. Реакция с азотистой кислотой – образование карбоновых кислот, реакция аналогична взаимодействию первичных аминов с азотистой кислотой и является качественной.
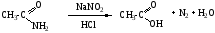
5. Восстановление амидов - синтез аминов
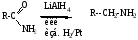
6. Дегидратация амидов – синтез нитрилов карбоновых кислот (см. тему “Карбоновые кислоты”)
studfiles.net
3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
Сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Общая формула сложных эфиров карбоновых кислот:
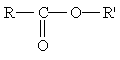
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Общая формула жиров:
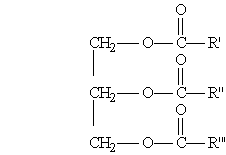
где R', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
1. Масляная кислота СН3 — (Ch3)2 — СООН
2. Капроновая кислота СН3 — (Ch3)4 — СООН
3. Пальмитиновая кислота СН3 — (Ch3)14 — СООН
4. Стеариновая кислота СН3 — (Ch3)16 — СООН
5. Олеиновая кислота С17Н33СООН
СН3—(СН2)7—СН === СН—(СН2)7—СООН
6. Линолевая кислота С17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН
7. Линоленовая кислота С17Н29СООН
СН3СН2СН = CHCh3CH == CHCh3CH = СН(СН2)4СООН
Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи.
По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.
1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
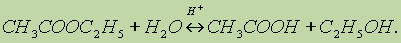
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
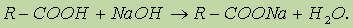
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
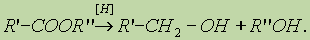
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
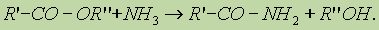
Получение. 1. Реакция этерификации:
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
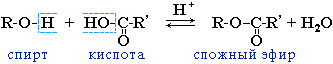
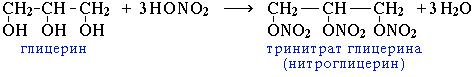
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
2. Взаимодействием ангидридов кислот со спиртами:
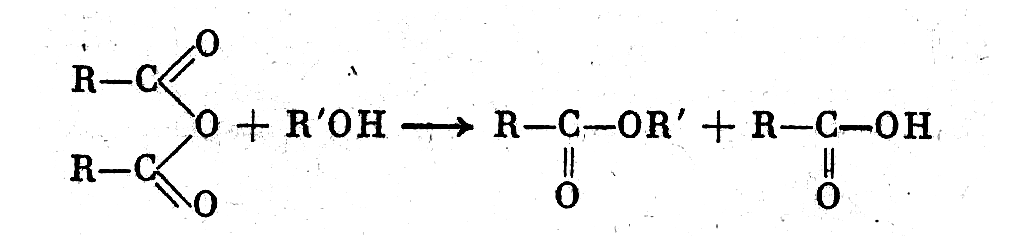
3. Взаимодействием галоидангидридов кислот со спиртами:
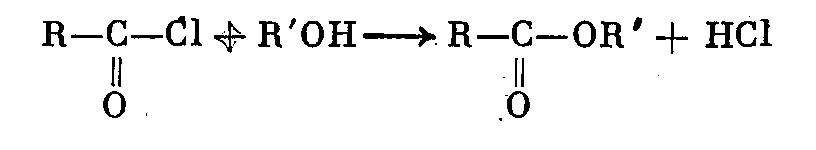
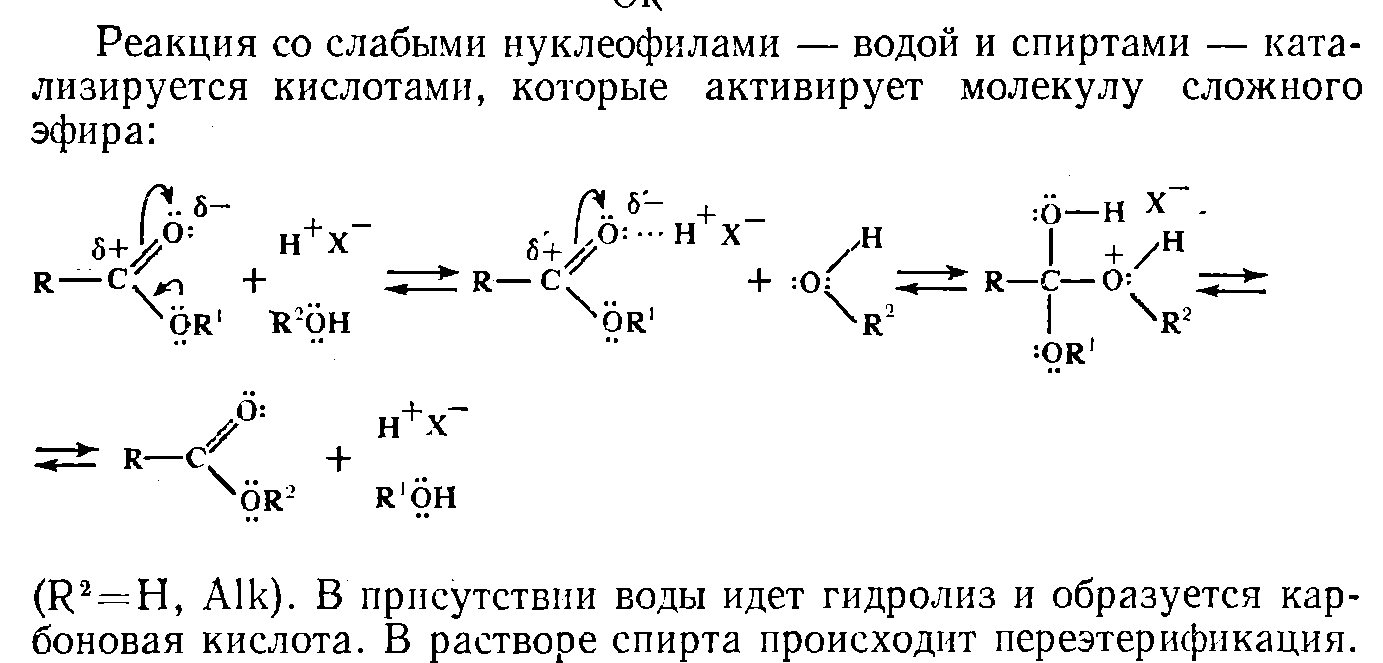
Механизм гидролиза:
Жидкие жиры превращаются в твердые путем реакции гидрогенизации. Водород присоединяется по месту разрыва двойной связи в углеводородных радикалах молекул жиров:
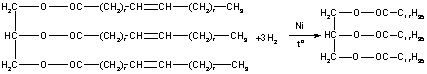
Реакция протекает при нагревании под давлением и в присутствии катализатора - мелко раздробленного никеля. Продукт гидрогенизации - твердый жир (искусственное сало), называется саломасом идет на производство мыла, стеарина и глицерина. Маргарин - пищевой жир, состоит из смеси гидрогенизованных масел (подсолнечного, хлопкового и др.), животных жиров, молока и некоторых других веществ (соли, сахара, витаминов и др.).
Важное химическое свойство жиров, как и всех сложных эфиров, - способность подвергаться гидролизу (омылению). Гидролиз легко протекает при нагревании в присутствии катализаторов - кислот, щелочей, оксидов магния, кальция, цинка:
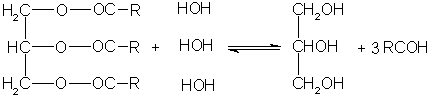
Реакция гидролиза жиров обратима. Однако при участии щелочей она доходит практически до конца - щелочи превращают образующиеся кислоты в соли и тем самым устраняют возможность взаимодействия кислот с глицерином (обратную реакцию).
studfiles.net
номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
Сложными эфирами называются функциональные производные карбоновых кислот обшей формулы RC(О)ОR'.
Сложные эфиры карбоновых кислот (а также сульфоновых кислот) называют аналогично солям, только вместо названия катиона употребляют название соответствующего алкила или арила, которое помещается перед названием аниона и пишется с ним слитно. Наличие сложноэфирной группы —COOR также можно отразить описательным способом, например, «R-овый эфир (такой-то) кислоты» (такой способ менее предпочтителен ввиду его громоздкости):

Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости, с приятным запахом, плохо растворимые в воде и хорошо — в большинстве органических растворителей. Запахи сложных эфиров напоминают запахи разных фруктов, благодаря чему в пищевой промышленности из них готовят эссенции, имитирующие фруктовые запахи. Повышенную летучесть сложных эфиров используют в аналитических целях.
Гидролиз. Важнейшей из реакций ацилирования является гидролиз сложных эфиров с образованием спирта и карбоновой кислоты:

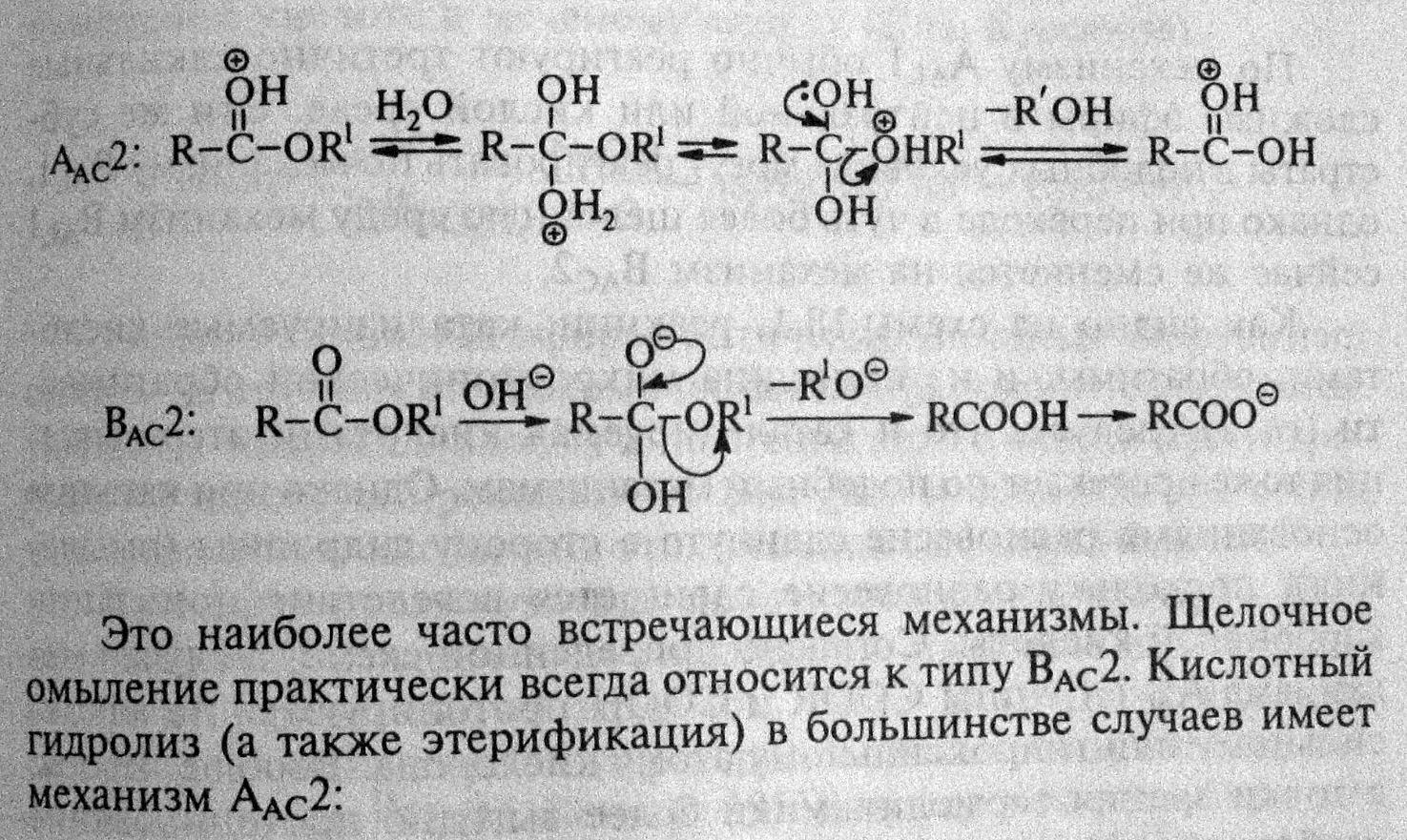
Реакция осуществляется как в кислой, так и в щелочной среде. Кислотно-катализируемый гидролиз сложных эфиров — реакция, обратная этерификации, протекает по тому же самому механизму ААС2:

Нуклеофилом в этой реакции является вода. Смещение равновесия в сторону образования спирта и кислоты обеспечивается добавлением избытка воды.
Щелочной гидролиз необратим, в процессе реакции на моль эфира расходуется моль щелочи, т. е. щелочь в этой реакции выступает в качестве расходуемого реагента, а не катализатора:

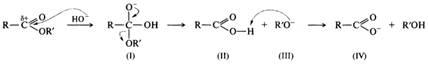
Гидролиз сложных эфиров в щелочной среде протекает по бимолекулярному ацильному механизму ВАС2 через стадию образования тетраэдрического интермедиата (I). Необратимость щелочного гидролиза обеспечивается практически необратимым кислотно-основным взаимодействием карбоновой кислоты (II) и алкоксид-иона (III). Образовавшийся анион карбоновой кислоты (IV) сам является довольно сильным нуклеофилом и потому не подвергается нуклеофильной атаке.
Аммонолиз сложных эфиров. Амиды получают с помощью аммонолиза сложных эфиров. Например, при действии водного аммиака на диэтилфумарат образуется полный амид фумаровой кислоты:
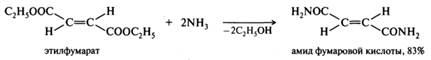
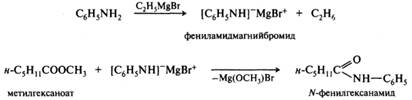
При аммонолизе сложных эфиров аминами с низкой нуклеофильностью последние предварительно превращают в амиды щелочных или щелочно-земельных металлов:
Амиды карбоновых кислот: номенклатура; строение амидной группы; кислотно–основные свойства; кислотный и щелочной гидролиз; расщепление гипобромитами и азотистой кислотой; дегидратация в нитрилы; химическая идентификация.
Амидами называются функциональные производные карбоновых кислот обшей формулы R—С(О)—Nh3-nR'n, где п = 0-2. В незамещенных амидах ацильный остаток соединен с незамещенной аминогруппой, в N-замещенных амидах один из атомов водорода замещен одним алкильным или арильным радикалом, в N,N-замещенных — двумя.
Соединения, содержащие одну, две или три ацильные группы, присоединенные к атому азота, носят родовое название амиды (соответственно первичные, вторичные и третичные). Названия первичных амидов с незамещенной группой — Nh3 производят от названий соответствующих ацильных радикалов заменой суффикса -оил (или -ил) на -амид. Амиды, образованные от кислот с суффиксом -карбоновая кислота, получают суффикс -карбоксамид. Амиды сульфоновых кислот также называют по соответствующим кислотам, используя суффикс -сулъфонамид.
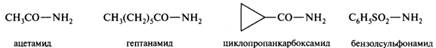
Названия радикалов RCO—NH— (как и RSО2—NH—) образуют от названий амидов, изменяя суффикс -амид на -амидо-. Они применяются в том случае, если в остальной части молекулы имеется более старшая группа или замещение происходит в более сложной структуре, чем радикал R:

В названиях N-замещенных первичных амидов RCO—NHR' и RCO—NR'R" (а также подобных сульфонамидов) названия радикалов R' и R" указывают перед названием амида с символом N-:

Амиды такого типа часто называют вторичными и третичными амидами, что ИЮПАК не рекомендуется.
N-Фенилзамещенные амиды получают в названиях суффикс -анилид. Положение заместителей в остатке анилина указывается цифрами со штрихами:
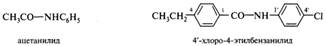
Сохранились, кроме того, полусистематические названия, в которых суффикс -амид соединен с основой латинского названия карбоновой кислоты (формамид, ацетамид), а также некоторые тривиальные названия, такие, как «анилиды» (ацилированные анилины) или «толуидиды» (ацилированные толуидины).
Амиды представляют собой кристаллические вещества с относительно высокими и четкими температурами плавления, что позволяет использовать некоторые из них в качестве производных для идентификации карбоновых кислот. В редких случаях являются жидкостями, например, амиды муравьиной кислоты — формамид и N,N-диметилформамид — известные диполярные апротонные растворители. Низшие амиды хорошо растворимы в воде.
Амиды являются одними из самых устойчивых к гидролизу функциональных производных карбоновых кислот, благодаря чему широко распространены в природе. Многие амиды применяются в качестве лекарственных средств. Уже около века используются в медицинской практике парацетамол и фенацетин, являющиеся замещенными амидами уксусной кислоты.
Строение амидов. Электронное строение амидной группы в значительной степени сходно со строением карбоксильной группы. Амидная группа является p,π-сопряженной системой, в которой неподеленная пара электронов атома азота сопряжена с электронами π-связи С=O. Делокализация электронной плотности в амидной группе может быть представлена двумя резонансными структурами:
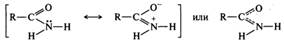
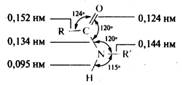
За счет сопряжения связь С—N в амидах имеет частичнодвоесвязанный характер, длина ее существенно меньше длины одинарной связи в аминах, тогда как связь С=O несколько длиннее, чем связь С=O в альдегидах и кетонах. Амидная группа из-за сопряжения имеет плоскую конфигурацию. Ниже приведены геометрические параметры молекулы N-замещенного амида, установленные с помощью рентгеноструктурного анализа:
Важным следствием частично двоесвязанного характера связи С—N является довольно высокий энергетический барьер вращения вокруг этой связи, например, для диметилформамида он составляет 88 кДж/моль. По этой причине амиды, имеющие у атома азота разные заместители, могут существовать в виде π-диастереомеров. N-Замещенные амиды существуют преимущественно в виде Z-изомеров:

В случае N,N-дизамещенных амидов соотношение Е- и Z-изомеров зависит от объема радикалов, соединенных с атомом азота. Стереоизомеры амидов конфигурационно неустойчивы, их существование доказано в основном физико-химическими методами, в индивидуальном виде они выделялись лишь в отдельных случаях. Это связано с тем, что барьер вращения для амидов все-таки не такой высокий, как у алкенов, у которых он составляет 165 кДж/моль.
Кислотно-основные свойства. Амиды обладают слабыми как кислотными, так и основными свойствами. Основность амидов лежит в пределах значений РkBH+ от -0,3 до -3,5. Причиной пониженной основности аминогруппы в амидах является сопряжение неподеленной пары электронов атома азота с карбонильной группой. При взаимодействии с сильными кислотами амиды протонируются по атому кислорода как в разбавленных, так и в концентрированных растворах кислот. Такого рода взаимодействие лежит в основе кислотного катализа в реакциях гидролиза амидов:
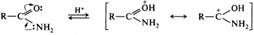
Незамещенные и N-замещенные амиды проявляют слабые NH-кислотные свойства, сравнимые с кислотностью спиртов и отщепляют протон только в реакциях с сильными основаниями.
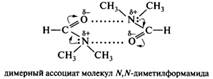
Кислотно-основное взаимодействие лежит в основе образования амидами межмолекулярных ассоциатов, существованием которых объясняются высокие температуры плавления и кипения амидов. Возможно существование двух типов ассоциатов: линейных полимеров и циклических димеров. Преобладание того или иного типа определяется строением амида. Например, N-метилацетамид, для которого предпочтительна Z-конфигурация, образует линейный ассоциат, а лактамы, имеющие жестко зафиксированную E-конфигурацию, образуют димеры:
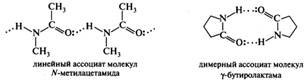
N, N-Дизамещенные амиды образуют димеры за счет диполь-дипольного взаимодействия 2х полярных молекул:
Реакции ацилирования. Вследствие наличия в сопряженной системе амидов сильной электронодонорной аминогруппы электрофильность карбонильного атома углерода, а следовательно, и реакционная способность амидов в реакциях ацилирования очень низкая. Низкая ацилирующая способность амидов объясняется также и тем, что амид-ион Nh3- — плохая уходящая группа. Из реакций ацилирования значение имеет гидролиз амидов, который можно проводить в кислой и щелочной средах. Амиды гидролизуются намного труднее, чем другие функциональные производные карбоновых кислот. Гидролиз амидов проводится в более жестких условиях по сравнению с гидролизом сложных эфиров.
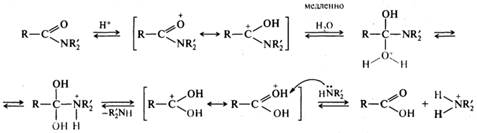
Кислотный гидролиз амидов — необратимая реакция, приводящая к образованию карбоновой кислоты и аммониевой соли:

В большинстве случаев кислотный гидролиз амидов протекает по механизму бимолекулярного кислотного ацилирования ААС2, т. е. похож на механизм кислотного гидролиза сложных эфиров. Необратимость реакции обусловлена тем, что аммиак или амин в кислой среде превращаются в ион аммония, не обладающий нуклеофильными свойствами:
Щелочной гидролиз тоже необратимая реакция; в результате ее образуются соль карбоновой кислоты и аммиак или амин:
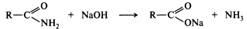
Щелочной гидролиз амидов, как и гидролиз сложных эфиров, протекает по тетраэдрическому механизму ВАС2. Реакция начинается с присоединения гидроксид-иона (нуклеофила) к электрофильному атому углерода амидной группы. Образовавшийся анион (I) протонируется по атому азота, и далее в биполярном ионе (II) формируется хорошая уходящая группа — молекула аммиака или амина. Полагают, что медленная стадия - распад тетраэдрического интермедиата (II).
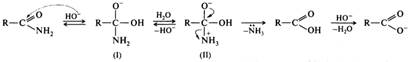
Для анилидов и других амидов с электроноакцепторными заместителями у атома азота распад тетраэдрического интермедиата (I) может проходить через образование дианиона (II):
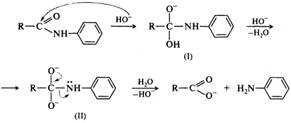
Расщепление азотистой кислотой. При взаимодействии с азотистой кислотой и другими нитрозирующими агентами амиды превращаются в соответствующие карбоновые кислоты с выходами до 90%:
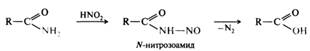
Дегидратация. Незамещенные амиды под действием оксида фосфора(V) и некоторых других реагентов (РОС13, РС15, SOCl2) превращаются в нитрилы:
47. Карбоновые кислоты: галогенирование по Геллю-Фольгарду-Зелинскому, использование реакции для синтезаa-гидрокси иa-аминокислот.
Галогенирование алифатических карбоновых кислот.
Алифатические карбоновые кислоты галогенируются в α-положение хлором или бромом в присутствии каталитических количеств красного фосфора или галогенидов фосфора (реакция Гелля-Фольгарда-Зелинского). Например, при бромировании гексановой кислоты в присутствии красного фосфора или хлорида фосфора(III) с высоким выходом образуется 2-бромогексановая кислота, например:

Бромированию подвергается не сама карбоновая кислота, а образующийся из нее in situ хлорангидрид. Хлорангидрид обладает более сильными, чем карбоновая кислота, СН-кислотными свойствами и легче образует енольную форму.
Енол (I) присоединяет бром с образованием галогенопроизводного (II), которое в дальнейшем отщепляет галогеноводород и превращается в α-галогенозамещенный галогенангидрид (III). На последнем этапе происходит регенерирование галогенангидрида незамещенной карбоновой кислоты.
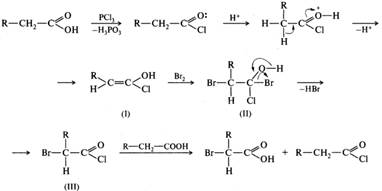
Из образующихся α-галогенозамещенных кислот с помощью реакций нуклеофильного замещения синтезируют другие гетерофункциональные кислоты.
infopedia.su
Гидролиз сложных эфиров - Справочник химика 21
ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ 529 [c.529]При взаимодействии обычной бензойной кислоты с метанолом, который содержал повышенное количество (0,379%) О , было установлено образование лишь обычной воды таким образом, кислородный атом образующейся при этерификации воды отщепляется от бензойной кислоты, а не от метанола, и, следовательно, этерификация протекает в соответствии с уравнением (а). При обратной реакции — гидролизе сложных эфиров водой, содержащей О , меченый кислород входит в образовавшуюся кислоту, а не в спирт, и, значит, омыление протекает по схеме [c.262]
Гидролиз сложных эфиров карбоновых кислот можно осуществить при помощи водных растворов кислот или щелочей, водно-спиртовых растворов щелочей и в присутствии ферментов (эстеразы) и других специальных катализаторов. Обычно сложные эфиры гидролизуются в присутствии кислот медленнее, чем под влиянием щелочей. Щелочной гидролиз протекает более гладко, чем кислотный, и чаще используется в лабораторной практике. [c.166]Кинетика гидролиза сложных эфиров очень сложна, так как приходится учитывать и каталитическое действие получающейся при гидролизе кислоты. При кислотном гидролизе реакции не доходят до конца, оставаясь всегда в каком-то состоянии равновесия, и лишь при щелочном гидролизе благодаря образованию солей кислот реакция проходит количественно. Скорость щелочного гидролиза в 3000—4000 раз больше, чем кислотного. [c.530]
Гидролиз сложных эфиров [c.529]
Реакция щелочного гидролиза сложных эфиров называется реакцией омыления. [c.489]
В качестве примера специфического кислотного катализа рассмотрим реакцию гидролиза сложного эфира, катализируемую водородным ионом [c.624]
Все упомянутые реакции равновесны, причем обратные процессы пре ставляют собой гидролиз сложных эфиров, часто называемый омылением. [c.203]
Типичным примером такой реакции может служить реакция гидролиза сложного эфира или обратная ей реакция этерифи-кации [c.30]
Механизм гидролиза сложных эфиров до недавнего времени представлял неразрешимую задачу, так как было неизвестно, по какому из двух направлений идет реакция [c.530]
По современным взглядам кислотный гидролиз сложных эфиров можно представить следующим механизмом [42]. [c.548]
К реакциям гидролиза, гидратации и дегидратации близки процессы этерификации, обратное направление которых представляет собой гидролиз сложных эфиров [c.170]
При нагревании с раствором едкого натра не только нейтрализуются жирные кислоты, но и происходит гидролиз сложных эфиров, лактонов и эстолидов. Как правило, оксидат-сырец нагревают до 150° в автоклавах с мешалкой очень недолго, прибавляя 35%-ный раствор едкого натра в количестве, немного меньшем теоретического, т. е. найденного при определении числа омыления. Недостаток щелочи предупреждает кристаллизацию мыла (растрескивание), вызываемую слишком высоким содержанием соды. [c.457]
На основании изучения механизма гидролиза сложных эфиров установлено, что процесс действительно протекает в две стадии [c.551]
Все стадии равновесны, и обратная их последовательность ведет к гидролизу сложного эфира (или к алкоголизу, если вместо воды взять спирт). [c.207]
Активным катализатором может быть и ион водорода. Отклонения в каталитической силе кислот в зависимости от изменения их концентрации, различную скорость гидролиза сложных эфиров слабыми и сильными кислотами, действие нейтральных соединений (солевой эффект) и т. д. следует приписать образованию промежуточных соединений. [c.547]
И водным раствором щелочи в омылителе 8, где происходит гидролиз сложных эфиров и лактонов [c.385]
Все эти реакции также катализируются кислотами, однако алкоголиз более эффективно ускоряется основаниями. Гидролиз сложных эфиров катализируется и кислотами, и основаниями, причем в последнем случае реакция протекает необратимо, поскольку образуется соль карбоновой кислоты. [c.237]
Чаще всего дегидратация происходит за счет спиртовых или карбоксильных гидроксилов. Реакции дегидратации, как и все каталитические процессы, обратимы примером является образование и гидролиз сложных эфиров. [c.450]
ГИДРОЛИЗ сложных ЭФИРОВ [c.531]
ГИДРОЛИЗ сложных ЭФИРОВ 533 [c.533]
Скорость гидролиза сложного эфира зависит от строения как ацильного, так и спиртового радикалов. При этом сложные эфиры омыляются тем быстрее, чем легче они образуются. Наименее устойчивыми являются сложные эфиры, полученные из кислот с высокой константой диссоциации. Муравьиноэтиловый эфир, метиловый и этиловый эфиры щавелевой кислоты гидролизуются при комнатной температуре. [c.166]
Применение некоторых катализаторов значительно ускоряет процесс сернокислотной гидратации. Для этой цели используются соли железа, кобальта, никеля, меди, платины, серебра [41, 42], а также соединения висмута [43, 44]. Сульфат серебра [45, 46] и соли меди [47—49] сильно ускоряют гидролиз сложных эфиров серной кпслоты. Рекомендуется применять в качестве катализаторов галогениды бора пли бораты в соединении с сульфатами никеля и других тяжелых металлов [50]. Необходимые для этого реакционные условия определены Поповым [51]. При высоком давлении и высокой температуре каталитическое действие проявляют сульфаты органических оснований, например изопроииламина, анилина, наф-ти.талшна, хинолнна [52], а также сульфаты и галогениды цинка, магния, бериллия [53] и алюминия [54]. Соли алюминия обладают каталитическим действием при высоком давлении и низких температурах в водном растворе. Наконец, следует упомянуть еще кремневую или борвольфрамовую кислоту и их соли [55], однако процессы с их участием протекают прн 200—300 °С под давлением уже, в газообразной фа.зе. [c.60]
Обработкой масляного слоя щелочью гидролизуют сложные эфиры в конденсате и переводят кислоты в соли. Полученное нейтральное масло фракционируют до 360 . [c.697]
Гомогенно-каталитические реакции особенно распространены при проведении процессов в жидкой фазе. К таким процессам относятся ускоряющиеся под действием водородных ионов реакции этерификации и гидролиза сложных эфиров, инверсии сахаров, мутаротации глюкозы, а также катализируемый некоторыми анионами и катионами распад перекиси водорода в водных растворах. Кроме того, гомогенно-каталитическими являются реакции полимеризации олефинов в жидкой фазе под действием серной кислоты, полимеризация олефинов в жидкой и паровой фазах в присутствии трехфторнстого бора или фтористого водорода и многие другие. [c.276]
Таким образом, бимолекулярная (с учетом катализатора) элементарная реакция идет, как мономолекулярная, а тримолекуляр-ная (также с учетом катализатора) — как бимолекулярная. В условиях специфического кислотно-основного катализа идут реакции замещения, рацемизации (инверсия тростникового сахара, стр. 248), омыления (гидролиз) сложного эфира (стр. 253). [c.228]
Получение и гидролиз сложных эфиров [c.164]
Учитывая, что при гидролизе на одну сложноэфирную группировку расходуется одна молекула щелочи, гидролиз сложного эфира можно использовать для определения эквивалентного веса сложного эфира. [c.265]
Гидролиз сложных эфиров [c.6]
Электростатическое взаимодействие. Эффекты, обусловленные электростатическим взаимодействием боковых групп в молекулах реагентов, удобно рассмотреть на примере гидролиза сложных эфиров следующего строения [c.73]
При гидролизе сложных эфиров применяют как кислоты, так и основания. В производстве мыла из жирюв и масел в качестве катализатора и реагента чаше всего используется едкий натр. Вероятно, наиболее известным кислотным каталитическим гидролизом жиров в жирные кислоты и глицерины является процесс Твитчела. Жир с 25-50% воды, 0,75-1,25% катализатора Твитчела и 0,5% серной кислоты кипятят в течение 20-48 ч. Образующийся глицерин растворяется в избытке воды и отделяется от расплавленных жирных кислот /34/. [c.341]
Выделить жирные кислоты из реакционной смеси довольно трудно. Существует несколько епссобов. Сначала экстрагируют теплой водой низшие кислоты (муравьиную, уксусную, проиионовую), затем омыляют оставшиеся кислоты и гидролизуют сложные эфиры и лактогы щелочами под давлением при 150 °С. Из продуктов гидролиза Еыделяют отстаиванием и возвращают в сырье неомыляемую фракцию — верхний слой нижний представляет собой водный раствор мыл, в котором кроме натровых солей жирных кислот содержатся соли оксикислот, а также спирты, кетоны и растворенные парафиновые углеводороды. При нагревании раствора (300—350°С и 80—120 ат) в трубчатой печи происходит дегидратация оксикислот с образованием ненасыщенных кислот [c.155]
Основные стадии производства — абсорбция этилена Н2304, разбавление и гидролиз сложных эфиров серной кислоты, отгонка спирта и, наконец, регенерация Нг504 высокой концентрации. Скорость абсорбции этилена серной кислотой возрастает с увеличением концентрации кислоты, температуры, давления, эффективности катализатора и времени контакта. [c.200]
Гидролиз сложных эфиров усиливается гидроксид-иоиами. При нагревании со щелочами сложные эфиры расщепляются с образонанием спирта и соли кислоты [c.489]
Чтобы избежать гидролиза сложных эфиров, следует использовать объемистые грет-бутильные группы. Метиловые эфиры можно применять в том случае, если кислотные свойства активной метиленовой группы усилены. Для этого, например, подходит образование я-комплексов типа арен-Сг (СО)з, в которых атом металла является электроноакцептором [341, 930]. Эти комплексы получают при кипячении с гексакарбонилом хрома. После почти количественного алкилирования (СНгСЬ или СбНб/цетилтриметиламмонийбромид/50%-ный NaOH, 1,5—3 ч при комнатной температуре) комплексы можно легко разрушить солями церия [341, 390]. [c.189]
Последовательные реакции широко распространены. К ним относятся, в частности, реакции гидролиза сложных эфиров дикарбоновых кислот, или сложных эфиров гликолей, или дигалоидо-производных. Кинетику последовательно протекающих процессов радиоактивных превращений можно рассматривать как частный случай кинетики ряда последовательных реакций первого порядка ( 230). [c.473]
Для повыщения степени копверсни исходных реагентов в сложный зфир имеются различные методы. При жидкофазных реакциях игшболсе эффективно отгонять нз реакционной массы воду или э( нр по мере их образованпя. Когда это невозможно, а также во R OX процессах газофазной этерификации, чтобы повысить равновесную степень конверсии, берут избыток одного из реагентов, обычно наиболее дешевого. В обратном процессе — прн гидролизе сложных эфиров — для увеличения степени конверсии, очевидно, необходимы другие условия, а именно проведение реакции в из-бь тке воды. [c.206]
Эта сульфокислота, однако, приготовлена гидролизом сложного эфира, полученного из дифенилдиазометана и спиртового раствора двуокиси серы [139а] [c.129]
Литература по гидролизу сложных эфиров обширна, однако все попытки объяснить гидролиз простой реакцией обменного разложения или ионизации не приводили к удовлетворительным результатам и не выяснили механизм влияния катализаторов. Первые исследования механизма реакции гидролиза относятся к началу нынешнего столетия. Интерес представляют исследования Штиглица (1908 г.), который считал, что всякий сложный эфир может реагировать как слабо диссоциированное оксониевое основание, спо- [c.547]
При помощи спиртового раствора щелочи, хотя реакция протекает с малой степенью замещения и требует длительного нагревания реакционной смеси под давлением. Полиметакрилаты гидролизуются eii , труднее. Это соответствует прави, 1у гидролиза сложных эфиров, соглэсн( которому эфирная rpvnna, присоединенная к [c.343]
Справедливость такой схемы подтверждается тем, что гидролиз сложного эфира, содержащего остаток оптически активного спирта К протекает с сохранением оптической конфигурации остатка К, а при щелочном гидролизе эфира карбоновых кислот водой с изотопом кислорода образуется спнрт, не содержащий [c.167]
Методы эксперимента в органической химии (1968) -- [ c.365 ]Органикум. Практикум по органической химии. Т.2 (1979) -- [ c.91 , c.92 ]
Препаративная органическая химия (1959) -- [ c.541 ]
Химия кремнезема Ч.1 (1982) -- [ c.786 ]
Биоорганическая химия (1991) -- [ c.200 ]
Органическая химия (2002) -- [ c.676 , c.677 , c.678 ]
Органическая химия (1998) -- [ c.267 , c.330 ]
Введение в электронную теорию органических реакций (1965) -- [ c.253 , c.256 , c.258 , c.269 , c.276 , c.308 ]
Органическая химия (1964) -- [ c.444 , c.547 , c.573 ]
Общий практикум по органической химии (1965) -- [ c.369 ]
Неформальная кинетика (1985) -- [ c.210 , c.211 ]
Общая химия 1982 (1982) -- [ c.489 , c.490 ]
Общая химия 1986 (1986) -- [ c.473 , c.475 ]
Органическая химия 1971 (1971) -- [ c.100 , c.165 , c.166 , c.168 ]
Органическая химия 1974 (1974) -- [ c.82 , c.136 ]
Объёмный анализ Том 1 (1950) -- [ c.234 ]
Органическая химия (1972) -- [ c.265 ]
Теоретические основы органической химии (1979) -- [ c.426 , c.432 ]
Органическая химия Издание 6 (1972) -- [ c.82 , c.136 ]
Общая химия Издание 18 (1976) -- [ c.485 , c.486 ]
Общая химия Издание 22 (1982) -- [ c.489 , c.490 ]
Химическое равновесие и скорость реакций при высоких давлениях Издание 3 (1969) -- [ c.224 ]
Химия органических лекарственных препаратов (1949) -- [ c.229 ]
Теория технологических процессов основного органического и нефтехимического синтеза Издание 2 (1975) -- [ c.225 ]
Курс органической химии Издание 4 (1985) -- [ c.197 ]
Органическая химия (1972) -- [ c.265 ]
Органическая химия Издание 2 (1976) -- [ c.271 ]
Органическая химия (1964) -- [ c.444 , c.547 , c.573 ]
chem21.info
Реакция - гидролиз - сложный эфир
Реакция - гидролиз - сложный эфир
Cтраница 1
Реакции гидролиза сложных эфиров происходят без значительного изменения объема; поэтому константа равновесия этих реакций почти не изменяется с повышением давления. Отсюда следует, что ускорение давлением обратной реакции образования сложных эфиров из кислот и спиртов должно быть столь же значительным, как и ускорение реакций гидролиза. Действительно, константа скорости реакции уксусной кислоты с этиловым спиртом возрастает в 25 раз при повышении давления от 1 до 5000 атм. [1]
Реакции гидролиза сложных эфиров карбоновых кислот2, широко применяемых в гербицидах, позволяют подавить их токсичность. В результате гидролиза образуются соответствующие карбоновая кислота и спирт. Амиды карбоновых кислот3 гидролизуются с образованием кислоты и амина. [2]
Реакция гидролиза сложных эфиров алифатических дикарбоновых кислот имеет практическое значение, так как может быть использована для получения индивидуальных дикарбоновых кислот. [3]
Изучена реакция гидролиза сложных эфиров ароматических спиртов и серной кислоты [104, 105] в присутствии кислотных катализаторов. [4]
Для реакций гидролиза сложных эфиров карбоновых кислот и образования этих эфиров возможны два пути, дающие одинаковые продукты. [5]
На примере реакций гидролиза сложных эфиров, реакции Канниццаро, расщеплений и циклизации четвертичных аммониевых солей изучена кинетика в концентрированных растворах сильных оснований. Рассмотрено несколько возможных механизмов ионизации. [6]
Ввиду относительной простоты реакций гидролиза сложных эфиров, в частности щелочного гидролиза, эти процессы служат в качестве модельных в исследованиях влияния мицелл на скорости реакций и активационные параметры. Важность изучения таких реакций определяется также и тем, что они чрезвычайно распространены в биологических системах, где гидролиз сложных эфиров катализируется нуклеофильными агентами или ферментами. [7]
Экспериментально доказано, что реакции гидролиза сложных эфиров и этерификации действительно осуществляются по приведенным механизмам ( случаи смены механизма и влияние строения субстрата на механизм гидролиза будут рассмотрены на стр. [8]
Аналогичные примеры найдены для реакций гидролиза сложных эфиров кислотами и основаниями, активированные комплексы в которых сильно полярны за счет ионизации карбонильных групп; во второй главе обсуждаются именно такие механизмы реакции. За счет ориентации растворителя активированными комплексами энтропия активации в таких реакциях очень мала. И реакция ускоряется с повышением диэлектрической проницаемости растворителя. [9]
При специфическом основном катализе в реакции гидролиза сложного эфира в водном растворе происходит нуклеофильная атака иона гидроксила на карбонильный углерод и электро-фильная атака молекулы воды на атом кислорода спиртовой группы. Последний процесс является реакцией переноса протона. [10]
При специфическом основном катализе в реакции гидролиза сложного эфира в водном растворе происходит нуклеофильная атака иона гидроксила на карбонильный углерод и электрофиль-ная атака молекулы воды на атом кислорода спиртовой группы. Последний процесс является реакцией переноса протона. [11]
В табл. 6.4 приведены примеры реакций гидролиза сложных эфиров, показывающие индукционные и мезомерные влияния. [12]
Таким образом, присутствие щелочи делает реакцию гидролиза сложного эфира необратимой. Гидролиз сложных эфиров называется омылением. [13]
Учитывая сказанное, мы просим читателя приведенный ниже разбор реакций гидролиза сложных эфиров и амидов в рамках моделей 26 и 2в считать просто условным примером для демонстрации применяемых методов. Примем вместе с авторами работ [23] и [27], что реакция идет по механизму ( 2), причем в исходные уравнения ( V. [14]
Необходимо также напомнить приведенный в самом начале этого параграфа пример реакций гидролиза сложных эфиров, показывающий, что в зависимости от условий проведения конкретной реакции и от особенностей строения реагирующих молекул могут осуществляться различные варианты изменения связей из числа тех, которые удовлетворяют условию минимальности структурных изменений. [15]
Страницы: 1 2 3
www.ngpedia.ru
Гидролиз - сложный эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Гидролиз - сложный эфир
Cтраница 1
Гидролиз сложных эфиров в кислой среде приводит к образованию кислот и спиртов. [1]
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. [2]
Гидролиз сложных эфиров протекает с образованием экви-мольного количества кислоты и спирта. [3]
Гидролиз сложных эфиров приводит к образованию спиртов и карбоновых кислот. Этот процесс часто называют омылением. Происхождение термина омыление связано с методом производства мыла из жиров. [4]
Гидролиз сложных эфиров протекает как в кислой, так и в щелочной среде. Для кислотного гидролиза требуются лишь каталитические количества кислоты. При щелочном омылении обычно берут или молярное количество щелочи, или избыток, так как она является не только катализатором, но и выводит из сферы реакции образующуюся кислоту в виде соли. [5]
Гидролиз сложных эфиров приводит к образованию спиртов и карбоновых кислот. Этот процесс часто называют омылением. Происхождение термина омыление связано с методом производства мыла из жиров. [6]
Гидролиз сложных эфиров протекает как в кислой, так и в щелочной среде. Для кислотного гидролиза требуются лишь каталитические количества кислоты. При щелочном омылении обычно берут или молярное количество щелочи, или избыток, так как она является не только катализатором, но и выводит из сферы реакции образующуюся кислоту в виде соли. [7]
Гидролиз сложных эфиров едким натром, наоборот, относится к реакциям нуклеофильного типа, поскольку при этом происходит атака карбалкоксильной группы ионом О - Н, а не Na; хлористый натрий в этом случае также не оказывает никакого действия. [8]
Гидролиз сложного эфира декалина под действием щелочи в диэтиленгликоле или под действием щелочных металлов в жидком аммиаке протекает менее успешно. [9]
Гидролиз сложных эфиров заслуживает более подробного рассмотрения. [10]
Гидролиз сложных эфиров катализируется большим числом агентов, таких, как кислоты, основания, энзимы. [11]
Гидролиз сложных эфиров с легко отщепляющимися остатками ( например, гс-нитрофенилацетатов) эффективно катализируется нейтральной молекулой имидазола, и чем выше основность этого имидазола, тем он эффективнее. Если же уходящая группа сложного эфира отщепляется труднее ( например, в случае / г-крезил-ацетата), активным началом служит анион имидазола, и имеет место общий основной катализ. Так, в случае имидазолов с р / ( а 4 ведущим является катализ анионом. В реакциях этого типа имидазол - гораздо более эффективный нуклеофил по сравнению с другими аминами, так как имидазол - третичный амин с минимальными стерическими трудностями и легкой делокализа-цией положительного заряда, что очень ускоряет нуклеофильное присоединение к карбонильной группе. [12]
Гидролиз сложных эфиров катализируется также сильными основаниями, причем такой катализ особенно эффективен, так как выделяющаяся кислота превращается в соль, что вызывает СДЕИГ равновесия вправо. [13]
Гидролиз сложных эфиров ( Гоулд, 314) находит широкое применение. Реакция между кислотой и спиртом катализируется кислотами и является обратимой ( см. стр. Поэтому для проведения полного гидролиза в смесь вводят щелочь, которая нейтрализует кислоту и делает процесс необратимым. Гидролиз, проводимый по этому методу, получил название омыления. [14]
Гидролиз сложного эфира на спирт и кислоту при действии воды происходит медленно, но при прибавлении небольшого количества минеральной кислоты реакция значительно ускоряется. Точно так же ускоряют омыление и щелочи, однако в этом случае реакция несколько усложняется. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Эфиры простые гидролиз - Справочник химика 21
Хотя 2,2-диметоксипропан, который можно рассматривать как простой эфир, быстро гидролизуется до метанола и ацетона в разбавленной водной кислоте, диэтиловый эфир и 1,2-диметоксипропан устойчивы в этих условиях. Чтобы объяснить это различив, напишите механизм кислотного гидролиза 2,2-диметоксипропана. [c.23]Этансульфокислота. В этом разделе приведены только реакции, не упомянутые при рассмотренип общих методов получения сульфокислот. Встряхивание диэтилсульфита с иодистым этилом [54] в щелочном растворе или просто гидролиз диэтилсульфита холодным раствором 20%-ной щелочи [87] ведет к образованию некоторого количества щелочной соли этансульфокислоты. Аналогичные. результаты дает действие иодистого этила на натриевую соль кислого этилового эфира сернистой кислоты. Последняя в присутствии солеи, например роданида натрия, претерпевает перегруппировку, превращаясь в натриевую соль этансульфокислоты [88]. Сернистокислый натрий может быть алкилирован [89] путем нагревания с натриевой солью этилсерной кислоты в концентрированном водном растворе до температуры 110—120° в течение 3 час. [c.122]
Синтез из ацетилена простого винилового эфира и гидролиз его в ацетальдегид (реакции, не требующие ртутного катализатора, применяемого при прямой гидратации ацетилена в ацетальдегид по Кучерову) предложены как способ получения ацетальдегида из ацетилена непрямой его гидратацией (А. Е. Фаворский, М. Ф. Шостаковский). [c.311]Третья группа. В раствор осаждаемого металла вводят не свободный осадитель, а вещества, которые медленно образуют осадитель в определенных условиях реакции. Наиболее простой пример — осаждение сернокислого бария персульфатом, который при нагревании медленно разлагается, образуя сульфат-ионы. Чтобы получить плотные и чистые осадки купферонатов металлов, в раствор вводят фенилгидроксиламин и нитрит натрия. Эти вещества медленно образуют купферон, который и осаждает металл. Наиболее разработаны те методы этой группы, в которых осадитель вводят в виде эфира соответствующей кислоты. При нагревании эфир медленно гидролизуется, образуя кислоту, которая в соответствующих условиях вызывает осаждение. Для осаждения сульфатов применяют диметилсульфат, оксихинолинатов — 8-ацетоксихинолин и т. п. [c.80]
Защита карбоксильной группы путем превращения ее в сложноэфирную группировку обсуждалась в разд. 9.1.4.7 для регенерации исходной кислоты используют ряд селективных методов расщепления (см. также [189]). Защите гидроксильных групп посвящен обзор [190], и здесь будут рассмотрены лишь несколько примеров использования ацилирования, как метода защиты. Образование простейших эфиров, например ацетатов, таких соединений, как стероиды, сахара, нуклеозиды и циклические спирты, а также бензоатов получило широкое применение расщепление таких эфиров достигается гидролизом с основанием, аммонолизом и метано-лизом. Очень легко образуются формиаты, которые затем гладко гидролизуются в присутствии водных или спиртовых оснований, например бикарбоната натрия в метаноле. Формиаты поэтому можно использовать для селективной защиты в присутствии других этерифицированных гидроксильных функций пример подобной селективной защиты представлен на схеме (215). [c.342]
Дегидратация с образованием простых эфиров. Ранее уже говорилось о побочном образовании простых эфиров при гидролизе хлорпроизводных и гидратации олефинов. Этим путем получают все необходимое количество таких эфиров, как диизопропиловый. Однако диэтиловый эфир имеет довольно широкое применение, и его специально производят межмолекулярной дегидратацией этанола при 250 °С на гетерогенном катализаторе АЬОз [c.188]
Исследования превращений простых виниловых эфиров фуранового ряда показали, что их реакционная способность существенно не отличается от таковой алкилвиниловых эфиров. Изучены гидролиз, гидрирование, реакции присоединения спиртов, карбоновых кислот, галогенов и галогенводородов на примере винилфурфурилового и винилтетрагидрофурфурилового эфиров и винилового эфира пирослизевой кислоты. Ниже приведена схема синтеза и превращений винилфурфурилового эфира и винилового эфира пирослизевой кислоты. [c.208]
Простые эфиры представляют собой, в противоположность сложным эфирам, весьма стойкие в химическом отношении вещества. В отличие от сложных эфиров простые эфиры не гидролизуются ни водой, ни едкими щелочами. Даже металлический натрий не действует на них при комнатной температуре. Большинство кислот также практически не действует на простые эфиры, за исключением концентрированной серной и йодистоводородной кислот, которые их разрушают. [c.127]
Гидролиз. Сложные эфиры легко гидролизуются и отличаются в этом отношении от простых эфиров, которые, наоборот, очень стойки к гидролизу [c.130]
Обсуждение роли полярных и пространственных эффектов в реакциях гидролиза алифатических эфиров и амидов тесно связано с работами Тафта, который применил линейное соотношение между изменениями свободной энергии Гаммета к этим системам. Первоначально Ингольд [41] предположил, что катализируемый кислотами гидролиз эфиров в основном не зависит от полярных эффектов и что отношение констант скоростей щелочного и кислотного гидролиза / он / н зависит только от полярности заместителей. Исходя из этого предположения, Тафт вывел следующее уравнение, позволяющее оценить полярные и пространственные эффекты заместителей на основании констант скоростей простого гидролиза эфиров [c.25]
Сопоставление химического поведения моделей с поведение аратов ЛМР и протолигнина показало, что в лигнине повышение дионной способностью обладают бензиловые спиртовые групп ко сульфонируются, реагируют с тиогликолевой кислотой, спи . Бензиловые эфиры просто гидролизуются, причем алкил-арил по сравнению с алкил-алкильными более способны к переэтер сации. Именно эти реакции позволили определить содержат лловых эфиров в ЛМР ели (см. табл. 3.3). [c.107]
Дегидратация с образованием простых эфиров. Ранее уже го- зрилось о побочном образовании простых эфиров при гидролизе слорпроизводных (стр. 174) и гидратации олефинов (стр. 186). [c.198]
Ди-т/>ет-бутиловый 5фир (205) (схема 4.61) — это высоко напряженное соединение. В противоположностт, другам простым эфирам его гидролиз происходит настолько легко, что для его ката тиза достаточно даже углекислоты [c.463]
Сложные эфиры можно получить из а,а-дихлоралкилзамещенных простых эфиров при гидролизе их водой [161]. Для гидролиза а,а-дифторалкилзамещенных простых эфиров необходимо применять более сильные гидролизующие агенты, такие, как 95%-ную серную кислоту [162, 163]. Выходы при этих реакциях гидролиза составляют от 55 до 83%. Механизм этого расщепления точно не установлен [163], но можно предполагать, что этот гидролиз протекает с большей легкостью, чем гидролиз тригалогензамещенных, в результате влияния простой эфирной группы [c.305]
При алкилировании иодистым метилом или диметилсульфатом в щелочной среде пентозы получают четыре, а гексозы — пять метилов, что согласуется с числом гидроксильных групп, установленным путем ацетилирования. Однако тетраметилпентозы и пептаметилгексозы прп этом теряют свою способность к альдегидным (или кетонным) реакциям. Кроме того, одна из этих метильных групп резко отличается по свойствам от остальных и вообще от поведения алкоксилов простых эфиров в то время как простые эфиры не гидролизуются пи в щелочных, ии в кислых растворах. эта особая метильная группа, хотя и устойчива к действию щелочей, тотчас гидролизуется разбавленными кислотами, и после этого к моносахариду, еще несущему остальные метилы, возвращаются спойства альдегида (или кетона). [c.441]
Для обеспечения стабильности подготовленной колонки неподвижные фазы часто связывают химически с носителем (обычно с помощью сложного или простого эфира). Простая эфирная связь обеспечивает более устойчивый продукт, чем сложноэфирная связь, которая может гидролизоваться полярными растворителями например, в покрытых октадецилсила-ном бусинках углеводородная цепь связана простой эфирной связью со стеклянными бусинками, покрытыми тонким слоем кремния, и это обеспечивает весьма эффективную систему с обращенной фазой, которая исключительно стабильна в пользовании. Для хроматографирования эти частицы укладывают в колонки с узким отверстием (внутренним диаметром обычно 2—4 мм) вполне очевидно, что такой мелкий материал, упакованный в колонки длиной до 1 м, будет создавать значительное сопротивление потоку подвижной фазы, в силу чего и должно применяться высокое давление. Типичная длина колонок составляет 20— 30 см, а условия, обычные для количественного анализа, — скорость потока около 1— 3 мл в минуту и давление до 28 000 кПа (4000 фунтов/дюйм ). [c.103]
При биосинтезе глюкозы, который протекает в основном по пути обращения целого ряда легко обратимых ферментативных реакций гликолиза, синтез отличается от распада в двух наиболее критических точках всей последовательной цепи реакций, а именно, в начале и конце. Так, например, в процессе катаболизма глюкоза превращается в глюкозо-6-фосфат посредством реакции трансфосфорилирования с участием АТФ однако при анаболизме она образуется из фосфорного эфира путем простого гидролиза. Пируват образуется катаболически из фосфоенолпируВата путем трансфосфорилирования - переноса фосфатной группы на АДФ в анаболических же процессах он используется у большинства организмов благодаря двум связанным реакциям сначала пируват карбоксилируется до оксалоацетата и только потом превращается в фосфоенолпируват (описанные реакции см. на Метаболической карте). [c.451]
Для проведения ГХ-анализа одинаково важны как химическая, так и термическая устойчивость рассмотренных выше производных. Химическая устойчивость прежде всего определяет условия обработки, хранения и дозировки образцов. Как уже упоминалось, в результате слишком длительного анализа одного и того же образца могут образовываться несколько продуктов и, следовательно, получаться неоднозначные данные. Если ТФА-производные эфиров простых моноаминомонокарбоновых кислот — устойчивые вещества, которые могут храниться неограниченное время, то этого нельзя сказать о производных аминокислот сложной структуры, содержащих несколько ацильных групп. Большинство таких соединений крайне чувствительны к гидролизу и частично разлагаются в присутствии следов воды [53]. У оксиаминокислот Сер и Тре это может привести к полной потере защитных групп, так как кислота, образующаяся при гидролизе О-ТФА-группы, по типу кислотноосновного катализа может способствовать N—О-ацильной миграции и таким образом вызвать полную потерю Ы-ТФА-групп [126]. Рекомендуется эти соединения хранить и даже вносить в прибор в присутствии избытка трифторуксусного ангидрида, к которому могут добавляться другие растворители. [c.318]
Одним из наиболее информативных методов установления строения полисахаридов является метилирование. Его основы и различные модификации рассмотрены в монографии Н. К. Кочеткова и соавт. и в ряде методических пособий [68, 77, 78]. Сущность метода сводится к преобразованию свободных гидроксильных групп иолисахаридов в мМоксильиые, устойчивые к воздействию кислот, последующей деструкции модифицированного биополимера до мономеров и их дальнейшей идентификации. Образующиеся ири гидролизе метилированного полисахарида метиловые эфиры простых сахаров содержат свободные гидроксильные группы, по положению которых судят о размерах окнсных циклов мо-носахаридных звеньев и местах присоединения мономерных, остатков друг к другу в молекуле исходного соединения. [c.61]
Диметиловый эфир дикарбоновой кислоты превращается в дикарбоновую кислоту в результате гидролиза водой в присутствии катионообменных смол [50] или без катализатора [51]. Технологически наиболее прост гидролиз без катализатора. При 220— 240 С и избытке воды (60—100 моль) можно достичь 94—96% превращения диалкилового эфира. [c.187]
В трополонах гидроксил является енольным, и поэтому трополоны обладают свойствами как енолов, так и фенолов. Кроме того, благодаря присутствию карбонильной группы трополоны являются винилогами карбоновых кислот. Сходство трополонов с фенолами проявляется в том, что они легко реагируют с ангидридами и хлорангидридами кислот с образованием сложных эфиров ( XV). Так, сам трополон был превращен в ацетат [123], бензоат [123], 3, 5-динитробензоат [123] и п-толуолсульфонат [83]. Эти эфиры легко гидролизуются [123, 278, 350] и напоминают по своим свойствам ангидриды кислот. Простые эфиры трополонов ( XVI) можно получить различными способами, такими, как реакция серебряных или натриевых солей трополонов с галоидными алкилами [9, 123, 354], реакция трополонов со спиртами в присутствии минеральных кислот, реакция с диметилсульфатом в щелочной среде [84, 123, 185, 447], однако чаще всего для метилирования трополонов применяют диазометан. В случае [c.376]
С уравнением (I) Скрабал ассоциирует идею, что каждое превращение между двумя компонентами связано с противо поле жно стью их свойств, и если это так, то реагирующее вещество А должно иметь основные свойства, если катализатор К — кислота, и для реагирующего вещества, имеющего свойства кислоты, катализатор должен быть основанием. Он иллюстрировал эту мысль примером типичные эфиры (простые), не имеющие свойств кислоты, а имеющие лишь основные свойства (оксониевые основания), гидролизуются при каталитическом действии кислот. Сложные эфиры, являясь одновременно основаниями и кислотами, при гидролизе ведут себя соответствующим образом, т. е. последний ускоряется и кислотами и основаниями. Указывается, что промежуточное соединение К [c.220]
Гарн и Джилрой [75] предложили для стадии гидролиза двухфазную систему бензол — вода. Поскольку простейшие сложные эфиры не гидролизуются в этих условиях, можно различить фталат, вступивщий в полимеризацию, и фталевые эфиры, используемые как пластификаторы. [c.384]
Подобно алкенам, двойная связь в ненасыщенных простых эфирах подвержена электрофильной атаке, однако в виниловых эфирах присутствие атома кислорода вблизи двойной связи оказывает заметное влияние на скорость и региоселективность реакции. Виниловые эфиры легко гидролизуются в кислой среде до альдегидов или кетонов [уравнение (170)] и реагируют со спиртами при катализе кислотами с образованием ацеталей [уравнение (171)]. Последняя реакция обратима в результате в контролируемых условиях можно получать ацетали из виниловых эфиров или виниловые эфиры из ацеталей, однако можно также проводить трансацетализацию и трансвинилирование. Образование этим методом виниловых эфиров и их последующая перегруппировка служат основой для некоторых важных методов синтеза полиенов (см. разд. 4.3.6.2). Имеются данные об относительной термодинамической стабильности различных виниловых эфиров [257]. [c.351]
chem21.info



















