/ холестериды, всасывание холестерина. Эфиры холестерина
Какова формула холестерина? Из чего он образуется?
В крови присутствуют 4 основные группы липидов:- холестерин и его эфиры
- триглицериды
- фосфолипиды
- неэтерифицированные жирные кислоты.
 Холестерин относится к группе стероидов (как половые гормоны и желчные кислоты), так как содержит в своем составе циклические структуры. Эфир холестерина = холестерин + жирная кислота. Триглицериды - это то, что обычно в обиходе называется жирами. Триглицерид = глицерин + 3 жирные кислоты. Глицерин - это многоатомный спирт, известный женщинам как составная часть многих косметических средств. Жирная кислота - это органическая кислота, входящая в состав жира, часто она имеет большой углеводородный хвост (если у уксусной кислоты он составляет 1 атом углерода, то у пальмитиновой их 15, а у стеариновой целых 17). Фосфолипиды - это сложные липиды, состоящие из глицерина, жирных кислот, фосфорной кислоты и какого-либо азотсодержащего соединения. Они входят в состав мембран клеток животных, растений, микроорганизмов. Если жирная кислота не входит в состав жира, то она называется неэтерифицированной. Холестерин, триглицериды и фосфолипиды образуют комплексы с белками - липопротеиды.
Холестерин относится к группе стероидов (как половые гормоны и желчные кислоты), так как содержит в своем составе циклические структуры. Эфир холестерина = холестерин + жирная кислота. Триглицериды - это то, что обычно в обиходе называется жирами. Триглицерид = глицерин + 3 жирные кислоты. Глицерин - это многоатомный спирт, известный женщинам как составная часть многих косметических средств. Жирная кислота - это органическая кислота, входящая в состав жира, часто она имеет большой углеводородный хвост (если у уксусной кислоты он составляет 1 атом углерода, то у пальмитиновой их 15, а у стеариновой целых 17). Фосфолипиды - это сложные липиды, состоящие из глицерина, жирных кислот, фосфорной кислоты и какого-либо азотсодержащего соединения. Они входят в состав мембран клеток животных, растений, микроорганизмов. Если жирная кислота не входит в состав жира, то она называется неэтерифицированной. Холестерин, триглицериды и фосфолипиды образуют комплексы с белками - липопротеиды. - Функции холестерина:
- входит в состав мембраны клеток
- регулирует ее проницаемость
- регулирует активность мембранных ферментов
- является предшественником некоторых биологически активных веществ
- стероидных гормонов
- витаминов группы D
- желчных кислот.
- входит в состав мембраны клеток
- Источники холестерина:
- пища (яйца, сливочное масло и др.)
- синтез из ацетилКоА в печени и в кишечнике (в самом организме).
- Удаление избытка холестерина происходит с помощью липопротеинов высокой плотности. Они переносят холестерин в печень, далее он превращается в желчные кислоты, которые выделяются с желчью в кишечник.
Холестерин - это не только атеросклероз! Ни одна клеточка нашего организма не может обойтись без него, так как он входит в состав их мембран. Проблема большинства современных людей заключается в том, что они употребляют слишком много продуктов, содержащих холестерин, поэтому организм не успевает избавляться от его избытка.
Высокое содержание холестерина в сыворотки крови не обязательно приведет к атеросклерозу. Для развития последнего необходимо, чтобы внутренняя стенка артерий была повреждена, а этому способствуют стрессы, повышенное давление (гипертоническая болезнь). Кроме того, вероятность "вырастить" в своих сосудах атеросклеротические бляшки зависит от того, сколько в нашей сыворотке содержится липопротеидов высокой плотности (отрицательный фактор риска). Чем их меньше, тем больше риск. Опасен не столько сам холестерин, сколько сочетание его высокой концентрации в сыворотке крови с низким содержание ЛПВП и повреждением внутренней стенки сосудов, поэтому лучше все-таки не рисковать и иметь нормальный уровень холестерина.
- Нормальное содержание холестерина в сыворотке крови:
новорожденные 1,3 - 2,6 ммоль/л 1 год 1,82 - 4,94 ммоль/л 2 года - 14 лет 3,74 - 5,2 ммоль/л взрослые 3,9 - 5,2 ммоль/л - Когда уровень холестерина в крови повышается...
- при атеросклерозе
- при сахарном диабете
- при заболеваниях печени
- при наследственной гиперхолестеринемии (наследственное заболевание, проявляющееся повышением уровня холестерина в крови, а следственно ранним развитием атеросклероза).
незначительная гиперхолестеринемия 5,2 - 6,5 ммоль/л умеренная гиперхолестеринемия 6,7 - 7,8 ммоль/л тяжелая гиперхолестеринемия более 7,8 ммоль/л - Когда уровень холестерина в крови понижается...
- при тиреотоксикозе
- при кахексии (истощение)
- при остром панкреатите.
- Функции липопротеидов высокой плотности:Липопротеиды высокой плотности переносят жирные кислоты, холестерин, фосфолипиды, триглицериды. По сравнению с другими транспортными формами (хиломикронами, липопротеидами низкой и очень низкой плотности) они содержат много белка и поэтому более прочные. Проникая в стенку сосуда, они не только не "разваливаются" с высвобождением холестерина, а наоборот "захватывают" его и уносят в печень.
- Нормальное содержание липопротеидов высокой плотности в сыворотке крови:
новорожденные 0,7 - 1,8 г/л 1 год 0,8 -2,8 г/л подростки и взрослые 1,5 - 3,3 г/л - Когда уровень липопротеидов высокой плотности в крови повышается...
- при алкоголизме.
- Когда уровень липопротеидов высокой плотности в крови понижается...
- при обтурационной желтухе и других заболеваниях печени
- при лимфогранулематозе
- у людей, находящихся на парентеральном питании (в/в введение пищевых веществ - глюкозы, жировых эмульсий, белковых препаратов).
| 20 - 30 лет | 2,5 |
| 40 - 60 лет (без признаков атеросклероза) | 3,0 - 3,5 |
| у людей с ИБС | больше 4,0 |
- Норма в медицинской практике. Справочное пособие. - М.: МЕДпресс, 2000. - 144 с.
- Данилова Л.А. Анализы крови и мочи. - 2-е изд., перераб и доп. - СПб., ЗАО "Салит" - ООО "Издательство Деан", 1999. - 128 с.
- Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник/ Под ред. С.С. Дебова. - М.: Медицина, 1983, 752 с., ил.
- Инькова А.Н. О чем говорят анализы/ Серия "Медицина для Вас". - Ростов н/Д: "Феникс", 2000. - 96 с.
Выпуск 28
www.gradusnik.ru
Холестерин
Холестерин
Холестерин или холестерол – это стероид, характерный только для животных организмов. Относится к классу стеринов (стерилов). Для стеринов характерно наличие гидроксильной группы в положении 3, а также боковой цепи в положении 17. У холестерина – все кольца находятся в транс-положении; кроме того, он имеет двойную связь между 5-м и 6-м углеродными атомами. Следовательно, холестерин является ненасыщенным спиртом:
Ядро, образованное гидрированным фенантреном (кольца А, В и С) и циклопентаном (кольцо D). Циклопентанпергидрофенантрен (общая структурная основа стероидов)
Кольцевая структура холестерина отличается значительной жесткостью, тогда как боковая цепь – относительной подвижностью. Итак, холестерин содержит спиртовую гидроксильную группу при С-3 и разветвленную алифатическую цепь из 8 атомов углерода при С-17. Химическое название холестерина 3-гидрокси-5,6-холестен. Гидроксильная группа при С-3 может быть этерифицирована высшей жирной кислотой, при этом образуются эфиры холестерина (холестериды)
В печени синтезируется более 50% холестерола, в тонком кишечнике - 15- 20%, остальной холестерол синтезируется в коже, коре надпочечников, половых железах. В цитоплазме холестерин находится преимущественно в виде эфиров с жирными кислотами, образующих вакуоли. В плазме крови как неэтерифицированный, так и этерифицированный холестерин транспортируется в составе липопротеинов. В сутки в организме синтезируется около 1 г холестерола; с пищей поступает 300-500 мг. Он является компонентом клеточных мембран, предшественником при синтезе желчных кислот, стероидных гормонов, витамина D.
История открытия. В 1769 году Пулетье де ла Сальполучил изжелчных камнейплотное белое вещество («жировоск»), обладавшее свойствамижиров. В чистом виде холестерин был выделен химиком, членом национального Конвента и министром просвещенияАнтуаном Фуркруав 1789 году. В 1815 годуМишель Шеврёль, тоже выделивший это соединение, назвал его холестерином («холе» — желчь, «стерин» — жирный). В 1859 годуМарселен Бертлодоказал, что холестерин принадлежит к классу спиртов, после чего французы переименовали холестерин в «холестерол». В ряде языков (русском, немецком, венгерском и др.) сохранилось старое название — холестерин.
Синтез холестерина начинается с ацетил-КоА. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе (1) из трех молекул ацетил-КоА образуется мевалонат (С6). На втором этапе (2) мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе (3) шесть молекул изопрена полимеризуются с образованием сквалена (С30). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин (4). На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
1. Образование мевалоната. Превращение ацетил-КоА в ацетоацетил-КоА и затем в З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза кетоновых тел (подробно см. рис. 305), однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину (см. ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина. Например, фосфорилированная редуктаза представляет собой неактивную форму фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2. Образование изопентенилдифосфата. Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат, который и является тем структурным элементом, из которого строятся все изопреноиды.
3. Образование сквалена. Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С5-молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу «голова к голове» образуется сквален. Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов, таких, как долихол и убихинон.
4. Образование холестерина. Сквален, линейный изопреноид, циклизуется с потреблением кислорода в ланостерин, С30-стерин, от которого на последующих стадиях, катализируемых цитохромом Р450, отщепляются три метильные группы, вследствие чего образуется конечный продукт — холестерин. Описанный путь биосинтеза локализован в гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении производных кофермента А и энергетически богатых фосфатов. Восстановителем при образовании мевалоната и сквалена, а также на последних стадиях биосинтеза холестерина является НАДФН + Η+. Для этого пути характерно то, что промежуточные метаболиты можно подразделить на три группы: производные кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до холестерина), связанные с переносчиками стеринов. 
. 
Этерификация холестерола. В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул - эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА: холестеролаиилтрансферазой). Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин: холестеролацилтрансфераза). Эфиры холестерола - форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров.
Используемая литература
Березов. Коровкин.
Северин
http://www.xumuk.ru/biochem/174.html
http://biokhimija.ru/lipidny-obmen/cholesterin.html
http://ru.wikipedia.org/wiki/%D0%A5%D0%BE%D0%BB%D0%B5%D1%81%D1%82%D0%B5%D1%80%D0%B8%D0%BD
studfiles.net
Эфиры холестерина биохимия - Про холестерин
Регуляция синтеза холестерина и холестерола
- Стабилизирует уровень сахара надолго
- Восстанавливает выработку инсулина поджелудочной железой
Узнать больше…
Холестерол является жизненно необходимым веществом, которое участвует в липидном обмене и синтезирует не один гормон. Он есть в составе практически во всех клетках. Широко известное название вещества – холестерин.
Первичное наименование ему присвоили в 1859 году, когда ученые выяснили, что вещество − спирт. Организмом он синтезируется в большей мере самостоятельно, а меньшая часть поступает с пищей. Важно, чтобы питание было способствующим его синтезу.
Часто встречается нарушение нормы содержания холестерина. Это случается в силу разных причин, но чаще это возникает из-за погрешностей в питании. Это явление негативно влияет на здоровье и становится причиной серьезных болезней.
В общем липопротеины в нормальном количестве могут выполнять такие функции:
- составляют основу клеточных мембран;
- участвуют в синтезе гормонов;
- помогают синтезу витамина Д;
- участвуют в метаболизме;
- участвуют в образовании желчи;
- входят в состав веществ нервных клеток;
- участвуют в синтезе серотонина;
- укрепляют иммунитет;
- обеспечивают нормальное состояние центральной нервной системы.
Главное, чтобы синтез холестерола всегда был в норме. Нарушение этого процесса сулит дисбалансом всех систем организма. Чтобы знать, как уберечься от последствий, нужно узнать, как происходит регуляция синтеза холестерина и ее механизм.
Как образовывается холестерин?
Синтез экзогенного (внутреннего) холестерина можно наблюдать во всех тканях.
Основная часть процессов происходит в печени.
Исходное его соединение называется Ацетил-Коа.
Биосинтез холестерина происходит по такой схеме:
- Образовывается мавалоновая кислота.
- Кислота превращается в активный изопрен, из которого синтезируется сквален.
- Происходит превращение сквалена в стерол.
 За одни сутки может образоваться примерно 1 грамм стероида. Химическая формула вещества — C27h55OH. Эта реакция происходит при участии около 30 ферментов, которые выступают катализаторами, находящиеся в клеточной цитоплазме. Некоторое количество вещества превращается в эфиры, соединяя между собой жирные кислоты, потом происходит катаболизм холестерина. Соединения образовываются в надпочечниках, печени, в половых железах. Позже образованное вещество станет участвовать в синтезе гормонов, образовании желчи.
За одни сутки может образоваться примерно 1 грамм стероида. Химическая формула вещества — C27h55OH. Эта реакция происходит при участии около 30 ферментов, которые выступают катализаторами, находящиеся в клеточной цитоплазме. Некоторое количество вещества превращается в эфиры, соединяя между собой жирные кислоты, потом происходит катаболизм холестерина. Соединения образовываются в надпочечниках, печени, в половых железах. Позже образованное вещество станет участвовать в синтезе гормонов, образовании желчи.
Существует другой вид холестерина – экзогенный. Он попадает в организм с едой, в основном с продуктами, в которых имеются животные жиры. Распад эфиров холестерола будет происходить с помощью фермента – «холестеролестераза». Жирные кислоты, образовавшиеся в результате этого, попадают в клетки тонкого кишечника и всасываются в кровь, после чего попадают в печень.
Вещество транспортируется по тканям с помощью специальных белков – липопротеинов. Они бывают трех видов:
- Липопротеины низкой плотности (ЛПНП) – вредные для здоровья. Вещество транспортируется в ткани, а его избыток способен оседать на стенках сосудов, образовывая холестериновые бляшки. Этот процесс провоцирует возникновение атеросклероза.
- Липопротеины очень низкой плотности (ЛПОНП). Занимаются транспортировкой триглицеридов и других соединений. Этот тип является наиболее опасными из всех, ведь способен вызвать склероз.
- Липопротеины высокой плотности (ЛПВП). Является полезным соединением, которое способно поглотить жировые излишки и перенести их к печени. Занимаются устранением вредного холестерина и тормозить развитие атеросклероза.
Для здоровья организма важен баланс этих видов соединений. При обследовании обращают внимание на общий уровень холестерина. Отклонение от нормы свидетельствует о проблемах со здоровьем. На показатели общего холестерина влияет:
- степень активности образования вещества в печени;
- степень скорости всасывания вещества тонкой кишкой;
- метаболизм через липопротеины;
- активность вывода холестерина через желчные кислоты.
Для каждого человека своя норма холестерола. Она зависит от пола, возраста. Стоит отметить, что у мужского пола с возрастом количество вещества может увеличиваться, а у женского, наоборот – уменьшаться.
Дисбаланс холестерина в организме
Недостаток холестерина влечет последствия.
Хотя такая патология случается гораздо реже, чем повышение, но она не менее опасна.
Рекомендуется следить за рационом и образом жизни.
Низкие показатели холестерола приводят к:
- Разным инфекциям.
- Сердечной недостаточности.
- Туберкулезу легких.
- Раку печени.
- Инсульту.
- Психическим нарушениям.
- Сепсису.
- Анемии.
- Гипертиреозу.
 У мужчин эта патология провоцирует сексуальную дисфункцию, у женщин под ее влиянием возникает аменорея.
У мужчин эта патология провоцирует сексуальную дисфункцию, у женщин под ее влиянием возникает аменорея.
Если патология развивается в период вынашивания ребенка, существует опасность нарушения развития плода. У новорожденных малышей часто наблюдается рахит.
Если общее количество вещества повышается, вероятность развития болезней также велика.
Длительный период повышенного холестерина может стать причиной:
- стенокардии;
- ишемической болезни сердца;
- инфаркта при диабете;
- инсульта;
- эндартериита;
- гипертензии.
Опасность в том, что нарушение практически не имеет своих ярко выраженных симптомов. Поэтому важно регулярно проходить медицинское обследование, или измерять его показатели в домашних условиях.
Без своевременного лечения заболевания такого рода могут привести к инвалидности и летальному исходу.
Почему нарушается уровень холестерина?
 Повышение уровня холестерина возникает, когда нарушен обмен веществ, поэтому этот процесс требует особого внимания.
Повышение уровня холестерина возникает, когда нарушен обмен веществ, поэтому этот процесс требует особого внимания.
Научное название патологии – гиперлипидемия.
Это состояние свидетельствует о том, что в организме большое количество ЛПНП.
В основном, он повышается из-за:
- Пассивного образа жизни.
- Лишнего веса.
- Неправильного питания.
- Генетической склонности.
- Сахарного диабета 2 типа.
- Болезней соединительных тканей.
- Злоупотребления спиртными напитками.
- Курения.
- Постоянных стрессов.
- Приема некоторых медикаментов.
- Пожилого возраста.
Низкие показатели возникают в силу других причин. Также существуют факторы, которые снижают его катаболизм: нарушение работы щитовидной железы и наличие заболеваний печени. Особенно проявляется он в случае полного исключения из пищи жиров, при приеме некоторых препаратов. Также есть ряд других причин, среди которых строгие диеты; длительное голодание; наличие острых инфекций; туберкулез легких; сердечные болезни.
Для того чтобы избежать патологий нужно сдавать анализы на липопротеины, также исследуется биохимия крови. Биохимическое исследование позволит выявить даже малейшие нарушения в крови, определить в каком состоянии находится гормональный фон: тиреоидные, половые гормонов. Желательно исследовать состояние организма систематически. Показаниями к исследованию может выступить:
- Склонность к ожирению, или наличие лишнего веса.
- Профилактика атеросклероза, или наличие его в анамнезе.
- Заболевания сосудов.
- Болезни печени, почек.
- Сахарный диабет.
Перед процедурой желательно не есть за 12 часов. Анализ проводится на голодный желудок. Для того чтобы липопротеины были в норме нужно исключить риски.
Следует убрать из рациона продукты, содержащие ЛПНП, увеличить потребление овощей и фруктов, регулировать употребление кондитерских изделий и конфет, заменить сливочное масло растительными.
Регуляция холестерина может осуществиться самостоятельно, главное – исключить из жизни вредные привычки и начать побольше двигаться, тогда здоровье всегда будет в норме.
Как происходит синтез и транспорт холестерола в организме рассказано в видео в этой статье.
- Стабилизирует уровень сахара надолго
- Восстанавливает выработку инсулина поджелудочной железой
Узнать больше…
dieta.holesterin-lechenie.ru
- холестерин - Биохимия
Холестерин — одноатомный спирт, в молекуле которого имеется ядро циклопентанпергидрофенатрена. Он является компонентом клеточных мембран, предшественником при синтезе желчных кислот, стероидных гормонов (глюкокортикоидов, альдостерона, половых гормонов), витамина D, обнаруживается во всех тканях и жидкостях организма как в свободном состоянии, так и в виде эфиров с жирными кислотами, преимущественно с линолевой (около 10% всего холестерина). Синтез холестерина происходит во всех клетках организма. Основными транспортными формами в крови являются α‑, β‑ и преβ‑липопротеины (или, соответственно, липопротеины высокой, низкой и очень низкой плотности). В плазме крови холестерин находится главным образом в форме сложных эфиров (60‑70%). Эфиры образуются либо в клетках в реакции катализируемой ацил-КоA-холестерин-ацилтрансферазой, использующей в качестве субстрата ацил‑КоA, либо в плазме в результате работы фермента лецитин-холестерин-ацилтрансферазы, осуществляющей перенос жирной кислоты со второго атома углерода фосфатидилхолина на гидроксильную группу холестерина. В плазме крови главными источниками холестерина и фосфатидилхолина для реакции служат липопротеины высокой и низкой плотности, этим путем образуется большая часть эфиров холестерина плазмы.
Для определения содержания холестерина в крови используют следующие методы:
- Титрометрические.
- Гравиметрические.
- Нефелометрические.
- Тонкослойная и газожидкостная хроматография.
- Полярографические методы, позволяют определять общий и свободный холестерин в присутствии ферментов холестеролоксидаз и холестеролэстераз.
- Флюориметрия по реакции с о‑фталевым альдегидом и другими реактивами.
- Ферментативные методы — определение протекает в одной пробирке, но в несколько этапов: ферментативный гидролиз эфиров холестерина, окисление холестерина кислородом воздуха с образованием холест‑4‑ен‑3‑ола и перекиси водорода. В качестве ферментов применяются холестеролоксидаза, холестеролэстераза, пероксидаза, каталаза. Ход реакции можно регистрировать:
- спектрофотометрически по накоплению холестенола.
- по убыли кислорода в среде.
- по изменению окраски раствора, в качестве хромогенов — индикаторов протекания реакций — используются 4‑гидроксибензоат, 4‑аминофеназон, 4‑аминоантипирин.
Все эти методы весьма специфичны и хорошо воспроизводимы.
- Колориметрические методы, в основе которых лежат следующие цветные реакции:
- реакция Биоля‑Крофта с использованием персульфата калия, уксусной и серной кислоты и с появлением красного окрашивания.
- реакция Ригли, базирующаяся на взаимодействии холестерина с реактивом, в составе которого имеются метанол и серная кислота.
- реакция Чугаева, в которой появляется красное окрашивание после реакции холестерина с ацетилхлоридом и хлористым цинком.
- реакция Либермана‑Бурхарда, при которой холестерин окисляется в сильно кислой абсолютно безводной среде с образованием сопряженных двойных связей. В результате образуется соединение холестагексаена с концентрированной серной кислотой изумрудно‑зеленого цвета с максимумом абсорбции при 410 и 610 нм. Особенностью этой реакции является отсутствие стабильности окрашивания. В литературе можно встретить разное соотношение ингредиентов в реактиве Либерман-Бурхарда: чем выше содержание уксусного ангидрида, тем с большей скоростью протекает реакция. Протеканию реакции способствуют сульфосалициловая, паратолуенсульфоновая, диметилбензол‑сульфоновая кислоты. С эфирами холестерина реакция идет медленнее, чем со свободным холестерином, скорость возрастает при повышении температуры, свет оказывает разрушающее воздействие на продукты реакции. Все методы, основанные на реакции Либерман-Бурхарда, подразделяются на прямые и непрямые:
| ◊ к непрямым относятся методы Энгельгарда‑Смирновой, Раппопорта‑Энгельберга, Абеля и заключаются в предварительной экстракции холестерина из сыворотки с последующим определением его концентрации. Из этой группы методов наиболее известен метод Абеля с экстракцией свободного и этерифицированного холестерина изопропанолом или петролейным эфиром, гидролизом эфиров холестерина и последующей реакцией Либерман-Бурхарда. Методы этой группы более воспроизводимы и специфичны; |
| ◊ в прямых методах (Илька, Мрскоса‑Товарека, Златкис‑Зака) холестерин предварительно не экстрагируется, а цветная реакция осуществляется непосредственно с сывороткой. Выявлено, что определение концентрации холестерина по Ильку при сравнении с методом Абеля дает более высокие (по разным авторам на 6%, на 10‑15%) значения, что необходимо учитывать при типировании гиперлипопротеинемий. |
- реакция Калиани‑Златкиса‑Зака, заключающаяся в появлении красно‑фиолетового окрашивания раствора при окислении холестерина хлорным железом в уксусной и концентрированной серной кислотах. Эта реакция в 4‑5 раз чувствительнее, чем реакция Либерман‑Бурхарда, но менее специфична.
Унифицированными методами являются колориметрические методы Илька и Калиани-Златкис-Зака.
Определение содержания общего холестерина в сыворотке крови методом Илька
Принцип
Основан на реакции Либерман‑Бурхарда: в сильно кислой среде в присутствии уксусного ангидрида происходит дегидратация холестерина с образованием окрашенного в зеленовато‑синий цвет бисхолестадиенилмоносульфоновой кислоты.
Нормальные величины
| Сыворотка (указанный метод) | 0 ‑ 1 год | 1.81‑4.53 ммоль/л |
| до 20 лет | 3.10‑5.80 ммоль/л | |
| 20 ‑ 29 | 3.40‑5.80 ммоль/л | |
| 30 ‑ 39 | 3.70‑6.20 ммоль/л | |
| 40 ‑ 49 | 3.70‑6.80 ммоль/л | |
| 50 ‑ 59 | 4.10‑7.30 ммоль/л | |
| 60 ‑ 69 | 4.20‑7.40 ммоль/л |
Определение количества общего холестерина в сыворотке крови методом Златкис‑Зака
Принцип
Свободный и эфирносвязанный холестерин окисляется хлорным железом в присутствии уксусной, серной и фосфорной кислот с образованием ненасыщенных продуктов, окрашенных в фиолето‑красный цвет.
Нормальные величины
| Сыворотка (указанный метод) | 3,1‑6,5 ммоль/л |
Определение содержания общего холестерина ферментативным методом по набору "Новохол"
Принцип
Основан на использовании сопряженных ферментативных реакций, катализируемых: 1) холестеролэстеразой, катализируещей гидролиз эфиров холестерина до свободного холестерина; 2) холестеролоксидазой, катализирующей превращение холестерина в холестенон с образованием перекиси водорода; 3) пероксидазой, катализирующей в присутствии фенола окисление перекисью водорода 4‑аминоантипирина с образованием окрашенного продукта розово‑малинового цвета.
Нормальные величины
| Сыворотка(указанный метод) | 20‑29 лет | 3,70‑6,51 ммоль/л |
| 30‑39 лет | 4,25‑7,04 ммоль/л | |
| 40‑49 лет | 4,37‑7,70 ммоль/л | |
| старше 50 лет | 4,55‑8,24 ммоль/л | |
| Спинномозговая жидкость | 0‑0,013 ммоль/л | |
| Слюна | 0,065‑0,233 ммоль/л | |
| Желчь | печеночная | 2,1‑5,4 ммоль/л |
| пузырная | в среднем 11,1 ммоль/л | |
Влияющие факторы
Завышение результатов при колориметрических методах исследования происходит при высоком содержании в пробе билирубина, гемоглобина, витамина A; при ферментативном методе — оксикортикостероидов и применении антикоагулянтов (фторидов, оксалатов).
Клинико‑диагностическое значение
Сыворотка
Существенное повышение содержания холестерина отмечается при гиперлипопротеинемии IIa типа (семейная гиперхолестеринемия), IIb и III типа (полигенная гиперхолестеринемия, семейная комбинированная гиперлипидемия), умеренное повышение наблюдается при гиперлипопротеинемии I, IV, V типа, а также заболеваниях печени (внутри‑ и внепеченочный холестаз), заболеваниях почек, злокачественных опухолях поджелудочной железы, гипотиреозе, заболеваниях сердечно‑сосудистой системы, беременности, сахарном диабете.
Снижение выявляется при гипертиреозе, циррозе печени, злокачественных опухолях печени, гипопротеинемии и аb‑липопротеинемии.
Спинномозговая жидкость
Накопление холестерина выявляется при менингите, опухоли или абсцессе мозга, кровоизлияниях в мозг, при рассеяном склерозе.
Снижение значений обнаруживается при церебральной и кортикальной атрофии.
Определение концентрации свободного иэтерифицированного холестерина в сыворотке крови
Свободный холестерин способен образовывать с дигитонином, томатином, пиридинсульфатом труднорастворимые соединения. Чаще всего применяют водно‑спиртовый или изопропаноловый раствор дигитонина.
Принцип
Холестерин экстрагируют из сыворотки с помощью изопропилового спирта, экстракт делят на две части, в одной определяют содержание общего холестерина. В другой порции экстракта свободный холестерин осаждают дигитонином, супернатант отбрасывают, а осадок растворяют и определяют содержание свободного холестерина любым методом. Содержание этерифицированного холестерина рассчитывают как разницу между общим и свободным.
Нормальные величины
| Сыворотка | фракция этерифицированного холестерина составляет 60‑80% от общего |
Клинико‑диагностическое значение
Коэффициент этерификации холестерина является важной функциональной пробой печени. Снижение коэффициента пропорционально снижению функции печени: острый и обострения хронического гепатита, механическая желтуха, цирроз печени. Степень этерификации также зависит от активности сывороточного фермента лецитин-холестерин-ацил-трансферазы, поэтому хранение пробы при комнатной температуре может изменить соотношение между свободной и этерифицированной фракцией холестерина.
Определение содержания α‑холестерина
Принцип
Разделение α‑ и β‑липопротеинов основано на избирательной способности липопротеинов очень низкой и низкой плотности образовывать нерастворимые комплексы с гепарином в присутствии двухвалентных катионов Mn2+. Липопротеины высокой плотности при этом остаются в надосадке, где определяют содержание α‑холестерина любым способом.
Определение α‑холестерина используется для расчета индекса атерогенности:
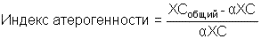
Нормальные величины
| α‑Холестерин | ||
| Сыворотка | 0,9‑1,9 ммоль/л | |
| Индекс атерогенности | ||
| Сыворотка | новорожденные | < 1.0 |
| 20-30 лет | 2.0‑2.8 | |
| больше 30 лет | 3.0‑3.5 | |
Клинико‑диагностическое значение
Возрастание концентрации α‑холестерина клинически не значимо, наблюдается при доброкачественных состояниях. Снижение содержания α‑холестерина свидетельствует об угрозе атеросклероза.
Возрастание индекса атерогенности до 4 и более наблюдается при ишемической болезни сердца и атеросклерозе.
Вы можете спросить или оставить свое мнение.
biokhimija.ru
Регуляция синтеза холестерина
Глава 10. Обмен и функция липидов | 315 |
которых образуется около 10 % всего холестерина организма; еще примерно 5 % добавляют клетки кожи. Общее количество холестерина, синтезируемого в орга низме человека за сутки, составляет 1,3 г.
Скорость синтеза холестерина регулируется довольно сложным аппаратом. Основ ным пунктом регуляции является реакция образования мевалоновой кислоты — первая специфическая реакция в пути синтеза холестерина (рис. 10.30). Существу ет три механизма регуляции:
I.Аллостерическая регуляция по механизму отрицательной обратной связи: холестерин, а в печени — и желчные кислоты ингибируют ГМГ-КоА-редук-тазу (см. рис. 10.30,I).
|
| Н,РО, | h2O |
| ГМГ-КоА | ГМГ-КоА- | ГМГ-КоА- |
| - I r | ||
| редуктаза-ОН | S редуктаза-Р | |
| (активная) | (неактивная) | |
| Мевзал(онат |
|
|
© | \ | АТФ | АДФ |
у | мРНК |
| |
— Холестеринi |
|
| |
| -----© |
| |
|
| 2 |
|
ген ГМГ-КоА-редуктазы
Рис. 10.30. Регуляция синтеза холестерина
2.Репрессия синтеза ГМГ-КоА-редуктазыхолестерином — тоже механизм от рицательной обратной связи (см. рис. 10.30, 2). При содержании2-3г холе стерина в суточной пище человека синтез собственного холестерина почти полностью прекращается.
3.Регуляция путем фосфорилирования-дефосфорилированияГМГ-КоА-редук-тазы; активна нефосфорилированная форма (рис. 10.30,3). Фосфорилиро вание (инактивация) включается присоединением глюкагона к его рецеп тору на клеточной поверхности, а дефосфорилирование (активация) — сигналом инсулина и его рецептора. Этот механизм представляет собой сложный каскад реакций. Таким образом, скорость синтеза холестерина из меняется при смене абсорбтивного и постабсорбтивного состояний, по скольку в регуляции задействованы инсулин и глюкагон.
Обмен эфиров холестерина
Фонд холестерина содержит свободный холестерин и эфиры холестерина, кото рые имеются и в клетках, и в липопротеинах крови.
3 1 6 | Часть II. Обмен веществ и энергии |
В клетках этерификация холестерина происходит при действии ацил-КоА-хо-лестерин-ацилтрансферазы(АХАТ):
Ацил-КоА+ Холестерин-*HS-KoA+ Ацилхолестерин
В клетках человека, в основном, образуется линолеилхолестерин. В отличие от свободного холестерина, его эфиры в клеточных мембранах содержатся в очень небольших количествах и находятся главным образом в цитозоле в составе липид ных капель. Образование эфиров можно рассматривать, с одной стороны, как ме ханизм удаления из мембран избыточного холестерина, а с другой стороны — как механизм запасания холестерина в клетке. Мобилизация запасов происходит при участии ферментов эстераз, гидролизующих эфиры холестерина:
Ацилхолестерин + H 2O -*Ж ирная кислота + Холестерин
Синтез и гидролиз эфиров происходят во многих клетках, но особенно актив но в клетках коры надпочечников: в этих клетках до 80 % всего холестерина пред ставлено эфирами, в то время как в других клетках обычно меньше 20%.
В липонротеинах крови образование эфиров происходит при участии леци- тин-холестерин-ацилтрансферазы(ЛХАТ), катализирующей перенос ацильного остатка из(i-положениялецитина на холестерин (рис. 10.31). ЛХАТ образуется в печени, секретируется в кровь и присоединяется к липопротеинам. Скорость этерификации для разных липопротеинов существенно различна и зависит от нали чия аполипопротеинов, активирующих ЛХАТ (главным образомапо-АТ,а такжеC-I)или ингибирующих(C-II)этот фермент. Наиболее активна ЛХАТ в ЛВП, в которой на долюапо-АТприходится более 2/ 3 от всех белков. В наибольших коли чествах образуются эфиры олеиновой и линолевой кислот. В других липопротеинах образование эфиров происходит с меньшей скоростью, чем в ЛВП.
Холестерин
А
Олеилхолестерин
Рис. 10.31. Образование эфиров холестерина при действии ЛХАТ
ЛХАТ локализована в поверхностном слое ЛВП и использует в качестве суб страта холестерин, находящийся в фосфолипидном монослое. Образующиеся здесь эфиры холестерина в силу своей полной гидрофобности плохо удерживаются в
Глава 10. Обмен и функция липидов | 3 1 7 |
фосфолипидном монослое и погружаются в липидное ядро липопротеина. При этом в фосфолипидном монослое освобождается место для холестерина, которое может быть заполнено холестерином из клеточных мембран или из других липоп ротеинов. Таким образом, ЛВП в результате действия ЛХАТ оказываются ловуш кой холестерина.
Синтез желчных кислот
В печени часть холестерина превращается в желчные кислоты. Ж елчные кисло ты можно рассматривать как производные холановой кислоты (рис. 10.32).
Холановая кислота как таковая в организме не образуется. В гепатоцитах из холестерина получаются непосредственно хенодезоксихолевая и холевая кисло ты — первичные желчные кислоты (рис. 10.33; см. также рис. 10.12).
| Холестерин | ||
| / |
| \ |
Ch4 | / |
| \ |
I | хонодезоксихолевая кислота | холевая кислота | |
CH CHi CHj COOH | (3,7-диоксихолановая)(3,7,12-триоксихолаиовая) | ||
| литохолевая кислота | дезоксихолевая кислота | |
| (3,-оксихолановая)(3,12-диоксихолановая) | ||
Рис. 10.32. Холановая кислота | Рис. 10.33. Образование желчных кислот | ||
Их образование включает реакции введения гидроксильных групп при участии гидроксилаз и реакции частичного окисления боковой цепи холестерина.
После выделения желчи в кишечник при действии ферментов кишечной фло ры из первичных желчных кислот образуются литохолевая и дезоксихолевая кис лоты — вторичные желчные кислоты. Они всасываются из кишечника, с кровью воротной вены попадают в печень, а затем в желчь. Следует отметить, что микро организмы кишечника образуют около 20 разных вторичных желчных кислот, но всасываются в заметных количествах только дезоксихолевая и, в меньшей мере, литохолевая кислоты; остальные выводятся с калом.
Вжелчи содержатся главным образом конъюгированные желчные кислоты,
т.е. их соединения с глицином или таурином. Боковая цепь с остатком глицина или таурина гидрофильна, в то время как другой конец молекулы (циклическая группировка) гидрофобный. Амфифильная природа желчных кислот обусловли вает их поверхностно-активныесвойства, участие в образовании липидных ми целл и в переваривании жиров.
Концентрация желчных кислот в желчи равна примерно I %; в желчи содер жатся также фосфолипиды (главным образом фосфатидилхолины, 0,5 %), холес терин (0,5 %), а также билирубин, белки, минеральные соли. Следует отметить, что концентрация желчи непостоянна: желчь может концентрироваться вслед ствие всасывания воды в желчном пузыре. Непостоянны также и относительные концентрации отдельных компонентов желчи.
3 1 8 | Часть II. Обмен веществ и энергии |
Ж елчные кислоты, холестерин и фосфатидилхолины в пузырной желчи обра зуют смешанные мицеллы. Собственно эти мицеллы, т. е. все их компоненты, а не только желчные кислоты, участвуют в эмульгировании жиров в кишечнике и во всасывании продуктов переваривания жиров.
Энтерогепатическая циркуляция и экскреция желчных кислот и холестерина
Основная часть желчных кислот (90-95%) из полости кишечника всасывается в клетки, с кровью воротной вены попадает в печень и повторно используется при образовании желчи. В результате этого вторичные желчные кислоты, возникшие при участии кишечных микроорганизмов, становятся равноправными функцио нальными компонентами желчи. Ж елчные кислоты проходят энтерогепатический круг5-10раз за сутки.
Небольшая часть желчных кислот — около 0,5 г за сутки — выводится с ка лом. Эта убыль компенсируется синтезом в печени новых желчных кислот в та ком же количестве; фонд желчных кислот обновляется полностью примерно за 10 дней.
Холестерин также выводится в основном через кишечник. В кишечник холес терин поступает из двух источников — с пищей и из печени в составе желчи. В суточном рационе при обычном питании содержится 0,5-1г холестерина; с жел чью поступает около 2 г в сутки. В люмене кишечника холестерин пищи и холес терин желчи образуют смешанный фонд холестерина (холестерин суммарный,
|
|
| рис. 10.34), в котором уже неразличи | |
Печень | Кишечник (люмен) | Экскреция | мо происхождение отдельных молекул. | |
|
|
| Часть холестерина этого фонда всасы | |
Ацетил-КоА | Холестерин пищи |
| вается в кровь, а часть — экскретиру- | |
If | *1 |
| ется с калом. Холестерин, всосавшийся | |
| в кровь, содержит фракцию, происхо | |||
Холестерин | Холестерин |
| дящую из желчи, и фракцию, происхо | |
„ | „ ---► Холестерин | |||
суммарный | суммарный |
| дящую из пищи. Вторая из этих фрак | |
*______ J |
| |||
| ций обозначается как экзогенный холесте | |||
и ( | V ' |
| рин, в отличие от эндогенного холестерина, | |
| синтезированного в печени из ацетил- | |||
Желчные | Желчные ____ ^ | Желчные | ||
KoA. Экскретируемый холестерин тоже | ||||
кислоты | кислоты | кислоты | ||
t____ J |
| включает фракции, происходящие из | ||
|
|
| ||
|
|
| желчи и пищи. | |
Рис. 10.34. Баланс холестерина в организ | Таким образом, пополнение фонда | |||
холестерина обеспечивается двумя пу | ||||
ме: изогнутые стрелки — энтерогепатичес | ||||
| кая циркуляция |
| тями: синтезом холестерина в тканях | |
|
|
| (около I г в сутки) и поступлением из | |
кишечника (около 0,3 г в сутки). Удаление холестерина из тканей происходит тоже двумя путями: путем его окисления в желчные кислоты в печени с после дующей экскрецией желчных кислот с калом (примерно 0,5 г в сутки) и путем экскреции неизмененного холестерина (тоже с калом).
В стационарном состоянии суммарное количество холестерина, поступаю щего в кишечник с пищей, и холестерина, синтезированного в тканях, равно
studfiles.net
холестериды, всасывание холестерина
Переваривание холестеридов и всасывание холестерина. Понятие об экзогенном и эндогенном холестерине.
Холестерин в организме человека бывает 2 видов:
1) холестерин, поступающий с пищей через ЖКТ и называемый экзогенный
2) холестерин, синтезируемый из Ац – КоА - эндогенный.
С пищей ежедневно поступает ≈ 0,2 – 0,5 г, синтезируется ≈ 1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.)
Взаимоотношения экзо и эндогенного холестерина в определенной степени конкурентные – холестерин пищи ингибирует его синтез в печени.
В составе пищи холестерин находится в основном в виде эфиров. Гидролиз эфиров холестерола происходит под действием холестеролэстеразы. Продукты гидролиза всасываются в составе смешанных мицелл.

Всасывание холестерина происходит в основном в тощей кишке (пищевой холестерин всасывается почти полностью – если в пище его не очень много)
Всасывание холестерина осуществляется только после эмульгирования эфиров холестерина. Эмульгаторами являются желчные кислоты, моно- и диглицериды и лизолецитины. Холестериды гидролизуются холестеринэстеразой поджелудочной железы.
Пищевой и эндогенный холестерин находится в просвете кишечника в неэстерифицированной форме в составе сложных мицелл (желчные, жирные кислоты, лизолецитин), причем поступают в состав слизистой кишечника не вся мицелла целиком, а ее отдельные фракции.
Поглощение холестерина из мицелл – пассивный процесс, идущий по градиенту концентрации. Поступивший в клетки слизистой холестерин этерифицируется холестеринэстеразой или АХАТ (у человека это в основном олеиновая кислота). Из клеток слизистой кишечника холестерин поступает в лимфу в составе ХМ, из них он переходит в ЛНП и ЛВП. В лимфе и крови 60-80% всего холестерина находится в этерифицированном виде.
Процесс всасывания холестерина из кишечника зависит от состава пищи: жиры и углеводы способствуют его всасыванию, растительные стероиды (структурные аналоги) блокируют этот процесс. Большое значение принадлежит желчным кислотам (все функции активируют – улучшают эмульгирование, всасывание). Отсюда значение лекарственных веществ, блокирующих всасывание желчных кислот.
Основные этапы синтеза холестерина. Химизм реакции образования мевалоновой кислоты. Ключевой фермент синтеза холестерина. Представьте схематически скваленовый путь синтеза холестерина
Ключевой фермент биосинтеза холестерина — ГМГ-редуктаза
Локализация:печень,кишечник,кожа
Реакции синтеза холестерола происходят в цитозоле клеток. Это один из самых длинных метаболических путей в организме человека.
Источник-ацетил-КоА
1 этап-Образование мевалоната
Две молекулы ацетил-КоА конденсируются ферментом тиолазой с образованием ацетоацетил-КоА.
Фермент гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА).
Следующая реакция, катализируемая ГМГ-КоА-редуктазой, является регуляторной в метаболическом пути синтеза холестерола. В этой реакции происходит восстановление ГМГ-КоА до мевалоната с использованием 2 молекул NADPH. Фермент ГМГ-КоА-редуктаза - гликопротеин, пронизывающий мембрану ЭР, активный центр которого выступает в цитозоль.
2 этап - Образование сквалена
На втором этапе синтеза мевалонат превращается в пятиуглеродную изопреноидную структуру, содержащую пирофосфат - изопентенилпирофосфат. Продукт конденсации 2 изопреновых единиц - геранилпирофосфат. Присоединение ещё 1 изопреновой единицы приводит к образованию фарнезилпирофосфата - соединения, состоящего из 15 углеродных атомов. Две молекулы фарнезилпирофосфата конденсируются с образованием сквалена - углеводорода линейной структуры, состоящего из 30 углеродных атомов.
3 этап - Образование холестерола
На третьем этапе синтеза холестерола сквален через стадию образования эпоксида ферментом циклазой превращается в молекулу ланостерола, содержащую 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол. На последних этапах синтеза от ланостерола отделяется 3 атома углерода, поэтому холестерол содержит 27 углеродных атомов.

Биологическая роль холестерина. Пути использования холестерина в различных тканях. Биосинтез желчных кислот.
Часть холестеринового фонда в организме постоянно окисляется, преобразуясь в различного рода стероидные соединения. Основной путь окисления холестерина - образование желчных кислот. На эти цели уходит от 60 до 80% ежедневно образующегося в организме холестерина. Второй путь - образование стероидных гормонов (половые гормоны, гормоны коры надпочечников и др.). На эти цели уходит всего 2-4% холестерина, образующегося в организме. Третий путь - образование в коже витамина ДЗ под действием ультрафиолетовых лучей.
Еще одним производным холестерина является холестанол. Его роль в организме пока еще не выяснена. Известно лишь, что он активно накапливается в надпочечниках и составляет 16% от всех находящихся там стероидов. С мочой у человека выделяется около 1 мг холестерина в сутки, а со слущивающимся эпителием кожи теряется до 100 мг/сут.
Желчные кислоты являются основным компонентом билиарной секреции, они образуются только в печени. Синтезируются в печени из холестерина.
В организме синтезируется за сутки 200-600 мг желчных кислот. Первая реакция синтеза-образование 7-альфа-гидроксихолестерола-является регуляторной.Фермент-7-альфа-гидроксилаза,ингибируется конечным продуктом-желчными кислотами.7-альфа-гидроксилаза представляет собой одну из форм цитохрома п450 и использует атом кислорода как один из субстратов. Один атом кислорода из О2 включается в гидроксильную группу в 7 положении, а другой восстанавливается до воды. Последующие реакции синтеза приводят к формированию 2 видов желчных кислот:холевой и хондезоксихолевой(первичные желчные кислоты)

Особенности обмена холестерина в организме человека. Роль липопротеинлипазы, печеночной липазы, липопротеинов, ЛХАТ, апопротеинов в транспорте холестерина в крови: альфа- и бета-холестерин, коэффициент атерогенности, АХАТ, накопление холестерина в тканях. Пути распада и выведения холестерина
В организме человека содержится 140-190 г холестерина и около 2 г образуется ежедневно из жиров,углеводов, белков. Чрезмерное поступление холестерина с пищей приводит к отложению его в сосудах и может способствовать развитию атеросклероза, а также нарушению функции печени и развитию желчно-каменной болезни. Ненасыщенные жирные кислоты ( линолевая, линоленовая) затрудняют всасывание холестерина в кишечнике, тем самым способствуя уменьшению его содержания в организме. Насыщенные жирные кислоты (пальмитиновая, стеариновая) являются источником образования холестерина.
Липопротеинлипаза (ЛПЛ) — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе.
Печёночная липаза - один из ферментов липидного метаболизма. Эта липаза по ферментативному действию похожа на панкреатическую липазу. Однако в отличие от панкреатической липазы ПЛ синтезируется в печени и секретируется в кровь. Печёночная липаза после секреции связывается со стенкой сосуда (почти исключительно в печени) и расщепляет липиды липопротеинов.
Печёночная липаза работает в кровотоке в тандеме с липопротеинлипазой. Липопротеинлипаза расщепляет липопротеины, богатые триглицеридами (липопротеины очень низкой плотности и хиломикроны), до их остатков. Остатки липопротеинов являются в свою очередь субстратом для печёночной липазы. Таким образом, в результате действия печёночной липазы образуются атерогенные липопротеины низкой плотности, которые поглощаются печенью.
(ЛВП) - Транспорт холестерина от периферийных тканей к печени
(ЛНП) - Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
ЛПП (ЛСП) - Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
(ЛОНП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
Хиломикроны -Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень
Лецитинхолестеринацилтрансфераза (ЛХАТ)- является ферментом метаболизма липопротеинов. ЛХАТ связан с поверхностью липопротеинов высокой плотности, которые содержат аполипопротеин A1 — активатор этого фермента. Холестерин, превращённый в эфиры холестерина, благодаря высокой гидрофобности перемещается с поверхности липопротеина в ядро, освобождая место на поверхности частицы для захвата нового свободного холестерина. Таким образом, эта реакция является исключительно важной для процесса очищения периферических тканей от холестерина (обратный транспорт холестерина). Частица ЛПВП в результате увеличивается в диаметре или в случае насцентных ЛПВП превращается из дисковидной в сферическую.
Апопротеины формируют структуру липоппротеинов,взаимодействуют с рецепторами на поверхности клеток и таким образом определяют какими тканями будет захватываться данный тип липопротеидов, служат ферментами или активаторами ферментов, действующих на липопротеины.
АХАТ катализирует эстерификацию холестерола . Свободный холестерол выходит в цитоплазму , где ингибирует ГМГ-CoA-редуктазу и de novo синтез холестерола и активирует АХАТ . У человека, однако, из-за низкой активности АХАТ в печени холестерол поступает в плазму в составе ЛПОНП преимущественно в свободном виде.
Нарушение обмена холестерола и холестеридов проявляется прежде всего накоплением их в тканях (кумулятивные холестерозы), особенно в стенке артерий и в коже. Основной причиной накопления холестерола в тканях является недостаточность механизма его обратного транспорта. Ключевым фактором системы обратного транспорта холестерола (с периферии в печень, откуда его излишки удаляются из организма с желчью) являются липопротеины высокой плотности, точнее входящий в их состав белок апопротеин А. Частицы липопротеинов высокой плотности собирают холестерол не только в интерстициальном секторе, но и внутри клеток. У человека (а также высших обезьян и свиней) существует видовая (характерная для всех представителей вида) недостаточность апопротеина А и, соответственно, липопротеинов высокой плотности. Животные с высоким содержанием этих липопротеинов не страдают холестериновым диатезом, даже при постоянном употреблении богатой холестеролом пищи. Некоторые люди также отличаются довольно высокой концентрацией апопротеина А («синдром долголетия»).
Из организма человека ежедневно выводится около 1 г холестерола. Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты . Оставшаяся часть выводится в виде нейтральных стероидов. Большая часть холестерола, поступившего в желчь, реабсорбируется; считается, что по крайней мере часть холестерола, являющегося предшественником фекальных стеролов , поступает из слизистой оболочки кишечника . Основным фекальным стеролом является копростанол , который образуется из холестерола в нижнем отделе кишечник а под действием присутствующей в нем микрофлоры . Значительная доля солей желчных кислот , поступающих с желчью, всасывается в кишечнике и через воротную вену возвращается в печень , где снова поступает в желчь. Этот путь транспорта солей желчных кислот получил название кишечно-печеночной циркуляции . Оставшаяся часть солей желчных кислот, а также их производные выводятся с фекалиями. Под действием кишечных бактерий первичные желчные кислоты превращаются во вторичные.
studfiles.net
Холестерол используется как переносчик полиненасыщенных жирных кислот
Транспорт холестерола и его эфиров осуществляется липопротеинами низкой и высокой плотности.
Липопротеины высокой плотности
Общая характеристика
- образуются в печени de novo, в плазме крови при распаде хиломикронов, некоторое количество в стенке кишечника,
- в составе частицы примерно половину занимают белки, еще четверть фосфолипиды, остальное холестерин и ТАГ (50% белка, 7% ТАГ, 13% эфиров ХС, 5% свободного ХС, 25% ФЛ),
- основным апобелком является апо А1, содержат апоЕ и апоСII.
Функция
- Транспорт свободного ХС от тканей к печени.
- Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов.
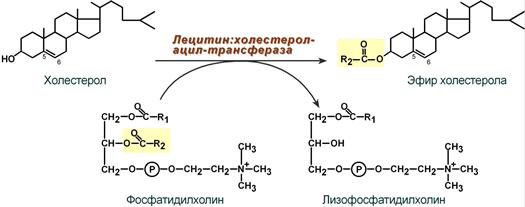
Метаболизм
1. Синтезированный в печени ЛПВП (насцентный или первичный) содержит в основном фосфолипиды и апобелки. Остальные липидные компоненты накапливаются в нем по мере метаболизма в плазме крови.
2-3. В плазме крови насцентный ЛПВП переходит в ЛПВП3 (условно его можно назвать "зрелый") и тесно взаимодействует с ЛПНП и ЛПОНП. Получая от них свободный холестерин, ЛПВП3 в обмен отдают эфиры ХС, образованные благодаря переносу жирной кислоты от фосфатидилхолина на холестерин.
Внутри ЛПВП активно протекает реакция при участии лецитин:холестерол-ацилтрансферазы (ЛХАТ-реакция). В этой реакции остаток полиненасыщенной жирной кислоты переносится от ФХ на свободный ХС с образованием лизофосфатидилхолина (лФХ) и эфиров ХС. Лизофосфатидилхолин остается внутри ЛПВП, эфир холестерина отправляется в ЛПНП.
 Реакция этерификации холестерола при участии лецитин:холестерол-ацилтрансферазы
Реакция этерификации холестерола при участии лецитин:холестерол-ацилтрансферазы 4. Взаимодействуя с ЛПОНП и ХМ, ЛПВП получают МАГ и ДАГ и отдают им апоЕ- и апоСII-белки.
5. При непосредственном контакте с клеточными мембранами или при участии специфических транспортных белков получают от них свободный ХС.
6. Взаимодействует с мембранами клеток, отдает часть фосфолипидной оболочки, доставляя таким образом полиеновые жирные кислоты в клетки.
7. Накопление свободного ХС, МАГ и ДАГ, лизоФХ и утрата фосфолипидной оболочки преобразует ЛПВП3 в ЛПВП2 (остаточный, ремнантный). Последний захватывается гепатоцитами при помощи апоА-1-рецептора и разрушается.
 Транспорт холестерола и его эфиров в организме
Транспорт холестерола и его эфиров в организме Липопротеины низкой плотности
Общая характеристика
- образуются в гепатоцитах de novo и в сосудистой системе печени под воздействием печеночной ТАГ-липазы из ЛПОНП,
- в составе преобладают холестерол и его эфиры, около половины занимают белки и фосфолипиды (25% белки, 7% триацилглицеролы, 38% эфиров ХС, 8% свободного ХС, 22% фосфолипидов),
- основным апобелком является апоВ-100,
- нормальное содержание в крови 3,2-4,5 г/л,
- самые атерогенные.
Функция
1. Транспорт холестерола в клетки, использующие его для реакций синтеза половых гормонов (половые железы), глюкокортикоидов и минералокортикоидов (кора надпочечников), холекальциферола (кожа), утилизирующие ХС в виде желчных кислот (печень).
2. Транспорт полиеновых жирных кислот в виде эфиров ХС в некоторые клетки рыхлой соединительной ткани (фибробласты, тромбоциты, эндотелий, гладкомышечные клетки), в эпителий гломерулярной мембраны почек, в клетки костного мозга, в клетки роговицы глаз, в нейроциты, в базофилы аденогипофиза.
Особенностью всех этих клеток является наличие лизосомальных кислых гидролаз, расщепляющих эфиры ХС. У других клеток таких ферментов нет.
Клетки рыхлой соединительной ткани активно синтезируют эйкозаноиды. Поэтому им необходим постоянный приток полиненасыщенных жирных кислот (ПНЖК), что осуществляется либо переходом фосфолипидов от оболочки ЛПВП в мембраны клеток, либо поглощением ЛПНП, которые несут ПНЖК в составе эфиров холестерола.
Обмен
1. В крови первичные ЛПНП взаимодействуют с ЛПВП, отдавая свободный ХС и получая этерифицированный. В результате в них происходит накопление эфиров ХС, увеличение гидрофобного ядра и "выталкивание" белка апоВ-100 на поверхность частицы. Таким образом, первичный ЛПНП переходит в зрелый.
2. На всех клетках, использующих ЛПНП, имеется высокоафинный рецептор, специфичный к ЛПНП – апоВ-100-рецептор. При взаимодействии ЛПНП с рецептором происходит эндоцитоз липопротеина и его лизосомальный распад на составные части – фосфолипиды, белки (и далее до аминокислот), глицерол, жирные кислоты, холестерол и его эфиры.
- ХС превращается в гормоны или включается в состав мембран,
- излишки мембранного ХС удаляются с помощью ЛПВП,
- принесенные с эфирами ХС ПНЖК используются для синтеза эйкозаноидов или фосфолипидов.
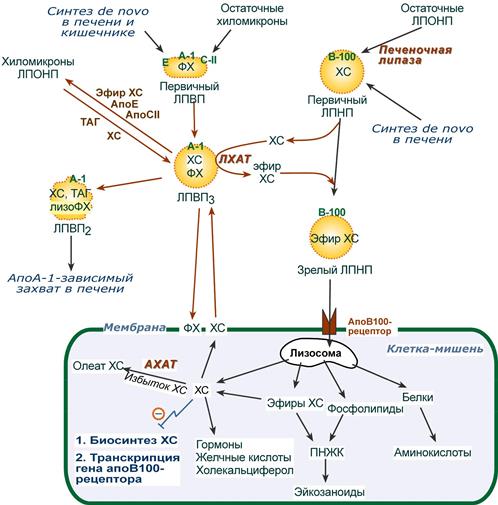
- при невозможности удалить ХС часть его этерифицируется с олеиновой кислотой ферментом ацил-SКоА:холестерол-ацилтрансферазой (АХАТ),
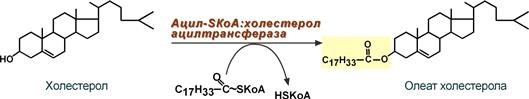 Синтез олеата холестерола при участии ацил-SKoA-холестерол-ацил-трансферазы
Синтез олеата холестерола при участии ацил-SKoA-холестерол-ацил-трансферазы 3. Около 50% ЛПНП взаимодействуют с апоВ-100-рецепторами гепатоцитов и примерно столько же поглощаются клетками других тканей.
Вы можете спросить или оставить свое мнение.
biokhimija.ru



















