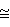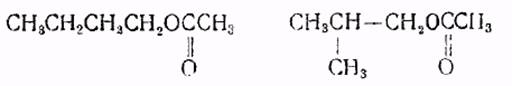Способ получения эпоксидированных сложных эфиров. Эпоксидированный эфир
Эпоксидированный эфир - Большая Энциклопедия Нефти и Газа, статья, страница 2
Эпоксидированный эфир
Cтраница 2
В нашей лаборатории разработаны методы получения следующих эпоксидированных пластификаторов: дибутил - и ди - ( 2-этилгексил) - 4 5-эпоксигексагидрофталатов 16; диалкиллактатов-4 5-эпоксигекса-гидрофталатов 17, а также бутил - и 2-этилгексиловых эпоксидированных эфиров жирных кислот таллового масла, представляющих собой смесь в основном олеиновой, линолевой и линоленовой кислот. Эпоксидирование проводили надуксусной кислотой ( в момент ее образования из 30 % - ной перекиси водорода и уксусной кислоты) в присутствии кислого катализатора и стабилизатора. [16]
Эпоксидированные кислоты таллового масла, этерифицированные пропиленгликолем, не оказывают такого эффективного действия и на морозостойкость поливинилхлоридных пленок состава 70: 30, как изоок-тилэпоксиолеат. Эпоксидированный эфир пентаэритрита может найти специальное применение вследствие присущей ему стойкости к мыльной воде и минеральному маслу. Он значительно менее склонен к миграции в покрытиях из нитрата целлюлозы, чем линейные моноэфиры или гликоле-вые эфиры эпоксидированных жирных кислот. [17]
Длинноцепные эпоксисоединения с эпокси-группой в середине цепи, например алкил-9 10-эпоксистеарат, являются более эффективными стабилизаторами и пластификаторами, чем соединения с эпоксигруппами, расположенными на концах коротких цепей. Присутствие гидроксильных или карбоксильных групп в эпоксидированных эфирах приводит к резкому снижению совместимости с полимером. При исчерпывающем эпоксидировании и последующем восстановлении остаточной ненасыщенности совместимость с ПВХ улучшается. [19]
При отверждении ангидридами поликарбоновых кислот продуктов для эпоксидных смол, содержащих более чем одну эпоксидную группу, расположенную не в конце цепи, в качестве активаторов рекомендуется 8 также применять амины, их соли и четвертичные соли аммония. В патенте указываются следующие продукты для эпоксидных смол: эпоксидированные эфиры монокарбоновых кислот с несколькими двойными связями, содержащие до 22 атомов углерода ( например, триглицериды соевого масла), эпоксидированные эфиры непредельных поликарбоновых кислот, содержащие до 25 атомов углерода, непредельные эпоксидированные эфиры непредельных спиртов и карбоновых кислот. Далее рассматриваются также эпоксидированные дикротиловые эфиры ароматических дикарбоновых кислот, а также эпоксидированные сополимеры бутадиена. В качестве отвердителей называются прежде всего ангидриды гексагидрофталевой и хлорэндофталевой кислот. [20]
Смешанные эфиры, светлеющие при эпоксидировании, отличаются от других эпоксидированных эфиров жирных кислот очень незначительной миграцией, нерастворимостью в бензине, высших углеводородах, маслах и ворвани. [21]
Авторы установили, что алициклические эпоксисоединения - эффективные стабилизаторы полимера, превосходящие в некоторых случаях эпоксидированное соевое масло. Аналогичные стабилизаторы-пластификаторы поливинилхлорида, представляющие собой эпоксигексагидрофталаты бутилового, гексилового, изо-октилового и некоторых других алифатических спиртов, описаны в работе [254]; для стабилизации хлорсодержащих высокомолекулярных соединений предложены эпоксидированные эфиры 3 4-эпоксицик-логексан - 1 1-диметанола и их алкилзамещенные производные [263], а также 3 4-эпокси - 1 ( или 6) - циклогексилметиловые эфиры 9 10-эпоксистеариновой кислоты или 5 6-эпоксилауриловой кислоты. [22]
При отверждении ангидридами поликарбоновых кислот продуктов для эпоксидных смол, содержащих более чем одну эпоксидную группу, расположенную не в конце цепи, в качестве активаторов рекомендуется 8 также применять амины, их соли и четвертичные соли аммония. В патенте указываются следующие продукты для эпоксидных смол: эпоксидированные эфиры монокарбоновых кислот с несколькими двойными связями, содержащие до 22 атомов углерода ( например, триглицериды соевого масла), эпоксидированные эфиры непредельных поликарбоновых кислот, содержащие до 25 атомов углерода, непредельные эпоксидированные эфиры непредельных спиртов и карбоновых кислот. Далее рассматриваются также эпоксидированные дикротиловые эфиры ароматических дикарбоновых кислот, а также эпоксидированные сополимеры бутадиена. В качестве отвердителей называются прежде всего ангидриды гексагидрофталевой и хлорэндофталевой кислот. [23]
При отверждении ангидридами поликарбоновых кислот продуктов для эпоксидных смол, содержащих более чем одну эпоксидную группу, расположенную не в конце цепи, в качестве активаторов рекомендуется 8 также применять амины, их соли и четвертичные соли аммония. В патенте указываются следующие продукты для эпоксидных смол: эпоксидированные эфиры монокарбоновых кислот с несколькими двойными связями, содержащие до 22 атомов углерода ( например, триглицериды соевого масла), эпоксидированные эфиры непредельных поликарбоновых кислот, содержащие до 25 атомов углерода, непредельные эпоксидированные эфиры непредельных спиртов и карбоновых кислот. Далее рассматриваются также эпоксидированные дикротиловые эфиры ароматических дикарбоновых кислот, а также эпоксидированные сополимеры бутадиена. В качестве отвердителей называются прежде всего ангидриды гексагидрофталевой и хлорэндофталевой кислот. [24]
Более высококачественные пластифицированные экструзионные изделия получают при применении оловоорганических соединений. Например, добавка смеси 2 % лаурата-малеата дибутилолова с 0 25 % жидкого барий-кадмиевого стабилизатора дает прозрачный светостойкий материал. Светостойкость может быть также улучшена введением в качестве пластификатора 10 % эпоксидированного эфира. Для светостабилизации изделий, подвергающихся атмосферному воздействию, специально вводят УФ-абсорберы. [25]
Композиции металлических мыл с другими типами соединений чрезвычайно разнообразны. Наиболее эффективными среди них являются смеси, содержащие эпоксисоединения, эфиры фосфористой кислоты, многоатомные спирты или фенольные соединения. Системы с эпоксисоединениями наряду с металлическими мылами могут содержать также глицидный эфир [252, 1549] или эпоксидированные эфиры жирных кислот [333] ( см. III. [26]
Совместимость и эффективность действия эпоксидированных эфиров жирных кислот, как это часто бывает, обратно пропорциональны их молекулярному весу и длине цепи спиртового остатка. В таких эпоксидированных эфирах содержится от 1 6 до 8 % эпоксидного кислорода и их йодное число большей частью ниже пяти. [27]
Таким образом, их механические свойства аналогичны механическим свойствам пленок, пластифицированных диоктилфталатом. При этом почти не отмечается различия в эффективности действия эпоксидированных эфиров указанных выше кислот. Модуль эластичности, равный 92 кгс / см2, и твердость, равную 75, имеют пленки, содержащие около 32 % пластификатора. Для сравнения укажем, что те же характеристики получены для пленок, содержащих 35 % диоктилфталата. Эпоксидирован-ные эфиры очень мало испаряются при пропускании горячего воздуха ( 60 С) и очень мало вымываются водой. [28]
В зависимости от гидрофильности компонентов, соединяющих пленки, водопоглощение несколько увеличивается, однако прочность клейки ( соединения) пленок не снижается. Механические свойства пленок и слоистых изделий из них после выдержки в воде также не снижаются. Рейххерцер показал, что в случае полимерных пластификаторов на основе дикарбоновых кислот и эпоксидировашшх эфиров после 10 суток выдержки при комнатной температуре потери пластификатора за счет вымывания не установлены. Наибольшие потери получены при применении полипропиленадипатов, модифицированных одноатомными спиртами. Они во много раз превышают значения потерь, получающихся при применении диоктилсебацината или фталата и эпоксидированных эфиров олеиновой кислоты. [29]
Страницы: 1 2
www.ngpedia.ru
Эфиры эпоксидированных кислот - Справочник химика 21
При отверждении ангидридами поликарбоновых кислот продуктов для эпоксидных смол, содержащих более чем одну эпоксидную группу, расположенную не в конце цепи, в качестве активаторов рекомендуется также применять амины, их соли и четвертичные соли аммония. В патенте указываются следующие продукты для эпоксидных смол эпоксидированные эфиры монокарбоновых кислот с несколькими двойными связями, содержащие до 22 атомов углерода (например, триглицериды соевого масла), эпоксидиро-ванные эфиры непредельных поликарбоновых кислот, содержащие до 25 атомов углерода, непредельные эпоксидированные эфиры непредельных спиртов и карбоновых кислот. Далее рассматриваются также эпоксидированные дикротиловые эфиры ароматических дикарбоновых кислот, а также эпоксидированные сополимеры бутадиена. В качестве отвердителей называются прежде всего ангидриды гексагидрофталевой и хлорэндофталевой кислот. [c.605] При применении в качестве эпоксидирующего агента трет-бу-тилгидропероксида исходным сырьем являются пропилен и изобутан, а конечными продуктами — пропиленоксид и грет-бутанол или 2-метилпропен при применении гидропероксидов этилбензола, изопропилбензола, изопентана, изопентена-2 и эфира изомасляной кислоты наряду с пропиленоксидом соответственно получают стирол, а-метилстирол, изопентен, изопрен и эфир метакриловой кислоты. [c.211]Реакция. Энантио- и региоселективное эпоксидирование аллильных спиртов тре/я-бутилгидропероксидом в присутствии диэтилового эфира ( + )- или ( —)-винной кислоты и каталитических количеств тетраизопропилата титана (реакция Шарплесса-Кацуки [6а]). Ориентирующий эффект гидроксильной группы и скорость реакции при эпоксидировании надкислотами намного ниже. Так, гераниол дри взаимодействии с надкислотами эпоксидируется предпочтительно по А -двойной связи. Первоначально образующийся эпоксиспирт необходимо ацетилировать, так как он весьма неустойчив. [c.467]
Опасность размыкания эпоксидного кольца значительно уменьшается, если использовать метод, описанный недавно в ряде патентов При этом применяется также надуксусная кислота, но не в растворе уксусной кислоты, а в ацетоне или другом растворителе реакция обычно проводится при 60—90°С. Этот метод позволяет использовать непосредственно моноперок-сиацетат ацетальдегида, образующийся при окислении ацетальдегида. Большинство непредельных кислот, эфиров и хлороле-финов эпоксидируется этим способом с высоким выходом. [c.227]
Реакция окисления кетонов носит название реакции Байера— Виллигера, которые впервые начали ее изучение . Этими исследователями было установлено, что некоторые циклические кетоны можно превратить в лактоны при действии на них над-серной кислоты. Позже было найдено, что органические надкислоты могут с одинаковым успехом быть использованы для окисления циклических кетонов в лактоны, а также карбонильных соединений с открытой цепью в сложные эфиры. В этих условиях алифатические альдегиды обычно окисляются до соответствующих кислот, хотя Прилежаев установил, что непредельный альдегид — цитраль — вначале эпоксидируется, а затем превращается через стадию образования эфира в низшие альдегиды, подобно тому, как это происходит с кетонами [c.232]
Как правило, пероксикарбоновые кислоты весьма неустойчивы и должны храниться при низких температурах. На практике ранее для эпоксидиро-вания чаще других надкислот применяли лкачестве растворителя пригодны инертные неполярные растворители (эфир, бензол, метиленхлорид). [c.279]
Действительно, показано, что метиловый эфир -дигидро-абиетиновой кислоты (XXI), а также Зр-ацетокси-4,4-диметил-Дб-холестен (XXII) не окисляются реагентом ГПТА — МоС или Мо(СО)д даже после продолжительного воздействия. Если к этому добавить, что надбензойная кислота легко эпоксидирует оба вещества, то характеристика стерической избирательности гидроперекисного реагента станет еще полнее. Не исключена возможность, что стадией, определяющей принципиальную возможность протекания эпоксидирования, является превращение молибдена в 1,2-диольный комплекс, от размеров и геометрии которого целиком зависит исход следующих стадий. Нет сомнения в том, что из-за пространственных затруднений экранированные олефины либо совершенно не способны к образованию дипольных комплексов с молибденом, либо стерическая ситуация в полученном комплексе настолько сложна, что молибден теряет способность к комплексообразованию с гидроперекисью. [c.81]
По зтой же схеме из R-(+)-цитронеллола получают 3R, 6R-309, а из S-(--)-цитронеллола — 3S, eRS-изомер (309). Только последний является активным феромоном, поэтому синтезированы 3S, 6R- и 3S, 65-изомерь( из S-(—)-цитронеллола по другой схеме 109 [802] Метоксиэтокси-метиловый эфир S-цитронеллола эпоксидируют, кислым гидролизом переводят в (тнл-коль (332), который превращают в диэфир с хлорангидридом Р-(+) - -ме-токси-а- (трифторметил)-фенилуксусной кислоты. Разделение диастереоизомеров проводят жидкостной хроматографией высокого разрешения. 3S, 6Р-изомер выделен 96,0% диастереоизомерной чистоты, а 3S, 68-изомер — 96,5%. Восстановление алюмогидридом лития эфиров (333) до соответствующих диолов, эпоксидирование, введение 3-бутенильного остатка и дегидратация проводились, как показано в схеме 108. Снятие метоксиэто-ксиметильной защиты достигнуто лишь обработкой бутиллитием с последующим кислым гидролизом. После ацетилироваиия получают 3S, 6R- и 3S, 65-изомеры феромона. [c.144]
Неорганические пероксикислоты обладают исключительно широким диапазоном действия и при подборе соответствующих условий позволяют эпоксидировать как незамещенные алкены и циклоалкены (например, циклогексен), так и электронодефицитные алкены (а, -ненасыщенные кислоты и их эфиры). Следует заметить, что а, р-ненасыщенные кислоты органическими пероксикислотами не эпоксидируются. Неорганические пероксикислоты используются в момент образования при обработке каталитических количеств окислов металлов, хлорангидридов или солей (натриевых, аммониевых и др.) неорганических кислот пероксидами водорода или щелочных металлов [223—230]. [c.58]
В реакции эпоксидирования использовались тетрахлор-[317], гексахлор-, гексафторацетоны [ 214, 284, 318], хлораль, бензоин, ацетофенон, ацетоуксусный эфир, глюкоза и др. [ 255]. Наиболее сильные из реагентов (производные гекса-фторацетона и хлораля) сравнимы с пероксиуксусной кислотой. Например, реагент на основе гексафтор ацетона эпоксидирует циклические и ациклические олефины при О"" С с выходом окси-ранов 60—937о, а при повышенной температуре окисляет кетоны в сложные эфиры. [c.87]
Эпоксидирующими агентами, сравнимыми с пероксиуксусной кислотой, являются а-гидропероксиды кетонов, сложных эфиров, нитрилов и амидов [319], образующиеся при их автоокислении в присутствии трет-бутилата калия [c.87]
chem21.info
Эпоксидной эфир - Большая Энциклопедия Нефти и Газа, статья, страница 2
Эпоксидной эфир
Cтраница 2
На основе продуктов сополимеризации эпоксидных эфиров ненасыщенных жирных кислот со стиролом получают быстросохнущие покрытия с высокими электроизоляционными показателями. [16]
В сочетании с мочевино-формальдегидными смолами эпоксидные эфиры образуют покрытия горячей сушки, которые по свойствам близки к амино-алкидным смолам, но обладают более высокой стойкостью к действию щелочей и моющих средств. Такие покрытия применяются для декоративной отделки металлических поверхностей и окраски различных инструментов. [17]
Хорошие результаты были достигнуты при модификации эпоксидных эфиров. Успешно используются стиро-лизированные эфиры эпоксидных смол. В присутствии кобальтового сиккатива они образуют быстросохнущие прозрачные твердые пленки с высокой химической и атмосферной стойкостью. [18]
Одной из самых перспективных модификаций, как он указывает, является модификация продуктами конденсации мочевины и формальдегида ( 70 % эпоксидного эфира, 30 % продукта конденсации мочевины с формальдегидом) с применением n - толуол - или бензолсульфокислоты в качестве отвердителя. Далее Шур приводит описания комбинаций с первичными аминами, феноло-формальдегидными продуктами конденсации, алкидаминными смолами, сополимерами с поливинилацетатом, этерификацию смоляными и жирными кислотами с применением в качестве добавок мочевинных смол. При этом он подчеркивает что модификация эпоксидных смол дает неограниченную возможность получения ценных комбинаций. [19]
Одной из самых перспективных модификаций, как он указывает, является модификация продуктами конденсации мочевины и формальдегида ( 70 % эпоксидного эфира, 30 о продукта конденсации мочевины с формальдегидом) с применением / ьтолуол - или бензолсульфокислоты в качестве отвердителя. Далее Шур приводит описания комбинаций с первичными аминами, феноло-формальдегидньши продуктами конденсации. При этом он подчеркивает, что модификация эпоксидных смол дает неограниченную возможность получения ценных комбинаций. [20]
Этот 2 3-эпоксипропилхлоркарбонат за счет атома хлора в кислотном остатке может подвергаться различным реакциям, причем в общем случае эпоксидная группа сохраняется, так что при этом могут получаться разнообразные эпоксидные эфиры угольной кислоты. [21]
При этой реакции в качестве катализатора наиболее эффективен mpe / n - бутилат калия, однако применим и амид натрия. Напротив, - метилах или этилат натрия применять нельзя, так как они, предположительно, вызывают переэтерификацию. Эпоксидные эфиры такого рода являются хорошими пластификаторами и стабилизаторами поливинилхлоридов. [22]
При этой реакции в качестве катализатора наиболее эффективен ш.о. / п-бутилат калия, однако применим и амид натрия. Напротив, метилат или этнлат натрия применять нельзя, так как они, предположительно, вызывают переэтерификацию. Эпоксидные эфиры такого рода являются хорошими пластификаторами и стабилизаторами поливинилхлоридов. [23]
Взаимодействие эпоксидных смол с жирными кислотами приводит к образованию эпоксиэфирных производных, что дает возможность использовать их для покрытий как воздушной, так и горячей сушки. Присутствие жирных кислот уменьшает химическую стойкость эпоксидных смол до та-того уровня, который имеют алкидные смолы. Тем не менее эпоксидные эфиры применяют для специальных целей. [24]
В то время как эфиры ненасыщенных жирных кислот не совмещаются с хлорированными или нехлорированными виниловыми смолами, зфиры жирных кислот, содержащие эпоксидные группы, прекрасно с ними совмещаются. Это ценное свойство открывает для последних широкую область применения, так как они обладают очень хорошими пластифицирующими свойствами, а хороших пластификаторов для этих смол недостаточно. Кроме того, эпоксидные эфиры являются хорошими акцепторами галогеноводоро-дов, так что они пригодны в качестве стабилизаторов для галоген-содержащих смол. [25]
В то время как зфиры ненасыщенных жирных кислот не совмещаются с хлорированными или нехлорированными виниловыми смолами, зфиры жирных кислот, содержащие эпоксидные группы, прекрасно с ними совмещаются. Это денное свойство открывает для последних широкую область применения, так как они обладают очень хорошими пластифицирующими свойствами, а хороших пластификаторов для этих смол недостаточно. Кроме того, эпоксидные эфиры являются хорошими акцепторами галогеноводоро-дов, так что они пригодны в качестве стабилизаторов для галоген-содержащих смол. [26]
Жирные кислоты являются одноосновными, но из-за ненасыщенности они многофункциональны. Их функциональность может быть повышена за счет применения небольших количеств малеиновой или других многоосновных кислот. Но кислоты с повышенной таким образом функциональностью применяются редко. Эпоксидные эфиры ненасыщенных жирных кислот применяют для производства покрытий воздушной сушки. [27]
Жирные кислоты являются одноосновными, но из-за ненасыщениости они многофункциональны. Их функциональность может быть повышена за счет применения небольших количеств малеиновой или других многоосновных кислот. Но кислоты с повышенной таким образом функциональностью применяются редко. Эпоксидные эфиры ненасыщенных жирных кислот применяют для производства покрытий воздушной сушки. [28]
Твердые связующие, применяющиеся для покрытий - это в основном высокомолекулярные смолы, плавящиеся при комнатной температуре; они не дают отлила, полимеризируются при нагревании или без него. Наиболее подходящими для использованя в качестве покрытий являются смолы на основе DGEBA, имеющего молекулярную массу 900 и выше. Смолы на основе DGEBA, имеющие молекулярную массу от 900 до 1 000, отверждаются непосредственно аминами; реакция отверждения протекает преимущественно через эпоксидные группы. Смолы на основе DGEBA, имеющие молекулярную массу от 1 500 до 2 000, обычно используются для этерификащш жирных кислот. Получающиеся в ( результате эпоксидные эфиры отварждаются затем в шлейке реакцией пепасыщения жирных кислот. Смолы на основе DGEBA, имеющие молекулярную массу от 3000 до 4000, обычно используются в смеси с моче-виио-меламинными или фенолформальдегидными смолами; реакция отверждения протекает благодаря конденсации метилольных групп с гидроксилишми группами эпоксидной цепочки, эпоксидные группы мало или совсем не способствуют реакции. [29]
Страницы: 1 2 3
www.ngpedia.ru
аддукты левулиновых производных с эфирами эпоксидированных жирных кислот и их применение - патент РФ 2434861
Данное изобретение относится к соединениям формулы

где R1 обозначает С1 -С10 линейный или разветвленный алкил или алкоксиалкил; один из А или В обозначает водород и другой обозначает С 1-С10 линейную или разветвленную алкоксикарбонильную группу; "n" и "m" независимо обозначают целые числа от 0 до 20. Соединения по настоящему изобретению пригодны в качестве пластификаторов для поливинилхлорида, поли-(3-гидроксиалканоата) и полисахарида. Описываются также способы получения подобных соединений реакцией между производными эфиров эпоксидированных жирных кислот и эфирами левулиновой кислоты. Кроме того, данное изобретение относится и к моно-, ди- и трикеталям, являющимся аддуктами, образовавшимися при взаимодействии алкиловых эфиров левулината и эфиров эпоксидированных ненасыщенных жирных кислот на основе растительных масел. 8 н. и 3 з.п. ф-лы, 9 ил.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способам получения соединений из левулиновых эфиров и эфиров эпоксидированных ненасыщенных жирных кислот. Соединения пригодны в качестве пластификаторов на основе возобновляемой биомассы для различных полимеров.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Пластификаторы для различных полимеров широко известны. Большинство пластифицирующих соединений получают из сырья нефтяного происхождения, которое является дорогим и невозобновляемым. Некоторые пластификаторы получают из возобновляемого сырья, например триглицериды растительных масел, обычно они получаются путем эпоксидирования ненасыщенных производных жирных кислот. Однако эпоксидированные триглицериды имеют значительные ограничения и не могут с успехом применяться в качестве основных пластификаторов, так как их совместимость с поливинилхлоридом (PVC) ограничена.
Некоторые эфиры алифатических дикарбоновых кислот, такие как эфиры себациновой и азелаиновой кислот, получают из различных ненасыщенных жирных кислот. Такие дикарбоновые кислоты имеют отличные пластифицирующие свойства. Однако из-за сложности их синтеза и высокой стоимости сырья такие дикарбоновые кислоты являются довольно дорогими и применяются как качественные продукты в областях, используемых при низких температурах.
Некоторые известные пластификаторы, применяемые в промышленности, такие как эфиры фосфорной кислоты и алкилированных фенолов, наносят вред окружающей среде, придают неприятный запах готовым изделиям и вызывают загрязнение воздуха.
Обычно применяемые при пластификации PVC эфиры фталевой кислоты, как недавно было установлено, разрушают эндокрин и ответственны за снижение репродуктивности у животных и людей и за репродуктивную токсичность у мужчин, в частности.
Следовательно, желательно получить пластифицирующие соединения, которые были бы недорогими, нетоксичными и получались из возобновляемого распространенного сырья, а также не оказывали вредного воздействия на окружающую среду.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предлагаются сложноэфирные соединения, которые являются многосторонними пластификаторами с хорошей совместимостью со многими полимерами. Сложноэфирные соединения получают из имеющегося в изобилии, недорогого возобновляемого сырья, например из эфиров ненасыщенных жирных кислот и эфиров левулиновой кислоты. Эпоксидные группы эфиров моноэпоксидированных ненасыщенных жирных кислот реагируют с левулиновыми эфирами в присутствии подходящего катализатора, обычно протонной кислоты или кислоты Льюиса, с образованием кеталей левулиновых эфиров дигидроксилированных эфиров жирных кислот. Подобно этому эфиры левулиновой кислоты реагируют с эфирами бис-эпоксидированных и трис-эпоксидированных ненасыщенных жирных кислот, полученных из эфиров ненасыщенных жирных кислот, содержащих две или три двойные связи, образуя при этом соответствующие бис-кетали и трис-кетали. Кроме того, левулиновая кислота и ангеликалактон могут применяться в комбинации или вместо эфира левулиновой кислоты в реакциях с эфирами эпоксидированных ненасыщенных жирных кислот. Аддукты эфира левулиновой кислоты и эпоксидированной ненасыщенной жирной кислоты пригодны в качестве пластификаторов целого ряда промышленных полимеров.
Примеры соединений, полученных из эфира левулиновой кислоты, левулиновой кислоты и/или ангеликалактона и эпоксидированной ненасыщенной жирной кислоты, включают соединения формулы

и формулы

где X выбран из следующих групп
 ,
,
 , и
, и
 ;
;
и где R1 и R3 независимо обозначают C1-С10 линейный или разветвленный алкил или алкоксиалкил; один из А или В представляет собой водород, а другой - этерифицированную карбоксильную группу; и "n" и "m" обозначают независимо целые числа от 0 до 20, а величина суммы m+n находится в пределах от 8 до 21.
Продукт реакции может также иметь формулу

где R1 и R2 независимо обозначают C1-С10 линейный или разветвленный алкил или алкоксиалкил.
Когда эфир левулиновой кислоты, левулиновая кислота и/или ангеликалактон реагируют с эфиром бис-эпоксидированной или трис-эпоксидированной ненасыщенной жирной кислоты, примеры получаемых соединений могут включать следующие соединения:
 ,
,
 ,
,
 , и
, и

где R1 и R2 независимо обозначают C1-С10 линейный или разветвленный алкил или алкоксиалкил. Согласно некоторым вариантам R1 и R2 могут обозначать метил, этил, н-бутил, изобутил, изоамил или 2-этилгексил.
Соединения могут также применяться в качестве пластификатора с основным полимером в пластифицированной полимерной композиции. Основной полимер может представлять собой полимеры винилхлорида, поли-(3-гидроксиалканоаты), полилактаты или полисахариды.
Подробно один или более варианты изобретения описаны ниже на прилагаемых чертежах и в описании. Другие признаки, цели и преимущества данного изобретения будут очевидны из описания, чертежей и из формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 показанные репрезентативные EI масс-спектры соединений (4) (Фиг.1А) и (11) (Фиг.1В), полученные в ходе ГХ-МС анализа по примеру 6 (электронная ионизация при 70 эВ).
Фиг.2А отражает EI масс-спектры соединений (4) (Фиг.2A1) и (11) (Фиг.2А2 ), полученные методом ГХ-МС анализа по примеру 7 (образец В).
Фиг.2В показывает репрезентативные IE масс-спектры смеси изомеров эпоксикеталя (13а) и (13b) (образец А, пример 7).
На Фиг.3 представлены репрезентативные IE масс-спектры смеси изомеров монокеталя (4), где R1 =R2=этил (пример 24) (Фиг.3А), и репрезентативные IE масс-спектры смеси изомеров дикеталя (11), где R1 =R2=этил (пример 24) (Фиг.3В).
На Фиг.4 представлены IE масс-спектры смеси изомеров монокеталя (4), где R1=R2=н-бутил (пример 25) (Фиг.4А), и репрезентативные IE масс-спектры смеси изомеров дикеталя (Фиг.4В), где R1 =R2=н-бутил (пример 25).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используются следующие термины.
Термин "ненасыщенные жирные кислоты" означает линейные монокарбоновые кислоты, содержащие от 10 до 24 атомов углерода и, по меньшей мере, одну двойную связь. Двойные связи могут быть в любом положении, могут быть сопряженными друг с другом или несопряженными, но не в алленовой конфигурации, и каждая из двойных связей может быть цис- или транс. Предпочтительно, чтобы ненасыщенные жирные кислоты содержали от одной до трех двойных связей. Жирные кислоты также могут состоять из смеси различных ненасыщенных и насыщенных жирных кислот, например, как в триглицеридах различных растительных масел, рыбьем жире и пальмовом масле.
Термин "эфиры ненасыщенных жирных кислот" означает эфиры вышеописанных жирных кислот и одноатомных или многоатомных спиртов.
Термин "одноатомные спирты" означает линейные или разветвленные первичные или вторичные алканолы или алкоксиалканолы, содержащие от 1 до 12 атомов углерода. Предпочтительными примерами алканолов являются метанол, этанол, пропанол, изопропанол, бутанол, втор. бутанол, изобутанол, изоамиловый спирт, 2-этилгексанол. Предпочтительными алкоксиалканолами являются первичные или вторичные спирты, содержащие от 3 до 12 атомов углерода, в которых линейная, разветвленная или циклическая алкоксигруппа, содержащая от 1 до 8 атомов углерода, расположена в соседнем положении к гидроксильной группе. Такие алкоксиалканолы обычно получают раскрытием алкилоксиранового цикла алканолом. Другим подходящим примером алкоксиалканолов является тетрагидрофурфуриловый спирт, который легко получить путем гидрирования фурфураля. Наиболее предпочтительными являются одноатомные спирты благодаря их доступности, стоимости и удовлетворительной стабильности их эфиров.
Термин "многоатомные спирты" означает линейные или разветвленные полигидроксилированные алканы, содержащие от 1 до 6 гидроксильных групп. Типичными примерами являются этиленгликоль, пропилен-1,2- и 1,3-диолы, изомеры бутиленгликоля, глицерин, 1, 2, 4-тригидроксибутан, пентаэритрит, ксилит, рибит, сорбит, маннит и галактит. Многоатомные спирты могут содержать одну или несколько эфирных связей, подходящими примерами таких многоатомных спиртов являются изосорбид, изомеры сорбитана и диглицерин.
Предпочтительно, чтобы практически все гидроксильные группы многоатомных спиртов были этерифицированы группами ненасыщенной жирной кислоты. Очевидно, что в промышленности может быть нецелесообразно достигать полной этерификации.
Очевидно также, что в промышленности, когда применяют смеси жирных кислот, не все жирные кислоты могут быть ненасыщенными и могут содержаться некоторые полностью насыщенные кислоты. В действительности, с экономической точки зрения предпочтительно применять смеси эфиров ненасыщенных и насыщенных жирных кислот, такие как содержащиеся в триголицеридах обычных растительных масел (например, соевого, льняного масла, масла канолы, сафлорового масла, подсолнечного масла, кукурузного масла, касторового масла, их смесей и т.п.). Однако предпочтительно, чтобы смешанные эфиры жирных кислот содержали преимущественно эфиры ненасыщенных жирных кислот. Предпочтительно также, чтобы применялся эфир жирной кислоты с высоким содержанием эфира мононенасыщенной жирной кислоты, например, такой как композиции, содержащиеся в масле канолы с высоким содержанием олеиновой кислоты. Предпочтительны также эфиры 10-ундециленовой кислоты. Другим предпочтительным исходным веществом является смесь метиловых эфиров жирных кислот, полученная переэтерификацией растительных масел (например, соевого масла, масла канолы и других ненасыщенных триглицеридов), обычно применяемых в промышленном производстве различных биодизельных топлив.
Различные эфиры ненасыщенных жирных кислот могут быть совмещены, смешаны, частично гидрированы или изомеризованы для изменения положения или стереохимии двойных связей.
Термин "эфир эпоксидированной ненасыщенной жирной кислоты" означает, что по меньшей мере одна из двойных связей эфира ненасыщенной жирной кислоты окислена до эпоксидной группы. Такая реакция окисления хорошо известна из уровня техники, ее легко осуществить в промышленном масштабе, например, с использованием перекиси водорода и карбоновой кислоты (например, формиата или ацетата) или галоидгидрина. Однако предпочтительно, чтобы осуществлялось эпоксидирование большинства или всех двойных связей, имеющихся в эфире ненасыщенной жирной кислоты. Очевидно, что на практике эфиры эпоксидированных жирных кислот могут содержать различные количества побочных продуктов, образующихся при гидролизе или перегруппировке эпоксидов и при сшивании цепей жирных кислот. Применение эфиров эпоксидированных жирных кислот, содержащих небольшие количества побочных продуктов эпоксидирования, полностью охватывается данным изобретением.
Левулиновые эфиры представляют собой эфиры левулиновой (4-оксипентановой) кислоты и одноатомного спирта. Однако остаток одноатомного спирта в левулиновом эфире независимо выбран из фрагмента одноатомного спирта эфиров ненасыщенных жирных кислот и поэтому может быть таким же или другим. Левулиновые эфиры могут быть смесями левулиновых эфиров с более чем одним одноатомным спиртом.
Полимеры. Поливинилхлориды (PVC) представляют собой гомополимеры или сополимеры винилхлорида. Многие PVC с различной степенью полимеризации, сшитые, а также сополимеры известны из уровня техники и получаются в промышленности.
Поли-(3-гидроксиалканоаты), РНА, являются гомолимерами или сополимерами 3-гидроксиалкановых кислот. Предпочтительно РНА состоит из линейных фрагментов 3-гидроксиалкановой кислоты, содержащих от 3 до 18 атомов углерода. Поли-(3-гидроксибутират), РНВ, является гомополимером, который получается биологически, например при помощи различных микроорганизмов. Чистый полимер РНВ представляет собой хрупкий полимер, перерабатываемый в узком интервале температур, и он легко разлагается при температурах, которые только на 20-30°С выше его температуры плавления.
Полилактат или полилактид, PLA, представляет собой известный гомополиэфир, содержащий повторяющиеся единицы молочной кислоты различной стереохимии.
Полисахариды могут быть гомополимерами и сополимерами, линейными или разветвленными, содержащими звенья гексозы или пентозы, соединение гликозильными связями. Полисахариды могут содержать различные дополнительные группы, такие как ациламидогруппы, сульфатные группы, карбоксилатные группы, группы алкиловых и гидроксиалкиловых эфиров и т.п. Такие дополнительные группы могут содержаться в полисахаридах, полученных из природных источников, или могут быть получены искусственно (например, путем ацилирования целлюлозы). Примеры полисахаридов включают ацилированные производные целлюлозы и крахмала, а также природные или ацилированные хитин и пектин.
Пластификаторами являются химические соединения, добавляемые к основе композиции, включающей один или более указанные выше полимеры, с целью снижения температуры стеклования полимерной композиции, что делает ее более гибкой и легче поддающейся переработке, например, путем экструзии расплава или формования. Пластификаторы применяют в различных эффективных концентрациях, и в зависимости от вида используемого полимера и желаемых свойств полимерных составов пластификаторы могут быть введены в концентрации, находящейся между 1% и 80% от веса непластифицированного полимера. Очевидно, что в зависимости от вида используемых полимера и пластификатора пластификаторы могут также вызывать другие изменения физических и механических свойств полимера, а также изменения в защитных свойствах смешиваемого полимера в отношении его проницаемости для различных газов, воды, водяного пара или органических соединений. Очевидно также, что в различных смесях с дополнительными компонентами для получения экструдируемой или формуемой полимерной композиции могут быть использованы один или несколько разных пластификаторов. Указанные дополнительные компоненты могут включать различные неорганические и органические наполнители, древесную пыль, армирующие волокна, красители, пигменты, стабилизаторы, смазочные агенты, антимикробные добавки и т.п.
Пластификаторы обычно смешивают с полимером и другими возможными компонентами основной композиции в различных перемешивающих устройствах, хорошо известных из уровня техники, при температурах выше или ниже температуры плавления полимера. Пластификаторы также можно вводить при помощи летучего растворителя.
Кетальные производные левулиновой кислоты получают путем взаимодействия эфира эпоксидированной ненасыщенной жирной кислоты с достаточным количеством эфира левулиновой кислоты в присутствии подходящего катализатора, получая при этом различные соединения, представляющие собой ковалентные аддукты эфирных фрагментов жирной кислоты и левулиновых фрагментов.
Согласно одной такой реакции образуется кетальэфир формулы (3):

где (2) означает левулинат, (1) означает эфир эпоксидированной ненасыщенной жирной кислоты (его эпоксидная группа), (3) означает кетальэфирный аддукт и R1 обозначает C1-С10 линейный или разветвленный алкил или алкоксиалкил.
Например, по этой реакции легкодоступный эфир 9, 10-эпоксидированного олеинового эфира превращается в кеталь формулы (4):
 ,
,
где R1 и R2 каждый независимо обозначают C1-С10 линейный или разветвленный алкил или алкоксиалкил.
Обычно катализаторы реакции различных эпоксидов с кетонами включают различные кислоты. Эти условия обычно применяются для взаимодействия левулинатных эфиров с эфирами эпоксидированных ненасыщенных жирных кислот. Неограничивающие примеры таких катализаторов включают сильные минеральные кислоты, такие как серная, соляная, фтористоборводородная, бромистоводородная кислоты, п-толуолсульфокислота, камфорасульфокислота, метансульфокислота и т.п. Могут также применяться различные смолы, которые содержат протонированные сульфогруппы, и они могут быть легко выделены после завершения реакции. Примеры кислот включают также кислоты Льюиса. Например, пригодны также трифторид бора и различные комплексы ВF3, например диэтилэфират ВF 3. Можно также применять двуокись кремния, кислые окись алюминия, окись титана, окись циркония, различные кислые глины, смешанные окиси алюминия или магния. Можно также использовать активированные производные углерода, содержащие минеральную кислоту, сульфокислоту или производные кислоты Льюиса.
Специалист в данной области может применять различные по составу катализаторы и различное их количество при получении соединений, описанных в данной заявке.
Для ускорения реакции в присутствии менее активных катализаторов можно применять повышенные температуры. Однако для успешного получения количественного выхода кеталя левулиновой кислоты температура реакционной смеси не является критической, так как даже с менее активными катализаторами реакция все еще протекает с получением желательных соединений. Количество и вид катализатора зависят от конкретного химического состава эпоксида и левулината, применяемых при проведении реакции, и легко могут быть определены специалистом в данной области. Реакцию можно проводить в присутствии сорастворителя, являющегося инертным в условиях реакции и обычно удаляемого путем отгонки в конце реакции. Обычно желательно применять достаточное количество сорастворителя (или достаточный избыток левулината) для минимизации сшивки эфиров эпоксидированных жирных кислот за счет образования связи простого эфира. Неограничивающие предпочтительные примеры подходящих сорастворителей включают насыщенные углеводороды, простые эфиры и эфиры карбоновых кислот и простых алканолов и алкановые кислоты.
Подобно моноэпоксидам бис-эпоксиды эфиров ненасыщенных жирных кислот превращаются в смесь стереоизомеров, содержащих бис-кетали левулинового эфира.
Когда моно- или бис-эпоксиды эфиров ненасыщенных жирных кислот реагируют с этиллевулинатом, реакция бис-эпоксидов жирной кислоты может сопровождаться другими конкурирующими реакциями. Эти конкурирующие реакции, как было установлено, предпочтительны для получения полезных соединений. В частности, когда содержится некоторое количество свободного этанола и/или когда применяются протонные кислые катализаторы, способствующие реакциям переэтерификации, образование алкоксиалканольного производного эфира ненасыщенной жирной кислоты более вероятно по сравнению с образованием кеталя. При условиях, позволяющих осуществить удаление алканола после раскрытия эпоксидного кольца, образуется левулиновый продукт переэтерификации формулы (5):

где R3 может обозначать C 1-С10 линейный или разветвленный алкил или алкоксиалкил; один из А или В обозначает водород, а другой обозначает сложноэфирную группу карбоновой кислоты, "n" и "m" обозначают целые числа, каждое из которых имеет значение от 0 до 20, а величина суммы m+n находится в пределах от 8 до 21.
Иначе, известные алкоксиалканольные производные эфиров ненасыщенных жирных кислот могут быть получены путем раскрытия эпоксидных групп эфира эпоксидированной ненасыщенной жирной кислоты при помощи алканола. Гидроксильные группы производных алкоксиалканола затем этерифицируют эфиром левулиновой кислоты, или свободной левулиновой кислотой, или гамма-агеликалактоном, получая при этом вицинальные алкоксилевулиноильные производные эфиров ненасыщенных жирных кислот:

где (6) означает эфир эпоксидированной ненасыщенной жирной кислоты; R3 может быть C1 -С10 линейным или разветвленным алкилом или алкоксиалкилом; один из А или В обозначает водород, а другой обозначает сложноэфирную группу карбоновой кислоты, "n" и "m" обозначают целые числа, каждое из которых имеет значение от 0 до 20, а величина суммы m+n находится в пределах от 8 до 21.
Когда применяют бис-эпоксиды или трис-эпоксиды эфиров ненасыщенных жирных кислот, содержащие эпоксидные группы, расположенные совсем близко друг к другу, происходит также внутримолекулярное раскрытие эпоксидной группы, при этом образуется одна или несколько эфирных связей, каждая из которых соединяет два атома углерода непрерывной углеродной цепи жирной кислоты. Обычно такие эфирные связи приводят к образованию тетрагидрофуранового (основного) и тетрагидропиранового (в небольшом количестве) колец. Затем образуются сложные смеси стереоизомеров оксигенированных производных эфиров ненасыщенных жирных кислот. Например, изомеры таких продуктов из бис-эпоксидов, полученных из ди-ненасыщенной жирной кислоты, содержащей две двойных связи, разделенные метиленовой группой, могут иметь формулы (8а) и (8b):


где R3, А, В, n и m указаны выше.
Обычно после удаления или нейтрализации катализатора обычно путем отгонки при пониженном давлении осуществляется удаление избытка эфира левулиновой кислоты, растворителя и, где это нужно, эфиров насыщенных жирных кислот, которые могут присутствовать в качестве примесей в исходных эфирах эпоксидированных жирных кислот, что приводит к образованию чистой, прозрачной стабильной жидкости, практически не имеющей запаха. В зависимости от конкретных использованных условий жидкость включает левулиновые кетали вицинальных дигидроксипроизводных эфиров ненасыщенных жирных кислот и/или смеси алкилоксилевулиноильных соединений. Эти последние соединения могут содержать связи простого эфира, соединяющие два атома углерода в цепи ненасыщенной жирной кислоты (образуя при этом тетрагидрофурановое или тетрагидропирановое кольцо).
Левулиновые аддукты могут применяться в качестве пластификаторов для PVC, поли(3-гидроксиалканоатов), полилактата и различных полисахаридов. Они совместимы с этими полимерами в широком интервале концентраций. Путем выбора различных фрагментов алканолов в реагентах при синтезе этих аддуктов можно также регулировать свойства пластификатора не только в отношении пластифицирующей способности и лучшей совместимости, но также и в отношении барьерных свойств получаемого полимера, таких как проницаемость влаги, газов, растворителя, просачивания воды и сохранения запаха и пятен.
В данной заявке предусмотрен также ряд похожих пластификаторов, которые практически не содержат свободных карбоксильных групп и поэтому могут быть смешаны с левулиновыми производными, описанными в настоящей заявке, с целью получения желаемых композиций на основе пластифицированных полимеров. Пластификаторы получают с применением эфира низшей алкановой кислоты вместо эфира левулиновой кислоты. Согласно этому варианту свободные гидроксильные группы производных алкоксиалканолов (7) ацилируют низшими алкановыми кислотами или их ангидридами при переэтерификации, получая эфиры алканолов и низших алкановых кислот. Алкановые кислоты согласно этому варианту являются линейными или разветвленными монокарбоновыми кислотами, содержащими 2-8 атомов углерода. Предпочтительными примерами таких кислот являются уксусная, пропионовая, масляная, 2-этилгексановая кислоты.
Предпочтительными эфирами в реакциях переэтерификации по этому варианту являются эфиры упомянутых алкановых кислот и линейных или разветвленных, первичных или вторичных алканолов, содержащих от 1 до 4 атомов углерода. Спиртовой фрагмент обычно выбирают, исходя из стремления получить в реакции переэтерификации спирт с пониженной точкой кипения, чтобы его можно было легко удалять путем перегонки по мере образования во время реакции.
Переэтерификация обычно проводится в обычных условиях, хорошо известных из уровня техники, она включает применение кислого или основного катализатора. Полученные из моноэпоксидов эфиров ненасыщенных жирных кислот алкилоксиацилоксипроизводные имеют формулу (9):

где R3 может быть C1 -С10 линейным или разветвленным алкилом или алкоксиалкилом; и R4 может быть C1-С7 линейным или разветвленным алкилом; один из А или В обозначает водород, а другой - этерифицированную карбоксильную группу, "n" и "m" обозначают целые числа, имеющие значения от 0 до 20, величина суммы m+n находится в пределах от 8 до 21. Как и левулиновые производные (8а) и (8b), полученные из бис-эпоксидов эфиров диеновых жирных кислот, содержащих двойные связи, разделенные метиленовой группой, алкилоксиацилоксипроизводные эфиров жирных кислот имеют структуры (10а) и (10b):


где R3, R4, А, В, n и m указаны выше.
Полученные алкилоксиацилоксипроизводные эфиров жирных кислот и низшие алкановые эфиры имеют отличные пластифицирующие свойства, похожие на свойства аддуктов левулиновых эфиров, описанных выше. Следовательно, они могут быть использованы также для полимерных композиций как основные пластификаторы или в виде смесей с левулиновыми производными, описанными в данной заявке, для регулирования наличия свободных карбонильных групп в пластифицированной полимерной композиции.
Согласно другому варианту, когда желательно получить пластификатор, используемый в различных изделиях на основе PVC, можно осуществить синтез аддуктов левулиновых эфиров и эфиров эпоксидированных ненасыщенных жирных кислот, применяя эфиры эпоксидированных ненасыщенных жирных кислот с типичной углеродной смежной цепью эфира жирной кислоты, содержащей 18 атомов углерода. Такой аддукт может включать соединения, которые преимущественно содержат кетали формулы (4), при этом бис-эпоксиды и трис-эпоксиды эфиров ненасыщенных жирных кислот содержатся в исходных материалах, они также могут быть превращены в кетальные аддукты левулиновых эфиров, например бис-кетали формулы (11) и трис-кетали формулы (12):


где R1 и R2 могут обозначать C1-С10 линейный или разветвленный алкил или алкоксиалкил.
Очевидно, что согласно этим вариантам могут получаться другие продукты реакции и они могут содержаться в различных количествах. Такие другие реакционные продукты могут, например, включать стереоизомеры эпоксикеталей формул (13а) и (13b):


Продукты реакции могут также включать комбинации соединений формул (5)-(10). Кроме того, могут также быть различные количества эфирных производных сшитых модифицированных ненасыщенных жирных кислот, в которых две или более соседние углеродные связи эфира ненасыщенной жирной кислоты соединены через эфирную связь. Другие соединения, которые также могут присутствовать, включают различные количества эфиров насыщенных жирных кислот, которые практически не реагируют с левулиновыми эфирами и поэтому остаются без изменений в образующихся смесях продуктов.
Согласно дальнейшим вариантам смесь продуктов, содержащая любую комбинацию кетальных аддуктов, полученных из левулинового эфира и эфира эпоксидированной ненасыщенной жирной кислоты (типичными примерами являются кетальные аддукты (4), (11), (12) и (13)) и одного или более эфиров насыщенных жирных кислот (типичными примерами являются эфиры гексадекановой или октадекановой кислот и одноатомного спирта R3-ОН), подвергают дальнейшей обработке, которая позволяет осуществить частичное или практически полное удаление эфиров насыщенных жирных кислот из смеси кетальных аддуктов. Такое удаление обычно осуществляют путем отгонки эфиров насыщенных жирных кислот при пониженном давлении и повышенной температуре, достаточной для начала отгонки насыщенных эфиров, но не кетальных аддуктов. Такие условия перегонки могут меняться в зависимости от температуры и величины используемого вакуума, а также от типа оборудования для перегонки, известного из уровня техники. Было установлено, что кетальные аддукты, такие как соединения (4), (11), (12) и (13), имеют высокие температуры плавления, которые обычно на 25-100°С выше, чем температуры плавления соответствующих эфиров насыщенных жирных кислот, и такая большая разница в температуре кипения позволяет осуществить эффективное удаление насыщенных жирных эфиров, применяя простое оборудование для перегонки, такое как колонны с падающей пленкой и другие колонны для перегонки со сравнительно небольшим числом теоретических тарелок. Было установлено, что частичное или существенное удаление эфиров насыщенных жирных кислот из смесей аддуктов левулиновых эфиров с эфирами эпоксидированных ненасыщенных жирных кислот приводит к образованию смеси кетальных аддуктов с улучшенными пластифицирующими свойствами, улучшенной совместимостью и минимальным или незначительным выпотеванием и с небольшим запахом или без запаха. Было также обнаружено, что монокетальные аддукты левулиновых эфиров с эфирами эпоксидированных ненасыщенных жирных кислот (обычно типичными примерами являются кетали формулы (4)) могут быть с успехом отогнаны из реакционных смесей, содержащих аддукты бис- и трис-кеталей (типичными примерами являются кетали формул (11)-(13)). Такая перегонка обычно проводится под вакуумом или при пониженном давлении, она может обеспечить получение монокетального соединения с высокой степенью чистоты в практически бесцветном виде и без запаха. Очищенные кетали формулы (4), как было обнаружено, являются превосходными пластификаторами для PVC, сравнимыми по своей пластифицирующей способности с эфирами себациновой и азелаиновой кислот, известными из уровня техники.
Пластифицирующие соединения можно применять в отдельности или в виде различных смесей, включающих многие другие пластификаторы, известные из уровня техники, такие как эфиры дикарбоновых кислот, лимонной кислоты и эфиры ароматических дикарбоновых кислот (например, эфиры фталевой кислоты). Особенно подходящими являются смеси, содержащие пластификаторы, полученные с эпоксидированными триглицеридами с высокой степенью эпоксидирования, для пластификации PVC.
Примерами таких эпоксидированных триглицеридов являются эпоксидированное соевое масло и эпоксидированное льняное масло, другие эпоксидированные растительные масла также пригодны. В таких составах фрагменты эпоксидированной жирной кислоты обеспечивают желаемый стабилизирующий эффект, действуя как поглотители продуктов разложения кислых полимеров. Пластификаторы пригодны для получения различных промышленных и потребительских товаров, включая материалы для полов, сайдинг для внешней отделки и внутренней отделки зданий, материалы для изготовления оконных рам, гибких и жестких труб, тюбинга, армированных кожухов, искусственной кожи, упаковки потребительских товаров, внутренних и наружных деталей автомобилей, частей электронного оборудования, различных однослойных и многослойных пленок, товаров для офисов и т.д.
Выше был описан ряд вариантов изобретения. Тем не менее следует иметь в виду, что, не выходя за рамки данного изобретения, можно осуществить его различные модификации. Соответственно другие варианты входят в объем изобретения, определяемый следующей ниже формулой изобретения.
ПРИМЕРЫ
ПРИМЕР 1А
506,2 г полностью эпоксидированного соевого масла (Vicoflex 7170, Arkema) смешивали с 1 л безводного метанольного раствора, содержащего 2,1 г метоксида натрия, полученную смесь перемешивали магнитной мешалкой при комнатной температуре (18°С) в течение 6 ч. Прохождение переэтерификации во времени отслеживали при помощи газовой хроматографии. Когда было установлено, что переэтерификация практически завершена, реакционную смесь нейтрализовали путем добавления 12,8 г тонкодисперсного порошка безводного дигидрофосфата калия с последующим перемешиванием в течение ночи (12 ч). Полученную смесь фильтровали, метанол выпаривали при пониженном давлении, используя роторный выпариватель с водяной баней с температурой 40°С. Полученное масло растворяли в 1 л смеси гексанов, фильтровали и отгоняли гексаны при пониженном давлении с применением ротарного выпаривателя. Полученный прозрачный чистый продукт со слабым маслянистым запахом (485 г) анализировали методом GC-MS (газовой хроматографии-масс-спектрометрии). С применением метода NIC интеграции было установлено, что масло содержит примерно 9% метилгексадеканоата, 5% метилоктадеканоата, 42% метил-9,10-эпокси-9-октадеканоата, 40% изомеров метил-9, 10-12,13-бис-эпокси-9,12-октадеканоата и небольшие количества эфиров других насыщенных и эпоксидированных ненасыщенных жирных кислот.
ПРИМЕР 1В
Альтернативно эпоксидированные жирные кислоты соевого масла получали из пищевого соевого масла (поставщик Archer Daniels Midland Company) путем проведения реакций переэтерификации и эпоксидирования. 0,950 кг соевого масла перемешивали с 0,5 л метанола, содержащего 6 г гидроокиси натрия, при температуре 40-45°С в течение примерно 6 ч. Реакционную смесь нейтрализовали, добавляя 40 г тонкодисперсного порошка дигидрофосфата калия с последующим перемешиванием в течение 10 ч при комнатной температуре. Метанол отгоняли из полученной смеси при пониженном давлении, используя роторный выпариватель, а остающийся раствор смешивали с 1 л смеси гексанов и давали отстояться в разделительной воронке в течение 2 ч. Нижний слой (сырок глицерин) выгружали. Верхний слой (содержащий вещества, растворимые в гексане) собирали и фильтровали, а гексаны отгоняли при пониженном давлении в роторном испарителе. Полученная смесь метилового эфира жирной кислоты (922 г, бледно-желтое прозрачное масло со слабым запахом) анализировалась методом ГХ-МС, оказалось, что она имеет типичный состав жирных кислот соевого масла. Масло растворяли в 0,5 л гексана, смешивали со 100 г водного 10% раствора муравьиной кислоты, содержащего 500 мг поверхностно-активного вещества Tween 80, и подвергали интенсивному перемешиванию при помощи магнитной мешалки. Во время непрерывного перемешивания смеси аккуратно небольшими порциями (20-40 мл) в течение 8 ч добавляли 50% водную перекись водорода (всего 380 мл) для того, чтобы поддерживать экзотермическую реакционную смесь при температуре ниже точки кипения гексанов. Процесс эпоксидирования подвергали мониторингу методом GC-MS (ГХ-МС). После завершения эпоксидирования реакционную смесь разделяли в разделительной воронке и выгружали водный нижний слой. Гексановый слой сушили над безводным сульфатом натрия, фильтровали и отгоняли гексан при пониженном давлении. Полученное масло (1,06 кг) анализировали методом ГХ-МС, было установлено, что его состав практически идентичен составу продукта, полученного в примере 1А.
ПРИМЕРЫ 2-5
Синтез эфиров эпоксидированных жирных кислот проводили в соответствии с примером 1В, используя оливковое масло, масло канолы или кукурузное масло, образцы которых получали из местного бакалейного магазина вместо соевого масла, или в соответствии с примером 1А, используя эпоксидированное льняное масло (Vicoflex 7170, Arkema) вместо эпоксидированного соевого масла. Все примеры проводили при использовании веществ в количестве 25% от использованных в примере 1, соответственно все другие вещества применялись в меньших количествах.
ПРИМЕР 6
0,2 г метилового эфира эпоксидированных жирных кислот соевого масла, полученного из соевого масла согласно примеру 1, и 1 г безводного этиллевулината растворяли в 5 мл третбутилметилового эфира. Во время перемешивания реакционной смеси магнитной мешалкой при комнатной температуре к реакционному раствору добавляли 0,01 мл эфирата трехфтористого бора, наблюдался умеренно экзотермический эффект. После перемешивания в течение 20 мин температура реакционной смеси вновь вернулась к комнатной (18°С), добавляли 0,01 мл эфирата трехфтористого бора, реакционную смесь перемешивали еще в течение 30 мин и анализировали продукты реакции методом ГХ-МС. Было установлено, что реакционная смесь содержит стереоизомеры левулиновых кеталей формул (4) и (11) в качестве основных продуктов реакции:


где R1 обозначает метил и R2 обозначает этил.
Репрезентативные масс-спектры изомеров приведены на Фиг.1.
Было также найдено, что реакционная смесь содержит избыток непрореагировавшего этиллевулината и неизменившийся эфир насыщенной жирной кислоты, который содержался в исходном веществе, полученном из соевого масла.
Было установлено также, что реакционная смесь содержит небольшие количества соединения (12):

ПРИМЕР 7
1 мл эфира эпоксидированной жирной кислоты соевого масла (полученного согласно примеру 1) растворяли в 4 мл сухого метиллевулината и перемешивали реакционную смесь магнитной мешалкой в атмосфере азота. Во время перемешивания раствора инициировали реакцию путем добавления 0,02 мл эфирата трехфтористого бора (наблюдался экзотермический эффект). Развитие реакции наблюдали при помощи метода ГХ-МС. Через 30 мин отбирали образец для ГХ-МС (образец А) и добавляли еще 0,02 мл эфирата трехфтористого бора. После дальнейшего перемешивания в течение 30 мин отбирали другой образец для анализа методом ГХ-МС (образец В). ГХ-МС образца А показали, что основными продуктами реакции были соединение (4):

и стереоизомеры эпоксид-кеталя формул (13а) и (13b)


где R1=R2=метил. Анализ методом ГХ-МС образца В показал, что основными продуктами реакции были соединения (4) и (11), наблюдались только следы соединений (13а) и (13b), что показывает, что соединения (13а) и (13b) являются промежуточными продуктами при получении соединения (4), получаемого при ступенчатом добавлении левулинового эфира к бис-эпоксиду, содержащемуся в исходном веществе.
Репрезентативные масс-спектры соединений (4), (11), (13), полученных в этом примере, показаны на Фиг.2А и 2В.
ПРИМЕРЫ 8-12
Реакции проводили, как описано в примере 7, за исключением того, что вместо трифторида бора использовали один из следующих катализаторов: безводный SnCl2 (50 мг), SnCl4 (50 мг), TiCl4 (50 мг) или п-толуолсульфокислота (20 мг). Реакции проводили в течение 3 ч при температуре 60-80°С. Характеристики ГХ и МС - спектры продуктов, полученных в этих примерах, были полностью идентичны спектрам продуктов по примеру 7.
ПРИМЕР 13
Реакцию проводили, как в примере 7, но вместо эпоксидированных жирных кислот по примеру 1 применяли 1,2 г эпоксидированного соевого масла (Vicoflex 7170, Arkema) и использовали 0,05 мл эфирата трехфтористого бора (все количество вводили сразу). По окончании реакции метиллевулинат отгоняли при пониженном давлении. Полученное масло растворяли в 50 мл смеси гексанов и промывали один раз 10 мл водного 1%-ного раствора фторида натрия и затем дважды 20 мл воды. Раствор в гексанах сушили над безводным сульфатом натрия, фильтровали и удаляли растворитель при пониженном давлении. Получали бледно-желтое масло (1,32 г), которое содержало кетальные аддукты метиллевулината и эпоксидированное масло. Половину этого масла (0,66 г) растворяли в 10 мл метанола, содержащего 0,2% вес./вес. метоксида натрия и перемешивали в течение 2 ч. Затем реакционную смесь нейтрализовали, перемешивая ее с 0,8 г безводного тонкодисперсного порошка дигидрофосфата калия в течение 3 ч, фильтровали и отгоняли метанол при пониженном давлении. Остаток растворяли в 10 мл смеси гексанов и фильтровали. Гексаны удаляли при пониженном давлении, полученное масло (0,46 г) анализировали методом ГХ-МС. Было обнаружено, что состав этого масла практически идентичен составу продукта, полученного в примере 7.
ПРИМЕРЫ 14-17
Синтез осуществляли по примеру 7, за исключением того, что вместо эпоксидированных эфиров из примера 1 использовали эпоксидированные эфиры, полученные по примерам 2-5. Было установлено, что все продукты содержат разные количества соединений (4) и (11), где R1=R 2=метил, в количествах, свидетельствующих о больших количествах эпоксидированных метил-9-октадеценоата и метил-9,12-октадекандиеноата в исходных веществах. Кроме того, продукт, полученный из метиловых эфиров эпоксидированных жирных кислот льняного масла, содержит большие количества (примерно 35 - 45%) трикеталя (12), где R 1=R2=метил.
ПРИМЕР 18
252 г эпоксидированных эфиров жирных кислот соевого масла растворяли в 745 г сухого метиллевулината, смесь перемешивали магнитной мешалкой в атмосфере азота и затем нагревали до 70°С при помощи масляной бани. Эфират трехфтористого бора (1,2 мл) вводили четырьмя порциями (каждая по 0,3 мл) с интервалами в 20 мин, при этом реакционную смесь перемешивали магнитной мешалкой и выдерживали при температуре 65-70°С на масляной бане. Осуществляли мониторинг реакции методом ГХ-МС. После введения всего количества катализатора перемешивание продолжали в течение 1 ч при температуре 70°С и затем в течение 1 ч при комнатной температуре.
Метиллевулинат отгоняли при пониженном давлении в роторном выпаривателе, при температуре нагревательной бани, равной 105-110°C, с применением вакуумного насоса, способного создать вакуум в 6 мм. Полученное масло растворяли в 600 мл смеси гексанов и промывали 100 мл 2%-ного водного раствора фторида натрия и затем дважды промывали 150 мл воды. Промытый раствор в гексане сушили над безводным сульфатом натрия и фильтровали. Фильтрат собирали и гексан отгоняли при пониженном давлении до достижения постоянного веса. Полученное вязкое масло (336 г) имело бледно-желтый цвет и слабый запах, типичный для метилгексадеканоата. Масло анализировали методом ГХ-МС, было установлено, что его состав практически идентичен составу продукта, полученного согласно примеру 6.
ПРИМЕРЫ 19-22
75 г продукта, полученного в примере 18, помещали в круглодонную колбу объемом 500 мл, присоединенную к вращающемуся прибору типа Kugelrohr, и создавали вакуум, используя насос, способный обеспечить вакуум 0,1 миллибар. Вращающуюся колбу, содержащую исходный материал, аккуратно нагревали при помощи теплового ружья, создающего поток нагретого воздуха с температурой 250°C с целью начала устойчивой отгонки метилгексадеканоата и метилоктадеканоата. Отгонку прекращали, когда в приемнике было собрано около 5-10 г метилгексадеканоата и метилоктадеканоата, содержимое неотогнанного вещества оценивали на наличие остаточных метилгексадеканоата и метилоктадеканоата. Процедуру удаления метилгексадеканоата и метилоктадеканоата повторяли несколько раз, каждый раз со свежей порцией исходного вещества. Было установлено, что полученные вещества содержали в основном стереоизомеры монокеталя (4) и дикеталя (11) и небольшие количества трикеталя (12), где R1=R2=метил.
Было найдено, что полученные смеси соединений также содержат небольшие количества метилгексадеканоата и метилоктадеканоата в различных количествах. Общее содержание метилгексадеканоата и метилоктадеканоата, взятых вместе, составляло менее 0,1% (пример 19), примерно 1,5% (пример 20), примерно 2,9% (пример 21) и примерно 5,1% (пример 22) по весу.
ПРИМЕР 23
96 г смеси соединений, полученной в соответствии с примером 19, содержащей преимущественно кетали (4) и (11), где R1 =R2=метил, помещали в круглодонную колбу объемом 500 мл, присоединенную к вращающемуся устройству типа Kugelrohr, создавали вакуум при помощи насоса, способного обеспечить вакуум 0,1 миллибар. Вращающуюся колбу, содержащую исходное вещество, аккуратно нагревали при помощи теплового ружья, создающего поток нагретого воздуха с температурой 350°С. Начиналась отгонка, в приемник было собрано примерно 32 г дистиллята, отгонку прекращали, убирая источник тепла, смеси давали охладиться до комнатной температуры под вакуумом. Дистиллят в виде масла (пример 23А) был практически бесцветным и не имел запаха. Его анализировали методом ГХ-МС, оказалось, что он содержал монокеталь (4), где R1=R 2=метил, со степенью чистоты, равной 96%. Были также обнаружены следы соединений (11), (13а) и (13b) (пример 23А).
Остаточное масло, содержащееся в колбе для отгонки (пример 23В), анализировали методом ГХ-МС, было найдено, что оно содержит примерно 80% стереоизомеров дикеталя (11), 12% монокеталя (4) и небольшие количества трикеталя (12), где R1=R2=метил.
ПРИМЕРЫ 24-28
16 г смеси, содержащей кеталь (4) и дикеталь (11), R1=R2=метил, в качестве основных компонентов, полученной в соответствии с примером 19, растворяли в 40 мм одного из следующих растворителей:
(24) абсолютного этанола, содержащего около 0,2% вес./вес. этоксида натрия;
(25) безводного н-бутанола, содержащего 0,2% вес./вес. н-бутоксида натрия;
(26) безводного изобутанола, содержащего примерно 0,4% изобутоксида натрия;
(27) безводного изоамилового спирта, содержащего 0,3% 3-метилбутоксида натрия;
(28) 2-этилгексилового спирта, содержащего 0,3% 2-этилгексоксида натрия.
Растворы перемешивали в течение 12 ч при помощи магнитной мешалки при комнатной температуре (26°С). Реакцию переэтерификации подвергали мониторингу, осуществляя анализ небольших аликвот реакционных смесей методом ГХ-МС. Были обнаружены смеси соединений (4) и (11), где R1 и R2 каждый обозначает метил и где один из R1 и R2 обозначает метил, а другой обозначает этил, н-бутил, изобутил, изоамил или 2-этилгексил.
Примеры масс-спектров монокеталя (4) и дикеталя (11), полученных в примерах 24 и 25, приведены на Фиг.3 и 4 соответственно.
После практического окончания реакции переэтерификации по данным ГХ-МС реакционные смеси нейтрализовали путем добавления 0,4 - 0,5 г порошка безводного дигидрофосфата калия с последующим энергичным перемешиванием при комнатной температуре в течение 24 ч. Затем растворы фильтровали, из каждого образца отгоняли избыток спирта при пониженном давлении в роторном выпаривателе до достижения постоянного веса каждого образца. Полученные маслянистые продукты анализировали методом ГХ-МС, было найдено, что они содержат преимущественно соединения (4) и (11), где R1=R2 и R 1 и R2 выбраны из этила, н-бутила, изобутила, изоамила, 2-этилгексила.
ПРИМЕРЫ 29-40
Реакцию переэтерификации проводили как в примерах 24 и 25, за исключением того, что исходные материалы, содержащие левилиновые кетальные аддукты (4) и (11), были получены в соответствии с примерами 18, 20, 21, 22, 23А и 23В, полученные продукты содержали R1=R2, выбранные из этила или н-бутила, и включали различные небольшие количества этил- или н-бутиловых эфиров гексадекановой или октадекановой кислоты, эти количества соответствовали их содержанию в исходных веществах до переэтерификации.
ПРИМЕР 41
Были приготовлены пластифицированные композиции на основе PVC, содержащие соединения (4) и (11). Образцы чистых пластифицированных смесей, содержащие разные количества кеталей (4) и (11), полученных в соответствии с примерами 18-40, тщательно предварительно смешивали в стеклянных сосудах объемом 20 мл с сухим порошком PVC (средний Мn около 55000, средний Mw 97000, характеристическая вязкость 0,92, относительная вязкость 2,23, поставщик - Sigma Aldrich Company, Cat. N 34677-2), в количествах, обеспечивающих конечное содержание пластификатора, равное 20%, 40% или 60% по весу. В качестве эталонных пластификаторов применяли бис-(2-этилгексил)фталат, бис-(2-этилгексил)себацинат и эпоксидированное соевое масло (Vicoflex, Arkema). Каждую из полученных смесей по отдельности вводили в предварительно очищенный миниатюрный двухшнековый смеситель - экструдер Daca Microcompounder (Daca Instruments) в атмосфере азота, при этом камеру для смешения нагревали до 160°С и скорость мотора была равна 100 об/мин. Смесь перемешивали в течение примерно 5 мин. Полученный расплав затем подвергали экструзии из камеры для смешения, получая гибкий кружок (диаметр 3 мм), который сразу же охлаждали до комнатной температуры на воздухе.
Для образцов пластифицированного PVC, вырезанных из кружков, определяли температуры стеклования (методом дифференциальной сканирующей калориметрии) и выпотевания пластификатора.
Было найдено, что все смеси, содержащие соединения (4) и (11), обладают удовлетворительными свойствами, о чем свидетельствуют пониженные температуры стеклования по сравнению с непластифицированным полимером.
Соединения превосходно совмещались с полимером, что показывало их минимальное или незначительное выпотевание из образцов. Пластифицирующая способность смесей соединений, полученных в соответствии с примерами 18-40, как было установлено, превосходит пластифицирующую способность бис-(2-этилгексил)фталата или сравнима с ней. Совместимость с PVC и показатели выпотевания также превосходят эти свойства у эпоксидированного соевого мала и бис-(2-этилгексил)фталата при испытанных концентрациях.
Оптимальная комбинация пластифицирующей способности и совместимости наблюдалась в условиях испытаний, когда смеси пластификатора содержали преимущественно монокеталь (4) и/или дикеталь (11) с R1=R2 =этил или н-бутил. Кроме того, образцы смесей пластификаторов, содержащих монокеталь (4) и дикеталь (11), при концентрации алкилгексадеканоата и алкилоктадеканоата, равной около 5% или менее от веса пластификатора, проявляли лучшую совместимость с PVC и не выпотевали по сравнению с теми образцами, в которых концентрация алкилгексадеканоата и алкилоктадеканоата была выше примерно 5%.
ПРИМЕР 42
Образцы пластифицированного РНВ (поли-(3-гидроксибутират), природного происхождения, т. пл. 172°С, поставщик - Sigma Aldrich, Cat. N 36350-2), готовили в соответствии с примером 41, за исключением того, что температура смесительной камеры была равна 180°С, время смешения составляло 3 мин; смеси пластификаторов по примерам 18-40, содержащие кетали (4) и (11), вводили в количестве 5, 10, 20 и 30% по весу. Было установлено, что смеси пластификаторов, у которых R1=R2 =метил или этил, введенные в концентрации, равной примерно 20% вес или ниже, а содержание соответствующих алкилгексадеканоата и алкилоктадеканоата составляло примерно 1,5% от веса пластификатора или менее, обладали удовлетворительными пластифицирующей способностью и совместимостью.
ПРИМЕР 43
Пластифицированные полимерные композиции были получены, как в примере 42, за исключением того, что использовали ацетат целлюлозы, содержащей 39,8% ацетильных групп, с Мn около 30000 (Sigma Aldrich, Cat. N 18095-5). Полученные результаты были похожи на результаты, полученные для полиэфира РНВ в примере 42.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Соединение формулы где R1 обозначает С1-С 10 линейный или разветвленный алкил или алкоксиалкил; один из А или В обозначает водород и другой обозначает С1 -С10 линейную или разветвленную алкоксикарбонильную группу; "n" и "m" независимо обозначают целые числа от 0 до 20, при этом сумма m+n находится в пределах от 8 до 21.
где R1 обозначает С1-С 10 линейный или разветвленный алкил или алкоксиалкил; один из А или В обозначает водород и другой обозначает С1 -С10 линейную или разветвленную алкоксикарбонильную группу; "n" и "m" независимо обозначают целые числа от 0 до 20, при этом сумма m+n находится в пределах от 8 до 21.
2. Соединение формулы  где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
3. Соединение формулы  ,где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
,где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
4. Соединение формулы  где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
5. Соединение формулы  где R1 и R2 независимо обозначают C1-С10 линейный или разветвленный алкил или алкоксиалкил.
где R1 и R2 независимо обозначают C1-С10 линейный или разветвленный алкил или алкоксиалкил.
6. Соединение формулы  где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
где R1 и R2 независимо обозначают С1-С10 линейный или разветвленный алкил или алкоксиалкил.
7. Соединение по любому из пп.2-6, отличающееся тем, что R1 и R2 независимо выбраны из группы, состоящей из метила, этила, н-бутила, изобутила, изоамила и 2-этилгексила.
8. Соединение по п.7, отличающееся тем, что R1 и R2 независимо выбраны из группы, состоящей из метила, этила и н-бутила.
9. Способ получения соединения по любому из пп.1-6 или их смесей, включающий:осуществление реакции между производным эфира эпоксидированной жирной кислоты и одного или более соединений из эфиров левулиновой кислоты и ангеликалактона в присутствии кислого катализатора.
10. Пластифицированная полимерная композиция, включающаяа) основной полимер иб) соединение по любому из пп.1-6, при этом основной полимер выбран из группы, состоящей из полимера винилхлорида, поли-(3-гидроксиалканоата) и полисахарида.
11. Пластифицированная полимерная композиция по п.10, отличающаяся тем, что основной полимер представляет собой полимер винилхлорида.
www.freepatent.ru
Способ получения эпоксидированных сложных эфиров
с
О 6::И-C.,AP И Е
ИЗОБРЕТЕНИЯ
327I65
Союз Советских
Социалистических
Республии
Зависимое от авт, свидетельства №
Заявлено 14.IV.1969 (№ 1321031/23-4) с присоединением заявки №
Приоритет
Опубликовано 26.1.1972. Бюллетень ¹ 5
Дата опубликования описания 20.11|.1972
М. Кл. С 07с 69/14 йамитет оо делаю изобретений и открытие ори Совете Министров
СССР
УДК 547.290.26.07 (088.8) Авторы изобретения
С. И. Дворкина, P. В. Воробьева, А. T. Пилтокова, Е. В. Федорова и В. Я. Мозговая
Заявитель
СПОСОБ ПОЛУЧЕНИЯ
ЭПОКСИДИРОВАННЪ|Х СЛОЖНЫХ ЭФИРОВ
Изобретение относится к области органического синтеза, а именно к получению пластификаторов-стабилизаторов, широко применяемых в производстве пластических масс.
Известен способ получения сложных эпоксидированных эфиров смеси алифатических карбоновых кислот С4 — С9, выделяемых из отходов производства себациновой кислоты (кипящих в пределах 120 — 250 С) и алифатического спирта, путем обработки эфира перекисью водорода в уксуснокнслой среде.
Указанные эфиры могут применяться как пластификаторы-стабилизаторы в производстве пластических масс.
Недостаток способа состоит в том, что указанные кислоты С4 — Се содержатся в отходах до 15%. Остальное количество приходится на кислоты Св — С2о, кипящих при 250 — 400 С.
Цель настоящего изобретения состоит в разработке такого способа получения нового эпоксиэфира, который позволит значительно расширить сырьевую базу для производства пластификаторов за счет использования большой части основной массы смеси жирных кислот содержащихся в отходах производства себациновой кислоты с одновременным улучшением качества целевого продукта и уменьшением токсичности и пожаро- и взрывоопасности производства.
Согласно нзобретеьнно, поставленая цель достигается тем, что эпоксиднруют не подвергнутые нейтрализации октиловые эфиры смеси жирных кислот предельных непредель5 ных и оксикислот состава С8 — С2о, выделенных из отходов производства себациловой кислоты при температуре паров до 215 С, при остаточном давлении 5 — 10 хтхт рт. ст. и температуре острого пара 230 †2 С.
10 Процесс эпоксидпрования производят преимущественно при соотношении пергидроли и уксусной кислоты 5: 1, что исключает применение органического растворителя.
Операции осуществляют в следующем по15 рядке.
Отходы производства себациновой кислоты тщательно освобождают от летучих продуктов реакции и воды путем высушивания в неглубоком вакууме при температуре 40 — 80 С.
20 Сухие отходы подвергают дистиляции в вакууме прп остаточном давлении 5 — 10 лтлт. рт. ст., температуре в реакционной массе 250—
300 С и температуре перегретого острого пара 230 †2 С. В этих условиях извлекают до
25 70% смеси высших кислот состава Cs — C20) содержащих до 72% непредельных кислот.
Последние подвергают эфиризации октиловым спиртом в присутствии катализатора серной кислоты при температуре 100 — 130 С и оста30 точном давлении 600 — 700 ттм. рт. ст. Полу327165
Новый эфир, полученный по предлагаемому способу
Эфир, полученный по известному способу
Показатели
Иодное число в .иг lq иа !00 г
Содержание эпоксидного кислорода ю/о
Удельное объемное электро15 сопротивление, с.и/с.и
Температура вспышки, С
Выход эфира (в пересчете на нсходныс отходы), %
2 — 3,2
1,76 — 1,86
15 — 35
0,48
4X10"
0,5)(10ы
202
65 — 70
13,5
Предмет изобретения
Сост и шггсль T. Лавриненко
Тсхрсд Е. Борисова
Корректор !1, Шматева
Редактор А. Герасимова
Заказ 538/5 Изд. Ко !57 Тираж 448 Подписное
ЦНИИПИ Комитета по делам изобретений и открытий при Совете Министров ССС!?
Москва, Ж-35, Раушская наб., д. 4/5
Типография, ир. Сапунова, 2 чснный эфир, без его предварительной нейтрализации, подвергают эпоксидированию падуксусной кислотой в момент ее образования в присутствии катализатора — серной или другой минеральной кислоты при 58 — 70 С (предпочтительно 60 — 65" С) в течение 12 час при непрерывном перемешиванип.
Максимальная глубина эпоксидирования достигается при соотношении перекиси водорода и ледяной кислоты уксусной или уксусного ангидрида 5: 1. На 1 по,гь эфира берут
0,2 — 0,25 люль ледяной уксусной кислоты или уксусного ангидрида.
Обязательным условием успешного проведения процесса является следующий порядок загрузки реакционной смеси. К эфиру добавляют уксусный ангидрид, массу нагревают до температуры реакции и к ней в течение 1—
1;5 час каплями добавляют смесь пергидроли с минеральной кислотой.
Полученный эпоксиэфир отделяют от водного слоя, промывают несколько раз водой, нейтрализуют 10-кратным (против теории) количеством сухой кальцинированной соды, отфильтровывают и высушивают в вакууме на водяной бане.
Пример 1. К 100 г октилового эфира жирных кислот добавляют 5,5 г уксусного ангидрида, нагрева!от до 60 С, добавляют IIOpциями смесь, состоящую из 10,8 г перекиси водорода (100 о/о ) и 0,5 г серной кислоты.
Смесь перемешивают 12 — 16 час при 60 С, отделяют нижний водный слой от эпоксиэфира, последний промывают, нейтрализуют кальцинированной содой, су.шат в вакууме, фильтруют и получают 101 г эпоксиэфира с йодным числом 2,4 с содержанием эпоксидного кислорода 1,76 о/о.
Пример 2. К 100 г октилового эфира жирных кислот добавляют 4,2 г уксусной кислоты, нагревают до 60 и добавляют 86 г (100 ) перекиси водорода и 0,5 г серной кислоты. Далее процесс ведут как в примере 1. Получают 100 г эпоксиэфира с йодны;I числом 3,2, содержанием эпоксидного кислорода 1,83о/о и кислотным числом 0,6.
Полученный в результате лабораторной разработки эфир имеет показатели, представляемые в таблице.
Как видно из данных таблицы, эфир, полученный по предлагаемому способу, отличается высоким качеством по основным показателям, более низким йодным числом и высоким со25 держанием эпоксидного кислорода, что оказывает большое влияние на качество пластификатора по термостойкости технологичности.
Выход эфира в пересчете на исходные отходы превышает выход эфира IIo известному спосо30 бу в несколько раз, 1. Способ получения эпоксидированных
35 сложных эфиров смеси алифатических карбоновых кислот производства себаниновой кислоты и алифатического спирта путем обработки указанного эфира перекисью водорода в уксуснокислой среде при нагревании, отли40 чающийся тем, что, с целью расширения ассортимента соединений, используемых в качестве пластификатора-стабилизатора, в качестве смеси алифатических карбоновых кислот используют смесь кислот Са — С о.
45 2. Способ по п. 1, отличающийся тем, что используют смесь алифатических карбоновых кислот с т. кип. 250 — 400 С.


www.findpatent.ru
Эпоксидирование ненасыщенных сложных эфиров - Справочник химика 21
Группу природных соединений, находящихся в тканях растительных и животных организмов, составляют жиры и жироподобные вещества (общее название — липиды). Жиры — это сложные эфиры глицерина п высших жирных кислот насыщенных (пальмитиновой, стеариновой) и ненасыщенных (олеиновой, линолевой, линоленовой и др.). Эти эфиры называют глицеридами. Жидкие жиры (масла) содержат в основном кислотные остатки ненасыщенных, твердые — насыщенных кислот. Ненасыщенные жиры легко окисляются кислородом воздуха, подвергаются каталитической гидрогенизации и эпоксидированию надкис-лотами. Пищевой жир — маргарин — представляет собой смесь гидрогенизиро-ванных масел (подсолнечного, хлопкового). [c.101] Химические свойства. Исследована способность к пластификации поливинилацетата следующих веществ эпоксидированных сложных эфиров олеиновой и стеариновой кислот или олеинового спирта [819], эфиров жирных кислот соевого масла, модифицированных эпокси- или ацетоксигруппой [820], дибутилфталата, диметилциклогексилфталата, ди- . гек-силфталата, тритолилфосфата, трикрезилфосфата, ди-н. бутил-адипата, хлорированного дифенила [821—825], N.N-дизаме-щенных амидов ненасыщенных жирных кислот [826] и других соединений [827, 828]. [c.464]Эпоксидирование а, Р-ненасыщенных сложных эфиров [c.425]
Эпоксидирование а,р-ненасыщенных сложных эфиров обычными. методами редко протекает удачно к успеху приводит использование трифторнадуксусной кислоты в присутствии динатрийфосфатного буфера (Эммонс, 1955) или чистой надуксусной кислоты (см. 5.17) в этилацетате или о ацетоне (Мак Пик, 1959). [c.569]
Сопряженные диены подвергаются эпоксидированию (1,2-присоединение), хотя реакция идет медленнее, чем для соответствующих олефинов, но а,р-ненасыщенные кетоны при обработке перкислотами не эпоксидируются [569]. Однако а, 3-нена-сыщенные сложные эфиры реагируют обычным образом, давая глицидные сложные эфиры [570]. Если карбонильная группа в молекуле не сопряжена с двойной связью, то с реакцией эпо-ксидирования конкурирует реакция Байера — Виллигера (т. 4, реакция 18-22). Под действием перкислот аллены превращаются в алленоксиды 69 [571] или в спиродиоксиды 70, которые в некоторых случаях удается выделить [572], но чаще они оказываются неустойчивыми в условиях проведения реакции и реагируют дальше, давая другие продукты [573]. [c.226]
Эпоксидированные растительные масла. Сложные эфиры и глицериды ненасыщенных высших жирных кислот, например олеиновой и линолевой, обычно недостаточно полярны для хорошей со-йместимости с большинством полярных полимеров. Однако совместимость может быть достигнута при обработке их органическими [c.339]
Хорошими стабилизаторами являются сложные эфиры ароматических и алифатических кислот, содержащих этиленоксидную группу, например эфиры эпоксидированных олеиновой и других ненасыщенных кислот, получаемых гидролизом различных масел. В качестве спиртов применяются метанол, бутанол, октанол, циклогексанол, тетрагидрофурфуриловый спирт, монобутиловый эфир диэтиленгликоля и др. Наличие этиленоксидных групп улучшает совместимость хлорсодержащих полимеров и эфиров жирных кислот. Поэтому описанные эпоксидированные соединения часто рассматриваются не только как стабилизаторы, но и как пластификаторы . В промышленности применяются эпоксидированные масла например зпоксидированное соевое масло. Пригоден для этой цели эпоксидированный китовый жир . Однако как пластификаторы они уступают таким соединениям, как трикрезилфосфат и ди-2-этил-гексилфталат. Эффективными стабилизаторами-пластификаторами являются эпоксидированные моно- и диацетоглицериды, например сложный эфир глицерина с одной молекулой эпокси-стеариновой и двумя молекулами уксусной кислоты , эпоксидированные сложные эфиры гликолей и пeнтaэpитpитa Эпоксидные пластификаторы целесообразно применять совместно с обычными стабилизаторами, например солями тяжелых металлов . [c.93]
chem21.info
Эфиры эпоксидных смол - Справочник химика 21
Эфир эпоксидной смолы . . . 0,75 - 0,75 3 0,25 [c.34]Эфир эпоксидной смолы . . . 3,00 - 3,0 3 1,00 [c.34]
Для поверхностного окрашивания полистирола пригодны масляные краски, а также эмалевые краски на основе полужирных и жирных алкидных смол на льняном и соевом масле и сложных эфиров эпоксидных смол на льняном масле, растворимых в лаковом бензине. Состав белой эмали на основе алкидной [c.61]
Из названных способов печатания наименее пригоден для полиэтилена способ высокой (типографской) печати, хотя в ЧССР им постоянно пользуются. В частности, этим способом печатают на готовых полиэтиленовых пакетах. Печатные краски, применяемые для этой цели, обычно приготовляются на основе высыхающих алкидных смол или сложных эфиров эпоксидных смол. Они закрепляются в результате окислительной полимеризации связующего для ускорения процесса высыхания в краску вводят соответствующие сиккативы. Для доведения краски до рабочей консистенции можно применять только разбавители, содержащие высыхающие масла. Невысыхающие масла для этой цели принципиально непригодны, так как нарушают процесс пленкообразования и иногда даже сильно размягчают образовавшуюся нленку печатной краски, снижая тем самым ее стойкость к механическому - истиранию. Основной недостаток типографских печатных красок — относительная длительность высыхания. Учитывая свойства полиэтиленовой пленки, этим способом на ней нельзя печатать несколькими красками, особенно если требуется соблюдение точной приводки (совмещения) красок. Кроме того, при печатании невозможно обойтись без прокладок для ускорения процесса высыхания краски. [c.79]Сложный эфир эпоксидной смолы Алкидная смола То же [c.367]
По описанной технологической схеме изготавливают премикс ПСК-4 на основе ненасыщенных эфиров эпоксидных смол. Этот материал обладает повышенными водостойкостью и термостойкостью. Условная температура разложения связующего у ПСК-4 на 30 °С выше, чем у ПСК-1, и составляет 250—260 °С. Изделия из ПСК-4 можно эксплуатировать при температуре 180— 200 °С в течение 30—60 сут, а также в условиях тропического климата. В результате введения в смолу ЗСП-3 сополимера стирола с а-метилстиролом марки САМИ получено связующее, на основе которого изготавливают премикс ПСК-8, отличающийся стабильной усадкой 0,10—0,15%. Поверхность прессованных изделий получается глянцевой, гладкой, без волнистости и -короблений [95]. [c.53]
Эфиры эпоксидных смол с невысыхающими жирными кислотами, совмещенные с аминосмолами, служат главным образом [c.680]
Подробно -исследовалось влияние добавок аминосмол к лакам горячей сушки на основе эфиров эпоксидных смол. Было установлено, что этерифицированные смолы на основе меламина превосходят этерифицированные смолы на основе мочевины по глянцу и степени возможного совмещения с эфирами эпоксидных смол. Однако добавки аминосмол любого вида снижают гибкость и адгезию пленок. В табл. 33 показано, в каких количествах могут до- [c.682]
Общие замечания для лаков на основе эфиров эпоксидных смол. У лаков на слишком низкомолекулярном полимерном глицидном эфире бисфенола А и у пигментированных лаков за счет плохой смачиваемости пигмента быстро теряется глянец. Лаки на основе эфиров эпоксидных смол (чистые или пигментированные) при применении их для лакирования лодок превосходят по прочности все выпускаемые промышленностью лаковые композиции. [c.684]
Эпоксиэфиры (эфиры эпоксидных смол). Эпоксиэфиры растворимы в углеводородах, и поэтому выбор растворителей для них не представляет трудностей. Аналогично алкидам, для эпоксиэфиров, в зависимости от жирности необходимо выбирать соответствующее соотношение алифатических и аро-матических углеводородов. [c.286]
За последнее время появился ряд работ (Г. Л. Юхнов-ский, В. М. Кузнецова, 1967) в области получения ненасыщенных эфиров эпоксидных смол и их использования в качестве связующих. [c.50]
Молотков Р. В., Левитская О. М. и др. Ненасыщенные эфиры эпоксидных смол в качестве связующих. Пластмассы, 1969, 8. [c.163]
В заключение рассмотрим вкратце химическое строение и характеристику свойств основных полимерных веществ, используемых при изготовлении кинодекорационной бутафории и бутафорского реквизита. К ним относятся полиэтилен, некоторые полимеры винилового ряда (поливинилацетат, полистирол, полиакриловая и полиметакриловая кислоты и их эфиры), эпоксидные смолы. [c.152]
Эпоксиэфиры второго типа синтезируют в более мягких условиях кроме того, часть жирных кислот высыхающих масел может быть заменена жирными кислотами таллового масла, но водные растворы этих эпоксиэфиров, как и в случае алкидов, легко гидролизуются в слабощелочной среде по сложноэфирным группам. Синтез таких олигомеров проводят в две стадии. На первой стадии получают гидроксилсодержащие эфиры эпоксидной смолы Э-40 и одноосновных высших жирных кислот, например жирных кислот льняного масла. Условия синтеза и некоторые характеристики таких эфиров приведены ниже [c.44]
На основе эфиров эпоксидных смол можно получить покрытия как холодного, так и горячего отверждения. [c.64]
Хорошие результаты были достигнуты при модификации эпоксидных эфиров. Успешно используются стиро-лизированные эфиры эпоксидных смол. В присутствии кобальтового сиккатива они образуют быстросохнущие прозрачные твердые пленки с высокой химической и атмосферной стойкостью. [c.65]
Эфиры эпоксидных смол чаще всего выпускаются в виде растворов с переменным содержанием сухого остатка (обычио ог 50 до 80%), причем растворителями в зависимости от длины [c.414]
Получение глицидных эфиров (эпоксидных смол) [c.99]
Сложные эфиры эпоксидных смол .... .........606 [c.49]
Из-за повышенной хрупкости пленок и недостаточной адгезии к подложкам, аминосмолы применяются только в сочетании с другими смолами, например алкидными и эпоксидными, а также с эфирами эпоксидных смол. [c.86]
СЛОЖНЫЕ ЭФИРЫ ЭПОКСИДНЫХ смол [c.98]
Эфиры эпоксидных смол и ненасыщенных кислот отверждаются, так же как и алкидные смолы, в результате протекания окислительных процессов, следовательно, — на воздухе и при комнатной температуре. 15 лаках горячей сушки применяются также и эфиры насыщенных кислот, но обычно в сочетании с 15—30% мочевино- или меламино-формальдегидных смол. Такие лаки обладают хорошей адгезией к металлическим подложкам и часто применяются в качестве грунтовых лаков горячей сушки. [c.99]
Эфир эпоксидной смолы, полученный при взаимодействии 59 вес. % смолы Эпон 1001 с мол. в. 875 и функциональностью 6,0 с 41 вес. % лауриновоА кислоты. [c.34]
Описаны способы получения смешанных смол на основе мочевины и тиомочевины, модифицированных углеводородами или низшими алифатическими спиртами , сульфированных мочевино- и тиомочевиноформальдегидных смол з2, а также способы получения мочевиноформальдегидных смол, модифицированных бутанолом - метилбутиловым эфиром эпоксидными смолами , акриламидом . Патентуется метод получения порошкообразной синтетической смолы из мочевины и СНгО в присутствии гексаметилентетрамина и пригодной для литья мочевиноформальдегидной смолы, содержащей меламин , а также гранулированной мочевиноформальдегидной смолы . [c.370]
Способом трафаретной печати осуществляется печатание преимущественно на толстой пленке и формованных изделиях, например бутылках. В качестве связующих для красок трафаретной печати используют сложные эфиры эпоксидных смол (в этом случае краски закрепляются в сущности так же, как краски для типографской печати) или нитроцеллюлозу, поливинилметиловый эфир и др. (в этом случае краски закрепляются в результате испарения растворителя). Скорость закрепления краски зависит прежде всего от летучести растворителей, но ее можно повысить также применением подогрева. Высыхание при повышенной температуре более рационально, так как в этом случае краска может содерлсать вышекинящне растворители и не будет высыхать на форме-трафарете. [c.79]
Аэрозоль с антибиотиком Смесь наиболее эффективных эфиров п-оксибензойной кислоты Сложные эфиры эпоксидных смол Силиконовые жидкости Полиоксиэтиленовые эфиры (смешанные) жирных и смоляных кислот. Детергенты и пентогасители Циклическая кетонная смола Инсектицид [c.366]
Отверждение кремнийоргани4еских смол происходит в результате взаимодействия оставшихся в олигомерах силанольных групп между собой и с отвердителями — алкоксисиланами. Катализаторами отверждения служат олово- и титанорганические соединения, амины и их комплексы, а также органические соли щелочных металлов, свинца, железа, кобальта. В процессе отверждения выделяются низкомолекулярные вещества — обычно вода или спирт. Довольно широко используется модифицирование кремнийорганических смол ненасыщенными сложными эфирами, эпоксидными смолами и др., осуществляемое обычно на стадии синтеза смол после гидролиза органохлорсиланов. [c.89]
Для таких материалов обычно используют низко- или среднемолекулярные эпоксидные смолы, а в качестве реакционноспособных растворителей упомянутые выше алициклические эпоксидные смолы, эпоксидированные масла, а также моноглицидиловые эфиры, эпоксидные смолы на основе алифатических многоатомных спиртов и др. [c.168]
Р. Gastan, С. Q а и d i 1 1 о п, Об эфирах эпоксидных смол и о некоторых их аналогах. [c.587]
Многие лаки на основе эфиров эпоксидных смол обладают худшей смачивающей способностью, чем лаки на основе алкпдных смол, и поэтому для того, чтобы добиться хорошего смешения с порошкообразными пигментами, необходимо вводить специальные смачивающие агенты. Для этой цели пригодны нафтенаты цинка или кобальта, которые добавляют в количестве 1—2% в процессе помола. [c.681]
В качестве сиккатива для лаков воздушной сушки на основе эфиров эпоксидных смол в первую очередь рекомендуют вводить 0,04% (в расчете на содержание смолы) нафтената кобальта. Свинцовые сиккативы в данном случае оказываются непригодными, так как они значительно снижают стабильность. Однако можно использовать сиккативы кальция и марганца. Кальциевые сиккативы улучшают время сущки, в особенности у высокопигмен-тированных лаков марганцовые сиккативы вызывают медленное [c.681]
При введении аминосмол всегда происходит снижение химической стойкости, однако оно более значительно при введении смол на основе мочевины, чем при введении смол на основе меламина. Уже прн небольшой добавке аминосмолы кислотостой-кость лаков значительно снижается водостойкость же ухудшается лишь при введении значительно больших количеств аминосмол. Стойкость к щелочам, не особенно хорошая у лаков на основе чистых эфиров эпоксидных смол, при добавлении аминосмол улучшается. Оптимальные значения характеристик, которые можно получить приготовлением композиций с аминосмолами или полиамидными смолами, в сравнении с чистым алкидным лаком (ОСО-алкидный лак), видны из табл. 34 причем лаки были высушены при оптимальных режимах. [c.683]
Газонепроницаемость лаковой пленки на основе эфира эпоксидной смолы повышается у немодифицированных лаков добавкой 1% триэтаноламина и у лаков, содержащих аминосмолу, добавкой 7,5% монобутилфосфата. [c.684]
Т. R. Hopper, Получение эфиров эпоксидных смол для покрытий, Ат. [c.897]
В качестве первичных стабилизаторов (термостабилизаторов), основное назначение которых — связывать отщепляющийся при нагреве хлористый водород, используют основные и средние соли свинца, оловоорганические соединения, диалкилкарбоксилаты или диалкилтиокарбоксилаты, мыла бария, кадмия, кальция, цинка и некоторых других металлов. В качестве вторичных стабилизаторов, ослабляющих влияние специфических условий эксплуатации, используют антиоксиданты, например производные фенолов и дифенолов, гидрохиноны, производные мочевины, тиомочевины, органические фосфиты, соединения, поглощающие УФ-лучи (производные бензофенонов или бензтриазолов, кумарина, салициловой кислоты), вспомогательные стабилизирующие агенты (эпоксидированные природные масла, сложные эфиры, эпоксидные смолы). [c.179]
Такие гидроксилсодержащие производные изоциану-ровой кислоты более приемлемы, так как их легко синтезировать по известной и легко протекающей реакции циануровой кислоты с эпоксидными соединениями, окисями олефинов, глицидиловыми простыми эфирами, эпоксидными смолами на основе дианов и т. д. [c.246]
Наконец, укажем продукты (в, сущности они уже не могут рассматриваться как истинные эпоксидные смолы), представляющие собой продукты модификации эпоксидных смол жирными кислотами высыхаюших масел (эфиры эпоксидных смол) или термореактивными смолами (начальные продукты конденсации). В зависимости от условий приготовления эти модифицированные смолы представляют собой растворы или твердые продукты. [c.414]
Первые пленкообразующие для анодного электроосаждения представляли собой малеинизированные масла и производные масел, затем появились конденсаты винилированного и алкид-ного типов и, наконец, сложные эфиры эпоксидных смол на основе малеинизированных жирных кислот. Поскольку композиции на основе эпоксидных смол очень хорошо зарекомендовали себя в качестве грунтовок по металлу, эпоксидные связующие играют основную роль как в анодных, так и в катодных системах, особенно при окраске автомобилей. [c.72]
chem21.info