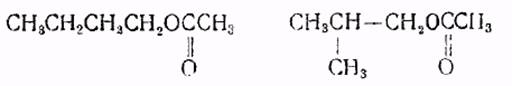Способ получения сложного (4r-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Диметилэтиловый эфир
способ получения сложного (4r-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты - патент РФ 2067580
Использование: в синтезе промежуточного соединения, применяемого в процессе получения ингибиторов биосинтеза холестерина. Сущность: способ получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Б. Ф. С14Н23NO4, т. пл. 67,2 - 69,7oС. Реагент 1: сложный (4R-цис)-1,1-диметилэтиловый эфир 2,2-диметил-1,3-диоксан-4-уксусной кислоты ф-лы 2, где L - атом галогена или группа ф-лы IIa, где Ar - фенил, замещенный одним или двумя заместителями, из числа: атом галогена или нитрогруппа. Реагент 2: соединение ф-лы: M-CN, где M - атом щелочного металла. Условия процесса: 0 - 100oС в среде растворителя. Соединение ф-лы I является сырьем для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты, который представляет собой промежуточное соединение для получения ингибиторов биостинтеза холестерина. Структура соединений формул:
 Изобретение относится к синтезу промежуточного соединения, применяемого в процессе получения ингибиторов биосинтеза холестерина, более конкретно к способу получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты представляет собой исходное соединение для получения (4R-цис)-1,1-диметилэтилового эфира 6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты, который применяют в процессе получения (2R-транс)-5-(4-фторфенил)-2-(-метилэтил)-N, 4-дифенил-1- [2-тетрагидро-4-окси-6-оксо-2Н-пиран-2-ил)-этил]-1Н-пиррол-3-карбоксамида или соли гидроксильной кислоты, [R-(R*,R*)]-1-(4-фторфенил)-
Изобретение относится к синтезу промежуточного соединения, применяемого в процессе получения ингибиторов биосинтеза холестерина, более конкретно к способу получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты представляет собой исходное соединение для получения (4R-цис)-1,1-диметилэтилового эфира 6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты, который применяют в процессе получения (2R-транс)-5-(4-фторфенил)-2-(-метилэтил)-N, 4-дифенил-1- [2-тетрагидро-4-окси-6-оксо-2Н-пиран-2-ил)-этил]-1Н-пиррол-3-карбоксамида или соли гидроксильной кислоты, [R-(R*,R*)]-1-(4-фторфенил)- ,d-диокси-5- (1-метил-этил)-3-фенил-4-[(фениламино)-карбонил] -1Н-пиррол-1-гептановой кислоты (2 1) (см. например, патент США N 4647576, кл. C 07 D 405/06, A 61 K 31/40, 1987, патент США N 4681893, кл. A 61 K 31/40, 1987 и патент США N 4681893, кл. A 61 K 31/40, С 07 D 207/327, 1987). Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты можно получать различными путями, известными специалисту в данной области. Задачей изобретения является расширение возможностей получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты за счет разработки простого и экономичного способа. Данная задача решается предлагаемым способом получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы:
,d-диокси-5- (1-метил-этил)-3-фенил-4-[(фениламино)-карбонил] -1Н-пиррол-1-гептановой кислоты (2 1) (см. например, патент США N 4647576, кл. C 07 D 405/06, A 61 K 31/40, 1987, патент США N 4681893, кл. A 61 K 31/40, 1987 и патент США N 4681893, кл. A 61 K 31/40, С 07 D 207/327, 1987). Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты можно получать различными путями, известными специалисту в данной области. Задачей изобретения является расширение возможностей получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты за счет разработки простого и экономичного способа. Данная задача решается предлагаемым способом получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы: который заключается в том, что соединение формулы:
который заключается в том, что соединение формулы: где L означает галоид или группу
где L означает галоид или группу  , где Ar означает фенил, замещенный одним или двумя заместителями из числа галоида и нитро, подвергают взаимодействию с соединением формулы: M-CN (III), где M означает щелочной металл, при температуре примерно 0 100oС в среде растворителя. Соединение формулы II, где L означает группу
, где Ar означает фенил, замещенный одним или двумя заместителями из числа галоида и нитро, подвергают взаимодействию с соединением формулы: M-CN (III), где M означает щелочной металл, при температуре примерно 0 100oС в среде растворителя. Соединение формулы II, где L означает группу  , получают взаимодействием соединения формулы:
, получают взаимодействием соединения формулы: c соединением формулы:
c соединением формулы: где Ar имеет вышеуказанное значение, а X означает галоид, в среде растворителя в присутствии основания. Соединение формулы II, где L означает галоид, получают взаимодействием соединения формулы II, где L означает группу
где Ar имеет вышеуказанное значение, а X означает галоид, в среде растворителя в присутствии основания. Соединение формулы II, где L означает галоид, получают взаимодействием соединения формулы II, где L означает группу  , где Ar имеет вышеуказанное значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. Предлагаемый способ основан на замене сульфонатов или галоидов на цианид. Такая замена широко известна в литературе. Однако такая замена еще не могла успешно проводиться в комплексных системах, в частности в системах, содержащих 1,3-диоксановое кольцо. В связи с этим внимание обращается на Sunay, U. и Fraser-Reid, B. Tetrahedron Letters, 27, с. 5335 5338, 1986, где сообщается о неудаче такой замены в системе, содержащей 1,3-диоксановое кольцо. Следовательно, успешное проведение предлагаемого способа нельзя было предвидеть, в связи с чем предлагаемый способ следовало бы рассматривать как обладающий изобретательским уровнем. Реакцию соединения форму IV и V обычно осуществляют при температурах примерно -40oС. При этом в качестве основания можно применять, например, триэтиламин, диизопропилэтиламин, 4-диметиламинопиридин и тому подобное. В качестве растворителя можно применять, например, пиридин, толуол, хлористый метилен и тому подобное. Предпочтительно реакцию осуществляют в среде хлористого метилена в присутствии триэтиламина при температуре примерно 0 - 25oС. В качестве растворителя для проведения реакции соединения формулы II, где L означает группу
, где Ar имеет вышеуказанное значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. Предлагаемый способ основан на замене сульфонатов или галоидов на цианид. Такая замена широко известна в литературе. Однако такая замена еще не могла успешно проводиться в комплексных системах, в частности в системах, содержащих 1,3-диоксановое кольцо. В связи с этим внимание обращается на Sunay, U. и Fraser-Reid, B. Tetrahedron Letters, 27, с. 5335 5338, 1986, где сообщается о неудаче такой замены в системе, содержащей 1,3-диоксановое кольцо. Следовательно, успешное проведение предлагаемого способа нельзя было предвидеть, в связи с чем предлагаемый способ следовало бы рассматривать как обладающий изобретательским уровнем. Реакцию соединения форму IV и V обычно осуществляют при температурах примерно -40oС. При этом в качестве основания можно применять, например, триэтиламин, диизопропилэтиламин, 4-диметиламинопиридин и тому подобное. В качестве растворителя можно применять, например, пиридин, толуол, хлористый метилен и тому подобное. Предпочтительно реакцию осуществляют в среде хлористого метилена в присутствии триэтиламина при температуре примерно 0 - 25oС. В качестве растворителя для проведения реакции соединения формулы II, где L означает группу  , с йодидом щелочного металла, таким, как, например, йодид натрия или калия, можно применять, например, ацетон, 2-бутанон и тому подобное. Реакцию предпочтительно осуществляют в среде 2-бутанона при температуре примерно 55oС. Предлагаемый способ можно проводить в присутствии четвертичной аммониевой соли, такой, как, например, бромид тетрабутиламмония, йодид тетрабутиламмония, хлорид бензилтриэтиламмония и тому подобное. В качестве растворителя можно применять, например, этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, толуол, хлористый метилен и тому подобное, а также их смеси и смеси любого из упомянутых смешивающихся с водой растворителей с водой. В последнем случае реакцию проводят в среде четвертичной аммониевой соли. Реакцию соединений формул II и III предпочтительно осуществлять при температуре примерно 20 50oС в среде диметилсульфоксида. Соединение формулы IV известно из Европейского патента заявки N 0319847. Соединения формул III и V либо известны, либо могут получаться известными методами. Предлагаемый способ иллюстрируется следующими примерами. Пример 1. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-бром-бензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 15 г (57,5 ммоль) 4-бромбензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 20 ч, после чего раствор подают на 250 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 200 мл. После сушки над сульфатом магния и сгущения в вакууме получают 26,3 г продукта в качестве светло-оранжевого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,2 г (36 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианида натрия. Смесь размешивают еще в течение 42 ч при температуре 20 25oС, после чего добавляют 2 г (40,5 ммоль) цианида натрия и размешивание продолжают в течение 96 ч при температуре 20 25oС. Затем реакционную смесь подают на 200 мл воды и экстрагируют два раза этилацетатом в количестве по 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. Получают 11,3 г красно-коричневого масла, которое затвердевает при стоянии. В результате колоночной флеш-хроматографии на силикагеле с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 9,5 г продукта в виде слабо-желтых иголок с точкой плавления 67,2 - 69,7oС. Степень чистоты по парофазной хроматографии с применением капиллярной колонки марки DB-5 (40 280oС при 15oС/мин): 98,35% при 18,63 мин. 1Н-ЯМР: (СDCl3,
, с йодидом щелочного металла, таким, как, например, йодид натрия или калия, можно применять, например, ацетон, 2-бутанон и тому подобное. Реакцию предпочтительно осуществляют в среде 2-бутанона при температуре примерно 55oС. Предлагаемый способ можно проводить в присутствии четвертичной аммониевой соли, такой, как, например, бромид тетрабутиламмония, йодид тетрабутиламмония, хлорид бензилтриэтиламмония и тому подобное. В качестве растворителя можно применять, например, этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, толуол, хлористый метилен и тому подобное, а также их смеси и смеси любого из упомянутых смешивающихся с водой растворителей с водой. В последнем случае реакцию проводят в среде четвертичной аммониевой соли. Реакцию соединений формул II и III предпочтительно осуществлять при температуре примерно 20 50oС в среде диметилсульфоксида. Соединение формулы IV известно из Европейского патента заявки N 0319847. Соединения формул III и V либо известны, либо могут получаться известными методами. Предлагаемый способ иллюстрируется следующими примерами. Пример 1. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-бром-бензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 15 г (57,5 ммоль) 4-бромбензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 20 ч, после чего раствор подают на 250 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 200 мл. После сушки над сульфатом магния и сгущения в вакууме получают 26,3 г продукта в качестве светло-оранжевого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,2 г (36 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианида натрия. Смесь размешивают еще в течение 42 ч при температуре 20 25oС, после чего добавляют 2 г (40,5 ммоль) цианида натрия и размешивание продолжают в течение 96 ч при температуре 20 25oС. Затем реакционную смесь подают на 200 мл воды и экстрагируют два раза этилацетатом в количестве по 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. Получают 11,3 г красно-коричневого масла, которое затвердевает при стоянии. В результате колоночной флеш-хроматографии на силикагеле с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 9,5 г продукта в виде слабо-желтых иголок с точкой плавления 67,2 - 69,7oС. Степень чистоты по парофазной хроматографии с применением капиллярной колонки марки DB-5 (40 280oС при 15oС/мин): 98,35% при 18,63 мин. 1Н-ЯМР: (СDCl3,  : 1,38 (3Н, s), 1,45 (9H, s), 1,75 (1H, m), 2,39 (2H, dq), 2,51 (2H, d), 4,10 4,32 (2H, m). [
: 1,38 (3Н, s), 1,45 (9H, s), 1,75 (1H, m), 2,39 (2H, dq), 2,51 (2H, d), 4,10 4,32 (2H, m). [ ]D= 1,33
]D= 1,33 (с 1, CHCl3). Пример 2. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонилхлорида. Размешивание продолжают в течение 150 мин при температуре 0 5oС, после чего раствор медленно нагревают до температуре 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты К размешиваемому раствору 21,5 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь перемешивают при температуре 20 25oС в течение 40 ч, после чего добавляют еще 2 г (40,5 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 4,5 ч и при температуре 48 52oС в течение 24 ч. Затем смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятыми в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. При этом получают 11,7 г продукта в качестве желто-оранжевого твердого вещества. Продукт имеет 90%-ную чистоту (по данным парофазной хроматографии). Пример 3. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2,5-дихлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 14,7 г (57,5 ммоль) 2,5-дихлорбензолсульфонилхлорида. Размешивание продолжают в течение 3,5 ч при температуре 0 5oС, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 2,5-дихлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 24,6 г продукта в качестве желто-оранжевого масла. Стадия Б. Получение сложного (4R-бис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,6 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Реакционную смесь размешивают при температуре 20 - 25oС в течение 44 ч, после чего добавляют еще 1 г (20 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 24 ч. Смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,7 г продукта в качестве коричневого масла, которое при стоянии затвердевает. Продукт имеет 85%-ную чистоту (по данным парофазной хроматографии). Пример 4. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 9,8 г (0,043 моль) 2-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 24 ч, после чего добавляют еще 2,0 г (0,009 моль) 2-нитробензолсульфнилхлорида и раствор размешивают еще в течение дальнейших 4 ч. Затем раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 2-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 20,8 г продукта в качестве зеленого масла. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 19 г (35,8 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 17 ч, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 8,1 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 97,4% (по данным парофазной хроматографии). Пример 5. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 10,5 г (43 ммоль) 4-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 22 ч, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 18,7 г продукта в качестве коричневого масла, которое сразу же затвердевает. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 12,7 г (28,5 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 40 45oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 40 45oС в течение часа, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 200 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 2,8 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет 98% -ную чистоту (по данным парофазной хроматографии). Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (39 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонил-хлорида. Размешивание продолжают при температуре 0 5oС в течение 2,5 ч, после чего раствор медленно нагревают до температуры 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают 200 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и 200 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-йодметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемой суспензии 21,5 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 100 мл 2-бутанона, имеющей температуру 55 60oС и содержащей 10 г (77 ммоль) карбоната калия, добавляют 11,4 г (77 ммоль) йодистого натрия. Размешивание продолжают при температуре 55oС в течение 30 мин, после чего смесь нагревают до слабой флегмы в течение 18 ч, твердое вещество удаляют фильтрацией и фильтрат сгущают. Получают 14 г продукта в качестве масла. Стадия В. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 14 г (38 ммоль) продукта стадии Б в 150 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 3,8 г (77 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 5 дней, после чего подают на 300 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. Получают 10 г продукта в качестве слабо-желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 82,4% (по данным парофазной хроматографии).
(с 1, CHCl3). Пример 2. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонилхлорида. Размешивание продолжают в течение 150 мин при температуре 0 5oС, после чего раствор медленно нагревают до температуре 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты К размешиваемому раствору 21,5 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь перемешивают при температуре 20 25oС в течение 40 ч, после чего добавляют еще 2 г (40,5 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 4,5 ч и при температуре 48 52oС в течение 24 ч. Затем смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятыми в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. При этом получают 11,7 г продукта в качестве желто-оранжевого твердого вещества. Продукт имеет 90%-ную чистоту (по данным парофазной хроматографии). Пример 3. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2,5-дихлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 14,7 г (57,5 ммоль) 2,5-дихлорбензолсульфонилхлорида. Размешивание продолжают в течение 3,5 ч при температуре 0 5oС, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 2,5-дихлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 24,6 г продукта в качестве желто-оранжевого масла. Стадия Б. Получение сложного (4R-бис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,6 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Реакционную смесь размешивают при температуре 20 - 25oС в течение 44 ч, после чего добавляют еще 1 г (20 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 24 ч. Смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,7 г продукта в качестве коричневого масла, которое при стоянии затвердевает. Продукт имеет 85%-ную чистоту (по данным парофазной хроматографии). Пример 4. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 9,8 г (0,043 моль) 2-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 24 ч, после чего добавляют еще 2,0 г (0,009 моль) 2-нитробензолсульфнилхлорида и раствор размешивают еще в течение дальнейших 4 ч. Затем раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 2-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 20,8 г продукта в качестве зеленого масла. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 19 г (35,8 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 17 ч, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 8,1 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 97,4% (по данным парофазной хроматографии). Пример 5. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 10,5 г (43 ммоль) 4-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 22 ч, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 18,7 г продукта в качестве коричневого масла, которое сразу же затвердевает. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 12,7 г (28,5 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 40 45oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 40 45oС в течение часа, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 200 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 2,8 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет 98% -ную чистоту (по данным парофазной хроматографии). Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (39 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонил-хлорида. Размешивание продолжают при температуре 0 5oС в течение 2,5 ч, после чего раствор медленно нагревают до температуры 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают 200 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и 200 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-йодметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемой суспензии 21,5 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 100 мл 2-бутанона, имеющей температуру 55 60oС и содержащей 10 г (77 ммоль) карбоната калия, добавляют 11,4 г (77 ммоль) йодистого натрия. Размешивание продолжают при температуре 55oС в течение 30 мин, после чего смесь нагревают до слабой флегмы в течение 18 ч, твердое вещество удаляют фильтрацией и фильтрат сгущают. Получают 14 г продукта в качестве масла. Стадия В. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 14 г (38 ммоль) продукта стадии Б в 150 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 3,8 г (77 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 5 дней, после чего подают на 300 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. Получают 10 г продукта в качестве слабо-желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 82,4% (по данным парофазной хроматографии). ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы I отличающийся тем, что соединение формулы II
отличающийся тем, что соединение формулы II где L атом галогена, или группа
где L атом галогена, или группа где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, подвергают взаимодействию с соединением формулы III M CN где M означает атом щелочного металла при температуре примерно 0 100oС в среде растворителя. 2. Способ по п. 1, отличающийся тем, что реакцию осуществляют в среде растворителя из группы, включающей этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, хлористый метилен, смесь хлористого метилена и воды, толуол и смесь толуола и воды. 3. Способ по п. 2, отличающийся тем, что в случае использования смеси хлористого метилена или толуола и воды реакцию осуществляют в присутствии четвертичной аммониевой соли. 4. Способ по п.1, отличающийся тем, что реакцию осуществляют в среде диметилсульфоксида при температуре примерно 20 50oС. 5. Способ по п.1, отличающийся тем, что соединение формулы II, где L означает группу
где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, подвергают взаимодействию с соединением формулы III M CN где M означает атом щелочного металла при температуре примерно 0 100oС в среде растворителя. 2. Способ по п. 1, отличающийся тем, что реакцию осуществляют в среде растворителя из группы, включающей этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, хлористый метилен, смесь хлористого метилена и воды, толуол и смесь толуола и воды. 3. Способ по п. 2, отличающийся тем, что в случае использования смеси хлористого метилена или толуола и воды реакцию осуществляют в присутствии четвертичной аммониевой соли. 4. Способ по п.1, отличающийся тем, что реакцию осуществляют в среде диметилсульфоксида при температуре примерно 20 50oС. 5. Способ по п.1, отличающийся тем, что соединение формулы II, где L означает группу где Ar имеет указанное в п.1 значение получают взаимодействием соединения формулы IV
где Ar имеет указанное в п.1 значение получают взаимодействием соединения формулы IV с соединением формулы V
с соединением формулы V где Ar имеет указанное в п.1 значение; X атом галогена, в среде растворителя в присутствии основания. 6. Способ по п.5, отличающийся тем, что используют основание из группы, включающей триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин. 7. Способ по п.6, отличающийся тем, что в качестве основания используют триэтиламин. 8. Способ по п. 5, отличающийся тем, что используют растворитель из группы, включающей пиридин, толуол и хлористый метилен. 9. Способ по п. 8, отличающийся тем, что в качестве растворителя используют хлористый метилен. 10. Способ по п.1, отличающийся тем, что соединение формулы II, где L - атом галогена, получают взаимодействием соединения формулы II, где L группа
где Ar имеет указанное в п.1 значение; X атом галогена, в среде растворителя в присутствии основания. 6. Способ по п.5, отличающийся тем, что используют основание из группы, включающей триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин. 7. Способ по п.6, отличающийся тем, что в качестве основания используют триэтиламин. 8. Способ по п. 5, отличающийся тем, что используют растворитель из группы, включающей пиридин, толуол и хлористый метилен. 9. Способ по п. 8, отличающийся тем, что в качестве растворителя используют хлористый метилен. 10. Способ по п.1, отличающийся тем, что соединение формулы II, где L - атом галогена, получают взаимодействием соединения формулы II, где L группа где Ar имеет указанное в п.1 значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. 11. Способ по п.10, отличающийся тем, что в качестве растворителя используют ацетон или 2-бутанон. 12. Сложный (4R-цис)-1,1-диметилэтиловый эфир 2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы II
где Ar имеет указанное в п.1 значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. 11. Способ по п.10, отличающийся тем, что в качестве растворителя используют ацетон или 2-бутанон. 12. Сложный (4R-цис)-1,1-диметилэтиловый эфир 2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы II где L атом галогена или группа
где L атом галогена или группа где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, в качестве промежуточного соединения для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты.
где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, в качестве промежуточного соединения для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. www.freepatent.ru
Способ получения сложного (4r-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты
Использование: в синтезе промежуточного соединения, применяемого в процессе получения ингибиторов биосинтеза холестерина. Сущность: способ получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Б. Ф. С14Н23NO4, т. пл. 67,2 - 69,7oС. Реагент 1: сложный (4R-цис)-1,1-диметилэтиловый эфир 2,2-диметил-1,3-диоксан-4-уксусной кислоты ф-лы 2, где L - атом галогена или группа ф-лы IIa, где Ar - фенил, замещенный одним или двумя заместителями, из числа: атом галогена или нитрогруппа. Реагент 2: соединение ф-лы: M-CN, где M - атом щелочного металла. Условия процесса: 0 - 100oС в среде растворителя. Соединение ф-лы I является сырьем для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты, который представляет собой промежуточное соединение для получения ингибиторов биостинтеза холестерина. Структура соединений формул: 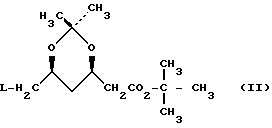
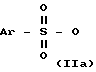
Изобретение относится к синтезу промежуточного соединения, применяемого в процессе получения ингибиторов биосинтеза холестерина, более конкретно к способу получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты.
Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты представляет собой исходное соединение для получения (4R-цис)-1,1-диметилэтилового эфира 6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты, который применяют в процессе получения (2R-транс)-5-(4-фторфенил)-2-(-метилэтил)-N, 4-дифенил-1- [2-тетрагидро-4-окси-6-оксо-2Н-пиран-2-ил)-этил]-1Н-пиррол-3-карбоксамида или соли гидроксильной кислоты, [R-(R*,R*)]-1-(4-фторфенил)-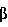 ,d-диокси-5- (1-метил-этил)-3-фенил-4-[(фениламино)-карбонил] -1Н-пиррол-1-гептановой кислоты (2 1) (см. например, патент США N 4647576, кл. C 07 D 405/06, A 61 K 31/40, 1987, патент США N 4681893, кл. A 61 K 31/40, 1987 и патент США N 4681893, кл. A 61 K 31/40, С 07 D 207/327, 1987). Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты можно получать различными путями, известными специалисту в данной области. Задачей изобретения является расширение возможностей получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты за счет разработки простого и экономичного способа. Данная задача решается предлагаемым способом получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы:
,d-диокси-5- (1-метил-этил)-3-фенил-4-[(фениламино)-карбонил] -1Н-пиррол-1-гептановой кислоты (2 1) (см. например, патент США N 4647576, кл. C 07 D 405/06, A 61 K 31/40, 1987, патент США N 4681893, кл. A 61 K 31/40, 1987 и патент США N 4681893, кл. A 61 K 31/40, С 07 D 207/327, 1987). Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты можно получать различными путями, известными специалисту в данной области. Задачей изобретения является расширение возможностей получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты за счет разработки простого и экономичного способа. Данная задача решается предлагаемым способом получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы: 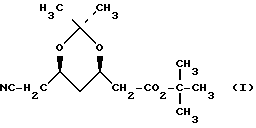 который заключается в том, что соединение формулы:
который заключается в том, что соединение формулы: 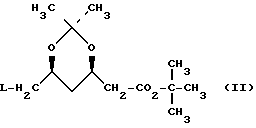 где L означает галоид или группу
где L означает галоид или группу 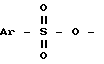 , где Ar означает фенил, замещенный одним или двумя заместителями из числа галоида и нитро, подвергают взаимодействию с соединением формулы: M-CN (III), где M означает щелочной металл, при температуре примерно 0 100oС в среде растворителя. Соединение формулы II, где L означает группу
, где Ar означает фенил, замещенный одним или двумя заместителями из числа галоида и нитро, подвергают взаимодействию с соединением формулы: M-CN (III), где M означает щелочной металл, при температуре примерно 0 100oС в среде растворителя. Соединение формулы II, где L означает группу 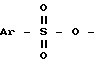 , получают взаимодействием соединения формулы:
, получают взаимодействием соединения формулы: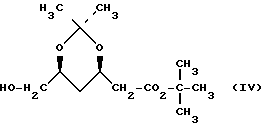 c соединением формулы:
c соединением формулы: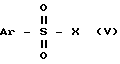 где Ar имеет вышеуказанное значение, а X означает галоид, в среде растворителя в присутствии основания. Соединение формулы II, где L означает галоид, получают взаимодействием соединения формулы II, где L означает группу
где Ar имеет вышеуказанное значение, а X означает галоид, в среде растворителя в присутствии основания. Соединение формулы II, где L означает галоид, получают взаимодействием соединения формулы II, где L означает группу 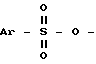 , где Ar имеет вышеуказанное значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. Предлагаемый способ основан на замене сульфонатов или галоидов на цианид. Такая замена широко известна в литературе. Однако такая замена еще не могла успешно проводиться в комплексных системах, в частности в системах, содержащих 1,3-диоксановое кольцо. В связи с этим внимание обращается на Sunay, U. и Fraser-Reid, B. Tetrahedron Letters, 27, с. 5335 5338, 1986, где сообщается о неудаче такой замены в системе, содержащей 1,3-диоксановое кольцо. Следовательно, успешное проведение предлагаемого способа нельзя было предвидеть, в связи с чем предлагаемый способ следовало бы рассматривать как обладающий изобретательским уровнем. Реакцию соединения форму IV и V обычно осуществляют при температурах примерно -40oС. При этом в качестве основания можно применять, например, триэтиламин, диизопропилэтиламин, 4-диметиламинопиридин и тому подобное. В качестве растворителя можно применять, например, пиридин, толуол, хлористый метилен и тому подобное. Предпочтительно реакцию осуществляют в среде хлористого метилена в присутствии триэтиламина при температуре примерно 0 - 25oС. В качестве растворителя для проведения реакции соединения формулы II, где L означает группу
, где Ar имеет вышеуказанное значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. Предлагаемый способ основан на замене сульфонатов или галоидов на цианид. Такая замена широко известна в литературе. Однако такая замена еще не могла успешно проводиться в комплексных системах, в частности в системах, содержащих 1,3-диоксановое кольцо. В связи с этим внимание обращается на Sunay, U. и Fraser-Reid, B. Tetrahedron Letters, 27, с. 5335 5338, 1986, где сообщается о неудаче такой замены в системе, содержащей 1,3-диоксановое кольцо. Следовательно, успешное проведение предлагаемого способа нельзя было предвидеть, в связи с чем предлагаемый способ следовало бы рассматривать как обладающий изобретательским уровнем. Реакцию соединения форму IV и V обычно осуществляют при температурах примерно -40oС. При этом в качестве основания можно применять, например, триэтиламин, диизопропилэтиламин, 4-диметиламинопиридин и тому подобное. В качестве растворителя можно применять, например, пиридин, толуол, хлористый метилен и тому подобное. Предпочтительно реакцию осуществляют в среде хлористого метилена в присутствии триэтиламина при температуре примерно 0 - 25oС. В качестве растворителя для проведения реакции соединения формулы II, где L означает группу 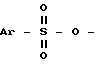 , с йодидом щелочного металла, таким, как, например, йодид натрия или калия, можно применять, например, ацетон, 2-бутанон и тому подобное. Реакцию предпочтительно осуществляют в среде 2-бутанона при температуре примерно 55oС. Предлагаемый способ можно проводить в присутствии четвертичной аммониевой соли, такой, как, например, бромид тетрабутиламмония, йодид тетрабутиламмония, хлорид бензилтриэтиламмония и тому подобное. В качестве растворителя можно применять, например, этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, толуол, хлористый метилен и тому подобное, а также их смеси и смеси любого из упомянутых смешивающихся с водой растворителей с водой. В последнем случае реакцию проводят в среде четвертичной аммониевой соли. Реакцию соединений формул II и III предпочтительно осуществлять при температуре примерно 20 50oС в среде диметилсульфоксида. Соединение формулы IV известно из Европейского патента заявки N 0319847. Соединения формул III и V либо известны, либо могут получаться известными методами. Предлагаемый способ иллюстрируется следующими примерами. Пример 1. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-бром-бензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 15 г (57,5 ммоль) 4-бромбензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 20 ч, после чего раствор подают на 250 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 200 мл. После сушки над сульфатом магния и сгущения в вакууме получают 26,3 г продукта в качестве светло-оранжевого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,2 г (36 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианида натрия. Смесь размешивают еще в течение 42 ч при температуре 20 25oС, после чего добавляют 2 г (40,5 ммоль) цианида натрия и размешивание продолжают в течение 96 ч при температуре 20 25oС. Затем реакционную смесь подают на 200 мл воды и экстрагируют два раза этилацетатом в количестве по 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. Получают 11,3 г красно-коричневого масла, которое затвердевает при стоянии. В результате колоночной флеш-хроматографии на силикагеле с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 9,5 г продукта в виде слабо-желтых иголок с точкой плавления 67,2 - 69,7oС. Степень чистоты по парофазной хроматографии с применением капиллярной колонки марки DB-5 (40 280oС при 15oС/мин): 98,35% при 18,63 мин. 1Н-ЯМР: (СDCl3,
, с йодидом щелочного металла, таким, как, например, йодид натрия или калия, можно применять, например, ацетон, 2-бутанон и тому подобное. Реакцию предпочтительно осуществляют в среде 2-бутанона при температуре примерно 55oС. Предлагаемый способ можно проводить в присутствии четвертичной аммониевой соли, такой, как, например, бромид тетрабутиламмония, йодид тетрабутиламмония, хлорид бензилтриэтиламмония и тому подобное. В качестве растворителя можно применять, например, этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, толуол, хлористый метилен и тому подобное, а также их смеси и смеси любого из упомянутых смешивающихся с водой растворителей с водой. В последнем случае реакцию проводят в среде четвертичной аммониевой соли. Реакцию соединений формул II и III предпочтительно осуществлять при температуре примерно 20 50oС в среде диметилсульфоксида. Соединение формулы IV известно из Европейского патента заявки N 0319847. Соединения формул III и V либо известны, либо могут получаться известными методами. Предлагаемый способ иллюстрируется следующими примерами. Пример 1. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-бром-бензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 15 г (57,5 ммоль) 4-бромбензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 20 ч, после чего раствор подают на 250 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 200 мл. После сушки над сульфатом магния и сгущения в вакууме получают 26,3 г продукта в качестве светло-оранжевого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,2 г (36 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианида натрия. Смесь размешивают еще в течение 42 ч при температуре 20 25oС, после чего добавляют 2 г (40,5 ммоль) цианида натрия и размешивание продолжают в течение 96 ч при температуре 20 25oС. Затем реакционную смесь подают на 200 мл воды и экстрагируют два раза этилацетатом в количестве по 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятым в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. Получают 11,3 г красно-коричневого масла, которое затвердевает при стоянии. В результате колоночной флеш-хроматографии на силикагеле с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 9,5 г продукта в виде слабо-желтых иголок с точкой плавления 67,2 - 69,7oС. Степень чистоты по парофазной хроматографии с применением капиллярной колонки марки DB-5 (40 280oС при 15oС/мин): 98,35% при 18,63 мин. 1Н-ЯМР: (СDCl3,  : 1,38 (3Н, s), 1,45 (9H, s), 1,75 (1H, m), 2,39 (2H, dq), 2,51 (2H, d), 4,10 4,32 (2H, m). [
: 1,38 (3Н, s), 1,45 (9H, s), 1,75 (1H, m), 2,39 (2H, dq), 2,51 (2H, d), 4,10 4,32 (2H, m). [ ]D= 1,33
]D= 1,33 (с 1, CHCl3). Пример 2. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонилхлорида. Размешивание продолжают в течение 150 мин при температуре 0 5oС, после чего раствор медленно нагревают до температуре 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты К размешиваемому раствору 21,5 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь перемешивают при температуре 20 25oС в течение 40 ч, после чего добавляют еще 2 г (40,5 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 4,5 ч и при температуре 48 52oС в течение 24 ч. Затем смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятыми в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. При этом получают 11,7 г продукта в качестве желто-оранжевого твердого вещества. Продукт имеет 90%-ную чистоту (по данным парофазной хроматографии). Пример 3. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2,5-дихлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 14,7 г (57,5 ммоль) 2,5-дихлорбензолсульфонилхлорида. Размешивание продолжают в течение 3,5 ч при температуре 0 5oС, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 2,5-дихлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 24,6 г продукта в качестве желто-оранжевого масла. Стадия Б. Получение сложного (4R-бис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,6 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Реакционную смесь размешивают при температуре 20 - 25oС в течение 44 ч, после чего добавляют еще 1 г (20 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 24 ч. Смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,7 г продукта в качестве коричневого масла, которое при стоянии затвердевает. Продукт имеет 85%-ную чистоту (по данным парофазной хроматографии). Пример 4. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 9,8 г (0,043 моль) 2-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 24 ч, после чего добавляют еще 2,0 г (0,009 моль) 2-нитробензолсульфнилхлорида и раствор размешивают еще в течение дальнейших 4 ч. Затем раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 2-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 20,8 г продукта в качестве зеленого масла. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 19 г (35,8 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 17 ч, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 8,1 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 97,4% (по данным парофазной хроматографии). Пример 5. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 10,5 г (43 ммоль) 4-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 22 ч, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 18,7 г продукта в качестве коричневого масла, которое сразу же затвердевает. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 12,7 г (28,5 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 40 45oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 40 45oС в течение часа, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 200 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 2,8 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет 98% -ную чистоту (по данным парофазной хроматографии). Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (39 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонил-хлорида. Размешивание продолжают при температуре 0 5oС в течение 2,5 ч, после чего раствор медленно нагревают до температуры 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают 200 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и 200 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-йодметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемой суспензии 21,5 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 100 мл 2-бутанона, имеющей температуру 55 60oС и содержащей 10 г (77 ммоль) карбоната калия, добавляют 11,4 г (77 ммоль) йодистого натрия. Размешивание продолжают при температуре 55oС в течение 30 мин, после чего смесь нагревают до слабой флегмы в течение 18 ч, твердое вещество удаляют фильтрацией и фильтрат сгущают. Получают 14 г продукта в качестве масла. Стадия В. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 14 г (38 ммоль) продукта стадии Б в 150 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 3,8 г (77 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 5 дней, после чего подают на 300 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. Получают 10 г продукта в качестве слабо-желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 82,4% (по данным парофазной хроматографии).
(с 1, CHCl3). Пример 2. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонилхлорида. Размешивание продолжают в течение 150 мин при температуре 0 5oС, после чего раствор медленно нагревают до температуре 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты К размешиваемому раствору 21,5 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь перемешивают при температуре 20 25oС в течение 40 ч, после чего добавляют еще 2 г (40,5 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 4,5 ч и при температуре 48 52oС в течение 24 ч. Затем смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, взятыми в количестве по 100 мл, сушат над сульфатом магния и сгущают в вакууме. При этом получают 11,7 г продукта в качестве желто-оранжевого твердого вещества. Продукт имеет 90%-ную чистоту (по данным парофазной хроматографии). Пример 3. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2,5-дихлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 14,7 г (57,5 ммоль) 2,5-дихлорбензолсульфонилхлорида. Размешивание продолжают в течение 3,5 ч при температуре 0 5oС, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают насыщенным раствором бикарбоната натрия (для полного удаления 2,5-дихлорбензолсульфонилхлорида) и насыщенным раствором хлористого натрия, взятыми в количестве по 200 мл. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 24,6 г продукта в качестве желто-оранжевого масла. Стадия Б. Получение сложного (4R-бис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 24,6 г (38 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Реакционную смесь размешивают при температуре 20 - 25oС в течение 44 ч, после чего добавляют еще 1 г (20 ммоль) цианистого натрия и размешивание продолжают при температуре 20 25oС в течение 24 ч. Смесь подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 250 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,7 г продукта в качестве коричневого масла, которое при стоянии затвердевает. Продукт имеет 85%-ную чистоту (по данным парофазной хроматографии). Пример 4. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 9,8 г (0,043 моль) 2-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 24 ч, после чего добавляют еще 2,0 г (0,009 моль) 2-нитробензолсульфнилхлорида и раствор размешивают еще в течение дальнейших 4 ч. Затем раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои последовательно промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 2-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 20,8 г продукта в качестве зеленого масла. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 19 г (35,8 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 17 ч, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, каждый раз в количестве 200 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 10,8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 8,1 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 97,4% (по данным парофазной хроматографии). Пример 5. Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-нитробензол)-сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (0,038 моль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 20 25oС и содержащему 7 мл (0,05 моль) триэтиламина, добавляют 10,5 г (43 ммоль) 4-нитробензолсульфонилхлорида. Размешивание продолжают при температуре 20 25oС в течение 22 ч, после чего раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 250 мл хлористого метилена и объединенные органические слои промывают 100 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-нитробензолсульфонилхлорида) и 100 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 18,7 г продукта в качестве коричневого масла, которое сразу же затвердевает. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 12,7 г (28,5 ммоль) продукта стадии А в 100 мл диметилсульфоксида, имеющему температуру 40 45oС, добавляют 4,0 г (81 ммоль) цианистого натрия. Смесь размешивают при температуре 40 45oС в течение часа, после чего подают на 200 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 200 мл. Объединенные экстракты последовательно промывают 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. При этом получают 8 г продукта в качестве красно-коричневого масла. В результате колоночной флеш-хроматографии на двуокиси кремния с применением в качестве элюента смеси гексана и этилацетата в соотношении 4 1 получают 2,8 г продукта в качестве желтого масла, которое при стоянии затвердевает. Продукт имеет 98% -ную чистоту (по данным парофазной хроматографии). Стадия А. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 10 г (39 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-оксиметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 250 мл хлористого метилена, имеющему температуру 0 5oС и содержащему 10 мл (72 ммоль) триэтиламина, добавляют 12,7 г (60 ммоль) 4-хлорбензолсульфонил-хлорида. Размешивание продолжают при температуре 0 5oС в течение 2,5 ч, после чего раствор медленно нагревают до температуры 20 25oС в течение 2 ч. Раствор подают на 200 мл воды и осуществляют разделение фаз. Верхний водный слой экстрагируют 200 мл хлористого метилена и объединенные органические слои последовательно промывают 200 мл насыщенного раствора бикарбоната натрия (для полного удаления 4-хлорбензолсульфонилхлорида) и 200 мл насыщенного раствора хлористого натрия. В результате сушки раствора над сульфатом магния и сгущения в вакууме получают 21,5 г продукта в качестве слабо-желтого твердого вещества. Стадия Б. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-йодметил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемой суспензии 21,5 г (38 ммоль) сложного (4R-цис)-1,1-диметилэтилового эфира 6-(4-хлорбензол)сульфонилокси-2,2-диметил-1,3-диоксан-4-уксусной кислоты в 100 мл 2-бутанона, имеющей температуру 55 60oС и содержащей 10 г (77 ммоль) карбоната калия, добавляют 11,4 г (77 ммоль) йодистого натрия. Размешивание продолжают при температуре 55oС в течение 30 мин, после чего смесь нагревают до слабой флегмы в течение 18 ч, твердое вещество удаляют фильтрацией и фильтрат сгущают. Получают 14 г продукта в качестве масла. Стадия В. Получение сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. К размешиваемому раствору 14 г (38 ммоль) продукта стадии Б в 150 мл диметилсульфоксида, имеющему температуру 20 25oС, добавляют 3,8 г (77 ммоль) цианистого натрия. Смесь размешивают при температуре 20 25oС в течение 5 дней, после чего подают на 300 мл воды и два раза экстрагируют этилацетатом, взятым в количестве по 250 мл. Объединенные экстракты последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом магния и сгущают в вакууме. Получают 10 г продукта в качестве слабо-желтого масла, которое при стоянии затвердевает. Продукт имеет чистоту 82,4% (по данным парофазной хроматографии).Формула изобретения
1. Способ получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы I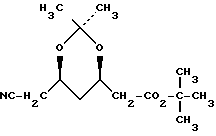 отличающийся тем, что соединение формулы II
отличающийся тем, что соединение формулы II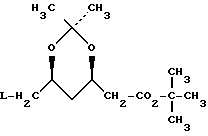 где L атом галогена, или группа
где L атом галогена, или группа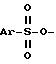 где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, подвергают взаимодействию с соединением формулы III M CN где M означает атом щелочного металла при температуре примерно 0 100oС в среде растворителя. 2. Способ по п. 1, отличающийся тем, что реакцию осуществляют в среде растворителя из группы, включающей этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, хлористый метилен, смесь хлористого метилена и воды, толуол и смесь толуола и воды. 3. Способ по п. 2, отличающийся тем, что в случае использования смеси хлористого метилена или толуола и воды реакцию осуществляют в присутствии четвертичной аммониевой соли. 4. Способ по п.1, отличающийся тем, что реакцию осуществляют в среде диметилсульфоксида при температуре примерно 20 50oС. 5. Способ по п.1, отличающийся тем, что соединение формулы II, где L означает группу
где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, подвергают взаимодействию с соединением формулы III M CN где M означает атом щелочного металла при температуре примерно 0 100oС в среде растворителя. 2. Способ по п. 1, отличающийся тем, что реакцию осуществляют в среде растворителя из группы, включающей этанол, диметилсульфоксид, диметилформамид, диметилпропиленмочевину, диметилэтиленмочевину, тетраметилмочевину, N-метилпирролидинон, тетрагидрофуран, хлористый метилен, смесь хлористого метилена и воды, толуол и смесь толуола и воды. 3. Способ по п. 2, отличающийся тем, что в случае использования смеси хлористого метилена или толуола и воды реакцию осуществляют в присутствии четвертичной аммониевой соли. 4. Способ по п.1, отличающийся тем, что реакцию осуществляют в среде диметилсульфоксида при температуре примерно 20 50oС. 5. Способ по п.1, отличающийся тем, что соединение формулы II, где L означает группу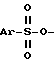 где Ar имеет указанное в п.1 значение получают взаимодействием соединения формулы IV
где Ar имеет указанное в п.1 значение получают взаимодействием соединения формулы IV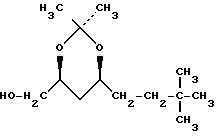 с соединением формулы V
с соединением формулы V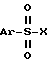 где Ar имеет указанное в п.1 значение; X атом галогена, в среде растворителя в присутствии основания. 6. Способ по п.5, отличающийся тем, что используют основание из группы, включающей триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин. 7. Способ по п.6, отличающийся тем, что в качестве основания используют триэтиламин. 8. Способ по п. 5, отличающийся тем, что используют растворитель из группы, включающей пиридин, толуол и хлористый метилен. 9. Способ по п. 8, отличающийся тем, что в качестве растворителя используют хлористый метилен. 10. Способ по п.1, отличающийся тем, что соединение формулы II, где L - атом галогена, получают взаимодействием соединения формулы II, где L группа
где Ar имеет указанное в п.1 значение; X атом галогена, в среде растворителя в присутствии основания. 6. Способ по п.5, отличающийся тем, что используют основание из группы, включающей триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин. 7. Способ по п.6, отличающийся тем, что в качестве основания используют триэтиламин. 8. Способ по п. 5, отличающийся тем, что используют растворитель из группы, включающей пиридин, толуол и хлористый метилен. 9. Способ по п. 8, отличающийся тем, что в качестве растворителя используют хлористый метилен. 10. Способ по п.1, отличающийся тем, что соединение формулы II, где L - атом галогена, получают взаимодействием соединения формулы II, где L группа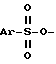 где Ar имеет указанное в п.1 значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. 11. Способ по п.10, отличающийся тем, что в качестве растворителя используют ацетон или 2-бутанон. 12. Сложный (4R-цис)-1,1-диметилэтиловый эфир 2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы II
где Ar имеет указанное в п.1 значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя. 11. Способ по п.10, отличающийся тем, что в качестве растворителя используют ацетон или 2-бутанон. 12. Сложный (4R-цис)-1,1-диметилэтиловый эфир 2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы II где L атом галогена или группа
где L атом галогена или группа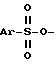 где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, в качестве промежуточного соединения для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты.
где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, в качестве промежуточного соединения для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты.www.findpatent.ru
Способ получения сложного (4r-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты
Использование: в синтезе промежуточного соединения, применяемого в процессе получения ингибиторов биосинтеза холестерина. Сущность: способ получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Б. Ф. С14Н23NO4, т. пл. 67,2 - 69,7oС. Реагент 1: сложный (4R-цис)-1,1-диметилэтиловый эфир 2,2-диметил-1,3-диоксан-4-уксусной кислоты ф-лы 2, где L - атом галогена или группа ф-лы IIa, где Ar - фенил, замещенный одним или двумя заместителями, из числа: атом галогена или нитрогруппа. Реагент 2: соединение ф-лы: M-CN, где M - атом щелочного металла. Условия процесса: 0 - 100oС в среде растворителя. Соединение ф-лы I является сырьем для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты, который представляет собой промежуточное соединение для получения ингибиторов биостинтеза холестерина. Структура соединений формул:ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ
Изобретение относится к синтезу промежуточного соединения, применяемого в процессе получения ингибиторов биосинтеза холестерина, более конкретно к способу получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты представляет собой исходное соединение для получения (4R-цис)-1,1-диметилэтилового эфира 6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты, который применяют в процессе получения (2R-транс)-5-(4-фторфенил)-2-(-метилэтил)-N, 4-дифенил-1- [2-тетрагидро-4-окси-6-оксо-2Н-пиран-2-ил)-этил]-1Н-пиррол-3-карбоксамида или соли гидроксильной кислоты, [R-(R*,R*)]-1-(4-фторфенил)-β,d-диокси-5- (1-метил-этил)-3-фенил-4-[(фениламино)-карбонил] -1Н-пиррол-1-гептановой кислоты (2 1) (см. например, патент США N 4647576, кл. C 07 D 405/06, A 61 K 31/40, 1987, патент США N 4681893, кл. A 61 K 31/40, 1987 и патент США N 4681893, кл. A 61 K 31/40, С 07 D 207/327, 1987). Сложный (4R-цис)-1,1-диметилэтиловый эфир 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты можно получать различными путями, известными специалисту в данной области. Задачей изобретения является расширение возможностей получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты за счет разработки простого и экономичного способа. Данная задача решается предлагаемым способом получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы:который заключается в том, что соединение формулы:
где L означает галоид или группу
, где Ar означает фенил, замещенный одним или двумя заместителями из числа галоида и нитро, подвергают взаимодействию с соединением формулы:M-CN (III),где M означает щелочной металл,при температуре примерно 0 100oС в среде растворителя.
, получают взаимодействием соединения формулы:
c соединением формулы:
где Ar имеет вышеуказанное значение, а X означает галоид,в среде растворителя в присутствии основания.
, где Ar имеет вышеуказанное значение, с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя.
, с йодидом щелочного металла, таким, как, например, йодид натрия или калия, можно применять, например, ацетон, 2-бутанон и тому подобное. Реакцию предпочтительно осуществляют в среде 2-бутанона при температуре примерно 55oС.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы Iотличающийся тем, что соединение формулы II
где L атом галогена, или группа
где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа,подвергают взаимодействию с соединением формулы IIIM CNгде M означает атом щелочного металлапри температуре примерно 0 100oС в среде растворителя.
где Ar имеет указанное в п.1 значениеполучают взаимодействием соединения формулы IV
с соединением формулы V
где Ar имеет указанное в п.1 значение;X атом галогена,в среде растворителя в присутствии основания.
где Ar имеет указанное в п.1 значение,с йодидом щелочного металла в среде растворителя при температуре примерно между 0oС и температурой флегмы используемого растворителя.
где L атом галогена или группа
где Ar означает фенил, замещенный одним или двумя заместителями из числа атома галогена или нитрогруппа, в качестве промежуточного соединения для получения сложного (4R-цис)-1,1-диметилэтилового эфира 6-цианометил-2,2-диметил-1,3-диоксан-4-уксусной кислоты.
bankpatentov.ru
Диметилэфир в качестве альтернативного автомобильного топлива

Одним из перспективных видов альтернативного топлива является диметилэфир (ДМЭ). Он представляет собой газ, который при давлении в 5 бар переходит в жидкое состояние. Характеристики ДМЭ схожи с характеристиками сжиженного нефтяного газа, однако его теплосодержание ниже. По сравнению с обычными видами топлива ДМЭ также имеет более низкую теплотворную способность, но он не содержит серы. В промышленности диметилэфир получают из природного газа, угля или биомассы.
Первые опыты по применению ДМЭ в качестве топлива для грузовых автомобилей начались еще в начале 90-х годов. Исследования показали значительное снижение вредных выбросов по сравнению с дизтопливом, однако ввиду дешевизны нефти на тот момент применение ДМЭ было признано нецелесообразным. В начале ХХI века исследования и разработки были продолжены. Наиболее активно и результативно эта работа проводилась в США и Швеции.
Преимущества ДМЭ
 Преимущества диметилэфира
Преимущества диметилэфираДиметилэфир имеет более высокое цетановое число (55), чем дизтопливо, полученное из нефти (38-53) и более низкую температуру самовоспламенения. ДМЭ не токсичен и не является канцерогеном, а при его сгорании не образуется сажи. Выбросы углекислого газа снижаются на 95%.
Хранение ДМЭ гораздо проще, чем сжатого природного газа (метана) и сжиженного нефтяного газа (пропана). Метан, как известно, требует для хранения резервуары высокого давления и криогенные температуры, а пропан – емкости, изготовленные из двух слоев нержавеющей стали. Диметилэфир же можно безопасно держать в обычных стальных емкостях длительное время. Баки для заправки ДМЭ гораздо легче, что снижает общий вес автомобиля.
Подача диметилэфира в цилиндры производится в жидком состоянии и требует гораздо меньшего давления впрыска в системе питания. Так как при сгорании ДМЭ не образуется серы, отпадает необходимость в сажевом фильтре – одном из самых дорогостоящих элементов очистки выхлопных газов современных дизелей. А из-за отсутствия сажевого фильтра ненужной становится и система регенерации. Также безболезненно можно удалить систему рециркуляции выхлопных газов (EGR). Впечатляющая экономия и снижение общего веса! Стандартный дизельный двигатель для работы на ДМЭ требует только переделки системы питания.
Перспективы ДМЭ
В настоящее время шведская Volvo сотрудничает с американской компанией Oberon по тестированию тяжелых грузовиков, работающих на ДМЭ. Volvo подготовила автомобили, а Oberon разработала технологию получения диметилэфира. Целью сотрудничества является запуск в серийное производство к 2015 году тяжелых коммерческих грузовиков, работающих на ДМЭ, и создание для этого соответствующей топливной инфраструктуры.
Базовым двигателем для испытаний Volvo выбрала серийный 13-литровый D13, агрегатированный с автоматизированной КПП I-Shift. Изменению подверглась система впрыска, из-за меньшей энергоэффективности ДМЭ. По этой же причине необходим топливный бак увеличенной емкости. Вместо турбокомпрессора с изменяемой геометрией установлен обычный. Хотя опытный образец грузовика оборудован системой SCR для уменьшения выбросов окислов азота, исследователи считают, что в окончательном варианте необходимость в нем отпадет. Мощность двигателя составляет 425 л.с., а крутящий момент 2373 Нм. В ходе испытаний планируется довести мощность до 500 л.с.
Компания Oberon разработала модульную, смонтированную на салазках, конструкцию для производства ДМЭ. Мелкомасштабный вариант выбран сознательно, чтобы удовлетворять потребности силами местных производителей, а не создавать общенациональную инфраструктуру. Весь производственный процесс состоит из трех стадий: получение синтезированного газа, его преобразование в метанол и каталитическая дегидратация метанола в диметилэфир. Основным сырьем для производства ДМЭ должно стать возобновляемое сырье: животные, пищевые и сельскохозяйственные отходы. Это предотвращает выбросы метана в атмосферу и позволяет утилизировать отходы в сгорающее без вредных выбросов топливо.
avtonov.info