Статья: Синтез изобутилового эфира уксусной кислоты реакцией этерификации. Изобутиловый эфир
Статья - Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
“СИНТЕЗ ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ”
Курсовая работа
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
1. Введение
1.1.Общие сведения
1.2.Практическое применение
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Способ 2. Получение на катионитовых катализаторах
Способ 3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1.Из карбоновых кислот (реакция этерификации)
3.2.Из хлорангидридов кислот
3.3.Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5.Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6.Из нитрилов
3.7.Из сложных эфиров и спиртов (реакция переэтерификации)
3.8.Из лактонов и спиртов (реакция переэтерификации)
3.9.Из сложных эфиров и кислот (реакция переэтерификации)
3.10.Из солей при взаимодействии с алкилгалогенидами
3.11.Из солей и кислот и других алкилирующих агентов
3.12.Из медных солей
3.13.Из тетраалкиламмоиевых солей
3.14.Из амидов
3.15.Из тригалогензамещенных
3.16.Из дигалогензамещенных простых эфиров
3.17.Из карбоновых кислот и дивинилртути
3.18.Механизм реакции этерификации
4.Выводы
Список литературы
1. Введение
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии h3 SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
2. Синтез ы изобутилацетата
Способ 1. Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Способ 2. Получение на катионитовых катализаторах
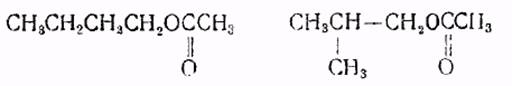
н-Бутил- и изобутилацетат очень широко используются в качестве растворителей и в ряде синтезов. Как известно, синтез сложных эфиров проводится в присутствии минеральных кислот в качестве катализаторов, используемых только однократно, что приводит к большому расходу воды при промывании.
При применении катионитов этот недостаток исключается; кроме того, в меньшей степени идут побочные процессы, в частности, образование непредельных соединений.
Схема синтеза
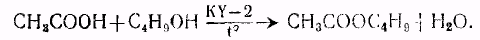
Характеристика основного сырья
Бутиловый спирт, ч., ГОСТ 6006—51 или 5980—51. Изобутиловый спирт, ч., ГОСТ 6016—51. Уксусная кислота, ч, ГОСТ 61—51. Катионит КУ-2, ГОСТ 5696—51.
Условия получения
Синтез веществ проводят в трехгорлой колбе с механической мешалкой, термометром и обратным холодильником с водоотделительной насадкой. Нагревание производят на глицериновой или масляной бане, температуру которой поддерживают контактным термометром.
В колбу загружают 17 г катионита в Н-форме (см. примечание 1), 74,86 г (1,01 М) н — или изобутилового спирта, 60,06 г (1 М) уксусной кислоты и нагревают. По достижении 98° начищает выделяться вода (воду, собравшуюся во флорентине, сливают с таким расчетом, чтобы к концу синтеза она оставалась заполненной водой почти полностью). Перед завершением реакции температура повышается для н-бутилацетата ~ до 115°, для изобутилацетата —110°. Реакцию ведут до выделения примерно 98—99% воды (17,7—17,8 мл) так как кроме реакции этерификации три накоплении эфира, идет дегидратация сложного эфира с образованием непредельных соединений и кислоты. Синтез веществ с н-бутиловым спиртом заканчивается за 45—50 минут, а с изобутиловым спиртом за 60—62 минуты (см. примечание 2). Затем реакционную смесь охлаждают, отделяют катализат от катионита декантацией, пропускают через колонку с анионитом АВ—17 или АВ—16 в ОН -форме, либо нейтрализуют 18—20%-ным раствором соды до слабощелочной реакции и промывкой водой до нейтральной реакции. Далее катализат подвергают разгонке на ректификационной колонке с эффективностью 10 теоретических тарелок.
Первую фракцию н-бутилацетата собирают до 122° с выходом 8,9—9 г, она состоит примерно из 51—52% спирта и 48—49% бутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 122 —127°/745 мм. Его выход составляет 106,8—106,9 г (или 92% от теоретического по кислоте) с содержанием бутилацетата не менее 99% и кислотностью не более 0,05%.
Первую фракцию изобутилацетата собирают до 110° с выходом 6,5—8 г, она состоит также примерно из 51—52% спирта и 48—49% изобутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 110—1157745 мм. Его выход составляет 108—110,3 г (или 93—95% от теоретического по кислоте) с содержанием изобутилацетата не менее 99,0% и кислотностью не более 0,05%.
Первые фракции с учетом содержания спирта и эфира снова используются в синтезе или повторной разгонке, последнее менее желательно.
Примечания:
1. При расчете количество катионита лучше выражать не в процентах по отношению к спирту или кислоте, а в граммах на грамм-моль гидроксильных или карбоксильных групп. Эти данные для сравнения более реальны и не меняются в зависимости от колебания молекулярного веса кислоты или спирта. В данном случае необходимо 17 г катиоинита КУ-2 на 1 грамм-моль гндроксильных (17 г) или карбоксильных (45 г) групп. Если синтез вести с избытком 0,25 М спирта, то достаточно уже 10 г катионита и реакция заканчивается примерно в два раза быстрее. Следует также отметить, что первые два-три синтеза протекают несколько дольше.
2. Необходимо заметить, что скорость образования эфиров из спиртов изостроения заметно медленнее, то есть продолжительность реакции зависит от прямой и обратной скорости диффузии внутри зерна ионообменной смолы реагирующих веществ и образовавшихся продуктов. Это наблюдалось также на примере образования н-амил- и изоамилацетата, н-бутил- и изобутил-, н-амил- и изоамилсалицилатов.
Способ 3. На ионообменных катализаторах
Существующий метод получения эфиров уксусной кислоты основан на действии уксусного ангидрида или уксусной кислоты на соответствующие спирты в присутствии серной кислоты. Возможность побочных процессов, трудность очистки от не вступившего в реакцию спирта являются недостатками метода гомогенного кислотного катализа.
В последнее время разработан метод получения некоторых эфиров уксусной кислоты этерификацией уксусной кислоты соответствующими спиртами в присутствии ионообменной смолы КУ-2.
Использование ионитов как катализаторов реакции этерификации позволяет применить эквивалентные количества реагирующих веществ, что значительно облегчает очистку готового продукта.
Схема синтеза
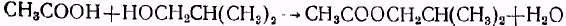
Характеристика основного сырья
Уксусная кислота, техн., ГОСТ 7077—54, изобутиловый спирт техн., ТУ МХП 1704—47, ионообменная смола КУ-2, ВТУ ГХПК М-661—55, используется без предварительной обработки.
Условия получения
В круглодонную колбу емкостью 1 л, снабженную мешалкой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°.
Выход чистого продукта составляет 470 г или 67,5% от теоретического; 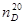 ~ 1,390;
~ 1,390; 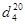 — 0,8710. По литературным данным,
— 0,8710. По литературным данным, 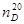 —1,39066;
—1,39066; 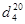 —0,8712.
—0,8712.
Сольволитические методы составляют самую большую группу методов синтеза сложных эфиров, поскольку все производные кислот так или иначе способны к взаимопревращениям. По уменьшению относительной реакционной способности эти производные располагаются в следующий ряд: хлорангидрид > ангидрид кислоты > > сложный эфир > амид, нитрил > соль. Можно ожидать, что сложные эфиры, находящиеся в середине этого ряда, легко будут образовываться из хлорангидридов или ангидридов кислот, существовать в равновесии с другими эфирами (в условиях кислотного катализа) и с несколько большим трудом образовываться из амидов и солей. Получение эфиров из солей облегчается, если при этом происходит выделение или осаждение нерастворимой неорганической соли. Короче говоря, сложные эфиры могут быть получены из кислот (реакция этерификации), а также из соединений пяти других приведенных выше типов. Кроме того, для синтеза сложных эфиров можно применять и другие исходные вещества, например кетены — соединения, родственные ангидридам, и 1,1,1-тригалоген-замещенные или а -дигалогензамещенные простые эфиры, имеющие ту же степень окисления, что и сложные эфиры. Единственным в своем роде методом получения является рассмотренный пример пиролиза медных солей, при котором происходит необычная ориентация.
RCOOH + R ' OH = RCOOR ' + Н2 О
Реакция этерификации — один из самых обычных методов, применяемых для синтеза сложных эфиров, поскольку часто и необходимая кислота, и спирт имеются в готовом виде. Наилучшие результаты этот метод дает в случае первичных спиртов, менее удовлетворительные — для вторичных и еще менее удовлетворительные — в случае третичных спиртов. Для быстрейшего достижения равновесия применяют такие катализаторы, как серная кислота, хлористый водород, арилсульфокислота или эфират трехфтористого бора, хотя некоторые эфиры бензилового спирта и муравьиной кислоты можно получить в отсутствие катализатора. Если спирт или кислота изменяются под действием кислот, следует предпочесть эфират трехфтористого бора. Для этерификации ароматических, кислот лучше брать 2 экв трехфтористого бора. Если при проведении реакции нежелательно присутствие кислоты в реакционной среде, в качестве катализатора можно использовать сильнокислые ионообменные смолы. Скорость образования эфира зависит orплощади поверхности ионообменной смолы, а в случае кислот высокого молекулярного веса площадь поверхности может быть еще больше ограничена плохой диффузией кислоты внутрь смолы. Ниже приведен пример этерификации при помощи кислой ионообменной смолы фурилового спирта, который при наличии кислоты в реакционной среде полимеризуется (пример а).
Недавно для получения метилового эфира пеларгоновой кислоты из этой кислоты, спирта и серной кислоты были использованы молекулярные сита Линде ЗА в виде таблеток; выход эфира составил 96%.
Для того чтобы максимально сместить равновесие в сторону образования сложного эфира, одно из исходных веществ (обычно спирт применяют в избытке или один из получающихся продуктов (воду) удаляют азеотропной перегонкой, а растворитель (бензол или толуол) возвращают в реакционную смесь при помощи ловушки Дина— Старка. Другими методами удаления воды могут служить следующие: азеотропная перегонка в аппарате Сокслета, в патрон которого помещают осушитель, например сульфат магния, или химический способ, заключающийся в реакции с диметилацеталем ацетона, приводящей к образованию ацетона и метилового спирта. Азеотропная перегонка при помощи аппарата Дина — Старка — лучший метод получения сложных эфиров, особенно эфиров высококипящих спиртов. Применение метилового спирта при этом представляет трудности вследствие его летучести. В этом случае используют специальную барботажную колонну для удаления; промежуточных фракций, содержащих воду. Однако в тех случаях, когда большие количества серной кислоты не оказывают влияния на карбоновую кислоту, из которой получают эфир, эту кислоту, метиловый спирт и серную кислоту просто можно кипятить с обратным холодильником, а образующийся метиловый эфир экстрагировать толуолом по методу Клостергарда, предназначенному для получения этиловых эфиров, таких, как триэтиловый эфир лимонной кислоты. Разработан простой полумикрометод, похожий на приведенный выше, при котором метиловые эфиры образуются и разделяются так же эффективно, как и при реакции кислоты с диазометаном. Наконец, удобным методом получения метиловых эфиров алифатических и ароматических кислот, дающим выходы 87—98%, является кипячение соответствующей кислоты (1 моль), метилового спирта (3 моля) и серной кислоты в этилен или метиленхлориде в течение 6—15 ч. Этот метод не требует сложного оборудования, как метод Вайсбергераи Киблера, и более удобен для получения эфиров в больших масштабах, чем метод Бейкера.
Схема реакции этерификации следующая:
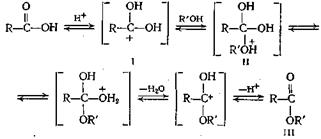
Электрофильная атака протона кислоты приводит к образованию иона карбония (I), который подвергается нуклеофильной атаке спиртом, давая соединение II; при перегруппировке и выделении молекулы воды и протона из него получается сложный эфир (III). Несомненно, что аллиловый и бензиловый спирты, а также третичные спирты склонны реагировать по карбоний-ионному механизму. В связи с существованием такой тенденции третичные спирты превращаются в основном в олефины, а не в сложные эфиры, а для получения сложных эфиров третичных алкилов необходимо искать другие пути синтеза, как показано в следующих параграфах.
Существенную роль в реакции этерификации играют стерические эффекты, поскольку атом углерода карбонильной группы кислоты в переходном комплексе II переходит из плоской тригональной структуры в тетраэдрическую структуру ( sp 3- тибридизация). Для определения влияния стерических эффектов на скорость этерификации алифатических кислот полезно «правило шести» Ньюмена, но лучшим способом оценки стерических факторов является изучение моделей. При применении обычных методов этерификации влияние оказывают также заместители, находящиеся в орто-положении ароматических кислот. В случае о, о-ди-алкилзамещенных можно проводить этерификацию, приливая раствор кислоты в 100%-ной серной кислоте к спирту. Успех этой реакции, по-видимому, зависит от образования плоского иона кар бония (обычная протонированнаякарбоксильная группа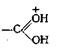 в этом случае не может стать копланарной с кольцом), который реагирует со спиртом, давая сложный эфир. Выходы при применении этого метода бывают от удовлетворительных до хороших.
в этом случае не может стать копланарной с кольцом), который реагирует со спиртом, давая сложный эфир. Выходы при применении этого метода бывают от удовлетворительных до хороших.
Этиловые эфиры могут быть получены (с выходами 84—94%) при нагревании соответствующей кислоты с избытком ортомуравьиного эфира вплоть до образования однородного раствора. В двух случаях добавляют толуолсульфокислоту или диметилформамид. Пространственно затрудненные кислоты, например 2,4,6-тринитро-и 2,4,6-триметилбензойные кислоты, этерифицируются с умеренными выходами.
Недавно опубликован новый метод этерификации пространственно затрудненных кислот. В этом случае реакция между спиртом и кислотой катализируется ангидридом трифторуксусной кислоты. Отличные выходы обычно получают с пространственно затрудненными кислотами, такими, как антрацен-9-карбоновая и 2,4,6-три-метилбензойная, и простыми или пространственно затрудненными спиртами или фенолами. Если и фенол, и кислота пространственно затруднены и возможен другой путь протекания реакции, например ацилирование атома углерода фенола, этерификация может не пойти. Согласно предполагаемому механизму, реакция идет по двум направлениям, которые оба включают образование протонированного ангидрида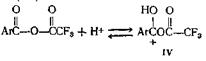
Этот последний может реагировать непосредственно со спиртом, образуя сложныйэфир (V)
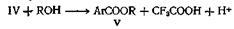
или в образовании эфира V может участвовать ион ацилия (VI)
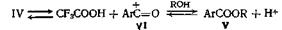
Аналогичным методом является реакция раствора кислоты в 20 частях пиридина с 2 экв бензол- или толуолсульфохлорида, приводящая к образованию ангидрида кислоты. К этому раствору на холоду добавляют 1 экв спирта (или фенола) и смесь разбавляют ледяной водой. Этот метод рекомендуется для получения трет- алкильных сложных эфиров и сложных эфиров третичных ацетиленовых спиртов. Для этерификации кислот в мягких условиях пригоден диэтилацеталь диметилформамида. Так, например, при реакции бензойной кислоты и 2 экв формамида в бензоле при 80 °С в течение 1 ч выход сложного эфира превышает 90%.
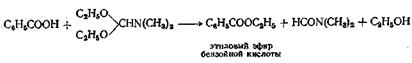
Сложные эфиры аминокислот можно с успехом получать при взаимодействии аминокислот со спиртом в присутствии хлористого тионила в качестве катализатора, а в некоторых случаях при взаимодействии с а -толуолсульфокислотой и большим избытком диметилсульфита

Стероидные спирты часто лучше ацетилируются уксусной кислотой и уксусным ангидридом в присутствии следов хлорной кислоты.
Ариловые сложные эфиры можно получать взаимодействием кислоты с фенолом в присутствии хлорокиси фосфора или полифесфорной.
Если в молекуле имеется как первичная, так и вторичная спиртовая группа, как, например, в антибиотике хлорамфениколе (синтомицин), частичная этерификация обычно приводит к образованию первичных моноэфиров. Эфир со вторичной спиртовой группой получают, проводя реакцию по остроумной схеме, приведенной ниже:
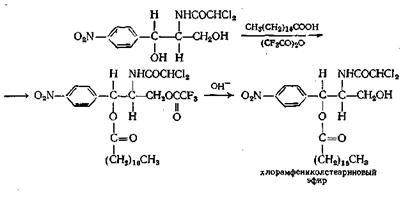
Диэфиры из кетонов или альдегидов и кислот можно получать, вероятно, через ангидрид кислоты (пример г) и из эфира.

Этот метод синтеза находит широкое применение, поскольку эта реакция необратима в отличие от реакции этерификации. Выделяющийся при реакции хлористый водород можно уводить из сферы реакции или поглощать его каким-нибудь основанием, например едким натром, диметиланилином или пиридином, или магнием. Иногда желательно применение алкоголята натрия. Диметиланилин и магний применяют для. получения эфиров третичных спиртов, имеющих тенденцию в отсутствие вещества, способного поглощать выделяющийся хлористый водород, образовывать галогенпроизводные. При этерификации фенолов часто применяют магний; эта реакция исследована количественно. Наиболее высокие выходы фениловых эфиров получают из таллиевых солей фенолов и хлорангидрида соответствующей кислоты.
Простейший метод — метод Шоттена — Баумана, состоящий во встряхивании хлорангидрида кислоты с водным раствором едкого натра, содержащим соответствующий спирт. Самые высокие выходы получаются тогда, когда хлорангидрид кислоты (и образующийся эфир) нерастворимы в воде, так что реакция протекает на границе раздела между органическим и водным слоем. Нерастворимость образующегося сложного эфира в водной фазе препятствует его омылению. По окончании реакции эфир получается свободным от хлорангидрида кислоты и хлористого водорода и его можно сразу экстрагировать и сушить. В довольно старом и незаслуженно забытом
Исследовании реакции Шоттена — Баумана было установлено, что (выходы сложных эфиров возрастают при понижении температуры Макции, при увеличении концентрации спирта (что можно осуществлять, добавляя щелочь постепенно) и при применении едкого кали, а не едкого натра. Кроме того, ангидрид уксусной кислоты дает более высокий выход эфира, чем хлорангидрид. Наиболее общим методом служит метод, в котором используют пиридин; если бы не неудобства, связанные с необходимостью избавляться от следов пиридина, который обычно отмывают разбавленной кислотой, вероятно, применяли бы только этот метод.
Эффективность реакции галогенангидридов кислот со спиртами может быть повышена проведением предварительной реакции галогенангидрида с кислотой Льюиса с целью получения соли ацилия. Простейшей такой солью является, по-видимому, метилоксокарбонийгексафторантимонат, который сам по себе или в нитрометане быстро реагирует со спиртами, образуя ацетаты с выходами от 62 до 87%.
Эта реакция, вероятно, происходит в результате нуклеофильной атаки спирта на атом углерода карбонила хлорангидрида кислоты.
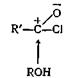
Образующийся при этом комплекс быстро теряет хлористый водород, давая сложный эфир R'COOR.
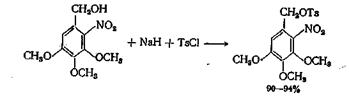
В случае образования реакционноспособных и нестабильных бензилтозилатов желательно сначала получить соответствующий алкоголят с гидридом натрия, а затем обрабатывать его хлор ангидридом кислоты. Аналогичный метод, но без выделения алкоголята натрия, применялся для получения тозилата 2-нитро-3,4,5-триметок-сибензилового спирта, в котором гидроксил спирта прочно связан с нитрогруппой.]
Многие функциональные группы при этом методе синтеза не затрагиваются. В хлорангидридах кислот, содержащих двойные связи, ацетокси-, алкиламино- и 2-фуранакрилогруппы, эти группы не изменяются. Оксиэфиры можно получать из двухатомных спиртов и хлорангидридов кислот; аналогичным образом хлорзамещенные сложные эфиры можно получать из галогендоинов. При этом часто получают высокие выходы
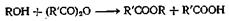
Или
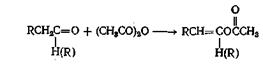
Как и хлорангидриды кислот, ангидриды кислот широко применяют для получения сложных эфиров из соединений, содержащих оксигруппу. Эту реакцию проводят как в отсутствие катализаторов, так и с применением таких катализаторов, как серная кислота, хлористый цинк, хлорсульфокислота, хлористый ацетил, ацетат натрия. борная кислота, сульфат железа(Ш), метилат натрия и моногидрат я-толуолсульфокислоты. Ацетилирование многих фенолов можно осуществить в водном растворе щелочи, а циклические ангидриды можно полностью или частично этерифицировать. Механизм этой реакции такой же, как и при реакции с хлорангидридом кислоты, только при этом происходит отрыв аниона карбоксилата, а не галоген-аниона. Поскольку анион карбоксилата в растворе менее термодинамически стабилен, чём анион галогена, можно ожидать, что реакция ангидрида кислоты со спиртом будет несколько менее экзотермической, чем реакция соответствующего хлорангидрида. Вопреки тому, что написано в некоторых учебниках, третичные спирты можно этерифицировать ангидридами кислот при применении кислых катализаторов или трифенилметилнатрия.
Способные енолизоваться альдегиды можно превратить в енол-ацетаты нагреванием с уксусным ангидридом и ацетатом калия. Для трех ангидридов, для которых была проведена эта реакция, выходы составляли от 35 до 61%. Способные к енолизации кетоны реагируют не с такой легкостью, но, применяя уксусный ангидрид и л-толуолсульфокислоту, можно добиться успеха. Выходы для трех изученных кетонов составляли от 32 до 68%. Интересно отметить, что в условиях, применявшихся при реакции с кетонами, в реакцию вовлекались только метиленовые водородные атомы. При получении а -бром альдегидов и кетонов в качестве промежуточных соединений используют енолацетаты, как показано ниже:
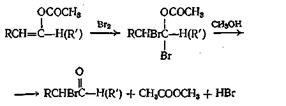
Смешанные ангидриды, получающиеся из алкиловых эфиров хлормуравьиной кислоты, разлагаются при нагревании, образуя сложные эфиры по следующим схемам:
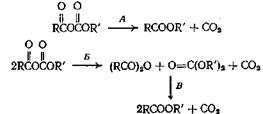
Ряд смешанных ангидридов из алифатических кислот разлагается с образованием сложных эфиров по пути А, а смешанные ангидриды ароматических кислот разлагаются по пути либо А, либо Б. При 250 °С происходит также реакция В. Трифторуксусная кислота и фениловый эфир хлормуравьиной кислоты при смешивании образуют фениловый эфир трифторуксусной кислоты с выходом 75—80%. Рассмотренные реакции декарбоксилирования, по-видимому, протекают через промежуточное циклическое состояние, причем происходит сдвиг электронов в цикле.
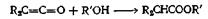
Несмотря на то что эти реакции часто дают высокие выходы, этот метод синтеза не находит широкого распространения вследствие того, что химик обычно не имеет готового кетена, а его получение иногдабывает довольно сложным. Реакцию промотируют такие катализаторы, как серная кислота или толуолсульфокислота. Этот метод с успехом применяют при ацетилировании сложных эфиров молочной кислоты, а также при ацетилировании третичных спиртов и фенолов. Некоторые функциональные группы, например функциональные группы альдегидов и кетонов, подвержены атаке кетенами. В некоторых случаях эти карбонильные соединения превращаются в енолацетаты
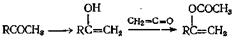
Присоединение спирта к кетену, вероятно, идет как присоединение к карбонильным группам. Сначалаобразуется енол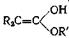
таутомеризующийся затем собразованием сложного эфира 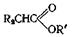
Поскольку кетены образуются в качестве промежуточных соединений при облучении большинства кетонов, кетоны представляют собой потенциальные источники получения сложных эфиров, если проводить их облучение в присутствии спиртов
Спирты присоединяются к дикетенам с образованием ацетоацетатов следующим образом: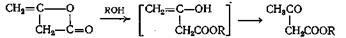
Этот метод выгодно применять для получения ацетоацетатов с ненасыщенными группами R. Оказалось, что в этих случаях лучше всего в качестве катализатора использовать алкоголят натрия. Такие сложные эфиры можно также получать из хлорангидридов кислот через дикетен в одну стадию.
Ацетали кетенов также могут самопроизвольно превращаться в сложные эфиры с количественным выходом
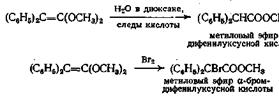
Получение карбаматов из изоцианатов и спиртов напоминает образование сложных эфиров из кетенов
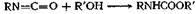
Эта реакция происходит самопроизвольно в отсутствие катализатора и дает высокие выходы карбаматов. Третичные спирты, однако, склонны к образованию олефинов. При получении фенилкарбаматов из изоцианатов и фенолов в качестве катализатора используют несколько капель триэтиламина или пиридина. Получение сложного эфира изоцианата представляет собой способ идентификации спиртов.
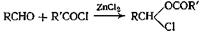
или
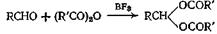
Эти реакции присоединения применяют в ограниченных масштабах для синтеза а -галогензамещенных сложных эфиров или ацилалей. Сложные эфиры получают, смешивая компоненты либо сами по себе, либо в присутствии следов хлористого цинка, причем выходы составляют примерно 50%. Ацилали лучше всего получать действием уксусного ангидрида, если реакцию вести с добавлением небольших количеств эфирата трехфтористого бора, но с ангидридами пропионовой и и-масляной кислот наилучшие результаты достигаются при добавлении 10%-ного избытка катализатора сверх эквивалентного количества. При проведении реакции как с малым количеством катализатора, так и с избытком уксусный ангидрид и формальдегид образуют смеси, а с янтарным и пропионовым альдегидами реакция не идет. Выходы при этих реакциях присоединения составляют 60—80%. При реакциях присоединения ангидрида можно использовать кислоты, например серную кислоту, но выходы при этом обычно получаются более низкими, кроме тех случаев, когда добавляют ацетат натрия.
Выше уже приводились примеры получения изопропилиденмалоната и а -ацетокси-М-циклогексилизовалерамида.
3 .6 Из нитрилов
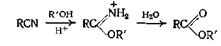
Хотя от нитрилов можно перейти к сложным эфирам через амиды, обычный метод состоит в превращении их в иминоэфир, который можно выделять в качестве промежуточного соединения, а можно и не выделять. Для этой реакции применяют различные катализаторы, такие, как хлористый водород, бромистый и йодистый водород, серную кислоту и моногидраты бензол- и толуолсульфокислот. Следует отдать предпочтение аренсульфокислотам по сравнению с хлористым водородом или серной кислотой. С хлористым водородом получаются, более высокие выходы, чем с бромистым и йодистым водородом. Как показывает приведенное уравнение реакции, если исключить из участия в реакции воду, можно получить иминоэфиры. В некоторых случаях для реакции, ведущей к образованию иминоэфира, вода не нужна совсем, а иногда в отсутствие воды реакция не идет.
Этот метод синтеза находит широкое применение для получения полифункциональных соединений. Так, например, малоновые эфиры обычно синтезируют из эфиров а -цианкарбоновых кислот. Из циангидринов получают оксиэфиры, из кетоцианидов — кетоэфиры, а из аминоцианидов—аминоэфиры. Выходы при этом обычно бывают удовлетворительные.
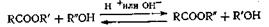
Переэтерификация представляет собой равновесную реакцию, которую можно сдвинуть в прямом направлении, применяя избыток одного из реагентов или, что предпочтительно, удаляя один из компонентов — RCOOR" или R'OH. Если температура кипения R'OH ниже, чем R«OH, можно проводить разделение, при помощи фракционирования: иногда для удаления получающихся продуктов пользуются образованием азеотропных смесей. Катализаторами такой реакции обмена служат кислоты, например серная или толуолсульфокислота, или основания, например алкоголяты алюминия. Как правило, превращение лучше протекает с первичными спиртами, причем наиболее реакционноспособен метиловый спирт, хотя в некоторых случаях с успехом можно применять вторичные спирты.
Этот метод синтеза пригоден для синтеза алкиловых эфиров высших жирных кислот из жиров, масел и восков. Путем такого обмена удобно получать и многие другие сложные эфиры, например эфиры акриловой и диэтиламино-а -фенилмасляной кислот. Наиболее важным эфиром енола, применяемым для получения сложных эфиров, является изопропенилацетат. Этот реагент легко доступен, и из него можно получать различные сложные эфиры с высоким выходом в результате обмена со спиртом в присутствии кислых катализаторов
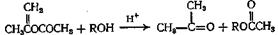
Эта реакция может протекать с образованием кетена, из которого получают изопропенилацетат, но возможно также, что при реакии, катализируемой кислотой, образуется ион ацилия, атакующий спирт. Приведен пример образования сложного эфира, а также эфира енола.
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами. Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Бутиловый спирт, однако, обменивается очень медленно
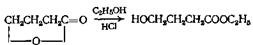
Этот метод синтеза находит лишь ограниченное применение при получении сложных эфиров. Бромистый водород в спиртовом растворе дает бромзамещенный сложный эфир, а хлористый водород приводит к образованию оксиэфира. Вместо галогеноводорода применяют и другие галогенпроизводные, например пятибромистый фосфор и тионилхлорид. Наиболее детально изучена, по-видимому, реакция пропиолактона. В этом случае при взаимодействии со спиртом в зависимости от природы катализатора образуются два продукта. С основаниями происходит расщепление по связи кислород—углерод карбонила, приводящее к образованию оксиэфиров
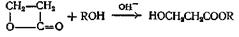
В отсутствие катализатора или с кислыми катализаторами происходит расщепление связи кислород — углерод метиленовой группы с образованием р-алкоксикислот
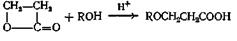
Механизм этого расщепления сходен с механизмом, предложенным для сложных эфиров, поскольку лактоны можно рассматривать как внутримолекулярные сложные эфиры. Выходы при этой реакции получаются удовлетворительные.

Этот обмен происходит, и часто с хорошими выходами, в случае ациламинокислот и при получении виниловых эфиров различных алифатических и ароматических карбоновых кислот. N-Ациламинокислоты, например фталоилглицин или тозилглицин, превращаются в метиловые или этиловые эфиры под действием алкилформиата или алкилацетата. Обычно в качестве катализаторов используют 96% -ную серную кислоту или моногидрат толуолсульфокислоты. Неацилированные аминокислоты, за исключением фенилаланина нельзя превратить в сложные эфиры при помощи такого катализатора, как серная кислота.
«Винильный обмен» требует применения в качестве катализатора ртутной соли сильной кислоты. Температура при этой реакции должна поддерживаться в области 20—80 °С; более высокие температуры приводят к образованию диэфиров этилидена и ангидридов кислот. Этот метод синтеза позволяет получать более чистые мономеры, чем те, которые образуются в результате присоединения ацетилена к кислоте. Считают, что в этом случае соль ртути образует ацетиленовый комплекс (I)
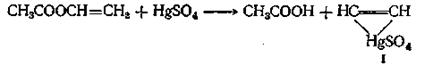
реагирующий с кислотой с образованием сложного эфира (II)
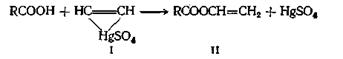
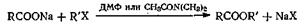
Эта реакция обмена дает высокие выходы с галогенпроизводными, способными к реакции замещения по механизму SN2 в апротонных растворителях. Хорошие выходы метиловых эфиров высокой степени чистоты получаются с йодистым метилом, бикарбонатом натрия и соответствующей кислотой при проведении реакции в диметилацетамиде при комнатной температуре. При реакции с другими алкилгалогенидами синтезирован ряд сложных эфиров. Можно использовать для этой реакции соль натрия или серебра с триэтиламином в качестве катализатораили саму свободную кислоту с триэтиламином. Фенациловые эфиры, получаемые этим методом, используют для характеристики карбоновых кислот.
При получении тритиловых эфиров следует предпочесть бромистый триэтил хлористому, поскольку он более реакционноспособен и менее гигроскопичен и его можно применять с безводной серебряной, натриевой или калиевой солью.
При реакции соли, уксуснокислого тетраэтиламмония, с оптически активным галогенпроизводным образуется сложный эфир с меньшей степенью рацемизации, чем при применении уксусной кислоты
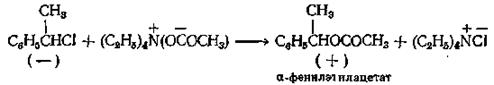
Реакция медной соли кислоты с каким-либо арилгалогенидом в высококипящем растворителе — единственно пригодный способ получения ариловых эфиров из арилгалогенидов. В качестве промежуточного соединения образуется медьорганическое соединение
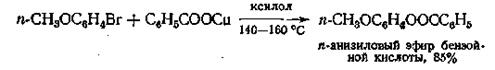
Эту реакцию можно применять также в случае винилгалогенидов с целью получения виниловых эфиров.
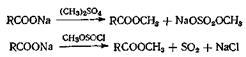
При этом методе синтеза обычно в качестве алкилирующегс агента применяют диметилсульфат; кроме того, используются алкилпирокарбонаты, алкилсиликаты, алкилфосфонаты, ацетали и даже алкилхлорсульфиты. В последнем случае эфир получается в результате пиролиза реакционной смеси с выделением двуокиси серы. Алкилирование, как правило, проводят в щелочной среде; в этих условиях алкилируется как пространственно затрудненная, так и незатрудненная карбоксильная группа. При проведении реакции в кислых условиях алкилируется только пространственно незатрудненная карбоксильная группа. Выходы часто получаются высокие.
В методе, предложенном недавно, свободную кислоту алкили-руют при помощи какого-нибудь алкилсульфата и дициклогексил-этиламина в качестве акцептора протонов
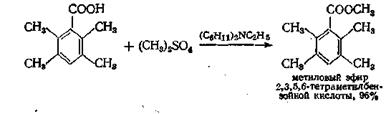
Выходы некоторых эфиров составляют 96—97% (метиловые эфиры) и 84% (этиловые эфиры).
Эта реакция дает возможность осуществить весьма необычный синтез эфиров арилбензойных кислот. При пиролизе медной соли ароматической кислоты образуется с хорошим выходом сложный эфир. Необычным является то, что арильная группа становится в орто-положение по отношению к присутствующей вначале карбоксильной группе, выделяющейся в процессе реакции, как показано ниже:
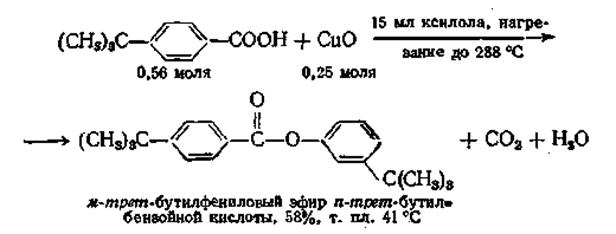
Механизм этой реакции, возможно, представляет собой циклозамещение, но он еще не установлен окончательно. Окись меди частично может быть заменена воздухом.
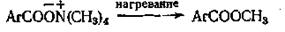
Этот метод синтеза первоначально применялся для получения сложных эфиров пространственно затрудненных бензойных кислот. Метиловые эфиры 2,4,6-триметил- и 2,4,6-триэтилбензойной кислот получены с выходом от 63 до 90%. Сложный эфир также образуется при непосредственном нагревании четвертичного галогенида аммония с ацетатом натрия и уксусной кислотой.
3.14. Из амидов
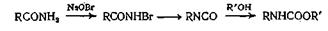
Превращение амидов в сложные эфиры — термодинамически невыгодная реакция и поэтому требует специальных условий. И действительно, реакция легко осуществляется лишь в необычных условиях. В качестве одного из примеров приведем гладкое превращение о- или п-нитроацетанилидов в сложные эфиры при взаимодействии со спиртами в присутствии алкоголята натрия. При этом очевидно, происходит алкоголиз через анион нитроацетанилида.
Амиды можно превратить в изоцианаты реакцией Гофмана с гипобромитом, а изоцианаты затем превратить в карбаматы действием спирта. Поскольку мочевина при нагревании превращается в изоциановую кислоту HN=C=O, она может реагировать со спиртами, образуя в качестве производных сначала изоциановую кислоту, а затем алкилкарбаматы (уретаны). Так, например, бензилкарбамат легко получается при кипячении мочевины и бензилового спирта до прекращения выделения аммиака

Любое соединение, приводящее к образованию изоцианата, является потенциальным источником карбамата, если проводить реакцию каком-нибудь спирте в качестве растворителя. Так, например,: облучении азида кислоты в этиловом спирте образуется уретан
-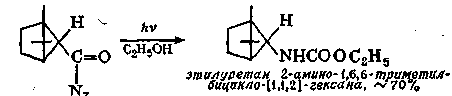 о
о
Из изоциановой кислоты, которая, вероятно, в кислых растворax сначала димеризуется, можно получить эфиры аллофановой кислоты
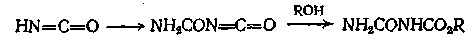
Многие эфиры аллофановой кислоты и целлосольва представляют собой кристаллические соединения и удобны для получения про водных.
Наиболее удобным, хотя и имеющим ограниченное применен методом превращения амида в сложный эфир является перегруппировка р-оксиэтиламида под влиянием концентрированной соляной кислоты
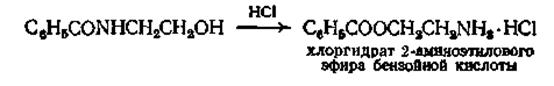
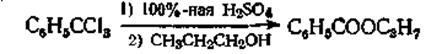
Эта реакция проводилась с различными замещенными бензотрифторидами и бензотрихлоридами, причем выходы составляли от 42 до 90%. Для более лабильных тригалогензамещенных, таких, как 3,3,3-трихлор-1,1-ди-(п-хлорфенил)пропен-1, при кипячении его с метиловым спиртом выход сложного эфира составляет 95%.
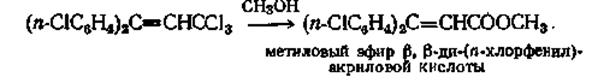
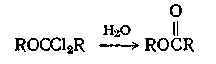
Сложные эфиры можно получить из а ,а -дихлоралкилзамещенных простых эфиров при гидролизе их водой. Для гидролиза а, а -дифторалкилзамещенных простых эфиров необходимо применять более сильные гидролизующие агенты, такие, как 95%-ную серную кислоту. Выходы при этих реакциях гидролиза составляют от 55 до 83%. Механизм этого расщепления точно не установлен, но можно предполагать, что этот гидролиз протекает с большей легкостью, чем гидролиз тригалогензамещенных, в результате влияния простой эфирной группы.
3.17. Из карбоновых кислот и дивинилртути
Этот метод синтеза применим только для получения сложных виниловых эфиров, простых виниловых эфиров (из фенола) и винилсульфидов (из тиофенола или алкилтиола). Для проведения реакции ароматическую или алифатическую карбоновую кислоту нагревают саму по себе или в каком-нибудь растворителе с дивинилртутью, полученной из хлорида ртути и винилмагнийбромида в тетрагидрофуране. В отсутствие растворителя реакция обычно проходит более чем на 50% за время меньше 5 мин при нагревании на паровой бане. Для безопасности реакцию необходимо проводить в хорошо вентилируемой тяге, поскольку дивинилртуть высоко токсична. Если проводить реакцию в инертном растворителе, можно выделить образующийся в качестве промежуточного соединения винилртутный эфир RCOOHgCH=Ch3 — Выходы виниловых сложных эфиров составляют от 38 до 74%.
3.18. Механизм реакции этерификации
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):
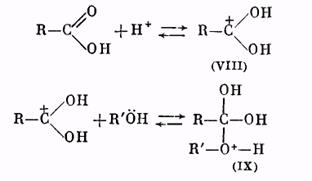
Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):
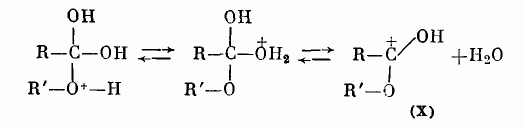
Катион (X) в результате отщепления протона образует молекулу сложного эфира:
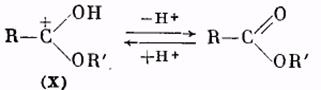
Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорания (CO2 и Н2 О) на присутствие тяжелого изотопа кислорода.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:
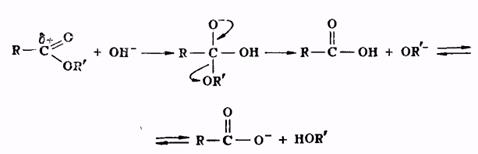
Он является процессом необратимым, поскольку богатый электронами анион кислоты не способен взаимодействовать с нуклеофильной молекулой спирта.
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2, Са(ОН)2 Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
В качестве растворителя основания для реакции гидролиза чаще всего применяют воду, которая, однако, не растворяет сложный эфир. Реакция идет на поверхности раздела двух фаз и требует, поэтому хорошего перемешивания. Иногда реакцию бывает целесообразно проводить в гомогенной среде, используя в качестве растворителя водный спирт. При этом, однако, нужно иметь в виду, что для выделения кислоты перед подкислением раствора спирт необходимо удалить (отогнать).
1. Терней А. Современная органическая химия: В 2 т. — М.: Мир, 1981. — Т.1 — 670 с; Т.2 — 615 с.
2. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, — 708 с.
3. Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
4. Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
5. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
6. Дорофеенко Г.Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
7. Голодников Г.В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
8. Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
9. Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
10. Шабаров Ю.С. Органическая химия: В 2-х кн. — М.: Химия, 1994.- 848 с.
11. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. — 623 с.
12. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
13. Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.
www.ronl.ru
Эфир изобутиловый уксусной кислоты - Справочник химика 21
Изобутиловый эфир уксусной кислоты [c.150]Эфир изобутиловый уксусной кислоты (изобути-лацетат) [c.93]
ЭФИР ИЗОБУТИЛОВЫЙ УКСУСНОЙ КИСЛОТЫ [c.123]
Изобутиловый эфир муравьиной кислоты (изобутилформиат). . Пропиловый эфир уксусной кислоты (пропилацетат). ...... [c.679]
Изобутиловый эфир уксусной кислоты. ............. [c.736]
Амиловый эфир муравьиной кислоты (амилформиат) Бутиловый эфир уксусной кислоты (бутилацетат). . Изобутиловый эфир уксусной кислоты (изобутилацетат) грет-Бутиловый эфир уксусной кислоты (трет-бутил- [c.971]
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты — ацетаты. Прочие эфиры (кислот молочной — лактаты, масляной — бу-тираты, муравьиной —формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемо-сти и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот [45], а также алкилен-карбонаты [46, с. 469]. Физико-химические свойства наиболее распространенных сложных эфиров приведены в табл. 11 и 12. [c.47]ИЗОБУТИЛОВЫЙ ЭФИР УКСУСНОЙ кислоты [c.51]
СХЕМА СИНТЕЗА ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ [c.51]
В круглодонную колбу емкостью 1 л, снабженную мешал-кой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°. [c.52]
Изобутилацетат (уксусной кислоты изобутиловый эфир) 110-19-0 СбН.гОг 0,1 /-рефл., 4 [c.986]
Ацетон (300 г), бутиловый спирт (200 г), изобутиловый спирт (80 г), диэтиловый эфир (150 г), изоами-ловый эфир уксусной кислоты (50 г), коллодий (75 г), муравьиная кислота 85%-ная (300 г), уксусная кислота (50 г), этиленгликоль (100 г), этиловый эфир уксусной кислоты (50 г) [c.386]
Бензол можно алкилировать некоторыми сложными эфирами органических и минеральных кислот [160]. При этом, в зависимости от взятого эфира, реакция проводится при комнатной или повышенной температуре. Нормальные и вторичные бутиловые эфиры муравьиной и уксусной кислот с бензолом дают один и тот же втор, бутил бензол. Изобутиловый эфир муравьиной кислоты дает трет.бутилбензол. Нормальные алкиловые эфиры реагируют труднее, чем эфиры, имеющие радикалы изостроения, что вполне [c.137]
Эфир изобутиловый уксусной кислоты (изо0у в-лацетат) [c.93]
Ангидриды кислот изомасляной Г7,111,477 и масляной 85,359. О Бутиловый, 0тор- и Г 5ег-бутиловый, изобутиловый эфиры ацето-уксусной кислоты 02,1,363. О 3-Гидрокси 5-метокси-З-метоксиме- [c.99]
С5НЮС1202 Изобутиловый эфир дихлор-уксусной кислоты. ... 1,192 -1,221 0,1159 [c.660]
Капроновая кислота. . . Изокапроновая кислота Дпацетоиовый спирт. . . Изоамиловый эфир муравьиной кислоты ( 3 о а м л ф о р м I й т) Изобутиловый эфир уксусной кислоты (изобутилацетат). . . Пропиловый эфир пропионовой кис лоты (пропилпроппоиат). . Этиловый эфир масляной кислоты [c.637]
Изобутиловый эфир уксусной кислоты, изобутил-ацетат, jS-метилэтилэтаноат [c.12]
Получение изобутилового эфира уксусной кислоты К бромистому магний-этилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см эфира (ср. Б, II, 2) медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 лкш., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида н сноса кипятят несколько минут. Через 12 час. реакциопную массу выливают в лед, смесь ела о подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике "21 реакцию ведут в автоклаоах, а вместо бромистого Этила применяют хлористый метил, хлористый этил или хлористый бенлил. [c.474]
Исследовалась массопередача уксусной кислоты в системах этиленгликоль — этилацетат, вода — изобутиловьп спирт и вода — этилацетат. Прп определенной величине возмущений наблюдались псевдостационарные полигональные конвективные ячейки. Этот тип межфазных явлений был назван микромасштабным межфазным движением в отличие от макромасштабного, под которым Беккер ы др. понимали движение, обусловленное потоками и геометрией межфазной новерхности. Средняя площадь ячейки возрастает во времени, причем ячейки большого размера растут за счет меньших. Для систем гликоль — ацетат и вода — изобутиловый эфир соотношение между средней площадью и временем было найдено линейным при массопередаче из гликоля или изобутилового спирта. Это означает, что линейный размер ячейки нропорционален корню квадратному из времени. Определяя глубину проникновения в случае молекулярной диффузии как было показано, что поря- [c.236]
Изобутилацетат, изобутиловый эфир уксусной кислоты (СН3СООС4Н9)—бесцветная и прозрачная жидкость. Приме няется в качестве растворителя для приготовления лаков. [c.98]
На способность сложных эфиров к самоконденсации заметное влияние оказывает также природа радикала в спиртовом фрагменте их молекулы. Соответствующие сведения имеются, правда, практически только для эфиров уксусной кислоты. Так, при проведении конденсации -пропил- и изопропилацетатов в сравнимых условиях (катализатор — этилат натрия) выходы соответствующих эфиров ацетоуксусной кислоты составили 70 и 45%. Это свидетельствует о том, что ацетат разветвленного — изопропилового—спирта вступает в реакцию конденсации не так легко, как ацетат спирта с нормальной цепью углеродных атомов. Однако в ряде случаев такое заключение сделать трудно, поскольку для конденсации использовались в качестве катализаторов алкоголяты тех спиртов, эфиры которых вводились в конденсацию. Например, конденсация м-бутил-, изобутил-, втор.-бутил и трет.-бутил ацетатов проводилась под действием алкоголятов н-бутилового, изобутилового, вторично- и трегичнобугилового спиртов соответственно в то же время указанные алкоголяты обладают различной силой основности, поскольку способность соответствующих спиртов к диссоциации убывает при переходе от н-бутилового к грет.-бутиловому спирту (см. Несмеянов А. Н., Несмея- нов А. Н. Начала органической химии, т. I. М., Химия , 1974, с. 96). [c.194]
СЙН1202 Изобутилацетат (изобутиловый эфир уксусной кислоты) [c.542]
Конденсация кротонового альдегида 250 г кротонового альдегида превращаются в о-дигидротолуило-вый альдегид, октатриенал и небольшое количество додекапентаенала, продолжительность реакции 30 часов выход 25% в изопропиловом, изобутиловом, изоамиловом и н-бу-тиловом спиртах конденсация происходит значительно медленнее, чем в этиловом, метиловом и пропиловом спирте растворители, которые не содержат особых активирующих групп, например бензол, хлороформ, диоксан и эфир уксусной кислоты, так сильно замедляют конденсацию, что через 24 часа появляется только слабая желтая окраска, но еще нет конечного продукта [c.437]
Бензол можно алкилировать некоторыми сложными эфирами органических и минеральных кислот [1601. При этом, в зависимости от взятого эфира, реакция проводится при комнатной или повышенной температуре. Нормальные и втор, бутиловые эфиры муравьиной и уксусной кислот с бензолом дают один и тот же втор, бутилбензол. Изобутиловый эфир муравьиной кислоты дает трет, бутилбензол. Нормальные алкиловые эфиры реагируют труднее, чем эфиры, имеющие радикалы изостроения, что вполне согласуется с менее выраженной способностью их к диссоциации на олефин и кислоту. Образующиеся диалкилбеизолы и в данном случае представлены в основном пара-изомерами. Винилацетат с бензолом образует трудно идентифицируемую смесь смолообразных продуктов. [c.166]
В качестве а1пиваторов полимеризации помимо воды применялись такие вещества, как изобутиловый сппрт и уксусная кислота. Эти вещества оказались эффективными активаторами. Добавка диэтилового эфира также активировала реакцию, но в малой степени. Для того чтобы получить такую же скорость реакции, как и с другими активаторами, требовалось давление эфира в десять раз большее. [c.68]
В ряде работ изучалось влияние метилового и этилового спиртов на реакции перекиси водорода [138]. Было показано, например, что эти вещества тормозят каталитическое разложение под действием меди или марганца [139, 140]. Подавляется также и реакция с ионом закисного железа [141] ацетон и уксусная кислота оказывают значительно меньшее влияние. Это влияние может заметно зависеть и от концентрации. В случае йодидного катализа повышение концентрации метилового или этилового спирта или пиридина в растворителе непрерывно снижает скорость разложения с другой стороны, при н-пропиловом спирте скорость проходит через минимум в зависимости от концентрации [142]. Наоборот, изобутиловый и амиловый спирты, глицерин и этиленгликоль увеличивают скорость реакции в присутствии йодида, хотя Уолтон и Джонс [143] указывают, что такие растворители все же качественно от воды не отличаются. Овербергер и Камминс [63] исследовали окисление сульфида в таких растворителях, как этиловый и изопропиловый спирты, диизо-пропиловый эфир, ацетонитрил и пропионитрил, и пришли к заключению, что окисление протекает быстрее в растворителях, способных к образованию водородных связей с перекисью водорода, а также, что вода и спирт, возможно, обладают одинаковой эффективностью в отношении сольватации перекиси водорода. [c.331]
chem21.info
Уксусная кислота изобутиловый - Справочник химика 21
Изобутиловый эфир уксусной кислоты [c.150]Изобутилацетат (уксусной кислоты изобутиловый эфир) 110-19-0 СбН.гОг 0,1 /-рефл., 4 [c.986]
Уксусной кислоты изобутиловый эфир (изобутилацетат) [c.26]
Изобутиловый эфир муравьиной кислоты (изобутилформиат). . Пропиловый эфир уксусной кислоты (пропилацетат). ...... [c.679]
Изобутиловый эфир уксусной кислоты. ............. [c.736]
В одном из вариантов тривиальной номенклатуры сложных эфиров указываются кислота и спирт, из которых получен сложный эфир этиловый эфир уксусной кислоты, или уксусноэтиловый эфир,— из этилового спирта и уксусной кислоты изобутиловый эфир азотной кислоты, или азотноизобутиловый эфир,— из изобутилового спирта и азотной кислоты и т. д. [c.136]Амиловый эфир муравьиной кислоты (амилформиат) Бутиловый эфир уксусной кислоты (бутилацетат). . Изобутиловый эфир уксусной кислоты (изобутилацетат) грет-Бутиловый эфир уксусной кислоты (трет-бутил- [c.971]
ИЗОБУТИЛОВЫЙ ЭФИР УКСУСНОЙ кислоты [c.51]
СХЕМА СИНТЕЗА ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ [c.51]
В круглодонную колбу емкостью 1 л, снабженную мешал-кой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°. [c.52]
В качестве подвижной фазы использованы также бутиловый, изобутиловый, амиловый и изоамиловый спирты и их растворы с кислотами. В бутиловом и амиловом спиртах эти ионы остаются па стартовой линии неподвижными. При добавлении концентрированного раствора HG1 резко увеличивается величина Rf для рения, молибдена и ванадия. Для перемещения вольфрама требуется больше 25 мл раствора соляной кислоты в 100 мл смеси. Разбавление подкисленных растворов водой не влияет на Rf ионов, но добавление уксусной кислоты способствует перемещению вольфрама при меньшем количестве соляной кнслоты [97]. [c.223]
Токсикология. Патти [1445] считает, что максимально допустимая концентрация изобутилового зфира уксусной кислоты в воздухе составляет 0,04%. [c.378]
К 1 мл анализируемого раствора прибавляют I мл 30%-ного раствора уксусной кислоты, 0,1—0,2 г цинковой пыли (для восстановления мешающих ионов) и фильтруют. К фильтрату прибавляют 4 мл концентрированного раствора гидроокиси аммония, 2 мл I Л/ раствора этилксантогената калия и мл изобутилового спирта и перемешивают, В присутствии кобальта появляется Темно-зеленое окрашивание спиртового слоя. Железо, медь, никель и большинство других катионов не мешают обнаружению кобальта. [c.53]
Уксусная кислота. Этиловый спирт. . Изобутиловый спирт [c.385]
В. М. Олевский и И. Ф. Голубев (ГИАП) проводили работы по азеотропной ректификации искусственно приготовленных смесей ксилолов. В опытах применяли воду, параальдегид, уксусную кислоту, изобутиловый и этиловый спирты. Установ.лено, что исследованных веществ для разделения смеси изомеров ксилола методом азеотропной ректификации практически пригоден лишь изобутиловый спирт, хотя ксилолы образуют азеотропные смеси также и с этиловым спиртом. [c.215]
Бензиловый эфир уксусной кислоты. ... Изобутиловый эфир ук сусной кислоты. . [c.418]
Наблюдения за системой изобутиловый спирт—уксусная кислота—вода+ЫаОН показали, что активность достигает максимума при некоторой концентрации NaOH (около 1 н.). В этой же области Шервуд получил наибольшие коэффициенты массопередачи и наибольшие отклонения их от теоретически вычисленных, из чего следует вывод о связи между спонтанной турбулентностью и массопе-реносом. [c.61]
Капроновая кислота. . . Изокапроновая кислота Дпацетоиовый спирт. . . Изоамиловый эфир муравьиной кислоты ( 3 о а м л ф о р м I й т) Изобутиловый эфир уксусной кислоты (изобутилацетат). . . Пропиловый эфир пропионовой кис лоты (пропилпроппоиат). . Этиловый эфир масляной кислоты [c.637]
Расположите в ряд по увеличению кислотности следующие соединения а) изобутиловый спирт, муравьиная кислота, уксусная кислота, щавелевая кислота, бгор-бутиловый спирт, трег-пентиловый спирт, бензиловый спирт [c.94]
Примеры систем различного типа а — бензол —вода, вода — хлорбензол, вода—ксилол б —вода—фурфурол в — вода—и-бу-типовый спирт, вода — изобутиловый спирт г — бтор-бутило-вый спирт — вода а — уксусная кислота — и-октан, этиловый спирт — вода, сероуглерод — ацетон е — и-гексан — бензол, н-гептан — бензол, метиловый спирт — вода ж — бензол—толуол, этан — бутан, циклогексан—н-октап з — ацетальдегид— фурфурол, ацетон—уксусная кислота, метилацетилкетон—про-нионовая кислота и — азотная кислота—вода, соляная кислота-вода, циклогексанол —фенол. [c.53]
Уксусная кислота Этилеихлоргидрии Этилнитрат. . Этиловый спирт Аллиловый спирт Диметилкарбонат Иодистый изопропил. Пропиловый спирт. Изопропиловый спирт Пропилформиат. . . Бутиловый спирт. . втор-Бутиловый спирт трет-Б иловый спирт Изобутиловый спирт. трет-Амиловый спирт Диэтилформаль. Циклогексаи. . [c.383]
Ангидриды кислот изомасляной Г7,111,477 и масляной 85,359. О Бутиловый, 0тор- и Г 5ег-бутиловый, изобутиловый эфиры ацето-уксусной кислоты 02,1,363. О 3-Гидрокси 5-метокси-З-метоксиме- [c.99]
Бромистый изобутил может быть получен из изобутилового спирта при действии брома и фосфора водного раствора бромистоводородной кислоты 2 и газообразного бромистого водорода из изобутилена и газообразного бромистого водорода или раствора бромистого водорода в ледяной уксусной кислоте изомеризацией бромистого ягршич.-бутила при 210—220° . Целый ряд бромидов, в том числе и бромистый изобутил, был получен действием трехбромистого фосфора на спирты Описанный метод является видоизменением метода, применявшегося для получения бромистого циклопентила [c.116]
В трехгорлую колбу, снабженную термометром, обратным холодильником и мешалкой, помещают 72 г (0,52 М) монобромуксусной кислоты, нейтрализуют ее 20°/о-ным раствором едкого натра до pH 7, нагревают до 90° и добавляют при перемешивании 16 г (0,03 М) a,a a"-тpиaминдибeпзилднфeнил-метана. Затем раствор нагревают до кипения (110° в колбе) и при энергичном размешивании прибавляют 20%-ный раствор едкого натра, поддерживая pH 8—10 по фенолфталеину. Конденсацию считают законченной, если щелочная реакция среды не изменяетсй в течение 30 минут после прибавления последнего количества щелочи. Реакция продолжается 5—6 часов. Затем реакционную массу фильтруют горячей, охлаждают и подкисляют 10%-ным раствором соляной кислоты до pH 2—3. Кислоту отфильтровывают и промывают водой до отрицательной реакции на ион хлора. После перекристаллизации из бутилового спирта в соотношении 1 8 получают 12 г комплексона ( 51% теории) с т. пл. 159—161°. а, а, а"-Три-аминдибензилдифенилметан- У, Л , Ы , К, К", М" -гекса-уксусная кислота представляет собой белый аморфный порошок с желтоватым оттенком хорошо растворим в щелочах, соляной кислоте, этиловом спирте, хуже — в бутиловом н изобутиловом нерастворим в хлороформе, ацетоне, воде. [c.74]
Изобутиловый эфир уксусной кислоты, изобутил-ацетат, jS-метилэтилэтаноат [c.12]
Определением скорости этерификацииодноосновных алифатических кислот можно установить, является ли данная кислота первичной, вторичной нлн третичной, т. е. с каким числом водородных атомов связан атом углерода, соседний с карбоксилом. Чтобы получать сравнимые между собой результаты, всегда следует вести этерификацию одним и тем же алкоголем. Обычно для этой цели применяют изобутиловый алкоголь. Вступление фенильных групп в уксусную кислоту очень сильно уменьшает скорость ее этерификации О влиянии строения на скорость этерификации ароматических кислот см. А, TV, 12. [c.361]
Получение изобутилового эфира уксусной кислоты К бромистому магний-этилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см эфира (ср. Б, II, 2) медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 лкш., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида н сноса кипятят несколько минут. Через 12 час. реакциопную массу выливают в лед, смесь ела о подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике "21 реакцию ведут в автоклаоах, а вместо бромистого Этила применяют хлористый метил, хлористый этил или хлористый бенлил. [c.474]
Исследовалась массопередача уксусной кислоты в системах этиленгликоль — этилацетат, вода — изобутиловьп спирт и вода — этилацетат. Прп определенной величине возмущений наблюдались псевдостационарные полигональные конвективные ячейки. Этот тип межфазных явлений был назван микромасштабным межфазным движением в отличие от макромасштабного, под которым Беккер ы др. понимали движение, обусловленное потоками и геометрией межфазной новерхности. Средняя площадь ячейки возрастает во времени, причем ячейки большого размера растут за счет меньших. Для систем гликоль — ацетат и вода — изобутиловый эфир соотношение между средней площадью и временем было найдено линейным при массопередаче из гликоля или изобутилового спирта. Это означает, что линейный размер ячейки нропорционален корню квадратному из времени. Определяя глубину проникновения в случае молекулярной диффузии как было показано, что поря- [c.236]
Изобутилацетат, изобутиловый эфир уксусной кислоты (СН3СООС4Н9)—бесцветная и прозрачная жидкость. Приме няется в качестве растворителя для приготовления лаков. [c.98]
На способность сложных эфиров к самоконденсации заметное влияние оказывает также природа радикала в спиртовом фрагменте их молекулы. Соответствующие сведения имеются, правда, практически только для эфиров уксусной кислоты. Так, при проведении конденсации -пропил- и изопропилацетатов в сравнимых условиях (катализатор — этилат натрия) выходы соответствующих эфиров ацетоуксусной кислоты составили 70 и 45%. Это свидетельствует о том, что ацетат разветвленного — изопропилового—спирта вступает в реакцию конденсации не так легко, как ацетат спирта с нормальной цепью углеродных атомов. Однако в ряде случаев такое заключение сделать трудно, поскольку для конденсации использовались в качестве катализаторов алкоголяты тех спиртов, эфиры которых вводились в конденсацию. Например, конденсация м-бутил-, изобутил-, втор.-бутил и трет.-бутил ацетатов проводилась под действием алкоголятов н-бутилового, изобутилового, вторично- и трегичнобугилового спиртов соответственно в то же время указанные алкоголяты обладают различной силой основности, поскольку способность соответствующих спиртов к диссоциации убывает при переходе от н-бутилового к грет.-бутиловому спирту (см. Несмеянов А. Н., Несмея- нов А. Н. Начала органической химии, т. I. М., Химия , 1974, с. 96). [c.194]
СЙН1202 Изобутилацетат (изобутиловый эфир уксусной кислоты) [c.542]
chem21.info
Изобутиловый эфир действие - Справочник химика 21
Реакция обратима, и в зависимости от исходных веществ, условий ее проведения и стехиометрических соотношений реагентов устанавливается определенное состояние равновесия. Полученную смесь эфиров и спиртов обычно разделяют перегонкой. Фактором, катализирующим обмен, может явиться минеральная кислота примером применения такой добавки может служить превращение жиров в метиловые эфиры жирных кислот , а также получение бутилового эфира олеиновой кислоты Эту реакцию катализируют также ионы ОН . При добавлении небольшого количества едкого натра к спиртовому раствору сложного эфира реакция алкоголиза значительно ускоряется. Подобным же образом действуют алкоголяты, образующиеся в спиртовом растворе сложного эфира при введении в него небольших количеств металлического натрия . Путем алкоголиза можно получить такие эфиры, получение которых другими методами затруднительно ввиду малой стойкости кислоты, например изобутиловый эфир ацетоуксусной кислоты . [c.357] ЭФО (ТУ 38.1011210-89) — цинкобариевая соль изобутилового эфира арилдитиофосфоновой кислоты. Используют в качестве противоизносной присадки в тракторных трансмиссионных маслах. Присадка ЭФО обладает также антиокислительным действием. Применяют в маслах в концентрации 5-6 % (мае. доля). [c.455]Рост цепи на свободных ионах. Доказано, что при К. п. стирола, а-метилстирола, винил-изобутилового эфира и циклопентадиена под действием пучка быстрых электронов рост цепи идет на свободных катионах. Образующиеся при взаимодействии излучения с мономером горячие частицы взаимодействуют друг с другом и со средой за время порядка 0,1 мксек (10 сек), после чего в системе устанавливается стационарная концентрация свободных катионов, к-рые и являются активными частицами процесса. Значение константы скорости роста цепей Кр на свободных катионах и анионах много выше, чем на свободных радикалах или ионных парах (табл. 1). Кроме того, Кр для свободных катионов примерно в 50 раз (стирол) больше, чем для свободных анионов. Энергия активации роста цепи Д р на свободных катионах близка к нулю. Это связано со структурой реагирующих частиц свободный катион пмеет незанятые низко расположенные энергетич. электронные орбиты, на к-рые легко переходит [c.490]
Действием на целлюлозу соответствующих эфиров бензолсуль-фокислоты были синтезированы гексиловый, гептиловый, октиловый, нониловый и дециловый эфиры целлюлозы с у = 150 — 200, а также простые эфиры целлюлозы и спиртов с разветвленной углеродной цепью, в частности изопропиловый и изобутиловый эфиры целлюлозы которые ранее другими методами не были получены или синтез которых при использовании алкилгалогенидов связан с затруднениями. [c.376]
Изобутиловый эфир фосфористой кислоты описан в литературе Иене [27] и получен им по способу, аналогичному предыдущим, т. е. действием треххлористого фосфора на алкоголят изобутилового спирта. [c.87]
На основании действия брома на аналоги изобутилового эфира фосфористой кислоты [8, 10] можно было предполагать, что и на изобутиловый эфир бром будет действовать подобным же образом и реакция выразится уравнениями [c.170]
В 1914 г. А. Е. Арбузовым [1] было описано получение этилового, изопропилового и изобутилового эфиров дифенилфосфинистой кислоты действием соответствующих алкоголятов спиртов на дифенилхлорфосфин. Эти соединения оказались весьма реакционноспособными, особенно сильно в них развита способность к реакциям присоединения. [c.330]
Изобутиловый эфир хлорсульфоновой кислоты [158] получен в виде сырого продукта действием хлористого сульфурила на спирт. Вследствие большой неустойчивости чистый эфир выделен не был. [c.44]
Реакции этого типа у алифатических альдегидов легко и гладко 1фОтекают под влиянием веществ, содержащихся в некоторых животных тканях, например в ткани печени или селезенки Однако у алифатических альдегидов эта реакция лучше протекает при действии алкоголятов алюминия или магния. При этом ацетальдегид превращается в уксусноэтиловый эфир, изо-масляный альдегид в изобутиловый эфир изомасляной кислоты, а хлораль — в грихлорэтиловый эфир трихлоруксусной кислоты i a [c.217]
Для устранения возможности подобных реакций рекомендуется избегать избытка магнийорганического соединения и проводить реакцию и переработку продуктов без нагревания [189]. Из эфира салициловой кислоты действием бромистого фенилмагния получен о-окситрнфенилкарбинол [190] изобутиловый эфир салициловой кислоты с бромистым изопропилмагнием образует о-оксифенилдиизопропилкарбинол [191] [c.205]
Сополимеры N-винилкарбазола с изобутиловым эфиром акриловой или метакриловой кислот или с акрилонитрилом предложено получать при действии ионизирующего облучения Описан способ прививки N-винилкарбазола на полиэтилен с помощью радиации полученные привитые сополимеры весьма стойки к действию растворителей, температуры плавления их выше, чем у полиэтилена, а хрупкость меньше, чем хрупкость поливи-нилкарбазола Попытка прививки винилкарбазола на полиэтилен в присутствии некоторых окислительно-восстановительных систем не увенчалась успехом [c.744]
Окисление изобутанола раствором двухромокислого натрия и серной кислоты в воде проводится при температуре не выше 15° и приводит к смеси а-изомасляной кислоты, ее изобутилового эфира и небольших количеств изомасляного альдегида. Изомасляная кислота как связанная в виде эфира, так и свободная переводится действием едкого натра в натриевую соль. После отделения последней действием на нее минеральной- кислоты h3SO4 или НС ) выделяется изомасляная кислота, которая для очистки подвергается перегонке. Выход изомасляной кислоты по этому способу может достигать 70—75% от теоретического. [c.382]
Пытаясь приготовить в 1905 г. изобутиловый эфир фосфористой кислоты, я нашел [83], что при действии треххлористого фосфора на алкоголят изобутилового спирта, после разгонки продуктов реакции под уменьшенным давлением, получаются две фракции первая представляет смесь кислого эфира фосфористой кислоты со средним и по анализам близко подходит к формуле P(O 4H9)3-P(O sH9)2(OH) (iso), вторая — средний эфир фосфорной кислоты состава ОР (ОС4Н9) з(г о). [c.166]
Для того чтобы выделить средний изобутиловый эфир фосфористой кислоты из ее смеси с кислым эфиром, т. е. диизобутилфосфористой кислотой, мы воспользовались только что описанным свойством этой кислоты давать при действии металлического патрия соль, неразлагаемую ири высокой температуре. [c.169]
Реакция присоединения серы к изобутиловому эфиру фосфористой кислоты уже отчасти изучена П. С. Пищимукой [14], который действовал серой на приготовленное мною соединение состава Р(ОС4Н9)з- Р(ОС4Н9)2(ОН). [c.176]
Бутиловый эфир дифенилборной кислоты можно отделить от дибутилового эфира фенилборной кислоты следующим образом. На смесь эфиров действуют аммиаком, и неустойчивый аммиачный комплекс эфира дифенилборной кислоты (т. пл. 64—67° С) превращают затем в хорошо кристаллизующийся аминоэтиловый эфир (т. пл. 189—190° С) действием этаноламина (синтез этих эфиров см. ниже). Были также получены изобутиловый [59, 601 и изоамиловый [59] эфиры дифенилборной кислоты, изобутиловый эфир ди-/г-толилборной кислоты, т. кип. 146—146,5°С/2,5жж, 1,5448, 0,9630 изобутиловый эфир ди-о-толилборной кислоты [59], т. кип. 135° С/1,2 мм. По 1,5440, iif 0,9704 н-бутиловый эфир ди(п-толил)борной кислоты, т. кип. 138° С/0,6 жж, выход 26%, в смеси с ди-н-бутиловым эфиром п-толилборной кислоты, т. кип. 110° С/0,6 жж, бутиловый эфир ди(/г-хлорфенил)борной кислоты, т. кип. 150° С/0,5 жж, выход 15,5% этиловый эфир ди(п-бромфе-нил)борной кислоты, т. кип. 160° С/О,25 мм, выход 42,7%. [c.35]
Ангидрид циклогексилборпой кислоты (т. пл. 60—76 С) получен из. изобутилового эфира циклогексилхлорборной кислоты действием абсолютного ацетона и эфира [52]. Полученный продукт энергично окисляется кислородом воздуха. [c.185]
При действии хлористого ацетила на изобутиловый эфир меркур-бис-уксусной кислоты выделен изобутил ацетоацетат (реагирование по 1—2-направлению) и изобутил ацетат — продукт 1—4 -реагирования при дей- ствии хлористого ацетила на метиловый эфир меркур-быс-уксусной кислоты и хлористого изовалерила на изобутиловый эфир меркур-быс-уксусной кислоты получены соответственно а-метоксивинилацетат и а-изобутокси- винилизовалерат — продукты реагирования по 1—4-направлению. [c.128]
Реакция изобутилового эфира меркур-бмс-уксусной кислоты с хлористым ацетилом. Из 21,4 г изобутилового эфира меркур-бис-уксусной кислоты и 11,8 г хлористого ацетила в смеси 20 мл изопентана и 20 мл эфира (12 час. при 20 С и 0,5 часа при 50—55 С после отгонки растворителей) после аналогичной обработки выделено 2,5 г (43%) изобутилацетата с т. кип. 116—117 С Ид 1,3915 (литературные данные [9] т. кип. 118 С Пд 1,39066) и 3 3 (24%)изобутилацетоацетатаст. кип. 123—127 С/ЪЪмм рт. ст. (литературные данные [10] т. кип. 202—206 С/760 мм рт. ст.) 0,79 3 этой фракции при действии фенилгидразина дали 0,6 г 3-метил-1-фенилпиразолона-5. Эта фракция не содержит а-изобутоксивинилаце-тата, так как не образует ацетанилида при действии анилина. [c.597]
Осуществляя реакцию хлорангидридов арилсульфокислот с нитроспиртами в присутствии пиридина для получения эфиров сульфокислот, Рибсомер достиг хорошего выхода, только применив одноатомные нитроспирты. То, что из 2-нитробутанола не образуется сложных эфиров, объясняют легкостью образования нитроолефина при действии на него бикарбоната. В качестве пластификаторов наиболее пригодны 2-нитро-к-бутиловый эфир га-толуолсульфокислоты (т. пл. 73° С) и соответствующий изобутиловый эфир (т. пл. 52—53° С). [c.488]
Для характеристики было исследовано действие на него водного раствора едкого кали. Реакция идет легко уже при обыкновенной температуре, в результате образуется кислота, которую выделить как таковую, однако, не удалось, так как эфиром она не извлекается, а при перегонке с водяным паром в присутствии серной кислоты переходит в продукт ее разложения — альдегид, который по исследовании оказался а-оксиизо.масляным. В конце концов она выделена была в виде изобутилового эфира и оказалась Р-ди-метилглицериновой. [c.331]
Белое кристаллическое вещество, плохо растворимое в воде. Для уничтожения сорияхов применяются натриевая и аминная соли, бутиловый и изобутиловый эфиры. Исполшу-ются как избирательные системные гербициды -на тех же культурах, что и 2,4-Д. Имеют сходный механизм действия на сорняки и тепло юр 01ВНЫХ. [c.61]
Бутиловый И изобутиловый эфиры 2,4,5-Т — ванускаются с ОП-7 в виде жидкости темнобурого (бутилов сй эфир) или светло-коричневого цвета (изобутиловый) с ароматическим запахом. Действующего начала содержится 75%, ОП-7 — 25%. [c.62]
Получение бутиловых спиртов гидрированием масляных альдегидов. Сырые масляные альдегиды, полученные оксосинтезом, имеют сложный состав. Основными компонентами этой смеси являются масляный и изомасляный альдегиды, спирты, которые присутствуют в продукте реакции за счет гидрирования альдегидов в процессе карбонилирования пропилена, и растворитель (пентан-гексано-вая фракция, ароматические углеводороды, смесь бутилового и изобутилового спиртов). В меньших количествах присутствуют-кислоты, сложные эфиры (в частности, формиаты и ацетали), простые эфиры и продукты конденсации. Эти примеси гидрируются значительно хуже основных продуктов и многие из них оказывают отравляющее действие на катализатор. Некоторые примеси образуются во время декобальтизации продуктов синтеза. Поэтому принятый способ деко-бальтизации в значительной мере предопределяет выбор катализатора и условий гидрирования. [c.24]
При действии избытка 100%-ной серной кислоты при комнатной температуре нормальные первичные спирты превращаются в алкипсерные кислоты, не образуя диалкил сульфатов [8], но после длительного стояния от кислоты отслаивается сложная смесь углеводородов, относящихся главным образом к парафиновому ряду. При этерификации первичных изоспиртов с разветвленными цепями, включая изобутиловый,. изоамиловый и оптически активный амиловый спирты, кроме сложных эфиров, получаются соединения, обесцвечивающие бромную воду. Наибольшее количество этих соединений отмечено при этерификации изо-бутилового спирта. При действии серной кислоты вторичные и третичные спирты сначала превращаются главным образом в сложные эфиры, которые при стоянии в присутствии избытка серной кислоты образуют углеводороды. Маслянистый слой, медленно отслаивающийся от серной кислоты, содержит большой процент насыщенных углеводородов [9]. Водород, необходимый для их образования, освобождается путем диспропор-ционирования типа сопряженной полимеризации [10], в результате которого получаются циклоолефины, остающиеся в кислом растворе. Из цетилового спирта получается вещество с т. пл. 50°, обладающее свойствами парафинового воска. Цикло-гексанол превращается в высококинящие углеводороды [11]. Кислый сульфат, приготовленный из трифенилкарбинола [8], представляет собой сильно диссоциированную кислоту, судя по его низкому молекулярному весу в растворе сернох кислоты. Он разлагается водой, регенерируя трифенилкарбинол. [c.8]
Эфиры енолов обычно получают нагреванием кетонов с эфирами ортомуравьиной кислоты в присутствии небольшого количества кислоты [525]. В ряду стероидов эфиры енолов можно, по-видимому, получить только из соединений, содержащих кетогруппу в положении 3 и двойную связь в положении 4. Эфиры енолов устойчивы в щелочной среде, например при восстановлении металлическим натрием в спирте и жидком аммиаке [525], натрием в пропаноле [496, 526] и алюмогидридом лития [527, 528]. Кроме того, они не изменяются при длительном кипячении с раствором едкого кали в метаноле [529] и при действии реактивов Гриньяра [530]. Хотя обычно применяются этиловые эфиры енолов, иногда следует отдать предпочтение бензиловым [527] или изобутиловым [528] эфирам енолов. Все такие эфиры енолов очень легко гидролизуются минеральными кислотами. [c.261]
chem21.info
Изобутиловый эфир фенолами - Справочник химика 21
Фракция 60—175° С состояла в основном из изобутилового спирта и изобутилового эфира (около 90%) с примесью диизобутилена и фенола. [c.105]Изобутиловый спирт, изобутиловый эфир, диизобутилен Фенол [c.195]
Коэффициенты распределения органических соединений в системах изобутиловый спирт — вода и диэтиловый эфир — вода. ... Коэффициенты распределения некоторых карбоновых кислот. . . Коэффициенты распределения некоторых фенолов в системе цикло гексан — вода. ....................... [c.5]
Окись углерода Метиловый спирт Этиловый спирт Изобутиловый спирт Глицерин Бензиловый спирт Маннит Этиловый эфир Терпентин Арабиноза Г люкоза Мальтоза Фенол [c.352]Изобутиловый спирт получается оксосинтезом н-бутиловый спирт производят из ацетальдегида через кротоновый альдегид, а также оксо>синтезом. Изобутиловый спирт применяется как растворитель для нитроцеллюлозных лаков, как компонент гидротормозных жидкостей, для получения сложных эфиров н 100%-ного изобутилена, а также для алкилирования фенола. Нормальный бутиловый спирт применяется как растворитель лаков, смол, для производства бутилацетата, масляной кислоты и альдегида. [c.204]
Для определения фенолов в высоких ко щентрациих >25 мг/л) 100 мл пробы (pH = 3 — 5) экстрагируют, встряхивая точно 10 мл изобутилового эфира уксусной кислоты, высушивают эфирный экстракт безводным N32804 и 20 мкл полученного раствора впрыскивают в фрактометр 116 (фирмы Перкин Эльмер) с термисторным детектором. [c.128]
Было установлено, что вода, изобутиловый спирт, диизобутилен, диизобутиловый эфир, фенол и высококипящие хвостовые фракции деалкилата затрудняют кристаллизацию /г-трет.бутилфенола и выделение его методами кристаллизации и фильтрования (центрифугирования). Поэтому суммарный безводный жидкий деалкилат (после добавления 0,3 % едкого натра для нейтрализации кислоты и предотвращения тем самым дополнительного деалкилирования трет.бутилфенолов) перегоняли на фракции до 175° С (содержа- [c.98]
Однако Еесьма важное промышленное значение имеют и многие пары жидкостей, частично растворимых друг в друге и образующих растворы, относящиеся ко второй группе, например, фенол и вода, фурфурол и вода, ацетон и вода, изобутиловый спирт н вода, эфир и вода. [c.10]
Состав тройных смесей, содержащих наряду с пропиленгликолем и олеатом натрия спирты (этиловый, аллиловый, пропиловый и изопропиловый, бутиловый, в/пор-бутиловый, изобутиловый, трет-бу-тиловый и /пре/п-хлорбутиловый, амиловый, в/пор-амиловый и изо-амиловый, гексиловый и циклогексиловый, октиловый и изоактило-вый, лауриловый, цетиловый, бензиловый), хлорорганические соединения (этиленхлоргидрин, триметиленхлоргидрин, четыреххлористый углерод, хлороформ, хлористый метилен, дихлорэтан, хлористый бутил), а также ацетон, метилэтилкетон, этилацетат, бензол, фенол, приведены в работе [28]. Там же приведен состав тройных систем пропиленгликоль — бензол с лауратом, миристатом, пальмитатом, стеаратом натрия и пальмитатом калия, пропиленгликоль — вода с подом, этиловым эфиром, сахарозой, пропиленгликоль — бензоат натрия — хлороформ. [c.186]
Методами с избирательным растворением и осаждением растворителями можно выделить смолистые вещества из нефтяных фракций и разделить их на более узкие группы, например растворимые и нерастворимые в пропане [122] или феноле [123]. Твердые смолы выделяли смесью (8 2) изобутилового спирта и циклогексана, а мягкие — изобутиловым спиртом [1]. Однако методы, основанные на обработке растворителями, не являются строго селективными. Вместе со смолами выделяются высокомолекулярные углеводороды, а с отдельными группами — их пограничные представители предыдущей группы. Эти налегания фракций различны в зависимости от состава анализируемой смеси, количества и свойств растворителей и осадителей. Так, при разделении смесей смол и асфальтенов петролейным эфиром из бензольного раствора осаждаются асфа.льтены. Когда такой обработке подвергали смолы, не содержащие асфальтенов, этим реагентом осаждались тяжелые смолы (которые в предыдущем случае оставались в растворителе). Применяя для осаждения асфальтенов (из смеси со смолами) различные легкие растворители, количество асфальтенов и их свойства получали различными, так как из раствора в осадок переходили следующие пограничные продукты [1]. [c.242]
Феносольван является смесью сложных уксуснокислых эфиров изоамилового и изобутилового спиртов. Удельный вес феносоль-вана меньше единицы и точка кипения его 110—130°. Феносольван мало растворим в воде и имеет большую избирательную способность по отношению к растворенным в сточной воде фенолам, маслам, смолам и т. п. [c.471]
Тогда было показано, что эфир этот с большой легкостью гидролизуется 1 % -ной серной кислотой и в результате дает этиловый спирт и ацетон... Новые работы показали, что, подобно аллилену, ацетилен при нагревании в автоклаве, содержащем какой-либо спирт, в присутствии едкого кали под давлением 12—15 ат при 150—160° присоединяет различные спирты и дает соответственно винильные эфиры с выходом около 95% по расчету на взятый в реакцию спирт. Получены эфиры, отвечающие метиловому, этиловому, пропиловому, изопропиловому, бутиловому, изобутиловому и изоамиловому спиртам, и, крюме того, получен эфир, отвечающий фенолу... [c.61]
В алкилате наряду с целевым продуктом содержались не вступивший в реакцию фенол, о-трет-бутилфенол, 2,4- и 2,6-ди-(грет-бутил)-фенолы и некоторое количество легкокипящих примесей (диизобутилен, грет-бутиловый эфир). В случае применения изобутилового спирта образовывались также о-втор-бу-тилфенол, 2-втор-бутил-4-трет-бутилфенол и 2,6-ди-(вгор-бутил)-фенол в результате спрямления углеродной цепочки этого спирта на стадии образования карбониевого иона [c.192]
Etijo представлял собою чистый гидрированный диизобутилен, а — смесь гидрированных диизобутилена и триизобутилена. Оба продукта синтезировались из изобутилена, получавшегося дегидратацией изобутилового спирта. Изобутиловый и высшие спирты, включая изобутирон, после его гидрирования в диизопропилкарбинол, использовались также для синтеза сложных эфиров с адипиновой и метил адипиновой кислотами, являвшимися компонентами низкозастывающих авиационных смазочных масел (адипиновая и метиладипиновая кислоты получались гидрированием фенола и крезолов в циклогексанол и метилциклогексанол с последующим окислением этих вторичных спиртов). Следует также заметить, что при желании отношение метанола к изобутанолу (5 1 на Лейна-Верке) может быть изменено, хотя бы на обратное, что и было осуществлено на установке, работавшей в Освенциме. Для этого требуется лишь снижение объемной скорости пропускания газа, некоторое повьппение температуры синтеза и изменение в смеси пропорции окиси углерода и водорода. [c.188]
chem21.info
Отчет по практике - Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
“СИНТЕЗ ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ”
Курсовая работа
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
1. Введение
1.1.Общие сведения
1.2.Практическое применение
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Способ 2. Получение на катионитовых катализаторах
Способ 3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1.Из карбоновых кислот (реакция этерификации)
3.2.Из хлорангидридов кислот
3.3.Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5.Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6.Из нитрилов
3.7.Из сложных эфиров и спиртов (реакция переэтерификации)
3.8.Из лактонов и спиртов (реакция переэтерификации)
3.9.Из сложных эфиров и кислот (реакция переэтерификации)
3.10.Из солей при взаимодействии с алкилгалогенидами
3.11.Из солей и кислот и других алкилирующих агентов
3.12.Из медных солей
3.13.Из тетраалкиламмоиевых солей
3.14.Из амидов
3.15.Из тригалогензамещенных
3.16.Из дигалогензамещенных простых эфиров
3.17.Из карбоновых кислот и дивинилртути
3.18.Механизм реакции этерификации
4.Выводы
Список литературы
1. Введение
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии h3 SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
2. Синтез ы изобутилацетата
Способ 1. Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Способ 2. Получение на катионитовых катализаторах
н-Бутил- и изобутилацетат очень широко используются в качестве растворителей и в ряде синтезов. Как известно, синтез сложных эфиров проводится в присутствии минеральных кислот в качестве катализаторов, используемых только однократно, что приводит к большому расходу воды при промывании.
При применении катионитов этот недостаток исключается; кроме того, в меньшей степени идут побочные процессы, в частности, образование непредельных соединений.
Схема синтеза
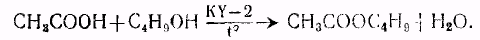
Характеристика основного сырья
Бутиловый спирт, ч., ГОСТ 6006—51 или 5980—51. Изобутиловый спирт, ч., ГОСТ 6016—51. Уксусная кислота, ч, ГОСТ 61—51. Катионит КУ-2, ГОСТ 5696—51.
Условия получения
Синтез веществ проводят в трехгорлой колбе с механической мешалкой, термометром и обратным холодильником с водоотделительной насадкой. Нагревание производят на глицериновой или масляной бане, температуру которой поддерживают контактным термометром.
В колбу загружают 17 г катионита в Н-форме (см. примечание 1), 74,86 г (1,01 М) н — или изобутилового спирта, 60,06 г (1 М) уксусной кислоты и нагревают. По достижении 98° начищает выделяться вода (воду, собравшуюся во флорентине, сливают с таким расчетом, чтобы к концу синтеза она оставалась заполненной водой почти полностью). Перед завершением реакции температура повышается для н-бутилацетата ~ до 115°, для изобутилацетата —110°. Реакцию ведут до выделения примерно 98—99% воды (17,7—17,8 мл) так как кроме реакции этерификации три накоплении эфира, идет дегидратация сложного эфира с образованием непредельных соединений и кислоты. Синтез веществ с н-бутиловым спиртом заканчивается за 45—50 минут, а с изобутиловым спиртом за 60—62 минуты (см. примечание 2). Затем реакционную смесь охлаждают, отделяют катализат от катионита декантацией, пропускают через колонку с анионитом АВ—17 или АВ—16 в ОН -форме, либо нейтрализуют 18—20%-ным раствором соды до слабощелочной реакции и промывкой водой до нейтральной реакции. Далее катализат подвергают разгонке на ректификационной колонке с эффективностью 10 теоретических тарелок.
Первую фракцию н-бутилацетата собирают до 122° с выходом 8,9—9 г, она состоит примерно из 51—52% спирта и 48—49% бутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 122 —127°/745 мм. Его выход составляет 106,8—106,9 г (или 92% от теоретического по кислоте) с содержанием бутилацетата не менее 99% и кислотностью не более 0,05%.
Первую фракцию изобутилацетата собирают до 110° с выходом 6,5—8 г, она состоит также примерно из 51—52% спирта и 48—49% изобутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 110—1157745 мм. Его выход составляет 108—110,3 г (или 93—95% от теоретического по кислоте) с содержанием изобутилацетата не менее 99,0% и кислотностью не более 0,05%.
Первые фракции с учетом содержания спирта и эфира снова используются в синтезе или повторной разгонке, последнее менее желательно.
Примечания:
1. При расчете количество катионита лучше выражать не в процентах по отношению к спирту или кислоте, а в граммах на грамм-моль гидроксильных или карбоксильных групп. Эти данные для сравнения более реальны и не меняются в зависимости от колебания молекулярного веса кислоты или спирта. В данном случае необходимо 17 г катиоинита КУ-2 на 1 грамм-моль гндроксильных (17 г) или карбоксильных (45 г) групп. Если синтез вести с избытком 0,25 М спирта, то достаточно уже 10 г катионита и реакция заканчивается примерно в два раза быстрее. Следует также отметить, что первые два-три синтеза протекают несколько дольше.
2. Необходимо заметить, что скорость образования эфиров из спиртов изостроения заметно медленнее, то есть продолжительность реакции зависит от прямой и обратной скорости диффузии внутри зерна ионообменной смолы реагирующих веществ и образовавшихся продуктов. Это наблюдалось также на примере образования н-амил- и изоамилацетата, н-бутил- и изобутил-, н-амил- и изоамилсалицилатов.
Способ 3. На ионообменных катализаторах
Существующий метод получения эфиров уксусной кислоты основан на действии уксусного ангидрида или уксусной кислоты на соответствующие спирты в присутствии серной кислоты. Возможность побочных процессов, трудность очистки от не вступившего в реакцию спирта являются недостатками метода гомогенного кислотного катализа.
В последнее время разработан метод получения некоторых эфиров уксусной кислоты этерификацией уксусной кислоты соответствующими спиртами в присутствии ионообменной смолы КУ-2.
Использование ионитов как катализаторов реакции этерификации позволяет применить эквивалентные количества реагирующих веществ, что значительно облегчает очистку готового продукта.
Схема синтеза
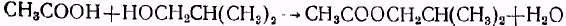
Характеристика основного сырья
Уксусная кислота, техн., ГОСТ 7077—54, изобутиловый спирт техн., ТУ МХП 1704—47, ионообменная смола КУ-2, ВТУ ГХПК М-661—55, используется без предварительной обработки.
Условия получения
В круглодонную колбу емкостью 1 л, снабженную мешалкой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°.
Выход чистого продукта составляет 470 г или 67,5% от теоретического; 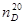 ~ 1,390;
~ 1,390; 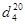 — 0,8710. По литературным данным,
— 0,8710. По литературным данным, 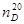 —1,39066;
—1,39066; 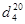 —0,8712.
—0,8712.
Сольволитические методы составляют самую большую группу методов синтеза сложных эфиров, поскольку все производные кислот так или иначе способны к взаимопревращениям. По уменьшению относительной реакционной способности эти производные располагаются в следующий ряд: хлорангидрид > ангидрид кислоты > > сложный эфир > амид, нитрил > соль. Можно ожидать, что сложные эфиры, находящиеся в середине этого ряда, легко будут образовываться из хлорангидридов или ангидридов кислот, существовать в равновесии с другими эфирами (в условиях кислотного катализа) и с несколько большим трудом образовываться из амидов и солей. Получение эфиров из солей облегчается, если при этом происходит выделение или осаждение нерастворимой неорганической соли. Короче говоря, сложные эфиры могут быть получены из кислот (реакция этерификации), а также из соединений пяти других приведенных выше типов. Кроме того, для синтеза сложных эфиров можно применять и другие исходные вещества, например кетены — соединения, родственные ангидридам, и 1,1,1-тригалоген-замещенные или а -дигалогензамещенные простые эфиры, имеющие ту же степень окисления, что и сложные эфиры. Единственным в своем роде методом получения является рассмотренный пример пиролиза медных солей, при котором происходит необычная ориентация.
RCOOH + R ' OH = RCOOR ' + Н2 О
Реакция этерификации — один из самых обычных методов, применяемых для синтеза сложных эфиров, поскольку часто и необходимая кислота, и спирт имеются в готовом виде. Наилучшие результаты этот метод дает в случае первичных спиртов, менее удовлетворительные — для вторичных и еще менее удовлетворительные — в случае третичных спиртов. Для быстрейшего достижения равновесия применяют такие катализаторы, как серная кислота, хлористый водород, арилсульфокислота или эфират трехфтористого бора, хотя некоторые эфиры бензилового спирта и муравьиной кислоты можно получить в отсутствие катализатора. Если спирт или кислота изменяются под действием кислот, следует предпочесть эфират трехфтористого бора. Для этерификации ароматических, кислот лучше брать 2 экв трехфтористого бора. Если при проведении реакции нежелательно присутствие кислоты в реакционной среде, в качестве катализатора можно использовать сильнокислые ионообменные смолы. Скорость образования эфира зависит orплощади поверхности ионообменной смолы, а в случае кислот высокого молекулярного веса площадь поверхности может быть еще больше ограничена плохой диффузией кислоты внутрь смолы. Ниже приведен пример этерификации при помощи кислой ионообменной смолы фурилового спирта, который при наличии кислоты в реакционной среде полимеризуется (пример а).
Недавно для получения метилового эфира пеларгоновой кислоты из этой кислоты, спирта и серной кислоты были использованы молекулярные сита Линде ЗА в виде таблеток; выход эфира составил 96%.
Для того чтобы максимально сместить равновесие в сторону образования сложного эфира, одно из исходных веществ (обычно спирт применяют в избытке или один из получающихся продуктов (воду) удаляют азеотропной перегонкой, а растворитель (бензол или толуол) возвращают в реакционную смесь при помощи ловушки Дина— Старка. Другими методами удаления воды могут служить следующие: азеотропная перегонка в аппарате Сокслета, в патрон которого помещают осушитель, например сульфат магния, или химический способ, заключающийся в реакции с диметилацеталем ацетона, приводящей к образованию ацетона и метилового спирта. Азеотропная перегонка при помощи аппарата Дина — Старка — лучший метод получения сложных эфиров, особенно эфиров высококипящих спиртов. Применение метилового спирта при этом представляет трудности вследствие его летучести. В этом случае используют специальную барботажную колонну для удаления; промежуточных фракций, содержащих воду. Однако в тех случаях, когда большие количества серной кислоты не оказывают влияния на карбоновую кислоту, из которой получают эфир, эту кислоту, метиловый спирт и серную кислоту просто можно кипятить с обратным холодильником, а образующийся метиловый эфир экстрагировать толуолом по методу Клостергарда, предназначенному для получения этиловых эфиров, таких, как триэтиловый эфир лимонной кислоты. Разработан простой полумикрометод, похожий на приведенный выше, при котором метиловые эфиры образуются и разделяются так же эффективно, как и при реакции кислоты с диазометаном. Наконец, удобным методом получения метиловых эфиров алифатических и ароматических кислот, дающим выходы 87—98%, является кипячение соответствующей кислоты (1 моль), метилового спирта (3 моля) и серной кислоты в этилен или метиленхлориде в течение 6—15 ч. Этот метод не требует сложного оборудования, как метод Вайсбергераи Киблера, и более удобен для получения эфиров в больших масштабах, чем метод Бейкера.
Схема реакции этерификации следующая:

Электрофильная атака протона кислоты приводит к образованию иона карбония (I), который подвергается нуклеофильной атаке спиртом, давая соединение II; при перегруппировке и выделении молекулы воды и протона из него получается сложный эфир (III). Несомненно, что аллиловый и бензиловый спирты, а также третичные спирты склонны реагировать по карбоний-ионному механизму. В связи с существованием такой тенденции третичные спирты превращаются в основном в олефины, а не в сложные эфиры, а для получения сложных эфиров третичных алкилов необходимо искать другие пути синтеза, как показано в следующих параграфах.
Существенную роль в реакции этерификации играют стерические эффекты, поскольку атом углерода карбонильной группы кислоты в переходном комплексе II переходит из плоской тригональной структуры в тетраэдрическую структуру ( sp 3- тибридизация). Для определения влияния стерических эффектов на скорость этерификации алифатических кислот полезно «правило шести» Ньюмена, но лучшим способом оценки стерических факторов является изучение моделей. При применении обычных методов этерификации влияние оказывают также заместители, находящиеся в орто-положении ароматических кислот. В случае о, о-ди-алкилзамещенных можно проводить этерификацию, приливая раствор кислоты в 100%-ной серной кислоте к спирту. Успех этой реакции, по-видимому, зависит от образования плоского иона кар бония (обычная протонированнаякарбоксильная группа в этом случае не может стать копланарной с кольцом), который реагирует со спиртом, давая сложный эфир. Выходы при применении этого метода бывают от удовлетворительных до хороших.
в этом случае не может стать копланарной с кольцом), который реагирует со спиртом, давая сложный эфир. Выходы при применении этого метода бывают от удовлетворительных до хороших.
Этиловые эфиры могут быть получены (с выходами 84—94%) при нагревании соответствующей кислоты с избытком ортомуравьиного эфира вплоть до образования однородного раствора. В двух случаях добавляют толуолсульфокислоту или диметилформамид. Пространственно затрудненные кислоты, например 2,4,6-тринитро-и 2,4,6-триметилбензойные кислоты, этерифицируются с умеренными выходами.
Недавно опубликован новый метод этерификации пространственно затрудненных кислот. В этом случае реакция между спиртом и кислотой катализируется ангидридом трифторуксусной кислоты. Отличные выходы обычно получают с пространственно затрудненными кислотами, такими, как антрацен-9-карбоновая и 2,4,6-три-метилбензойная, и простыми или пространственно затрудненными спиртами или фенолами. Если и фенол, и кислота пространственно затруднены и возможен другой путь протекания реакции, например ацилирование атома углерода фенола, этерификация может не пойти. Согласно предполагаемому механизму, реакция идет по двум направлениям, которые оба включают образование протонированного ангидрида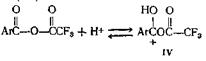
Этот последний может реагировать непосредственно со спиртом, образуя сложныйэфир (V)
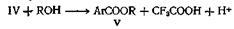
или в образовании эфира V может участвовать ион ацилия (VI)
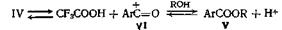
Аналогичным методом является реакция раствора кислоты в 20 частях пиридина с 2 экв бензол- или толуолсульфохлорида, приводящая к образованию ангидрида кислоты. К этому раствору на холоду добавляют 1 экв спирта (или фенола) и смесь разбавляют ледяной водой. Этот метод рекомендуется для получения трет- алкильных сложных эфиров и сложных эфиров третичных ацетиленовых спиртов. Для этерификации кислот в мягких условиях пригоден диэтилацеталь диметилформамида. Так, например, при реакции бензойной кислоты и 2 экв формамида в бензоле при 80 °С в течение 1 ч выход сложного эфира превышает 90%.

Сложные эфиры аминокислот можно с успехом получать при взаимодействии аминокислот со спиртом в присутствии хлористого тионила в качестве катализатора, а в некоторых случаях при взаимодействии с а -толуолсульфокислотой и большим избытком диметилсульфита

Стероидные спирты часто лучше ацетилируются уксусной кислотой и уксусным ангидридом в присутствии следов хлорной кислоты.
Ариловые сложные эфиры можно получать взаимодействием кислоты с фенолом в присутствии хлорокиси фосфора или полифесфорной.
Если в молекуле имеется как первичная, так и вторичная спиртовая группа, как, например, в антибиотике хлорамфениколе (синтомицин), частичная этерификация обычно приводит к образованию первичных моноэфиров. Эфир со вторичной спиртовой группой получают, проводя реакцию по остроумной схеме, приведенной ниже:

Диэфиры из кетонов или альдегидов и кислот можно получать, вероятно, через ангидрид кислоты (пример г) и из эфира.

Этот метод синтеза находит широкое применение, поскольку эта реакция необратима в отличие от реакции этерификации. Выделяющийся при реакции хлористый водород можно уводить из сферы реакции или поглощать его каким-нибудь основанием, например едким натром, диметиланилином или пиридином, или магнием. Иногда желательно применение алкоголята натрия. Диметиланилин и магний применяют для. получения эфиров третичных спиртов, имеющих тенденцию в отсутствие вещества, способного поглощать выделяющийся хлористый водород, образовывать галогенпроизводные. При этерификации фенолов часто применяют магний; эта реакция исследована количественно. Наиболее высокие выходы фениловых эфиров получают из таллиевых солей фенолов и хлорангидрида соответствующей кислоты.
Простейший метод — метод Шоттена — Баумана, состоящий во встряхивании хлорангидрида кислоты с водным раствором едкого натра, содержащим соответствующий спирт. Самые высокие выходы получаются тогда, когда хлорангидрид кислоты (и образующийся эфир) нерастворимы в воде, так что реакция протекает на границе раздела между органическим и водным слоем. Нерастворимость образующегося сложного эфира в водной фазе препятствует его омылению. По окончании реакции эфир получается свободным от хлорангидрида кислоты и хлористого водорода и его можно сразу экстрагировать и сушить. В довольно старом и незаслуженно забытом
Исследовании реакции Шоттена — Баумана было установлено, что (выходы сложных эфиров возрастают при понижении температуры Макции, при увеличении концентрации спирта (что можно осуществлять, добавляя щелочь постепенно) и при применении едкого кали, а не едкого натра. Кроме того, ангидрид уксусной кислоты дает более высокий выход эфира, чем хлорангидрид. Наиболее общим методом служит метод, в котором используют пиридин; если бы не неудобства, связанные с необходимостью избавляться от следов пиридина, который обычно отмывают разбавленной кислотой, вероятно, применяли бы только этот метод.
Эффективность реакции галогенангидридов кислот со спиртами может быть повышена проведением предварительной реакции галогенангидрида с кислотой Льюиса с целью получения соли ацилия. Простейшей такой солью является, по-видимому, метилоксокарбонийгексафторантимонат, который сам по себе или в нитрометане быстро реагирует со спиртами, образуя ацетаты с выходами от 62 до 87%.
Эта реакция, вероятно, происходит в результате нуклеофильной атаки спирта на атом углерода карбонила хлорангидрида кислоты.

Образующийся при этом комплекс быстро теряет хлористый водород, давая сложный эфир R'COOR.
В случае образования реакционноспособных и нестабильных бензилтозилатов желательно сначала получить соответствующий алкоголят с гидридом натрия, а затем обрабатывать его хлор ангидридом кислоты. Аналогичный метод, но без выделения алкоголята натрия, применялся для получения тозилата 2-нитро-3,4,5-триметок-сибензилового спирта, в котором гидроксил спирта прочно связан с нитрогруппой.]

Многие функциональные группы при этом методе синтеза не затрагиваются. В хлорангидридах кислот, содержащих двойные связи, ацетокси-, алкиламино- и 2-фуранакрилогруппы, эти группы не изменяются. Оксиэфиры можно получать из двухатомных спиртов и хлорангидридов кислот; аналогичным образом хлорзамещенные сложные эфиры можно получать из галогендоинов. При этом часто получают высокие выходы
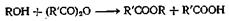
Или
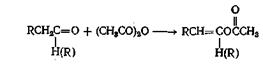
Как и хлорангидриды кислот, ангидриды кислот широко применяют для получения сложных эфиров из соединений, содержащих оксигруппу. Эту реакцию проводят как в отсутствие катализаторов, так и с применением таких катализаторов, как серная кислота, хлористый цинк, хлорсульфокислота, хлористый ацетил, ацетат натрия. борная кислота, сульфат железа(Ш), метилат натрия и моногидрат я-толуолсульфокислоты. Ацетилирование многих фенолов можно осуществить в водном растворе щелочи, а циклические ангидриды можно полностью или частично этерифицировать. Механизм этой реакции такой же, как и при реакции с хлорангидридом кислоты, только при этом происходит отрыв аниона карбоксилата, а не галоген-аниона. Поскольку анион карбоксилата в растворе менее термодинамически стабилен, чём анион галогена, можно ожидать, что реакция ангидрида кислоты со спиртом будет несколько менее экзотермической, чем реакция соответствующего хлорангидрида. Вопреки тому, что написано в некоторых учебниках, третичные спирты можно этерифицировать ангидридами кислот при применении кислых катализаторов или трифенилметилнатрия.
Способные енолизоваться альдегиды можно превратить в енол-ацетаты нагреванием с уксусным ангидридом и ацетатом калия. Для трех ангидридов, для которых была проведена эта реакция, выходы составляли от 35 до 61%. Способные к енолизации кетоны реагируют не с такой легкостью, но, применяя уксусный ангидрид и л-толуолсульфокислоту, можно добиться успеха. Выходы для трех изученных кетонов составляли от 32 до 68%. Интересно отметить, что в условиях, применявшихся при реакции с кетонами, в реакцию вовлекались только метиленовые водородные атомы. При получении а -бром альдегидов и кетонов в качестве промежуточных соединений используют енолацетаты, как показано ниже:

Смешанные ангидриды, получающиеся из алкиловых эфиров хлормуравьиной кислоты, разлагаются при нагревании, образуя сложные эфиры по следующим схемам:

Ряд смешанных ангидридов из алифатических кислот разлагается с образованием сложных эфиров по пути А, а смешанные ангидриды ароматических кислот разлагаются по пути либо А, либо Б. При 250 °С происходит также реакция В. Трифторуксусная кислота и фениловый эфир хлормуравьиной кислоты при смешивании образуют фениловый эфир трифторуксусной кислоты с выходом 75—80%. Рассмотренные реакции декарбоксилирования, по-видимому, протекают через промежуточное циклическое состояние, причем происходит сдвиг электронов в цикле.
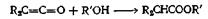
Несмотря на то что эти реакции часто дают высокие выходы, этот метод синтеза не находит широкого распространения вследствие того, что химик обычно не имеет готового кетена, а его получение иногдабывает довольно сложным. Реакцию промотируют такие катализаторы, как серная кислота или толуолсульфокислота. Этот метод с успехом применяют при ацетилировании сложных эфиров молочной кислоты, а также при ацетилировании третичных спиртов и фенолов. Некоторые функциональные группы, например функциональные группы альдегидов и кетонов, подвержены атаке кетенами. В некоторых случаях эти карбонильные соединения превращаются в енолацетаты
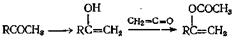
Присоединение спирта к кетену, вероятно, идет как присоединение к карбонильным группам. Сначалаобразуется енол
таутомеризующийся затем собразованием сложного эфира 
Поскольку кетены образуются в качестве промежуточных соединений при облучении большинства кетонов, кетоны представляют собой потенциальные источники получения сложных эфиров, если проводить их облучение в присутствии спиртов
Спирты присоединяются к дикетенам с образованием ацетоацетатов следующим образом: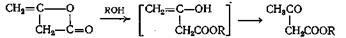
Этот метод выгодно применять для получения ацетоацетатов с ненасыщенными группами R. Оказалось, что в этих случаях лучше всего в качестве катализатора использовать алкоголят натрия. Такие сложные эфиры можно также получать из хлорангидридов кислот через дикетен в одну стадию.
Ацетали кетенов также могут самопроизвольно превращаться в сложные эфиры с количественным выходом
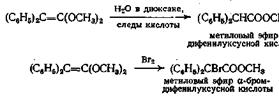
Получение карбаматов из изоцианатов и спиртов напоминает образование сложных эфиров из кетенов
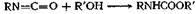
Эта реакция происходит самопроизвольно в отсутствие катализатора и дает высокие выходы карбаматов. Третичные спирты, однако, склонны к образованию олефинов. При получении фенилкарбаматов из изоцианатов и фенолов в качестве катализатора используют несколько капель триэтиламина или пиридина. Получение сложного эфира изоцианата представляет собой способ идентификации спиртов.
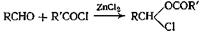
или
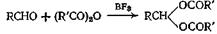
Эти реакции присоединения применяют в ограниченных масштабах для синтеза а -галогензамещенных сложных эфиров или ацилалей. Сложные эфиры получают, смешивая компоненты либо сами по себе, либо в присутствии следов хлористого цинка, причем выходы составляют примерно 50%. Ацилали лучше всего получать действием уксусного ангидрида, если реакцию вести с добавлением небольших количеств эфирата трехфтористого бора, но с ангидридами пропионовой и и-масляной кислот наилучшие результаты достигаются при добавлении 10%-ного избытка катализатора сверх эквивалентного количества. При проведении реакции как с малым количеством катализатора, так и с избытком уксусный ангидрид и формальдегид образуют смеси, а с янтарным и пропионовым альдегидами реакция не идет. Выходы при этих реакциях присоединения составляют 60—80%. При реакциях присоединения ангидрида можно использовать кислоты, например серную кислоту, но выходы при этом обычно получаются более низкими, кроме тех случаев, когда добавляют ацетат натрия.
Выше уже приводились примеры получения изопропилиденмалоната и а -ацетокси-М-циклогексилизовалерамида.
3 .6 Из нитрилов

Хотя от нитрилов можно перейти к сложным эфирам через амиды, обычный метод состоит в превращении их в иминоэфир, который можно выделять в качестве промежуточного соединения, а можно и не выделять. Для этой реакции применяют различные катализаторы, такие, как хлористый водород, бромистый и йодистый водород, серную кислоту и моногидраты бензол- и толуолсульфокислот. Следует отдать предпочтение аренсульфокислотам по сравнению с хлористым водородом или серной кислотой. С хлористым водородом получаются, более высокие выходы, чем с бромистым и йодистым водородом. Как показывает приведенное уравнение реакции, если исключить из участия в реакции воду, можно получить иминоэфиры. В некоторых случаях для реакции, ведущей к образованию иминоэфира, вода не нужна совсем, а иногда в отсутствие воды реакция не идет.
Этот метод синтеза находит широкое применение для получения полифункциональных соединений. Так, например, малоновые эфиры обычно синтезируют из эфиров а -цианкарбоновых кислот. Из циангидринов получают оксиэфиры, из кетоцианидов — кетоэфиры, а из аминоцианидов—аминоэфиры. Выходы при этом обычно бывают удовлетворительные.
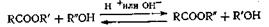
Переэтерификация представляет собой равновесную реакцию, которую можно сдвинуть в прямом направлении, применяя избыток одного из реагентов или, что предпочтительно, удаляя один из компонентов — RCOOR" или R'OH. Если температура кипения R'OH ниже, чем R«OH, можно проводить разделение, при помощи фракционирования: иногда для удаления получающихся продуктов пользуются образованием азеотропных смесей. Катализаторами такой реакции обмена служат кислоты, например серная или толуолсульфокислота, или основания, например алкоголяты алюминия. Как правило, превращение лучше протекает с первичными спиртами, причем наиболее реакционноспособен метиловый спирт, хотя в некоторых случаях с успехом можно применять вторичные спирты.
Этот метод синтеза пригоден для синтеза алкиловых эфиров высших жирных кислот из жиров, масел и восков. Путем такого обмена удобно получать и многие другие сложные эфиры, например эфиры акриловой и диэтиламино-а -фенилмасляной кислот. Наиболее важным эфиром енола, применяемым для получения сложных эфиров, является изопропенилацетат. Этот реагент легко доступен, и из него можно получать различные сложные эфиры с высоким выходом в результате обмена со спиртом в присутствии кислых катализаторов

Эта реакция может протекать с образованием кетена, из которого получают изопропенилацетат, но возможно также, что при реакии, катализируемой кислотой, образуется ион ацилия, атакующий спирт. Приведен пример образования сложного эфира, а также эфира енола.
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами. Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Бутиловый спирт, однако, обменивается очень медленно
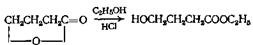
Этот метод синтеза находит лишь ограниченное применение при получении сложных эфиров. Бромистый водород в спиртовом растворе дает бромзамещенный сложный эфир, а хлористый водород приводит к образованию оксиэфира. Вместо галогеноводорода применяют и другие галогенпроизводные, например пятибромистый фосфор и тионилхлорид. Наиболее детально изучена, по-видимому, реакция пропиолактона. В этом случае при взаимодействии со спиртом в зависимости от природы катализатора образуются два продукта. С основаниями происходит расщепление по связи кислород—углерод карбонила, приводящее к образованию оксиэфиров
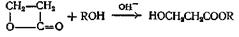
В отсутствие катализатора или с кислыми катализаторами происходит расщепление связи кислород — углерод метиленовой группы с образованием р-алкоксикислот
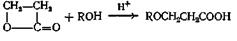
Механизм этого расщепления сходен с механизмом, предложенным для сложных эфиров, поскольку лактоны можно рассматривать как внутримолекулярные сложные эфиры. Выходы при этой реакции получаются удовлетворительные.

Этот обмен происходит, и часто с хорошими выходами, в случае ациламинокислот и при получении виниловых эфиров различных алифатических и ароматических карбоновых кислот. N-Ациламинокислоты, например фталоилглицин или тозилглицин, превращаются в метиловые или этиловые эфиры под действием алкилформиата или алкилацетата. Обычно в качестве катализаторов используют 96% -ную серную кислоту или моногидрат толуолсульфокислоты. Неацилированные аминокислоты, за исключением фенилаланина нельзя превратить в сложные эфиры при помощи такого катализатора, как серная кислота.
«Винильный обмен» требует применения в качестве катализатора ртутной соли сильной кислоты. Температура при этой реакции должна поддерживаться в области 20—80 °С; более высокие температуры приводят к образованию диэфиров этилидена и ангидридов кислот. Этот метод синтеза позволяет получать более чистые мономеры, чем те, которые образуются в результате присоединения ацетилена к кислоте. Считают, что в этом случае соль ртути образует ацетиленовый комплекс (I)
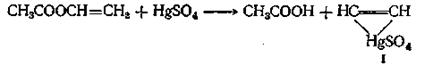
реагирующий с кислотой с образованием сложного эфира (II)

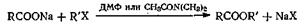
Эта реакция обмена дает высокие выходы с галогенпроизводными, способными к реакции замещения по механизму SN2 в апротонных растворителях. Хорошие выходы метиловых эфиров высокой степени чистоты получаются с йодистым метилом, бикарбонатом натрия и соответствующей кислотой при проведении реакции в диметилацетамиде при комнатной температуре. При реакции с другими алкилгалогенидами синтезирован ряд сложных эфиров. Можно использовать для этой реакции соль натрия или серебра с триэтиламином в качестве катализатораили саму свободную кислоту с триэтиламином. Фенациловые эфиры, получаемые этим методом, используют для характеристики карбоновых кислот.
При получении тритиловых эфиров следует предпочесть бромистый триэтил хлористому, поскольку он более реакционноспособен и менее гигроскопичен и его можно применять с безводной серебряной, натриевой или калиевой солью.
При реакции соли, уксуснокислого тетраэтиламмония, с оптически активным галогенпроизводным образуется сложный эфир с меньшей степенью рацемизации, чем при применении уксусной кислоты
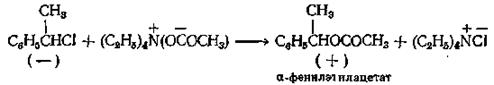
Реакция медной соли кислоты с каким-либо арилгалогенидом в высококипящем растворителе — единственно пригодный способ получения ариловых эфиров из арилгалогенидов. В качестве промежуточного соединения образуется медьорганическое соединение
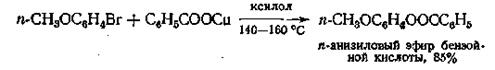
Эту реакцию можно применять также в случае винилгалогенидов с целью получения виниловых эфиров.
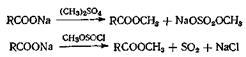
При этом методе синтеза обычно в качестве алкилирующегс агента применяют диметилсульфат; кроме того, используются алкилпирокарбонаты, алкилсиликаты, алкилфосфонаты, ацетали и даже алкилхлорсульфиты. В последнем случае эфир получается в результате пиролиза реакционной смеси с выделением двуокиси серы. Алкилирование, как правило, проводят в щелочной среде; в этих условиях алкилируется как пространственно затрудненная, так и незатрудненная карбоксильная группа. При проведении реакции в кислых условиях алкилируется только пространственно незатрудненная карбоксильная группа. Выходы часто получаются высокие.
В методе, предложенном недавно, свободную кислоту алкили-руют при помощи какого-нибудь алкилсульфата и дициклогексил-этиламина в качестве акцептора протонов

Выходы некоторых эфиров составляют 96—97% (метиловые эфиры) и 84% (этиловые эфиры).
Эта реакция дает возможность осуществить весьма необычный синтез эфиров арилбензойных кислот. При пиролизе медной соли ароматической кислоты образуется с хорошим выходом сложный эфир. Необычным является то, что арильная группа становится в орто-положение по отношению к присутствующей вначале карбоксильной группе, выделяющейся в процессе реакции, как показано ниже:

Механизм этой реакции, возможно, представляет собой циклозамещение, но он еще не установлен окончательно. Окись меди частично может быть заменена воздухом.
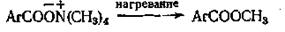
Этот метод синтеза первоначально применялся для получения сложных эфиров пространственно затрудненных бензойных кислот. Метиловые эфиры 2,4,6-триметил- и 2,4,6-триэтилбензойной кислот получены с выходом от 63 до 90%. Сложный эфир также образуется при непосредственном нагревании четвертичного галогенида аммония с ацетатом натрия и уксусной кислотой.
3.14. Из амидов
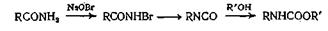
Превращение амидов в сложные эфиры — термодинамически невыгодная реакция и поэтому требует специальных условий. И действительно, реакция легко осуществляется лишь в необычных условиях. В качестве одного из примеров приведем гладкое превращение о- или п-нитроацетанилидов в сложные эфиры при взаимодействии со спиртами в присутствии алкоголята натрия. При этом очевидно, происходит алкоголиз через анион нитроацетанилида.
Амиды можно превратить в изоцианаты реакцией Гофмана с гипобромитом, а изоцианаты затем превратить в карбаматы действием спирта. Поскольку мочевина при нагревании превращается в изоциановую кислоту HN=C=O, она может реагировать со спиртами, образуя в качестве производных сначала изоциановую кислоту, а затем алкилкарбаматы (уретаны). Так, например, бензилкарбамат легко получается при кипячении мочевины и бензилового спирта до прекращения выделения аммиака

Любое соединение, приводящее к образованию изоцианата, является потенциальным источником карбамата, если проводить реакцию каком-нибудь спирте в качестве растворителя. Так, например,: облучении азида кислоты в этиловом спирте образуется уретан
-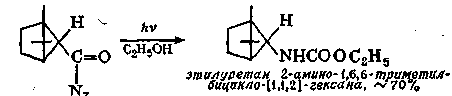 о
о
Из изоциановой кислоты, которая, вероятно, в кислых растворax сначала димеризуется, можно получить эфиры аллофановой кислоты
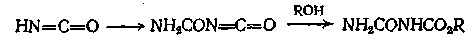
Многие эфиры аллофановой кислоты и целлосольва представляют собой кристаллические соединения и удобны для получения про водных.
Наиболее удобным, хотя и имеющим ограниченное применен методом превращения амида в сложный эфир является перегруппировка р-оксиэтиламида под влиянием концентрированной соляной кислоты
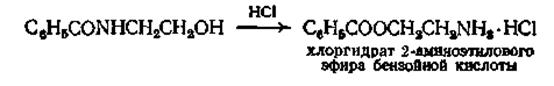
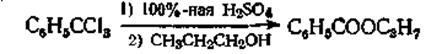
Эта реакция проводилась с различными замещенными бензотрифторидами и бензотрихлоридами, причем выходы составляли от 42 до 90%. Для более лабильных тригалогензамещенных, таких, как 3,3,3-трихлор-1,1-ди-(п-хлорфенил)пропен-1, при кипячении его с метиловым спиртом выход сложного эфира составляет 95%.
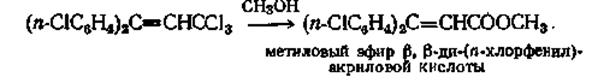
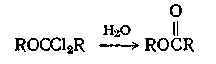
Сложные эфиры можно получить из а ,а -дихлоралкилзамещенных простых эфиров при гидролизе их водой. Для гидролиза а, а -дифторалкилзамещенных простых эфиров необходимо применять более сильные гидролизующие агенты, такие, как 95%-ную серную кислоту. Выходы при этих реакциях гидролиза составляют от 55 до 83%. Механизм этого расщепления точно не установлен, но можно предполагать, что этот гидролиз протекает с большей легкостью, чем гидролиз тригалогензамещенных, в результате влияния простой эфирной группы.
3.17. Из карбоновых кислот и дивинилртути
Этот метод синтеза применим только для получения сложных виниловых эфиров, простых виниловых эфиров (из фенола) и винилсульфидов (из тиофенола или алкилтиола). Для проведения реакции ароматическую или алифатическую карбоновую кислоту нагревают саму по себе или в каком-нибудь растворителе с дивинилртутью, полученной из хлорида ртути и винилмагнийбромида в тетрагидрофуране. В отсутствие растворителя реакция обычно проходит более чем на 50% за время меньше 5 мин при нагревании на паровой бане. Для безопасности реакцию необходимо проводить в хорошо вентилируемой тяге, поскольку дивинилртуть высоко токсична. Если проводить реакцию в инертном растворителе, можно выделить образующийся в качестве промежуточного соединения винилртутный эфир RCOOHgCH=Ch3 — Выходы виниловых сложных эфиров составляют от 38 до 74%.
3.18. Механизм реакции этерификации
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):

Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):

Катион (X) в результате отщепления протона образует молекулу сложного эфира:

Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорания (CO2 и Н2 О) на присутствие тяжелого изотопа кислорода.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:

Он является процессом необратимым, поскольку богатый электронами анион кислоты не способен взаимодействовать с нуклеофильной молекулой спирта.
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2, Са(ОН)2 Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
В качестве растворителя основания для реакции гидролиза чаще всего применяют воду, которая, однако, не растворяет сложный эфир. Реакция идет на поверхности раздела двух фаз и требует, поэтому хорошего перемешивания. Иногда реакцию бывает целесообразно проводить в гомогенной среде, используя в качестве растворителя водный спирт. При этом, однако, нужно иметь в виду, что для выделения кислоты перед подкислением раствора спирт необходимо удалить (отогнать).
1. Терней А. Современная органическая химия: В 2 т. — М.: Мир, 1981. — Т.1 — 670 с; Т.2 — 615 с.
2. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, — 708 с.
3. Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
4. Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
5. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
6. Дорофеенко Г.Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
7. Голодников Г.В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
8. Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
9. Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
10. Шабаров Ю.С. Органическая химия: В 2-х кн. — М.: Химия, 1994.- 848 с.
11. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. — 623 с.
12. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
13. Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.
www.ronl.ru
Синтез изобутилового эфира уксусной кислоты реакцией этерификации


























































 Федеральное агентство по образованию
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
“СИНТЕЗ ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ”
Курсовая работа
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
1. Введение
1.1. Общие сведения
1.2. Практическое применение
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Способ 2. Получение на катионитовых катализаторах
Способ 3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1. Из карбоновых кислот (реакция этерификации)
3.2. Из хлорангидридов кислот
3.3. Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5. Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6. Из нитрилов
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)
3.8. Из лактонов и спиртов (реакция переэтерификации)
3.9. Из сложных эфиров и кислот (реакция переэтерификации)
3.10. Из солей при взаимодействии с алкилгалогенидами
3.11. Из солей и кислот и других алкилирующих агентов
3.12. Из медных солей
3.13. Из тетраалкиламмоиевых солей
3.14. Из амидов
3.15. Из тригалогензамещенных
3.16. Из дигалогензамещенных простых эфиров
3.17. Из карбоновых кислот и дивинилртути
3.18. Механизм реакции этерификации
4.Выводы
Список литературы
1. Введение
Общие сведения
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
Практическое применение
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии h3SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
Способ 1. Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Способ 2. Получение на катионитовых катализаторах
н-Бутил- и изобутилацетат очень широко используются в качестве растворителей и в ряде синтезов. Как известно, синтез сложных эфиров проводится в присутствии минеральных кислот в качестве катализаторов, используемых только однократно, что приводит к большому расходу воды при промывании.
При применении катионитов этот недостаток исключается; кроме того, в меньшей степени идут побочные процессы, в частности, образование непредельных соединений.
Схема синтеза
Характеристика основного сырья
Бутиловый спирт, ч., ГОСТ 6006—51 или 5980—51. Изобутиловый спирт, ч., ГОСТ 6016—51. Уксусная кислота, ч, ГОСТ 61—51. Катионит КУ-2, ГОСТ 5696—51.
Условия получения
Синтез веществ проводят в трехгорлой колбе с механической мешалкой, термометром и обратным холодильником с водоотделительной насадкой. Нагревание производят на глицериновой или масляной бане, температуру которой поддерживают контактным термометром.
В колбу загружают 17 г катионита в Н-форме (см. примечание 1), 74,86 г (1,01 М) н- или изобутилового спирта, 60,06 г (1 М) уксусной кислоты и нагревают. По достижении 98° начищает выделяться вода (воду, собравшуюся во флорентине, сливают с таким расчетом, чтобы к концу синтеза она оставалась заполненной водой почти полностью). Перед завершением реакции температура повышается для н-бутилацетата ~ до 115°, для изобутилацетата —110°. Реакцию ведут до выделения примерно 98—99% воды (17,7—17,8 мл) так как кроме реакции этерификации три накоплении эфира, идет дегидратация сложного эфира с образованием непредельных соединений и кислоты. Синтез веществ с н-бутиловым спиртом заканчивается за 45—50 минут, а с изобутиловым спиртом за 60—62 минуты (см. примечание 2). Затем реакционную смесь охлаждают, отделяют катализат от катионита декантацией, пропускают через колонку с анионитом АВ—17 или АВ—16 в ОН-форме, либо нейтрализуют 18—20%-ным раствором соды до слабощелочной реакции и промывкой водой до нейтральной реакции. Далее катализат подвергают разгонке на ректификационной колонке с эффективностью 10 теоретических тарелок.
Первую фракцию н-бутилацетата собирают до 122° с выходом 8,9—9 г, она состоит примерно из 51—52% спирта и 48—49% бутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 122 —127°/745 мм. Его выход составляет 106,8—106,9 г (или 92% от теоретического по кислоте) с содержанием бутилацетата не менее 99% и кислотностью не более 0,05%.
Первую фракцию изобутилацетата собирают до 110° с выходом 6,5—8 г, она состоит также примерно из 51—52% спирта и 48—49% изобутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 110—1157745 мм. Его выход составляет 108—110,3 г (или 93—95% от теоретического по кислоте) с содержанием изобутилацетата не менее 99,0% и кислотностью не более 0,05%.
Первые фракции с учетом содержания спирта и эфира снова используются в синтезе или повторной разгонке, последнее менее желательно.
Примечания:
1. При расчете количество катионита лучше выражать не в процентах по отношению к спирту или кислоте, а в граммах на грамм-моль гидроксильных или карбоксильных групп. Эти данные для сравнения более реальны и не меняются в зависимости от колебания молекулярного веса кислоты или спирта. В данном случае необходимо 17 г катиоинита КУ-2 на 1 грамм-моль гндроксильных (17 г) или карбоксильных (45 г) групп. Если синтез вести с избытком 0,25 М спирта, то достаточно уже 10 г катионита и реакция заканчивается примерно в два раза быстрее. Следует также отметить, что первые два-три синтеза протекают несколько дольше.
2. Необходимо заметить, что скорость образования эфиров из спиртов изостроения заметно медленнее, то есть продолжительность реакции зависит от прямой и обратной скорости диффузии внутри зерна ионообменной смолы реагирующих веществ и образовавшихся продуктов. Это наблюдалось также на примере образования н-амил- и изоамилацетата, н-бутил- и изобутил-, н-амил- и изоамилсалицилатов.
Способ 3. На ионообменных катализаторах
Существующий метод получения эфиров уксусной кислоты основан на действии уксусного ангидрида или уксусной кислоты на соответствующие спирты в присутствии серной кислоты. Возможность побочных процессов, трудность очистки от не вступившего в реакцию спирта являются недостатками метода гомогенного кислотного катализа.
В последнее время разработан метод получения некоторых эфиров уксусной кислоты этерификацией уксусной кислоты соответствующими спиртами в присутствии ионообменной смолы КУ-2.
Использование ионитов как катализаторов реакции этерификации позволяет применить эквивалентные количества реагирующих веществ, что значительно облегчает очистку готового продукта.
Схема синтеза
Характеристика основного сырья
Уксусная кислота, техн., ГОСТ 7077—54, изобутиловый спирт техн., ТУ МХП 1704—47, ионообменная смола КУ-2, ВТУ ГХПК М-661—55, используется без предварительной обработки.
Условия получения
В круглодонную колбу емкостью 1 л, снабженную мешалкой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°.
Выход чистого продукта составляет 470 г или 67,5% от теоретического; ~ 1,390; - 0,8710. По литературным данным, —1,39066; —0,8712.
Сольволитические методы составляют самую большую группу методов синтеза сложных эфиров, поскольку все производные кислот так или иначе способны к взаимопревращениям. По уменьшению относительной реакционной способности эти производные располагаются в следующий ряд: хлорангидрид > ангидрид кислоты > > сложный эфир > амид, нитрил > соль. Можно ожидать, что сложные эфиры, находящиеся в середине этого ряда, легко будут образовываться из хлорангидридов или ангидридов кислот, существовать в равновесии с другими эфирами (в условиях кислотного катализа) и с несколько большим трудом образовываться из амидов и солей. Получение эфиров из солей облегчается, если при этом происходит выделение или осаждение нерастворимой неорганической соли. Короче говоря, сложные эфиры могут быть получены из кислот (реакция этерификации), а также из соединений пяти других приведенных выше типов. Кроме того, для синтеза сложных эфиров можно применять и другие исходные вещества, например кетены — соединения, родственные ангидридам, и 1,1,1-тригалоген-замещенные или а-дигалогензамещенные простые эфиры, имеющие ту же степень окисления, что и сложные эфиры. Единственным в своем роде методом получения является рассмотренный пример пиролиза медных солей, при котором происходит необычная ориентация.
Из карбоновых кислот (реакция этерификации)
RCOOH + R'OH = RCOOR' + Н2О
Реакция этерификации — один из самых обычных методов, применяемых для синтеза сложных эфиров, поскольку часто и необходимая кислота, и спирт имеются в готовом виде. Наилучшие результаты этот метод дает в случае первичных спиртов, менее удовлетворительные — для вторичных и еще менее удовлетворительные — в случае третичных спиртов. Для быстрейшего достижения равновесия применяют такие катализаторы, как серная кислота, хлористый водород, арилсульфокислота или эфират трехфтористого бора, хотя некоторые эфиры бензилового спирта и муравьиной кислоты можно получить в отсутствие катализатора. Если спирт или кислота изменяются под действием кислот, следует предпочесть эфират трехфтористого бора. Для этерификации ароматических, кислот лучше брать 2 экв трехфтористого бора. Если при проведении реакции нежелательно присутствие кислоты в реакционной среде, в качестве катализатора можно использовать сильнокислые ионообменные смолы. Скорость образования эфира зависит or площади поверхности ионообменной смолы, а в случае кислот высокого молекулярного веса площадь поверхности может быть еще больше ограничена плохой диффузией кислоты внутрь смолы. Ниже приведен пример этерификации при помощи кислой ионообменной смолы фурилового спирта, который при наличии кислоты в реакционной среде полимеризуется (пример а).
Недавно для получения метилового эфира пеларгоновой кислоты из этой кислоты, спирта и серной кислоты были использованы молекулярные сита Линде ЗА в виде таблеток; выход эфира составил 96%.
Для того чтобы максимально сместить равновесие в сторону образования сложного эфира, одно из исходных веществ (обычно спирт применяют в избытке или один из получающихся продуктов (воду) удаляют азеотропной перегонкой, а растворитель (бензол или толуол) возвращают в реакционную смесь при помощи ловушки Дина— Старка. Другими методами удаления воды могут служить следующие: азеотропная перегонка в аппарате Сокслета, в патрон которого помещают осушитель, например сульфат магния, или химический способ, заключающийся в реакции с диметилацеталем ацетона, приводящей к образованию ацетона и метилового спирта. Азеотропная перегонка при помощи аппарата Дина — Старка — лучший метод получения сложных эфиров, особенно эфиров высококипящих спиртов. Применение метилового спирта при этом представляет трудности вследствие его летучести. В этом случае используют специальную барботажную колонну для удаления; промежуточных фракций, содержащих воду. Однако в тех случаях, когда большие количества серной кислоты не оказывают влияния на карбоновую кислоту, из которой получают эфир, эту кислоту, метиловый спирт и серную кислоту просто можно кипятить с обратным холодильником, а образующийся метиловый эфир экстрагировать толуолом по методу Клостергарда, предназначенному для получения этиловых эфиров, таких, как триэтиловый эфир лимонной кислоты. Разработан простой полумикрометод, похожий на приведенный выше, при котором метиловые эфиры образуются и разделяются так же эффективно, как и при реакции кислоты с диазометаном. Наконец, удобным методом получения метиловых эфиров алифатических и ароматических кислот, дающим выходы 87—98%, является кипячение соответствующей кислоты (1 моль), метилового спирта (3 моля) и серной кислоты в этилен или метиленхлориде в течение 6—15 ч. Этот метод не требует сложного оборудования, как метод Вайсбергераи Киблера, и более удобен для получения эфиров в больших масштабах, чем метод Бейкера.
Схема реакции этерификации следующая:
Электрофильная атака протона кислоты приводит к образованию иона карбония (I), который подвергается нуклеофильной атаке спиртом, давая соединение II; при перегруппировке и выделении молекулы воды и протона из него получается сложный эфир (III). Несомненно, что аллиловый и бензиловый спирты, а также третичные спирты склонны реагировать по карбоний-ионному механизму. В связи с существованием такой тенденции третичные спирты превращаются в основном в олефины, а не в сложные эфиры, а для получения сложных эфиров третичных алкилов необходимо искать другие пути синтеза, как показано в следующих параграфах.
Существенную роль в реакции этерификации играют стерические эффекты, поскольку атом углерода карбонильной группы кислоты в переходном комплексе II переходит из плоской тригональной структуры в тетраэдрическую структуру (sp3-тибридизация). Для определения влияния стерических эффектов на скорость этерификации алифатических кислот полезно «правило шести» Ньюмена, но лучшим способом оценки стерических факторов является изучение моделей. При применении обычных методов этерификации влияние оказывают также заместители, находящиеся в орто-положении ароматических кислот. В случае о,о-ди-алкилзамещенных можно проводить этерификацию, приливая раствор кислоты в 100%-ной серной кислоте к спирту. Успех этой реакции, по-видимому, зависит от образования плоского иона кар бония (обычная протонированнаякарбоксильная группав этом случае не может стать копланарной с кольцом), который реагирует со спиртом, давая сложный эфир. Выходы при применении этого метода бывают от удовлетворительных до хороших.
Этиловые эфиры могут быть получены (с выходами 84—94%) при нагревании соответствующей кислоты с избытком ортомуравьиного эфира вплоть до образования однородного раствора. В двух случаях добавляют толуолсульфокислоту или диметилформамид. Пространственно затрудненные кислоты, например 2,4,6-тринитро-и 2,4,6-триметилбензойные кислоты, этерифицируются с умеренными выходами.
Недавно опубликован новый метод этерификации пространственно затрудненных кислот. В этом случае реакция между спиртом и кислотой катализируется ангидридом трифторуксусной кислоты. Отличные выходы обычно получают с пространственно затрудненными кислотами, такими, как антрацен-9-карбоновая и 2,4,6-три-метилбензойная, и простыми или пространственно затрудненными спиртами или фенолами. Если и фенол, и кислота пространственно затруднены и возможен другой путь протекания реакции, например ацилирование атома углерода фенола, этерификация может не пойти. Согласно предполагаемому механизму, реакция идет по двум направлениям, которые оба включают образование протонированного ангидрида
Этот последний может реагировать непосредственно со спиртом, образуя сложныйэфир (V)
или в образовании эфира V может участвовать ион ацилия (VI)
Аналогичным методом является реакция раствора кислоты в 20 частях пиридина с 2 экв бензол- или толуолсульфохлорида, приводящая к образованию ангидрида кислоты. К этому раствору на холоду добавляют 1 экв спирта (или фенола) и смесь разбавляют ледяной водой. Этот метод рекомендуется для получения трет-алкильных сложных эфиров и сложных эфиров третичных ацетиленовых спиртов. Для этерификации кислот в мягких условиях пригоден диэтилацеталь диметилформамида. Так, например, при реакции бензойной кислоты и 2 экв формамида в бензоле при 80 °С в течение 1 ч выход сложного эфира превышает 90%.
Сложные эфиры аминокислот можно с успехом получать при взаимодействии аминокислот со спиртом в присутствии хлористого тионила в качестве катализатора, а в некоторых случаях при взаимодействии с а-толуолсульфокислотой и большим избытком диметилсульфита
Стероидные спирты часто лучше ацетилируются уксусной кислотой и уксусным ангидридом в присутствии следов хлорной кислоты.
Ариловые сложные эфиры можно получать взаимодействием кислоты с фенолом в присутствии хлорокиси фосфора или полифесфорной.
Если в молекуле имеется как первичная, так и вторичная спиртовая группа, как, например, в антибиотике хлорамфениколе (синтомицин), частичная этерификация обычно приводит к образованию первичных моноэфиров. Эфир со вторичной спиртовой группой получают, проводя реакцию по остроумной схеме, приведенной ниже:
Диэфиры из кетонов или альдегидов и кислот можно получать, вероятно, через ангидрид кислоты (пример г) и из эфира.
Из хлорангидридов кислот
Этот метод синтеза находит широкое применение, поскольку эта реакция необратима в отличие от реакции этерификации. Выделяющийся при реакции хлористый водород можно уводить из сферы реакции или поглощать его каким-нибудь основанием, например едким натром, диметиланилином или пиридином, или магнием. Иногда желательно применение алкоголята натрия. Диметиланилин и магний применяют для. получения эфиров третичных спиртов, имеющих тенденцию в отсутствие вещества, способного поглощать выделяющийся хлористый водород, образовывать галогенпроизводные. При этерификации фенолов часто применяют магний; эта реакция исследована количественно. Наиболее высокие выходы фениловых эфиров получают из таллиевых солей фенолов и хлорангидрида соответствующей кислоты.
Простейший метод — метод Шоттена — Баумана, состоящий во встряхивании хлорангидрида кислоты с водным раствором едкого натра, содержащим соответствующий спирт. Самые высокие выходы получаются тогда, когда хлорангидрид кислоты (и образующийся эфир) нерастворимы в воде, так что реакция протекает на границе раздела между органическим и водным слоем. Нерастворимость образующегося сложного эфира в водной фазе препятствует его омылению. По окончании реакции эфир получается свободным от хлорангидрида кислоты и хлористого водорода и его можно сразу экстрагировать и сушить. В довольно старом и незаслуженно забытом
Исследовании реакции Шоттена — Баумана было установлено, что (выходы сложных эфиров возрастают при понижении температуры Макции, при увеличении концентрации спирта (что можно осуществлять, добавляя щелочь постепенно) и при применении едкого кали, а не едкого натра. Кроме того, ангидрид уксусной кислоты дает более высокий выход эфира, чем хлорангидрид. Наиболее общим методом служит метод, в котором используют пиридин; если бы не неудобства, связанные с необходимостью избавляться от следов пиридина, который обычно отмывают разбавленной кислотой, вероятно, применяли бы только этот метод.
Эффективность реакции галогенангидридов кислот со спиртами может быть повышена проведением предварительной реакции галогенангидрида с кислотой Льюиса с целью получения соли ацилия. Простейшей такой солью является, по-видимому, метилоксокарбонийгексафторантимонат, который сам по себе или в нитрометане быстро реагирует со спиртами, образуя ацетаты с выходами от 62 до 87%.
Эта реакция, вероятно, происходит в результате нуклеофильной атаки спирта на атом углерода карбонила хлорангидрида кислоты.
Образующийся при этом комплекс быстро теряет хлористый водород, давая сложный эфир R'COOR.
В случае образования реакционноспособных и нестабильных бензилтозилатов желательно сначала получить соответствующий алкоголят с гидридом натрия, а затем обрабатывать его хлор ангидридом кислоты. Аналогичный метод, но без выделения алкоголята натрия, применялся для получения тозилата 2-нитро-3,4,5-триметок-сибензилового спирта, в котором гидроксил спирта прочно связан с нитрогруппой.]
Многие функциональные группы при этом методе синтеза не затрагиваются. В хлорангидридах кислот, содержащих двойные связи, ацетокси- , алкиламино- и 2-фуранакрилогруппы, эти группы не изменяются. Оксиэфиры можно получать из двухатомных спиртов и хлорангидридов кислот; аналогичным образом хлорзамещенные сложные эфиры можно получать из галогендоинов. При этом часто получают высокие выходы
Из ангидридов кислот
Или
Как и хлорангидриды кислот, ангидриды кислот широко применяют для получения сложных эфиров из соединений, содержащих оксигруппу. Эту реакцию проводят как в отсутствие катализаторов, так и с применением таких катализаторов, как серная кислота, хлористый цинк, хлорсульфокислота, хлористый ацетил, ацетат натрия. борная кислота, сульфат железа(Ш), метилат натрия и моногидрат я-толуолсульфокислоты. Ацетилирование многих фенолов можно осуществить в водном растворе щелочи, а циклические ангидриды можно полностью или частично этерифицировать. Механизм этой реакции такой же, как и при реакции с хлорангидридом кислоты, только при этом происходит отрыв аниона карбоксилата, а не галоген-аниона. Поскольку анион карбоксилата в растворе менее термодинамически стабилен, чём анион галогена, можно ожидать, что реакция ангидрида кислоты со спиртом будет несколько менее экзотермической, чем реакция соответствующего хлорангидрида. Вопреки тому, что написано в некоторых учебниках, третичные спирты можно этерифицировать ангидридами кислот при применении кислых катализаторов или трифенилметилнатрия.
Способные енолизоваться альдегиды можно превратить в енол-ацетаты нагреванием с уксусным ангидридом и ацетатом калия. Для трех ангидридов, для которых была проведена эта реакция, выходы составляли от 35 до 61%. Способные к енолизации кетоны реагируют не с такой легкостью, но, применяя уксусный ангидрид и л-толуолсульфокислоту, можно добиться успеха. Выходы для трех изученных кетонов составляли от 32 до 68%. Интересно отметить, что в условиях, применявшихся при реакции с кетонами, в реакцию вовлекались только метиленовые водородные атомы. При получении а-бром альдегидов и кетонов в качестве промежуточных соединений используют енолацетаты, как показано ниже:
Смешанные ангидриды, получающиеся из алкиловых эфиров хлормуравьиной кислоты, разлагаются при нагревании, образуя сложные эфиры по следующим схемам:
Ряд смешанных ангидридов из алифатических кислот разлагается с образованием сложных эфиров по пути А, а смешанные ангидриды ароматических кислот разлагаются по пути либо А, либо Б. При 250 °С происходит также реакция В. Трифторуксусная кислота и фениловый эфир хлормуравьиной кислоты при смешивании образуют фениловый эфир трифторуксусной кислоты с выходом 75—80%. Рассмотренные реакции декарбоксилирования, по-видимому, протекают через промежуточное циклическое состояние, причем происходит сдвиг электронов в цикле.
Из кетенов, ацетатов кетонов и изотианалей
Несмотря на то что эти реакции часто дают высокие выходы, этот метод синтеза не находит широкого распространения вследствие того, что химик обычно не имеет готового кетена, а его получение иногда бывает довольно сложным. Реакцию промотируют такие катализаторы, как серная кислота или толуолсульфокислота. Этот метод с успехом применяют при ацетилировании сложных эфиров молочной кислоты, а также при ацетилировании третичных спиртов и фенолов. Некоторые функциональные группы, например функциональные группы альдегидов и кетонов, подвержены атаке кетенами. В некоторых случаях эти карбонильные соединения превращаются в енолацетаты
Присоединение спирта к кетену, вероятно, идет как присоединение к карбонильным группам. Сначалаобразуется енол
таутомеризующийся затем собразованием сложного эфира
Поскольку кетены образуются в качестве промежуточных соединений при облучении большинства кетонов, кетоны представляют собой потенциальные источники получения сложных эфиров, если проводить их облучение в присутствии спиртов
Спирты присоединяются к дикетенам с образованием ацетоацетатов следующим образом:
Этот метод выгодно применять для получения ацетоацетатов с ненасыщенными группами R. Оказалось, что в этих случаях лучше всего в качестве катализатора использовать алкоголят натрия. Такие сложные эфиры можно также получать из хлорангидридов кислот через дикетен в одну стадию.
Ацетали кетенов также могут самопроизвольно превращаться в сложные эфиры с количественным выходом
Получение карбаматов из изоцианатов и спиртов напоминает образование сложных эфиров из кетенов
Эта реакция происходит самопроизвольно в отсутствие катализатора и дает высокие выходы карбаматов. Третичные спирты, однако, склонны к образованию олефинов. При получении фенилкарбаматов из изоцианатов и фенолов в качестве катализатора используют несколько капель триэтиламина или пиридина. Получение сложного эфира изоцианата представляет собой способ идентификации спиртов.
Диэфиры или α-замещенные эфиры из карбонильных соединений
или
Эти реакции присоединения применяют в ограниченных масштабах для синтеза а-галогензамещенных сложных эфиров или ацилалей. Сложные эфиры получают, смешивая компоненты либо сами по себе, либо в присутствии следов хлористого цинка, причем выходы составляют примерно 50%. Ацилали лучше всего получать действием уксусного ангидрида, если реакцию вести с добавлением небольших количеств эфирата трехфтористого бора, но с ангидридами пропионовой и и-масляной кислот наилучшие результаты достигаются при добавлении 10%-ного избытка катализатора сверх эквивалентного количества. При проведении реакции как с малым количеством катализатора, так и с избытком уксусный ангидрид и формальдегид образуют смеси, а с янтарным и пропионовым альдегидами реакция не идет. Выходы при этих реакциях присоединения составляют 60—80%. При реакциях присоединения ангидрида можно использовать кислоты, например серную кислоту, но выходы при этом обычно получаются более низкими, кроме тех случаев, когда добавляют ацетат натрия.
Выше уже приводились примеры получения изопропилиденмалоната и а-ацетокси-М-циклогексилизовалерамида.
3.6 Из нитрилов
Хотя от нитрилов можно перейти к сложным эфирам через амиды, обычный метод состоит в превращении их в иминоэфир, который можно выделять в качестве промежуточного соединения, а можно и не выделять. Для этой реакции применяют различные катализаторы, такие, как хлористый водород, бромистый и йодистый водород, серную кислоту и моногидраты бензол- и толуолсульфокислот. Следует отдать предпочтение аренсульфокислотам по сравнению с хлористым водородом или серной кислотой. С хлористым водородом получаются, более высокие выходы, чем с бромистым и йодистым водородом. Как показывает приведенное уравнение реакции, если исключить из участия в реакции воду, можно получить иминоэфиры. В некоторых случаях для реакции, ведущей к образованию иминоэфира, вода не нужна совсем, а иногда в отсутствие воды реакция не идет.
Этот метод синтеза находит широкое применение для получения полифункциональных соединений. Так, например, малоновые эфиры обычно синтезируют из эфиров а-цианкарбоновых кислот. Из циангидринов получают оксиэфиры, из кетоцианидов — кетоэфиры, а из аминоцианидов—аминоэфиры. Выходы при этом обычно бывают удовлетворительные.
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)
Переэтерификация представляет собой равновесную реакцию, которую можно сдвинуть в прямом направлении, применяя избыток одного из реагентов или, что предпочтительно, удаляя один из компонентов — RCOOR" или R'OH. Если температура кипения R'OH ниже, чем R"OH, можно проводить разделение, при помощи фракционирования: иногда для удаления получающихся продуктов пользуются образованием азеотропных смесей. Катализаторами такой реакции обмена служат кислоты, например серная или толуолсульфокислота, или основания, например алкоголяты алюминия. Как правило, превращение лучше протекает с первичными спиртами, причем наиболее реакционноспособен метиловый спирт, хотя в некоторых случаях с успехом можно применять вторичные спирты.
Этот метод синтеза пригоден для синтеза алкиловых эфиров высших жирных кислот из жиров, масел и восков. Путем такого обмена удобно получать и многие другие сложные эфиры, например эфиры акриловой и диэтиламино-а-фенилмасляной кислот. Наиболее важным эфиром енола, применяемым для получения сложных эфиров, является изопропенилацетат. Этот реагент легко доступен, и из него можно получать различные сложные эфиры с высоким выходом в результате обмена со спиртом в присутствии кислых катализаторов
Эта реакция может протекать с образованием кетена, из которого получают изопропенилацетат, но возможно также, что при реакии, катализируемой кислотой, образуется ион ацилия, атакующий спирт. Приведен пример образования сложного эфира, а также эфира енола.
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами. Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Бутиловый спирт, однако, обменивается очень медленно
3.8. Из лактонов и спиртов (реакция переэтерификации)
Этот метод синтеза находит лишь ограниченное применение при получении сложных эфиров. Бромистый водород в спиртовом растворе дает бромзамещенный сложный эфир, а хлористый водород приводит к образованию оксиэфира. Вместо галогеноводорода применяют и другие галогенпроизводные, например пятибромистый фосфор и тионилхлорид. Наиболее детально изучена, по-видимому, реакция пропиолактона. В этом случае при взаимодействии со спиртом в зависимости от природы катализатора образуются два продукта. С основаниями происходит расщепление по связи кислород—углерод карбонила, приводящее к образованию оксиэфиров
В отсутствие катализатора или с кислыми катализаторами происходит расщепление связи кислород — углерод метиленовой группы с образованием р-алкоксикислот
Механизм этого расщепления сходен с механизмом, предложенным для сложных эфиров, поскольку лактоны можно рассматривать как внутримолекулярные сложные эфиры. Выходы при этой реакции получаются удовлетворительные.
3.9. Из сложных эфиров и кислот (реакция переэтерификации)
Этот обмен происходит, и часто с хорошими выходами, в случае ациламинокислот и при получении виниловых эфиров различных алифатических и ароматических карбоновых кислот. N-Ациламинокислоты, например фталоилглицин или тозилглицин, превращаются в метиловые или этиловые эфиры под действием алкилформиата или алкилацетата. Обычно в качестве катализаторов используют 96% -ную серную кислоту или моногидрат толуолсульфокислоты. Неацилированные аминокислоты, за исключением фенилаланина нельзя превратить в сложные эфиры при помощи такого катализатора, как серная кислота.
«Винильный обмен» требует применения в качестве катализатора ртутной соли сильной кислоты. Температура при этой реакции должна поддерживаться в области 20—80 °С; более высокие температуры приводят к образованию диэфиров этилидена и ангидридов кислот. Этот метод синтеза позволяет получать более чистые мономеры, чем те, которые образуются в результате присоединения ацетилена к кислоте. Считают, что в этом случае соль ртути образует ацетиленовый комплекс (I)
реагирующий с кислотой с образованием сложного эфира (II)
3.10 Из солей при взаимодействии с алкилгалогенидами
Эта реакция обмена дает высокие выходы с галогенпроизводными, способными к реакции замещения по механизму SN2 в апротонных растворителях. Хорошие выходы метиловых эфиров высокой степени чистоты получаются с йодистым метилом, бикарбонатом натрия и соответствующей кислотой при проведении реакции в диметилацетамиде при комнатной температуре. При реакции с другими алкилгалогенидами синтезирован ряд сложных эфиров. Можно использовать для этой реакции соль натрия или серебра с триэтиламином в качестве катализатора или саму свободную кислоту с триэтиламином. Фенациловые эфиры, получаемые этим методом, используют для характеристики карбоновых кислот.
При получении тритиловых эфиров следует предпочесть бромистый триэтил хлористому, поскольку он более реакционноспособен и менее гигроскопичен и его можно применять с безводной серебряной, натриевой или калиевой солью.
При реакции соли, уксуснокислого тетраэтиламмония, с оптически активным галогенпроизводным образуется сложный эфир с меньшей степенью рацемизации, чем при применении уксусной кислоты
Реакция медной соли кислоты с каким-либо арилгалогенидом в высококипящем растворителе — единственно пригодный способ получения ариловых эфиров из арилгалогенидов. В качестве промежуточного соединения образуется медьорганическое соединение
Эту реакцию можно применять также в случае винилгалогенидов с целью получения виниловых эфиров.
3.11. Из солей и кислот и других алкилирующих агентов
При этом методе синтеза обычно в качестве алкилирующегс агента применяют диметилсульфат; кроме того, используются алкилпирокарбонаты, алкилсиликаты, алкилфосфонаты, ацетали и даже алкилхлорсульфиты. В последнем случае эфир получается в результате пиролиза реакционной смеси с выделением двуокиси серы. Алкилирование, как правило, проводят в щелочной среде; в этих условиях алкилируется как пространственно затрудненная, так и незатрудненная карбоксильная группа. При проведении реакции в кислых условиях алкилируется только пространственно незатрудненная карбоксильная группа. Выходы часто получаются высокие.
В методе, предложенном недавно, свободную кислоту алкили-руют при помощи какого-нибудь алкилсульфата и дициклогексил-этиламина в качестве акцептора протонов
Выходы некоторых эфиров составляют 96—97% (метиловые эфиры) и 84% (этиловые эфиры).
3.12. Из медных солей
Эта реакция дает возможность осуществить весьма необычный синтез эфиров арилбензойных кислот. При пиролизе медной соли ароматической кислоты образуется с хорошим выходом сложный эфир. Необычным является то, что арильная группа становится в орто-положение по отношению к присутствующей вначале карбоксильной группе, выделяющейся в процессе реакции, как показано ниже:
Механизм этой реакции, возможно, представляет собой циклозамещение, но он еще не установлен окончательно. Окись меди частично может быть заменена воздухом.
3.13. Из тетраалкиламмоиевых солей
Этот метод синтеза первоначально применялся для получения сложных эфиров пространственно затрудненных бензойных кислот. Метиловые эфиры 2,4,6-триметил- и 2,4,6-триэтилбензойной кислот получены с выходом от 63 до 90%. Сложный эфир также образуется при непосредственном нагревании четвертичного галогенида аммония с ацетатом натрия и уксусной кислотой.
3.14. Из амидов
Превращение амидов в сложные эфиры — термодинамически невыгодная реакция и поэтому требует специальных условий. И действительно, реакция легко осуществляется лишь в необычных условиях. В качестве одного из примеров приведем гладкое превращение о- или п-нитроацетанилидов в сложные эфиры при взаимодействии со спиртами в присутствии алкоголята натрия. При этом очевидно, происходит алкоголиз через анион нитроацетанилида.
Амиды можно превратить в изоцианаты реакцией Гофмана с гипобромитом, а изоцианаты затем превратить в карбаматы действием спирта. Поскольку мочевина при нагревании превращается в изоциановую кислоту HN=C=O, она может реагировать со спиртами, образуя в качестве производных сначала изоциановую кислоту, а затем алкилкарбаматы (уретаны). Так, например, бензилкарбамат легко получается при кипячении мочевины и бензилового спирта до прекращения выделения аммиака
Любое соединение, приводящее к образованию изоцианата, является потенциальным источником карбамата, если проводить реакцию каком-нибудь спирте в качестве растворителя. Так, например, : облучении азида кислоты в этиловом спирте образуется уретан
-о
Из изоциановой кислоты, которая, вероятно, в кислых растворax сначала димеризуется, можно получить эфиры аллофановой кислоты
Многие эфиры аллофановой кислоты и целлосольва представляют собой кристаллические соединения и удобны для получения про водных.
Наиболее удобным, хотя и имеющим ограниченное применен методом превращения амида в сложный эфир является перегруппировка р-оксиэтиламида под влиянием концентрированной соляной кислоты
3.15. Из тригалогензамещенных
Эта реакция проводилась с различными замещенными бензотрифторидами и бензотрихлоридами, причем выходы составляли от 42 до 90%. Для более лабильных тригалогензамещенных, таких, как 3,3,3-трихлор-1,1-ди-(п-хлорфенил)пропен-1, при кипячении его с метиловым спиртом выход сложного эфира составляет 95%.
3.16. Из дигалогензамещенных простых эфиров
Сложные эфиры можно получить из а,а-дихлоралкилзамещенных простых эфиров при гидролизе их водой. Для гидролиза а,а-дифторалкилзамещенных простых эфиров необходимо применять более сильные гидролизующие агенты, такие, как 95%-ную серную кислоту. Выходы при этих реакциях гидролиза составляют от 55 до 83%. Механизм этого расщепления точно не установлен, но можно предполагать, что этот гидролиз протекает с большей легкостью, чем гидролиз тригалогензамещенных, в результате влияния простой эфирной группы.
3.17. Из карбоновых кислот и дивинилртути
Этот метод синтеза применим только для получения сложных виниловых эфиров, простых виниловых эфиров (из фенола) и винилсульфидов (из тиофенола или алкилтиола). Для проведения реакции ароматическую или алифатическую карбоновую кислоту нагревают саму по себе или в каком-нибудь растворителе с дивинилртутью, полученной из хлорида ртути и винилмагнийбромида в тетрагидрофуране. В отсутствие растворителя реакция обычно проходит более чем на 50% за время меньше 5 мин при нагревании на паровой бане. Для безопасности реакцию необходимо проводить в хорошо вентилируемой тяге, поскольку дивинилртуть высоко токсична. Если проводить реакцию в инертном растворителе, можно выделить образующийся в качестве промежуточного соединения винилртутный эфир RCOOHgCH=Ch3- Выходы виниловых сложных эфиров составляют от 38 до 74%.
3.18. Механизм реакции этерификации
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):
Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):
Катион (X) в результате отщепления протона образует молекулу сложного эфира:
Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорания (CO2 и Н2О) на присутствие тяжелого изотопа кислорода.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:
Он является процессом необратимым, поскольку богатый электронами анион кислоты не способен взаимодействовать с нуклеофильной молекулой спирта.
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2, Са(ОН)2 Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
В качестве растворителя основания для реакции гидролиза чаще всего применяют воду, которая, однако, не растворяет сложный эфир. Реакция идет на поверхности раздела двух фаз и требует, поэтому хорошего перемешивания. Иногда реакцию бывает целесообразно проводить в гомогенной среде, используя в качестве растворителя водный спирт. При этом, однако, нужно иметь в виду, что для выделения кислоты перед подкислением раствора спирт необходимо удалить (отогнать).
Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
Дорофеенко Г.Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
Голодников Г.В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
Шабаров Ю.С. Органическая химия: В 2-х кн. - М.:Химия, 1994.- 848 с.
Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.
globuss24.ru


















