Справочник химика 21. Сукцинимидный эфир
Сукцинимид получение - Справочник химика 21
В данном разделе рассматриваются методы получения и свойства только таких гетероциклических соединений, у которых суммарное количество я- и р-электронов гетероатома в цикле отвечает формуле Хюккеля 4п + 2 (например, фуран, тиофен, пиррол, пиридин, хинолин и др.). (При таком подходе вне рассмотрения здесь оказываются такие соединения, как капро-лактам, сукцинимид, фталевый ангидрид, которые являются функциональными производными различных классов соединений алифатического или ароматического ряда.) [c.508] Нагреванием аммонийной соли янтарной кислоты получают ее имид (сукцинимид). Механизм этой реакции такой же, как при получении амидов монокарбоновых кислот из их солей (см. разд. 6.1.3.1) [c.397]Около 7з части сукцинимида (50—53 г) выпадает из раствора во время охлаждения, облегчая тем самым последующую очистку нитрила. Иногда, для того чтобы началась кристаллизация, в раствор приходится внести затравку. Проверявшие синтез нашли целесообразным ставить смесь на ночь в холодильник для получения М—53 г сукцинимида. [c.20]
Получение N-бромсукцинимида. В круглодонную колбу на 100 мл, снабженную механической мешалкой и охлаждаемую смесью льда с солью, наливают 6,4 г едкого натра в 40 мл воды и прибавляют 16 г сукцинимида. Как только сукцинимид растворится, добавляют медленно по каплям при энергичном перемешивании и охлаждении в течении 20—40 мин [c.161]
Комплекс полученных в работе данных по закономерностям реакций синтеза сукцинимидных присадок, оптимальным условиям проведения реакций, спектрально-структурным корреляциям и методам анализа присадок и промежуточных соединений их синтеза представляет составную часть теоретической основы для разработки нового технологического процесса производства высокомолекулярных сукцинимидных присадок в промышленном масштабе. Методы анализа алкилфенолов и сукцинимидов и целенаправленное исследование реакций на основе этих методов способствовали значительному ускорению решения прикладных технологических задач в ВНИИПКНЕФТЕХИМ (Киев). [c.9]
В молекуле аммиака два атома водорода могут замещаться на ацильные остатки. При этом образуются имиды кислот. Особенно большое Значение имеют циклические имиды дикарбоновых кислот, например, сукцинимид (имид янтарной кислоты), который может быть получен ацилированием аммиака янтарной кислотой. Промежуточно образуется соль янтарной кислоты [c.195]
При изучении влияния поверхностных и объемных свойств на моющее действие присадок, содержащихся в масле, была предложена математическая модель [66]. Заславский и другие [66] изучали антиокислительные свойства и механизм действия металлсодержащих сукцинимидов, полученных на основе товарной присадки С-5А, применяя метод, который основан на инициированном окислении тетрадекана и кумола, служащих моделью минерального масла. Показано, что введение в масло металлсодержащих сукцинимидов не тормозит реакцию окисления при 115°С и давлении кислорода 20—100 кПа. Эти присадки каталитически разрушают гидропероксиды. Подробно исследован механизм действия молибденсодержащей сукцинимидной присадки. [c.98]
Янтарный ангидрид (т. пл. 119,6°С) может быть вновь гидролизо-ван до янтарной кислоты. С аммиаком при более высоких температурах он образует сукцинимид, который может быть получен также нагреванием сукцината аммония [c.433]
Установка получения сукцинимид-ных присадок — - — 18 202 63 — — [c.555]
Получение Ы-винилсукцинимида отщеплением уксусной кислоты от эфира уксусной кислоты и N-ф-оксиэтил)сукцинимида [c.222]
Незамещенные или монозамещенные амиды кислот могут присоединяться к а,р-ненасыщенным карбонильным соединениям и нитрилам. Эта реакция всегда требует участия основных катализаторов. Особенно легко вступают в эту реакцию такие амиды, как фталимид или сукцинимид, а также амиды сульфокислот. Под действием катализатора они очень легко превращаются в соответствующие основания, присоединяющиеся по кратной связи [см. схему (Г. 8.49)]. Образующиеся продукты присоединения представляют интерес, поскольку омылением амидной группы можно получить (3-аминоэтильные соединения. Прямым присоединением аммиака или моноалкиламинов эти соединения получаются лишь с трудом. Примером использования реакции присоединения амидов может служить 3-аланин, для которого ниже приводится удобный лабораторный метод получения. [c.214]
Аланин был получен каталитическим восстановлением эфи-ров или солей циануксусной кислоты нагреванием акрилонитри-ла , 9-аминопропионитрила, б с-(Р-цианэтил)-амина , р-окси-пропионитрила , -алкоксипропионигрилов, бйс-р-цианэтилового эфира , б с-(р-цианэтил)-сульфида с водным аммиаком при 150—225° гидролизом р-аминопропиопитрила концентрированной соляной кислотой и последующим удалением кислоты (с анионообменными смолами) . Описанный выше способ был уже опубликован . Дополнительные указания относительно препаративных методов получения были даны при описании способа получения [3-аланина из сукцинимида действием бромноватистокислого калия [c.15]
Y-Аминомасляная кислота была получена электролитическим восстановлением сукцинимида в пирролидон с последующим гидролизом его гидроокисью бария окислением пиперилуретана дымящей азотной кис ютой и обработкой полученного продукта концентрированной соляной кислотой в запаянных трубках при 100° гидролизом продукта конденсации Н-(р-бромэтил)-фталимида с натрий-малоиовым эфиром и с помощью метода, описанного выше, который является незначительным видоизменением метода Габриэля 2. [c.39]
В подтверждение этого лабораторные данные, полученные при испытании масла ДС-11 с различными композициями присадок на основе сульфоната, алкилсалицилата кальция, сукцинимида и дитиофосфата цинка, были сопоставлены с результатами испытаний на моторной установке ОЦУ ИТ 9-3 по методу ИДМ-60. В качестве лабораторных методов, оценивающих различные стороны моющего действия, были отобраны методы, которые достаточно полно и всесторонне характеризовали бы заданное свойство. В частности, стабилизирующее действие определяли по обобщенному показателю стабилизирующих свойств (ОПС), собственно моющее действие — по времени образования пленки нагара заданной толщины при 330°С (тззо), а противоокислительные свойства — по конечной вязкости масла (vкoн) и содержанию в нем осадка Рос) при 205°С в присутствии металлического катализатора. С учетом указанных данных получена эмпирическая расчетная формула [c.221]
Многочиеленные методы получения -аланина имеют тот общий недостаток, что требуют либо труднодоступных исходных веществ, либо применения высокого давления и особых катализаторов. Мульдер получал -аланин из трудно доступной иодпропионовой кислоты. По методу Кларк и Бэр еукцини-мид обрабатывается гипохлоритом. Этот метод дает хорошие выходы (до 45%), но для получения сукцинимида требуется [c.5]
Ле Сойер и Норман [пат. США взаимодействием гексаметилендиамина, аллиламина и п-фенилендиамина с полиизобутенилян-тарным ангидридом, полученным реакцией малеинового ангидрида с полиизобутиленом, синтезировали высокомолекулярные алкенил-производные М-((о-аминогексил)-, Ы-алкил- и Ы-(л-аминофенил)-сукцинимидов [c.90]
Для получения серу- и молибденсодержащих составов в смазочные масла вводят [пат. США 4 283 295] продукт взаимодействия тетратиомолибдата аммония с основным азотистым соединением в таком соотношении, чтобы на 1 атом азота приходилось 0,01—2,00 атома молибдена реакцию ведут в присутствии полярного промотора. В качестве азотистых соединений применяют сукцинимид, амиды карбоновых кислот, органические моно- или полиамины и др. [c.129]
Среди азотсодержащих присадок эффективны сукцинимиды. Использование сукцинимидных присадок для повышения качества смазочных масел описано в гл. III особое внимание эти присадки привлекают в связи с их высокими защитными свойствами, что важно для рабоче-консервационных масел. Синтез сукцинимидных присадок в основном осуществляется взаимодействием а-олефинов или их олигомеров с малеиновым ангидридом и дальнейшей обработкой полученных производных днтарного ангидрида различными аминами. [c.185]
Положение двойных связей в молекуле витамина Bio нельзя еще считать окончательно установленным. С другой стороны, с формулой I хорошо согласуется строение различных низкомолекулярных п родук-тов окислительного расщепления витамина В и, из которых в первую очередь следует отметить производное сукцинимида III (полученное при окислении хромовой кислотой Фолкерс и сотрудники), а также образование янтарной, метилянтарной, диметилмалоновой [c.906]
Дибромаценафтен. Смесь из 19,7 г (0,128 моля) аценафтена, 45,6 г (0,256 моля) N-бромсукцинимида, 250 мл сухого четыреххлористого углерода и нескольких кристалликов перекиси бензоила кипятят с обратным холодильником в течение 30 мин. Отфильтровывают сукцинимид и -отгоняют от фильтрата растворитель. Перекристаллизацией сначала из смеси абсолютного спирта и бензола, а затем из абсолютного спирта получают 19,9 г 1,2-дибромаценафтена в виде бесцветных игл с т. пл. 120,5— 123° выход составляет 56% от теорет. Для получения аценафтилена можно лрименять неперекристаллизованный 1,2-дибромаценафтен [228]. [c.189]
Получение К 1,62 моля (160 г) сукцинимида растворяют в смеси 1,60 моль (64 г) NaOH, 300 г измельченного льда и 400 мл воды. К этому раствору за один прием прибавляют при энергичном перемешивании и наружном охлаждеии 85 мл брома. Перемешивание продолжают 1—2 мин, после этого отфильтровывают образовавшийся осадок и отмывают его ледяной водой до отрицательной реакции на бромиды. Осадок сушат 8 ч над пятиокисью фосфора в вакуум-эксикаторе при 0,5 мм рт. ст. или в пистолете при 40 °С и 10—20 мм рт. ст. Выход 75—81%. Чистота 977о- [c.358]
Hoiupta,. В работе осуществлен комплексный подход к решению структурно-аналитических и физико-химических аспектов реакций нефтехимического синтеза на основе спектроскопических, хро-матофафических и химических методов исследования, позволяющий получать качественно новую информацию. Впервые получен комплекс экспериментальных данных структурных, аналитических, кинетических и закономерностей реакций процессов синтеза алкилфенолов и сукцинимидов, которые составили теоретическую базу технологических процессов синтеза алкилфенолов с высокомолекулярными радикалами линейного строения и высокомолекулярных сукцинимидных присадок. Разработаны новые комплексные спектрально-хроматографические методы анализа молекулярных систем в процессах синтеза компонентов поверхностно-активных веществ, присадок, высокочистых полифениловых эфиров, спектроскопические методы определения антиокислительной активности ингибиторов при термоокислении полимеров и энергетических характеристик конформаций вы- [c.8]
Фенилмеркурсукцинимид может быть получен нагреванием фенилмеркурацетата или гидроокиси фенилртути в водном растворе сукцинимида [1]. [c.136]
В начале XX века Лукеш с соавторами [82, 85, 110-119] предложили способ получения пиррол-2-оиов на основе обработки М-замещенного сукцинимида реактивом Гриньяра. Таким методом получен ряд ЗЯ-пиррол-2-оиов 49, имеющих метильиый или фенильный заместитель при атоме азота гетероцикла (схема 22), а также объемный алкильный или фенильный заместитель в пятом положении [120-127]. [c.191]
В начале XX века Лукеш P. . с соавторами [95, 98, 128-137] предложили способ получения пиррол-2-о1Юв на основе N-замешённого сукцинимида. В среде абсолютного растворителя сукцинимид обрабатывали реактивом Гриньяра. Таким методом получен ряд ЗН-пиррол 2-онов, имеющих метильный или фенильный заместитель при атоме азота гетероцикла, а также объёмный алкильный или фенильный заместители в пятом положении [138- [c.14]
Для получения 2-пирролидонов наиболе чаесто используется реакция у-лактонов с аммиаком [1, 21, электролитическое восстановление сукцинимида [3] и восстановление эфироп у-нитрокарбоновых кислот до соответствующих аминокислот с последующей циклизацией [41. [c.19]
Особенно легко алкилируются такие амиды или имиды кислот, у которых водород может замещаться натрием, серебром, ртутью и т. д., например, у сукцинимида, фталимида, амида камфарной кислоты амида сульфокислоты зз, причем галоидоалкил действует на эти металлические соединения) (см. реакцию с фта-лщидом по Габриэлю, стр. 461). Между тем оказывается, что из анилинов при помощи натрийаммония можно получить натриевые производные, которые могут быть использованы для получения некоторых труднодоступных алкиланилинов. [c.641]
Получение [1, 2]. Сукципимид серебра получают добавлением в темноте свежеосажденной влажной окиси серебра к кипящему раствору сукцинимида в воде. Образующуюся суспензию фильтруют с отсасыванием, и фильтрат выдерживают до выпадения серебряной соли. Соль сушат на воздухе, измельчают и высушивают в вакууме при 110° выход 47%. Соль добавляют в течение часа к смеси иода и диоксана в темном сосуде, иногда встряхивая его, и затем нагревают на бане при 50°. Иодид серебра удаляют фильтрованием, фильтрат разбавляют четыреххлористым углеродом и охлаждают для кристаллизации И. Выход продукта ст. пл. 193—199 составляет 81—85%. [c.60]
КИНЕТИКА РЕАКЦИИ ПОЛУЧЕНИЯ АЛКЕНИЛСУКЦИНАНГИДРИДА В ПРОИЗВОДСТВЕ БЕНЗОЛЬНЫХ ПРИСАДОК ТИПА СУКЦИНИМИДОВ [c.38]
chem21.info
Способ получения сукцинимида
Изобретение относится к гетероциклическим соединениям, в частности к получению сукцинимида, применяющегося в органическом синтезе для получения лекарственных веществ, стимуляторов роста растений, поверхностно-активных веществ, фунгицидов и гербицидов. Цель изобретения - повышение выхода и упрощение процесса. Синтез сукцинимида ведут из янтарной кислоты и мочевины при мольном соотношении, равном 1 : 0,5 - 0,55, нагревании реакционной массы до полного выделения воды и CO2. Сукцинимид выделяют перегонкой при 270 - 287°С и перекристаллизацией, выход 77,8% против 70% в известном способе. Изобретение сокращает в 2 раза расход сырья и исключает образование побочных продуктов, что предотвращает загрязнение окружающей среды.
Изобретение относится к органической химии, а именно к способам получения сукцинимида, применяемого в органическом синтезе для получения лекарственных веществ, стимуляторов роста растений, поверхностно-активных веществ, фунгицидов и гербицидов. Целью изобретения является повышение выхода, целевого продукта и упрощение процесса. П р и м е р 1. Смесь 59 г (0,5 моль) янтарной кислоты и 15 г (0,25 моль) мочевины нагревают в перегонной колбе. В интервале температур 100-175оС выделяются вода и углекислый газ. Затем температуру поднимают и при 270-287оС и атмосферном давлении перегоняют продукт, перекристаллизацией которого из этанола в присутствии активированного угля получают 46 г (93% от теоретического) сукцинимида с т.пл. 124-125оС (по лит.данным 123-125оС). Найдено, С 48,46; Н 5,06; N 14,11. Вычислено, С 48,48; Н 5,05; N 14,14. П р и м е р 2. Процесс проводят аналогично примеру 1 с той разницей, что количество мочевины уменьшают вдвое (мольное соотношение 1,5:0,5). Из 59 г янтарной кислоты и 10 г мочевины получают 23,2 г сукцинимида (71,8% считая на мочевину). П р и м е р 3. Процесс проводят аналогично примеру 1 с той разницей, что исходные вещества берут в мольном соотношении 1:1. Из 30 г мочевины и 59 г янтарной кислоты получают 38,7 г (77,8%) сукцинимида. Выделяющийся диоксид углерода определяют как качественно (пропусканием выделяющегося газообразного продукта через известковую воду), так и количественно. Количество воды определяют весовым методом, а аммиака титрованием. При получении сукцинимида нагреванием смеси янтарной кислоты и мочевины при соотношении 1:0,5 (как в предлагаемом способе) и 220-230оС в течение 1,5 ч с последующим охлаждением смеси и экстракцией продукта (как в прототипе) выход целевого продукта составляет 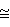 70% При получении же сукцинимида с соотношением янтарной кислоты и мочевины, равным 1:
70% При получении же сукцинимида с соотношением янтарной кислоты и мочевины, равным 1: 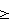 1 (как в прототипе), с последующей перегонкой смеси (как в предлагаемом способе) выход целевого продукта составляет 77,8% По сравнению с прототипом предлагаемый способ имеет следующие преимущества: позволяет упростить процесс в целом за счет упрощения выделения продукта, увеличить выход, сократить расход исходного сырья вдвое, исключает образование побочных продуктов, тем самым предотвращая загрязнение окружающей среды.
1 (как в прототипе), с последующей перегонкой смеси (как в предлагаемом способе) выход целевого продукта составляет 77,8% По сравнению с прототипом предлагаемый способ имеет следующие преимущества: позволяет упростить процесс в целом за счет упрощения выделения продукта, увеличить выход, сократить расход исходного сырья вдвое, исключает образование побочных продуктов, тем самым предотвращая загрязнение окружающей среды.
Формула изобретения
СПОСОБ ПОЛУЧЕНИЯ СУКЦИНИМИДА взаимодействием янтарной кислоты и мочевины при нагревании с последующим выделением целевого продукта, отличающийся тем, что, с целью повышения выхода целевого продукта и упрощения процесса, последний ведут при мольном соотношении янтарной кислоты и мочевины, равном 1 0,5 0,55, и нагревании реакционной массы до полного выделения воды и углекислого газа с последующим выделением продукта перегонкой при 270 - 287oС и перекристаллизацией.Похожие патенты:












Изобретение относится к органической химии и медицине и касается нового химического соединения, а именно производного пирролидин-2,4-диона формулы I: и лекарственного препарата противосудорожного действия на его основе

Изобретение относится к новым пирролиденметильным производным, к использованию известных и новых пирролиденметильных производных в качестве терапевтических средств, в частности, в качестве иммунологических средств, к способу их получения, а также к фармацевтическим композициям, содержащим их
Изобретение относится к способу снижения уровней TNF и ингибированию фосфодиэстеразы у млекопитающих, а также к соединениям и композициям, используемым для этого

Изобретение относится к новому способу получения 2,3-пиридиндикарбоксимида формулы (I), где R означает водород, C1-С6 алкил или C1-С6 алкоксиметил, R1 означает водород, C1-С6 алкил, С(O)R2, фенил, бензил, R2 означает C1-С6 алкил, бензил или фенил, который заключается в том, что соединение формулы (II), где R имеет вышеуказанные значения, R6 означает C1-С6 алкил, R7 означает OR8 или NR9R10, R8 означает водород, C1-С6 алкил, С(O)R11, фенил, бензил, R11 означает C1-С6 алкил, OR12, NR12, R13, бензил или фенил, R12 и R13 обозначают водород, C1-С6 алкил, бензил или фенил, R9 и R10 обозначают водород, C1-С6 алкил, бензил или фенил, подвергают взаимодействию с имидом малеиновой кислоты формулы (III), где R1 имеет вышеуказанные значения

Изобретение относится к химико-фармацевтической промышленности и касается способа получения противосудорожного препарата, представляющего собой 3-бензиламинометиленпирролидин-2,4-дион (1), заключающегося в том, что эфиры аминоуксусной кислоты ацилируют хлорангидридами моноэфиров малоновой кислоты в присутствии в качестве растворителя хлороформа, полученный продукт преобразуют в 3-алкоксикарбонилпирролидиндион-2,4 в спиртовом растворителе в присутствии в качестве циклизующего агента алкоголята натрия, полученный продукт декарбалкоксилируют путем трехкратного кипячения с ацетонитрилом, при концентрации продукта (V) 20-30 г/л в реакционной смеси, с последующим охлаждением, фильтрацией, отгонкой ацетонитрила, полученный пирролидин-2,4-дион вводят в реакцию с соответствующим диалкилацеталем диметилформамида или триалкоксиметаном, полученный продукт обрабатывают бензиламином при 0-5oС с последующим выделением целевого продукта
Изобретение относится к биотехнологии и может найти применение в медицине

Изобретение относится к получению 1,3-фениленбисмалеимида, который применяется как химический модификатор для резиновых смесей, а также в производстве термоустойчивых полимеров
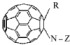
Изобретение относится к новым полифункциональным аминокислотным производным фуллерена С60, обладающим биологической активностью, а также к способам их получения и способу ковалентного связывания производных фуллерена с SH-содержащими белками
Изобретение относится к гетероциклическим соединениям, в частности к получению сукцинимида, применяющегося в органическом синтезе для получения лекарственных веществ, стимуляторов роста растений, поверхностно-активных веществ, фунгицидов и гербицидов
www.findpatent.ru
N-Бромсукцинимид — WiKi
NBS реагирует с алкеном 1 в водной среде, давая бромгидрин 2. Чаще всего реакцию осуществляют по частям, присыпая навеску NBS в раствор алкена в 50 % водном DMSO, DME, THF или трет-бутаноле при 0 °C. Образование бромоний-иона и атака интермедиата водой даёт присоединение строго по Марковникову и имеет анти-стереохимическую селективность.
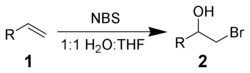
Побочные реакции, включающие образование α-бромо-кетонов и дибромзамещённых соединений, могут быть устранены использованием свежеперекристаллизованного NBS. Используя другие нуклеофилы вместо воды, можно получить другие бифункциональные алканы.
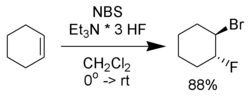
Аллильное и бензильное бромирование
Стандартные условия использования NBS в аллильном и/или бензильном бромировнии включают кипячение с обратным холодильником в безводной среде четырёххлористого углерода с радикальным инициатором — обычно AIBN или перекисью бензоила или при облучении — оба способа сразу приводят к образованию радикала. Аллильные и бензильные интермедиаты образующиеся в ходе реакции, более стабильны, чем другие углеродные радикалы и основными продуктами являются аллил- или бензилбромиды. Как, например, в реакции Воля-Циглера:
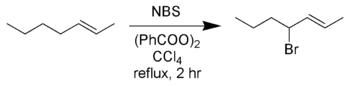
Четырёххлористый углерод должен быть сухим на протяжении реакции, так как присутствие воды может гидролизовать необходимый продукт. Для поддержания сухости и нейтральной кислотности часто добавляют карбонат бария. В вышеприведенной реакции при возможности образования аллильного или метилзамещённого, образуется аллильный продукт замещённый в 4-ое положение.
Бромирование карбонильных производных
NBS может ввести атом брома в α-положение карбонильного соединения как по радикальному механизму, так и с помощью кислотного катализа. Например, гексаноилхлорид 1 может быть бромирован в α-положение NBS при кислотном катализе[1].
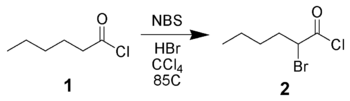
Реакция енолятов, енольных эфиров или енолацетатов с NBS — предпочтительный метод для α-бромирования из-за высоких выходов и малого количества побочных продуктов[2][3].
Бромирование ароматических соединений
Активированные электродонорными заместителями ароматические соединения (например фенолы, анилины и гетероциклы) могут быть[4] бромированы при использовании NBS[5][6]. Использование DMF как растворителя обеспечивает селективное бромирование по пара-положению[7].
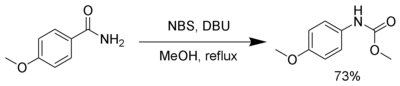
Перегруппировка Гоффмана
NBS в присутствии сильных оснований, таких как DBU (Диазабициклоундецен), реагирует образуя карбаматы через перегруппировку Гоффмана[8].
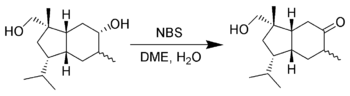
Селективное окисление спиртов
В некоторых случаях N-бромсукцинимид способен окислять спирты. Кори обнаружил случай селективного окисления вторичной спиртовой группы в присутствии первичной, используя NBS в водном диметоксиэтане (диглиме)[9].
N-бромсукцинимид синтезируют бромированием сукцинимида, при этом бромирование может производиться как действием брома на сукцинимид в присутствии щелочи (лабораторный метод)[10]:
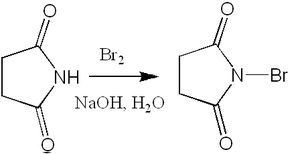 ,
,так и бромированием сукцинимида в разбавленной серной кислоте в присутствии бромида натрия (промышленный метод).
N-бромсукцинимид также может быть синтезирован электролизом водного раствора сукцинимида и NaBr[11].
При хранении NBS постепенно выделяется бром, что приводит к неожиданным результатам реакций. Реактив очищают обычно перекристаллизацией из воды (200 грамм NBS на 2,5 литра воды) или уксусной кислоты. Хранят NBS в холодильнике в отсутствии воды. Его преимущество перед бромом в безопасности хранения, тем не менее, все операции с ним проводятся в вытяжном шкафу из-за опасности отравления бромом.
ru-wiki.org
Сукцинимид Янтарная кислота, имид - Справочник химика 21
Янтарной кислоты имид см. Сукцинимид [c.572]Из имида янтарной кислоты (сукцинимида) по реакции Гофмана [22, 37, 38] при взаимодействии с гипохлоритом или гипобромитом натрия или калия в присутствии щелочи по схеме [c.139]
Нагреванием аммонийной соли янтарной кислоты получают ее имид (сукцинимид). Механизм этой реакции такой же, как при получении амидов монокарбоновых кислот из их солей (см. разд. 6.1.3.1) [c.397]
Пиррол может быть получен из имида янтарной кислоты (сукцинимида). [c.218]Сукцинимид (имид янтарной кислоты). [c.700]
Сукцинимид (янтарной кислоты имид) [c.95]
В молекуле аммиака два атома водорода могут замещаться на ацильные остатки. При этом образуются имиды кислот. Особенно большое Значение имеют циклические имиды дикарбоновых кислот, например, сукцинимид (имид янтарной кислоты), который может быть получен ацилированием аммиака янтарной кислотой. Промежуточно образуется соль янтарной кислоты [c.195]
Выполнение опыта. 1. Получение сукцинимида. В фарфоровой чашке смешать 2 г янтарной кислоты с 5 мл концентрированного раствора аммиака и, перемешивая массу термометром, прогреть на песчаной бане до температуры 200° С. При этом вначале образуется диамид янтарной кислоты, который при 190° С распадается на аммиак и циклический имид. [c.109]
Описать свойства сукцинимида. Написать уравнения реакций образования амида и имида янтарной кислоты. Определить выход сукцинимида в граммах и процентах от количества израсходованной янтарной кислоты. Почему щавелевая и малоновая кислоты не образуют кольчатых амидов [c.109]
Имид янтарной кислоты (сукцинимид) [c.240]
Сукцинимид (имид янтарной кислоты) — бесцветное кристаллическое вещество ст. пл. 126 С, растворимое в воде. [c.588]
Янтарный ангидрид при взаимодействии с аммиаком дает имид янтарной кислоты (см, стр. 134), который называют также сукцинимидом [c.137]
Исходный N-бромсукцннимид получается при бромировании сукцинимида (имида янтарной кислоты) бромом в водной щелочи ири 5°С [c.412]
Циклический ангидрид янтарной кислоты взаимодействует с аммиаком как типичный ангидрид, однако ори сильном нагревании образуется циклический имид (сукцинимид). Фталевый ангидрид реагирует аналогично, образуя фталимид. [c.498]
В 1942 г. Карл Циглер воспроизвел раннюю работу А. Воля но бромирование алкенов и показал, что реакция алкенов с К-бромсукцннимндом в СО.4, инициированная перекисями, является общим методом бромирования алкенов в так называемое аллильное положение (аллнлььш называется атом углерода в а-ноложении по отношению к двойной связи). К-Бромсукциршмид (КВ8) получается прн взаимодействии сукцинимида (имида янтарной кислоты) с бромом в щелочной среде [c.439]
N-Бромсукцикимид (или N-хлорсукцинимид) получают действием брома ([1ЛИ хлора) и щелочи на сукцинимид (имид янтарной кислоты) [c.157]
Получить сукцинимид (имид янтарной кислоты) из диамида янтарной кислоты. [c.197]
Янтарной кислоты имид см. Сукцинимид Янтарной кислоты N-(N-мeтoк ифeнил)имид [c.538]
Янтарная кислота хорошо кристаллизуется (т. пл. 183°). Она весьма склонна образовывать циклические производные. Так, например, при перегонке она циклизуется в янтарный а и г и д р и д, а при нагревании ее аммонийной соли получается сукцинимид — имид янтарной кислоты (I). Последний при перегонке с цинковой нылью переходит в пиррол (П). При нагревании же с сернистым фосфором янтарная кислота превращается в гетероциклическое соединение — тиофен (1И) [c.344]
М-(р- Оксиэти л) сукцинимид. В круглодонную колбу емкостью 500 мл помещают 118 г (1 моль) янтарной кислоты и постепенно прибавляют 61 г (1 моль) безводного 2-аминоэтилового спирта. Содержимое колбы нагревают в течение 60—90 мин. на воздушной бане при 160°. После прекращения выделения паров воды и охлаждения К-(р-оксиэтил)сукцин-имид застывает в светло-желтую кристаллическую массу. Н-(р-Оксиэтил)-сукцинимид перегоняют в вакууме и получают вещество с т. кип. 178° (5 мм). Перекристаллизовывают из бензола и получают белый кристаллический порошок с т. пл. 58° выход составляет 95% от теорет. [262]. [c.222]
Аллильное бромирование олефинов. Для аллильного бромирования алкенов свободный бром применять не удобно из-за его способности на холоду присоединяться к двойной связи олефина (см. ниже реакции А(1е)- В лаборатории предпочитают с этой целью использовать переносчики брома, например К-бромсукципи-мид (сокращенно НБС). Этот реагент готовят действием молекулярного брома на щелочной раствор имида янтарной кислоты (сукцинимида) [c.155]
Беззольные моющие ирисадки представляют собой чистоорганические соединения, в состав которых металл не входит. Существует два основных тииа беззольных моющих присадок сукцинимиды и полярные полимеры. Сукцинимидные присадки являются продуктом взаимодействия низкомолекулярного иолиизобутилена с малеиновым ангидридом и некоторыми аминами. С химической точки зрения — это имидо-ироизводные янтарной кислоты. [c.97]
Медленнее чем с фталимидом происходит реакция мея4ду диазометаном и имидом янтарной кислоты с разованием N-m е т и л-сукцинимида (иглы с темп. пл. 66°) Доп. перев.] [c.642]
Имиды. — Двухосновную янтарную кислоту можно обычными методами превратить в нейтральный диамид — сук-ципамид. При сильном нагревании сукцннамид не претерпевает обычной дегидратации до нитрила, а вместо этого отщепляет аммиак и превращается в циклическое диацильное производное — сукцинимид [c.624]
Сукцинимид (имид янтарной кислоты) может быть получен нагреванием янтарной кислоты в токе аммиака при 220° С кристаллизуется с одной молекулой воды безводный сукцинимид плавится при 125° С. Под действием натрия он выделяет водород, образуя натрийсукцинимид [c.523]
СУКЦИНИМИД (имид янтарной кислоты, пирроли-диндион-2,5), мол. вес 99,09 — бесцветные кристал- [c.545]
Формулу сукцинимида (имида янтарной кислоты) Н. А. Меншуткин писал так 4h5O2NH, что не противоречит позже принятой более подробной структурной формуле [c.242]
chem21.info