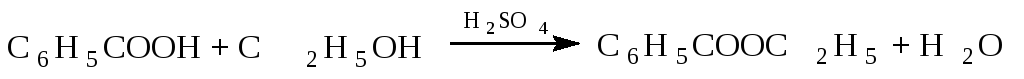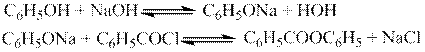Большая Энциклопедия Нефти и Газа. Эфир спирт
Сложный эфир - спирт - Большая Энциклопедия Нефти и Газа, статья, страница 3
Сложный эфир - спирт
Cтраница 3
К тому же купратные реагенты способны алкнлироваться не только алкилгалогенидами, но и сложными эфирами спиртов ( ацетатами, тозилата-ми), что, конечно, существенно расширяет возможности выбора реагентов, участников сочетания. Наконец, в отличие от соответствующих магний - или литийорганических соединений, купратные реагенты инертны по отношению к таким группам, как кетонная, что позволяет без осложнений реализовать сочетание по формальной схеме реакции Вюрца даже при наличии в субстратах такого рода рсаккионноспособных функций, что было просто недостижимо в классическом варианте реакции. Поэтому неудивительно, что стадию образования связи С-С с использованием этого подхода можно встретить в синтезах самых разнообразных соединений. [31]
К тому же купратные реагенты способны алкилироваться не только алкилгалогенидами, но и сложными эфирами спиртов ( ацетатами, тозилата-ми), что, конечно, существенно расширяет возможности выбора реагентов, участников сочетания. Наконец, в отличие от соответствующих магний - или литийорганических соединений, купратные реагенты инертны по отношению к таким группам, как кетонная, что позволяет без осложнений реализовать сочетание по формальной схеме реакции Вюрца даже при наличии в субстратах такого рода реакционноспособных функций, что было просто недостижимо в классическом варианте реакции. Поэтому неудивительно, что стадию образования связи С-С с использованием этого подхода можно встретить в синтезах самых разнообразных соединений. [32]
К тому же купратные реагенты способны алкилироваться не только алкилгалогенидами, но и сложными эфирами спиртов ( ацетатами, тозилата-ми), что, конечно, существенно расширяет возможности выбора реагентов, участников сочетания. Наконец, в отличие от соответствующих магний - или литийорганических соединений, купратные реагенты инертны по отношению к таким группам, как кетонная, что позволяет без осложнений реализовать сочетание по формальной схеме реакции Вюрца даже при наличии в субстратах такого рода рсакционноспособных функций, что было просто недостижимо в классическом варианте реакции. Поэтому неудивительно, что стадию образования связи С-С с использованием этого подхода можно встретить в синтезах самых разнообразных соединений. [33]
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации, а полученные вещества - сложными эфирами данного спирта и данной кислоты. [34]
При использовании таких эфиров в качестве пластификаторов эфиров целлюлозы фирма British Celanese62 рекомендует добавлять простые или сложные эфиры эпигидри-новых спиртов с температурой кипения выше 200 С. Для расщепления тетрагидрофуранового кольца можно использовать и хлорангидриды тех карбоновых кислот, которые принимают участие в образовании сложного эфира. [35]
Спирты ( алкоголи), затем феиолы; затем S - и Se-аналоги спиртов; затем; сложные эфиры спиртов с неорганическими кислотами; аналогичные производные фенолов в таком же порядке. [37]
В настоящее время в пароструйных насосах используют в основном три типа рабочих жидкостей: минеральные масла, сложные эфиры органических спиртов и кремнийорганические соединения. [38]
Известны различные воскообразные вещества, выделяемые из масел; например, воск церилцеротат, выделенный из подсолнечного масла и представляющий собой сложный эфир цер илового спирта и церотиновой кислоты. [39]
В Советском Союзе был найден дешевый источник для получения синтетической камфары; в пихтовом масле оказалось 30 - 40 % борнилаце-тата - сложного эфира спирта борнеола ( производного камфана) и уксусной кислоты. [40]
Влияние структуры молекулы на свойства сложных эфиров кремневой кислоты во многих случаях такое же, как и в сложных эфирах фосфорной кислоты, поскольку оба эти соединения являются сложными эфирами органических спиртов и неорганических кислот. Различие свойств этих соединений проявляется в основном в различной гидролитической стабильности, в смазывающих свойствах, воспламеняемости и вязкостно-температурных свойствах. [41]
Первая из них содержится в свободном виде в пчелином воске, а также в некоторых других воскообразных веществах, например в китайском воске ( из тли Coccus ceriferus), в виде сложного эфира цери-лового спирта. [42]
Судя по патентной литературе, до сих пор ведутся работы пб усовершенствованию этих основных светочувствительных компонентов Очень популярен триэфир 2 3 4-тригидроксибеизофенона, однако он ограниченно растворим в органических растворителях, особенно в таких широко применяемых, как монометиловый эфир этиленгликоля и сложные эфиры спиртов. [43]
Эти полиэфиры могут быть производными щавелевой, янтарной, глутаровой, адипиновой, пимелиновой, субериновой, азелаиновой, себациновой, дихлорянтарной, тио-дигликолевой, малеиновой, фумаровой, цитраконовой, итаконо-вой, менаконовой, фталевой, изофталевой, терефталевой, мелли-товой, пиромеллитовой, нафталевой, 2 6-нафталиндикарбоновой, тетрахлорфталевой, циановой, дифенил-о о - дикарбоновой кислот, а также ди-п-карбоксифенилового эфира этиленгликоля, триметиленгликоля или тетраметиленгликоля, а [ 3-ди - ( п-карбокси-фенил) - этана и др. Вместо глицидных эфиров могут применяться также сложные эфиры спиртов, содержащих четырехчленное кольцо с кислородом-1 3-эпоксисоединения. [44]
Переэтерификацией называется обменная реакция взаимодействия спирта с эфиром органической или минеральной кислоты, в результате которой образуется сложный эфир исходного спирта. Синтез сложных эфиров низкозамещенных спиртов методом переэтерифи-кации используется не только для препаративных целей, но и в промышленности. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Спирты и их свойства
Главная Учебники - Виноделие
поиск по сайту
Спирты и их свойства
Кислородсодержащие органические соединения
· Спирты,
· Простые эфиры,
· Альдегиды,
· Кетоны,
· Карбоновые кислоты, их ангидриды и галогенангидриды
· Сложные эфиры,
· Фенолы и их простые эфиры.
Спирты
К спиртам относятся соединения, содержащие функциональную группу -OH, связанную с алифатическим радикалом.
Например, Ch3=CH-Ch3-OH, HC≡C-Ch3-OH, Ch4-OH.
аллиловый спирт пропаргиловый спирт метанол
В радикал, соединенный с группой –OH, может входить так же остаток ароматического углеводорода, если он отделён, по крайней мере, одной метиленовой группой.


Классификация спиртов
I.  По
типу атомов углерода, контактирующих с функциональной группой –OH
различают первичные , вторичные и
третичные спирты.
По
типу атомов углерода, контактирующих с функциональной группой –OH
различают первичные , вторичные и
третичные спирты.










Исключение: Ch4-OH (метанол) –он тоже первичный спирт.
II. По количеству гидроксильных групп различают одноатомные, трёхатомные, многоатомные, полиатомные спирты, например:

















Номенклатура и изомерия спиртов
По номенклатуре ИЮПАК в структурной формуле спирта находится самая длинная цепь из атомов углерода, обязательно включающая атом углерода, связанный с гидроксильной группой. Эта цепь нумеруется с той стороны, к которой ближе гидроксил. Сначала называются алкильные радикалы с указанием их места положения в цепи, затем название алкана соответствующего длине выбранной цепи, после чего добавляется окончание спиртов – «ол».
По рациональной номенклатуре атом углерода и связанный с ним гидроксил получают название «карбинол». Сначала называются алкильные радикалы, соединённые с упомянутым выше атомом углерода, а затем слитно слово «карбинол». Ниже в таблице приведены названия спиртов с брутто-формулой С5Н12О по этим видам номенклатур, а также тривиальные (то есть исторически сложившиеся) их названия.
|
C5h22O |
Название по ИЮПАК |
Рациональное название |
Тривиальное название |
|
|
Пентанол - 1 |
н- Бутилкарбинол |
Амиловый спирт |
|
|
Пентанол - 2 |
Метилпропилкарбинол |
- |
|
|
Пентанол - 3 |
Диэтилкарбинол |
- |
|
|
2 – метилбутанол - 1 |
Втор - бутилкарбинол |
- |
|
|
2 - метилбутанол - 2 |
Диметилэтилкарбинол |
Трет – амиловый спирт |
|
|
3 – метилбутанол - 2 |
Метилизопропилкарбинол |
- |
|
|
3 – метилбутанол - 1 |
Изобутилкарбинол |
Изоамиловый спирт |
|
|
2,2 – диметилпропа- нол - 1 |
Трет - бутилкарбинол |
Неопентиловый спирт |
Контрольное задание: написать структурные формулы спиртов C6h24O и дать им названия по номенклатуре ИЮПАК и по рациональной номенклатуре.
Способы получения спиртов
1. Из алканов. Метан может быть селективно окислен на гетерогенном катализаторе – серебре расчётным количеством кислорода до метанола:

Алканы с большим числом атомов углерода ,такие, например, как пропан и бутан, окисляются до смеси первичных и вторичных спиртов расчётным количеством кислорода в присутствии катализаторов – солей марганца. Реакция малоселективна – получается довольно большое количество примесей: альдегидов и кетонов с тем же числом атомов углерода, альдегидов и спиртов – продуктов деструкции

2. Из алкенов. К любому алкену можно присоединить воду в присутствии кислот

Присоединение идёт по правилу Марковникова.
3. Из алкинов. Ацетилен и терминальные алкины, реагируя с формальдегидом, другими альдегидами и кетонами, дают соответственно первичные, вторичные и третичные спирты



Реакции были впервые опубликованы в 1905 году А.Е. Фаворским и носят его имя.
4. Из алкадиенов. Алкадиены аналогично алкенам присоединяют в присутствии кислот воду.
Присоединение первого моля воды идёт преимущественно в положения 1 – 4. При
присоединении второго моля воды образуются диолы. Ниже представлены примеры обоих
случаев:


5. Из галоидных алкилов. Галоидные алкилы вступают с водными растворами щелочей в реакцию нуклеофильного замещения галогена на гидроксил:


 6.
Из дигалоидных производных.
При действии щелочей на дигалоидные производные алканов получаются
двухатомные спирты (или диолы):
6.
Из дигалоидных производных.
При действии щелочей на дигалоидные производные алканов получаются
двухатомные спирты (или диолы):
Как показано выше из 1,2-дибромэтана получается 1,2-этандиол (этиленгликоль). Этот диол очень широко применяется для производства антифризов. Например, в незамерзающей жидкости для охлаждения двигателей внутреннего сгорания – «Тосол-А 40» его 40%.
 7.
Из тригалоидных производных. Из
1,2,3-трихлорпропана, например, получают широко используемый глицерин
(1,2,3-пропантриол).
7.
Из тригалоидных производных. Из
1,2,3-трихлорпропана, например, получают широко используемый глицерин
(1,2,3-пропантриол).
 8.
Из аминов. При
нагревании с парами воды в присутствии катализатора протекает обратимая реакция,
в которой конечными продуктами являются спирт с тем же строением углеродного
скелета и аммиак.
8.
Из аминов. При
нагревании с парами воды в присутствии катализатора протекает обратимая реакция,
в которой конечными продуктами являются спирт с тем же строением углеродного
скелета и аммиак.
Первичные амины можно перевести в спирты так же действием нитрита натрия в соляной кислоте при охлаждении до 2 – 5оС:

 9.
Из альдегидов и кетонов по реакции Меервейна – Понндорфа – Верлея. На
кетон или альдегид действуют каким-либо спиртом в присутствии катализатора –
алкоголята алюминия. В качестве алкоксильных групп берут остатки того же спирта,
который взят в качестве реагента. Например, в приведённой ниже реакции вместе с
нормальным бутиловым спиртом взят трибутилат алюминия. Реакция обратима и
равновесие в ней сдвигают по принципу Ле-Шателье избытком спирта-реагента.
9.
Из альдегидов и кетонов по реакции Меервейна – Понндорфа – Верлея. На
кетон или альдегид действуют каким-либо спиртом в присутствии катализатора –
алкоголята алюминия. В качестве алкоксильных групп берут остатки того же спирта,
который взят в качестве реагента. Например, в приведённой ниже реакции вместе с
нормальным бутиловым спиртом взят трибутилат алюминия. Реакция обратима и
равновесие в ней сдвигают по принципу Ле-Шателье избытком спирта-реагента.
Первые публикации об этой реакции появились практически одновременно в двух разных немецких и одном французском химических журналах в 1925 – 1926 годах. Реакция имеет огромное значение, так как позволяет восстановить карбонильную группу в спиртовую, не восстанавливая двойные связи, нитро- и нитрозогруппы, которые водородом и другими восстановителями переводятся соответственно в простые связи и аминогруппы, например:

Как видно двойная связь, присутствовавшая в кетоне, сохранилась и в полученном спирте. Ниже показано, что при гидрировании кетогруппы одновременно гидрируется и двойная связь.

Аналогичная картина наблюдается и при наличии в кетоне нитрогруппы: в реакции Меервейна –Понндорфа-Верлея она сохраняется, а при гидрировании водородом на катализаторе восстанавливается до аминогруппы:


10. Из альдегидов и кетонов путём гидрирования на катализаторах – металлах платиновой группы: Ni, Pd, Pt :


11. Получение спиртов из альдегидов и кетонов путём синтезов Гриньяра.
Реакции, открытые Франсуа Огюстом Виктором Гриньяром в 1900 – 1920 годах имеют колоссальное значение для синтезов многих классов органических веществ. Так, например, с их помощью можно из любого галоидного алкила и формальдегида в три стадии получить первичный спирт:
 (1)
(1)


Для получения вторичного спирта надо вместо формальдегида взять любой другой альдегид:


При гидролизе такой соли получается спирт с числом атомов углерода равным сумме их в магнийорганическом соединении и в альдегиде:

Для получения третичного спирта вместо альдегида в синтезе используют кетон:



12. Из карбоновых кислот спирты можно получить только в две стадии: на первой из карбоновой кислоты действием пентахлорида фосфора или действием оксиддихлорида серы (IV) получают её хлорангидрид:


На второй стадии, полученный хлорангидрид гидрируют на палладии до спирта:

13. Из алкоголятов спирты очень легко получаются путём гидролиза при комнатной температуре:


Борные эфиры гидролизуются труднее – только при нагревании:

 |
Выпадает в осадок если её больше, чем 4г/100г h3O
14. Из сложных эфиров спирты наряду с карбоновыми кислотами могут быть получены путём автокаталитического, кислотного или щелочного гидролиза. При автокаталитическом процессе в результате очень медленного гидролиза водой появляется слабая карбоновая кислота, которая в дальнейшем ходе реакции играет роль катализатора, заметно ускоряя расход сложного эфира и появление спирта во времени. Например, для реакции втор-бутилового эфира 2-метилпропановой кислоты кинетические кривые, то есть зависимости изменения молярных концентраций во времени представяют собой сигмоиды или S-образные кривые (смотрите график ниже реакции).

15. Если добавить к сложному эфиру сильную кислоту, которая является катализатором, то в
реакции не будет индукционного периода, когда гидролиз почти не идёт (от 0 до 1 времени).
Кинетические кривые в этом случае будут представлять собой экспоненты: нисходящую
для сложного эфира и восходящую для спирта. Процесс называется кислотным гидролизом:

16. Если добавить к сложному эфиру щёлочь (моль на моль или избыток) , то реакция так же описывается экспоненциальными кинетическими кривыми, но в отличие от кислотного гидролиза, где концентрации веществ стремятся к равновесным значениям, здесь конечная концентрация спирта практически равна исходной концентрации эфира. Ниже приведена реакция щелочного гидролиза того же сложного эфира и график с кинетическими кривыми. Как видно щёлочь здесь не катализатор, а реагент, и реакция необратима:


17. Из сложных эфиров спирты можно получить также по Буво и Блану. Этот способ был впервые опубликован авторами в двух разных французских химических журналах в 1903 и 1906 годах и заключается в восстановлении сложных эфиров натрием в спирте, например:

Как видно в реакции получаются два спирта: один из кислотной части сложного эфира и он всегда первичный, второй из спиртовой части и он может быть любым – первичным, вторичным или третичным.
18. Более современный способ получения спиртов из сложных эфиров заключается в восстановлении их комплексными гидридами до алкоголятов (реакция ( 1 ) ), которые затем легко переводятся в спирты путём гидролиза (реакции ( 2а ) и ( 2b ) ), например:



Физические свойства спиртов
Спирты – бесцветные вещества, поглощающие свет в ближней УФ части спектра 200 < αmax < 300 нм. Среди спиртов нет газов ни при нормальных условиях, ни при комнатной температуре. Спирты линейного строения с числом атомов углерода до 12 – жидкости при комнатной температуре. Например, деканол-1 плавится при +7оС, додеканол при 24оС, а тридеканол-1 уже при 30,6оС, то есть он твёрдое вещество при комнатной температуре. Среди спиртов разветвлённого строения даже с небольшим числом атомов углерода появляются твёрдые вещества. Так, например, трет-бутиловый спирт плавится при +25,5оС, тогда как нормальный бутиловый плавится при -89,5оС, изобутиловый при -108оС, а втор-бутиловый спирт при -114,7оС.
Спирты способны образовывать межмолекулярные водородные связи.

Образование
межмолекулярных водородных связей приводит к значительному повышению температур
кипения спиртов по сравнению с веществами, имеющими тот же радикал, но вместо
гидроксильной группы OH –
другие атомы или группы.
Ch4F, Ch4-Cl, Ch4-Br – газы при нормальных условиях.
tкип (C2H5OH) = 78, 5°C tкип (Ch4OH) = 65°C
Ch4-O-Ch4 – газ при комнатной температуре.

Температуры кипения у спиртов–изомеров зависят от строения; у линейных изомеров они самые высокие, у наиболее разветвлённых - самые низкие. Например, у нормального бутилового спирта tкип= 117,7оС, у изобутилового tкип= 107,9оС, а у трет-бутилового tкип= 82,8оС
Спирты – вязкие жидкости. Их вязкость превышает вязкость воды при той же температуре. Метанол, этанол и низшие спирты смешиваются с водой при любой температуре. Начиная со спиртов C4, растворимость становится ограниченной. При увеличении длины углеродной цепи растворимость жидких спиртов в воде резко падает.
Растворимость спиртов в алканах и их смесях, например, в октане или керосине, плохая. Они смешиваются в любых соотношениях с низшими кетонами (ацетоном и метилэтилкетоном). Спирты хорошо растворяются, а чаще – смешиваются в любых соотношениях с кетонами, альдегидами, сложными эфирами с близкой молярной массой. Спирты смешиваются в любых соотношениях или очень хорошо растворимы в полярных органических растворителях: формамиде, ТГФ, диоксане, ДМФА, ДМАА, гексаметаполе, ДМСО и др.
Сами спирты – полярные органические растворители. Они очень хорошо растворяют многие органические вещества: фенол, анилин, нитробензол, галогенпроизводные алканов. Хорошо или очень хорошо растворяются в спиртах также многие соли, например, некоторые из перхлоратов (ClO4-):
|
|
Ch4OH |
C2h4OH |
|
|
Nh5+ |
6,9 |
1,9 |
Хорошо растворяют |
|
Li+ |
188,2 |
151,8 |
Очень хорошо |
|
Na+ |
51,3 |
14,7 |
|
|
K+ |
0,21 |
0,012 |
Умеренно и плохо |
|
Rb+ |
0,06 |
0,009 |
Плохо |
|
Cs+ |
0,09 |
0,011 |
|
|
Mg2+ |
51,8 |
24,0 |
Очень хорошо |
|
Ca2+ |
237,4 |
166,2 |
Превосходно |
|
Sr2+ |
212 |
180,7 |
|
|
Ba2+ |
217,1 |
124,6 |
Растворимость перхлоратов в этой таблице указана в граммах на 100 грамм растворителя.
И метанол, и этанол хорошо растворяют нитрат серебра (AgNO3), роданид аммония (Nh5NCS) и другие соли. В глицерине растворяется до 30% буры (Na2B4O7)
Метанол, этанол, пропанол–2 имеют специфический запах водки.
Спирты C4 – C5 имеют запах сивушных масел. Высшие спирты (воск) практически не пахнут. Некоторые спирты, содержащие бензольные кольца, могут хорошо пахнуть, например, 2-фенилэтанол
 пахнет
розой, а 2,6-диметилгептанол-2 имеет тонкий цветочный запах с оттенком аромата
земляники.
пахнет
розой, а 2,6-диметилгептанол-2 имеет тонкий цветочный запах с оттенком аромата
земляники.
Химические свойства спиртов
Спирты являются очень слабыми кислотами .Их pKa = 16-18. Однако они гораздо более сильные кислоты, чем ацетилен (рКа= 22) и аммиак (рКа=35). Поэтому легко, при комнатной температуре низшие спирты реагируют с ацетиленидами щелочных металлов и с амидом натрия:


Со щелочами спирты реагируют обратимо. Равновесие сильно смещено в сторону исходных веществ, так как вода значительно более сильная кислота, чем спирты:

В связи с этим при реакциях галогенпроизводных бензола со щелочами, проводимых в спирте, получается больше продукта I, чем II, так как


скорость реакции с метилат –ионом намного выше, чем с гидроксид-ионом, хотя последнего в равновесии больше.
Спирты могут взаимодействовать с очень многими реагентами. Ниже приведены наиболее важные из этих реакций:
Спирты реагируют с активными металлами:


Реакции, приведённые ниже, используются для абсолютирования спиртов, то есть для удаления из них воды путём её химического связывания. К магниевым стружкам приливают
спирт, содержащий около 4% воды, и кипятят, добавляя йод для активации первой реакции:

Полученный этилат магния самопроизвольно реагирует с водой – обычный гидролиз соли слабого основания и слабой кислоты:

С менее активными металлами, такими как Al, Zn, Fe спирты не реагируют.
Спирты могут реагировать с концентрированными галогеноводородными кислотами в присутствии ZnCl2 (р. Лукаса):



Эти реакции – хороший пример для иллюстрации положения теории А.М.Бутлерова о влиянии строения на химические свойства. Как видно скорость реакции с одним и тем же реагентом в случае третичных спиртов намного выше, чем для вторичных, а те в свою очередь реагируют быстрее первичных.
С кислородсодержащими кислотами спирты реагируют с образованием сложных эфиров этих кислот:



Спирты реагируют с аммиаком. Реакция обратима. Равновесие в ней смещают вправо избытком аммиака в соответствии с принципом Ле-Шателье:

 Спирты реагируют с
аминами.
Спирты реагируют с
аминами.

При межмолекулярной дегидратации спиртов образуются простые эфиры:

 При
дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия
равновесие смещают вправо, понижая давление, так как
в реакции из одного моля
газа получается
два (в
соответствии с принципом Ле-Шателье)
При
дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия
равновесие смещают вправо, понижая давление, так как
в реакции из одного моля
газа получается
два (в
соответствии с принципом Ле-Шателье)
При внутримолекулярной дегидратации получаются алкены. В соответствии с правилом Зайцева водород преимущественно отщепляется от менее гидрогенизированного атома углерода из двух соседних с тем атомом углерода, который связан с гидроксилом

Спирты взаимодействуют с непредельными углеводородами:


При реакции спиртов с ацетиленом получаются очень важные для синтеза полимеров виниловые эфиры:

Алкадиены со спиртами так же дают непредельные простые эфиры:

С аренами спирты не реагируют. Они не реагируют также с галогенпроизводными алканов. Однако соли спиртов – алкоголяты реагируют с ними очень легко. В результате реакции получаются простые эфиры (лучший способ получения несимметричных простых эфиров):

 Реакция спиртов
с альдегидами (получение
полуацеталей).
Реакция спиртов
с альдегидами (получение
полуацеталей).
 При
реакции спиртов с полуацеталями получаются ацетали:
При
реакции спиртов с полуацеталями получаются ацетали:
Полуацетали и ацетали, как правило, обладают хорошим запахом, выделяются из растений и часто служат компонентами парфюмерных композиций.
Реакция спиртов с кетонами аналогична их взаимодействию с полуацеталями, но проходит в более жестких условиях.


Спирты взаимодействуют с альдегидами и кетонами по реакции Меервейна – Понндорфа – Верлея, о которой было подробно рассказано в пункте 9 способов получения спиртов. Здесь приведём другой пример этой реакции:

 Спирты взаимодействуют
также и с карбоновыми кислотами.
При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией
этерификации.
Спирты взаимодействуют
также и с карбоновыми кислотами.
При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией
этерификации.
Спирты могут взаимодействовать также со сложными эфирами. Получается новый спирт и новый сложный эфир. Реакция носит характер обратимой , катализируется кислотами и называется реакцией переэтерификации спиртом. Она очень широко применяется в синтезах душистых веществ для парфюмерных композиций.

Спирты могут окисляться в различных условиях до различных продуктов:
а) При горении:

б) При окислении паров первичных и вторичных спиртов оксидом меди получаются соответственно альдегиды и кетоны, например:


в) При дегидрировании спиртов на катализаторах платиновой группы первичные спирты окисляются до альдегидов, а вторичные - до кетонов:


При окислении спиртов в жидкой фазе в кислой среде сильными окислителями, такими как перманганат калия, дихромат калия или висмутат натрия первичные спирты окисляются до карбоновых кислот. Вторичные - до кетонов. Например, этанол до уксусной кислоты:

Изопропиловый спирт окисляется до кетона (до пропанона )

 Окисление третичных
спиртов идет
Окисление третичных
спиртов идет
только при нагревании с разрывом C-C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
Если все алкильные радикалы одинаковы, то реакция может быть уравнена. Ниже приведена реакция окисления третичного спирта – триэтилкарбинола висмутатом натрия в среде разбавленной азотной кислоты:

Особенности способов получения и реакционной способности двух- и многоатомных спиртов.
Наряду со способами аналогичными способам получения одноатомных спиртов, двухатомные спирты могут быть получены путём окисления алкенов по Вагнеру, например:

При присоединении воды к
эпоксисоединениям так же
получаются диолы: 
Трёхатомный спирт – глицерин может быть получен, например, по приведённой ниже цепи превращений:

Двух- и многоатомные спирты вступают во все те же реакции, в которые вступают одноатомные спирты, правда реакция может идти ступенчато, например:


При взаимодействии многоатомных спиртов с гидроксидами тяжелых металлов, таких как хром, свинец , висмут и медь в щелочной среде образуются хорошо растворимые в воде комплексные соединения. Медный комплекс ярко окрашен в сине-фиолетовый цвет. Для образования комплексов необходимо, чтобы гидроксильные группы в спиртах находились у соседних атомов углерода.

Незаряженные комплексы такого типа могут из водного раствора переходить в органические растворители , например, в 1,2-дихлорэтан или в хлороформ.
В трёхатомных спиртах, а так же и в спиртах с большим количеством гидроксильных групп, в образовании комплекса участвуют только два стоящих рядом гидроксила. Например, в комплексе из глицерина и катиона меди (II):

ПРИМЕНЕНИЕ И МЕДИКО-БИОЛОГИЧЕСКОЕ
ЗНАЧЕНИЕ СПИРТОВ
Простейший спирт – метанол очень широко применяется как исходное сырьё в многочисленных органических синтезах. Например, для синтеза формальдегида, метилмеркаптана, метиламина, сложных эфиров многих карбоновых кислот, которые в свою очередь применяются как пластификаторы, растворители, душистые вещества в парфюмерии и компоненты пищевых эссенций. Очень важным является синтез уксусной кислоты из метанола и угарного газа:

Этот способ производства уксусной кислоты вытеснил вредный с позиции экологии способ её синтеза из ацетилена через ацетальдегид по Кучерову, так как в нём получается большое количество ртутьсодержащих сточных вод.
Не менее важным является использование метанола в синтезе метилакрилата из ацетилена , угарного газа и этого спирта:

Метанол используется также как растворитель, антифриз и моторное топливо. Им растворяют пробки, образующиеся из замёрзшего конденсата в газопроводах на крайнем севере.
Метанол чрезвычайно токсичен. 7- 10 мл его достаточно для того, чтобы мужчина с массой тела около 70 кг ослеп. Выпитые по ошибке 25 – 30 мл приводят к летальному исходу. Важно знать, что токсичен не сам метанол, а продукты его окисления под действием ферментов – формальдегид и муравьиная кислота. Поэтому, если занять ферменты окислением гораздо менее опасного для человека этанола (в виде водки, принимаемой постоянно в течение трёх суток), то пациента можно спасти.
В мире производится около 30 миллионов тонн метанола в год.
Этанол применяется в производстве ацетальдегида, хлороформа, диэтилового эфира, этилацетата, уксусной кислоты, дивинила, многих душистых веществ для парфюмерии. Кроме того он применяется как растворитель лакокрасочных материалов, взрывчатых и лекарственных веществ. Этиловый спирт, получаемый путём брожения пищевого сырья, применяется при изготовлении алкогольных напитков, растворения и перекристаллизации лекарственных препаратов. Этанол – наркотик, возбуждающе действующий на организм; его постоянное (важно знать любителям пива) или периодическое, но неумеренное употребление ведёт к алкоголизму – тяжёлой болезни, заканчивающейся циррозом печени и полной деградацией личности. В мире производится около 3 миллионов тонн этанола в год.
Пропанол-1 широко применяется как растворитель для восков, природных и синтетических смол. Как исходное вещество в синтезе лекарственных препаратов, душистых веществ для парфюмерных композиций, сложных эфиров – растворителей лакокрасочных материалов, пестицидов.
Пропанол-2 широко применяется как растворитель ацетатов целлюлозы, этилцеллюлозы, целлофана, эфирных масел, алкалоидов. Как исходное вещество он применяется в синтезах ацетона, изорпопиламина, изопропилацетата , косметических, моющих и лекарственных средств.
Изопропиловый спирт входит в состав жидкостей для размораживания замков и в состав «жидкого ключа», помогающего отворачивать гайки, например, на колёсах автомобилей.
Бутанол-1 применяется как растворитель лакокрасочных материалов, как исходное вещество в синтезе душистых веществ для парфюмерных композиций, пластификаторов для полимерных материалов, гербицидов.
Бутанол-2 применяется как высокооктановый ( ОЧ = 110 ) компонент моторных топлив, как исходное вещество в синтезах. В мире производится около 1 миллиона тонн бутанола-2 в год.
Изобутиловый спирт ( 2-метилпропанол-1 ) применяется как растворитель лакокрасочных материалов и азотнокислых эфиров целлюлозы (взрывчатые вещества, ракетное топливо). Он используется так же в синтезах душистых веществ, пластификаторов для полимеров, гербицидов.
Трет-бутиловый спирт ( 2-метипропанол-2 )в огромных масштабах используется для получения путём дегидратации изобутилена ( 2-метилпропена ), который идёт как мономер для производства полиизобутилена. Последний с малой степенью полимеризации ( 15 – 50 ) служит как присадка к моторным маслам, а с большой (десятки тысяч) как материал для защиты от коррозии аппаратов большого объёма в химической промышленности. Трет-бутиловый спирт используется так же в производстве инициаторов полимеризации.
Высшие спирты ( С6 – С20 ) применяются по-разному в зависимости от длины углеродной цепи. Спирты ( С6 – С8 ) как флотореагенты, как экстрагенты солей Co, V и U, как растворители для синтетических смол, как сырьё в производстве пластификаторов. Спирты ( С10 – С20 ) как компоненты пеногасителей, смазочно-охлаждающих жидкостей, текстильно-вспомогательных веществ, косметических составов. Метакриловые эфиры спиртов ( С7 – С9 ) как депрессорные присадки к моторным топливам и маслам. Натровые и аммонийные соли сернокислых эфиров спиртов ( С10 – С20 ) как синтетические моющие средства, способные стирать в жёсткой и морской воде.
Этиленгликоль ( 1,2-этандиол ) очень широко применяется как компонент антифризов для охлаждения двигателей внутреннего сгорания. Эти антифризы обеспечивают хороший отвод тепла на рабочих режимах двигателя и не замерзают при отрицательных температурах, как вода. Отечественная промышленность выпускает антифризы «Тосол –А 40» и «Тосол –А 60». Первый содержит 40% этиленгликоля и 60% воды и предназначен для работы в средней полосе России, а второй содержит 60% этиленгликоля и 40% воды и используется на крайнем севере. Кроме того этиленгликоль широко применяется в синтезе полиэтилентерефталата, из которого производят волокно лавсан ( за границей терилен, дакрон, ямболен и другие ). Из этиленгликоля получают так же многочисленные сложные эфиры. Например, дибутиловый эфир этиленгликоля используют как реагент для выделения Bi(III), Po(IV) и U(IV) из водных растворов. Этиленгликоль входит так же в состав гидравлических, тормозных и закалочных жидкостей. В мире производится около 20 миллионов тонн этиленгликоля в год.
Глицерин ( 1,2,3-триоксипропан, 1,2,3-пропантриол ) применяется для производства тринитрата 1,2,3-пропантриола, неправильно называемого нитроглицерином. Нитрогглицерин одновременно является взрывчатым веществом и препаратом для снятия сердечных приступов.
Глицерин является сырьём в производстве алкидных смол, акролеина, полиуретанов. Он входит в состав эмульгаторов, моющих средств, антифризов, косметических и парфюмерных препаратов, медицинских мазей и растворов, кремов для обуви. В некоторых алкогольных напитках до 15%
глицерина. Глицерин абсолютно не токсичен. В виде фрагмента он входит в состав всех жиров и некоторых других липидов.
Пентаэритрит (2,2-диметилол-1,3-пропандиол) широко применяется как исходное вещество в синтезе синтетических смазочных масел повышающих моторесурс турбозубчатых агрегатов в 5 – 6 раз. Он является также сырьём в производстве алкидных смол, тетранитропентаэритрита, поверхностно-активных веществ и пластификаторов.
Поливиниловый спирт применяется в производстве волокон для хирургии, как компонент кровезаменяющих составов и некоторых готовых выпускных форм, например, «йодинола», как эмульгатор. В мире производится около 1 миллиона тонн поливинилового спирта в год.
Содержание
Кислородсодержащие органические соединения………………………………………………………………..1 Спирты. Определение……………………………………………………………………………………………………………..1
Классификация спиртов:
по типу атомов углерода, контактирующих с функциональной группой «ОН»……………………1
по количеству гидроксильных групп ……………………………………………………………………………………..2
Номенклатура и изомерия спиртов ……………………………………………………………………………………….2
Способы получения спиртов:
1. Из алканов…………………………………………………………………………………………………………………….4
2. Из алкенов…………………………………………………………………………………………………………………….4
3. Из алккинов…………………………………………………………………………………………………………………..4
4. Из алкадиенов………………………………………………………………………………………………………………5
5. Из галоидных алкилов………………………………………………………………………………………………….6
6. Из дигалоидных производных…………………………………………………………………………………….7
7. Из тригалоидных производных……………………………………………………………………………………7
8. Из аминов……………………………………………………………………………………………………………………..7
9. Из альдегидов и кетонов по реакции Меервейна-Понндорфа-Верлея……………………..7
10. Из альдегидов и кетонов путём гидрирования в присутствии катализаторов………….9
11. Из альдегидов и кетонов и галоидных алкилов путём синтезов Гриньяра…………….11
12. Из карбоновых кислот через галогенангидриды, которые гидрируют……………………11
13. Из алкоголятов……………………………………………………………………………………………………………12
14. Из сложных эфиров путём автокаталитического гидролиза…………………………………….13
15. Из сложных эфиров путём кислотного гидролиза…………………………………………………….13
16. Из сложных эфиров путём щелочного гидролиза…………………………………………………….14
17. Из сложных эфиров восстановлением по Буво и Блану……………………………………………15
18. Из сложных эфиров восстановлением комплексными гидридами…………………………15
Физические свойства спиртов…………………………………………………………………………………………16
Отношение спиртов к свету…………………………………………………………………………………………….16
Агрегатное состояние спиртов при различных температурах……………………………………….16
Зависимость температур плавления спиртов-изомеров от строения…………………………..16
Межмолекулярные водородные связи в спиртах………………………………………………………….17
Влияние водородных связей в спиртах на их физические свойства……………………………..17
Зависимость температур кипения спиртов-изомеров от строения……………………………….17
Вязкость спиртов………………………………………………………………………………………………………………17
Растворимость спиртов в воде и органических растворителях……………………………………..17
Спирты как растворители органических и неорганических веществ…………………………….18
Запах спиртов…………………………………………………………………………………………………………………..18
Химические свойства спиртов…………………………………………………………………………………………18
Спирты как слабые кислоты…………………………………………………………………………………………….19
Реакция спиртов с ацетиленидами металлов…………………………………………………………………19
Реакция спиртов с амидами щелочных металлов………………………………………………………….19
Реакция спиртов со щелочами……………………………………………………………………………………….19
Активированное нуклеофильное замещение атомов галогенов в ароматическом
ядре равновесной смесью спиртов и их алкоголятов……………………………………………………19
Реакция спиртов с активными металлами……………………………………………………………………..19
Абсолютирование этанола………………………………………………………………………………………………19
Гидролиз алкоголятов……………………………………………………………………………………………………..20
Реакция спиртов с концентрированными галогеноводородными кислотами
( реактивом Лукаса )………………………………………………………………………………………………………..20
Реакция спиртов с кислородсодержащими неорганическими кислотами…………………..20
Реакция спиртов с аммиаком и аминами……………………………………………………………………….21
Межмолекулярная дегидратация спиртов…………………………………………………………………….21
Внутримолекулярная дегидратация спиртов…………………………………………………………………22
Реакция спиртов с алкенами…………………………………………………………………………………………..22
Реакция спиртов с ацетиленом……………………………………………………………………………………….23
Реакция спиртов с алкадиенами……………………………………………………………………………………23
Реакции алкоголятов с галоидными алкилами……………………………………………………………..23
Реакция спиртов с альдегидами…………………………………………………………………………………….23
Реакция спиртов с полуацеталями………………………………………………………………………………..24
Реакция спиртов с кетонами………………………………………………………………………………………….24
Реакция спиртов с полукеталями…………………………………………………………………………………..24
Реакция спиртов с альдегидами и кетонами по Меервейну-Понндорфу-Верлею……..24
Реакция спиртов с карбоновыми кислотами – реакция этерификации………………………25
Реакция спиртов со сложными эфирами – реакция переэтерификации…………………….25
Горение спиртов…………………………………………………………………………………………………………….25
Окисление первичных спиртов до альдегидов…………………………………………………………….25
Окисление вторичных спиртов до кетонов……………………………………………………………………25
Дегидрирование первичных спиртов до альдегидов…………………………………………………..26
Дегидрирование вторичных спиртов до кетонов…………………………………………………………26
Окисление спиртов сильными окислителями в жидкой фазе в кислой среде…………..26
Особенности способов получения и реакционной способности двух- и много-
атомных спиртов…………………………………………………………………………………………………………….27
Получение диолов из алкенов по Вагнеру…………………………………………………………………….27
Получение диолов из эпоксидных соединений…………………………………………………………….28
Получение глицерина из простых и неорганических веществ……………………………………..28
Ступенчатая этерификация диолов карбоновыми кислотами………………………………………28
Образование комплексных соединений из гидроксидов тяжёлых металлов
и двух- или трёхатомных спиртов…………………………………………………………………………………..29
Применение и медико-биологическое значение спиртов……………………………………………29
Применение метанола и его токсические свойства………………………………………………………29
Применение этанола, его токсические свойства и медико-биологическое значение…………………………………………………………………………………………………………………………..30
Применение пропанола-1 ……………………………………………………………………………………………..30
Применение пропанола-2……………………………………………………………………………………………….30
Применение бутанола-1 ………………………………………………………………………………………………..30
Применение бутанола-2 …………………………………………………….…………………………………………..30
Применение изобутилового спирта……………………..…………………………………………………………31
Применение трет-бутилового спирта……………………..……………………………………………………31
Применение высших спиртов……………………..………..…………………………………………………………31
Применение этиленгликоля…………………………………………………………………………………………….31
Применение и медико-биологическое значение глицерина………………………….……….…….31
Применение пентаэритрита…………………………………………………………………………………………….31
Применение поливинилового спирта и его и медико-биологическое значение………….32
Содержание………………………………………………………………………………………………………………………32
zinref.ru
Эфир - высший спирт - Большая Энциклопедия Нефти и Газа, статья, страница 3
Эфир - высший спирт
Cтраница 3
Однако для обеспечения некоторых свойств, повышающих качество полимеров метилметакрилового эфира, интерес могут представлять и другие эфиры метакриловой кислоты. В частности, эфиры высших спиртов и метакриловой кислоты очень ценны для получения сополимеров, а эфиры двух - и многоосновных спиртов для получения нерастворимых и неплавких полимеров, имеющих строение трехмерных молекул. [31]
Метиловый и этиловый спирты и их эфиры, а также формальдегид и ацетальдегид не мешают определению. Мешают фенолы, эфиры высших спиртов и ацетон, если количество его в 10 раз больше спирта. [32]
Селективность двух последних реакций также достаточно высока: реакция с ванадийоксихинолиновым комплексом позволяет идентифицировать спирты в присутствии большинства ЛОС, за исключением фенолов. Реакция с п-диметиламинобензальдегидом дает положительную пробу на фенолы, эфиры высших спиртов и кетоны. При этом, однако, следует учитывать, что сведения о мешающих определению ЛОС по этим двум реакциям [5, 27] неполные. [33]
Подобные эфиры содержатся во многих афпрных маслах, а эфиры высших спиртов представляют собой существенную составную часть воска. Метиловый и этиловый спирты обнаружены в растениях в свободном виде. [34]
Наименьшей растворимостью обладают полимерные метиловые эфиры, абсолютно нерастворимые в бензинах и минеральном масле. Близки к ним этиловые эфиры, но уже бутиловые и, особенно, эфиры высших спиртов, набухают или растворяются в указанных растворителях. [35]
Спирты с меньшей длиной цепи не обеспечивают достаточной растворимости. Спирты же с большей длиной цепи придают смолам более высокую растворимость и лучшую совместимость, чем бутиловый спирт, однако этерификация высшими спиртами протекает очень медленно. Практически эфиры высших спиртов могут быть получены лишь путем переэтер. [36]
Недостаток диазометана как метилирующего реагента заключается в том, что удаление его избытка путем упаривания сопровождается потерей продуктов реакции вследствие очень высокой летучести метиловых эфиров некоторых аминокислот. Поэтому были изучены эфиры высших спиртов - пропилового, бутилового и аллилового ( см. [187], с. Поскольку аминокислоты нерастворимы в высших спиртах, сначала получают их метиловые эфиры, которые затем путем реакции переэтерификации превращают в эфиры высших спиртов. Эфиры обычно ацилируют ангидридами кислот в дихлорметане, этилацетате или ацетонитриле. Следует подчеркнуть, что этери-фикация всегда должна предшествовать ацилированию, поскольку О - и N-ацилпроизводные неустойчивы в условиях этерификации. Установлено, что наиболее подходящими для газохроматографи-ческого анализа являются ацетил -, пропионил - и трифторацетил-производные этилового, пропилового и бутилового эфиров аминокислот. Фторированные производные особенно удобны при использовании детектора по захвату электронов и масс-спектро-метрического метода химической ионизации отрицательными ионами. Согласно данным работы [211], детектор по захвату электронов позволяет обнаружить производные цистеина и метиони-на в количестве соответственно 2 1 пг. При получении н-бутиловых эфиров отпадает необходимость переэтерификации, поскольку аминокислоты можно превратить в указанные эфиры непосредственно путем их взаимодействия со спиртами. [37]
Аналогичная закономерность обнаружена для ацетобутиратов целлюлозы различной степени замещения. Наиболее мягкие массы получены сочетанием с диотиленгликольдипропионатом или низшими фталатами, наиболее жесткие - с трифенилфосфатом, а также этиламидомтолуолсульфокислоты. Расположение в разных плоскостях эфирных групп в эфирах высших спиртов, например в октаацетате сахарозы, приводит к заметному снижению пластифицирующего действия в противоположность влиянию длинных алифатических цепей. [38]
В состав органодисперсий входят желатинирующие, ограниченно совместимые пластификаторы и пластификаторы, которые не желатинируют поливинилхлорид даже при нагревании. Желатинирующими пластификаторами служат фталаты и их смеси с трикрезилфосфатом, к ограниченно совместимым относятся адипинаты, себацинаты, 40 % - ные хлорпарафины, эпоксидиро-ванные масла и др. Они уменьшают вязкость дисперсии и обеспечивают повышенную стабильность при хранении. К нежелатинирующим пластификаторам относятся эфиры жирных кислот, эфиры высших спиртов ( С. Сэ) и ненасыщенных дикарбоновых кислот ( 4 - Се) и др. Добавление их способствует снижению вязкости дисперсии, улучшает твердость и механические свойства покрытий и стойкость к царапанию, некоторые уменьшают способность к накоплению статического электричества. [39]
В состав органодисперсий входят желатинирующие, ограниченно совместимые пластификаторы и пластификаторы, которые не желатинируют поливинилхлорид даже при нагревании. Желатинирующими пластификаторами служат фталаты и их смеси с трикрезилфосфатом, к ограниченно совместимым относятся адипинаты, себацинаты, 40 % - ные хлорпарафины, эпоксидиро-ванные масла и др. Они уменьшают вязкость дисперсии и обеспечивают повышенную стабильность при хранении. К нежелатинирующим пластификаторам относятся эфиры жирных кислот, эфиры высших спиртов ( Ст - Сэ) и ненасыщенных дикарбоновых кислот ( С4 - Се) и др. Добавление их способствует снижению вязкости дисперсии, улучшает твердость и механические свойства покрытий и стойкость к царапанию, некоторые уменьшают способность к накоплению статического электричества. [40]
Одноатомные спирты в виде их соединений с кислотами ( так называемых сложных эфиров) широко распространены в растительном мире. Подобные эфиры содержатся во многих эфирных маслах, а эфиры высших спиртов представляют собой существенную составную часть воска. Метиловый и этиловый спирты обнаружены в растениях в свободном виде. [41]
Значительную часть акрилатов, особенно к-бутилакрилат, в настоящее время вырабатывают из ацетилена ( см. стр. Наилучшим промышленным способом получения метилакрилата является так называемый стехиометри-ческий способ [2052, 2053], согласно которому начало реакции ускоряется прибавлением к реакционной смеси небольшого количества готового эфира. Наоборот, непрерывный каталитический способ [2045] хорошо зарекомендовал себя при получении эфиров высших спиртов. Это относится главным образом к получению к-бутилакрилата в присутствии комплексного катализатора - производного трифенилфосфония [2041-2043] ( см стр. [42]
Реакция проводится следующим образом: к эквимолекулярной смеси спирта и серной кислоты при 130 - 140 С приливают спирт с такой скоростью, с какой отгоняется образующийся эфир. При этом частично образуется алкен ( см. стр. Практически одна весовая часть серной кислоты обеспечивает получение 200 весовых частей эфира. Этот метод непригоден для получения эфиров высших спиртов, так как при дегидратации последних в присутствии серной кислоты образуются преимущественно алкены. [43]
Реакция проводится следующим образом: к эквимолекулярной смеси спирта и серной кислоты при 130 - 140 приливают спирт с такой скоростью, с какой отгоняется образующийся эфир. При этом частично образуется алкен ( см. стр. Практически одна весовая часть серной кислоты обеспечивает получение 200 весовых частей эфира. Этот метод непригоден для получения эфиров высших спиртов, так как при дегидратации последних в присутствии серной кислоты образуются преимущественно алкены. [44]
Реакция проводится следующим образом: к эквимолекулярной смеси спирта и серной кислоты при 130 - 140 С приливают спирт с такой скоростью, с какой отгоняется образующийся эфир. При этом частично образуется алкен ( см. стр. Практически одна весовая часть серной кислоты обеспечивает получение 200 весовых частей эфира. Этот метод непригоден для получения эфиров высших спиртов, так как при дегидратации последних в присутствии серной кислоты образуются преимущественно алкены. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Эфир - многоатомный спирт - Большая Энциклопедия Нефти и Газа, статья, страница 1
Эфир - многоатомный спирт
Cтраница 1
Эфиры многоатомных спиртов получают прямой этерификацией К. С ( с катализаторами или без них) Применение: адгезионные добавки в произ-ве водо - и термостойких лаков и красок, окрашенных полимерных изделий. Канифольное мыло-натриевые ( реже калиевые) соли К. Обладает высокой моющей способностью, растворяет жиры, образует стабильные коллоидные р-ры с орг. [1]
Эфиры многоатомных спиртов и жирных кислот мигрируют из пленок триацетата целлюлозы в количествах от 2 до 16 % в расчете на вес пленки, причем быстрее всего мигрируют эфиры бутиленгликоля. В случае эфиров тиодигликолевой кислоты тенденция к миграции увеличивается с удлинением цепи спиртового радикала. Понижение температуры размягчения пленок бензилцеллюлозы при проникновении в нее эфиров тиодигликолевой кислоты и спиртов С7 э приводит к склеиванию всей системы. [2]
Простые хлоргидрииовые эфиры многоатомных спиртов могут быть получены также переэтерификацией соответствующих метиловых эфиров с помощью монохлор-гидрина глицерина. [3]
Все эфиры многоатомных спиртов характеризуются сильной полосой в области 1100 см-1, относящейся, по всей вероятности, к колебанию нескольких С-О связей. Эта полоса появляется в интервале 1090 - 1120 см - либо в виде дублета, либо в виде одиночной полосы. Такая же полоса должна была бы наблюдаться в спектрах эфиров пентаэритрита ( рис. 5), но в рассмотренном нами спектре эфира пентаэритрита и кислот С5 - С8 ее не видно, вероятно, вследствие ее низкой интенсивности. [4]
Из эфиров многоатомных спиртов особенно важными являются эфиры глицерина, представляющие животные и растительные жиры и масла. [5]
Из эфиров многоатомных спиртов наибольший интерес представляют в основном эфиры триметилолэтана и триметилолпропана; спирты, необходимые для таких эфлров, производятся в промышленных масштабах путем оксосинтеза. [6]
ДЭГ представляет собой эфир многоатомного спирта, хорошо растворимый в воде и незначительно в легких углеводородах. [7]
Сложные эфиры двухосновных карбоновых кислот и эфиры многоатомных спиртов являются хорошими смазками различных современных приборов, аппаратов и механизмов, требующих от смазочных материалоя качеств, которых не имеют минеральные смазочные масла и животные жиры. [8]
Масла на основе эфиров двухосновных кислот и эфиров многоатомных спиртов имеют малую летучесть, хорошие антиизносные свойства, незначительную коксуемость, стабильны к окислению при температурах до 175 С и не агрессивны к металлам. [9]
То же самое имеет место и для эфиров многоатомных спиртов, в данном случае для жиров. При действии одной частицы серной кислоты вытесняется одна частица органической кислоты. [10]
Для получения моющих, чистящих и диспергирующих веществ оксиалкиль-ные эфиры жирных многоатомных спиртов, содержащих в молекуле более двух углеродных атомов, могут быть этерифицированы жирными соединениями, содержащими в молекуле более пяти углеродных атомов, причем два гидроксила оставляют неэтерифицированными. Такими соединениями являются гекса - ( 2-гидрокси-этил) - эфиры сорбита и лавровой кислоты, линолевой кислоты, кислоты кокосового масла или кислоты, получающиеся при окислении парафиназзЬ и содержащие от 8 до 11 углеродных атомов. [11]
Смоляные кислоты канифоли вводят в полиэфиры или непосредственно в виде свободных смоляных кислот, или в виде эфиров многоатомных спиртов ( этиленгликоля, глицерина, пентаэритрита) и смоляных кислот канифоли. [12]
Из табл. 1 следует, что по частоте VGO возможно идентифицировать только два типа эфиров: полиметакрилаты и эфиры многоатомных спиртов. Остальные три группы сложных эфиров устанавливаются лишь по характерным особенностям в других частях спектра. В ряде случаев, помимо определения типа сложного эфира, возможна и более детальная идентификация внутри группы. [13]
Для предотвращения слипания ( схватывания) резьбовых соединений пластмассовых деталей предложено41 наносить на них смазки, содержащие полиэтилен, парафин, частичные эфиры многоатомных спиртов ( глицерина, пентаэритритола) и жирных кислот. [14]
Для инвертных эмульсий используют олеофильные эмульгаторы различные нефтехимические продукты, например окисленный парафин, нефтяные контакты, а также ионогенные ПАВ, эфиры многоатомных спиртов и ненасыщенных жирных кислот и ряд других продуктов, число которых непрерывно растет. Как правил о родним каким-либо реагентом не удается обеспечить стабилизацию нефтяных и инвертных растворов. Многофункциональность действия обеспечивает применение нескольких, взаимодополняющих эмульгаторов. В рецептурах инвертных эмульсий стабилизаторами являются асфальто-смо-листые вещества битумов, а также высоко дисперсная твердая фаза, в частности аминированные бентониты и добавки сажи, графита, извести. Для повышения тиксотропии и устойчивости инвертных эмульсии и нефтяных растворов, особенно при нагревании, используются различные мыла, вещества гидрофобизирующие и ингибирующие твердую фазу и препятствующие обращению эмульсий. [15]
Страницы: 1 2 3
www.ngpedia.ru
Сложный эфир - спирт - Большая Энциклопедия Нефти и Газа, статья, страница 4
Сложный эфир - спирт
Cтраница 4
Кроме упоминавшейся камфоры, некоторые другие бициюшческие мо-нотерпеноиды интересны как вещества, оказывающие физиологическое действие на человеческий организм. Например, сложный эфир фенхилового спирта и дипептида, состоящего из остатков аминомалоновой и аспараги-новой кислот 2.117, известен как одно из самых сладких химических соединений. [46]
Последний в момент образования распадается подобно серновинным кислотам, с которыми вполне сходен. Серно-винные кислоты - сложные эфиры спирта и серной кислоты, иодгидрин - сложный эфир спирта и йодисто-водородной кислоты. Серно-винные кислоты разлагаются при нагревании на кислоту и непредельный углеводород. Иодгидрин метил-изопропил-карбинола разлагается без нагревания на HJ и триметил-этилен, существующие один момент и немедленно снова соединяющиеся уже в ином порядке. [47]
Производить этерификацию фталевой или адишшовой кислотой для отделения спиртов от углеводородов будет иметь смысл только в том случае, если образующиеся при этом сложные эфиры найдут техническое применение непосредственно как таковые. Так, например, сложные эфиры спиртов с Г) - 10 атомами углерода могут быть использованы в качестве мягчителей для искусственных смол или как специальные смазочные масла. Однако в спирто-углеводородных смесях еще присутствуют так называемые вязкие масла, высококипящие побочные продукты, образовавшиеся в стадии гидроформилирования и состоящие из ацеталей, продуктов полимеризации и конденсации альдегидов и пр. Эти вещества будут загрязнять сложные эфиры спиртов, и поэтому спирто-углеводородную смесь перед этерифика-цией освобождают от них простой перегонкой. При перегонке одновременно можно отобрать некоторое количество головных погонов, не содержащих спиртов, в результате чего будет достигнута более высокая концентрация спиртов в спирто-углсводородной смеси. Этерификацию фталевой, адипи-новой или метиладипшювой кислотами производят в присутствии неболь-тих количеств минеральной кислоты. После этого нейтральные масла отделяют перегонкой. [48]
Производить этерификацию фталевой или адипиновой кислотой для отделения спиртов от углеводородов будет иметь смысл только в том случае, если образующиеся при этом сложные эфиры найдут техническое применение непосредственно как таковые. Так, например, сложные эфиры спиртов с Г) - 10 атомами углерода могут быть использованы в качестве мягчителей для искусственных смол или как специальные смазочные масла. Однако в спирто-углеводородных смесях еще присутствуют так называемые вязкие масла, высококипящие побочные продукты, образовавшиеся в стадии гидроформилирования и состоящие из ацеталей, продуктов полимеризации и конденсации альдегидов и пр. Эти вещества будут загрязнять сложные эфиры спиртов, и поэтому спирто-углеводородную смесь перед этерифика-циен освобождают от них простой перегонкой. При перегонке одновременно можно отобрать некоторое количество головных погонов, не содержащих спиртов, в результате чего будет достигнута более высокая концентрация спиртов в спирто-углеводородной смеси. Этерификацию фталевой, адипиновой или метиладипиновой кислотами производят в присутствии небольших количеств минеральной кислоты. После этого нейтральные масла отделяют перегонкой. [49]
Омыление жиров п масел является одним из наиболее важных методов получения многих карболовых кислот. Жиры и масла представляют собой сложные эфиры трехатомпого спирта глицерина: т различных средних и высших жирных кислот. [50]
Углеводороды, простые эфиры и сложные эфиры спиртов не мешают определению альдегидов и кетонов. [51]
Эти полиэфиры могут быть производными щавелевой, янтарной, глутаровой, адипиновой, пимелиновой. Вместо глицидных эфиров могут применяться также сложные эфиры спиртов, содержащих четырехчленное кольцо с кислородом-1 3-эпоксисоединения. [52]
Страницы: 1 2 3 4
www.ngpedia.ru
Эфиры вторичных спиртов - Справочник химика 21
Простые эфиры вторичных спиртов получаются с трудом, третичные спирты их почти не образуют. Ароматические спирты ведут себя несколько иначе бензгидрол с разбавленной серной кислотой (1 5) при 180° образует с высоким выходом простой эфир [c.461]Защита спиртовой группы чрезвычайно широко применяется при синтезах и превращениях сахаров, стеринов и глицеридов. К наиболее обычным трем типам защиты спиртов относятся их превращения в простые эфиры, смешанные ацетали и сложные эфиры. Вторичные спирты защищают от ацилирования окислением в кетоны. [c.215]
Эфиры вторичных спиртов реагируют таким же образом. Иногда они отщепляют воду, образуя непредельные соединения [c.579]Смесь натриевых солей сернокислых эфиров вторичных спиртов Се— ie- Основные примеси изопропиловый спирт, углеводороды, сульфат натрия. Выпускается в виде 20% водного раствора [c.651]
Старое доказательство того, что связь алкил — кислород остается нетронутой, было получено в отсутствие рацемизации в продуктах гидролиза эфиров вторичных спиртов при использовании оснований если бы эта связь разорвалась, то отсутствие рацемизации следовало бы объяснить только в результате такого маловероятного события, как осуществление двух инверсий конфигурации. [c.69]
Маловероятно, что поливиниловые эфиры, являющиеся эфирами вторичного спирта, будут распадаться по этому механизму при температурах, слишком низких для того, чтобы эта реакция могла конкурировать с возможной также реакцией деполимеризации. Причины протекания этой реакции при 160— 180° будут рассмотрены в гл. 6. Вкратце можно сказать, что эта способность зависит от структуры полимера, которая дает возможность двойным связям в главной цепи активировать соседние нереакционноспособные звенья. [c.17]
Простые эфиры -> Вторичные спирты [c.26]
Простые алифатические эфиры даже при высокой температуре лишь очень медленно разлагаются реактивами Гриньяра. Несколько лучше реагируют эфиры вторичных спиртов. В то же время эфиры фенолов с алифатическими спиртами при достаточно высокой температуре довольно хорошо образуют с алкилмагнийгалогенидами феноляты 1, 5, 6]. [c.324]
В случае ацеталя формальдегида (R = R = H) получаются простые эфиры первичных спиртов, из ацеталя любого другого альдегида (R = Н) — простые эфиры вторичных спиртов и из кеталя — простые эфиры третичных спиртов. [c.332]
Реакции с металлорганическими соединениями. При обменной реакции а, а-дихлорэфиров с реактивами Гриньяра образуются эфиры вторичных спиртов [18, 23]. Реакция проводится при 5—10° С. Реактив Гриньяра берется или в двухкратном избытке, или в эквимолекулярном количестве по отношению к а, а-дихлор-эфиру [c.114]
Образование кетона из эфира вторичного спирта и хромовой кислоты может происходить при определенных условиях и по другому механизму. При этом а-водород может быть удален внутримолекулярно при действии атома кислорода, связанного с хромом. [c.362]
По спиртовому компоненту труднее всего омыляются сложные эфиры первичных спиртов, легче — сложные эфиры вторичных спиртов и легче всего — сложные эфиры третичных спиртов. К последним в этом отношении относятся такн е фенолы. [c.218]
При действии метилового спирта в присутствии BFg на моноокись дивинила получается только метиловый эфир вторичного спирта [9] [c.421]
Прн действии ЯМдВг могут заместиться н две этоксиль-ные группы ортомуравьнного эфнра, в результате чего образуются с небольшим выходом) простые эфиры вторичных спиртов [c.241]
Кат.— щелочи, третичные амины, алкоголяты, четвертичные аммониевые основания. Особенно легко реаг. с акрилонитрилом галогеноводороды, амины, спирты, СН-кислоты (напр., малоновый эфир). Вторичные спирты реаг. труднее первичных, третичные в обычных условиях в р-цию не вступают. Ц. нек-рых полимеров испольэ. для их модификации. См., напр., Цианэтилцеллюлоэа. фТерентьев А. П., Кост А. H., в кн. Реакции и методы исследования органических соединений, т. 2, М.— Л 19. i2, с. 47 — 208. [c.678]
Так же, как и в случае окисления вторичных спиртов, в реакциях диоксиранов с эфирами вторичных спиртов образуются кетоны Эфиры третичньЕХ спиртов с высоким выходом превра-щаются в соответствующие спирты [c.258]
Интересно было выяснить токсичность других эфиров фторуксусной кислоты и установить, будут ли они более или менее токсичны, чем рассматриваемый. Например, в ряду фторфосфатов мы нашли, что эфиры вторичных спиртов более токсичны, чем эфиры первичных спиртов так, диизо-пропилфторфосфат (1) обладает исключительной активностью [3]. [c.290]
При действии RMgBr могут заместиться и две этоксиль-ные группы ортомуравьиного эфира, в результате чего образуются (с /Небольшим выходом) простые эфиры вторичных спиртов [c.27]
Это, безусловно, является общим правилом для алкилацетатов, алкилхло-ридов и алкилбромидов. Температура, при которой распад происходит с измеримой скоростью, близка к 500 для эфиров первичных спиртов и 450° для эфиров вторичных спиртов эфиры третичных спиртов распадаются при температуре ниже 300°. Если бы эфиры полиметакриловой кислоты были стабильны при этих температурах, они вели бы себя аналогично. Однако большинство из них легко распадается до мономера при 250°, так что преи-мущественное образование олефинов можно ожидать только в случае эфи-ров третичных спиртов, что и наблюдается в действительности. [c.17]
Окись дивинила в присутствии алкоголятов, подобно окиси пропилена, присоединяет спирты в соответствии с правилом Марковникова с образованием первичных эфиров и эритрита, а в присутствии BFg-0(G2H5)2 присоединение спиртов к окиси дивинила протекает вопреки правилу Марковникова с образованием втор.эфиров эритрола [48]. Для объяснения порядка присоединения спиртов к окиси дивинила А. А. Петровым предложена гипотеза, согласно которой щелочные катализаторы, в частности алкоголяты, просто повышают реакционную способность спиртов их каталитическое действие не связано с деформацией связи и обусловлено только легким, но сравнению со свободными спиртами, присоединением по правилу Марковникова, а BFg действует таким образом, что образует комплексные соединения с окисями. В результате такой координации ослабляется связь между кислородом и углеродом, окись принимает форму оксониевого соединения с положительно зарянтрехвалентным кислородом и взаимодействует со спиртами с образованием эфиров вторичных спиртов. Такое присоединение можно выразить следующими схемами [c.241]
Склонность олефиновых углеводородов, содержащих в молекуле 4 или более углеродных атома, вступать во взаимодействие с кислотами с образованием сложных эфиров соответствующих вториЧ Ных и третичных спиртов относительно-выше, чем у эти.лена и пропилена. Из трех изомерных бутиленов изобутилен являетхя наиболее активным по отношению к кислотам, довольно легког образуя, с последними эфиры т ретичного бутилового спирта. Оба других бутилена дают начало сложным эфирам вторичного спирта, а именно СН3СН2СНОНСН3. [c.356]
Интересно отметить, что при совместном проведении паров какого-либо спирта и сложного эфира вторичного спирта над окисью алюминия Происходит частичное замещение опиртоюго радикала эфира с образО ванием см-еси сложных эфиров 1 . Пары метило вого эфира муравьиной кислоты и изобутилового оп ирта [c.429]
Полученные ацетали могут быть легко гидролизованы в адьдегиды. Эта реакция является одним из лучших методов получения альдегидов посредством реакции Гриньяра, превосходящим другие методы их получения (из эфиров муравьиной кислоты, стр. 197, солей муравьиной кислоты, стр. 306, или из формамида, стр. 286). Позднее было показано, что в более жестких условиях можно заменить два алкоксила на радикал магнийорганического соединения и с небольшим выходом получить простые эфиры вторичных спиртов. В еще более жестких условиях происходит замещение третьего алкоксила с образованием углеводорода. Так, из ортомуравьиного эфира и бромистого фенилмагния получены ацеталь бензальдегида, бензгидрилэтиловый эфир и трифенилметан [82]. [c.336]
Окисление вторичных спиртов КК СНОН->НСОК (разд. 4.1.1,4, 5.2.10.1 и 5.2.13.1) отрыв гидрида от силиловых эфиров вторичных спиртов. [c.572]
Сложные эфиры вторичных спиртов с гидроксилом при двойной связи, например уксусноизопропениловый эфир СНз=С(СНз)-О—СО—СНз, представляют собой довольно прочные соединения. В настоящее время имеется два хо-рощих способа их получения действие кетена на кетоны в присутствии минеральных кислот [c.455]
Способность ацетохолинэстераз атаковать сложные эфиры вторичных спиртов является другой отличительной особенностью этого класса холинэстераз. Ацетил-р-метилхолин (гидроокись [c.639]
С,4Нб7(ОИ)2(ОСНз), а также эфиры вторичных спиртов а-эйкозанола-2 СНз(СН2)1 СНОНСНз и а-октадеканола-2 СНз(СН,),5 СНОНСН,, [c.331]
Так, например, соответствующие метиловые эфиры очень реакционноспособны по отношению к нуклеофильным реагентам в реакциях 5дг2-замещения, тогда как эфиры вторичных спиртов и другие эфиры, образующие карбониевые ионы, легко реагируют по 5 1-механизму. Особенно неустойчивы эфиры третичных и ал-лиловых спиртов. Недавно было установлено, что важная роль, которую выполняют диметилаллилфосфаты в синтезе терпенов и стероидов сводится к их участию в общей реакции образования углерод-углеродной связи. [c.15]
Аналогично, нз ортоэфира муравьиной кислоты образуется простой эфир вторичного спирта, хотя в мягких условиях можно получить ацеталь, а после его пздролиза — альдегид [c.231]
Наилучшее моющее средство получается при длине цепи Си. Полученный продукт может быть высушен распылением до порошка 35—40%-ной концентрации. По своим свойствам он ближе к сернокислым эфирам вторичных спиртов (типолу), чем к сернокислым эфирам первичных спиртов. Его устойчивость по отношению к кислотам выше, чем алкилсульфатов, но в жесткой воде его действие хуже, чем алкиларилсульфонятов. Оказалось также, что до-децилсульфонат кальция в 10 раз менее растворим в воде, чем соответствующий сульфат [3]. [c.36]
chem21.info
Поливиниловый спирт эфиры - Справочник химика 21
Полимеризованные эфиры (или поливиниловые эфиры) могут конденсироваться с непредельными альдегидами (акролеин, кротоновый альдегид) в мягкую, способную вулканизироваться массу. Они могут подвергаться совместной полимеризации также и с предельными альдегидами. Поливинилхлорид и поливиниловые сложные эфиры могут быть методом омыления переведены в поливиниловые спирты [c.466] Поливиниловый спирт Полиаллиловый спирт Поливиниловые простые эфиры Поливиниловые сложные эфиры [c.104]Стабилизаторами эмульсии служат поливиниловый спирт, метилцеллюлоза, желатин и др. Водорастворимая метилцеллюлоза с содержанием 26— 32% метоксильных групп наиболее надежно защищает капли мономера от агрегирования при значительно более низких концентрациях по сравнению с другими стабилизаторами эмульсии. Введение в эмульсию небольших количеств модифицирующих добавок (арил-, алкилсульфонатов, эфиров глицерина и жирных кислот и др.) повышает пористость полимера и его способность поглощать пластификатор, а также улучшает перерабатываемость и термостабильность поливинилхлорида. [c.25]
Поливиниловый спирт Эфиры целлюлозы [c.103]
В связи с этим полимерные простые виниловые эфиры практически синтезируют только полимеризацией мономеров, тогда как в синтезе поливинилацеталей преимущественное значение имеет полимер-аналогичное превращение поливинилового спирта. [c.295]
Поливинилацетат светостоек, обладает хорошими адгезионными свойствами к различным поверхностям и эластичностью. Будучи полярным полимером он хорошо растворяется в хлорированных и ароматических углеводородах, кетонах, сложных эфирах, в метаноле. Набухает в воде. Не растворяется в бензине, керосине, масле, скипидаре и др. Поливинилацетат легко гидролизуется в поливиниловый спирт в присутствии растворов кислот и щелочей, Под действием сильных кислот и щелочей он разрушается. [c.38]
После окончания промывки и препарации в большинстве случаев через слой нити на бобине 3—5 мин продувают воздух. Затем бобины отжимают в центрифуге. Содержание влаги в нити, после отжима снижается с 30 до 10%. Отжатую нить сушат в сушилках 4—6 ч при 90—95 °С. Высушенную нить выдерживают в помещении с кондиционной влажностью воздуха (65%) до поглощения стандартного количества влаги (3,5—4%). После этого нить перематывают на бобинажных машинах на шпули, сортируют и упаковывают. Если препарирующий состав не был нанесен после промывки, то нить обрабатывают при перемотке. В качестве препарирующих веществ рекомендуется применять кроме замасливателя поливи-нилацетат, поливиниловый спирт, эфиры полиакриловой кислоты с небольшими добавками борной кислоты и глицерина или гликоля для уменьшения электризуемости волокна, а таклсе поверхностноактивные вещества. Количество препарирующих веществ, наносимых на нить, составляет от 3 до 5% от ее массы. [c.81]
Характерным отличием многих ВМ ПАВ является необратимая адсорбция их на межфазной новерхности. Сливки, например, можно промывать водой, а жир экстрагировать эфиром. Оболочка будет сохранять свою форму [18]. Прямые эмульсии, стабилизированные поливиниловым спиртом (ПВС), можно разбавить водой, при этом [c.422]
Аналогично можно проводить гидролиз различных полимерных эфиров, например поливинилацетатов (стр. 616). При этом гидролиз в кислой или щелочной среде приводит к образованию не растворимых в бензоле и хлороформе поливиниловых спиртов различной степени сложности и не распадающихся на мономеры [c.533]
Источником получения поливинилового стерта служат сложные поливиниловые эфиры, легко гидролизующиеся до поливинилового спирта [c.282]
В большинстве случаев в качестве исходного вещества для синтеза поливинилового спирта используют поливинилацетат (стр. 303). Реакция гидролиза сложных поливиниловых эфиров, например поливинилацетата, может происходить при комнатной температуре в присутствии небольшого количества щелочи или кислоты (несколько меньше эквимолекулярного количества) [c.282]
Простые эфиры поливинилового спирта [c.294]
При нагревании поливинилового спирта в присутствии минеральной кислоты происходит частичная дегидратация его макромолекул, и в полимере образуются отдельные звенья поливинилового эфира [c.294]
Сложные эфиры поливиниловою спирта [c.297]
Например, при этерификации низкомолекулярного спирта на каждой промежуточной стадии в реакционной системе находится четыре соединения спирт, кислота, сложный эфир и вода, — которые легко могут быть отделены друг от друга. При этерификации же высокомолекулярного поливинилового спирта [c.51]
Азотнокислые эфиры поливинилового спирта получают действием на него смесью азотной и серной кислот. [c.299]
Сложные эфиры поливинилового спирта 30 I [c.301]
Например, при пропускании аммиака в раствор полимера в диметилформамиде образуется В-аминокротоновый эфир поливинилового спирта [c.304]
Эфиры титановой кислоты и многоатомных спиртов нерастворимы в воде и обладают повышенной термической устойчивостью. Эти наблюдения были использованы для модифицирования свойств иолимеров, относящихся к группе полимерных спиртов. При действии эфиров ортотитановой кислоты на поливиниловый спирт, феноло-формальдегидные полимеры и эпоксидные полимеры получены новые титанорганические полимеры, нерастворимые ь воде. [c.499]
Для облегчения гидроли а поливиниловый эфир предварительно растворяют в этиловом спирте. В качестве гидролизующего агента применяют спиртовой раствор щелочи или добавляют в раствор небольшое количество серной кислоты. Превращение поливинилового эфира в поливиниловый спирт с достаточной полнотой происходит уже при 20°, что позволяет свести к минимуму возможность деструктивных или побочных процессов. Если проводить эту реакцию в атмосфере азота, можно полностью предотвратить явления деструкции, в этих случаях размер и форма макромолекулярных цепей остается неизменной. Так, Штаудингер показал, что при гидролизе поливинилового эфира в атмосфере азота степень полимеризации образующегося поливинилового спирта, определенная вискозиметрическим и осмометрическим методами, остается неизменно равной степени полимеризации исходного полимерного эфира. Поскольку при определении молекулярного веса по вискозиметрическОму методу совпадающие результаты до и после гидролиза получаются лишь в том случае, если и форма цепи остается неизменной, то имеются достаточные основания отнести описанный процесс гидро-.1иза к подлинно полимераналогичным превращениям, Полученный поливиниловый спирт можно снова превратить в поливиниловый эфир. [c.173]
Поливинилфосфор но кислые эфиры получают фосфорилированием поливинилового спирта хлорокисью фосфора. Для этого тонко измельченный порошок поливинилового спирта суспендируют в диоксане или хлорпроизводных алифатических углеводородов. В суспензию приливают хлорокись фосфора, разбавленную тем же растворителем. Образующийся хлористый водород удаляют из реактора. Реакцию проводят до прекращения выделения НС1. После фосфорилирования полимер утрачивает способность растворяться в воде, поэтому его легко отделить от других продуктов реакции. Полимер, обработанный горячей водой, уже не содержит хлора. [c.298]
Галогенсодержащие полимеры, поливиниловый спирт, эфиры целлюлозы, полиэти-лентерефталат, новолаки, полиуретановые эластомеры, ненасыщенные полиэфирные смолы, фторсодер-жащие полимеры, полиал-киленсульфиды [c.297]
Сущность концентрирования латексов сливкоотделением заключается в ускоренной седиментации латексных частиц, агрегированных с помощью природных (альгинаты) или синтетических (полиакрилат натрия, поливиниловый спирт и его эфиры, полиакриламид, метилцеллюлоза) гидрофильных полимеров. [c.599]
Простые эфиры поливинилового спирта и низкомолекулярных спиртов можно получить замецением гидроксильных групп поливинилового спирта или непосредственной полимеризацией алкил- или арилвинилоБых эфиров. [c.294]
Иодсодержащую полимерную присадку, обладающую противоизносными и другими свойствами, получают при взаимодействии иода с сополимером алкилфумарового эфира, эфира поливинилового спирта и иизкомолекулярной насыщенной карбоновой кислоты [пат. США 3184413]. [c.207]
Это процесс суспензионной полимеризации винилхлорида в водной среде в присутствии гадроперекиси - инициатора полимеризации. Эмульгаторами служат поливиниловые спирты и эфиры целлюлозы. Реакцию проводят при температуре 50. .60 °С и давлении 7...8 атм в тсчяше 5...7 ч. Мономер (ВХ) и водный раствор эмульгатора с инициатором поступают в верхнюю часть реактора из нержавеющей стали с мешалкой. [c.72]
С. Н. Ушаков предложил получать поливиниловый спирт из поливинилформиата (полимер винилового эфира муравьиной кислоты), который легко гидролизуется в поливиниловый спирт [[ри [[агревани[1 с водой даже в отсутствис специально введенного катали 5атора. Муравьиная кислота, выделяющаяся при гидролизе поливинилформиата, является достаточно активным катализатором этого процесса. [c.283]
Поливиниловые сложные эфиры можно си тезировать как методом полимераналогичного превращения поливинилового спирта, так и непосредственной полимеризацией мономеров. Методом полимераналогичного превращения обычно получают сложные поливиниловые эфиры минеральных или высших жирных кислот. Поливиниловые эфиры низших органических кислот получают непосредственной полимеризациеп соответствующих мономеров. [c.297]
Из эфиров поливинилового спирта и минеральных кислот известны полимерные эфиры фосфорной кислоты, азотной кислоты, сульфоновой и титановой кислот. [c.298]
Поливиниловые эфиры титановой кис.лочы отличаются высокой водостойкостью и химической устойчивостью. Гидролиза эфира ие наблюдается даже при длительном нагревании полимера в воде. Такую нс-обычную для сложных эф1[ров химическую стойкость поливиниловых эфиров титановой кислоты можно объяснить тем, что титап соединяется с поливиниловым спиртом не только эфирными, но и координационными связями. Макромолекулы этого полимера, очевидно, соединены между собой ячейками и ледующего строен ия [c.301]
Метод получения сложных виниловых эфиров химическим превращением поливинилового спирта представляет практический интерес лишь при синтезе эфиров высших жирных кислот. Получение же таких эфиров, как поливинплформиат или поливинилацетат. из поливинилового спирта может иметь значение только для исследований, поскольку сам поливиниловый спирт получают омылением этих эфиров. Е> [c.302]
Полимеризация мономеров сложных виниловых эфиров, в противоположность полимеризации ацеталей и простых виниловых эфиров, протекает по радикальному механизму. Инициаторами служат органические перекиси и персульфаты. Винилформиат легко гидролизуется при увлажнении, поэтому полимеризовать его можно блочным методом или в растворах органических жидкостей (например, в ацетоне). Поливинплформиат растворим в ацетоне и диокса не, температура его стеклования 40°, при более высокой температуре полимер переходит в высокоэластическое состояние. В. воде поливинплформиат легко гидролизуется, образуя поливиниловый спирт [c.302]
Поливинилхлорид (полихлорвинил) [—СНг—СНС1—]п получают радикальной полимеризацией хлористого винила в основном эмульсионным методом в присутствии эмульгаторов. В качестве стабилизаторов могут быть поливиниловый спирт, растворимые эфиры целлюлозы, желатин и полиакриловая кислота. [c.416]
chem21.info