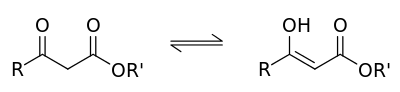Справочник химика 21. Уксусноэтиловый эфир
Этилацетат — WiKi
Этилацетат (этиловый эфир уксусной кислоты) СН3−СОО−Ch3−Ch4 — бесцветная летучая жидкость с резким запахом.
| Этилацетат | |
 | |
 | |
| C4H8O2 | |
| 88,11 г/моль | |
| 0,902 г/см³ | |
| 25,13±0,01 мН/м[1], 23,39±0,01 мН/м[1], 20,49±0,01 мН/м[1], 17,58±0,01 мН/м[1] и 14,68±0,01 мН/м[1] | |
| 0,578±0,001 мПа·с[2], 0,423±0,001 мПа·с[2], 0,325±0,001 мПа·с[2] и 0,259±0,001 мПа·с[2] | |
| 10,01±0,01 эВ[3] | |
| −84 °C | |
| 77 °C | |
| 24±1 °F[3] и −4±1 °C[4] | |
| 2±1 об.%[3] и 2±0,1 об.%[4] | |
| 73±1 мм.рт.ст.[3], 10±1 кПа[5], 12,6±0,1 кПа[6] и 100±1 кПа[5] | |
| 1,3720 | |
| 1,78±0,09 Д[7] | |
| 141-78-6 | |
| 8857 | |
| 205-500-4 | |
| E1504 | |
| AH5425000 | |
| 27750 | |
| 8525 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой (реакция этерификации):
Ch4COOH+C2H5OH→Ch4COOC2H5+h3O{\displaystyle {\mathsf {CH_{3}COOH+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+H_{2}O}}}Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
Ch4COCl+C2H5OH→Ch4COOC2H5+HCl{\displaystyle {\mathsf {CH_{3}COCl+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+HCl}}}К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработке этилового спирта кетеном.
- По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловым эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).[8]
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых[источник не указан 130 дней]. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта[9].
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
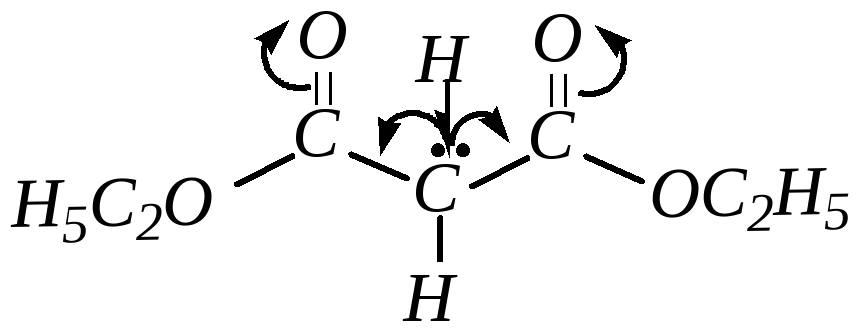
Используется для получения ацетоуксусного эфира:[10]:
2Ch4COOC2H5→Ch4COCh3COOC2H5{\displaystyle {\mathsf {2CH_{3}COOC_{2}H_{5}\rightarrow CH_{3}COCH_{2}COOC_{2}H_{5}}}}Очистка и сушка
Продажный этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5 % карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Безопасность
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³[11].
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1—16,8 % (по объёму).
Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
Примечания
- ↑ 1 2 3 4 5 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–183. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–232. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0260.html
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 16–22. — ISBN 978-1-4822-0868-9
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–99. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 15–17. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 9–56. — ISBN 978-1-4822-0868-9
- ↑ Химическая энциклопедия, Москва 1998, с. 494.
- ↑ Ильина Е. В., Макаров С. Ю., Славская И. Л. Технология и оборудование для производства водок и ликёроводочных изделий // Учебное пособие — М.: ДеЛи плюс, 2013. — 492 с. ISBN 978-5-905170-40-9 С. 24, 27, 92, 102-104, 118.
- ↑ Органикум. Том 2. Москва, Мир, 1992, с. 180.
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест
Литература
- ГОСТ 8981-78 «Эфиры этиловый и нормальный бутиловый уксусной кислоты технические. Технические условия». (С изменениями № 1, 2, 3, 4).
ru-wiki.org
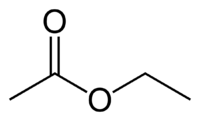
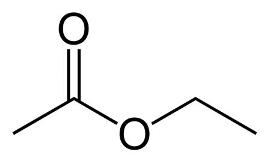
Формула Этилацетата структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C4H8O2
| C | Углерод | 12,011 | 4 | 54,5% |
| H | Водород | 1,008 | 8 | 9,2% |
| O | Кислород | 15,999 | 2 | 36,3% |
Молекулярная масса: 88,106
Этилацетат — (этиловый эфир уксусной кислоты) СН3-СОО-Ch3-Ch4 — бесцветная летучая жидкость с резким запахом.
Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой: Ch4COOH + C2H5OH → Ch4COOC2H5 + h3O Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом: Ch4COCl + C2H5OH → Ch4COOC2H5 + HCl К промышленным способам синтеза этилацетата относятся: Перегонка смеси этилового спирта, уксусной и серной кислот. Обработке этилового спирта кетеном. По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия: 2Ch4CHO → Ch4COOC2H5
Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловом эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн. тонн в год. Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа. Применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации. Используется для получения ацетоуксусного эфира: 2Ch4COOC2H5 → Ch4COCh3COOC2H5
Очистка и сушка
Продаваемый этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5%-го карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Безопасность
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³. Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1-16,8 % (по объему). Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1253.
formula-info.ru
Уксусноэтиловый эфир - Справочник химика 21
Классическим и простейшим примером сложноэфирной конденсации является образование ацетоуксусного эфира взаимодействием двух молекул уксусноэтилового эфира в присутствии этилата натрия [c.183]Реакция омыления уксусноэтилового эфира идет по уравнению [c.57]
Константа скорости омыления уксусноэтилового эфира едким натром 1[ри 282,6 К равна 2,37, а при 287,6 К — 3,204. При какой температуре константа скорости будет равна 4 [c.364]
Определите поверхностную активность уксусноэтилового эфира по приведенным ниже значениям поверхностного натяжения водных растворов его при 298 К [c.36]
Один из самых распространенных сложных эфиров этилацетат, уксусноэтиловый эфир. Его запах напоминает аромат груш, но немного резче его и не совсем похож на фруктовый. С этим эфиром хорошо знакомы женщины этилацетат растворяет лак для ногтей и входит в состав жидкости для снятия лака. Если вы когда-нибудь ею пользовались, вы знаете, как пахнет этилацетат знает это и всякий, кто в этот момент находился в одной комнате с вами. В промышленности этилацетат (температура его кипения 77 ""С) используется как важный растворитель и для других веществ, кроме лака для ногтей. [c.186]
Уксусноэтиловый эфир (этилацетат] [c.1018]Уксусноэтиловый эфир Уксусноэтиловый эфир Уксусноэтиловый эфир Уксусноэтиловый эфир Четыреххлористый углерод Четыреххлористый углерод [c.61]
Введение же в уравнение (1-4) весовых долей вместо молярных (г на 1 г раствора) изменяет величину коэффициента распределения. Изменения коэффициента распределения с изменением размерности долей вещества чаще всего имеют одинаковый характер для тех и других единиц, но иногда могут сложиться и обратные отношения. Например, в системе этиловый спирт—уксусноэтиловый эфир—вода доля этилового спирта при применении молярных единиц больше в эфирном слое, а при весовых единицах—в водном. [c.22]
Поскольку реакция этерификации является обратимой, выход эфира тем больше, чем в большем избытке взят спирт или кислота и чем полнее удаляются из реакционной смеси сложный эфир и вода. Так, например, при получении бензойноэтилового эфира берется избыток спирта при получении уксусноэтилового эфира отгоняется эфир, так как он кипит при температуре, которая ниже температуры кипения воды при получении уксусноизоамилового эфира отгоняется вода, так как ее температура кипения ниже температуры кипения образовавшегося эфира. В последнем случае вода отгоняется в виде азеотропной смеси с темп. кип. 94° С. Такой способ получения эфира называют азеотропной этерификацией. Иногда связывают воду с помощью водоотнимающих средств (И2864, гпСЦ, СаС , А12(804)3 и др.). [c.166]
На оси абсцисс нанесены концентрации этанола в фазе рафината (без растворителя), на оси ординат— концентрации этого компонента в фазе экстракта, которой может быть вода, бензол или уксусноэтиловый эфир. У первой смеси концентрация этанола в воде обнаруживает максимум для низких концентраций этанола в слое рафината и она больше, чем концентрация этанола в бензоле. Отсюда делаем вывод, что избирательность воды по отношению к этанолу особенно высока в этой области. Подобным образом складываются отношения и для другой системы. [c.37]
При омылении уксусноэтилового эфира едкой щелочью при 10 С [c.244]
Примеры такого рода диаграмм даны на рис. 1-20 для двух систем бен-зол—этанол—вода [114] и уксусноэтиловый эфир—этанол—вода [78]. [c.37]
Раствор уксусноэтилового эфира прй, = 0,01 г-экв/л 293 К омы ляется 0,002 г-экв/л раствором едкого натра за ti = [c.335]
Уксусноэтиловый эфир, моль 0,3114 0,2342 0,1943 0,1589 0,1354 [c.81]
Пользуясь значениями величин этилового спирта, уксусной кислоты, уксусноэтилового эфира и воды, подсчитать стандартную теплоту реакции при 25° С [c.74]
Галоидные алкилы обычно довольно легко реагируют со свежеприготовленными цинковыми стружками, в особенности если прибавить немного порошкообразной меди реакция каталитически ускоряется небольшими количествами уксусноэтилового эфира. Первичными продуктами реакции являются а л к и л ц и н к о в ы е соли, которые при перегонке разлагаются иа цинкдиалкилы и иодид цинка [c.192]
Температура кипения чистого уксусноэтилового эфира 78° С. Выход около 40 2. [c.175]
По данным задач 3 и 4 найти энергию активации реакции омыления уксусноэтилового эфира. [c.261]
Получите уксусноэтиловый эфир, используя в качестве исходного вещества ацетилен. [c.84]
При определенной температуре 0,01 н. раствор уксусноэтилового эфира омыляется 0,002 н. раствором NaOH за 23 мин на 10%. Через СКОЛ1.КО минут он будет омылен до такой же степени 0,005 н. раствором NaOH, если реакция омыления эфира — реакция второго порядка, а щелочи диссоциированы полностью [c.342]
Затем приготовляют раствор эфира с концентрацией несколько ниже 0,03 н. (например, 0,027 н.). Для этого вычисляют количество эфира, необходимого для приготовления 500 см раствора данной концентрации. Эфир отмеривают по объему с помощью пипетки, разделенной на десятые доли миллилитра (плотность уксусноэтилового эфира = 0,901 г/см ), выливают в мерную колбу на 500 см , доливают до метки дистиллированной водой и тщательно взбалтывают. [c.255]
Уксусноэтиловый эфир (этилацетат . . Тетраметиленсульфид (тетрагидротиофен) [c.860]
Константа скорости щелочного омыления уксусноэтилового эфира при 26°С равна 6,56 л-моль -мин-. [c.261]
Быстрый анализ сталей (Аккерман, 1963). Легирующими элементами в сталях являются А1, Сг, Ni, V, Мп, Ti, u, Со и Мо. Подвижной фазой служит смесь 25% НС1 (пл. I,19)-f30% к-бутанола-1-45% уксусноэтилового эфира (проценты по объему). Ионы железа перемещаются вместе с фронтом растворителя и поэтому не мешают определению других компонентов. [c.86]
Эффективного распределения можно добиться, подбирая соответствующую систему растворителей. Результирующая константа распределения, не зависящая от концентрации, является константой вещества аналогично температуре кипения, коэффициенту преломления и др. и может быть применена для характеристики веществ и испытания их на чистоту. В этом случае нужно дополнительно указывать температуру и систему растворителей, например вещество X, /С2о°с = 0,3 (уксусноэтиловый эфир — вода). [c.224]
Пр имер 4. Пользуясь значенпямн стандартны. теплот его рання си1фта, уксусной кислоты п уксусноэтилового эфира, под считать теплоту реакции [c.110]
По окончании реакции между I моль/л этилового спирта и 1 моль/л уксусной кислоты получено 0,667 моль/л уксусноэтилового эфира. Подсчитать чонстанту равновесия реакции [c.212]
Константа скорости реакции омыления уксусноэтилового эфира щелочью прн 283 К равна 2,38 мин- Х Xмоль- -л. Рассчитайте время половинног разложения эфира, еслн 1 л 0,05 н. раствора эфира смешать с I л 0,1 н. раствора щелочи. Реакция омыления эфира подчиняется кинетическому уравнению 2-го порядка. [c.69]
Трамбуз [54] рекомендует для титрования льюисовской кислоты диоксан и уксусноэтиловый эфир (этилацетат) как типичные льюисовские основания. Конечная точка обнаруживается по отсутствию выделения тепла (температурного инкремента) при добавлении бензольного раствора основания к помещенной в дьюаровский сосуд суспензии твердого тела в бензоле. [c.56]
P i TBop уксусноэтилового эфира при , = 0,01 г-экв/л и 293 К опыляется 0,002 н. раствором NaOH (сг) в течение 23 мин на 10%. Ргакци 5 второго порядка. Как изменится это время, если уменьшить концентрации реагирующих веществ в 10 раз увеличить температуру на 15 [c.362]
Если с уксусноэтиловым эфиром Н-С3Н,— MgJ дает только третичный спирт — метилдипропилкарбинол, то как показал Г. Л. Стадников [6], даже в обычных температурных условиях при действии / -СдН — MgJ на такой сложный эфир, как бензгидриловый эфир уксусной кислоты, наряду с нормальным продуктом третичным спиртом [c.223]
При взаимодействии этилхлорсульфата с концентрированным водным раствором уксуснокислого натрия [204в] получаются уксусноэтиловый эфир и уксусная кислота [c.42]
В подобных случаях задачу определения молекулярного веса соединения удается иногда упростить, исследуя какое-либо его производное, молекулы которого обладают меньщей склонностью к ассоциации. Из уксусной кислоты СНзСООН путем замены атома водорода карбоксильной группы углеводородным остатком можно получить так называемые сложные эфиры (например, СН3СООС2Н5 — уксусноэтиловый эфир), не обладающие, в отличие от исходного вещества, способностью к ассоциации. На основании данных об упругости паров этого эфира можно вычислить истинный молекулярный вес уксусной кислоты. [c.12]
После окончания реакции содержимое приемника переносят в делительную воронку и промывают концентрированным раствором соды для удаления уксусной кислоты (проба на лакмус). Эфирный слой отделяют и встряхивают его с насыщенным раствором хлористого кальция для удаления непрореагировавшего спирта (с первичными спиртами хлористый кальций дает кристаллическое молекулярное соединение СаС12-2С2Н5ОН, которое нерастворимо в уксусноэтиловом эфире). Эфирный слой отделяют от водного и сушат безводным сернокислым натрием. Эфир перегоняют из колбы Вюрца. При 71 — 75° С будет отгоняться смесь спирта и уксусноэтилового эфира, выше 75° С — уксусноэтиловый эфир. [c.175]
Пособие по химии для поступающих в вузы 1972 (1972) -- [ c.392 ]Практикум по органической химии (1956) -- [ c.82 ]
Технология спирта (1981) -- [ c.304 ]
Реакции органических соединений (1939) -- [ c.309 ]
Синтез органических препаратов из малых количеств веществ (1957) -- [ c.59 ]
Общий практикум по органической химии (1965) -- [ c.241 , c.456 , c.457 , c.480 ]
Руководство по малому практикуму по органической химии (1964) -- [ c.121 , c.156 ]
Вредные органические соединения в промышленных сточных водах 1982 (1982) -- [ c.200 ]
Курс органической химии (1967) -- [ c.0 ]
Курс органической химии (1979) -- [ c.246 ]
Органическая химия для студентов медицинских институтов (1963) -- [ c.129 ]
Курс органической химии (1970) -- [ c.174 ]
Химико-технические методы исследования Том 3 (0) -- [ c.0 , c.260 , c.296 ]
Органическая химия 1971 (1971) -- [ c.0 ]
Органическая химия 1974 (1974) -- [ c.0 ]
Лекционные опыты и демонстрационные материалы по органической химии (1956) -- [ c.184 , c.187 ]
Практикум по органическому синтезу (1976) -- [ c.0 ]
Органическая химия (1976) -- [ c.88 , c.134 , c.159 , c.197 ]
Практикум по органической химии Издание 3 (1952) -- [ c.83 ]
Технология спирта Издание 3 (1960) -- [ c.345 ]
Лакокрасочные покрытия (1968) -- [ c.17 ]
Практикум по органической химии (1950) -- [ c.83 ]
Справочное руководство по эпоксидным смолам (1973) -- [ c.127 ]
Курс органической химии _1966 (1966) -- [ c.180 ]
Органическая химия Издание 4 (1970) -- [ c.127 ]
Курс органической химии (1955) -- [ c.278 ]
chem21.info
Уксусноэтиловый эфир
55
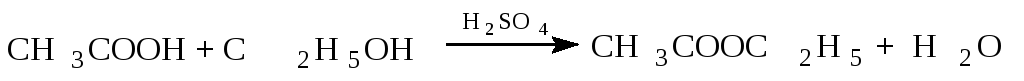
Реактивы:
Уксусная кислота (конц.) 30 см3
Этиловый спирт 45 см3
Серная кислота (конц.) 15 см3
Углекислый натрий
Хлористый кальций
Сернокислый натрий
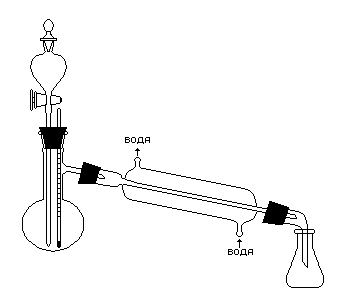
Рис. 1. Прибор для получения эфиров
Собирают прибор (рис. 1), в колбу Вюрца вместимостью 100 см3 помещают 15 см3 спирта и затем осторожно при перемешивании приливают такой же объем концентрированной серной кислоты. Колбу закрывают пробкой, в которую вставлена капельная воронка и термометр, соединяют с длинным водяным холодильником и нагревают на закрытой плитке. Шарик термометра должен быть погружен в жидкость. Нагревают колбу до температуры (1155) 0С.
В нагретую жидкость из капельной воронки постепенно приливают смесь 30 см3 спирта и 30 см3 уксусной кислоты. Приливание ведут с такой же скоростью, с какой отгоняется образующийся эфир. По окончании реакции в приемник для удаления уксусной кислоты прибавляют насыщенный раствор углекислого натрия до тех пор, пока водный слой не перестанет показывать кислую реакцию. Раствор углекислого натрия нужно прибавлять постепенно, так как жидкость сильно вспенивается из-за выделения углекислого газа. После этого смесь переливают в делительную воронку, отделяют эфир от нижнего водного слоя и для освобождения от примеси спирта взбалтывают его с 15 см3 водного раствора хлористого кальция с массовой долей 50%. Отделив эфир, его сушат безводным сернокислым натрием и перегоняют на водяной бане из маленькой перегонной колбы, собирая фракцию c температурой кипения от 75 до 780С.
Выход около 30 г.
Примечание. Уксусноэтиловый эфир огнеопасен и образует с воздухом взрывоопасные смеси.
Бензойноэтиловый эфир
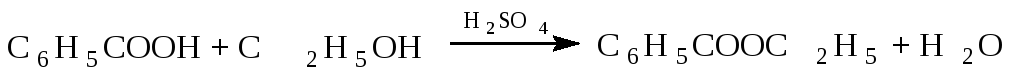
Реактивы:
Бензойная кислота 12,2 г
Этиловый спирт 35 см3
Серная кислота (конц.) 4 см 3
Углекислый натрий
Диэтиловый эфир
Хлористый кальций
В круглодонную колбу вместимостью 100 или 150 см3 помещают 12,2 г бензойной кислоты (надо помнить, что бензойная кислота раздражает кожу и дыхательные пути), 35 см3 этилового спирта, 4 см3 концентрированной серной кислоты и несколько кусочков фарфора. Смесь нагревают на водяной бане в течение трех часов с обратным холодильником. Затем заменяют холодильник нисходящим и по возможности полно отгоняют избыток спирта. Остаток после охлаждения выливают в 80 см3 холодной воды и нейтрализуют твердым углекислым натрием. Выделившееся масло извлекают эфиром, отделяют при помощи делительной воронки эфирный слой и сушат его в течение нескольких часов хлористым кальцием. Затем переливают раствор в небольшую колбу Вюрца и отгоняют эфир на водяной бане в приемник, охлаждаемый льдом. Оставшийся в колбе бензойноэтиловый эфир перегоняют с воздушным холодильником, собирая фракцию, кипящую при температуре от 210 до 2120С.
Выход бензойноэтилового эфира 10 г.
Уксусноизоамиловый эфир (1 способ)
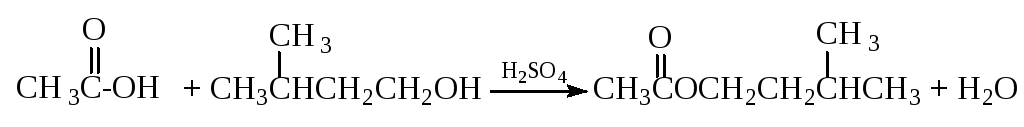
Реактивы:
Изоамиловый спирт 22,0 г
Уксусная кислота, ледяная 18,0 г
Серная кислота (конц.) 0,5 см3
Гидрокарбонат натрия
Хлористый кальций
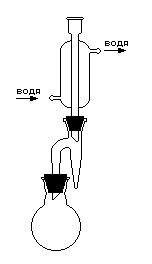
Рис. 2. Прибор для получения эфиров с водоотделителем
В круглодонную колбу, соединенную с водоотделителем и обратным холодильником (рис 2.) помещают 22 г изоамилового спирта, 18 г конц. уксусной кислоты и 0,5 см3 серной кислоты. Колбу нагревают на закрытой плитке. При нагревании смесь постепенно перегоняется, и в водоотделителе образуются два слоя: нижний - водный и верхний - состоящий из эфира, спирта и уксусной кислоты , который стекает обратно в реакционную колбу. Конец реакции определяют по количеству выделившейся воды (4,5 см3) или по тому моменту, когда количество воды в водоотделителе не перестанет увеличиваться. По достижении этого момента убирают плитку, а содержимое колбы и водоотделителя выливают в стакан с холодной водой.
Эфир отделяют от воды в делительной воронке, затем промывают водой (в делительной воронке), и затем раствором гидрокарбоната натрия до нейтральной реакции и вновь водой. Отделив от воды эфир, высушивают его безводным сернокислым натрием или хлористым кальцием. После высушивания эфир перегоняют, собирая фракцию при температуре от 138 до 142 0С.
Выход уксусноизоамилового эфира около 27 г.
Примечание. Уксусноизоамиловый эфир (изоамилацетат) легко воспламеняется.
studfiles.net