Реферат по химии "Сложные эфиры". Реферат эфиры
Реферат - Cложные эфиры - Химия
Содержание стр.
Введение -3-
1. Строение -4-
2. Номенклатураи изомерия -6-
3. Физическиесвойства и нахождение в природе -7-
4. Химическиесвойства -8-
5.Получение -9-
6. Применение -10-
6.1 Применение сложных эфиров неорганических кислот -10-
6.2 Применение сложных эфиров органических кислот -12-
Заключение -14-
Использованныеисточники информации -15-
Приложение -16-
Введение
Среди функциональных производных кислот особоеместо занимают сложные эфиры — производные кислот, у которых кислотный водородзаменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того,производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природныеэфиры — жиры и масла, которые образованы трехатомным спиртом глицерином ивысшими жирными кислотами, содержащими четное число углеродных атомов. Жирывходят в состав растительных и животных организмов и служат одним из источниковэнергии живых организмов, которая выделяется при окислении жиров.
Цель моей работы заключается в подробном ознакомлениис таким классом органических соединений, как сложные эфиры и углублённомрассмотрении области применения отдельных представителей этого класса.
1. Строение
Общая формула сложных эфиров карбоновых кислот:
/>
гдеR и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атомводорода).
Общая формула жиров:
/>
гдеR', R", R"' — углеродныерадикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковыхкислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирныекислоты:
Алкановыекислоты
1. Масляная кислота СН3 — (Ch3)2— СООН
2. Капроновая кислота СН3 — (Ch3)4— СООН
3. Пальмитиновая кислота СН3 — (Ch3)14— СООН
4. Стеариновая кислота СН3 — (Ch3)16— СООН
Алкеновыекислоты
5. Олеиновая кислота С17Н33СООН
СН3—(СН2)7—СН ===СН—(СН2)7—СООН
Алкадиеновыекислоты
6. Линолевая кислота С17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН= СН—СООН
Алкатриеновыекислоты
7. Линоленовая кислота С17Н29СООН
СН3СН2СН = CHCh3CH ==CHCh3CH = СН(СН2)4СООН
2. Номенклатура иизомерия
Названия сложных эфиров производят от названияуглеводородного радикала и названия кислоты, в котором вместо окончания -оваяиспользуют суффикс -ат, например:
/>
Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углероднойцепи начинается по кислотному остатку с бутановой кислоты, по спиртовомуостатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират,пропилацетат и изопропилацетат.
2. Изомерия положениясложноэфирной группировки —СО—О—. Этот вид изомерии начинаетсясосложных эфиров, в молекулах которых содержится не менее 4 атомов углерода,например этилацетат и метилпропионат.
3. Межклассоваяизомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислотуили непредельный спирт, возможны еще двавида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
3. Физическиесвойства и нахождение в природе
Сложные эфиры низших карбоновых кислот и спиртовпредставляют собой летучие, нерастворимые в воде жидкости. Многие из них имеютприятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат— груши и т. д.
Сложные эфиры высших жирных кислот и спиртов —воскообразные вещества, не имеют запаха, в воде не растворимы.
Приятный аромат цветов, плодов, ягод в значительнойстепени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры широко распространены в природе. Наряду суглеводородами и белками они входят в состав всех растительных и животныхорганизмов и составляют одну из основных частей нашей пищи.
По агрегатному состоянию при комнатной температурежиры делятся на жидкие и твердые. Твердые жиры, как правило, образованыпредельными кислотами, жидкие жиры (их часто называют маслами) — непредельными.Жиры растворимы в органических растворителях и нерастворимы в воде.
4. Химическиесвойства
1. Реакция гидролиза, или омыления. Так, как реакцияэтерификации является обратимой, поэтому в присутствии кислот протекаетобратная реакция гидролиза:
/>
Реакция гидролиза катализируется и щелочами; в этомслучае гидролиз необратим, так как получающаяся кислота со щелочью образуетсоль:
/>
2. Реакция присоединения. Сложные эфиры, имеющие всвоем составе непредельную кислоту или спирт, способны к реакциямприсоединения.
3. Реакция восстановления. Восстановление сложныхэфиров водородом приводит к образованию двух спиртов:
/>
4. Реакция образования амидов. Под действием аммиакасложные эфиры превращаются в амиды кислот и спирты:
/>/>
5. Получение
1. Реакция этерификации:
Спирты вступают в реакции с минеральными и органическимикислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролизсложных эфиров).
/>
/>
/>
Реакционнаяспособность одноатомных спиртов в этих реакциях убывает от первичных ктретичным.
2.Взаимодействием ангидридов кислот со спиртами:
/>
3.Взаимодействием галоидангидридов кислот со спиртами:
/>
6. Применение
6.1 Применениесложных эфиров неорганических кислот
Эфиры борной кислоты — триалкилбораты — легко получаютсянагреванием спирта и борной кислоты с добавкой концентрированной сернойкислоты. Борнометиловый эфир (триметилборат) кипит при 65° С, борноэтиловый(триэтилборат) — при 119° С. Эфиры борной кислоты легко гидролизуются водой.
Реакция с борной кислотой служит для установления конфигурации многоатомныхспиртов и была неоднократно использована при изучении Сахаров.
Ортокремневые эфиры — жидкости. Метиловый эфир кипит при 122° С, этиловыйпри 156° С. Гидролиз водой проходит легко уже на холоду, но идет постепенно ипри недостатке воды приводит к образованию высокомолекулярных ангидридныхформ, в которых атомы кремния соединены друг с другом через кислород (силоксановыегруппировки):
/> Эти высокомолекулярные вещества (полиалкоксисилоксаны)находят применение в качестве связующих, выдерживающих довольно высокуютемпературу, в частности для покрытия поверхности форм для точной отливкиметалла.
Аналогично SiCl4 реагируют диалкилдихлорсиланы, например ((СН3)2SiCl2,образуя диалкоксильные производные:
/>
Их гидролиз при недостатке воды дает так называемыеполиалкилсилоксаны:
/>
Они обладают разным (но очень значительным) молекулярным весом и представляютсобой вязкие жидкости, используемые в качестве термостойких смазок, а при ещеболее длинных силоксановых скелетах — термостойкие электроизоляционные смолы икаучуки.
Эфиры ортотитановой кислоты. Их получают аналогично ортокремневым эфирам по реакции:
/>
Это жидкости, легко гидролизующиеся до метиловогоспирта и TiO2 применяются для пропитки тканей с целью придания имводонепроницаемости.
Эфиры азотной кислоты. Их получают действием на спирты смеси азотной иконцентрированной серной кислот. Метилнитрат СН3ONO2, (т.кип. 60° С) и этилнитрат C2H5ONO2 (т. кип. 87°С) при осторожной работе можно перегнать, но при нагревании выше температурыкипения или при детонации они очень сильно взрывают.
/>
Нитраты этиленгликоля и глицерина, неправильноназываемые нитрогликолем и нитроглицерином, применяются в качестве взрывчатыхвеществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен в обращении.
Пентрит — тетранитрат пентаэритрита С(Ch3ONO2)4,получаемый обработкой пентаэритрита смесью азотной и серной кислот, — тожесильное взрывчатое вещество бризантного действия.
Нитрат глицерина и нитрат пентаэритрита обладаютсосудорасширяющим эффектом и применяются как симптоматические средства при стенокардии.
Эфиры фосфорной кислоты — высококипящиежидкости, лишь очень медленно гидролизуемые водой, быстрее щелочами иразбавленными кислотами. Эфиры, образованные этерификацией высших спиртов (ифенолов), находят применение как пластификаторы пластмасс и для извлечениясолей уранила из водных растворов.
Известны эфиры типа (RO)2S═O, но они не имеют практического значения.
Из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислотыпроизводят моющие средства. В общем виде образование таких солей можноизобразить уравнениями:
/>
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают оченьхорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, апотому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многихстиральных порошках.
Они и обладают прекрасными моющими способностями. Принцип их действия тот же,что и у обычного мыла, только кислотный остаток серной кислоты лучшеадсорбируется частицами загрязнения, а кальцевые соли алкилсерной кислотырастворимы в воде, поэтому это моющее средство стирает и в жесткой, и в морскойводе.
6.2 Применениесложных эфиров органических кислот
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты- ацетаты. Прочие эфиры (кислот молочной — лактаты, масляной — бутираты,муравьиной — формиаты) нашли ограниченное применение. Формиаты из-за сильнойомыляемости и высокой токсичности в настоящее время не используются.Определенный интерес представляют растворители на основе изобутилового спирта исинтетических жирных кислот, а также алкиленкарбонаты. Физико-химическиесвойства наиболее распространенных сложных эфиров приведены в таблице (см.приложение).
МетилацетатСН3СООСН3. Отечественной промышленностью техническийметилацетат выпускается в виде древесно-спиртового растворителя, в которомсодержится 50% (масс.) основного продукта. Метилацетат также образуется в видепобочного продукта при производстве поливинилового спирта. По растворяющейспособности метилацетат аналогичен ацетону и применяется в ряде случаев как егозаменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2Н5СООСН3. Получают методом этерификациина лесохимических предприятиях при переработке синтетической и лесохимическойуксусной кислоты, гидролизного и синтетического этилового спирта иликонденсацией ацетальдегида. За рубежом разработан процесс получения этилацетатана основе метилового спирта. Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению сацетоном его преимущество в более высокой температуре кипения (меньшейлетучести). Добавка 15-20 % этилового спирта повышает растворяющую способностьэтилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы.
Пропилацетат СН3СООСН2СН2СН3. Порастворяющей способности подобен этилацетату.
Изопропилацетат СН3СООСН(СН3)2. По свойствам занимаетпромежуточное положение между этил- и пропилацетат.
Амилацетат Ch4COOCh3Ch3Ch3Ch3Ch4,т. кип. 148° С, иногда называют «банановым маслом» (которое он напоминает позапаху). Он образуется в реакции между амиловым спиртом (часто – сивушныммаслом) и уксусной кислотой в присутствии катализатора. Амилацетат широкоприменяется как растворитель для лаков, поскольку он испаряется медленнее, чемэтилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни,винограда и рома, отчасти обусловлен летучими эфирами, например этиловым иизоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот.Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Винилацетат Ch3=CHOOCCh4,образуется при взаимодействии уксусной кислоты с ацетиленом в присутствиикатализатора. Это важный мономер для приготовления поливинилацетатных смол,клеев и красок.
Мыла — это соли высших карбоновых кислот. Обычные мыласостоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновойкислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствиищелочей:
/>
Обычноемыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так каксодержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимыев воде соли:
Ca2+ + 2C17h45COONa→Ca(C17h45COO)2↓+ 2Na+
Внастоящее время для стирки в быту, для промывки шерсти и тканей впромышленности используют синтетические моющие средства, которые обладают в 10раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткойи даже морской воды.
Заключение
Исходяиз вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение,как в быту, так и в промышленности. Некоторые из сложных эфиров готовятсяискусственно и под названием «фруктовых эссенций» широко применяются вкондитерском деле, в производстве прохладительных напитков, в парфюмерии и вомногих других отраслях. Жиры используют для многих технических целей. Однакоособенно велико их значение как важнейшей составной части рациона человека иживотных, наряду с углеводами и белками. Прекращение использования пищевыхжиров в технике и замена их непищевыми материалами – одна из важнейших задачнародного хозяйства. Эта задача может быть разрешена только при достаточноосновательных знаниях о сложных эфирах и дальнейшем изучении этого классаорганических соединений.
Использованныеисточники информации
1. Цветков Л.А. Органическая химия:Учебник для 10-11 классов общеобразовательных учебных заведений. — М.: Гуманит.изд. центр ВЛАДОС, 2001;
2. Несмеянов А. Н., Несмеянов Н. А., Началаорганической химии, кн. 1-2, М.,1969-70.;
3. Глинка Н. Л. Общая химия: Учебноепособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия,1983;
4. http://penza.fio.ru
5. http://encycl.yandex.ru
Приложение
Физико-химические свойства сложных эфиров
Название Давление пара при 20°С, кПа Молеку- лярная масса Темпера- тура кипения при 101,325 кПа. °СПлотность при 20°С. г/см3
Показа- тель перелом- ления n20
Поверхнос- тное натяжение 20°С. мН/м Метилацетат 23,19 74,078 56,324 0,9390 1,3619324,7625,7
Этилацетат 9,86 88,104 77,114 0,90063 1,37239 23,75 Пропилацетат 3,41 102,13 101,548 0,8867 1,38442 20,53 Изопропилацетат 8,40 102,13 88,2 0,8718 1,3773022,1022
Бутилацетат 2,40 116,156 126,114 0,8813 1,39406 25,2 Изоиутилацетат 1,71 116,156 118 0,8745 1,39018 23,7 Втор-Бутилацетат - 116,156 112,34 0,8720 1,3894123,3322,1
Гексилацетат - 114,21 169 0,890 - - Амилацетат 2,09 130,182 149,2 0,8753 1,40228 25,8 Изоамилацетат 0,73 130,182 142 0,8719 1,4053524,6221,1
Ацетат монометилового эфира этиленгликоля (метилцеллозольвацетат) 0,49 118,0 144,5 1,007 1,4019 - Ацетат моноэтилового эфира этиленгликоля (этилцеллозольвацетат) 0,17 132,16 156,4 0,9748 1,4030 - Этиленгликольмоноацетат - 104 181-182 1,108-1,109 - - Этиленгликольдиацетат 0,05 146 186-190 1,106 - - Циклогексилацетат 0,97 142 175 0,964 1,4385 - Этиллактат 0,13 118,13 154,5 1,031 1,411828,917,3
Бутиллактат 0,05 146,0 185 0,97 - - Пропиленкарбонат - 102,088 241,7 1,206 1,4189 -www.ronl.ru
Реферат: Cложные эфиры
Содержание стр.
Введение -3-
1. Строение -4-
2. Номенклатура и изомерия -6-
3. Физические свойства и нахождение в природе -7-
4. Химические свойства -8-
5. Получение -9-
6. Применение -10-
6.1 Применение сложных эфиров неорганических кислот -10-
6.2 Применение сложных эфиров органических кислот -12-
Заключение -14-
Использованные источники информации -15-
Приложение -16-
Введение
Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Цель моей работы заключается в подробном ознакомлении с таким классом органических соединений, как сложные эфиры и углублённом рассмотрении области применения отдельных представителей этого класса.
1. Строение
Общая формула сложных эфиров карбоновых кислот:

где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Общая формула жиров:

где R', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
Алкановые кислоты
1. Масляная кислота СН3 — (Ch3)2 — СООН
2. Капроновая кислота СН3 — (Ch3)4 — СООН
3. Пальмитиновая кислота СН3 — (Ch3)14 — СООН
4. Стеариновая кислота СН3 — (Ch3)16 — СООН
Алкеновые кислоты
5. Олеиновая кислота С17Н33СООН
СН3—(СН2)7—СН === СН—(СН2)7—СООН
Алкадиеновые кислоты
6. Линолевая кислота С17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН
Алкатриеновые кислоты
7. Линоленовая кислота С17Н29СООН
СН3СН2СН = CHCh3CH == CHCh3CH = СН(СН2)4СООН
2. Номенклатура и изомерия
Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например:

Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
3. Физические свойства и нахождение в природе
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи.
По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.
4. Химические свойства
1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:

Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:

2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:

4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:


5. Получение
1. Реакция этерификации:
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).



Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
2. Взаимодействием ангидридов кислот со спиртами:

3. Взаимодействием галоидангидридов кислот со спиртами:

6. Применение
6.1 Применение сложных эфиров неорганических кислот
Эфиры борной кислоты — триалкилбораты — легко получаются нагреванием спирта и борной кислоты с добавкой концентрированной серной кислоты. Борнометиловый эфир (триметилборат) кипит при 65° С, борноэтиловый (триэтилборат) — при 119° С. Эфиры борной кислоты легко гидролизуются водой.
Реакция с борной кислотой служит для установления конфигурации многоатомных спиртов и была неоднократно использована при изучении Сахаров.
Ортокремневые эфиры — жидкости. Метиловый эфир кипит при 122° С, этиловый при 156° С. Гидролиз водой проходит легко уже на холоду, но идет постепенно и при недостатке воды приводит к образованию высокомолекулярных ангидридных форм, в которых атомы кремния соединены друг с другом через кислород (силоксановые группировки):
 Эти высокомолекулярные вещества (полиалкоксисилоксаны)
находят применение в качестве связующих, выдерживающих довольно высокую
температуру, в частности для покрытия поверхности форм для точной отливки
металла.
Эти высокомолекулярные вещества (полиалкоксисилоксаны)
находят применение в качестве связующих, выдерживающих довольно высокую
температуру, в частности для покрытия поверхности форм для точной отливки
металла.
Аналогично SiCl4 реагируют диалкилдихлорсиланы, например ((СН3)2SiCl2, образуя диалкоксильные производные:

Их гидролиз при недостатке воды дает так называемые полиалкилсилоксаны:

Они обладают разным (но очень значительным) молекулярным весом и представляют собой вязкие жидкости, используемые в качестве термостойких смазок, а при еще более длинных силоксановых скелетах — термостойкие электроизоляционные смолы и каучуки.
Эфиры ортотитановой кислоты. Их получают аналогично ортокремневым эфирам по реакции:

Это жидкости, легко гидролизующиеся до метилового спирта и TiO2 применяются для пропитки тканей с целью придания им водонепроницаемости.
Эфиры азотной кислоты. Их получают действием на спирты смеси азотной и концентрированной серной кислот. Метилнитрат СН3ONO2, (т. кип. 60° С) и этилнитрат C2H5ONO2 (т. кип. 87° С) при осторожной работе можно перегнать, но при нагревании выше температуры кипения или при детонации они очень сильно взрывают.

Нитраты этиленгликоля и глицерина, неправильно называемые нитрогликолем и нитроглицерином, применяются в качестве взрывчатых веществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен в обращении.
Пентрит — тетранитрат пентаэритрита С(Ch3ONO2)4, получаемый обработкой пентаэритрита смесью азотной и серной кислот, — тоже сильное взрывчатое вещество бризантного действия.
Нитрат глицерина и нитрат пентаэритрита обладают сосудорасширяющим эффектом и применяются как симптоматические средства при стенокардии.
Эфиры фосфорной кислоты — высококипящие жидкости, лишь очень медленно гидролизуемые водой, быстрее щелочами и разбавленными кислотами. Эфиры, образованные этерификацией высших спиртов (и фенолов), находят применение как пластификаторы пластмасс и для извлечения солей уранила из водных растворов.
Известны эфиры типа (RO)2S═O, но они не имеют практического значения.
Из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты производят моющие средства. В общем виде образование таких солей можно изобразить уравнениями:

Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Они и обладают прекрасными моющими способностями. Принцип их действия тот же, что и у обычного мыла, только кислотный остаток серной кислоты лучше адсорбируется частицами загрязнения, а кальцевые соли алкилсерной кислоты растворимы в воде, поэтому это моющее средство стирает и в жесткой, и в морской воде.
6.2 Применение сложных эфиров органических кислот
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты - ацетаты. Прочие эфиры (кислот молочной - лактаты, масляной - бутираты, муравьиной - формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот, а также алкиленкарбонаты. Физико-химические свойства наиболее распространенных сложных эфиров приведены в таблице (см. приложение).
Метилацетат СН3СООСН3. Отечественной промышленностью технический метилацетат выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2Н5СООСН3. Получают методом этерификации на лесохимических предприятиях при переработке синтетической и лесохимической уксусной кислоты, гидролизного и синтетического этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс получения этилацетата на основе метилового спирта. Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы.
Пропилацетат СН3СООСН2СН2СН3. По растворяющей способности подобен этилацетату.
Изопропилацетат СН3СООСН(СН3)2. По свойствам занимает промежуточное положение между этил- и пропилацетат.
Амилацетат Ch4COOCh3Ch3Ch3Ch3Ch4, т. кип. 148° С, иногда называют «банановым маслом» (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто – сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Винилацетат Ch3=CHOOCCh4, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок.
Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:

Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
Ca2+ + 2C17h45COONa→Ca(C17h45COO)2↓ + 2Na+
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.
Заключение
Исходя из вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение, как в быту, так и в промышленности. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений.
Использованные источники информации
1. Цветков Л.А. Органическая химия: Учебник для 10-11 классов общеобразовательных учебных заведений. - М.: Гуманит. изд. центр ВЛАДОС, 2001;
2. Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М.,1969-70.;
3. Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия, 1983;
4. http://penza.fio.ru
5. http://encycl.yandex.ru
Приложение
Физико-химические свойства сложных эфиров
|
Название |
Давление пара при 20°С, кПа |
Молеку- лярная масса |
Темпера- тура кипения при 101,325 кПа. °С |
Плотность при 20°С. г/см3 |
Показа- тель перелом- ления n20 |
Поверхнос- тное натяжение 20°С. мН/м |
|
Метилацетат |
23,19 |
74,078 |
56,324 |
0,9390 |
1,36193 |
24,7625,7 |
|
Этилацетат |
9,86 |
88,104 |
77,114 |
0,90063 |
1,37239 |
23,75 |
|
Пропилацетат |
3,41 |
102,13 |
101,548 |
0,8867 |
1,38442 |
20,53 |
|
Изопропилацетат |
8,40 |
102,13 |
88,2 |
0,8718 |
1,37730 |
22,1022 |
|
Бутилацетат |
2,40 |
116,156 |
126,114 |
0,8813 |
1,39406 |
25,2 |
|
Изоиутилацетат |
1,71 |
116,156 |
118 |
0,8745 |
1,39018 |
23,7 |
|
Втор-Бутилацетат |
- |
116,156 |
112,34 |
0,8720 |
1,38941 |
23,3322,1 |
|
Гексилацетат |
- |
114,21 |
169 |
0,890 |
- |
- |
|
Амилацетат |
2,09 |
130,182 |
149,2 |
0,8753 |
1,40228 |
25,8 |
|
Изоамилацетат |
0,73 |
130,182 |
142 |
0,8719 |
1,40535 |
24,6221,1 |
|
Ацетат монометилового эфира этиленгликоля (метилцеллозольвацетат) |
0,49 |
118,0 |
144,5 |
1,007 |
1,4019 |
- |
|
Ацетат моноэтилового эфира этиленгликоля (этилцеллозольвацетат) |
0,17 |
132,16 |
156,4 |
0,9748 |
1,4030 |
- |
|
Этиленгликольмоноацетат |
- |
104 |
181-182 |
1,108-1,109 |
- |
- |
|
Этиленгликольдиацетат |
0,05 |
146 |
186-190 |
1,106 |
- |
- |
|
Циклогексилацетат |
0,97 |
142 |
175 |
0,964 |
1,4385 |
- |
|
Этиллактат |
0,13 |
118,13 |
154,5 |
1,031 |
1,4118 |
28,917,3 |
|
Бутиллактат |
0,05 |
146,0 |
185 |
0,97 |
- |
- |
|
Пропиленкарбонат |
- |
102,088 |
241,7 |
1,206 |
1,4189 |
- |
www.referatmix.ru
Реферат - Сложные эфиры - Органическая химия
СодержаниеВведение 1. Строение 2. Номенклатура и изомерия 3. Физические свойства и нахождение в природе 4. Химические свойства 5. Получение 6. Применение 6.1 Применение сложных эфиров неорганических кислот 6.2 Применение сложных эфиров органических кислот Заключение Использованные источники информации Приложение
Введение Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы. Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой). Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров. Цель моей работы заключается в подробном ознакомлении с таким классом органических соединений, как сложные эфиры и углублённом рассмотрении области применения отдельных представителей этого класса.
1. Строение Общая формула сложных эфиров карбоновых кислот:
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода). Общая формула жиров:
где R', R", R"' — углеродные радикалы. Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных. В жирах наиболее часто встречаются следующие жирные кислоты: Алкановые кислоты 1. Масляная кислота СН3 — (Ch3)2 — СООН 2. Капроновая кислота СН3 — (Ch3)4 — СООН 3. Пальмитиновая кислота СН3 — (Ch3)14 — СООН 4. Стеариновая кислота СН3 — (Ch3)16 — СООН Алкеновые кислоты 5. Олеиновая кислота С17Н33СООН СН3—(СН2)7—СН === СН—(СН2)7—СООН Алкадиеновые кислоты 6. Линолевая кислота С17Н31СООН СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН Алкатриеновые кислоты 7. Линоленовая кислота С17Н29СООН СН3СН2СН = CHCh3CH == CHCh3CH = СН(СН2)4СООН
2. Номенклатура и изомерия Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например:
Для сложных эфиров характерны следующие виды изомерии: 1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. 2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат. 3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота. Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
3. Физические свойства и нахождение в природе
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д. Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы. Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров. Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи. По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.
4. Химические свойства 1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. 3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
5. Получение
1. Реакция этерификации: Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
2. Взаимодействием ангидридов кислот со спиртами:
3. Взаимодействием галоидангидридов кислот со спиртами:
6. Применение
6.1 Применение сложных эфиров неорганических кислот
Эфиры борной кислоты — триалкилбораты — легко получаются нагреванием спирта и борной кислоты с добавкой концентрированной серной кислоты. Борнометиловый эфир (триметилборат) кипит при 65° С, борноэтиловый (триэтилборат) — при 119° С. Эфиры борной кислоты легко гидролизуются водой. Реакция с борной кислотой служит для установления конфигурации многоатомных спиртов и была неоднократно использована при изучении Сахаров. Ортокремневые эфиры — жидкости. Метиловый эфир кипит при 122° С, этиловый при 156° С. Гидролиз водой проходит легко уже на холоду, но идет постепенно и при недостатке воды приводит к образованию высокомолекулярных ангидридных форм, в которых атомы кремния соединены друг с другом через кислород (силоксановые группировки): Эти высокомолекулярные вещества (полиалкоксисилоксаны) находят применение в качестве связующих, выдерживающих довольно высокую температуру, в частности для покрытия поверхности форм для точной отливки металла. Аналогично SiCl4 реагируют диалкилдихлорсиланы, например ((СН3)2SiCl2, образуя диалкоксильные производные:
Их гидролиз при недостатке воды дает так называемые полиалкилсилоксаны:
Они обладают разным (но очень значительным) молекулярным весом и представляют собой вязкие жидкости, используемые в качестве термостойких смазок, а при еще более длинных силоксановых скелетах — термостойкие электроизоляционные смолы и каучуки. Эфиры ортотитановой кислоты. Их получают аналогично ортокремневым эфирам по реакции:
Это жидкости, легко гидролизующиеся до метилового спирта и TiO2 применяются для пропитки тканей с целью придания им водонепроницаемости. Эфиры азотной кислоты. Их получают действием на спирты смеси азотной и концентрированной серной кислот. Метилнитрат СН3ONO2, (т. кип. 60° С) и этилнитрат C2H5ONO2 (т. кип. 87° С) при осторожной работе можно перегнать, но при нагревании выше температуры кипения или при детонации они очень сильно взрывают.
Нитраты этиленгликоля и глицерина, неправильно называемые нитрогликолем и нитроглицерином, применяются в качестве взрывчатых веществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен в обращении. Пентрит — тетранитрат пентаэритрита С(Ch3ONO2)4, получаемый обработкой пентаэритрита смесью азотной и серной кислот, — тоже сильное взрывчатое вещество бризантного действия. Нитрат глицерина и нитрат пентаэритрита обладают сосудорасширяющим эффектом и применяются как симптоматические средства при стенокардии. Эфиры фосфорной кислоты — высококипящие жидкости, лишь очень медленно гидролизуемые водой, быстрее щелочами и разбавленными кислотами. Эфиры, образованные этерификацией высших спиртов (и фенолов), находят применение как пластификаторы пластмасс и для извлечения солей уранила из водных растворов. Известны эфиры типа (RO)2S?O, но они не имеют практического значения. Из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты производят моющие средства. В общем виде образование таких солей можно изобразить уравнениями:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках. Они и обладают прекрасными моющими способностями. Принцип их действия тот же, что и у обычного мыла, только кислотный остаток серной кислоты лучше адсорбируется частицами загрязнения, а кальцевые соли алкилсерной кислоты растворимы в воде, поэтому это моющее средство стирает и в жесткой, и в морской воде.
6.2 Применение сложных эфиров органических кислот Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты - ацетаты. Прочие эфиры (кислот молочной - лактаты, масляной - бутираты, муравьиной - формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот, а также алкиленкарбонаты. Физико-химические свойства наиболее распространенных сложных эфиров приведены в таблице (см. приложение). Метилацетат СН3СООСН3. Отечественной промышленностью технический метилацетат выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон. Этилацетат С2Н5СООСН3. Получают методом этерификации на лесохимических предприятиях при переработке синтетической и лесохимической уксусной кислоты, гидролизного и синтетического этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс получения этилацетата на основе метилового спирта. Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы. Пропилацетат СН3СООСН2СН2СН3. По растворяющей способности подобен этилацетату. Изопропилацетат СН3СООСН(СН3)2. По свойствам занимает промежуточное положение между этил- и пропилацетат. Амилацетат Ch4COOCh3Ch3Ch3Ch3Ch4, т. кип. 148° С, иногда называют «банановым маслом» (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто – сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат. Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры. Винилацетат Ch3=CHOOCCh4, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок. Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла. Мыла получаются при гидролизе жиров в присутствии щелочей:
Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
Ca2+ + 2C17h45COONa?Ca(C17h45COO)2? + 2Na+
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.
Заключение
Исходя из вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение, как в быту, так и в промышленности. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений.
Использованные источники информации
1. Цветков Л.А. Органическая химия: Учебник для 10-11 классов общеобразовательных учебных заведений. - М.: Гуманит. изд. центр ВЛАДОС, 2001; 2. Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М.,1969-70.; 3. Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия, 1983; 4. http://penza.fio.ru 5. http://encycl.yandex.ru 6. Приложение Физико-химические свойства сложных эфиров Название Давление пара при 20°С, кПа Молеку- лярная масса Темпера- тура кипения при 101,325 кПа. °С Плотность при 20°С. г/см3 Показа- тель перелом- ления n20 Поверхнос- тное натяжение 20°С. мН/м Метилацетат 23,19 74,078 56,324 0,9390 1,36193 24,7625,7 Этилацетат 9,86 88,104 77,114 0,90063 1,37239 23,75 Пропилацетат 3,41 102,13 101,548 0,8867 1,38442 20,53 Изопропилацетат 8,40 102,13 88,2 0,8718 1,37730 22,1022 Бутилацетат 2,40 116,156 126,114 0,8813 1,39406 25,2 Изоиутилацетат 1,71 116,156 118 0,8745 1,39018 23,7 Втор-Бутилацетат - 116,156 112,34 0,8720 1,38941 23,3322,1 Гексилацетат - 114,21 169 0,890 - - Амилацетат 2,09 130,182 149,2 0,8753 1,40228 25,8 Изоамилацетат 0,73 130,182 142 0,8719 1,40535 24,6221,1 Ацетат монометилового эфира этиленгликоля (метилцеллозольвацетат) 0,49 118,0 144,5 1,007 1,4019 - Ацетат моноэтилового эфира этиленгликоля (этилцеллозольвацетат) 0,17 132,16 156,4 0,9748 1,4030 - Этиленгликольмоноацетат - 104 181-182 1,108-1,109 - - Этиленгликольдиацетат 0,05 146 186-190 1,106 - - Циклогексилацетат 0,97 142 175 0,964 1,4385 - Этиллактат 0,13 118,13 154,5 1,031 1,4118 28,917,3 Бутиллактат 0,05 146,0 185 0,97 - - Пропиленкарбонат - 102,088 241,7 1,206 1,4189 -
8
www.ronl.ru
Реферат по химии "Сложные эфиры"
Муниципальное казенное общеобразовательное учреждение « Средняя общеобразовательная школа а.Зеюко»

Учитель химии и биологии
Заубидова Светлана Владимировна
Содержание :
Введение -3-
1. Строение -4-
2. Номенклатура и изомерия -6-
3. Физические свойства и нахождение в природе -7-
4. Химические свойства -8-
5. Получение -9-
6. Применение -10-
6.1 Применение сложных эфиров неорганических кислот -10-
6.2 Применение сложных эфиров органических кислот -12-
Заключение -14-
Использованные источники информации -15-
Приложение -16-
Введение
Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Цель моей работы заключается в подробном ознакомлении с таким классом органических соединений, как сложные эфиры и углублённом рассмотрении области применения отдельных представителей этого класса.
1. Строение
Общая формула сложных эфиров карбоновых кислот: 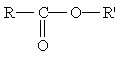
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Общая формула жиров: 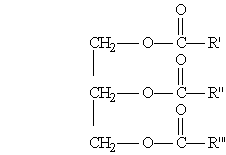
где R', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
Алкановые кислоты
1. Масляная кислота СН3— (Ch3)2— СООН
2. Капроновая кислота СН3— (Ch3)4— СООН
3. Пальмитиновая кислота СН3— (Ch3)14— СООН
4. Стеариновая кислота СН3— (Ch3)16— СООН
Алкеновые кислоты
5. Олеиновая кислота С17Н33СООН
СН3—(СН2)7—СН === СН—(СН2)7—СООН
Алкадиеновые кислоты
6. Линолевая кислота С17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН
Алкатриеновые кислоты
7. Линоленовая кислота С17Н29СООН
СН3СН2СН = CHCh3CH == CHCh3CH = СН(СН2)4СООН
2. Номенклатура и изомерия
Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например:
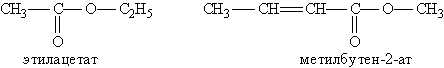
Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
infourok.ru
Реферат Cложные эфиры
Содержание стр.Введение -3-
1. Строение -4-
2. Номенклатура и изомерия -6-
3. Физические свойства и нахождение в природе -7-
4. Химические свойства -8-
5. Получение -9-
6. Применение -10-
6.1 Применение сложных эфиров неорганических кислот -10-
6.2 Применение сложных эфиров органических кислот -12-
Заключение -14-
Использованные источники информации -15-
Приложение -16-Введение
Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Цель моей работы заключается в подробном ознакомлении с таким классом органических соединений, как сложные эфиры и углублённом рассмотрении области применения отдельных представителей этого класса.
1. Строение
Общая формула сложных эфиров карбоновых кислот:
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Общая формула жиров:
гдеR', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
Алкановые кислоты
1. Масляная кислота СН3 — (Ch3)2 — СООН
2. Капроновая кислота СН3 — (Ch3)4 — СООН
3. Пальмитиновая кислота СН3 — (Ch3)14 — СООН
4. Стеариновая кислота СН3 — (Ch3)16 — СООН
Алкеновые кислоты
5. Олеиновая кислота С17Н33СООН
СН3—(СН2)7—СН === СН—(СН2)7—СООН
Алкадиеновые кислоты
6. Линолевая кислота С17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН
Алкатриеновые кислоты
7. Линоленовая кислота С17Н29СООН
СН3СН2СН = CHCh3CH == CHCh3CH = СН(СН2)4СООН2. Номенклатура и изомерия
Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например:
Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинаетсясо сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.3. Физические свойства и нахождение в природе Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи.
По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.4. Химические свойства
1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
5. Получение1. Реакция этерификации:
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.2. Взаимодействием ангидридов кислот со спиртами:
3. Взаимодействием галоидангидридов кислот со спиртами:
6. Применение6.1 Применение сложных эфиров неорганических кислот Эфиры борной кислоты — триалкилбораты — легко получаются нагреванием спирта и борной кислоты с добавкой концентрированной серной кислоты. Борнометиловый эфир (триметилборат) кипит при 65° С, борноэтиловый (триэтилборат) — при 119° С. Эфиры борной кислоты легко гидролизуются водой.
Реакция с борной кислотой служит для установления конфигурации многоатомных спиртов и была неоднократно использована при изучении Сахаров.
Ортокремневые эфиры — жидкости. Метиловый эфир кипит при 122° С, этиловый при 156° С. Гидролиз водой проходит легко уже на холоду, но идет постепенно и при недостатке воды приводит к образованию высокомолекулярных ангидридных форм, в которых атомы кремния соединены друг с другом через кислород (силоксановые группировки):
Эти высокомолекулярные вещества (полиалкоксисилоксаны) находят применение в качестве связующих, выдерживающих довольно высокую температуру, в частности для покрытия поверхности форм для точной отливки металла.
Аналогично SiCl4 реагируют диалкилдихлорсиланы, например ((СН3)2SiCl2, образуя диалкоксильные производные:
Их гидролиз при недостатке воды дает так называемые полиалкилсилоксаны:
Они обладают разным (но очень значительным) молекулярным весом и представляют собой вязкие жидкости, используемые в качестве термостойких смазок, а при еще более длинных силоксановых скелетах — термостойкие электроизоляционные смолы и каучуки.
Эфиры ортотитановой кислоты. Их получают аналогично ортокремневым эфирам по реакции:
Это жидкости, легко гидролизующиеся до метилового спирта и TiO2 применяются для пропитки тканей с целью придания им водонепроницаемости.
Эфиры азотной кислоты. Их получают действием на спирты смеси азотной и концентрированной серной кислот. Метилнитрат СН3ONO2, (т. кип. 60° С) и этилнитрат C2H5ONO2 (т. кип. 87° С) при осторожной работе можно перегнать, но при нагревании выше температуры кипения или при детонации они очень сильно взрывают.
Нитраты этиленгликоля и глицерина, неправильно называемые нитрогликолем и нитроглицерином, применяются в качестве взрывчатых веществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен в обращении.
Пентрит — тетранитрат пентаэритрита С(Ch3ONO2)4, получаемый обработкой пентаэритрита смесью азотной и серной кислот, — тоже сильное взрывчатое вещество бризантного действия.
Нитрат глицерина и нитрат пентаэритрита обладают сосудорасширяющим эффектом и применяются как симптоматические средства при стенокардии.
Эфиры фосфорной кислоты — высококипящие жидкости, лишь очень медленно гидролизуемые водой, быстрее щелочами и разбавленными кислотами. Эфиры, образованные этерификацией высших спиртов (и фенолов), находят применение как пластификаторы пластмасс и для извлечения солей уранила из водных растворов.
Известны эфиры типа (RO)2S═O, но они не имеют практического значения.
Из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты производят моющие средства. В общем виде образование таких солей можно изобразить уравнениями:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Они и обладают прекрасными моющими способностями. Принцип их действия тот же, что и у обычного мыла, только кислотный остаток серной кислоты лучше адсорбируется частицами загрязнения, а кальцевые соли алкилсерной кислоты растворимы в воде, поэтому это моющее средство стирает и в жесткой, и в морской воде.6.2 Применение сложных эфиров органических кислот
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты - ацетаты. Прочие эфиры (кислот молочной - лактаты, масляной - бутираты, муравьиной - формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот, а также алкиленкарбонаты. Физико-химические свойства наиболее распространенных сложных эфиров приведены в таблице (см. приложение).
Метилацетат СН3СООСН3. Отечественной промышленностью технический метилацетат выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2Н5СООСН3. Получают методом этерификации на лесохимических предприятиях при переработке синтетической и лесохимической уксусной кислоты, гидролизного и синтетического этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс получения этилацетата на основе метилового спирта. Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы.
Пропилацетат СН3СООСН2СН2СН3. По растворяющей способности подобен этилацетату.
Изопропилацетат СН3СООСН(СН3)2. По свойствам занимает промежуточное положение между этил- и пропилацетат.
Амилацетат Ch4COOCh3Ch3Ch3Ch3Ch4, т. кип. 148° С, иногда называют «банановым маслом» (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто – сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Винилацетат Ch3=CHOOCCh4, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок.
Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли: Ca2+ + 2C17h45COONa→Ca(C17h45COO)2↓ + 2Na+В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.ЗаключениеИсходя из вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение, как в быту, так и в промышленности. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений. Использованные источники информации1. Цветков Л.А. Органическая химия: Учебник для 10-11 классов общеобразовательных учебных заведений. - М.: Гуманит. изд. центр ВЛАДОС, 2001;
2. Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М.,1969-70.;
3. Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия, 1983;
4. http://penza.fio.ru
5. http://encycl.yandex.ruПриложение
Физико-химические свойства сложных эфиров
| Название | Давление пара при 20°С, кПа | Молеку- лярная масса | Темпера- тура кипения при 101,325 кПа. °С | Плотность при 20°С. г/см3 | Показа- тель перелом- ления n20 | Поверхнос- тное натяжение 20°С. мН/м |
| Метилацетат | 23,19 | 74,078 | 56,324 | 0,9390 | 1,36193 | 24,7625,7 |
| Этилацетат | 9,86 | 88,104 | 77,114 | 0,90063 | 1,37239 | 23,75 |
| Пропилацетат | 3,41 | 102,13 | 101,548 | 0,8867 | 1,38442 | 20,53 |
| Изопропилацетат | 8,40 | 102,13 | 88,2 | 0,8718 | 1,37730 | 22,1022 |
| Бутилацетат | 2,40 | 116,156 | 126,114 | 0,8813 | 1,39406 | 25,2 |
| Изоиутилацетат | 1,71 | 116,156 | 118 | 0,8745 | 1,39018 | 23,7 |
| Втор-Бутилацетат | - | 116,156 | 112,34 | 0,8720 | 1,38941 | 23,3322,1 |
| Гексилацетат | - | 114,21 | 169 | 0,890 | - | - |
| Амилацетат | 2,09 | 130,182 | 149,2 | 0,8753 | 1,40228 | 25,8 |
| Изоамилацетат | 0,73 | 130,182 | 142 | 0,8719 | 1,40535 | 24,6221,1 |
| Ацетат монометилового эфира этиленгликоля (метилцеллозольвацетат) | 0,49 | 118,0 | 144,5 | 1,007 | 1,4019 | - |
| Ацетат моноэтилового эфира этиленгликоля (этилцеллозольвацетат) | 0,17 | 132,16 | 156,4 | 0,9748 | 1,4030 | - |
| Этиленгликольмоноацетат | - | 104 | 181-182 | 1,108-1,109 | - | - |
| Этиленгликольдиацетат | 0,05 | 146 | 186-190 | 1,106 | - | - |
| Циклогексилацетат | 0,97 | 142 | 175 | 0,964 | 1,4385 | - |
| Этиллактат | 0,13 | 118,13 | 154,5 | 1,031 | 1,4118 | 28,917,3 |
| Бутиллактат | 0,05 | 146,0 | 185 | 0,97 | - | - |
| Пропиленкарбонат | - | 102,088 | 241,7 | 1,206 | 1,4189 | - |
bukvasha.ru
Реферат: Cложные эфиры
Содержание стр.
Введение -3-
1. Строение -4-
2. Номенклатура и изомерия -6-
3. Физические свойства и нахождение в природе -7-
4. Химические свойства -8-
5. Получение -9-
6. Применение -10-
6.1 Применение сложных эфиров неорганических кислот -10-
6.2 Применение сложных эфиров органических кислот -12-
Заключение -14-
Использованные источники информации -15-
Приложение -16-
Введение
Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Цель моей работы заключается в подробном ознакомлении с таким классом органических соединений, как сложные эфиры и углублённом рассмотрении области применения отдельных представителей этого класса.
1. Строение
Общая формула сложных эфиров карбоновых кислот:

где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Общая формула жиров:

гдеR', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
Алкановые кислоты
1. Масляная кислота СН3 — (Ch3 )2 — СООН
2. Капроновая кислота СН3 — (Ch3 )4 — СООН
3. Пальмитиновая кислота СН3 — (Ch3 )14 — СООН
4. Стеариновая кислота СН3 — (Ch3 )16 — СООН
Алкеновые кислоты
5. Олеиновая кислота С17 Н33 СООН
СН3 —(СН2 )7 —СН === СН—(СН2 )7 —СООН
Алкадиеновые кислоты
6. Линолевая кислота С17 Н31 СООН
СН3 —(СН2 )4 —СН = СН—СН2 —СН = СН—СООН
Алкатриеновые кислоты
7. Линоленовая кислота С17 Н29 СООН
СН3 СН2 СН = CHCh3 CH == CHCh3 CH = СН(СН2 )4 СООН
2. Номенклатура и изомерия
Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс - ат, например:

Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинаетсясо сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
3. Физические свойства и нахождение в природе
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи.
По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.
4. Химические свойства
1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:

Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:

2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:

4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:


5. Получение
1. Реакция этерификации:
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).



Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
2. Взаимодействием ангидридов кислот со спиртами:

3. Взаимодействием галоидангидридов кислот со спиртами:

6. Применение
6.1 Применение сложных эфиров неорганических кислот
Эфиры борной кислоты — триалкилбораты — легко получаются нагреванием спирта и борной кислоты с добавкой концентрированной серной кислоты. Борнометиловый эфир (триметилборат) кипит при 65° С, борноэтиловый (триэтилборат) — при 119° С. Эфиры борной кислоты легко гидролизуются водой.
Реакция с борной кислотой служит для установления конфигурации многоатомных спиртов и была неоднократно использована при изучении Сахаров.
Ортокремневые эфиры — жидкости. Метиловый эфир кипит при 122° С, этиловый при 156° С. Гидролиз водой проходит легко уже на холоду, но идет постепенно и при недостатке воды приводит к образованию высокомолекулярных ангидридных форм, в которых атомы кремния соединены друг с другом через кислород (силоксановые группировки):
 Эти высокомолекулярные вещества (полиалкоксисилоксаны) находят применение в качестве связующих, выдерживающих довольно высокую температуру, в частности для покрытия поверхности форм для точной отливки металла.
Эти высокомолекулярные вещества (полиалкоксисилоксаны) находят применение в качестве связующих, выдерживающих довольно высокую температуру, в частности для покрытия поверхности форм для точной отливки металла.
Аналогично SiCl4 реагируют диалкилдихлорсиланы, например ((СН3 )2 SiCl2 , образуя диалкоксильные производные:

Их гидролиз при недостатке воды дает так называемые полиалкилсилоксаны:

Они обладают разным (но очень значительным) молекулярным весом и представляют собой вязкие жидкости, используемые в качестве термостойких смазок, а при еще более длинных силоксановых скелетах — термостойкие электроизоляционные смолы и каучуки.
Эфиры ортотитановой кислоты. Их получают аналогично ортокремневым эфирам по реакции:

Это жидкости, легко гидролизующиеся до метилового спирта и TiO2 применяются для пропитки тканей с целью придания им водонепроницаемости.
Эфиры азотной кислоты. Их получают действием на спирты смеси азотной и концентрированной серной кислот. Метилнитрат СН3 ONO2 , (т. кип. 60° С) и этилнитрат C2 H5 ONO2 (т. кип. 87° С) при осторожной работе можно перегнать, но при нагревании выше температуры кипения или при детонации они очень сильно взрывают.

Нитраты этиленгликоля и глицерина, неправильно называемые нитрогликолем и нитроглицерином, применяются в качестве взрывчатых веществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен в обращении.
Пентрит — тетранитрат пентаэритрита С(Ch3 ONO2 )4 , получаемый обработкой пентаэритрита смесью азотной и серной кислот, — тоже сильное взрывчатое вещество бризантного действия.
Нитрат глицерина и нитрат пентаэритрита обладают сосудорасширяющим эффектом и применяются как симптоматические средства при стенокардии.
Эфиры фосфорной кислоты — высококипящие жидкости, лишь очень медленно гидролизуемые водой, быстрее щелочами и разбавленными кислотами. Эфиры, образованные этерификацией высших спиртов (и фенолов), находят применение как пластификаторы пластмасс и для извлечения солей уранила из водных растворов.
Известны эфиры типа (RO)2S═O, но они не имеют практического значения.
Из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты производят моющие средства. В общем виде образование таких солей можно изобразить уравнениями:

Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Они и обладают прекрасными моющими способностями. Принцип их действия тот же, что и у обычного мыла, только кислотный остаток серной кислоты лучше адсорбируется частицами загрязнения, а кальцевые соли алкилсерной кислоты растворимы в воде, поэтому это моющее средство стирает и в жесткой, и в морской воде.
6.2 Применение сложных эфиров органических кислот
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты - ацетаты. Прочие эфиры (кислот молочной - лактаты, масляной - бутираты, муравьиной - формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот, а также алкиленкарбонаты. Физико-химические свойства наиболее распространенных сложных эфиров приведены в таблице (см. приложение).
Метилацетат СН3 СООСН3 . Отечественной промышленностью технический метилацетат выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2 Н5 СООСН3 . Получают методом этерификации на лесохимических предприятиях при переработке синтетической и лесохимической уксусной кислоты, гидролизного и синтетического этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс получения этилацетата на основе метилового спирта. Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы.
Пропилацетат СН3 СООСН2 СН2 СН3 . По растворяющей способности подобен этилацетату.
Изопропилацетат СН3СООСН(СН3 )2 . По свойствам занимает промежуточное положение между этил- и пропилацетат.
Амилацетат Ch4 COOCh3 Ch3 Ch3 Ch3 Ch4 , т. кип. 148° С, иногда называют «банановым маслом» (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто – сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Винилацетат Ch3 =CHOOCCh4 , образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок.
Мыла — это соли высших карбоновых кислот.Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:

Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
Ca2+ + 2C17 h45 COONa→Ca(C17 h45 COO)2 ↓ + 2Na+
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.
Заключение
Исходя из вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение, как в быту, так и в промышленности. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений.
Использованные источники информации
1. Цветков Л.А. Органическая химия: Учебник для 10-11 классов общеобразовательных учебных заведений. - М.: Гуманит. изд. центр ВЛАДОС, 2001;
2. Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М.,1969-70.;
3. Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия, 1983;
4. http://penza.fio.ru
5. http://encycl.yandex.ru
Приложение
Физико-химические свойства сложных эфиров
| Название | Давление пара при 20°С, кПа | Молеку- лярная масса | Темпера- тура кипения при 101,325 кПа. °С | Плотность при 20°С. г/см3 | Показа- тель перелом- ления n20 | Поверхнос- тное натяжение 20°С. мН/м |
| Метилацетат | 23,19 | 74,078 | 56,324 | 0,9390 | 1,36193 | 24,7625,7 |
| Этилацетат | 9,86 | 88,104 | 77,114 | 0,90063 | 1,37239 | 23,75 |
| Пропилацетат | 3,41 | 102,13 | 101,548 | 0,8867 | 1,38442 | 20,53 |
| Изопропилацетат | 8,40 | 102,13 | 88,2 | 0,8718 | 1,37730 | 22,1022 |
| Бутилацетат | 2,40 | 116,156 | 126,114 | 0,8813 | 1,39406 | 25,2 |
| Изоиутилацетат | 1,71 | 116,156 | 118 | 0,8745 | 1,39018 | 23,7 |
| Втор-Бутилацетат | - | 116,156 | 112,34 | 0,8720 | 1,38941 | 23,3322,1 |
| Гексилацетат | - | 114,21 | 169 | 0,890 | - | - |
| Амилацетат | 2,09 | 130,182 | 149,2 | 0,8753 | 1,40228 | 25,8 |
| Изоамилацетат | 0,73 | 130,182 | 142 | 0,8719 | 1,40535 | 24,6221,1 |
| Ацетат монометилового эфира этиленгликоля (метилцеллозольвацетат) | 0,49 | 118,0 | 144,5 | 1,007 | 1,4019 | - |
| Ацетат моноэтилового эфира этиленгликоля (этилцеллозольвацетат) | 0,17 | 132,16 | 156,4 | 0,9748 | 1,4030 | - |
| Этиленгликольмоноацетат | - | 104 | 181-182 | 1,108-1,109 | - | - |
| Этиленгликольдиацетат | 0,05 | 146 | 186-190 | 1,106 | - | - |
| Циклогексилацетат | 0,97 | 142 | 175 | 0,964 | 1,4385 | - |
| Этиллактат | 0,13 | 118,13 | 154,5 | 1,031 | 1,4118 | 28,917,3 |
| Бутиллактат | 0,05 | 146,0 | 185 | 0,97 | - | - |
| Пропиленкарбонат | - | 102,088 | 241,7 | 1,206 | 1,4189 | - |
www.yurii.ru
Доклад - Получение простых эфиров
Введение
Простыми эфирами (этерами) называют соединения общей формулы ROR'. По номенклатуре ИЮПАК эфиры рассматриваются как алкоксиалканы. При этом больший радикал считается основным. Для простых эфиров чаще, чем для других классов соединений, применяется радикально-функциональная номенклатура. В этом случае названия образуют из названий радикалов R и R’, связанных с атомом кислорода, добавляя слово «эфир»:
 или
или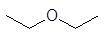
 или
или 
этоксиэтан 2-метокси-2-метилпропан
(диэтиловый эфир) (трет -бутилметиловый эфир, ТБМЭ)
Хорошими протонными растворителями для проведения реакций являются целлозольв и метилцеллозольв. Хорошим растворителем для поведения реакций гидроборирования и для восстановления гидроборатом натрия является диглим.
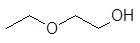
2-метоксиэтанол 2-этоксиэтанол диэтиленгликольдиэтиловый эфир
(метилцеллозольв) (целлозольв) (диглим)
Широкое применение находят циклические эфиры:

окись этилена тетрагидрофуран тетрагидропиран 1,4-диоксан
Простые эфиры имеют ту же геометрию, что и Н2 О (Гиллеспи). Валентный угол С-О-С соответстввует 112о для СН3 ОСН3, что близко к тетраэдрическому углу и указывает на sp3 -гибридизацию атома кислорода.
Молекулы простых эфиров не могут образовывать водородные связи между собой, и поэтому они значительно более летучи, чем спирты с тем же числом атомов углерода. Плотность эфиров меньше, чем воды. Их растворимость в воде, с которой они могут образовывать водородные связи почти такая же как и у изомерных им спиртов, например, диэтиловый эфир и 1-бутанол растворяются в воде в количестве примерно 8 г на 100 мл воды.
Эфиры химически довольно инертны и поэтому широко используются в качестве растворителей. Многие эфиры имеют приятный запах и испозьзуются в парфюмерии.
Упр.1. Изобразите каркасные формулы и назовите по ИЮПАК и общепринятыми названиями следующие эфиры:
(а) 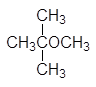 (б)
(б) 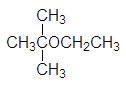 (в)
(в) 
(г) 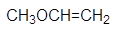 (д)
(д) 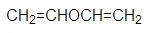
Ответ:
(а) 2-метокси-2-метилпропани (трет -бутилметиловый эфир), (б) 2-метокси-2-метилпропани (трет -бутилэтиловый эфир), (в) транс -2-этоксициклогексанол, (г) метоксиэтен (винилметиловый эфир).
1. Получение простых эфиров
Существует три общих метода получения простых эфиров: межмолекулярная дегидратация спиртов, взаимодействие спиртов с алкенамии и реакция Вильямсона.
1.1. Межмолекулярная дегидратацией спиртов
В присутствии концентрированной серной кислоты, безводной фосфорной кислоты или таких катализаторов, как оксид или фосфат алюминия от двух молекул спирта отщепляется вода:
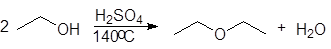 (1)
(1)
диэтиловыйи эфир
Механизм SN 2:
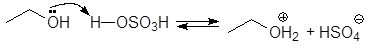
этилгидроксоний (М 1)
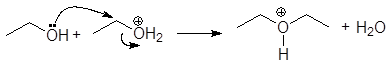
Диэтилгидроксоний
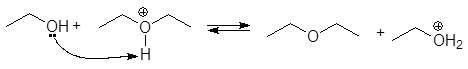
Способ пригоден для получения симметричных простых эфиров из неразветвленных первичных спиртов:
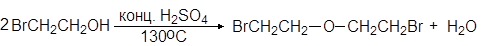 (2)
(2)
b-бромэтиловый спирт b-дибромэтилового эфиров
Дегидратация 1,4-бутандиола в присутствии фосфорной кислоты приводит к образованию циклического эфира тетрагидрофурана (ТГФ):
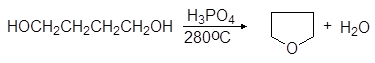 (3)
(3)
1,4-бутандиол тетрагидрофуран (ТГФ)
Рассмотренный метод пригоден лишь для получения симметричных простых эфиров из неразветвленных первичных спиртов, за исключением такого случая, когда один спирт третичный, а второй _ первичный:
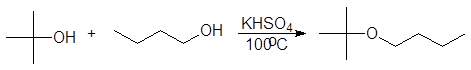 (4)
(4)
трет -бутанол 1-бутанол бутил-трет -бутиловый эфир
В промышленности межмолекулярной дегидратацией спиртов получают диэтиловый, дибутиловый и ряд других простейших эфиров.
Упр.2. Опишите механизм реакции:
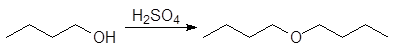
Ответ:
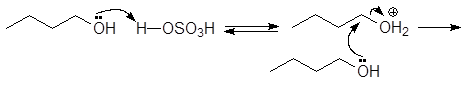
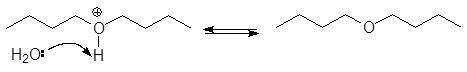
Упр.3. Напишите реакции получения (а) диэтилового, (б) дибутилового и (в) b-дибромэтилового эфиров и (г) тетрагидрофурана (ТГФ) и опишите их механизм.
1.2. Синтез эфиров по реакции Вильямсона
Эта реакция рассматривалась ранее при изучении алкилгалогенидов.

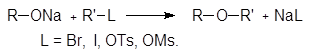
Алкоголяты металлов легко вступают в реакции нуклеофильного замещения, предоставляя алкоксид-анионы RO-. В случае необходимости получения асимметричных эфиров нужно тщательно рассматривать возможность использования галогенуглеводородов и алкоголятов спиртов.
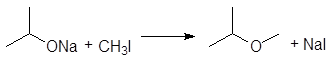 (5)
(5)
2-метоксипропан
 (6)
(6)
бензил-трет -бутиловый эфир
При синтезе алкилариловых эфиров необходимо на фенолят действовать алкилгалогенидом, поскольку арилгалогениды не реагируют с алкоголятами.
Упр.4. Напищите реакции получения следующих эфиров:
(а)  (б)
(б) 
Упр.5. Из каких соединений по Вильямсону можно получить
(а) метилизопропиловый эфир, (б) трет- бутилэтиловый эфир
(в) пропилфениловый эфир? Объясните выбор реагентов.
1.3. Присоединение спиртов к алкенам
В присутствии кислоты спирты присоединяются к алкенами с образованием эфиров. Механизм реакции напоминает механизм гидратации алкенов.
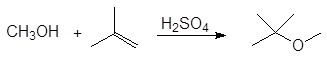 (7)
(7)
трет- бутилметиловый эфир
Механизм:
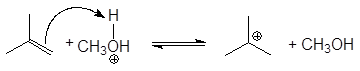 (М 2)
(М 2)
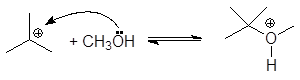
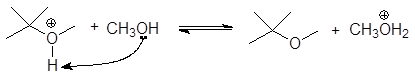
Этот метод часто используется для защиты гидроксильной группы первичных спиртов при проведении реакций с другими функциональными группами этой же молекулы, т.к. трет -бутильная группа легко может быть снята при действии кислоты.
Упр.6. Имея в своем распоряжении 3-бром-1-пропанол и ацетиленид натрия, предложите схему получения сначала 4-пентин-1-ола, а затем
4-гептин-1-ола,
Ответ. Непосредственная реакция исходных продуктов между собой не может привести к желаемому результату, т.к. сильное основание этинид (ацетиленид) натрия прежде всего будет реагировать по гидроксильной группе:
этинид натрия 3-бром-1-пропанол
Поэтому гидроксильную группу в 3-бром-1-пропаноле сначала нужно защитить превратив ее в трет -бутоксильную, а затем действовать ацетиленидом натрия:
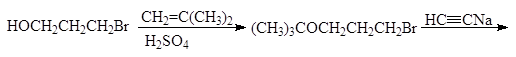
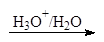
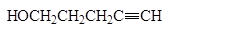
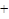
4-пентин-1-ол
Упр.7. Опишите механизм реакции:
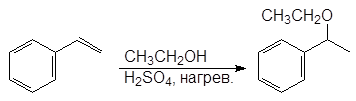
Ответ:
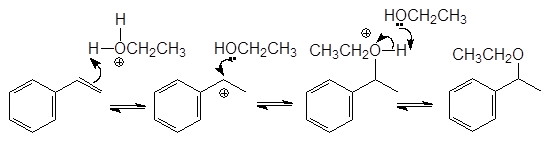
Упр.8. Напишите реакцию образования эфира из метанола и 2-метилпропена (изобутилена) и опишите ее механизм.
А. Синтез эфиров сольватомеркурированием — демеркурированием алкенов
Важным общим методом синтеза простых эфиров является алкоксимер-курирование алкенов. Взаимодействие алкена с ацетатом или трифторацетатом ртути в спирте приводит к образованию алкоксиалкилртутного соединения. Его восстановление боргидридом натрия дает эфир. Этот процесс называют сольватомеркурированием – демеркурированием. Метод аналогичен методу получения спиртов оксимеркурированием-демеркурированием:
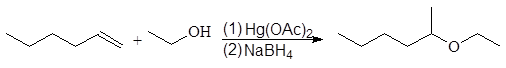 (8)
(8)
1-октен этанол 2-этоксигексан
Суммарный результат соответствует присоединению спирта по двойной связи алкена в соответствии с правилом Марковникова.
Упр.9. Допишите реакции:
(а)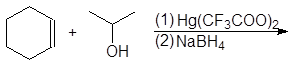
(б)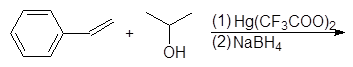
Упр.10. Напишите реакцию получения трет -бутилэтилового эфира методом сольватомеркурирования – демеркурирования.
Б. Присоединение спиртов к алкинам
Спирты присоединяются к ацетилену в присутствии алкоксидов и гидроксидов щелочных металлов с образованием виниловых эфиров:
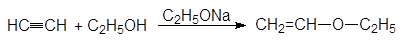 (9)
(9)
винилэтиловый эфир
Реакция протекает при 130-160о С и давлении 5-15 атм и проходит по механизму нуклеофильного присоединения к кратной связи.
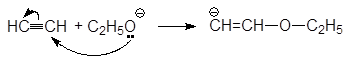 (М 3)
(М 3)
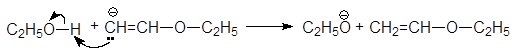
В. Триметилсилиловые эфиры. Силилирование
Гидроксильная группа может быть защищена в нейтральной и щелочной среде превращением ее в триметилсилилэфирную группу. Эта реакция, называемая силилированием, проводится в присутствии третичного амина.
триметилхлорсилан
Эта группа может быть снята действием водного раствора кислоты.
www.ronl.ru


















