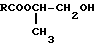1. Общие понятия о циклических эфирах. Простые циклические эфиры
1. Общие понятия о циклических эфирах. Химические свойства простых циклических эфиров на примере этилоксирана
Похожие главы из других работ:
Изучение свойств природных индикаторов, содержащихся в растениях
1. Индикаторы. Общие понятия. Классификация
химия индикатор пигмент растительный Существует несколько определений понятия «индикатор», но во всех определениях индикаторы представлены как вещества, которые меняют цвет в зависимости от того, попали они в кислую...
История алхимии
2.2. Знак и символ (общие понятия)
Знак - изображение несущее конкретное значение. Пример: Символ - изображение, имеющее более широкое значение, чем знак. Если у знака значение определено, то символ имеет множество зачастую противоречивых значений...
Метаморфизм углей
Основные понятия.
Когда говорят об изменении свойств углей, то имеют в виду изменение ОВ гумусовой природы. Изменение свойств углей начинается с момента их образования, то есть после перехода торфа в бурый уголь...
Метод комплексонометрического титрования и его применение в анализе лекарственных веществ
1. Общие понятия
Титриметрический анализ Титриметрический анализ (титрование) - методы количественного анализа в аналитической и фармацевтической химии, основанные на измерении объёма раствора реактива известной концентрации...
Определение термодинамических параметров реакции бис-ацетилацетоната меди (II) с пиридином спектрофотометрическим методом
Общие понятия спектроскопии
Спектроскопия базируется на представлениях квантовой теории, согласно которым любые изменения энергии системы (атомной или молекулярной) приводят к скачкообразным переходам из одного состояния в другое...
Основные понятия о науке химии
1. Основные понятия химии
Вещество - это любая совокупность атомов и молекул. Атом - наименьшая частица элемента в химических соединениях (определение XIX века). Современное определение: атом- это электронейтральная частица...
Оценка правильности определения суммарного содержания антиоксидантов в пищевых продуктах методом Frap с потенциометрическим детектированием
1.1 Общие понятия об антиоксидантах
В настоящее время резко возрос, прежде всего...
Синтез нитроксильных радикалов имидазолинового, имидазолидинового и пирролидинового ряда с объемными заместителями у атомов углерода нитроксильной группы
1.2.1 Способы получения циклических пространственно-затрудненных аминов
...
Смектические жидкие кристаллы. Различные степени упорядочения смектических жидких кристаллов. Параметр порядка смектической фазы
1. Общие понятия о жидких кристаллах
Жидкие кристаллы - вещества, переходящие при определенных условиях (температурара, давление, концентрация в растворе) в жидкокристаллическое состояние, которое является промежуточным между кристаллическим состоянием и жидкостью...
Теплообменник для нагрева смеси бензол-толуол
1.1.1 Общие понятия о теплообменных аппаратах
Теплообменниками называют аппараты, предназначенные для передачи тепла от одних веществ к другим. В зависимости от этого теплообменные аппараты называют подогревателями, холодильниками...
Физико-химические основы хроматографического процесса
Основные понятия и определения
Возможность разделения смесей на слое порошка известна давно, однако часть открытия хроматографии как метода разделения веществ принадлежит Цвету, который впервые применил в 1903г...
Фотохимические процессы в верхних слоях атмосферы
2. Основные понятия
Атмосфера - газовая оболочка (геосфера), окружающая планету Земля. Внутренняя её поверхность покрывает гидросферу и частично кору, внешняя граничит с околоземной частью космического пространства...
Химия древесины
1. ОБЩИЕ ПОНЯТИЯ О ВМС. КЛАССИФИКАЦИЯ ПОЛИМЕРОВ. ПОЛЯРНЫЕ И НЕПОЛЯРНЫЕ ПОЛИМЕРЫ
...
Химия древесины
1.1 Общие понятия о ВМС
Высокомолекулярные соединения (ВМС), или полимеры, получили свое название благодаря их высокой молекулярной массе. По своим свойствам они отличаются от других соединений...
Электрохимические методы анализа
ГЛАВА 1. ОБЩИЕ ПОНЯТИЯ. КЛАССИФИКАЦИЯ ЭЛЕКТРОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА
Электроаналитическая химия включает электрохимические методы анализа, основанные на электродных реакциях и на переносе электричества через растворы...
him.bobrodobro.ru
Эфиры простые циклические - Справочник химика 21
Простые эфиры, особенно циклического строения, легко окисляются воздухом с образованием пероксидов. Присутствие последних крайне нежелательно, так как они разрушают сорбенты с привитой фазой и полимерные сорбенты, а также окисляют лабильные компоненты анализируемых смесей и поглощают в УФ-области. Наиболее часто из растворителей этого класса применяют тетрагидрофуран, обычно стабилизированный гидрохиноном. Перед перегонкой проверяют наличие пероксидов в тетрагидрофуране. К 1 мл растворителя прибавляют 1 мл. 10%-ного раствора К1 или Nal в ледяной уксусной кислоте. При низкой концентрации пероксида раствор окрашивается в желтый цвет, а при высокой — в коричневый. При заметном содержании пероксидов во избежание взрыва при перегонке их удаляют кипячением с 0,5% U2 I2 в течение 30 мин. Тетрагидрофуран после удаления пероксида хранят над твердым КОН (10—15% об.] в плотно закрытой бутыли из темного стекла в атмосфере инертного газа и перегоняют непосредственно перед, применением. Чистота полученного растворителя вполне достаточна дпя проведения эксклюзионной хроматографии на полужестких полистироль-ных гелях при детектировании рефрактометром. В других вариантах, особенно при работе с УФ-детектором, может потребоваться дополнительная адсорбционная очистка. [c.133] Образование простых циклических эфиров. [c.84]Близко к простым эфирам стоят циклические простые эфиры (эпоксисоединения). Их можно рассматривать как продукты внутримолекулярной дегидратации гликолей [c.166]
Сложные циклические эфиры — лактоны превращаются в линейные полимеры под влиянием активаторов, а также по анионному и катионному механизмам. В отличие от пятичленных простых циклических эфиров пятичленный лактон — у-бутиролактон не полимеризуется, а четырех-, шести- и семичленные лактоны полимеризуются. Это объясняется, по-видимому, тем, что наличие карбонильной группы в лакто-нах изменяет их термодинамическую характеристику. [c.119]
I. К какому классу органических соединений относится розен-оксид а. Алкен б. Диалкиловый эфир в. Циклический простой эфир [c.115]
Этим способом получают простейшие простые эфиры — диэти-ловый, дипропиловый и дибутиловый эфиры и циклические простые эфиры, например тетрагидрофуран иш диоксан. Вторичные и третичные спирты в этих условиях дегидратируются с образованием алкенов [c.263]
I. Какие классы органических соединений называют лакто-нами а. Циклический кетон б. Циклический простой эфир в. Циклический сложный эфир [c.182]
Когда реагентом служит карбоновая кислота, в качестве катализатора можно использовать протонные кислоты. Смешанные ангидриды карбоновых и сульфоновых кислот R OOSO2 F3 являются чрезвычайно реакционноспособными ацилирующими агентами и могут гладко ацилировать бензол в отсутствие катализатора [240]. В случае реакционноспособных субстратов (например, ариловых простых эфиров, конденсированных циклических систем, тиофенов) ацилирование по Фриделю — Крафтсу можно проводить в присутствии очень малых количеств катализатора, часто достаточно его следов, а иногда реакция идет и в его отсутствие. При проведении реакции таким способом обычно используют катализ хлоридом железа (HI), иодом, хлоридом цинка и железом [241]. [c.356]
Для дисперсионной полимеризации простых циклических эфиров используют стабилизаторы на основе растворимых полимеров, содержащих реакционноспособные группы, способные к взаимодействию с основными полимеризуемыми молекулами или такими группами, как гидроксильные или карбоксильные, которые могут инициировать или обрывать основную полимерную цепь [45]. Были использованы также различные предварительно полученные привитые сополимер-стабилизаторы [46]. Недавно описано применение набухшего геля полиэпоксида для стабилизации полимерной дисперсии [47]. [c.243]
Простые циклические эфиры [c.297]
Эпоксиэтан окись этилена) Простейший циклический простой эфир — эпоксиэтан — легко вступает в реакции с раскрытием напряженного трехчленного цикла [c.554]
К образованию перекисей склонны все простые эфиры, особенно циклические, такие, как диоксан и тетрагидрофуран. Перегонка больших количеств эфира производится в специально оборудованных лабораториях с принятием особых мер предосторожности. В силу своей дешевизны и способности растворять многие органические соединения этиловый эфир находит широкое применение в работе химических лабораторий. Необходимо помнить, что он имеет низкую температуру кипения (34,48°), образует с воздухом взрывоопасные смеси в пределах 1,85—36,5 об. %. При неаккуратном хранении на воздухе он окисляется с образованием перекисей, легко взрывающихся при сотрясении сосуда или при нагревании. Необходимо всегда помнить об особой огнеопасности эфира. Пары его в 2,5 раза тяжелее воздуха, имеют низкую температуру вспышки и достаточно очень небольшого источника для его воспламенения. [c.110]
Химия гетероциклов составляет значительную часть всей органической химии в целом. Объем этого раздела так велик, что в любом однотомнике пришлось бы пропустить больше сведений, чем включить в него. Планируя этот очерк, нужно было серьезно подумать и об объеме материала, и о его лучшем расположении. Эти проблемы решались с учетом возможных запросов будущих читателей. Некоторым из них потребуются начальные знания химии гетероциклов, поэтому книга должна содержать сведения о более знакомых и обычных системах. Но кроме таких читателей будут и специалисты, которым нужна информация о сложных и менее стандартных структурах, представляющих практический интерес. Такие данные тоже следовало включить в книгу, и поэтому некоторые разделы, например химия пуринов (см. гл. 17.5) и мезоионных соединений (см. гл. 20.4), рассмотрены более глубоко. Следствием такой осмотрительности оказалось многое в традиционном способе изложения, где гетероциклические системы сгруппированы по числу и типу гетероатомов, размеру и количеству имеющихся колец. Чтобы не нарушить полноты изложения в других книгах этого издания, из тома 4 по большей части исключено описание насыщенных гетероциклических систем. Например, циклические простые эфиры и циклические амины рассматриваются главным образом в главах 4.4 и 6.1 (см. тома 2 и 3 русского перевода настоящего издания). [c.14]
Определение конфигурации атома С-8 основывается на образовании простых циклических эфиров (формула II). Только цинхонин и хинидин, но не цинхонидин и хинин могут образовать подобные эфиры. В двух первых алкалоидах группа R H(OH), связанная с С-8, имеет ис-ориентацию (III), а в двух остальных — тракс-ориентацию (IV) по отношению к мостику С-2—С-З [c.984]
Этрш способом получают простейшие простые эфиры - диэтиловый, дипропиловый и дибутиловый эфиры и циклические простые эфиры, например тетрагидрофуран или [c.882]
Гидрированные предельные гетероциклы не проявляют ароматических свойств. Тетрагидрофуран представляет собой циклический простой эфир, тетрагидротиофен — циклический тиоэфир, или сульфид, а тетрагидропиррол — циклический вторичный амин. [c.414]
Крауны представляют собой простые циклические полиэфиры, содержащие от 9 до 60 атомов в кольце, в том числе от 3 до 20 атомов кислорода многие из них ирп комнатной температуре являются твердыми веществами и далеко не всегда используются как растворители. Некоторые крауны образуют весьма стабильные комплексы с рядом катионов металлов и катионом аммония. См. [13, 14]. В какой-то мере подобными свойствами обладают некоторые бпапклическпе диамины, содержащие оксиметиленовые мостики атомы азота расположены в голове мостиковон связи) эти соединения способны капсулировать катионы металлов с образованием криитатов. См. 15]. В обзоре [16] обсулспособность простых циклических полиэфиров, политио-эфиров, полиаминов и подобных соединений связывать ионы металлов. Обзор [17] также посвящен простым полиэфирам [c.29]
Химия гетероциклов составляет значительную часть органической химии. Объем материала очень велик, и в рамках данного издания изложить его полностью ие представлялось возможным. При отборе материала и его расположении мы старались учесть возможные запросы будущих читателей. Некоторым из них необходимы лишь начальные сведения о химии гетероциклов, поэтому в книгу следовало вк 1ючить более простые и обычные системы однако специалистам нужна информация, причем более подробная, о сложных и меиее стандартных структурах, представляющих практический интерес, поэтому некоторые разделы, например химия пуринов (гл. 17.5) и мезоионных соединений (гл. 20.4), рассмотрены более глубоко. Вследствие такого подхода был избран традиционный способ изложения гетероциклические системы сгруппированы по типу и числу гетероатомов, размеру и числу имеющихся колец. Чтобы не нарушить полноты изложения в других разделах этого издания, из тома 4, как правило, исключены описания насыщенных гетероциклических систем. Например, циклические простые эфиры и циклические амины рассмотрены в основном в главах 4.4 и 6.1. [c.14]
Многие гетероциклические соединения под действием ионных инициаторов могут полимеризоваться с раскрытием цикла, образуя линейные макромолекулы. К таким соединениям относятся простые циклические эфиры, циклические ацетали, циклические сложные эфиры (лактоны), циклические амиды (лактамы) и цикличе-ске aMHFibi. Полимеризацию с раскрытием цикла проводят в таких же условиях и часто в присутствии тех же инициаторов, что и ионную полимеризацию ненасыщенных мономеров (см. раздел 3.2.1) следовательно, эти реакции чувствительны к тем же примесям. [c.162]
Простые циклические эфиры с малым размером цикла, такие как оксетан и оксолан (тетрагидрофуран), реагируют с монооксидом углерода в аналогичных условиях, образуя с умеренными выходами лактоны [схема (6.49)], хотя в данном случае также возможно последующее карбонилирование. [c.207]
Техника дисперсионной полимеризации в органической среде нашла также применение в ряде случаев полимеризации гетероциклических соединений с раскрытием цикла при ионном инициировании. Сюда относится полимеризация простых циклических эфиров (эпоксиды, оксациклобутаны), сложных циклических эфиров (лактоны), циклических амидов (лактамы) и циклических анеталей (триоксан) [c.242]
Приготовление простых циклических эфиров восстановлением у-или (5-окси-кето-карбонильных соединений или 1,2- и 1,3-дикарбоксиль-ных соединений с водородом температура 200— 500°, лучше 240—400° давление 30—650 ат [c.147]
Циклические ангидриды. Для решения вопросов стереохимии кроме методов получения лактонов и простых циклических эфиров используется также метод окисления природных соединений до дикарбоновых кислот, способных при соответствующей конфигурации к образованию ангидридов. Этот метод широко применялся в области стероидов, и полученные данные легли в основу многих выводов относительно стереохимии этих соединений. Типичный пример описан Виланд ом и Дэйном [144], изучившими стереохимию сочленения колец /D в 12-кетохолановой кислоте LXXXVII. [c.590]
Имеется достаточное количество данных [25, 33], свидетельствующих о том, что катионы металлов очень эффективно сольвати-руются эфирами и что строение ряда металлорганических производных в большей степени зависит от донорной способности эфирного растворителя, в котором они обычно получаются. Рассмотрение этого явления с позиции принципа жестких и мягких кислот и оснований [34] дает возможность предположить, что кислородсодержащие основания, обычно относящиеся к жестким, должны легко координироваться с жесткими кислотами, из которых в настоящем обсуждении особый интерес вызывают катионы щелочных и щелочноземельных металлов. Обширное гидратнро-вание этих ионов в водных растворах находится, естественно, в прямом соответствии с принципом , поэтому следует ожидать, что эфиры должны легко занимать координационную сферу ионов этих металлов и что должна существовать зависимость между координирующей способностью и структурой эфира. Комплексующее действие простых эфиров по отношению к ионам щелочных металлов находит наиболее полное выражение в макроциклических полиэфирах, которые обсуждаются в разд. 4.4.5.2, здесь же мы ограничимся рассмотрением простых циклических эфиров. [c.374]
Гетероциклические соединения приведенного типа по своему химическому поведению существенно не отличаются от ациклических соединений с аналогичным строением. Как и в классе циклопарафинов, известны в ббльшем числе и более устойчивы гетероциклические соединения с пяти- и шестичленными циклами это обусловлено тем, что валентные углы приведенных гетсроатомов незначительно отличаются от валентного угла углерода. Простые циклические эфиры, а также ангидриды, имиды и лактоны по своему химическому поведению сходны с ациклическими эфирами. Поэтому вполне обоснована трактовка гетероциклических соединений такого типа вместе с ациклическими соединениями аналогичного строения и поведения. [c.586]
Простейший циклический эфир — окись этилена — служит исключением из сделанного выше обобш,ения, согласно которому большинство простых эфиров устойчивы к расш еплению. В этом соединении трехчленный цикл подобно циклопропану является высоконапряженным и легко раскрывается в мягких условиях. Важное значение окиси этилена связано с легкостью, с которой он превраш ается в другие важные соединения например, этиленгликоль, диэтиленгликоль, целлозольвы и карбитолы, диоксан, этиленхлор-гидрин и полимеры (карбовакс). [c.370]
chem21.info
Циклический простой эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Циклический простой эфир
Cтраница 1
Циклические простые эфиры имеют интересную склонность к увеличению размеров кольца. [1]
Циклические простые эфиры ( тетрагидрофуран, диоксан) смешиваются с водой. [2]
Циклические простые эфиры с трехчленным ( а-оксидным) кольцом называют эпоксидами ( приставка epi обозначает соседнее положение), алкеноксидами. [3]
Циклические простые эфиры несколько отличаются от эфиров с открытой цепью тем, что само кольцо может иметь собственные колебания, которые, хотя и не яв-пяются колебаниями С-О как таковыми, тем не менее достаточно характеристичны для идентификации кольца. Исследования в этом направлении проводились, например, в отношении эпоксигруппы, но для того, чтобы стала возможной достаточно надежная идентификация этих групп, требуется располагать значительным количеством дополнительных данных. [4]
Циклические простые эфиры стали ценными промышленными продуктами, и их используют как промежуточные продукты синтеза и в качестве растворителей. Замыкание цикла осуществляют посредством реакций, аналогичных образованию ациклических простых эфирных связей. [5]
Другие алифатические и циклические простые эфиры ( ди-н-пропиловый и диизопропиловый эфиры, N-метил-морфолин) применялись редко. Однако при его применении для разложения реакционной смеси можно пользоваться только щелочным гидролизом, так как при действии кислот метилаль быстро гидролизуется. [6]
Такие ненасыщенные циклические простые эфиры, как 3 4-ди-гидро - 2Н - пиран и 2 3-дигидрофуран, представляют собой виниловые эфиры и характеризуются ожидаемой для них способностью подвергаться присоединениям под действием электрофильных инициаторов. Ди-гидро - 2Н - пиран находит широкое применение в качестве защитной группы в синтезе олигонуклеотидов, однако он обладает тем недостатком, что в случае хиральных спиртов образуются диасте-реомерные ацетали. Этот недостаток может быть устранен [129] при использовании винилового эфира 4-метокси - 5 6-дигидро - 2Н - пи-рана; присоединение спирта к этому соединению не приводит к образованию нового хирального центра. [7]
Из циклических простых эфиров получаются лактоны. [8]
Получение циклических простых эфиров из спиртов обработкой иодпм и тс трнацетнтпм свирща при пблучении, обсуждавшееся выше в разд. [9]
Эпоксидами называют циклические простые эфиры. [10]
По поглощению циклические простые эфиры несколько отличаются от эфиров с открытой цепью, поскольку кольцо может иметь собственные колебания, которые, хотя и не являются колебаниями С-О как таковыми, тем не менее достаточно характеристичны для идентификации гетеро-цикла. [11]
Дигидропиран как циклический простой эфир енола может присоединять спирты, давая ацетали ( ср. [12]
Диоксан представляет собой циклический простой эфир и по химическим свойствам подобен алифатическим простым эфи-рам, он устойчив к действию кислот, щелочей, аммиака, металлического натрия. [13]
В число циклических простых эфиров не включены циклические аце-тали, которые рассматриваются в специальном разделе, хотя по некоторым свойствам соединения этих обоих классов близки. [14]
Интересный пример образования циклического простого эфира был приведен [105] в связи с изучением стереохимии алкалоида ундулатина. [15]
Страницы: 1 2 3
www.ngpedia.ru
3.4.3. Способы получения
важнейшие способы получения простых эфиров связаны с нуклеофильными реакциями спиртов и их производных (алкоголятов) — гл. 3.3.3.1 и 3.2.2.1. Этими способами являются:
Межмолекулярная дегидратация спиртов:
2 R-ОН R-O-R
Однако такой способ в наибольшей степени подходит для получения симметричных эфиров, так как при попытке получить смешанный эфир ROR из спиртов R-ОН и R-ОН в реакционной смеси будут обнаружены значительные количества примесей эфиров состава ROR и RОR.
Реакция Вильямсона — способ, пригодный для получения как симметричных, так и смешанных эфиров:
R-X + R-O¯Na+ R-O-R + NaX
Для получения метилалкиловых эфиров применяют метилирование спиртов, для чего используется диметилсульфат (гл. 3.5.1) или диазометан.
R-ОН + (Сh4)2SO4 + NaOH R-O-Ch4 + NaCh4SO4 + h3O
диметилсульфат
диазометан
3.4.4. Циклические простые эфиры
Циклические простые эфиры содержат внутримолекулярную эфирную связь и по структуре представляют собой гетероциклические кислородсодержащие соединения. Они могут быть классифицированы в зависимости от размера цикла и числа кислородных атомов. Для названия циклических простых эфиров применяются заместительная, радикало-функциональная, заменительная номенклатуры (гл. 1.5) и номенклатура гетероциклических соединений. При этом для полиэфиров, т. е. для соединений, содержащих несколько атомов кислорода, применяются как заменительная номенклатура (гл. 1.5.3), так и номенклатура гетероциклических соединений (гл. 12.1).
По заместительной номенклатуре используется неотделяемая приставка эпокси- с указанием цифровыми локантами атомов углерода, связанных с кислородным мостиком.
По радикало-функциональной номенклатуре к названию двухвалентного углеводородного радикала, связанного с кислородным атомом, прибавляют используемое здесь название функционального класса «оксид».
Основой названия по заменительной номенклатуре является циклический углеводород (гл. 8.1) и используется заменительная приставка окса-.
По номенклатуре гетероциклических соединений название первого представителя циклических простых эфиров оксиран.
Примеры циклических простых моноэфиров и их названий:
.
1,2-эпоксиэтан, 1,2-эпоксибутан, 1,4-эпоксибутан,
этиленоксид, бутиленоксид, тетраметиленоксид,
оксиран этилоксиран тетрагидрофуран
3.4.4.1. Особенности строения и свойств 1,2-эпоксисоединений (оксиранов)
Эпоксиэтан представляет собой почти правильный треугольник со значительно деформированными валентными углами ( 60), сильно отличающимися от углов в обычных простых эфирах. Напомним, что в диалкиловых эфирах СОС составляет 109—112, а валентные углы насыщенного атома углерода также близки к 109.
Химические свойства оксиранов определяются наличием в молекуле полярных связей С–О, атома кислорода с неподелёнными парами электронов и угловым напряжением в трёхчленном цикле. Принципиальное отличие их превращений лишь в том, что реакции, характерные для простых эфиров, здесь протекают легко и сопровождаются раскрытием цикла, т.е. образуются продукты присоединения.
Реакции могут протекать и со слабыми нуклеофилами без катализатора, например с водой, но при повышенной температуре; с сильными нуклеофилами (амины, металлорганические соединения) взаимодействие протекает легко:
Кислотный катализ значительно увеличивает реакционную способность эпоксидов за счёт увеличения полярности связи С–О в исходном субстрате:
настолько, что присоединение воды и спиртов протекает легко.
В тех случаях, когда R и R являются разными углеводородными радикалами, направление расщепления эпоксидного цикла определяется механизмом реакции. Если механизм бимолекулярный, то нуклеофил атакует менее экранированный (замещённый) атом углерода. Если же в присутствии кислот может образоваться стабилизированный карбокатион, то реакция протекает по мономолекулярному механизму, первой стадией которой является разрыв одной из С–О-связей субстрата, и нуклеофил затем присоединяется по карбокатионному центру. Например:
Кислоты Льюиса в безводных средах вызывают димеризацию, олигомеризацию и полимеризацию 1,2-эпоксисоединений:
3.4.4.2. Способы получения 1,2-эпоксисоединений
Оксираны можно получить внутримолекулярным алкилированием -галогенозамещённых спиртов (галогенгидринов) и прямым окислением алкенов.
Кислотные свойства галогенгидринов повышены вследствие акцепторного влияния галогена, и в присутствии сильных оснований происходит образование аниона, в котором протекает нуклеофильное замещение:
Прямое окисление алкенов протекает по схеме:
Например, эпоксиэтан образуется при окислении этена кислородом воздуха на серебряном катализаторе при 520 К:
Эта реакция имеет большое промышленное значение. Мировое производство этиленоксида составляет 5 млн т в год.
Эпоксипроизводные других алкенов можно получить применением органических пероксикислот (RCOOOH) — реакция Прилежаева* (гл. 4.1.4.3, 6.4.6).
3.4.4.3. Краун-эфиры
Краун-эфиры — циклические полиэфиры, содержащие 9—60 атомов в цикле, в том числе от 3 до 20 эфирных атомов кислорода. Они открыты Чарльзом Педерсеном в 1960-х годах, за что ему в 1987 году (совместно с Дональдом Крамом и Жан-Мари Лёном) была присуждена Нобелевская премия.
Эти макроэфиры представляют собой бесцветные кристаллические или маслообразные вещества, устойчивые к действию кислот и оснований.
Ч. Педерсеном была предложена также и номенклатура краун-эфиров, общие правила которой заключаются в следующем. Название краун-эфира включает: 1) общее число атомов макроцикла, 2) термин «краун», 3) число атомов кислорода, то есть число эфирных звеньев в кольце краун-соединения. Имеющиеся в этой молекуле ароматические или циклогексановые кольца обозначают приставками бензо- и циклогексил-. Например:
дибензо-18-краун-6
Эти номенклатурные правила не всегда точно могут описать тип связей в соединении и положение заместителей, однако они очень удобны для обычных краун-эфиров с симметричными и сравнительно простыми структурами.
Самое важное свойство краун-эфиров — образование комплексов с металлами. Полость внутренней части, например, такой молекулы:
достаточна по размеру для того, чтобы там разместился ион калия, а наличие шести атомов кислорода обеспечивает возможность образования прочной системы координационных связей:
Чем ближе ионный диаметр металла к диаметру полости макроцикла, тем устойчивее комплекс. Так, 18-краун-6 больше подходит для ионов калия, а 15-краун-5 — для ионов натрия. Поэтому комплексы такого типа достаточно хорошо растворимы в органических растворителях.
В общем случае наличие полости в центре макроциклической полиэфирной системы обусловливает способность таких соединений поглощать неорганический катион, размер которого соответствует размеру этой полости, и удерживать его там за счёт сильных ион-дипольных взаимодействий положительного заряда иона с неподелёнными электронными парами шести атомов кислорода, обрамляющих полость.
Применение краун-эфиров в органических реакциях связано с образованием таких катионных комплексов, что делает возможным растворение неорганических солей в неполярных растворителях и способствует образованию несольватированного аниона. Это приводит к возрастанию основности аниона и, кроме того, за счёт малого размера несольватированный анион в качестве нуклеофила способен атаковать пространственно затруднённые реакционные центры.
В определённой степени краун-эфиры моделируют действие некоторых природных веществ (например, антибиотика пептидной природы валиномицина), облегчающих транспорт ионов через клеточные мембраны.
Синтезируют краун-эфиры алкилированием этиленгликоля, диэтиленгликоля НОСН2СН2ОСН2СН2ОН, триэтиленгликоля НОCН2СН2ОСН2СН2ОСН2СН2ОН подходящими реагентами, например, 2,2-дихлордиэтиловым эфиром O(Ch3Ch3Cl)2.
studfiles.net
Эфиры простые общие циклические - Справочник химика 21
По своему химическому поведению многоатомные спирты вполне аналогичны простейшим гликолям и дают общие для этого класса веществ производные (простые и сложные эфиры, циклические ацетали и кетали, из которых наибольшее применение получили изопропилиденовые и бензилиденовые производные). [c.101]В том же порядке располагаются циклы, содержащие вместо некоторых метиленовых групп другие атомы или группы атомов. Хотя данных для таких циклов, как простые эфиры, лактоны и лактамы, явно недостаточно, общие положения подтверждаются. Замена метиленовой группы на кислород, карбонил, азот или какую-либо группу не влияет практически на валентные углы в циклических структурах. Напряжение цикла, вызванное отталкиванием заместителей, уменьшается при замене метиленовой группы на менее объемистую карбонильную группу или кислород, что приводит к повышению термодинамической устойчивости цикла. Бьшо также показано, что в отличие от водорода другие заместители в циклических структурах, как правило, повышают их стабильность, хотя причина этого не совсем понятна. [c.68]
Эпоксиды. Циклические простые эфиры с трехчленным (а-окисным) кольцом называют эпоксидами (слово ер применяется для обозначения соседних положений). Их называют также окисями алкенов. Формула этих соединений в общем виде может быть записана так [c.185]Общий характер распада циклических форм сахаров или, вернее, их простых или сложных эфиров во многом напоминает фрагментацию полностью алкилированных или ацетилированных многоатомных спиртов. Различие состоит [c.140]
Очень простой синтез циклических простых эфиров с размером цикла от пяти до семи звеньев заключается в нагревании соответствующего а,ш-диола с 0,5 моль-экв диметилсульфоксида [100], Тетрагидрофуран, тетрагидропиран и оксепан при этом получаются с выходами 70 47 и 24% соответственно. Удовлетворительный выход оксепана заслуживает внимания, однако в оригинальном сообщении предполагается, что продукт может потребовать дальнейшей очистки. Дегидратация а,б-диолов в близких условиях, но с использованием большего количества диметилсульфоксида может быть использована для синтеза разнообразных тетрагидрофуранов [101], однако эта реакция не носит общего характера, и третичные спирты имеют тенденцию к образованию ненасыщенных. ациклических соединений наряду с требуемым продуктом. [c.398]
Образование межмолекулярных ангидридных соединений возможно из спиртов (простые эфиры), спиртов и кислот (сложные эфиры), кислот (ангидриды кислот). Внутримолекулярные ангидридные соединения получаются из многоатомных спиртов (окиси), из многоосновных кислот (циклические ангидриды). Для многоосновных кислот и многоатомных спиртов характерно образование полных или неполных ангидридов. Общее для всех этих ангидридов — содержание окисного атома кислорода, т. е. кислорода, связанного с двумя атомами углерода С—О—С. Такая связь менее прочна, чем углерод-углеродная связь, ее прочность зависит от степени окисленности органического радикала, с которым связан кислород. В связи с этим стойкость ангидридных соединений уменьшается в ряду простой эфир [c.253]
Своеобразно идет реакция в случае бромпроизводных циклических простых эфиров типа дигидропирана. При действии RM (М — щелочной металл) ее в общей форме можно написать так [c.488]
Исследования в области катионной полимеризации циклических эфиров, за исключением эпоксидных соединений и формалей, начаты сравнительно недавно, и первая работа в этой области, посвященная полимеризации тетрагидрофурана, опубликована Меервейном [1] в 1947 г. В настоящее время известно уже много примеров полимеризации этого типа, однако очень мало работ посвящено обсуждению механизма, и только в одной работе исследовали кинетику реакции. Простые эфирные связи обычно устойчивы, поэтому, исходя из общих соображений, можно ожидать, что реакция [c.366]
В циклической части могут содержаться нафтеновые кольца, азот, сера, т. е. смолы представляют собой соединения ароматического, нафтено-ароматического характера типа сульфидов или простых эфиров. Это соответствует и общим химическим реакциям смол, изученных ранее различными авторами. [c.54]
Установлена линейная зависимость между величиной растворимости GHF2 I и Av — смещениями полосы OD-связи в инфракрасном спектре СгНбОО, а также между ДЯ — теплотами смешения электронодонорных жидкостей с хлороформом и Д /. Существование последней зависимости позднее подтвердили также Сирлес, Тамрес и Барроу [84—86] на примере простых и циклических эфиров, лактонов, кетонов, сульфоксидов и азотистых оснований. Заметим, что точки для веществ, относящихся к разным классам азотистых оснований, ложатся на общую прямую, которая выражается уравнением [c.290]
В общем случае реакции замыкания цикла в галогеноспиртах или эквивалентных им соединениях в основных условиях служат полезным методом получения пяти-, шести- и семичленных циклических простых эфиров, хотя при использовании этого метода ок сепаны, как правило, получаются с низким выходом. В подходящих случаях можно использовать а,ой-дибромалканы, поскольку в водной среде они гидролизуются с образованием галогеноспиртов. Еще один метод состоит в обработке диола 1 моль-экв сульфонилгалогенида, в результате чего получается моносульфонат, где сульфонилоксигруппа может действовать в качестве эффективной уходящей группы. Для реакций дитиоацеталей рибозы, ксилозы,, ликсозы и арабинозы с сульфонилгалогенидами в пиридине обнаружена интересная зависимость тенденции к замыканию цикла от стереохимии [104]. Первые три из перечисленных пентоз дают [c.399]
Используемая для краун-эфиров сокращенная номенклатура довольно проста первое число означает общее число атомов в кольце, а второе — общее число гетероатомов. Легко усмотреть аналогию между такими комплексами, имеющими полость для связывания лиганда Ь, и активным центром фермента, специфически узнающим свой субстрат. Размер макроцикла может меняться и тем самым обеспечивать связывание лигандов разных размеров. Циклические полиэфиры типа краун сравнительно легко можно получить и подвергнуть разнообразным структурным модификациям. Эту область химии Крам предложил назвать химией до-норно-акцепторного комплексообразования [134—136]. Напомним также о гипотезе замка и ключа , предложенной Фишером в 1894 г. для описания структурного соответствия между ферментом и его субстратом в ферментсубстратном комплексе. Помимо ферментативного катализа и ингибирования комплексообразование играет первостепенную роль в таких биологических процессах, как репликация, хранение и передача генетической информации, иммунный ответ и транспорт ионов. В настоящее время накоплено уже достаточно сведений о структуре таких комплексов, чтобы подтолкнуть химиков-органиков к созданию высокоструктурированных молекулярных комплексов и к изучению специфического химизма процессов комплексообразования. [c.266]
Класс углеводов объединяет моносахариды — соединения, имеющие химическую природу оксиальдегидов или окси кетонов, но су шествующие преимущественно в таутомерных циклических формах дисахариды (или в более общем виде — олигосахариды от греч. олигос — мало) — продукты конденсации друг с другом двух (вообще нескольких) молекул моносахаридов по типу простых эфиров с выделением воды полисахариды — высокоыолекуляриые вещества, продукты конденсации большого числа молекул моносахаридов. [c.280]
СНзОСНз > С2Н5ОС2Н5. Некоторые двух- и трехатомные простые эфиры, например диглим, и некоторые циклические простые эфиры, например тетрагидрофуран, хорошо сольватируют катионы определенных размеров, главным образом потому, что атомы кислорода находятся в благоприятном положении для максимального взаимодействия с катионом. Можно полагать, что некоторые пира-нозиды с аксиальными метоксильной или оксигруппой должны быть хорошими сольватирующими растворителями общего характера для катионов подходящего размера, например натрия [49]. Специфическая сольватация катионов растворителями, как лигандами, рассматривается ниже. [c.11]
Относительная основность некоторых эфиров по отношению к водным растворам серной кислоты измерялась методом экстракции растворителем — ГЖХ [24]. Значения р/Са их океониевых ионов показали, что в общем случае циклические эфиры обладают заметно большей основностью, чем простые ациклические эфиры, и что основность понижается в следующем ряду оксепан (—2,02), тетрагидрофуран (—2,08), тетрагидропиран (—2,79), 1,4-диоксан (—3,22), диэтиловый эфир (—3,59). Большая основность тетрагидрофурана по сравнению с тетрагидропираном по отношению к хлориду водорода отмечена при использовании в качестве критерия констант закона Генри, причем этот порядок находит объяснение с позиций ослабления отталкивающих взаимодействий неподеленных пар электронов атома кислорода и электронов соседних связей С—Н при протонировании. [c.372]
В табл. 21а приведена большая часть литературных данных по различным способам измерения основности простых эфиров. Для наглядного сравнения этих методов в табл. 5 приведены качественные ряды основности нескольких особенно важных соединений по отноше1[ию к некоторым кислотным системам. Из этих данных можно сделать общий вывод, что циклические эфиры, как правило, значительно более основны, чем насыщенные ациклические, и что тетрагидрофуран является особенно сильным основанием — факт, который, по-видимому, непосредственно связан с его особо важным значением как растворителя для металлоорганических соединений и его высокой растворимостью в воде [109]. [c.247]
В качестве смешанных растворителей было предложено использовать смеси тетрагидрофурана с пропиленкарбонатом и диметилсульфоксидом [24), с низшими алифатическими спиртами (до 50% по объему) [68], с 1,2-диметоксиэтаном [64] и 1,2-диметилформалем (30%) или 1,1-диметилформалем (46%) [69]. Затем, к пропиленкарбонату предложено добавлять этиленкарбонат [43, 47], нитроэтилен [34], ацетонитрил и метил- или бутнлформиат [47]. Эти вещества рекомендуется добавлять также к у-бутиролактону, диметилформамиду и диметилсульфоксиду [47]. Существует также более общая заявка [33], в которой в качестве растворителя для источника тока предлагается использовать смеси пентациклических эфиров (этилен- и пропилен-карбоната, Y-бyтиpoлaктoнa и т. д.) с представителями нитропарафинов, алифатических или циклических эфиров, циклических кетонов и алифатических нитрилов. По причинам, которые указывались выше, далеко не всегда можно легко объяснить преимущества смешанного растворителя по сравнению с индивидуальными компонентами. В литературе имеется чрезвычайно мало данных не только по физико-химическим свойствам растворов электролитов в смешанных растворителях, но даже и по физическим свойствам самих смесей. Поэтому кроме тех простых соображений, о которых говорилось выше, работа по подбору смешанных растворителей, в основном, носит эмпирический характер. [c.59]
Скорость перегруппировки зависит от структуры, причем активность падает при замене цианогруппы алкоксикарбонильной, так что малононитрилы наиболее, а малоновые эфиры — наименее активны. В приведенной выше общей формуле радикалы К могут быть алкильными группами, но в случае циннамильных соединений наблюдается только разложение и никаких продуктов перегруппировки выделить нельзя. Простейший пример — винилаллилмалоновый эфир, который был успешно перегруппирован [224]. Присутствие активирующих групп, однако, несущественно З-фенил-1,5-гексадиен количественно перегруппировывается в 1-фенил-1,5-гексадиен, а его 3-метильный аналог претерпевает подобное превращение при повышенных температурах, хотя и с несколько меньшим выходом (95%), причем в этом случае была установлена частичная обратимость этой реакции [225]. Внутримолекулярная природа этой реакции вытекает из отсутствия смешанных продуктов, если нагреваются вместе более чем одно винилаллильное соединение, и из наблюдения, что аллильная группа обращается в тех случаях, когда она асимметрична. В отдельных случаях были измерены энергии активации и энтропийные члены реакции, причем значительные отрицательные величины энтропии активации подтверждают предлагаемое для этой реакции циклическое переходное состояние, которое рассматривается как согласованный процесс, хотя имеются отдельные факты, указывающие, что образование и разрыв связи могут происходить не совсем одновременно [226]. [c.251]
Реакции пирролидина, пиперидина, тетрагидрофурана и тетрагидротио-фена (нумерация атомов в которых показана на рис. 20.1) в общем соответствуют реакциям вторичных алифатических аминов, простых эфиров и тиоэфиров. Конечно, существуют известные различия, некоторые из которых связаны с тем очевидным фактом, что разрыв одной связи углерод — гетероатом не приводит к расщеплению молекулы на два фрагмента, и образующаяся молекула может оказаться способной превращаться обратно в циклическое вещество. Так, например, нуклеофильная атака аммиака превращает тетра- [c.501]
chem21.info
ПРОСТЫЕ ЭФИРЫ. ЦИКЛИЧЕСКИЕ ЭФИРЫ - Справочник химика 21
ПРОСТЫЕ ЭФИРЫ. ЦИКЛИЧЕСКИЕ ЭФИРЫ [c.91]Глава 18. Простые эфиры. Циклические эфиры [c.92]
Теоретически простые эфиры можно рассматривать как соединения, полученные замещением обоих атомов водорода в молекуле воды на алкильные группы. Эфиры бывают ациклические и циклические, причем последние относятся к гетероциклическим соединениям (подобно циклическим аминам). Все простые эфиры устойчивы по отношению к ионным реагентам, но, как и углеводороды, легко реагируют с кислородом по ради- [c.154]
К нейтральным соединениям нефти относят кетоны, а также простые и сложные эфиры. Идентифицированы как алифатические кетоны, так и циклические, первые присутствуют в основном в бензиновой фракции, циклические — в высококипящих фракциях нефти, а также присутствуют сложные эфиры, многие из которых имеют ароматическую структуру. Простые эфиры, по мнению многих исследователей, носят циклический характер. [c.28]При проведении реакции с кислотами, содержащими шесть или больше углеродных атомов, главными побочными продуктами являются циклические перфторированные простые эфиры. Эти эфиры имеют то же число углеродных атомов, что и исходная кислота. Они, как можно полагать, должны представлять собой смесь пяти- и шестичленных циклических соединений [c.496]
Эпоксидами, или эпокисями, называются простые эфиры циклического строения с а-окисным кольцом [c.114]
В простых эфирах отсутствуют связи О—Н. Большинство реакций, в которые они вступают, затрагивают замещающие группы. Циклические эфиры с небольшими циклами обнаруживают повышенную реакционную способность вследствие напряжения, существующего в циклах как будет показано, такие эфиры являются ценными промежуточными соединениями в органических синтезах. [c.405]
Методы получения. Получение из диборана и галогенидов бора. Комплексные соединения хлорборана с простыми и циклическими эфирами образуются при взаимодействии эквимолекулярных количеств диборана и треххлористого бора в среде соответствующих эфиров [40, 41] [c.175]
Циклические простые эфиры, метиловые эфиры фенолов Метиламиды [c.144]
Величины Щ для простых и циклических эфиров при 30° [ 10] (без учета внутримолекулярного продолжения цепи) [c.302]
По методу Горди оценена относительная донорная сила простых и циклических эфиров [140—144], нитрилов и изонитрилов [145]. При исследовании гидролизующихся соединений в качестве акцептора вместо метанола, фенола, воды применяется хлороформ. По смещению полосы С—D дейтерохлороформа в ИК-спектре определена относительная донорная способность большой группы металлоорганических эфиров, аминов, сульфидов типа [(СНз)дМ] Х, где М — С, Si, Ge, Sn, Pb X —О, N, S [146]. Электронодонорная способность гетероатома X в подобных соединениях зависит как от индуктивного эффекта металлоорганических групп М(СНз)з, так и от степени — Ря-связывания М—X. Показано, что в тех случаях, когда неподеленная пара электронов гетероатома X, обусловливающая его донорные свойства, участвует в образовании dn — ря-связи МХ, донорные свойства соединения понижены. Так, например, в. связях Si—N d — ря-связывание значительно, и атом азота в соеди- [c.365]
АНАЛИЗ ПРОСТЫХ И ЦИКЛИЧЕСКИХ ЭФИРОВ [c.78]
Диазирины, диазосоединения, арилазиды, диарилдиимиды Кислородсодержащие гетероциклы, фенолы, хиноны Неспецифичен при определении класса вещества Кислородсодержащие гетероциклы, фенолы, хиноны (вместе с пиком [М—28]), ароматические альдегиды, фермамиды Циклические простые эфиры, метиловые эфиры фенолов Метиламиды [c.326]
Получающиеся простые эфиры симметричны. Смешанные простые эфиры можно приготовить, если одна из алкильных групп третичная, а другая — первичная или вторичная, так как маловероятно, чтобы эти последние группы могли конкурировать с третичной группой в реакции образования карбокатиона, тогда как третичный спирт представляет очень слабый нуклеофил. Если же в реакции нет третичных групп, то взаимодействие смеси двух спиртов даст все три возможных эфира. Из диолов можно получить циклические эфиры, причем наиболее успешно эта реакция идет для пятичленных циклов [501]. Так, 1,6-гександиол дает в основном 2-этилтетрагидрофуран. Эта реакция важна также и для приготовления производных фурфу-раля из альдоз с последующим элиминированием [c.123]
Оксираны представляют собой внутримолекулярные простые эфиры и формально могут бнть получены теми же способами, что и ациклические эфиры. Однако оксираны являются циклическими соединениями, и поэтому к ним может быть применен подход, ио-пользуомый при конструирований циклических систем (см. раздел 4.5). Суть его заключается в том, что при ретрослнтотическом анализе можно разъединить как одну из связей С-О (и при этом приходить к синтонам, аналогичным тем, которые встречались при синтезе простых эфиров), так и две связи одновременно. Если это две связи С-О, то речь идет о реакции циклоприсоединения кислорода по двойной связи алкена [c.140]
Активаторы, координированные катализатором, могут вызвать дополнительное ослабление определенных связей в молекуле координированного субстрата, что убедительно продемонстрировали в своей недавней работе Шилов и сотр. [51]. В некоторых гомогенных реакциях в качестве катализаторов применяются металлалкильные комплексы. На определенной стадии реакции происходит внедрение атакующего лиганда по связи металл—алкил. Поэтому авторы изучили влияние различных лигандов, находящихся в координационной сфере М, на скорость разрыва этой связи в комплексах титана состава (СНз) Ti l4 (где л = 1, 2, 3). В присутствии таких лигандов, как простые и циклические эфиры, пиридин, трифенилфосфин, ацетонитрил, энергия ст-связи М—С уменьшается, и реакция протекает главным образом по механизму гомолитического распада [c.123]
Пирокатехин образует множество циклических производных, включая разнообразные простые эфиры. Метиленовый эфир (189) образуется в результате реакции с метилендигалогенидами в присутствии основания. Такая метилендиокси -группа часто присутствует в природных фенолах и происходит в результате окислительного сочетания в о-метоксифенольных звеньях, например [c.266]
Такие ненасыщенные циклические простые эфиры, как 3,4-ди-гидро-2Н-пиран и 2,3-дигидрофуран, представляют собой виниловые эфиры и характеризуются ожидаемой для них способностью подвергаться присоединениям под действием электрофильных инициаторов. Катализируемое кислотой присоединение спирта к виниловому эфиру дает ацеталь, который может служить полезным производным для защиты гидроксильной группы, поскольку спирт можно регенерировать обработкой водной кислотой [129]. 3,4-Ди-гидро-2Н-пиран находит широкое применение в качестве защитной группы в синтезе олигонуклеотидов, однако он обладает тем недостатком, что в случае хиральных спиртов образуются диасте-реомерные ацетали. Этот недостаток может быть устранен [129] при использовании винилового эфира 4-метокси-5,6-дигидро-2Н-пи-рана присоединение спирта к этому соединению не приводит к образованию нового хирального центра. [c.407]
Установлена линейная зависимость между величиной растворимости GHF2 I и Av — смещениями полосы OD-связи в инфракрасном спектре СгНбОО, а также между ДЯ — теплотами смешения электронодонорных жидкостей с хлороформом и Д /. Существование последней зависимости позднее подтвердили также Сирлес, Тамрес и Барроу [84—86] на примере простых и циклических эфиров, лактонов, кетонов, сульфоксидов и азотистых оснований. Заметим, что точки для веществ, относящихся к разным классам азотистых оснований, ложатся на общую прямую, которая выражается уравнением [c.290]
Гидроксикислоты с первичной гидроксильной группой получаются из двухосновных кислот с помощью образования полуэфира или соответствующего полуэфира полухлорангидрида и их последующего восстановления (легкость восстановления функциональной группы распространенными гидридами убывает в ряду хлорангидрид > альдегид > сложный эфир > карбоновая кислота). Сложные эфиры альдегидокислот получаются с помощью озонолиза простых эфиров циклических енолов восстановление борогид- [c.158]
Восстановление до простых эфиров (схема (293) ряда сложных эфиров, в особенности грег-бутиловых эфиров (схема (294) , можно осуществлять действием борогидрида натрия и эфирата трифторида бора в растворителе, таком как диглим [253], или при использовании амомогидрада лития и эфирата трифторида бора в эфире [254]. Лактоны, как полагали вначале, дают в этих условиях циклические простые эфиры [253, 254], однако позднее было показано [255], что в действительности образуются циклические простые эфиры енолов (схема (295) . [c.358]
Если к растворам алюмогидрида лития прибавить небольшое количество хлористого кобальта, то это может вызвать расщепление некоторых простых эфиров, которые в обычных условиях устойчивы по отношению к действию гидрида металла [720]. Две гидроксильные группы в 1,2-или 1,3-положениях могут быть защищены через образование циклических бензилиденовых и изопропилиденовых эфиров, на которые алюмогидрид лития не действует [185, 258, 578, 582, 689, 698—700, 702, 1274, 1373, 1379, 1380, 1482, 1705]. [c.109]
Галоидбораны образуют комплексные соединения с простыми и циклическими эфирами. Известны комплексы хлорборана и дихлорборана [c.175]
Катализаторами, вызывающими полимеризацию практически всех катионоактивных мономеров (олефины, полиены, альдегиды, кетоны, простые виниловые эфиры, циклические эфиры, изоцианаты, различные винильные мономеры и т. д.), являются кислоты Льюиса (апротонные кислоты). Для возбуждения катионной полимеризации кислотами Льюиса во многих случаях необходимо присутствие оптимального количества сокатализатора (промотора), с которым образуется соответствующий комплекс. Сокатали-заторы — электронодонорные соединения — вода, протонные кислоты, спирты, простые эфиры, алкилгалогениды и другие соединения. [c.55]
Реакционноспособными по отношению к формальдегиду и триоксану мономерами могут быть альдегиды и замещенные альдегиды кетоны окиси алкиленов циклические формали циклические простые эфиры, циклические сложные эфиры (лактоны) и циклические ангидриды винильные мономеры. [c.140]
chem21.info
3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
Органические окиси можно рассматривать как продукты внутримолекулярной дегидратации гликолей. Различают α, β, γ и т.д. окиси.
эпоксиэтан 1,3-эпоксипропан 1,4-эпоксибутан
Наибольшее практическое значение имеет окись этилена. В промышленных масштабах её получают из этилена через этиленхлоргидрин
или прямым окислением этилена кислородом воздуха при температуре ~ 250 °С на серебряном катализаторе.
Окись этилена кипит при температуре 10,7 °С, с водой смешивается в любых отношениях. По химическим свойствам она мало похожа на простые эфиры. Это химически активное вещество, для которого характерно размыкание трёхчленного цикла. При этом активный атом водорода атакующего реагента неизменно идёт к кислороду, а остальная часть – к углероду окисного кольца.
Неустойчивость окиси этилена обусловлена значительным отклонением величины угла С–О–С от нормальной, что приводит к сильному напряжению цикла.
Диоксан же
,
имеющий нормальные валентные углы, по устойчивости не отличается от простых эфиров с открытой цепью. Окись этилена может присоединять воду с образованием этиленгликоля, аммиак с образованием этаноламина, амины, спирты и другие соединения с активным водородом.
На основе окиси этилена в промышленности органического синтеза получают в больших масштабах уксусную кислоту, этанол, диоксан (растворитель), этиленгликоль, эфиры этиленгликоля, этаноламин, акрилонитрил, моющие средства и целый ряд других продуктов.
Органические перекиси и гидроперекиси
Органические перекиси и гидроперекиси можно рассматривать как производные перекиси водорода, в которой соответственно один или оба водорода заменены на углеродные радикалы или ацильные группы
Гидроперекиси алкилов и ацилов имеют формулы R–О–О–H и
перекиси – соответственно R–О–О–R и
.
Перекиси и гидроперекиси алкилов можно получить действием спиртов на гидропероксид водорода. Устойчивость их значительно возрастает при переходе от первичных к третичным алкильным заместителям.
Гидроперекиси и перекиси первичных алкилов при перегреве взрываются.
При нагревании перекиси и гидроперекиси сравнительно легко разлагаются с образованием свободных радикалов.
В промышленности перекиси и гидроперекиси используют как инициаторы реакций полимеризации и сильные окислители.
4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
4.1 Насыщенные карбонильные соединения
Как следует из реакций и способов получения, оксосоединения можно рассматривать как алканы, в которых два атома водорода при одном углероде замещены на двухвалентный атом кислорода. Функциональной группой оксосоединений является карбонильная группа
В зависимости от числа углеводородных радикалов, присоединенных к карбонильной группе, различают два вида оксосоединений:
альдегиды
и кетоны
,
в реакциях которых проявляется много общего, но имеются и различия.
Номенклатура и изомерия
Номенклатура этих двух групп соединений строится по-разному. Тривиальные названия альдегидов связывают их с тривиальными названиями кислот, в которые они переходят при окислении
Из кетонов лишь немногие имеют тривиальные названия (например, ацетон). Для них широко используется радикально-функциональная номенклатура, в которой названия кетонов даются с использованием названий радикалов, связанных с карбонильной группой. По номенклатуре ИЮПАК названия альдегидов производятся от названия углеводорода с тем же числом атомов углерода путём добавления окончания –аль. Для кетонов эта номенклатура требует окончания –он. Цифрой обозначается положение функциональной группы в цепи кетона (табл. 6).
Таблица 6 – Названия некоторых карбонильных соединений
| Соединение | Названия по триви-альной и радикально-функциональной номенклатурам | Названия по номенклатуре ИЮПАК |
| муравьиный альдегид; формальдегид | метаналь | |
| уксусный альдегид; ацетальдегид | этаналь | |
| пропионовый альдегид | пропиональ | |
| масляный альдегид | бутаналь | |
| изомасляный альдегид | метилпропаналь | |
| валериановый альдегид | пентаналь | |
| изовалериановый альдегид | 3-метилбутаналь | |
| ацетон; диметилкетон | пропанон | |
| метилэтилкетон | бутанон | |
| метилпропилкетон | пентанон-2 | |
| метилизопропилкетон | 3-метилбутанон-2 |
Изомерия альдегидов и кетонов полностью отражается номенклатурой и комментарий не требует. Альдегиды и кетоны с одинаковым числом атомов углерода являются изомерами. Например:
Способы получения
– Окисление или каталитическое дегидрирование первичных спиртов до альдегидов, вторичных – до кетонов. Реакции эти уже упоминались при рассмотрении химических свойств спиртов.
– Пиролиз кальциевых или бариевых солей карбоновых кислот, одна из которых – соль муравьиной кислоты, даёт альдегиды.
Во всех других случаях образуются кетоны.
– Гидролиз геминальных (заместители у одного углерода) дигалогеналканов
– Гидратация ацетилена и его гомологов протекает в присутствии сульфата ртути (реакция Кучерова) или над гетерогенным катализатором. В соответствии с правилом Марковникова из ацетилена получается уксусный альдегид из его гомологов – кетоны (смотри свойства ацетиленовых углеводородов).
– Оксосинтез. Эта реакция синтеза альдегидов из алкенов и смеси оксида углерода (II) с водородом открыта в 1938 году Реппе и является основным промышленным методом синтеза альдегидов С3 и выше. Процесс проводят при температуре 100 °C…200 °C и 100…200 атмосфе-рах в присутствии кобальтового или никелевого катализатора.
Физические свойства
Муравьиный альдегид – газ. Остальные низшие альдегиды и кетоны – жидкости, плохо растворимые в воде. Альдегиды имеют удушливый запах. Кетоны пахнут обычно приятно. Температуры кипения оксосоединений растут с увеличением молекулярной массы. Кетоны кипят выше изомерных альдегидов. В противоположность спиртам альдегиды и кетоны – слабо ассоциированные жидкости. Поэтому они кипят значительно ниже соответствующих спиртов.
| Структурная формула | tкип, °C | Структурная формула | tкип, °C |
|
| 97,4 |
| 82,4 |
|
| 48,8 |
| 56,1 |
В то же время, карбонильные соединения кипят выше углеводородов с той же молекулярной массой. Плотность их ниже единицы.
Химические свойства
Альдегиды и кетоны – соединения весьма активные. Высокую реакционную способность сообщает им карбонильная группа. По своей природе двойная связь С=О в карбонильной группе сходна с двойной связью между атомами углерода. Она образуется из - и π-связей (как у алкенов). Однако кислород более электроотрицателен по сравнению с углеродом. Поэтому электронная плотность у кислорода выше, чем у углерода при двойной связи. Вследствие этого связь С=О сильно поляризуется и реакционная способность ее возрастает. Углеродный атом обладает электрофильными свойствами и способен присоединять нуклеофильные реагенты. Кислород имеет дробный отрицательный заряд и легко атакуется электрофильными реагентами.
В то же время, карбонильная группа, связанная в альдегидах с одним алкильным радикалом, а в кетонах – с двумя, оказывает влияние на них, смещая электронную плотность с радикалов к положительно заряженному углероду карбонила.
При этом степень поляризации связи С=О несколько понижается: у альдегидов в меньшей степени (за счет одного радикала), у кетонов – в большей (за счет двух радикалов), а подвижность водородов при -углеродах радикалов возрастает: у альдегидов в большей степени у кетонов – в меньшей.
Таким образом, для карбонильных соединений наиболее характерны два типа реакций: 1) реакции присоединения по карбонильной группе и 2) реакции, обусловленные высокой подвижностью водородных атомов при -углеродах радикалов по отношению к карбонилу. Причем в обоих типах реакций альдегиды активнее кетонов.
Реакции присоединения
– Восстановление. Присоединение водорода к оксосоединениям происходит в присутствии катализаторов гидрирования (Ni, Pt, Pd, Cu и другие). Альдегиды при этом дают первичные, а кетоны – вторичные спирты.
– Присоединение магнийорганических соединений. Эта типичная и важная реакция была рассмотрена в разделе спиртов.
После гидролиза аддуктов из формальдегида получаются первичные спирты, из всех остальных альдегидов – вторичные, и из кетонов – третичные спирты.
– Присоединение синильной кислоты приводит к образованию α-оксинитрилов. Гидролизом из них получают α-гидроксикислоты.
– Присоединение кислой соли бисульфита (гидросульфита) натрия даёт кристаллические вещества – бисульфитные производные альдегидов и кетонов. Из кетонов в реакцию вступают только метилкетоны R–CO–Ch4.
При нагревании с раствором соды бисульфитные производные разлагаются с выделением свободного альдегида или кетона.
Реакция с бисульфитом натрия используется для качественного определения альдегидов и кетонов, а также для их выделения и очистки.
– Присоединение аммиака. Взаимодействие с аммиаком позволяет различить альдегиды и кетоны. Альдегиды образуют с аммиаком альдимины.
Альдимины легко циклизуются в альдегидаммиаки.
Кетоны реагируют с аммиаком очень медленно и сложно.
Совершенно своеобразна реакция формальдегида с аммиаком, приводящая к гексаметилентетрамину или уротропину.
Уротропин и его комплекс с CaCl2 (кальцекс) применяется в медицине (мочегонное, противогриппозное средство). Нитрованием уротропина получают сильное взрывчатое вещество – гексоген.
– С гидроксиламином альдегиды и кетоны дают альдоксимы и кетоксимы (реакция идет по схеме, показанной выше для реакции с аммиаком). Суммарно:
Под действием водоотнимающих средств (P2O5) альдоксимы (но не кетоксимы) переходят в нитрилы кислот. Это один из методов синтеза нитрилов.
Реакция с солянокислым гидроксиламином является качественной реакцией на карбонильную группу и используется также для количественного определения альдегидов и кетонов.
– С гидразином в зависимости от соотношения реагентов реакция протекает по разному:
с одной молекулой оксосоединения образуются гидразоны
с двумя – азины (альдазины или кетазины)
нагреванием гидразонов с твёрдым КОН получают насыщенные углеводороды.
– Образование полуацеталей и ацеталей происходит при действии на альдегиды спиртов.
Полуацетальный гидроксил обладает повышенной реакционной способностью.
При добавлении к смеси капли серной кислоты образуются ацетали.
Образование ацеталей кетонов протекает более сложно.
Реакции получения ацеталей обратимы. При гидролизе ацеталей выделяются свободные альдегиды.
– Полимеризация. Эта реакция характерна только для альдегидов и протекает в кислой среде (следы h3SO4).
Так, уксусный альдегид при внесении в него капли h3SO4 вскипает (экзотермическая реакция) и полимеризуется в шестичленное гетероциклическое соединение, называемое паральдегидом.
При температуре 0 °C происходит тетрамеризация и образуется твёрдый метальдегид, который используется как твёрдое горючее «твердый спирт». Оба полимера легко деполимеризуются.
Реакции, обусловленные высокой подвижностью атомов водорода при -углеродах по отношению к карбонильной группе
– Галогенирование
Замещение идет исключительно у -углерода.
– Реакции альдольной и кротоновой конденсации
В процессе конденсации одновременно реализуются оба типа реакций альдегидов и кетонов: одна из молекул карбонильного соединения диссоциирует по активированной связи СН -углерода и присоединяется по месту разрыва -связи карбонильной группы другой молекулы. Альдегиды конденсируются уже в слабоосновной среде (ацетат калия, К2СО3, K2SO3), кетоны реагируют труднее – в присутствии более сильных оснований, например, Ba(OH)2.
При конденсации уксусного альдегида образуется альдоль (альдегидоалкоголь), процесс называется альдольной конденсацией.
Альдольная конденсация кетонов протекает по такой же схеме:
Может протекать также конденсация альдегидов с кетонами:
Альдоль при нагревании отщепляет воду с образованием непредельного оксосоединения. Причём водород опять уходит от α-углерода по отношению к карбонильной группе. Из альдоля ацетальдегида при этом получается кротоновый альдегид, а альдоля ацетона – окись мезитила.
Процесс альдольной конденсации совместно с последующей реакцией дегидратацией альдоля называется кротоновой конденсацией.
Конденсации типа альдольной и кротоновой могут происходить не только между одинаковыми, но и различными молекулами альдегидов и кетонов, а также между альдегидами и кетонами.
Все эти реакции имеют огромное значение в органическом синтезе.
Реакции окисления
Окисление альдегидов протекает значительно легче, чем кетонов, в присутствии как сильных (h3Cr2O7, KMnO4), так и слабых окислителей. При этом образуются кислоты с тем же числом атомов углерода.
– Альдегиды, но не кетоны, вступают в реакцию «серебряного зеркала», которая является качественной пробой на присутствие альдегидной группы.
Реакция с фелинговой жидкостью также характерна только для альдегидов. Фелингова жидкость – это водно-щелочной раствор комплексной соли гидроксида меди и натрийкалиевой соли винной кислоты.
Красно-коричневая Cu2O выпадает в осадок.
– Кетоны окисляются в жёстких условиях с разрывом углеродной цепи по обе стороны от карбонильной группы с образованием смеси кислот и кетонов. По составу этой смеси можно судить о строении исходного кетона.
Получающиеся кетоны могут окислятся по такой же схеме далее.
Таким образом, наряду с общностью в химических свойствах альдегидов и кетонов при изучении их свойств обнаруживаются и существенные различия: альдегиды легко окисляются без изменения углеродного скелета, кетоны окисляются трудно с разрывом углеродной цепи; альдегиды полимеризуются в присутствии кислот, образуют альдегидаммиаки, ацетали. Кетоны не вступают в эти реакции.
Отдельные представители
Муравьиный альдегид (формальдегид). Это бесцветный газ с резким специфическим запахом, tкип° = –21 °C . Формальдегид в виде 40 %-ного водного раствора, содержащего 5 %…8 % метанола, получают в значительных количествах каталитическим окислением метанола. Это так называемый формалин. Формалин используется как дезинфицирующее средство.
Всё большее значение приобретает способ получения формальдегида неполным окислением метана или углеводородов крекинга нефтяных фракций.
Из-за отсутствия в молекуле формальдегида алкильной группы ему присущи некоторые специфические свойства.
– Реакция Канниццаро. В щелочной среде часть молекул формальдегида восстанавливается до метанола, другая часть за счёт кислорода воды окисляется до муравьиной кислоты.
– Реакция с аммиаком, которая упоминалась ранее.
– Сухой газообразный формальдегид в присутствии катализаторов [Fe(CO)5] способен к полимеризации.
Полиформальдегид не растворим ни в одном растворителе и идёт на изготовление синтетического волокна и различных изделий.
– При конденсации с фенолом получаются фенолформ-альдегидные смолы, с мочевиной – карбамидные смолы, имеющие широкое применение.
Уксусный альдегид (ацетальдегид)
Кипит при температуре 21 °C. Ацетальдегид получают гидратацией ацетилена, дегидрированием этилового спирта, изомеризацией окиси этилена, каталитическим окислением углеводородов. Он служит важным полупродуктом в промышленных синтезах этанола, уксусной кислоты, кротонового и масляного альдегидов, пентаэритрита, альдоля, ацеталей и других веществ.
Ацетон
Температура кипения 56,1 °C. Ацетон является многотоннажным растворителем. В промышленности он получается совместно с фенолом через гидроперекись изопропилбензола. Он является также исходным продуктом для синтеза метакриловой кислоты и метилметакрилата (мономер для получения «органического стекла» и других полимеров), кетена, СН2=С=О, из которого получают уксусный ангидрид, и других продуктов.
studfiles.net