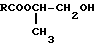Справочник химика 21. Диметиловый эфир строение
Диметиловый эфир, конфигурация - Справочник химика 21
Конфигурации диена и диенофила не изменяются в аддукте. Иными словами, осуществляется цис-при,соединение, как это показано на примере присоединения бутадиена-1,3 к диметиловому эфиру малеиновой кислоты [c.140]Атомные остовы у этих элементов довольно велики, поэтому они могут в принципе разместить на валентных оболочках большое число электронных пар. Однако, поскольку заряд остова мал, стремление притягивать на валентную оболочку значительную электронную плотность невелико, так что соединения этих элементов можно считать преимущественно ионными. Стереохимия лигандов, расположенных вокруг атомного остова щелочного металла, не зависит от степени ковалентности связей, так как в случае любого щелочного металла неподеленные пары отсутствуют. В бесконечных решетках очень часто обнаруживают тетраэдрическую координацию четырех лигандов, октаэдрическую конфигурацию шести лигандов и кубическую конфигурацию восьми лигандов. Дискретных комплексов, строение которых установлено, известно очень мало.. Согласно спектральным данным, достаточно стабильный комплекс Ыа(ЫНз)4 имеет тетраэдрическую конфигурацию. Все щелочные металлы образуют хелатные комплексы, например, с ацетилацетоном, салициловым альдегидом и диметиловым эфиром этиленгликоля. Координационные числа для этих комплексов, по-видимому, равны 4 или 6, и можно ожидать, что они имеют тетраэдрическую или октаэдрическую конфигурацию. [c.151]
Поэтому можно сделать вывод, что метиловый спирт и его гомологи, а также диметиловый эфир и его гомологи (аналогично аце-тали и др.) имеют изогнутую у кислорода конфигурацию молекулы. Расстояние С—О по данным спектроскопических и электронографических измерений составляет в среднем 1,43 0,03 А. Определения, констант Керра для спиртов также указывают на их изогнутое строение . [c.179]Уже в ранних исследованиях было установлено, что в диеновом синтезе имеет место г с-присоединение, причем в аддукте как диен, так и диенофил сохраняют исходную конфигурацию. Это четко следует, например, из того, что взаимодействие бутадиена-1,3 с диметиловыми эфирами малеиновой и фумаровой кислот приводит к диастереомерным диметиловым эфирам циклогексен-4,5-дикарбоновых кислот [c.241]
Диметиловый эфир гексагидротерефта-левой кислоты транс-1,4-Диме-тилциклогексан (I), цис-, 4-диметилцик-логексан (П), метанол Циклогександиме-тилол-1,4, метанол Медно-цинковый катализатор на носителе в растворе щелочи, 251 бар, 250° С. Превращение 70%. В продуктах 1—69,4%, П -30% [188] Медно-хромовый катализатор 200—340 бар, 250—400 С. При гидрировании цис-кзошра происходит частичное обращение конфигурации [189] [c.499]
Имеют место также побочные реакции, дающие более сложные продукты, которые, однако, не имеют значения для дальнейшего рассмотрения. Было найдено, что выделенные дихлорянтарная кислота, и ее диметиловый эфир содержат приблизительно одинаковые количества рацемических и ii 30-h40MepoB. Это не обязательно означает, что радикалы неактивны вследствие того, что они существуют в плоской конфигурации тот xie результат наблюдался бы, если бы радикалы были оптически стабильными в пирамидальной (или тетраэдрической) конфигурации, так как (-f)- и (—)-изомеры радикалов должны были бы образоваться в одинаковыху количествах. [c.486]
Эта реакция приблизительно на 90% стереоспецифична, причем преобладающим стереохимическим результатом является сохранение конфигурации. Интересно заметить, что боргидрид натрия, быстро реагирующий с хлорсиланом Рз51 С1 [см. уравнение (4-16)], не восстанавливает метоксисилана Рз51 ОСНз даже при продолжительном нагревании в диметиловом эфире диэтиленгликоля. Таким образом, атом алюминия в А1Н4 представляет собой лучший центр для нуклеофильной атаки кислородсодержащими веществами, чем центральный атом бора в ВН 4. Известно, что спирты [c.54]
Давно известно, что молекула НгО имеет угловое строение с ао=Ю7° (25]. Метильные группы в диметило-вом эфире (СНз)гО лишь немного увеличивают этот угол (до 11Г 126, 27]). Необычное увеличение валентного угла кислорода найдено в дисилоксане (51Нз)20, ао = = 144° [28]. В самое последнее время обнаружены еще большие изменения этого угла. Так, молекулы 20, КОН, СзОН [29—31] линейны, т. е. ао = 180°. Высокотемпературные электронографические исследования [32, 33] показали, что эффективный валентный угол атома О в субокисях Оа, 1п и Т1 (общей формулы МегО) значительно больше, чем величина этого угла в молекулах воды и диметилового эфира, и составляет величину - 150°. Трудность определения равновесного значения валентного угла атома О в этих молекулах электронографическим методом была обусловлена тем, что частота деформационного колебания этих молекул мала и точно не определена. Последнее приводит к тому, что функция распределения межъядерных расстояний металл — металл имеет несимметричную форму. Для определения равновесной геометрической конфигурации этих молекул необходимо совместное использование спектроскопических и электронографических данных. К сожалению, надежные спектроскопические данные в настоящее время отсутствуют. [c.381]
Было также замечено [585], что этот аддукт при кристаллизации образует фракции кристаллов с различными температурами плавления, но ближе это явление изучено лишь недавно [584]. Оказалось, что транс-транс-1,4-дифен и л бутадиен с малеиновым ангидридом при кипячении (—7 час.) в среде ксилола с выходом 95% дает аддукт, являющийся смесью трех (из шести возможных) стёреоизомеров, у которых относительные положения заместителей в циклогексеновом кольце можно представить схемами (ХХа), (ХХб) и (ХХв), Первый нз них, составляющий подавляющую массу аддукта, является сполна цис-изомером (т. пл. 206°). Наряду с ним в количестве около2- 3% образуются еще два (ХХб) (т. пл. 24Г) и (ХХв) (т. пл. 197°). Конфигурация этих изомеров была доказана их взаимными превращениями. Так, первый из них (ХХа) уже на холоду изомеризуется во второй с транс-положением карбоксильных групп (ХХб) при обработке его диметилового эфира пиридином в эфирном растворе. Транс-конфигурация второго (ХХб) доказывается его образованием при конденсации транс-транс-1,4-дифенилбутадиена с диметиловым эфиром фумаровой кислоты (170—180°, [c.194]
Конденсация винилциклогексена с диметиловым эфиром фумаровой кислоты (3 часа, 200—215°) с последующим омылением аддуктов дает почти с количественным выходом смесь примерно равных количеств обеих возможных стереоизомерных транс-кислот (XXX) и (XXXI), конфигурация которых также была установлена на основании ряда их химических превращений [73] [c.400]
Структурная изомерия и таутомерия. Из сказанного выще совершенно ясно, что молекулы структурных изомеров (включая тау-томеры), отличающиеся формулой химического строения, всегда отличаются и их равновесной геометрической конфигурацией. Для иллюстрации на рис. 32 показаны равновесные конфигурации молекул н-бутана и изобутана, а на рис. 33 — молекул диметилового эфира (СНз)гО и этилового спирта С2Н5ОН, являющихся структурными изомерами. [c.198]
Эго соединение было названо ииносильвином (3,5 — диоксистильбеном). Его конфигурация показана в формуле (100). Эрдтман выделил его монометиловый эфир и доказал присутствие соответствующего диметилового эфира у некоторых видов сосен. [c.536]
НИЯ. Диметиловый эфир азодикарбоновой кислоты — в некотором отнощении более реакционноспособный диенофил, чем малеиновый ангидрид, однако с некоторыми диенами, вступающими в реакцию с малеиновым ангидридом, он не взаимодействует или реагирует по механизму аллильного присоединения, что приписывают транс-конфигурации связи N=N. При г ггс-конфигурации этой связи реакционная способность как диенофила сильно увеличивается. Например, (3) в ацетоне мгновенно реагирует с циклопентадиеном в том же растворителе при —78° с исчезновением красной окраски, давая (4) с бутадиеном при —50° реагент образует (5). Таким образом, диенофил реакционноспособнее диазохинонов, как, например, (6) [3] [c.47]
Дальнейшее уточнение конфигурации рассматриваемых антибиотиков было сделано на основании данных, по,лученных при изучении симметрии их молекул. Было показано, что как бромирование и последую-Н1ее нитрование сезамина и диметилового эфира пинорезинола, так и нитрование с последующим бромированием этих соединений в каждом случае приводят к одному и тому же бромнитропроизводному соответ- [c.551]
chem21.info
Диметиловый эфир оксониевые соединения - Справочник химика 21
Оксониевые соединения образуются при взаимодействии минеральных кислот с эфирами например, при взаимодействии диметилового эфира с НС1 получается соединение (СНз)20-НС1, с т. пл. —96° С и очень низкой температурой кипения—по одним данным —2° С [50], по другим —12° С [51]. [c.242]Фтористый бор дает прочные оксониевые соединения с простыми эфирами [75]. Реакция протекает с выделением тепла например, для диметилового эфира [c.250]
Простые эфиры способны присоединять молекулу галоидоводородной кислоты, давая так называемые оксониевые соединения. Так, Фридель еще в 1875 г. получил соединение диметилового эфира с хлористым водородом следующего строения [c.214]Однако для осуществления этой формальной схемы образования необходимы еще некоторые специальные предпосылки. Так, например, уже простейшее эфирное соединение этого типа — поддающийся выделению продукт присоединения хлористого водорода к диметиловому эфиру по своим свойствам является не оксониевой солью, а простым аддитивным соединением. Это вещество не солеобразно, а легко летуче без разложения. [c.184]
Простые эфиры легко дают оксониевые соединения, типа комплексных, с трехфтористым бором, с галоидными солями магния и т. д. подобное соединение образуется и с серным ангидридом. При непосредственном действии серного ангидрида на простой эфир сначала образуется продукт присоединения се-рного ангидрида и затем происходит перегруппировка, в результате которой получается диалкилсульфат. Эта перегруппировка затрудняется с утяжелением радикалов образование диалкилсульфатов проходит с хорошим выходом только для диметилового эфира уже хлорметнловый эфир дает соответствующий сульфат с выходом только 30% для этилового эфира выходы еще меньше, а прн действии серного ангидрида на диизопропиловый эфир образуются смолы, из которых не удается выделить индивидуальных веществ даже при перегонке в глубоком вакууме Весьма возможно, 0 промежуточные продукты присоединения серного ангидрида могли бы быть получены, если проводить реакщгю при низких температурах и больших разбавлениях в инертных растворителях. [c.249]
Фейет отметил, что 2,б-диметил-7-пирон не дает фенилгидразона, а двой- ные связи его не восстанавливаются цинком в ледяной уксусной кислоте.. Эти факты в дальнейшем были подтверждены на многих производных у-пирст ов, Фейст отметил также, что водные растворы 2,6-диметил-7-пирона имеют нейтральную реакцию. Поэтому явилось неожиданным открытие и выделение хорошо образованных кристаллических продуктов присоединения большого числа неорганических и органических кислот к 2,6-диметил-7-пирону [79], В этих соединениях 1 моль пирона был связан с одним эквивалентом кислоты, и такие продукты присоединения, по аналогии с солями у-пиридона, рассматривались как оксониевые соли (V, К = Н) [80]. В то время представление о четырехвалентном кислороде было новым, однако в литературе можно было найти значительное число примеров таких соединений, например диметилового эфира с хлористым водородом [81] или цинеола с хлористым и бромистым водородом (VI) [82]. Строение этих соединений могло быть объяснено лишь в случае допущения существования четырехвалентного. кислорода [c.288]
Реакция обратима, поэтому к одному и тому же состоянию равновесия можно прийти как превращением в пар оксониевого соединения, так и смещением при той же температуре сухих НС1 и диметилового эфира. [c.243]
Однако наиболее замечательной работой в этой области является исследование Фриделя [20], относящееся к получению оксониевого соединения диметилового эфира с хлористым водородом. Фридель полагал, что полученное им соединение содержит четырехвалентный кислород [c.761]
В замечательных работах Сыркина, Волькенштейна и Гантмахер [30], относящихся к спектроскопическому исследованию оксониевого соединения Фриделя, т. е. диметилового эфира и хлористого водорода, показано, что нет основания допускать наличия четырехвалентного кислорода в указанном соединении. Вероятным строением соединения диметилового эфира и хлористого водорода является следующее [c.762]
Винилалкиловые эфиры, подобно многим простым эфирам, обладают в той или иной степени основными свойствами, которые проявляются в склонности к образованию оксониевых солей. Среди первых работ, раскрывающих эти свойства эфиров, наиболее достоверно исследование Фриделя [3], относящееся к получению оксониевого соединения диметилового эфира с хлористым водородом. Фридель полагал, что полученное им соединение содержит четырехвалентный кислород [c.56]
На основании новейших работ не следует считать кислород в оксониевых соединениях четырехвалентным, так же как нельзя допустить суш ествование пятивалентного азота в амониевых солях или в нитрогруппе [И]. В работах А. Р. Гант-махер, М. В. Волькепштейна и Я. К. Сыркина [12], относящихся к спектроскопическому исследованию оксониевого соединения Фриделя, т. е. соединения диметилового эфира с хлористым водородом, показано, что нет основания допускать наличие четырехвалентного кислорода в указанном соединении. Вероятным строением соединения диметилового эфира с хлористым водородом является следующее [c.57]
chem21.info
Диметиловый эфир угол связей - Справочник химика 21
Так как экспериментальное значение ц == 1,3-10 Кл-м, то молекула диметилового эфира не может иметь линейное строение ( х = 0) и ей должна быть приписана вторая структура. Учитывая, что дипольный момент группыСН3О равен ij = [д.2 = 1,2-10 Кл-м, и принимая угол между двумя связями С—О равным 111 , получаем путем расчета х = 1,35-10" Кл-м, что практически соответствует опыту. [c.39] Проведенные исследования обнаружили совершенно отчетливую связь между каталитическим действием активных углей и химической природой их поверхности (ионообменными свойствами) в то время как обычный, неокисленный уголь, электрохимический анионообменник [5, 6], не проявлял практически никакой каталитической активности (см., например, табл. 1), окисленный уголь Дубинина — Кройта, являюш ийся, как уже отмечалось, полифункциональным катионообменником [9], весьма эффективно ускорял все изученные процессы кислотного типа (помимо названных выше трех основных реакций, в этом плане были исследованы также реакции образования уксусноэтилового, олеиновобутилового эфиров, диметилового эфира адипиновой кислоты и получения 1,4-диоксана из этиленгликоля). Было установлено также, что, подобрав со-ответствуюш,им образом условия низкотемпературной обработки угля БАУ азотной кислотой, нетрудно получить катализатор, равноценный или даже превосходяш ий по активности образец ОУ, окисленный в токе воздуха при 450° С. Как видно из табл. 2, эффективность угля ОУ по Гам-метту [15] намного превосходит таковую не только карбоксильной смолы КБ-4П-2, но и сильнокислотного сульфокатионита КУ-2. [c.33]Весьма маловероятно, чтобы уменьшение моментов нри переходе от метиламина к триметиламину и от метилового спирта к диметиловому эфиру происходило бы главным образом вследствие изменений углов между связями. Хотя точные величины этих углов неизвестны, они, по-видимому, отличаются друг от друга лишь на несколько градусов в триметиламине и диметиловом эфире они соответственно равны 108 и 111° (1,885 и 1,937 рад) с точностью до 3 (0,0523 рад), в аммиаке угол равен 107° (1,867 рад), а в воде — 105° (1,832 рад). Наиболее вероятной основной причиной изменений моментов является то, что NH- и ОН-связи имеют больший момент, чем связи NG и ОС. Если предположительно приписать связям N и ОС продольные моменты, равные соответственно 0,6 и 1,2 Д (1,98 10- и 3,96-lO" Кл-м) (т. е. равные одной трети и двум третям момента фтористого метила при игнорировании малых различий в длине N -, ОС- и F -связей), а связям NH и ОН — 1,3 и 1,5 Д (4,29-10- и 4,95-10 Кл-м) (соответствующие моментам аммиака и воды) и если считать все углы в метильных соединениях тетраэдрическими, то вычисленные моменты окажутся равными h4Nh31,25 СН3ОН 1,58 (СНз)зНН 1,05 (СНз)зО 1,38 и (СНз)дК 0,60 Д (4,12-10- , 5,21-10 , 3,46-10 , 4,55-10 и 1,98-lO Кл-м соответственно). (Здесь, как и всюду в этом разделе, моменты, обусловленные наличием необобщенных электронов, рассматриваются как распределенные по связям.) [c.106]
Валентный угол углерода равен 110°. Валентный угол кислорода можно без большой ошибки принять равным также 110°. Отсюда угол изменения направления всех связей данной цепи равен 180°—110° = 70°. Указанное соединение можно рассматривать как молекулу, содержащую четыре диполя, два из которых имеют момент THj, равный 1,7 (значение момента хлористого метила в растворах), и действуют по направлению связей С — С1, а остальные два действуют но направлениям связей С — О и имеют одинаковый момент тп . Величину последнего можно рассчитать из моме та диметилового эфира, приведенного в табл. 1 и равного результирующему моменту двух таких диполей т . [c.12]
chem21.info
Диметиловый эфир - это... Что такое Диметиловый эфир?
Димети́ловый эфи́р (C2H6O) (метиловый эфир, метоксиметан, древесный эфир) Н3С-О-СН3 — широко применяемый на практике простой эфир.
Свойства
| 233.128 | 54.61 | 298.172 | 596.21 | 348.147 | 2022.45 |
| 238.126 | 68.49 | 303.160 | 687.37 | 353.146 | 2242.74 |
| 243.157 | 85.57 | 305.160 | 726.26 | 353.158 | 2243.07 |
| 248.152 | 105.59 | 308.158 | 787.07 | 358.145 | 2479.92 |
| 253.152 | 129.42 | 313.156 | 897.59 | 363.148 | 2735.67 |
| 258.160 | 157.53 | 316.154 | 968.55 | 368.158 | 3010.81 |
| 263.160 | 190.44 | 318.158 | 1018.91 | 373.154 | 3305.67 |
| 268.161 | 228.48 | 323.148 | 1152.35 | 378.150 | 3622.60 |
| 273.153 | 272.17 | 328.149 | 1298.23 | 383.143 | 3962.25 |
| 278.145 | 321.87 | 333.157 | 1457.50 | 388.155 | 4331.48 |
| 283.160 | 378.66 | 333.159 | 1457.76 | 393.158 | 4725.02 |
| 288.174 | 443.57 | 338.154 | 1631.01 | 398.157 | 5146.82 |
| 293.161 | 515.53 | 343.147 | 1818.80 | 400.378 | 5355.8 |
J.
Chem. Eng. Data 2004, 49, 32-34Производство
В промышленности производится из природного газа, угля, или биомассы.
Применение
Применение в качестве топлива
Диметиловый эфир — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53. Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя. Без переделки возможно применение на автомобилях с LPG-двигателями при 30 % содержании в топливе.
Теплота сгорания ДМЭ около 30 МДж/кг, у классических нефтяных топлив — около 42 МДж/кг. Одна из особенностей применения ДМЭ — его более высокая окисляющая способность (благодаря содержанию кислорода), чем у классического топлива.
В июле 2006 года Национальная Комиссия Развития и Реформ (NDRC) (Китай) приняла стандарт использования диметилового эфира в качестве топлива. Китайское правительство будет поддерживать развитие диметилового эфира, как возможную альтернативу дизельному топливу. В ближайшие 5 лет Китай планирует производить 5—10 млн тонн диметилового эфира в год.
Автомобили с двигателями, работающими на диметиловом эфире разрабатывают KAMAZ, Volvo, Nissan и китайская компания Shanghai Automotive.
Опасность
Является слабым наркотиком. Огнеопасен, смесь с воздухом взрывоопасна, температура вспышки −41 °C. ПДК в воздухе рабочей зоны составляет 200 мг/м³.
xzsad.academic.ru
Диметиловый эфир - это... Что такое Диметиловый эфир?
Димети́ловый эфи́р (C2H6O) (метиловый эфир, метоксиметан, древесный эфир) Н3С-О-СН3 — широко применяемый на практике простой эфир.
Свойства
| 233.128 | 54.61 | 298.172 | 596.21 | 348.147 | 2022.45 |
| 238.126 | 68.49 | 303.160 | 687.37 | 353.146 | 2242.74 |
| 243.157 | 85.57 | 305.160 | 726.26 | 353.158 | 2243.07 |
| 248.152 | 105.59 | 308.158 | 787.07 | 358.145 | 2479.92 |
| 253.152 | 129.42 | 313.156 | 897.59 | 363.148 | 2735.67 |
| 258.160 | 157.53 | 316.154 | 968.55 | 368.158 | 3010.81 |
| 263.160 | 190.44 | 318.158 | 1018.91 | 373.154 | 3305.67 |
| 268.161 | 228.48 | 323.148 | 1152.35 | 378.150 | 3622.60 |
| 273.153 | 272.17 | 328.149 | 1298.23 | 383.143 | 3962.25 |
| 278.145 | 321.87 | 333.157 | 1457.50 | 388.155 | 4331.48 |
| 283.160 | 378.66 | 333.159 | 1457.76 | 393.158 | 4725.02 |
| 288.174 | 443.57 | 338.154 | 1631.01 | 398.157 | 5146.82 |
| 293.161 | 515.53 | 343.147 | 1818.80 | 400.378 | 5355.8 |
J.
Chem. Eng. Data 2004, 49, 32-34Производство
В промышленности производится из природного газа, угля, или биомассы.
Применение
Применение в качестве топлива
Диметиловый эфир — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53. Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя. Без переделки возможно применение на автомобилях с LPG-двигателями при 30 % содержании в топливе.
Теплота сгорания ДМЭ около 30 МДж/кг, у классических нефтяных топлив — около 42 МДж/кг. Одна из особенностей применения ДМЭ — его более высокая окисляющая способность (благодаря содержанию кислорода), чем у классического топлива.
В июле 2006 года Национальная Комиссия Развития и Реформ (NDRC) (Китай) приняла стандарт использования диметилового эфира в качестве топлива. Китайское правительство будет поддерживать развитие диметилового эфира, как возможную альтернативу дизельному топливу. В ближайшие 5 лет Китай планирует производить 5—10 млн тонн диметилового эфира в год.
Автомобили с двигателями, работающими на диметиловом эфире разрабатывают KAMAZ, Volvo, Nissan и китайская компания Shanghai Automotive.
Опасность
Является слабым наркотиком. Огнеопасен, смесь с воздухом взрывоопасна, температура вспышки −41 °C. ПДК в воздухе рабочей зоны составляет 200 мг/м³.
brokgauz.academic.ru
Диметиловый эфир - это... Что такое Диметиловый эфир?
Димети́ловый эфи́р (C2H6O) (метиловый эфир, метоксиметан, древесный эфир) Н3С-О-СН3 — широко применяемый на практике простой эфир.
Свойства
| 233.128 | 54.61 | 298.172 | 596.21 | 348.147 | 2022.45 |
| 238.126 | 68.49 | 303.160 | 687.37 | 353.146 | 2242.74 |
| 243.157 | 85.57 | 305.160 | 726.26 | 353.158 | 2243.07 |
| 248.152 | 105.59 | 308.158 | 787.07 | 358.145 | 2479.92 |
| 253.152 | 129.42 | 313.156 | 897.59 | 363.148 | 2735.67 |
| 258.160 | 157.53 | 316.154 | 968.55 | 368.158 | 3010.81 |
| 263.160 | 190.44 | 318.158 | 1018.91 | 373.154 | 3305.67 |
| 268.161 | 228.48 | 323.148 | 1152.35 | 378.150 | 3622.60 |
| 273.153 | 272.17 | 328.149 | 1298.23 | 383.143 | 3962.25 |
| 278.145 | 321.87 | 333.157 | 1457.50 | 388.155 | 4331.48 |
| 283.160 | 378.66 | 333.159 | 1457.76 | 393.158 | 4725.02 |
| 288.174 | 443.57 | 338.154 | 1631.01 | 398.157 | 5146.82 |
| 293.161 | 515.53 | 343.147 | 1818.80 | 400.378 | 5355.8 |
J.
Chem. Eng. Data 2004, 49, 32-34Производство
В промышленности производится из природного газа, угля, или биомассы.
Применение
Применение в качестве топлива
Диметиловый эфир — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53. Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя. Без переделки возможно применение на автомобилях с LPG-двигателями при 30 % содержании в топливе.
Теплота сгорания ДМЭ около 30 МДж/кг, у классических нефтяных топлив — около 42 МДж/кг. Одна из особенностей применения ДМЭ — его более высокая окисляющая способность (благодаря содержанию кислорода), чем у классического топлива.
В июле 2006 года Национальная Комиссия Развития и Реформ (NDRC) (Китай) приняла стандарт использования диметилового эфира в качестве топлива. Китайское правительство будет поддерживать развитие диметилового эфира, как возможную альтернативу дизельному топливу. В ближайшие 5 лет Китай планирует производить 5—10 млн тонн диметилового эфира в год.
Автомобили с двигателями, работающими на диметиловом эфире разрабатывают KAMAZ, Volvo, Nissan и китайская компания Shanghai Automotive.
Опасность
Является слабым наркотиком. Огнеопасен, смесь с воздухом взрывоопасна, температура вспышки −41 °C. ПДК в воздухе рабочей зоны составляет 200 мг/м³.
dis.academic.ru
Дейтеропорфирин диметиловый эфир - Справочник химика 21
Оксомостиковый железопорфирин был впервые синтезирован и охарактеризован Когей и сотр. [27], которые установили строение соединения [ (диметиловый эфир дейтеропорфирина)Ре(П1)]20 на основе поглощения в ИК-области при 840 см" и данных по определению молекулярной массы. Позже были опубликованы данные [28], согласующиеся с этой формулой. Синтезирован так- [c.143]Полученный в работе [28] спектр соединения [(диметиловый эфир дейтеропорфирина)Ре(П1)]20 в видимой области проявляет сильное сходство со спектрами железо(III)гемоглобина, железо (III) миоглобина и гидроксида железо(III) пероксидазы [31]. Учитывая этот факт и приведенное выше обсуждение, мы приходим к выводу, что необходимо дальнейшее выяснение связи между магнитными свойствами и строением гидроксидов железо(III)гемопротеинов в растворах. [c.145]
Диметиловый эфир дейтеропорфирина IX [c.107]Диметиловый эфир 2-этил-4-ацетил-дейтеропорфирина IX [c.107]
Диметиловый эфир дейтеропорфирина IX 63,9 92,3 93,1 95,5 96,5 178,9 180,9 170,6 155,1 [c.109]
Выход диметилового эфира мезопорфирина IX ооставил 91%, а дейтеропорфирина — 30%. [c.122]
Диметиловый эфир дейтеропорфирина нагревают в течение продолжительного времени в запаянной ампуле с йодом-J , пи ридином II хлороформом. Выход диметилового эфира JJ -дийод-дейтеропорфирина количественный, т. пл. 239°. Продукт имеет солянокислое число 14, образует обычные комплексы с металлами п омыляется или 20%-ной соляной кислотой, или едким кали в смеси пиридина с метанолом. Калиевая соль очень хорошо растворима в воде. [c.117]
Как с оксида, так и с карбоната магния в первую очередь элюируются порфирины, содержащие наибольшее число сложноэфирных групп, т. е. в данном случае порядок элюирования отличается от характерного для других рассматриваемых здесь сорбентов. Разделение диметиловых эфиров протопорфирина, мезопорфирина и дейтеропорфирина на колонке с оксидом магния описано в работе [5]. [c.223]
chem21.info