Дайджест - Промышленная безопасность. Метилового эфира пропиленгликоля
Эфир - гликоль - Большая Энциклопедия Нефти и Газа, статья, страница 3
Эфир - гликоль
Cтраница 3
Таким образом, получается эфир гликоля и НС1 с одной стороны, гликоля и уксусной кислоты - с другой. [31]
В табл. 72 указаны эфиры гликолей, производимые в США в промышленном масштабе. Диэфиры этиленгликолей применяются в качестве растворителей. Вследствие наличия в молекуле двух эфирных атомов кислорода их физические свойства аналогичны свойствам дкоксана, но температуры кипения выше. [32]
В табл. 72 указаны эфиры гликолей, производимые в США в промышленном масштабе. Диэфкры этиленгликолей применяются в качестве растворителей. Вследствие наличия в молекуле двух эфирных атомов кислорода их физические свойства аналогичны свойствам диоксана, но температуры кипения выше. [33]
При повышении молекулярной массы эфира гликоля доля основного вещества еще больше снижается. [34]
При хранении и транспортировании эфиров гликолей возникает необходимость в устранении контакта с воздухом, который способствует окислению простых и гидролизу сложных эфиров. Поэтому в большинстве технических условий оговаривается транспортирование в герметичной таре с весьма высокой степенью заполнения. [35]
Описан непрерывный способ очистки политетраметиленового эфира гликоля, полученного из тетрагидрофурана. [36]
В некоторых случаях использование индивидуальных эфиров гликолей не дает преимуществ перед техническими смесями, и потому для охлаждения моторов предложен водный раствор метиловых эфиров пропиленгликолей, включающих от 1 до 4 оксипропильных групп. [37]
Резкое увеличение скорости полимеризации диметакриловых и кар-боксилаллилметакриловых эфиров гликолей при увеличении расстояния между функциональными группами мономеров свидетельствует о влиянии межмолекулярного взаимодействия на кинетику полимеризации. [38]
Продукты взаимодействия диокисн бис-з / сзо-дигидро-дициклопентадиенилового эфира гликоля с ангидридом поликарбоновой кислоты с 3 - 6 карбоксильными группами. [39]
В зависимости от длины цепи ди-метиловых эфиров гликолей их сольва-тирующая способность по отношению к катионам существенно изменяется. Как показано ниже, значения констант равновесия образования сольватно-разделенных ионных пар, К. [41]
Установлено, что при полимеризации карбаллилметакриловых эфиров гликолей в среде метанола основным фактором, влияющим на скорость процесса, являются пространственные затруднения, определяемые величиной расстояния между функциональными группами мономера. [42]
Аналогично могут приготовляться золи в эфирах гликолей, которые достаточно полярны, чтобы смешиваться с водным золем кремнезема в процессе испарения воды, но обычно органозоль формируется в несколько более летучем растворителе. [43]
Максимальное число оксиалкиленовых звеньев в эфире гликоля, не приводящее к разрушению молекулы, равно 7 для производных полиэтиленгликолей и 4 для прониленгликолей. [44]
Та же реакция с фенолом дает монофениловый эфир гликоля. Небольшое количество серной кислоты катализирует эту реакцию. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
пропиленгликоля эфиров гликолей - Справочник химика 21
Этиленгликоль и пропиленгликоль употребляются как антифризы. В смеси с водой ими охлаждают автомобильные двигатели, так как такие смеси не замерзают зимой. Этиленгликоль, применяют также для производства растворителей типа диоксана, карбитола (см. раздел Простые эфиры ). Его сложный эфир с азотной кислотой (динитрат гликоля) — взрывчатое вещество. [c.110] В книге описаны свойства и методы получения этилен- и пропиленгликоля, высших гликолей, высокомолекулярных полимеров окисей этилена и пропилена, эфиров этилен- и пропиленгликолей. Рассмотрены основные области их применения и методы анализа. Глава, посвященная пропиленгликолю, включает раздел по свойствам и технологии получения окиси пропилена. [c.352]При окислении гликолей молекулярным кислородом получаются перекисные соединения, формальдегид, муравьиная кислота и сложные эфиры. При окислении пропиленгликоля возмон но такн е образование большого числа различных соединений ацетон, пропионовый альдегид, пировиноградный альдегид, ацетол, молочная кислота, формальдегид, ацетальдегид, двуокись углерода и др. При окислении этиленгликоля йодной кислотой количественно образуется формальдегид [c.26]
Как метод вычитания используется также экстракция. Так, эффективным методом идентификации спиртов является предварительная экстракция компонентов пробы, растворенной в четыреххлористом углероде, пропилен-гликолем. Пропиленгликоль хорошо экстрагирует спирт, но плохо альдегиды, кетоны, углеводороды и сложные эфиры, которые остаются в растворе четыреххлористого углерода. Кислоты, фенолы и амины, которые также хорошо растворяются в пропиленгликоле, могут быть удалены обработкой щелочью или кислотой. [c.40]
Физические свойства эфиров этилен- и пропиленгликолей прежде сего зависят от молекулярной массы эфирной группы. С ее ростом Увеличиваются температура кипения и коэффициент преломления, о уменьшаются плотность и растворимость эфира гликоля (табл. 84, [c.291]
Этим требованиям в той или иной степени отвечают глико-ли - этиленгликоль (ЭГ), диэтиленгликоль (ДЭГ), триэти-ленгликоль (ТЭГ), пропиленгликоль (ПГ), смеси гликолей с их эфирами и т.д. [c.11]
Гидроксильная группа легко претерпевает гидрогенолиз в том случае, если она способна к реакциям замещения. Например, спирты бензильного типа лишь с трудом получаются при каталитическом гидрировании соответствующих эфиров, так как процесс трудно прервать на стадии образования соответствующего спирта. Аналогичная закономерность наблюдается в ряду эфиров замещенных малоновых кислот над медно-хромовым катализатором эти эфиры образуют главным образом замещенные пропи-ловые спирты вместо ожидаемых 1,3-гликолей. Известно, что сами 1,3-гликоли при гидрогенолизе дают пропанолы. Аналогично 1,3-циклогександиол при 200° над медно-хромовым катализатором дает циклогексанол глицерин подобным же образом теряет одну гидроксильную группу, превращаясь в пропиленгликоль. Легкость, с которой 1,3-гликоли подвергаются гидрогенолизу, свидетельствует о том, что промежуточной стадией могут являться Р-оксикарбонильные соединения, в которых гидроксильная группа подвижна. Было установлено (и это имеет важное значение), что при каталитическом восстановлении эфиров над медно-хромовым катализатором приме- [c.567]
Та же реа-кция с фено лом дает монофениловый эфир гликоля Небольшое количество серной кислоты весьма эффективно катализирует эту реакцию, вероятно вследствие промежуточного образования сернокислого эфира этиленгликоля Моноэтиловый эфир этиленгликоля, моноэтиловый эфир пропиленгликоля и монофениловый эфир этиленг.1тиколя готовятся из соответствующих окисей олефинов непрерывным пропусканием парш окиси в смеси с тарами соответствующего спирта или фенола под давлением от 5 до- 30 ат через эмалированную реакционную колонну, нагреваемую приблизительно до 180° Катализаторами для таких реакций 1служат диалкилсульфаты и некоторые подкисленные гидросиликаты (особенно гидросиликаты алюминия), имеющие величину pH в водной суспензии менее 3 [c.583]
Смеси растворителей, применяемые при титровании, могут иметь самый разнообразный состав. Их можно приготовить из этилен- или пропиленгликоля практически с любым другим растворителем спиртами, углеводородами (алифатическими и ароматическими), хлорированными соединениями и простыми эфирами. Соотношение содержания компонентов в этих смесях может изменяться в широких пределах, но если второй растворитель неполярный, то содержание гликоля должно быть более 25%, чтобы было возможно потенциометрическое титрование. Кроме того, пропиленгликоль является превосходным сорастворителем для таких растворителей, как бензол, хлороформ, петролейный эфир, поскольку он с ними смешивается, тогда как этиленгликоль не смешивается с неполярными растворителями. [c.136]
В некоторых случаях использование индивидуальных эфиров гликолей не дает преимуществ перед техническими смесями, п потому для охлаждения моторов предложен водный раствор метиловых эфиров пропиленгликолей, включающих от 1 до 4 оксипропильных групп. Для очистки карбюраторов используют сложную углеводородную смесь, содержащую бутилцеллозольв и изобутилкарби-тол [117]. Универсальное средство для мойки поверхностей, покрытых краской, наряду с этилцеллозольвом включает оксиэтилиро-ванные жирные кислоты и другие неионогенные поверхностноактивные вещества. [c.323]
Этим требованиям в той или иной степени отвечают гликоли — этиленгликоль, диэтиленгликоль, триэтиленгликоль, пропиленгликоль и другие спирты парафинового ряда (метанол, этанол), смеси гликолей со спиртами и их эфирами и т. д. [c.34]
Эфирное масло или смесь растворяют в равном объеме U и перемешивают с половинным объемом пропиленгликоля. В делительной воронке разделяют два слоя остатки раствора в четыреххлористом углероде отделяют от раствора в пропиленгликоле центрифугированием. К раствору в гликоле приливают равный объем насыщенного раствора хлорида натрия и извлекают кислородсодержащие соединения, обрабатывая четырежды диэтиловым эфиром, который затем отделяют перегонкой. [c.231]
Результаты исследования [11] показали, что наиболее эффективными и дешевыми ингибиторами для предотвращения гидратообразования могут быть высокоминерализованные пластовые или сточные воды, например отходы химического производства эпоксидных смол Сумгаитского химкомбината, а также упаренная пос-ледрожжевая барда (УПБ). На стадии получения эпоксидных смол в конце процесса производят промывку целевого продукта при этом получается кубовый остаток, который представляет собой сточные воды, в состав которых входят глицерин, глицериновый эфир, эпихлоргидрин, хлористый натрий, едкий натр и вода. УПБ является отходом спиртового производства и представляет собой темно-коричневую жидкость с запахом. Результаты физико-химических исследований позволили в некоторых случаях рекомендовать их в качестве ингибиторов гидратообразования взамен метанола или гликолей [5, 41]. Отмечено также, что добавка метанола или гликолей к высокоминерализованным водам значительно снижает температуру замерзания и улучшает антигидратные свойства. Так, при добавлении к сточной воде или УПБ гликолей (а именно, ППГ, который является отходом производства пропиленгликоля Сумгаитского химкомбината и представляет собой светло-коричневую маслянистую жидкость и имеет химические свойства технических гликолей) получаются ингибиторы гидратообразования с низкой температурюй замерзания (до -70 С) и полностью обеспечивающие промысловую подготовку газа. [c.12]
Были получены и исследованы пеноматериалы из диэпоксидных соединений вышеприведенного строения, в состав которых входят различные гликоли установлено, что характер структуры пенопласта зависит от состава исходных диэпоксидных соединений, а именно эфиры этиленгликоля дают пенопласты с очень мелкими ячейками эфиры пропиленгликоля дают пенопласты с ячейками. f средней величины эфиры диэтиленгликоля дают пенопласты с самыми большими ячейками. [c.860]
Из спиртовых компонентов наибольшее применение находят гликоли этиленгликоль, диэтиленгликоль и 1,2-пропиленгликоль. В ряде случаев в качестве спиртовых компонентов используют неполные аллиловые эфиры многоатомных спиртов, например диал-лиловый эфир триметилолпропана. [c.114]
Окись пропилена применяется для производства пропилен-гликоля, нолигликолей и эфиров гликолей. Большое количество окиси пропилена потребляется в качестве антифриза и пластификатора. На базе пропиленгликоля получают лекарства, полиэфирные смолы, эфиры жирных кислот и другие химические продукты. [c.77]
Из всех сложных эфиров гликолей наибольшее распространение имеют эфиры высших карбоновых кислот, которые обладают свойствами неионогенных ПАВ и прекрасно совмещаются со многими полимерными материалами [33, 34]. Если сложные эфиры этих кислот и моноэтилеп- и пропиленгликолей — кристаллические вещества (табл. 90), то продукты, содержащие несколько оксиалки-леновых групп, пастообразны. Поверхностная активность эфиров [c.299]
Максимальное число оксиалкиленовых звеньев в эфире гликоля, не приводяш,ее к разрушению молекулы, равно 7 для производных полиэтиленгликолей п 4 для пропиленгликолей,. [c.302]
Разработан [91—95] синтез и изучены свойства полиэфиров дикарбоновых кислот общей формулы НООС (СН2) СООН с п = О—8 и гликолей НО(СН2)шОН,где т =2—6, 10, 20, диэтиленгликоля, триэтиленгликоля, пропиленгликоля, бутандиола-1,3. Поликонденсация осуществлялась нагреванием исходных веществ сначала в токе азота, затем в вакууме. В случае полиэфиров щавелевой и малоновой кислот в качестве исходных веществ применяли их диэтиловые эфиры. Полиэфир октадеценилянтарной кислоты с диэтиленгликолем получался при нагревании ангидрида кислоты с эквивалентным количеством (или с избытком до 30%) диэтиленгликоля [97]. Известно получение полиэфира из янтарной кислоты и этиленгликоля [96]. Синтез оптически-активных полиэфиров приведен в диссертации Согомонянца [9]. [c.14]
Эфиры гликолей применяют во многих отраслях народного хозяйства для самых разнообразных целей. Поэтому при разработке технических условий на товарные продукты неизбежно возникает ряд трудностей, связанных со спецификой их использования. Казалось бы, можно добиться единого подхода прп введении такого показателя, как содержание основного вещества. Но многие даже низкомолекулярные эфиры гликолей (особенно производные пропиленгликолей) являются ошсями нескольких изомеров или родственных соединений, и их определенпе весьлш трудно. [c.327]
Известно, что сложные эфиры гликолей, являются полупродуктами в синтезе ряда важных продуктов химической промышленности. Так, например, в соответствии с патентом США 3 586716, при гидролизе эфиров, таких как моно- и диацетатов этиленгликоля, получают этиленгликоль в заявке ФРГ № 2 412136 описан метод расш,епления моноацетата пропиленгликоля с получением окиси пропилена. [c.201]
Пенообразователь ОПСМ Смесь монометило-вых эфиров полипро-пиленгликолей СНэ ОСэНб)пОН. Содержит 17—20% моно-метилового эфира три-пропиленгликоля, 42— 47% монометилового эфира тетрапропилен-гликоля, 11—15% монометилового эфира [c.672]
Некоторые простые диглицидиловые эфиры гликолей, например дигли-цидиловый эфир бутандиола-1,4 (XX) и диглицидиловый эфир поли-пропиленгликоля (XXI), используются в качестве эластомеров, содер- [c.334]
Наиболее важным производством периода первой мировой иопны был синтез нового вида взрывчатых веществ — нитро1Ли-т олей их продолжали получать и по окончании войны (для нужд горнорудной промышленности). Гликоли широко применяются также в качестве антифризов и растворителей. К числу важнейших продуктов ряда глпколей относятся этиленгликоль, пропиленгликоль, диэтиленгликоль, эфиры простые и сложные как этиленгликоля, так и диэтилеигликоля (так называемые целлозольвы и карбитоли), диоксан, получающийся по методу А. Е. Фаворского [.31 дегидратацией этиленгликоля [c.456]
Гликоли, например этиленгликоль, пропиленгликоль и т. д., в смеси с изопропиловым спиртом, 1,4-дпоксаном или хлороформом в отношении 1 1 также могут быть компонентами О — Н-смесей растворителей. Для приготовления 0,1 н. хлористоводородной кислоты очень часто используют смесь пронилепгликоля с хлороформом (1 1). Смесь люнометилового эфира гликоля с ксилолом (1 1) служит хорошим растворителем при определении числа омыления жиров и восков [330]. Смесь полиэтиленгликоля 400 с хлороформом применяется в качестве растворителя при анализе производных барбитуровой кислоты [788]. Для приготовления стандартного раствора лигийалюминийамида вместо тетрагидрофу-рана используют диметиловый эфир этиленгликоля [761]. [c.124]
Можно применять также ароматические и алифатические диамиды. Типичным представителем этого ряда является продукт реакции и-фенилендиамина с избытком олеиновой кислоты [31]. Высшие жирные ацильные производные гипотетического метилендиамина получают из 2 молей амида стеариновой кислоты и 1 моля формальдегида [32]. Описаны различные пеногасящие средства, у которых две крайние жирные ацильные группы соединены с бифункциональным амином, содержаш,им сложные амидогруппы между двумя аминогруппами [33]. При этом, по литературным данным, несимметричные диамиды или полиамиды во многих случаях не менее эффективны, чем симметричные [34]. К противопенным средствам для паровых котлов относятся также амиды [35] и гидразиды [36], обладающие также сложноэфирными промежуточными группами, высшие сульфамиды и дисульфамиды [37 и высокомолекулярные имидазолины [38]. Кроме амидов и других азотсодержащих соединений, для этой цели применяются полигликоли и их производные высокого молекулярного веса. Полигликоли должны содержать достаточное количество звеньев эфира пропиленгликоля или гликоля с более длинной цепью, чтобы быть нерастворимыми в воде. Оптимальными считаются молекулярные веса гораздо выше 1000 наиболее подходящими, по-видимому, являются соединения с молекулярным весом 5000—7000 [39]. Описаны также сложные и простые диэфиры гликолей и полигликолей [40], а также аналогичные кислородсодержащие соединения, имеющие, кроме эфирных групп, еще и ацетальную связь [41]. [c.510]
На первой стадии процесса осуществляется синтез низкомолекулярного линейного полиэфира. Как отмечалось выше, вул-коллан и аналогичные уретановые полимеры получаются на основе сложных эфиров. Для синтеза полиэфиров могут быть использованы этиленгликоль, пропиленгликоль, высшие гликоли, адипиновая кислота, янтарная и высшие дикарбоновые кислоты, содержащие до двенадцати углеродных атомов. [c.574]
Для моноэфиров гликолей есть несколько отклонений зависимости температуры кипения от молекулярной массы. Так, метилobhii и этиловый эфиры пропиленгликоля, имеющие вторичную гидроксильную группу, кипят при температуре ниже соответствушщи эфиров этиленгликолей с первичной ОН-грунной. Этот факт хороШ объясняется затрудненностью образования межмолекулярных связей для эфиров пропиленгликолей с вторичной ОН-группой. С увеличением молекулярной массы различия в свойствах многих эфиро выравниваются. По-видимому, из моиоэфиров ди-, три- и тетра-алкиленгликолей всегда можно подобрать близкие по свойствам соединения. [c.294]
Известны многочисленные с.ложные эфиры органических и неорганических кислот для а-гликолей. Сложные эфиры имеют более высокую температуру кипения и плавления, плотность и коэффициент преломления, чем простые у сложных диэфиров эти показатели выше, чем у смешанных. Свойства нескольких иизкомолекулярных эфиров моцокарбоновых кислот этилен- и пропиленгликолей приведены в табл. 89. [c.298]
Окись пропилена (или окись изобутилена) (I), спирты (II), например метанол, изопропанол Изомерные метиловые эфиры пропилен (изобутилен) гликоля, например моно-2- и моно-З-ме-тиловые эфиры пропиленгликоля ВРз. 0(С2Н5)2 20 и 30° С, 0,5—3 ч, 1 11 = = 1 10 (мол.). Выход 26,2—87,8% [385]. См. также [386] [c.131]
Окись пропилена можно гадратировать в пропиленгликоль и восстановить в нормальный пропиловый спирт. Эта окись реагирует со спиртами и фенолами, бразу Я моноэфиры пропиленгликоля, а с органическими кислотами дает сложные эфиры этого гликоля. [c.604]
Гликоли и их эфиры Этиленгликоль. . . Диэтиленгликоль, Пропиленгликоль. Метилцеллозольв Этилцеллозольв. . Бутилцеллозольв Моноэтиловый эфир ди-этиленгликоля (этил-карбитол, карбитол). . [c.255]
Наиболее важным производством в период с 1918 до 1938 г. был синтез нового вида взрывчатых веществ — нитрогликолей. Дальнейшее развитие их производства позволило широко использовать гликоли в качестве антифризов и растворителей. К числу важнейших продуктов ряда гликолей относятся этиленгликоль, пропиленгликоль, диэтиленгликоль, простые и сложные эфиры этиленгликоля и диэтиленгликоля (так называемые целлозольвы и карбитолы), диоксан, этилен- и пропиленхлоргидрины, дихлордиэтиловый эфир (хлорэкс), этиленоксид, этаноламины и другие препараты. [c.9]
О ходе синтеза судят по изменению интенсивности линий, отвечаюицк исходным веществам и продуктам реакции. В качестве примера рассмотрим изучение кинетики синтеза сложного эфира - полипропиленгликольади-пината (ППА) переэтерификацией дибутиладипината пропиленгликолем с отгшкой выделяющегося при реакции бутанола [38]. Сложность описания кинетики этого процесса состоит в том, что пропиленгликоль имеет зависимые реакционные центры, т.е. активность данной гидроксильной группы не только определяется ее природой (у первичной выше, чем у вторичной), но и существенно изменяется при вступлении в реакцию второй гидроксильной группы гликоля. Поэтому для описания реакции необходимо определить четыре константы скорости Kjj,Kjj,Kjj,Kjj [c.28]
chem21.info
Китай Метиловый Эфир Пропиленгликоля, Китай Метиловый Эфир Пропиленгликоля список товаров на ru.Made-in-China.com
Цена FOB для Справки: US $ 7300.0-7700.0 / Тонн. MOQ: 1Тонн.
- Кислотно-щелочного недвижимости: Кислотные поверхности Утилизация Агент
- Сертификация: ККА
- Защита окружающей среды: да
- Внешность: Granulars
- Упаковка: Pallets
- Стандарт: 25liter/bag, 1cu. ft/bag
-
Поставщики с проверенными бизнес-лицензиями
Поставщики, проверенные инспекционными службами
Extrepure Resin (Shanghai) Co., Ltd. - провинция: Shanghai, China
ru.made-in-china.com
Эфир моно.метиловый - Справочник химика 21
Пропиленгликоля 1-монометиловый эфир см. 1-Моно-метиловый эфир пропиленгликоля [c.417] Р-цию проводят при повыш. т-рах и давлениях в присут. кат.-гомогенных (к-ты, щелочи и др.) или гетерогенных (цеолиты, алюмосиликаты, силикагели и др.). Напр., при взаимод. смеси 10-15% этиленоксида и 85-90% метанола при т-ре 150-190 С и давлении 2-3 МПа в присут. 0,01-0,1% NaOH образуется смесь метиловых эфиров моно-, ди- и триэтиленгликоля. Ректификацией реакц. смеси выделяют товарные метилцеллозольв и метилкарбитол. К. могут быть также получены из этиленгликоля и этиленхлоргидрина. [c.318]Бут и лен г ли ко ля 3-метиловый эфир см. 3-Моно-метиловый эфир-2,3-бутиленгликоля [c.100]
Гемипиновой кислоты а-моно-метиловый эфир [c.397]
В метаноле 2 — в тетрагидрофуриловом спирте 2 — в бензиловом спирте 4]— в моно-метиловом эфире этиленгликоля 5 — в воде. [c.237]
Монометиловый эфир 2,2-диметилянтарной кислоты имеет т. пл. 40,5° и т. кип. 141° (при 14 мм рт, ст.). Изомерный моно-метиловый эфир имеет т. пл. 52° [2]. [c.54]
Кодеин i8h3i03N (т. пл. 155° левовращающий) является моно-метиловым эфиром морфина по фенольной ОН-группе. Следовательно, кодеин нерастворим в едких щелочах. Вторичная спиртовая группа не затронута при окислеиии получается кетон — кодеинон. Кодеин может быть получен метилированием морфина. [c.993]
Фотометрический метод определения кобальта в никеле посредством моно метилового эфира о-нитрорезорцина [1417]. Влияние железа устраняют прибавлением цитрата натрия, а меди—тиомочевиной. Оптическую плотность раствора комплекса кобальта в четыреххлористом углероде измеряют при 400 ммк. [c.202]
Из физико-химических методов наиболее эффективным является введение топливо специальных присадок - противоводокристаллизуюЩих жидкостей (ПВЮК) в концентрации 0,1 - 0,3% об. К таким присадкам относятся этилцеллозольв (жидкость И ) и метилцеллозольв (моноэтиловый и моно-метиловый эфиры этиленгликолей) R-0 - H - Hj-OH, где R = jHj или СНз, а также ТГФ-М (тетрагидрофурфуриловый спирт с метанолом 1 1). Присадки хорошо растворимы как в топливе, так и в воде. Фильтруемость топлива улучшается, перепад давления на фильтрах при низких температурах уменьшается до безопасных значений. Механизм действия присадок связан с образованием ассоциатов с водой и увеличением ее растворимости в топливе при низких температурах. Такие присадки вводят в реактивные топлива специальными дозаторами в процессе заправки самолетов. Использование присадок повышает безопасность полетов, но усложняет эксплуатацию техники и требует дополнительных материальных затрат. [c.70]
Для предотвращения полимеризации в процессе синтеза и при хранении М. ингибируют, чаще всего гидрохиноном (0,01—0,05% по массе) илп его моно-метиловым эфиром. Содержание в М. ингибитора определяют методом колориметрии или полярографии. Мономер перед полимеризацией обычно освобождают от ингибитора промывкой сначала 2—5%-ным щелочным р-ром (в случае гидрохинона), а затем водой с последующим высушиванием или ректификацией. Для воспроизводимости результатов по полимеризации необходима тщательная очистка мономера не содержащий примесей М. в отсутствие воздуха и действия света достаточно устойчив. [c.101]
Гваякол, т. е. монометиловый эфир ортодиоксибензола, моно-метиловый эфир пирокатехина, о-метоксифенол — [c.259]
Легко полимеризуется стабилизуют гидрохиноном или его моно-метиловым эфиром [c.199]
Кроцетин, Сго-дикарбоновая кислота, вероятно, образуется биогенетически в растениях в результате окислительного расщепления С40-каротиноидов. Биксин, представляющий собой моно-метиловый эфир С24-Дикарбоновой кислоты (см. раздел Сг + Нг Сго + Сг = Сг4 , стр. 193), и кроцетин — каротиноидиые дикарбоновые кислоты — давно применяются для окрашивания пищевых продуктов. [c.190]
Монометиловый эфир диэтиленгликоля, эпихлоргидрин а-Г лицерилхлорги-дриновый эфир моно-метилового эфира диэтиленгликоля ВРз- 0(СаНб)2 75-100° С [245] [c.143]
Константы Генрн углеводородов в диэтиленгликоле, моно-метиловом и моноэтиловом эфирах триэтиленгликоля приведены в табл. 4.59. [c.352]
Пенообразователь ОПСМ Смесь монометило-вых эфиров полипро-пиленгликолей СНэ ОСэНб)пОН. Содержит 17—20% моно-метилового эфира три-пропиленгликоля, 42— 47% монометилового эфира тетрапропилен-гликоля, 11—15% монометилового эфира [c.672]
Монометилтерефталат, терефталевой кислоты моно-метиловый эфир, твердое горючее вещество. Взвешенная в воздухе беззольная сухая пыль фракции 850 мк взрывоопасна фракция, содержащая 7% частиц размером 74 мк, имеет нижн. предел взр. 25 г/м -, т. самовоспл. 890° С. Осевшая пыль пожароопасна. Тушить тонкораспыленной водой, пеной. См. также Пыли промышленные. Тушение. [c.171]
Метод Рудлоффа [24] с использованием перйодата и перманганата нашел применение с теми или иными изменениями для определения положения двойных связей в молекуле путем окислительного расщепления по двойным связям и последующего ГХ-анализа образующихся продуктов. Продукты представляют собой карбоновые кислоты их обычно определяют в форме соответствующих метиловых эфиров. Для количественного выделения эфиров моно-и дикарбоновых кислот от С4 и выше Кюммель [25] проводил непрерывную экстракцию этих кислот, омылял их в процессе удаления растворителя и разделял метиловые эфиры, образовавшиеся из соответствующих солей (без концентрирования), методом ГХ с программированием температуры. Утверждалось, что такой метод позволяет преодолеть трудности, связанные с выделением короткоцепочечных кислот, для которых характерна высокая летучесть и значительная растворимость в воде. Имеется и несколько других аналогичных методов, которые обеспечивают количественное выделение всех образующихся кислот, за исключением короткоцепочечных [26, 27]. В еще одной модификации метода Рудлоффа [28 в водный раствор кислот добавляют гидроокись тетраметиламмония. Порцию полученного раствора помещают в специальный зонд, высушивают при температуре 100 °С и вводят в газовый хроматограф метиловые эфиры образуются в этом анализе при нагреве в результате контакта зонда с образцом с горячей поверхностью (выше 250 °С) входного устройства хроматографа. [c.222]
Полимеризация стирола в присутствхш растворителя, в котором растворимы и моно- и полпстиролы, позволяет хорошо регулировать температуру реакции. Полимеризация в растворе происходит медленнее, чем полимеризация в блоке, и продукты получаются более низкого молекулярного веса. Для получения лучшего продукта необходимо изменять начальную концентрацию мономера и температуру. Полученные этим методом полимерц уже находятся в растворе, что удобно для изготовления лаков. Для других целей полимер высаживают из раствора, например в этилбензоле, прибавлением растворителя, и котором полистирол не растворяется, а именно петролейного эфира или метилового спирта [73]. Если такой осадитель содержится в исходной поли-меризуемой смеси, то можно легко регулировать молекулярный вес продуктов. Например, в смеси стирола с метиловым спиртом и бензолом полистирол осаждается, когда цопь достигнет определенной величины, в то время как более короткие молекулы полимера остаются в растворе. Величина осаждающихся частиц полимера зависит от содержания метилового спирта [74]. [c.186]
Упраотение 2.2.38. Как изменится скорость реакции омыления по механизму Вас2 при переходе от метилового эфира уксусной кислоты к метиловым эфирам моно-хлоруксусной и дихлоруксусной кислот [c.413]
Описываемый способ вначале осуществляли в две стадии. На первой стадии п-ксилол окисляли кислородом воздуха при 130—140°С до п-толуиловой кислоты, которую этерифицирова-ли метанолом. Оставшуюся неокисленной метильную группу в молекуле метилового эфира п-толуиловой кислоты подвергали дальнейшему окислению при 200 °С в присутствии кобальтовой соли легких погонов жирных кислот в качестве катализатора и получали моиометиловый эфир ТФК. При этом эфирная группа в п-метилтолуилате не разрушалась. В дальнейшем моно-метиловый эфир ТФК этерифицировали и очищали. [c.142]
В трудных случаях можно попытаться получить динитрофенилгидразон в диметиловом эфире этиленгликоля (диглиме), моно-метиловом эфире этиленгликоля (метилцеллозольве),диметилфор-мамиде или диметилсульфоксиде. Однако при этом возникают трудности, связанные с удалением нелетучего растворителя. Вместо этанола можно применять метанол, однако более летучий растворитель может затруднять очистку получаемого продукта. [c.187]
Метил- салицилат [( 4H9)4N]0H в 30% моно-метиловом эфире этиленгликоля -2,15 [c.762]
Природное соединение состава С5Н10О5 дает реакцию серебряного зеркала, при действии метанола в присутствии каталитического количества хлороводорода образует моно-метиловый эфир, а при нагревании с иодоводородной кислотой и фосфором превращается в 2-иодпентан. Предложите возможную структурную формулу исходного вещества и продуктов его превращений. Составьте уравнение реакции образования 2-иодпентана из данного вещества. [c.379]
Для предотвращения биохимической коррозии в топливных баках реактивных самолетов разработаны микробицидные присадки на основе растворимых в топливе борорганических соединений. Высокоэффективной присадкой, снижающей количество микроорганизмов в реактивных топливах, оказался также моно-метиловый эфир этиленгликоля [137]. Антимикробиологические присадки в последнее время разработаны Я. М. Паушкиным с сотр. [c.38]
Обычно жирные кислоты превращают в их метиловые эфиры я продукты взаимодействия с ацетатом ртути хроматографируют в кблонке с силикагелем [307]. Ртутные производные (метоксимер-кураты) метиловых эфиров моно- и диеновых жирных кислот элюируют полярными растворителями и затем разлагают, добавляя сильную кислоту (сдвиг реакции влево в приведенном уравнении). Ниже изложена методика жидкостного хроматографического разделения продуктов взаимодействия с ацетатом ртути метиловых эфиров жирных кислот на группы насыщенных, моноеновых и диеновых кислот [308 ], которая может быть рекомендована для исследователь-углубленного изучения указанных кислот (см. также разд. 1.2.2.3). [c.140]
На хроматограммах получают достаточно симметричные пики по.таостью разделенных метиловых эфиров моно-(Сд -С ) и дикарбоновых (Са - J кислот, причем пик стандарта — метилбен-зоата выходит перед пиком метилового эфира ундекановой кислоты, а пик диметилтерефталата — перед пиком диметилового эфира унде-кандикарбоновой кислоты. [c.157]
Во многих патентах и других работах [16,68,69,81,82,87,89] предлагается использовать в качестве компонентов ангиобледенительных присадок к бензинам и водорастворяющих агентов, предотвращающих замерзание воды, метиловые, этиловые, изопропиловые и бутиловые эфиры моно-, ди-, и триэтиленгликоля (целлозольвы), эфиры дипропиленгликоли, ацетаты гликолевых эфиров, а также кетоны (ацетон, метилэтилкетон). Предлагается использовать и смеси этих эфиров с низшими спиртами и гликолями. Производство большин--ства предлагаемых сложных эфиров базируется на органических кислотах и спиртах различного строения с использованием реакции эте-рификации [30,90] [c.33]
Последние исследования [14] показали, что анализ большого числа моно- и двухосновных кислот более эффективен при хроматографировании м-пропиловых эфиров вместо метиловых эфиров. В этом методе эфиры получали при взаимодействии с к-проииловым спиртом и трехфтористым бором, а разделение проводили на колонке, заполненной 3% полиэтиленгликоля или 3% силиконового масла на целите. [c.200]
Напишите уравнения реакций получения следующих соединений трибромфенола, моно- и диметиловых эфиров пирокатехина, метилового и сернокислого эфиров фенола, дифенилового эфира, фенилового и бензило-вого эфиров уксусной кислоты, пикриновой кислоты (реакции нитрования фенола) и ее превращения в пикра-мнновую кислоту. [c.109]
Классические опыты по установлению строения методом расщепления на фрагменты показали, что соединение является моно-метиловым эфиром кверцетинового гликозида, и ему была приписана формула СХХШ (R = остаток рамнозы) [208]. [c.131]
chem21.info
Способ получения сложных монопропиленгликолевых эфиров карбоновых кислот
Использование: в химии сложных эфиров гликолей. Сущность изобретения: продукт - монопропиленгликолевый эфир жирной или нафтеновой, или ароматической кислоты, формулы 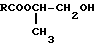 где R - радикал жирной или нафтеновой, или ароматической кислоты. Выход 94,5 - 96,5%, т.пл. 139 - 154°С 2 мм рт. ст. Реагент 1: жирная или нафтеновая, или ароматическая кислота. Реагент 2: монопропиленгликоль. Условия реакции: нагревание при 155 - 160°С и молярном соотношении реагентов 1 и 2, равное 1:(1,8-2), в присутствии катализатора - природного цеолита-клиноптилолита. 2 табл.
где R - радикал жирной или нафтеновой, или ароматической кислоты. Выход 94,5 - 96,5%, т.пл. 139 - 154°С 2 мм рт. ст. Реагент 1: жирная или нафтеновая, или ароматическая кислота. Реагент 2: монопропиленгликоль. Условия реакции: нагревание при 155 - 160°С и молярном соотношении реагентов 1 и 2, равное 1:(1,8-2), в присутствии катализатора - природного цеолита-клиноптилолита. 2 табл.
Изобретение относится к области органического синтеза, конкретно к способу получения монопропиленгликолевых эфиров карбоновых (жирных, нафтеновых, ароматических) кислот.
Указанные эфиры могут быть использованы в качестве пластификаторов для полимерных материалов, растворителей, жирующих материалов для жирования натуральных кож и меховых изделий, поверхностно-активных веществ и т.д. Известен способ получения моноэфиров пропиленгликоля формулы (I) окислительной этерификацией пропилена, которую ведут при температуре 60-120оС под давлением 0,4-1,4 МПа в присутствии монокарбоновой кислоты, О2 или О2-содержащего газа и двухкомпонентного Кт, включающего 0,01-20% Pd и 0,05-20% Se, Sb или Bi на инертном носителе, который предварительно обрабатывают восстановителем (МеОН, гидразин). Выход моноацетата пропиленгликоля 6,01% . Селективность 92,8. Однако этот способ имеет ряд недостатков: процесс многостадийный, трудоемкий и ведется под давлением. Известен также способ получения моноэфиров пропиленгликоля взаимодействием пропилена с газом, содержащим О2, под давлением 40 кг/см2, в жидкой фазе в присутствии хлорида, бромида или йодида, Тi, Su или W, и низшей карбоновой кислоты (АсОН) при 150оС. Выход моноацетата пропиленгликоля составляет 36-37%. Недостатком процесса является проведение реакции под давлением и низкий выход эфира, так как в процессе моноэфиры получаются в смеси с диэфирами. Наиболее близким по технической сущности и достигаемому эффекту к предлагаемому является способ получения моноэфира пропиленгликоля карбоновых кислот взаимодействием алифатических карбоновых кислот, С10-С24 (например, стеариновой или бегеновой кислоты) с пропиленгликолем (2-10 моль на 1 моль кислоты) в присутствии 0,01-10% (от массы смеси) гидроксида щелочного металла, например NaOH. Реакцию проводят при 190-250оС в течение 2-5 ч до испарения летучих продуктов. К остатку добавляют 3-7 моль пропиленгликоля и смесь кипятят еще 2-6 ч. Полученный продукт с к.ч. 0,5 содержит 91,9% моноэфира. Недостатком процесса является недостаточно высокий выход моноэфира и большой избыток пропиленгликоля. Поскольку процесс ведется при высокой температуре (до 250оС) и пропиленгликоль испаряется (т.кип. 189оС), то пропиленгликоль берется в реакцию в избытке (2-10 раз). Кроме того, процесс достаточно длительный. Данный способ выбран авторами в качестве прототипа. Целью изобретения является повышение выхода монопропиленгликолевых эфиров карбоновых кислот. Для достижения указанной цели этерификацию пропиленгликоля и карбоновых кислот осуществляют при 155-160оС и мольном соотношении кислоты и спирта 1:1,8-2,0 в присутствии катализатора - природного клиноптилолита, месторождения Айдаг Азербайджанской Республики, имеющего общую формулу Na2K2) O Al2O3
Al2O3 10SiO2
10SiO2 8Н2О, который содержит 60-80% кристаллической фазы, остальное кварц 15-25%, кальцит 2-5%, биотит 2-7% и прочие минералы 2%; адсорбционная емкость по воде 16-18%. Катализатор используют в естественном виде, в виде гранул 2-3 мм. Химический состав применяемого цеолита - клиноптилолита следующий, %: SiO2 65,4 Fe2O3 1,3 TiO2 0,1 Al2O3 12,6 CaO 3,7 MgO 0,7 K2O 1,4 Na2O 2,6 Потери при прокаливании 12,2%. Этерификацию проводят в трехгорлой, круглодонной колбе, снабженной механической мешалкой, термометром и водоотделителем типа Дина-Старка. В колбу загружают рассчитанные количества органической кислоты, спирта - 1,2-пропиленгликоля, в соотношении 1:1,8-2,0 и катализатора-природного цеолита (2% от массы кислоты). Смесь нагревают при перемешивании до 155-160оС и выдерживают при этой температуре 2,5-3 ч. Конец реакции определяют по кислотному числу этерификата (3-5,5 мг КОН/г). По окончании реакции этерификат отделяют от катализатора и подвергают вакуумной перегонке. Выход моноэфира составляет 94,5-96,5%. Данный способ иллюстрируется следующими примерами. П р и м е р 1. В реакционную колбу вместимостью 0,5 л загружают 232 г (2 моль) капроновой кислоты, 273 г (3,6 моль) пропиленгликоля, что соответствует их соотношению 1: 1,8, и 4,64 г природного цеолита (2% от массы кислоты). Кислотное число реакционной смеси 221 мл КОН/г. Смесь при перемешивании нагревают до 155оС. Через 2,5-3 ч кислотное число реакционной смеси (этерификата) составляет 3 мг КОН/г, которое в дальнейшем не меняется. Степень этерификации (эфиризации) 98,9%. По окончании реакции этерификат отделяют от катализатора фильтрованием, последний подвергают вакуумной перегонке при остаточном давлении 2 мм рт. ст. при температуре 148/2оС; выход моноэфира 96,5%. Физико-химические показатели полученного пропиленгликолевого моноэфира капроновой кислоты приведены в табл. 1. Ниже представлен материальный баланс: Взято: г % Капроновая кислота 232,00 45,94 Пропиленгли- коль 273,00 54,06 Итого: 505,00 100,00 Получено: Сырец монопро- пиленгликолевого эфира капроновой кислоты 346,00 68,51 Вода 30,00 5,94 Пропиленгликоль (непрореаг.) 126,00 24,95 Потери 3,00 5,94 Итого: 505,00 100,00 Перегонка: Взято: Сырец монопро- пиленгликолевого эфира карбоновой кислоты 346,00 100,00 Получено: Монопропиленгли- колевый эфир кап- роновой кислоты 333,89 96,5 Диэфир пропилен- гликоля капроно- вой кислоты 6,92 2,00 Остаток 5,19 1,5 Итого: 346,00 100 П р и м е р 2. В реакционную колбу загружают 148 г (2 моль пропионовой кислоты, 273,2 г (3,6 моль) пропиленгликоля, что соответствует их соотношению 1:1,8 и 3 г природного цеолита (2% от массы пропионовой кислоты). Смесь нагревают до 160оС. Кислотное число реакционной смеси 266 мг КОН/г. Через 2,5 ч этерификация заканчивается, кислотное число этерификата 3,0 мг КОН/г. Степень этерификации (эфиризации) 99,0%. После отделения катализатора от этерификата последний перегоняют при остаточном давлении 2 мм рт. ст. Выход моноэфира пропиленгликоля 96,5%. Физико-химические показатели полученного пропиленгликолевого моноэфира пропионовой кислоты приведены в табл. 1. П р и м е р 3. В реакционную колбу загружают 126 г (1 моль) кислогексенкарбоновой кислоты, 152 г (2,0 моль) пропиленгликоля, что соответствует их соотношению 1: 2,0, и 5 г природного цеолита (2% от массы циклогексенкарбоновой кислоты). Реакционную смесь нагревают до 160оС. Кислотное число реакционной смеси 202 мг КОН/г. Через 3 ч этерификация заканчивается, после окончания реакции кислотное число этерификата 5,46 мг КОН/г. Степень этерификации 98%. После отделения катализатора от этерификата последний перегоняют при остаточном давлении 2 мм рт. ст. Выход моноэфира 95%. Физико-химические показатели полученного пропиленгликолевого моноэфира циклогексенкарбоновой кислоты приведены в табл. 1. П р и м е р 4. В реакционную колбу загружают 244 г (2 моль) бензойной кислоты, 304 г (4 моль) пропиленгликоля, что соответствует их соотношению 1: 0,2, и 4,80 г природного цеолита (2% от массы кислоты). Кислотное число реакционной смеси 202 мг КОН/г. Смесь при перемешивании нагревают до 155оС. Через 2,5-3 ч кислотное число реакционной смеси (этерификата) составляет 5 мг КОН/г, которое в дальнейшем не меняется. Степень этерификации 98,9%. После отделения катализатора от этерификата последний перегоняют при остаточном давлении 2 мм рт. ст. Выход моноэфира 94,5%. Физико-химические показатели полученного пропиленгликолевого моноэфира бензойной кислоты приведены в табл. 1, а результаты полученных моноэфиров карбоновых кислот по примерам - в табл. 2. Как видно из приведенных примеров, при осуществлении этерификации при температуре 155-160оС и соотношении кислоты и спирта, равном 1:1,8-2,0; выход полученных моноэфиров пропиленгликоля составляет 94,5-96,5%. Проведение реакции при температуре выше 155-160оС и соотношении 1: 1,8-2,0 приводит к снижению выхода моноэфира за счет увеличения выхода диэфира и других побочных продуктов. При температуре ниже 155оС получается низкий выход моноэфира. Так, например, при температуре 140оС выход моноэфира пропиленгликоля и капроновой кислоты составляет всего 11%. При соотношении кислоты и спирта, равном 1:1,6, выход моноэфира составляет всего 69%, а диэфира - 12%, при увеличении соотношения до 1:2,2 выход моноэфира в дальнейшем больше не увеличивается, и проведение реакции при таком соотношении нецелесообразно. Таким образом, осуществление способа в указанных выше условиях в присутствии катализатора природного цеолита-клиноптилолита - позволяет, по сравнению с прототипом, увеличить выход моноэфира, а также упростить технологию, т.е. сократить расход пропиленгликоля, снизить температуру и сократить время осуществления способа.
8Н2О, который содержит 60-80% кристаллической фазы, остальное кварц 15-25%, кальцит 2-5%, биотит 2-7% и прочие минералы 2%; адсорбционная емкость по воде 16-18%. Катализатор используют в естественном виде, в виде гранул 2-3 мм. Химический состав применяемого цеолита - клиноптилолита следующий, %: SiO2 65,4 Fe2O3 1,3 TiO2 0,1 Al2O3 12,6 CaO 3,7 MgO 0,7 K2O 1,4 Na2O 2,6 Потери при прокаливании 12,2%. Этерификацию проводят в трехгорлой, круглодонной колбе, снабженной механической мешалкой, термометром и водоотделителем типа Дина-Старка. В колбу загружают рассчитанные количества органической кислоты, спирта - 1,2-пропиленгликоля, в соотношении 1:1,8-2,0 и катализатора-природного цеолита (2% от массы кислоты). Смесь нагревают при перемешивании до 155-160оС и выдерживают при этой температуре 2,5-3 ч. Конец реакции определяют по кислотному числу этерификата (3-5,5 мг КОН/г). По окончании реакции этерификат отделяют от катализатора и подвергают вакуумной перегонке. Выход моноэфира составляет 94,5-96,5%. Данный способ иллюстрируется следующими примерами. П р и м е р 1. В реакционную колбу вместимостью 0,5 л загружают 232 г (2 моль) капроновой кислоты, 273 г (3,6 моль) пропиленгликоля, что соответствует их соотношению 1: 1,8, и 4,64 г природного цеолита (2% от массы кислоты). Кислотное число реакционной смеси 221 мл КОН/г. Смесь при перемешивании нагревают до 155оС. Через 2,5-3 ч кислотное число реакционной смеси (этерификата) составляет 3 мг КОН/г, которое в дальнейшем не меняется. Степень этерификации (эфиризации) 98,9%. По окончании реакции этерификат отделяют от катализатора фильтрованием, последний подвергают вакуумной перегонке при остаточном давлении 2 мм рт. ст. при температуре 148/2оС; выход моноэфира 96,5%. Физико-химические показатели полученного пропиленгликолевого моноэфира капроновой кислоты приведены в табл. 1. Ниже представлен материальный баланс: Взято: г % Капроновая кислота 232,00 45,94 Пропиленгли- коль 273,00 54,06 Итого: 505,00 100,00 Получено: Сырец монопро- пиленгликолевого эфира капроновой кислоты 346,00 68,51 Вода 30,00 5,94 Пропиленгликоль (непрореаг.) 126,00 24,95 Потери 3,00 5,94 Итого: 505,00 100,00 Перегонка: Взято: Сырец монопро- пиленгликолевого эфира карбоновой кислоты 346,00 100,00 Получено: Монопропиленгли- колевый эфир кап- роновой кислоты 333,89 96,5 Диэфир пропилен- гликоля капроно- вой кислоты 6,92 2,00 Остаток 5,19 1,5 Итого: 346,00 100 П р и м е р 2. В реакционную колбу загружают 148 г (2 моль пропионовой кислоты, 273,2 г (3,6 моль) пропиленгликоля, что соответствует их соотношению 1:1,8 и 3 г природного цеолита (2% от массы пропионовой кислоты). Смесь нагревают до 160оС. Кислотное число реакционной смеси 266 мг КОН/г. Через 2,5 ч этерификация заканчивается, кислотное число этерификата 3,0 мг КОН/г. Степень этерификации (эфиризации) 99,0%. После отделения катализатора от этерификата последний перегоняют при остаточном давлении 2 мм рт. ст. Выход моноэфира пропиленгликоля 96,5%. Физико-химические показатели полученного пропиленгликолевого моноэфира пропионовой кислоты приведены в табл. 1. П р и м е р 3. В реакционную колбу загружают 126 г (1 моль) кислогексенкарбоновой кислоты, 152 г (2,0 моль) пропиленгликоля, что соответствует их соотношению 1: 2,0, и 5 г природного цеолита (2% от массы циклогексенкарбоновой кислоты). Реакционную смесь нагревают до 160оС. Кислотное число реакционной смеси 202 мг КОН/г. Через 3 ч этерификация заканчивается, после окончания реакции кислотное число этерификата 5,46 мг КОН/г. Степень этерификации 98%. После отделения катализатора от этерификата последний перегоняют при остаточном давлении 2 мм рт. ст. Выход моноэфира 95%. Физико-химические показатели полученного пропиленгликолевого моноэфира циклогексенкарбоновой кислоты приведены в табл. 1. П р и м е р 4. В реакционную колбу загружают 244 г (2 моль) бензойной кислоты, 304 г (4 моль) пропиленгликоля, что соответствует их соотношению 1: 0,2, и 4,80 г природного цеолита (2% от массы кислоты). Кислотное число реакционной смеси 202 мг КОН/г. Смесь при перемешивании нагревают до 155оС. Через 2,5-3 ч кислотное число реакционной смеси (этерификата) составляет 5 мг КОН/г, которое в дальнейшем не меняется. Степень этерификации 98,9%. После отделения катализатора от этерификата последний перегоняют при остаточном давлении 2 мм рт. ст. Выход моноэфира 94,5%. Физико-химические показатели полученного пропиленгликолевого моноэфира бензойной кислоты приведены в табл. 1, а результаты полученных моноэфиров карбоновых кислот по примерам - в табл. 2. Как видно из приведенных примеров, при осуществлении этерификации при температуре 155-160оС и соотношении кислоты и спирта, равном 1:1,8-2,0; выход полученных моноэфиров пропиленгликоля составляет 94,5-96,5%. Проведение реакции при температуре выше 155-160оС и соотношении 1: 1,8-2,0 приводит к снижению выхода моноэфира за счет увеличения выхода диэфира и других побочных продуктов. При температуре ниже 155оС получается низкий выход моноэфира. Так, например, при температуре 140оС выход моноэфира пропиленгликоля и капроновой кислоты составляет всего 11%. При соотношении кислоты и спирта, равном 1:1,6, выход моноэфира составляет всего 69%, а диэфира - 12%, при увеличении соотношения до 1:2,2 выход моноэфира в дальнейшем больше не увеличивается, и проведение реакции при таком соотношении нецелесообразно. Таким образом, осуществление способа в указанных выше условиях в присутствии катализатора природного цеолита-клиноптилолита - позволяет, по сравнению с прототипом, увеличить выход моноэфира, а также упростить технологию, т.е. сократить расход пропиленгликоля, снизить температуру и сократить время осуществления способа.Формула изобретения
СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ МОНОПРОПИЛЕНГЛИКОЛЕВЫХ ЭФИРОВ КАРБОНОВЫХ КИСЛОТ путем взаимодействия пропиленгликоля с жирной, или нафтеновой, или ароматической кислотой в присутствии катализатора при нагревании, отличающийся тем, что в качестве катализатора используют природный цеолит-клиноптилолит и процесс проводят при 155 - 160oС и молярном соотношении кислота : спирт 1 : 1,8 - 2,0 соответственно.РИСУНКИ
Рисунок 1www.findpatent.ru
Пропиленгликоль кислотами или их эфирами
Предложен еще ряд растворителей эфир борной кислоты в присутствии ацетата ртути (180 С, 3 кгс/см ) [51 катализаторы кобальт а, например каприлат Со, и частично смешанный с водой растворитель, например смесь хлорбензола и ацетона (при 150 С и 49 кгс/см получают 62,4% окиси пропилена наряду с пропиленгликолем и другими продуктами) [52]. [c.79]На практике при жидкофазном окислении пропилена в неметаллических реакторах параллельно с 1 т окиси пропилена образуется 1100—1900 кг побочных продуктов (муравьиная и уксусная кислоты, ацетон, изопропиловый спирт, акролеин, аллиловый спирт, ацетальдегид, метилформиат, пропиленгликоль и его эфиры). [c.198]
Полный кислый сульфат пропиленгликоля с помощью стрихнина можно разделить на оптически активные изомеры. Он очень устойчив в водном растворе и не гидролизуется до конца даже при кипячении с сильной кислотой. Охарактеризованы некоторые соли этого эфира. [c.51]Из сложных эфиров органических кислот пропиленгликоля наибольшего внимания заслуживают эфиры жирных кислот с длинной углеводородной цепью (лауриловая, олеиновая, пальмитиновая, стеариновая и др.), являющиеся хорошими эмульгаторами, пластификаторами, моющими и смачивающими веществами вследствие равновесия их лиофильных и гидрофильных радикалов. [c.276]
В качестве исходных продуктов в производстве полиэфиров используются этиленгликоль, пропиленгликоль, диэтиленгликоль, глицерин, фталевая кислота, терефталевая, главным образом ее диметиловый эфир, изофталевая, фталевый и малеиновый ангидриды, фумаровая, адипиновая 1и себациновая кислоты. [c.83]
Наиболее дешевым и доступным растворителем является пропиленкарбонат (циклический эфир пропиленгликоля и угольной кислоты) [c.282]
Этиленгликоль и пропиленгликоль употребляются как антифризы. В смеси с водой ими охлаждают автомобильные двигатели, так как такие смеси не замерзают зимой. Этиленгликоль, применяют также для производства растворителей типа диоксана, карбитола (см. раздел Простые эфиры ). Его сложный эфир с азотной кислотой (динитрат гликоля) — взрывчатое вещество. [c.110]
При окислении гликолей молекулярным кислородом получаются перекисные соединения, формальдегид, муравьиная кислота и сложные эфиры. При окислении пропиленгликоля возмон но такн е образование большого числа различных соединений ацетон, пропионовый альдегид, пировиноградный альдегид, ацетол, молочная кислота, формальдегид, ацетальдегид, двуокись углерода и др. При окислении этиленгликоля йодной кислотой количественно образуется формальдегид [c.26]
Оптические изомеры пропиленгликоля могут быть получены из лево- и правовращающей окиси пропилена. Кроме того, левовращающий изомер получают при восстановлении левовращающего эфира молочной кислоты, а правовращающий — прп гидрировании над никелем левовращающего 3-иод-1,2-пропиленгликоля [2, с. 356]. Оптические изомеры пропиленгликоля можно также получить из рацемата при фракционировании циклических кеталей пропиленгликоля и 1-ментона и последующем кислотном гидролизе индивидуальных кеталей [3]. [c.172]
Пропиленгликоль, его сложные эфиры и окись пропилена образуются пря окислении пропилена в растворе карбоновых кислот надуксусной кислотой или водным раствором перекиси водорода при умеренной температуре (около 60 °С) и небольшом давлении (около 0,17 МПа, или 1,7 кгс/см2). Вместо перекиси водорода можно использовать ее аддукт с карбамидом [41]. [c.196]
В лаки для волос могут быть добавлены различные специальные добавки средства для питания волос (витамины), смягчения (ланолин), для улучшения их внешнего вида и т. д. Наиболее распространенными добавками являются производные ланолина, четвертичные аммониевые основания, олеиновый спирт, мо-номиристиновый эфир пропиленгликоля, изопропиловый эфир миристиновой кислоты и т. д. [67]. [c.103]
Хлебопечение [109—112]. Улучшение вкусовых качеств хлебобулочных изделий и замедление их черствения путем ускорения гомогенизации теста и регулирования его реологических свойств и газосодержания. — Эфиры пропиленгликоля и глицерина с жирными кислотами эфиры ВЖС и двухосновных кислот или оксикислот эфиры сорбитана и жирных кислот (спяны и твяны) фосфатиды. [c.332]
Хорошему окислению пропилена в ароматических углеводородах способствует добавление к реакционной смеси Na2 Oз [40] или К2СО3 [41] для нейтрализации образовавшихся кислот. По первому методу при конверсии 12,5% получают 28,8 мол. % окиси пропилена п 18 мол. % пропиленгликоля наряду с кислотами и эфирами. Для инициирования реакции рекомендуется вводить соединения с карбонильными пли карбоксильными группами, наиример пропионовый альдегид или ацетальдегид. По второму методу [41], благодаря специальной конструкции реакционной камеры, получают высокую конверсию (94,2%) и высокий выход на единицу объема в единицу времени 100 г/ч окиси пропилена и 50 г/ч пропиленгликоля. [c.77]
Окись пропилена применяется для производства пропилен-гликоля, нолигликолей и эфиров гликолей. Большое количество окиси пропилена потребляется в качестве антифриза и пластификатора. На базе пропиленгликоля получают лекарства, полиэфирные смолы, эфиры жирных кислот и другие химические продукты. [c.77]
Полиэфиры, образующиеся при взаимодействии пропиленгликоля и себациновой кислоты, напоминают по своим свойствам каучук и могут быть вулканизированы при помощи перекиси бензоила. Соответствующие эфиры этиленгликоля — хрупкие смолы, размягчающиеся выше 74°. Присутствие лишней метильной группы в пропиленгликоле сильно влияет на физические свойства полиэфира себациновой кислоты, например на температуру размягчения, которая лежит ниже комнатной [34]. Продукты, полученные из полиэфиров пропиленгликоля, применяют в США в качестве каучуков специального назначения. Сами по себе полиэфиры пропиленгликоля и себациновой или адипиновой кислот являются фиксированными пластификаторами. [c.371]
Ацетол обычно получался реакцией между бромацетоном и муравьинокислым калием или натрием, или уксуснокислым калием или натрием, с последующим гидролизом эфира метиловым спир-том . При действии на глицерин или на пропиленгликоль катализаторов дегидрогенизации при 200—300° также образуется ацетол. Вместе с пировиноградной кислотой ацетол образуется и при непосредственном окислении ацетона при помощи перекиси ддетона (реактива Байера и Виллигера) [c.75]
Центральный резервуар может состоять из глицерина, этиленгликоля, пропиленгликоля, воды, смеси метилцеллюлозы с водой, альгината натрия, поливинилпирролидона, полиоксиэтиленстеарата, жирных кислот. Микропористые мембраны могут состоять из поликарбонатов, поливинилхлоридов, полиамидов, полисульфонов, поливинилацетатов, полиуретана, полиэфиров, акриловых смол, эфиров целлюлозы, кросс-сшитых полиэтиленоксида, поливинилпирролидона, поливинилового спирта. [c.400]
Несмотря па то, что окись этилена и окись пропилена, а также их основные производные были открыты более 100 лет тому назад (в 1859—1860 гг.), промышленное производство их началось значительно позднее. Производство этиленгликоля в промышленном масштабе было начато в Германии в период первой мировой войны с целью изготовления взрывчатого вещества динитрогликоля в связи с нехваткой глицерина для производства динамита. В США окись этилена и этиленгликоль были выпущены на рынок в 1925 г., а окись пропилена стала промышленным продуктом лишь в 1950 г. Промышленное же производство пропиленгликоля было начато в США в 1931 г. К этому же периоду относится начало промышленного производства простых эфиров этиленгликоля (1926 г.) и этанол-аминов в 1928 г. — триэтаноламина и в 1931 г. — моно- и диэтанол-аминов. Неионогенные поверхностно-активные вещества — окси-этилировапные спирты, кислоты и некоторые другие соединения. [c.9]
Пропиленгликоль служит одним из исходных веществ для получения лекарственных препаратов. Так, эфир пропиленгликоля и сульфаметилфенилкарбаминовой кислоты обладает бактерицидной активностью [75]. Сложные эфиры пропиленгликоля и салициловой кислоты или ее производных обладают противолихорадочным, противовоспалительным и анальгетическим действием [76]. [c.206]
Известны многочисленные с.ложные эфиры органических и неорганических кислот для а-гликолей. Сложные эфиры имеют более высокую температуру кипения и плавления, плотность и коэффициент преломления, чем простые у сложных диэфиров эти показатели выше, чем у смешанных. Свойства нескольких иизкомолекулярных эфиров моцокарбоновых кислот этилен- и пропиленгликолей приведены в табл. 89. [c.298]
Из всех сложных эфиров гликолей наибольшее распространение имеют эфиры высших карбоновых кислот, которые обладают свойствами неионогенных ПАВ и прекрасно совмещаются со многими полимерными материалами [33, 34]. Если сложные эфиры этих кислот и моноэтилеп- и пропиленгликолей — кристаллические вещества (табл. 90), то продукты, содержащие несколько оксиалки-леновых групп, пастообразны. Поверхностная активность эфиров [c.299]
В некоторых случаях использование индивидуальных эфиров гликолей не дает преимуществ перед техническими смесями, п потому для охлаждения моторов предложен водный раствор метиловых эфиров пропиленгликолей, включающих от 1 до 4 оксипропильных групп. Для очистки карбюраторов используют сложную углеводородную смесь, содержащую бутилцеллозольв и изобутилкарби-тол [117]. Универсальное средство для мойки поверхностей, покрытых краской, наряду с этилцеллозольвом включает оксиэтилиро-ванные жирные кислоты и другие неионогенные поверхностноактивные вещества. [c.323]
Некоторые сложные эфиры этилен- п пропиленгликолей, образованные салициловой, бензойной и ацетилбензойной кислотами, обладают терапевтическими свойствами [22, с. 328]. Метоксиэтия-никотин снижает содержание холестерина в крови. Полигликоли и их эфиры используются в медицине для приготовления легкопроникающих в кожу мазевых основ, в которые добавляются лекар- [c.326]
Моноалкил-1,4-диоксаны. Можно было бы ожидать, что при перегонке эквимолекулярной смеси этиленгликоля и пропиленгликоля получится монометил-1,4-диоксан. Однако в действительности основными продуктами реакции являются 1,4-диоксан и диметил-1,4-диоксан. В ранних работах пытались получать эти соединения, исходя из эфиров типа КСНОНСНзОСНзСНзОН. Например, эфир СН3СНОНСН2ОСН2СН2ОН может быть синтезирован пропусканием при 70° окиси этилена в пропиленгликоль, содержащий небольшое количество серной кислоты. Однако применение обычны) методов замыкания кольца не приводит к желаемым результатам и основными продуктами реакции являются смолы. По-видимому, на ход реакции оказывает влияние тот факт, является ли используемый спирт первичным или вторичным, что опре деляет его активность. Попытка замены гидроксильной группы на атом хлора путем обработки хлористым тионилом или пятихлористым фосфором приводит к разложению. [c.19]
Кроме спиртов, исследованных Фрицем и Шенком (см. табл. 1.2), авторы этой книги с успехом определяли этилен- и пропиленгликоль, бутандиол-1,4, октадеканол, додеканол, бутанол, октиловый, изооктиловый и аллиловый спирты. Было найдено, что этот метод неприменим для анализа эфиров полиэтилен-и полипропиленгликолей типа Н(0СНКСН2).х 0Н (где К — метил или водород), а также К(ОСН2СН2) сОН (где К — алифатический остаток или остаток алкилфенола). При анализе этих соединений получались завышенные результаты, возможно, вследствие окисления цепи хлорной кислотой с образованием гидроксильных или альдегидных групп. Некаталитический метод с использованием уксусного ангидрида также дает завышенные результаты анализа этих эфиров, однако это превышение небольшое, результаты воспроизводимы. Для определения эфиров полигликолей рекомендуется пиромеллитовый диангидрид (ПМДА). Пригоден и фталевый ангидрид, но для полноты реакции с ним необходимо 2 ч, тогда как с ПМДА требуется 30 мин и менее. [c.25]
Значения констант кислотности (Ка) и рКа, рКв некото-ых растворимых в воде кислот (сопряженных кислот) [13] иведены в таблице 6-3 Положение осложняется тем, что не существует уни-рсального растворителя, поэтому наряду с водой для из-ерения констант кислотности, основности применяются и е растворители ацетонитрил, ацетон, хлорбензол, то-ол, бензол, гептан, пропиленгликоль, метанол, этанол, этиловый эфир, 1,4-диоксан, нитрометан, диметилформ-, пиридин, этилендиамин, жидкий аммиак, уксусная ислота, серная кислота и др J Константы кислотности слабых кислот, нерастворимых в воде, определяют в других растворителях относи-ьно друг друга, измеряя константы равновесия реакций а (79) в разных растворителях и выстраивая таким обра- зом единую шкалу кислотности [c.185]
Пропилен (I) Окись пропилена (II), пропиленгликоль (111), карбоновые кислоты (IV), сложные эфиры (V), карбонильные соединения (VI) Фталоцианат кобальта в бензоле, 3—15 бар, 130 —190° С. Максимальная селективность по II при 10 бар и 175° С. Конверсия I — 18,8%, состав продукта П — 41,5%, III — 3,8%, IV — 14,1%, V-16,8%, VI—9,5%, С02-7,9%, СО - 3.7% [743] [c.630]
Пример. Для получения глиоксалидиновой композиции использовали, части (по массе) аминоэтилэтаноламин 30 и жирную кислоту таллового масла 70. Получившееся в этой реакции вещество (88,5 частей) взаимодействовало с азелаиновой (1,7-гептандикарбоновой) кислотой (11,5 частей). Полученную композицию (35 частей) смешивали с поли-пропиленгликолем молекулярной массой 3800 (25 частей), бутиловым целлозольвом (монобутиловым эфиром этиленгликоля) (20 частей) и водой (20 частей по массе). [c.255]
Та же реа-кция с фено лом дает монофениловый эфир гликоля Небольшое количество серной кислоты весьма эффективно катализирует эту реакцию, вероятно вследствие промежуточного образования сернокислого эфира этиленгликоля Моноэтиловый эфир этиленгликоля, моноэтиловый эфир пропиленгликоля и монофениловый эфир этиленг.1тиколя готовятся из соответствующих окисей олефинов непрерывным пропусканием парш окиси в смеси с тарами соответствующего спирта или фенола под давлением от 5 до- 30 ат через эмалированную реакционную колонну, нагреваемую приблизительно до 180° Катализаторами для таких реакций 1служат диалкилсульфаты и некоторые подкисленные гидросиликаты (особенно гидросиликаты алюминия), имеющие величину pH в водной суспензии менее 3 [c.583]
Окись пропилена можно гадратировать в пропиленгликоль и восстановить в нормальный пропиловый спирт. Эта окись реагирует со спиртами и фенолами, бразу Я моноэфиры пропиленгликоля, а с органическими кислотами дает сложные эфиры этого гликоля. [c.604]
В этих условиях могут быть синтезированы эфиры этилен-, диэтилен-, триэтилеп- и пропиленгликолей и янтарной или адипиновой кислот. [c.463]
chem21.info
Пропиленгликоль
Действие на кожу и слизистые оболочки. Сильно раздражает кожу, приближаясь по силе действия к аллиловому спирту. Резкий эффект на коже кролика наблюдается при нанесении 0,5 мл (в пропиленгликоле) внесение 0,01 мл 5— 40% суспензии X. в глаз кролика вызывает резко,е раздражение [107]. [c.300]
Физические свойства. Белые кристаллы. Не растворяется в холодной воде, растворяется в горячей. В пропиленгликоле при нагревании раств. 2,5 г/100 мл. [c.317]
Токсическое действие. Одноатомные предельные С. — наркотики. Наркотическое действие при вдыхании паров с увеличением молекулярной массы сначала нарастает, а затем (выше Сб) падает из-за малой летучести. Начиная с этанола, общая токсичность меняется аналогично, но при неингаляционном пути поступления наиболее токсичен гексиловый спирт. В моче одноатомные предельные С. не концентрируются. Для этиленгликоля, пропиленгликоля и глицерина отношение концентраций в моче и плазме крови — в пределах 3—5. Шестиатомные С. сильно концентрируются в моче — отношение концентраций 40—60 (Клин-ская). [c.362]
Токсическое действие. Отравление парами, по-видимому, маловероятно. -При введении белым мышам, крысам и кроликам через рот однократно Т. вдвое токсичнее, чем а-пропиленгликоль. То же при хроническом отравлении. [c.385]
Применяется в качестве растворителя в фармацевтической промышленности. Получается как побочный продукт производства пропиленгликоля с примесью 2,6-диметил-1,4-диоксана и 3,5-диметил-1,4-диоксана. [c.388]
Меры предупреждения — см. а-Метиловый эфир пропиленгликоля. [c.458]
Меры предупреждения — см. а-Метиловый эфир пропиленгликоля. [c.458]
Меры предупреждения — см, а-Метиловый эфир пропиленгликоля. [c.459]
Литература — см. а-Метиловый эфир пропиленгликоля. [c.460]
Определение в воздухе основано на гидролизе О. П., окислении образующегося пропиленгликоля йодной кислотой до формальдегида. Чувствительность 0,2 мкг в 7 мл пробы [48]. [c.479]
Пропиленгликоль В пределах, допусти- [c.269]
Физические и химические свойства. Предельно достижимая концентрация 60 мг/л (20°). При нагревании частично переходит в триметиленбромид. Т. разл. 425°. При кипячении с водой образует НВг, пропиленгликоль и немного ацетона. [c.272]
Действие на кожу и слизистые оболочки. Всасывается через кожу нанесение 1,4 г/кг чистого X. на кожу кролика смертельно, так же как и 400 мг/кг в виде 10% раствора в пропиленгликоле. Меньшие дозы снижали число эритроцитов и лейкоцитов, содержание белка в крови и ее щелочность. Однократное втирание в кожу кролика 0,5 мл чистого X. вызывает покраснение, а 20-кратное— некроз кожи. Внесение 1% раствора X. в глаз кролика вызывает раздражение с отеком (Резник и др. Torkelson et al.). / [c.297]
Превращения в организме. Предполагается окисление Т. с образованием -оксипропион овой и малоновой кислот. Малоновая кислота дает нерастворимые соли кальция и угнетает фермент сукцйндегидрогеназу, с чем, вероятно, связана большая токсичность Т. по сравнению с пропиленгликолем. [c.385]
Токсическое действие. Для морских свинок при введении через рот ЛД50 = = 2,0 -г- 2,6 г/кг. Крысы и кролики, в течение месяца по 5 раз в неделю получавшие по 0,5 или 1,0 г/кг, все остались живы у кроликов отмечены небольшие изменения в печени. Продолжительный и повторный контакт кожи кролика с 20% раствором Ф. в пропиленгликоле не оказывает заметного местного или общего токсического действия. [c.401]
Токсическое действие. При введении в желудок белым крысам ЛД50 — = 2,2 мл/кг. Длительное (в течение 4,5 месяцев) введение флотореагента ОПСБ, содержащего смесь бутиловых эфиров пропиленгликоля, в дозе 5 мг/кг тормозит синтез РНК и усиливает ее распад в гловном мозге и печени. При вдыхании паров смеси бутиловых эфиров пропиленгликоля в концентрации 0,06—0,11 мг/л животные погибают в течение 6 ч при картине резкого возбуждения и судорог. После повторных отравлений на вскрытии обнаружены дистрофические изменения в клетках коры головного мозга н подкорковых узлов, а также в печени и почках. [c.458]
Действие на кожу. Раздражающее действие на кожу и глаза кроликов несколько сильнее, чем у изопропилового эфира пропиленгликоля. Проникает через неповрежденную кожу кроликов. ЛД50 = 3 мл/кг. [c.458]
Физические и химические свойства. Бесцветная жидкость с эфирным запахом. Т. кип. 35°, т. воспл. выше —30°, плотн. 0,831 (20°/20°), давл. паров 451 мм рт. ст. (19,6°), n2 = 1,3667. Смешивается с водой, спиртом и эфиром. При нагревании с водой образует а-пропиленгликоль. В смеси с воздухом взрывает. [c.478]
Физические свойства. М. — бесцветные кристаллы с запахом ванили т плавл. 81—83°, т. кип. 170° (15 мм рт. ст.), 146° (4 мм рт. ст.) плотн. 1,056 давл. паров 0,0022 мм рт. ст. (25°) в воде малорастворим растворим в спирте, эфире,, глицерине, пропиленгликоле. Э. — твердое вещество т. плавл. 77—79°, т. кип.. 285°. [c.522]
Получается взаимодействием пропиленгликоля со смесью конц. НЫОз и h3S04. [c.124]
Превращения в организме. Продуктами метаболизма П. являются неорганические нитриты и нитраты, а также пропиленгликоль-1-нитрат и пропиленгли-коль-2-нитрат. [c.124]
Эфиры алициклического и алифатического ряда и их галогенопроизводные диметиловый, диэтиловый, диизопропиловый, дибутиловый, винилбутило-вый, дивиниловый, монохлордиметиловый, дихлордиэтиловый, тетрахлордиэти-ловнй, эфиры этиленгликоля, пропиленгликоля, глицерина, полигликолевые эфиры. [c.165]
Очиститель рук в аэрозольной упаковке, ТУ 6-15-1044—77 — ароматизированный спиртово-водный раствор поверхностно-активных и смачивающих веществ, различных полезных добавок. Средство не токсично, огнеопасно. Состав (%) кислота олеиновая техническая (олеин) 11 этилацетат технический 10,5 спирт изопропиловый 19 1,2 — пропиленгликоль 5 триэтаноламин технический 3 синтанол ДС-10 4,5 диэтаноламиды синтетических жирных кислот 5 концентрат стеаринов 1 вода до 100. [c.100]
Физико-химические свойства Темно-коричневая жидкость. Представляет собой смесь сложного полиэфира П-520 (на основе 1,2-пропиленгликоля, фталевого ангидрида, глицерина, таллового масла), трихлорпропилфосфата, лапромола 294, активатора, эмульгатора, хладона 11. Плотн. 1230 кг/м3 в воде не раствор. [c.646]
Состав, % масс. оксиэтилированные жирные кислоты С 0-С 6 9,0, высшие окси-этилированные спирты С 0-С 6 9,0, алканон 5,0, триполифосфат натрия 30, сульфат натрия 4-11, хлорид натрия 4-11, пропиленгликоль или этилен гликоль, или глицерин 2,0, парфюмерная отдушка 0,2, оптический отбеливатель 0,2, вода до 100. [c.148]
Состав, % масс. ди- и трипропиленгликоль 80, пропиленгликоль 20. [c.324]
ru-safety.info





















