/ Документ Microsoft Word. Краун эфиры
КРАУН-ЭФИРЫ | Энциклопедия Кругосвет
Содержание статьиКРАУН-ЭФИРЫ (от англ. crown корона) крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков СН2СН2 и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название (англ. crown корона).
Номенклатура краун-эфиров.
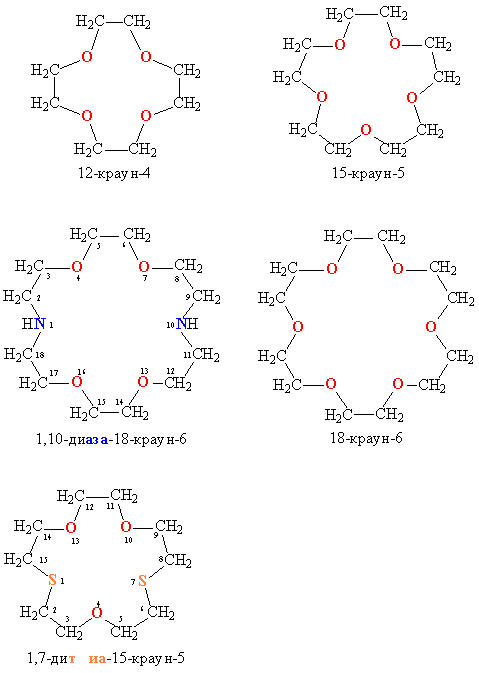
Рис. 1. СОСТАВЛЕНИЕ НАЗВАНИЙ ДЛЯ КРАУН-ЭФИРОВ
Свойства краун-эфиров.
Формально все краун-эфиры можно отнести к классу гетероциклических соединений, однако необычные свойства таких соединений позволили выделить их в самостоятельный класс, в связи с чем для составления названий были предложены специальные правила. Название содержит слово «краун», цифра перед этим словом обозначает общее число атомов в цикле, а цифра в конце названия указывает на количество гетероатомов O, N и S (рис.1). В названии не указывают наличие в цикле атомов О (это подразумевается), но если в цикле есть иные гетероатомы (кроме кислорода), например, азот или сера, то их количество указывают, добавляя к названию приставки ди- или три-, а положение в цикле с помощью числовых индексов, предварительно нумеруются все атомы в цикле.
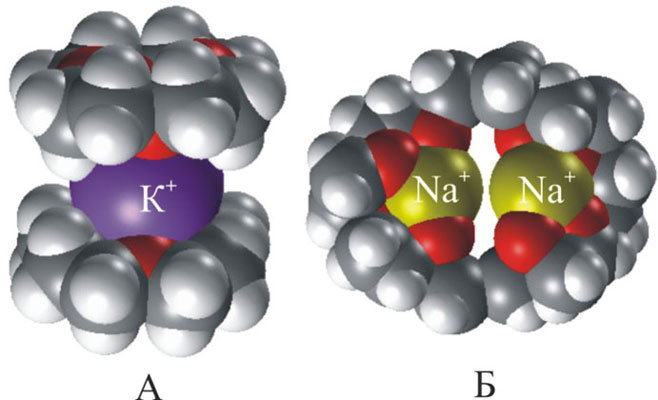
Краун-эфиры содержат фрагмент СОС, характерный для простых эфиров, а также могут включать фрагменты амина CNHC, или тиоэфира CSC (см. СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ). Характерное свойство этих классов соединений образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла. В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы. Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 (рис. 1) наиболее прочно захватывает катион лития, 15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия (рис. 2).
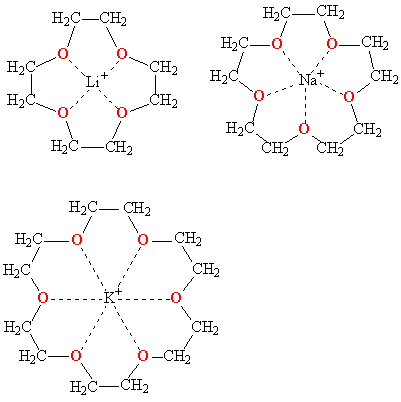
Рис. 2. КОМПЛЕКСЫ КРАУН-ЭФИРОВ с катионами щелочных металлов (пунктирными линиями показаны координационные связи)
Более наглядно взаимосоответствие внутренней полости цикла и размера катиона можно показать с помощью объемных моделей (рис. 3).
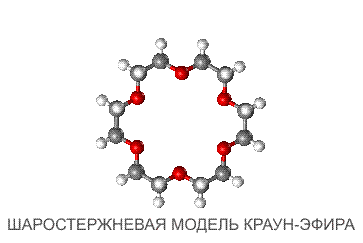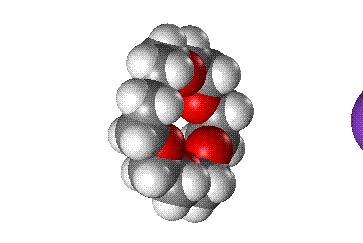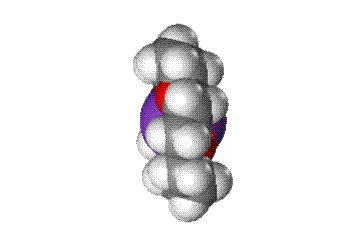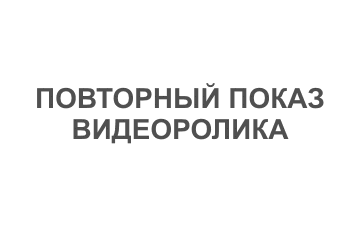
У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживаеся. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда (рис. 4А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. 4Б).
Подобные комплексы менее устойчивы, чем те, у которых размер катиона точно соответствует величине внутренней полости.
Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т.е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMnO4 практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Получение краун-эфиров.
При конденсации дихлоралкилов, содержащих в цепи простые эфирны группировки СОС, с полиэтиленгликолями протекает циклизация, приводящая к образованию краун-эфира (рис. 5А). В зависимости от длины цепочки исходных соединений получают краун-эфиры с различной величиной цикла. Азотсодержащие краун-эфиры получают конденсацией диаминов, содержащих эфирные группировки, с хлорангидридами дикарбоновых кислот. В результате получаются циклические амиды, которые затем восстанавливают, при этом карбонильные группы С=О превращаются в метиленовые СН2 (рис. 5Б). Серосодержащие краун-эфиры получают по схеме А (рис. 5), при этом исходные соединения содержат тиоэфирные группировки СSС.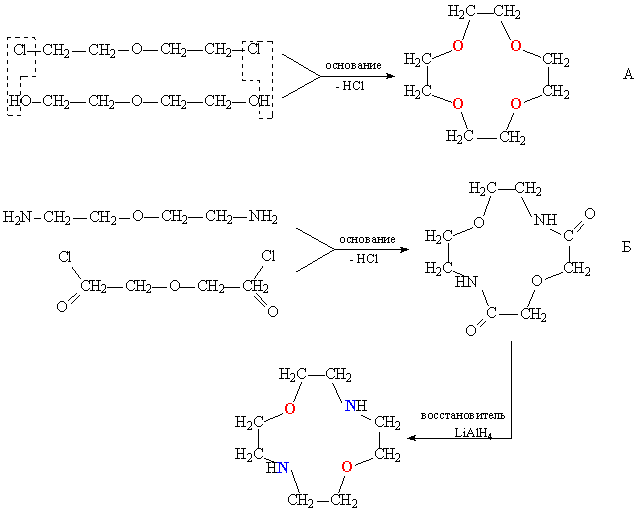
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Наибольшее распространение получили краун-эфиры, содержащие только гетероатомы О. Их применяют в технологических процессах, связанных с выделением и очисткой солей щелочных и щелочноземельных металлов, в аналитических исследованиях и работах, связанных с синтезом, когда нужно перевести неорганические соединения из водной фазы в органическую среду.
Краун-эфиры обладают противомикробной и противопаразитарной активностью, кроме того, из организма с их помощью выводятся ионы токсичных тяжелых металлов, а также радиоактивных изотопов цезия и стронция.
В радиохимии краун-эфиры помогают решать проблему переработки отходов ядерных производств. Первый этап удаление с помощью краун-эфиров из переработанного ядерного горючего наиболее активных изотопов (стронций-90, цезий-137, технеций-99), на этой стадии предпочтительны S-содержащие краун-эфиры, поскольку они обладают повышенной радиационной стойкостью. Извлеченные изотопы используются затем в установках радиодиагностики, заменяющих рентгеновские аппараты, а также при создании долговременных источников тока для метеостанций, метеозондов и космических аппаратов. Следующий этап переработки ядерного топлива извлечение с помощью краун-эфиров (специально подобранного состава) неизрасходованных урана и плутония, после чего объем подлежащих утилизации отходов становятся заметно меньше и к тому же отходы обладают слабой радиоактивностью.
На основе краун-эфиров созданы электропроводящие материалы нового типа (см. ЭЛЕКТРИДЫ).
За развитие химии макрогетероциклических соединений американский химик Ч.Педерсен, фактически создавший новый класс соединений краун-эфиры, в 1987 (совместно Д.Крамом и Ж.Леном) был удостоен Нобелевской премии.
Михаил Левицкий
www.krugosvet.ru
Краун-эфиры
Соединения типа краун-эфиров.
К соединениям данного типа относятся поданды, коронанды (или краун-соединения) и криптанды. Термин краун-эфиры употребляют в случае циклических полиэфиров. Соединения также называют ионофорами, поскольку они способны захватывать ионы и переносить их в липофильную среду.
Первыми представителями данного типа соединений являются краун-эфиры, синтезированные Педерсеном (лауреат Нобелевской примии). Название по номенкоатурн ИЮПАК очень сложное. Поэтому введены простые названия с сохранением названия краун-эфир и с добавлением заместителей. Например, бензо- или дибензо. Также возможно варьировать размер карун-эфира путем изменения количества атомов кислорода или метиленовых групп. В состав макроцикла могут входить и другие гетероатомы, отличные от кислорода, например, атомы серы, азота, а также фосфора и селена.
Когда в состав краун-соединения входят атомы азота, то возможно на их основе получить объемные структуры – криптанды. Между атомами азота возможна также дополнительная олигогликольная цепочка. На примере представленного здесь криптанда показана номенклатура соединений. В молекуле присутствует 3 олигоэфирные цепочки. В названии указывается количество гетероатомов в каждой из них. Так…..
В криптандах также могут присутствовать ароматические заместители или функциональные группы, а также можно построить криптанды цилиндрической или сферической формы.
Поданды являются открытоцепными аналогами краун-соединений. Определенной принятой номенклатуры для них не существует, есть лишь некоторые примеры устоявшихся названий. Они здесь приведены. Соединения могут также содержать различные заместители, различаться по структуре.
И,наконец, можно привести примеры комбинации различных ионофоров или рецепторов. Подандокоронанды или их называют также краун-соединения, снабженные руками.
Cинтез краун-эфиров заключается в конденсации линейных предшественников под действием оснований в среде органического растворителя таких как диметилформамид, спирты, диметилсульфоксид, ацетонитрил, тетрагидрофуран или их смесей с водой. Каков механизм реакции. На первой стадии происходит образование поданда вследствии атаки атома кислорода концевой группы атома углерода, имеющего тозильный заместитель. Взаимодействие происходит поскольку атом углерода, имеющий акцепторный заместитель, имеет недостаток электронной плотности, в то время как наличие электронной пары атома кислорода обеспечивает ему некоторый избыток электронной плотности. Т. е. происходит атака нуклеофилом (с избытком электронной плотности) электрофила. В присутствии катионов металлов происходит комплексообразование с подандом. Образуюшийся комплекс имеет псевдомакроциклическую структуру, которая является результатом оборачивания подандом катиона металла. В таком комплексе концевые или терминальные группы поданда сближены друг с другом. В результате облегчается протекание реакции конденсации между макроциклическими группами с образованием макроциклического соединения.
Каковы должны быть условия эффективного протекания процесса. Во-первых, реакция должна протекать при высоком разбавлении. Это очень важное условие. При проведении реакции в концентрированных условиях наблюдается олигомеризация, вследствии конденсации большого числа линейных предшественников между собой. При высоком разбавлении их концентрация мала, встретиться им очень проблематично, следовательно, реакция протекает внутримолекулярно с образованием одного циклического продукта.
Для эффективного протекания реакции необходимо наличие подходящей уходящей группы. Она должны иметь слабое связывание с олигогликолем. Подходящими группами являются хлориды, лучше иодиды и тозилаты. Нужно также, чтобы используемый растворитель в реакции мог растворять как неорганические соли, так и органические реагенты. И, наконец, важной компонентой реакционной среды является наличие катионов металлов, принимающих участие в реакции в качестве темплатного катиона. Роль катиона рассмотрим на примере синтеза тиакраун-эфиров. Макроциклические соединения, содержащие атомы серы, получают аналогично краун-эфирам. На данном слайде представлена конденсация замещенного бензальдегида с дитиолами. Также как и в случае краун-эфиров, реакция протекает через образование псевдомакроцикла. Было показано, что если размер катиона металла, участвующего в реакции, подходит к размеру полости образующегося краун-соединения, то реакция протекает с высоким выходом. В противном случае, выход реакции невелик, к тому же наблюдается образование побочных процессов. Для эффективного протекания реакции также было показано, что подходящей солью является перхлорат цезия, хотя по размеру не подходит. Почему? Более легко поляризуем, более походит по природе к лиганду сере. К тому же, одинаковые выходы для краун-эфиров различного размера указывают на то, что катион металла не входит в полость промежуточного поданда, а на его поверхности происходит реакция, присутствие металла облегчает отрыв галогена.
Для синтеза азакраун-эфиров используется несколько приемов. Можно также как и кислородные краун-соединения проводить конденсацию дигалогенидов или тозилатов с полиаминами в присутствии сильных основных реагентов. Другим способом является реакция хлорангидридов карбоновых кислот с полиаминами. Результатом этой реакции являются амиды, которые затем могут быть восстановлены, например, алюмогидридом лития. Можно также провести реакцию конденсации с олигоэтиленом в центре которого располагается атом азота, условия конденсации будут зависеть от концевых групп (спирты или тиолы).
Синтез криптандов более сложный, поскольку зачастую включает несколько стадий. Вначале синтезируют диазакраун-эфир через реакцию получения циклических амидов. Затем восстанавливают амид до диазакраун-эфира. На следующей стадии повторяется реакция.
Для осуществления синтеза подандов не требуется соблюдения условия высокого разбавления, поскольку реакция протекает межмолекулярно, однако, условия конденсации аналогичные: применение сильных оснований и органических полярных растворителей.
Образование комплексов катионов металлов с карун-эфирами характеризуется константой устойчивости. Это константа равновесного процесса связывания, зависит от концентрации реагирующих частиц и природы растворителя, температуры процесса. Как видно, необходимым условием связывания катиона металла является соответствие размера катиона металла размеру полости краун-соединения. Здесь приведены цифры, из которых следует, что катионы лития подходят по размеру к полости 12-краун-4-эфиру…..
Также сильно различаются константы устойчивости для подандов, криптандов и краун-эфиров. Здесь приведены равные по количеству и типу донорных центров представители краун-эфир, поданд, криптанд, а также краун-эфир с заместителем, способным также участвовать в процессе комплексообразования. Видно, что наиболее слабо связывают поданды. Понятно, что в этих соединениях нет жесткости. Наоборот, наиболее прочная связь между катионом и лигандом наблюдается в криптандах, поскольку в данном случае возможно осуществить сферическое связывание.
Для комплексообразования кроме устойчивости, важной характеристикой является селективность. Селективность бывает по отношению к размеру связываемогог катиона металла. Здесь приведены константы устойчивости для ряда металлов. Видно, что наиболее прочно связывается катион калия, вследствии хорошего соответствия полости макроцикла и размера катиона металла. Т. е. Наблюдается всплеск селективности.
Другой аспект селективности связан с соответствием природы донорных центров с природой катиона металла. В таблице приведены значения констант устойчивости для двух катионов и краун-эфиров, имеющих разный набор донорных центров. Так, калий наиболее прочно связывается с кислородными краун-эфирами. Ясно, что жесткие лиганды – атомы кислорода хорошо соответствуют жестким катионам металла. С другой стороны, более мягкие лиганды – атомы серы и азота лучше координируют с переходными и тяжелыми металлами.
Для криптандов также измерены константы комплексообразования. Как видно из приведеных данных, наиболее прочные комплексы образуются с катионами …..
Данные комплексы были подробно изучены методом рентгеноструктурного анализа. Как оказалось, криптанды обладают достаточно большой подвижностью. Что приводит к тому, что они могут приспосабливаться к размеру катиона. Так, обнаружены большие искажения от сферической формы в криптанде 2,2,2 в комплексе с катионом натрия, который не очень хорошо подходит по размеру, а для комплекса с катионами серебра обнаружена овальная структура. Такая подвижность приводит к не очень высокой селективности при комплексообразовании. Для катионов большого размера показано образование эксклюзивных комплексов, когда катион металла частично капсулирован криптандом. В таком комплексе сохраняется сильное связывание с анионом. Кстати, при образовании инклюзивного комплекса не наблюдается сохранение связи катион-анион.
Комплексообразование подандов отличается невысокой устойчивостью. Это связано с большой подвижностью олигоэфирной цепочкой. Однако, было обнаружено, что введение концевых групп может оказать стабилизирующее влияние. Так, хинолиновые группы придают комплексу устойчивость. Для поданда, имеющего 5 гетероатомов кислорода методом РСА обнаружено образование комплекса псевдокраун-эфирной структуры. Когда количество оксиметиленовых фрагментов увеличивается на 2 единицы, размер поданда становится больше, чем это необходимо для образования комплекса с рубидием, тогда происходит закручивание поданда вокруг катиона металла с образование структуры спирали.
За счет чего происходит упрочение комплексов подандов, имеющих концевые группы. Для хинолиновых подандов это происходит за счет слипания концевых ароматических фрагментов за счет стэкинг-взаимодействия. Также синтезированы поданды, у которых слипание концов происходит за счет образования водородных связей.
В приципе, подандовые комплексы характеризуются достаточно высокой прочностью, поскольку способны хорошо приспособиться к субстрату. Однако, из-за того, что приспособление происходит к каждой из связываемой частицы, то селективность низкая.
Комплексообразование можно также характеризовать значениями энергиеи Гиббса, которая расчитывается с учетом константы комплексообразования, а также учитывает температуру процесса. Нужно сказать, что можно производить и обратную операцию. С помощью метода калориметрии можно измерить тепловой эффект реакции, расчитать энергию Гиббса, а из полученных данных рассчитать константы комплексообразования.
Процесс комплексообразования начинается с организации лиганда. Например, структура кран-эфира не является сферической, электронная пара атомов кислорода развернута во внешнюю сторону от макроцикла. Значит, первым этапом процесса связывания катиона металла является реорганизация полости с разворотом электронной пары вовнутрь. Вторая структура называется челюсти. Два нафталиновых фрагмента связаны с 2 краун-эфирными частями. В результате комплексообразования челюсти схлопываются и держат внутри катион.
На процесс комплексообразования оказывают влияние два важных фактора. Прежде всего это природа противоиона катиона, связывающегося краун-эфиром. Между анионом и катионом может существовать прочная или слабая связь. В случае прочной связи плохо осуществляется диссоциация между ионами, тогда катиону не удается полностью погрузиться в краун-эфирную полость. На слайде приведено расстояние между атомами кислорода краун-эфирного фрагмента и катионом натрия, когда добавляют бромид и тиоцианат. Видимо, более прочная связь в бромиде не позволяет осуществлению тесного контакта с каслородом.
Другим важным влиянием является возможность вхождения аниона в полость макроцикла, если катион металла мал, а размер краун-эфира велик.
При изучении комплексообразования нужно очень внимательно относится к выбору аниона. Во-первых, нужно сравнительные исследования проводить с использованием одного и того же аниона для рада катионов металлов, поскольку рассчитанные константы комплексообразования всегда являются характеристиками конкретной соли, т.е. катиона и аниона. Т.е. при замене в составе соли аниона происходит изменение константы комплексообразования. Здесь приведен также случай, когда при использовании в качестве противоиона пикрата обнаружена его прочная связь с катионом кальция за счет образования хелатного комплекса данного состава. Это прочное связывание делает невозможным комплексообразование с краун-эфиром.
Как вы думаете, в приведеном ряду что будет образовывать более прочный комплекс.
Также очень важным фактором является влияние природы растворителя на протекание процесса комплексообразования. Например, если вы исследуете комплексообразование кислородных краун-эфиров в среде метанола, то можно предположить, что устойчивость комплексов будет невелика. Поскольку атомы кислорода спирта также могут являться лигандами для катионов металлов, даже если это связывание менее эффективно, чем краун-эфиром, оно будет проявляться сильно из-за обилия молекул спирта вокруг катиона. Наилучшим растворителем для исследования комплексообразования краун-эфиров является ацетонитрил. Этот растворитель обладает высокой полярностью и хорошо растворяет как краун-эфир, так и соль.
Растворители также могут входить в состав комплекса, что формирует определенную структуру комплекса. Так, катионы лития в водной среде всегда содержат большую водную шубу и входят с ней в состав макроцикла. Определить наличие растворителя или аниона в составе комплекса помогает элементный анализ.
Основным применением краун-эфиров является химические реакции и аналитическая химия. В химической реакции краун-эфиры используются в качестве переносчиков заряженых частиц из воды в органическую фазу в двухфазных реакциях. Если ваши исходные реагенты растворимы в органической фазе, а используемые щелочь или соли – в неорганической, то необходимо провести перенос неорганического реагента в органическую фазу. Для этой цели используются краун-эфиры. Напрмер, реакции Канницаро, когда диспропорционирование спиртов происходит под действием щелочи.
Другим примером использования является участие в модификации реакционной способности реагирующих частиц. Так, под действием краун-эфиров наблюдается активация анионов. Например, конденсация альдегида с малоновой кислотой происходит под действием алкоголята натрия. Механизм реакции заключается в отрыве протона от малоновой кислоты на первой стадии и нуклеофильной атаки образующегося аниона электрофильного центра альдегида с образование спирта, а затем и этилена. Добавление краун-эфирв в реакционную смесь приводит к связыванию катиона, высвобождению метилат-аниона и его активация в реакции депротонорования.
Можно также влиять на реакции, протекающие с учатием катиона. Так, показано, что при восстановлении карбонильной группы литийалюминий гидридами реакция подавляется в присутствии краун-эфиров, поскольку происходит захват лития краун-эфиром, что подавляет протекание реакции.
Далее представлены примеры применения краун-эфиров в аналитической химии. Это экстрагирующие лиганды. Механизм – обработка водных растворов солей органическими растворами, содержащими комплексоны (хлф, бензол, нитрометан). Для этой цели наиболее подходящими оказались природные ионофоры.
Искусственные ионофоры используются для разделения катионов, так…..
Также можно использовать для разделения анионов и концентрирования радионуклеидов.
Краун-соединения можно ввести в полимерные материалы или модифицировать ими селикагели. Таким образом получают носители, содержащие ионофорные группы. Такие носители используют в различных видах хроматографии.
Ионофоры используют и для проведения электрофореза на бумаге. Так производят деление аминокислот или карбоновых кислот.
Краун-эфиры нашли применение и в физико-химических методах анализа. Так, экстракционная фотометрия используется для анализа растворов. Т.е. экстрагируют водные растворы пикратами или краун-эфирами, растворы которых окрашены и по изменению окраски можно судить по концентрации катиона.
Добавляют краун-эфир в титрующий раствор при проведении потенциометрического титрования.
В полярографии в присутствии краун-эфиров более сильное взаимодействие с капилярным элетродом происходит в присутствии катиона металла.
studfiles.net
Краун-эфиры - «Энциклопедия»
КРАУН-ЭФИРЫ (краун-соединения), макрогетероциклические соединения, содержащие в цикле свыше 11 атомов, из которых не менее 4 - гетероатомы (О, N, S), связанные между собой этиленовыми мостиками. Молекулы краун-соединений имеют конформацию короны, что и определило название веществ этого класса (от английского crown - корона). Впервые синтезированы Ч. Педерсеном в 1967 году. За открытие и исследование свойств макрогетероциклических соединений Ч. Педерсену, Д. Краму и Ж. М. Лену присуждена Нобелевская премия (1987).
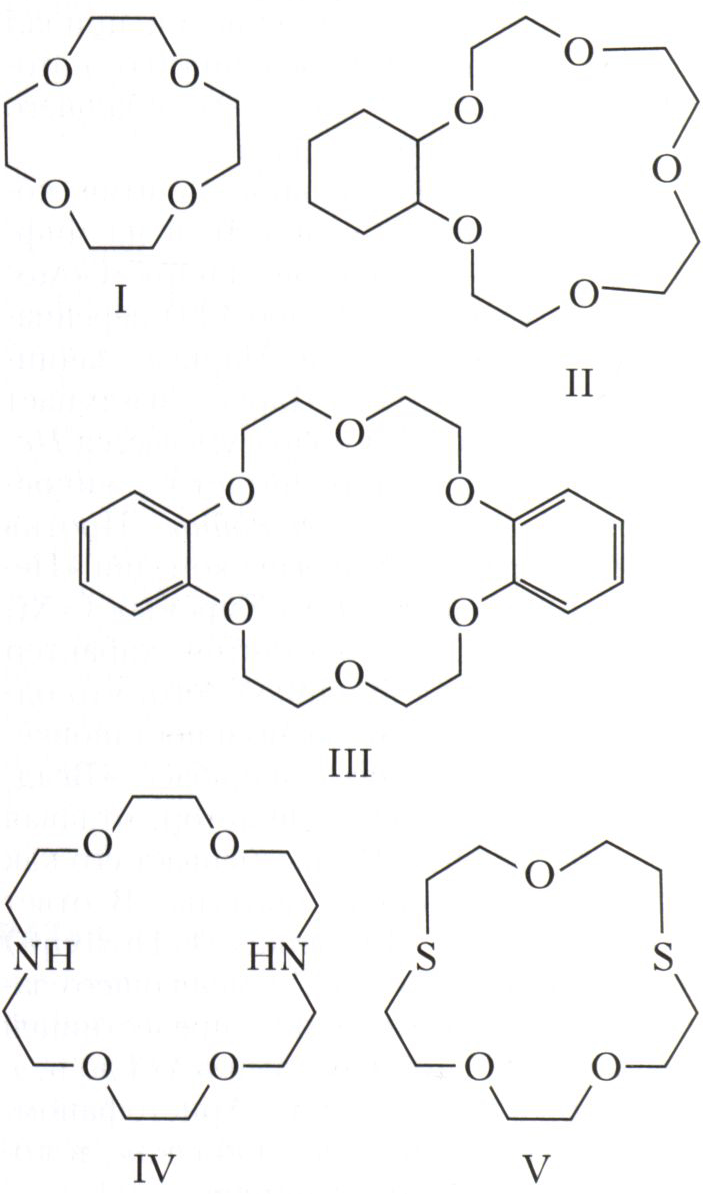
Структура простейшего краун-эфира представлена формулой I. Получены краун-соединения, содержащие в цикле другие гетероатомы (Р, Si, As), функциональные группы (сложноэфирные и пр.), а также конденсированные с одним или несколькими бензольными, циклогексановыми кольцами (в том числе замещёнными). В тривиальных названиях краун-эфира общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят соответственно перед и после слова «краун»; например, 12-краун-4 (формула I), циклогексано-15-краун-5 (II), дибензо-18-краун-6 (III), 1,10-диаза-18-краун-6 (IV), 1,7-дитиа-15-краун-5 (V).
Реклама
Краун-эфиры - вязкие жидкости или кристаллические вещества; растворяются в воде и в большинстве органических растворителей. Химические свойства определяются природой гетероатома и функциональных групп. Краун-эфиры образуют макроциклические комплексные соединения как с катионами, так и с нейтральными молекулами. В комплексах краун-эфира с катионами металлов (щелочных, щёлочноземельных и др.) катион включается во внутримолекулярную полость краун-эфира и удерживается там благодаря ион-дипольному взаимодействию с гетероатомами (один из способов расположения катиона металла в полости краун-эфира представлен формулой VI). Селективность связывания и устойчивость образуемых краун-эфиром комплексов зависит от ряда факторов – геометрического соответствия размеров внедряющейся частицы и полости макроцикла, природы растворителя, хелатного и макроциклических эффектов, заряда внедряющейся частицы, природы противоиона и пр. За счёт комплексообразования краун-эфиры повышают растворимость солей щелочных и щёлочноземельных металлов в малополярных растворителях; пример - образование малинового бензола и оранжевого бензола (окислительных реагентов) при растворении в бензоле соответственно KMnО4 или К2Cr2О7 в присутствии краун-эфира. Щелочные металлы в присутствии краун-эфира растворяются в координирующих органических растворителях; интенсивный синий цвет образующихся растворов объясняется присутствием в них сольватированной формы свободных электронов (получаемый раствор является восстановительным реагентом). Краун-эфиры способны селективно экстрагировать ионы металлов и некоторые органические соединения (амины, аминокислоты и др.) из водной фазы в органическую, энантиоспецифически связывать хиральные молекулы (в частности, протонированные формы аминокислот). За счёт влияния на ионную и субстратную проницаемость биологических мембран, на ферментные системы и другие биохимические процессы краун-эфиры проявляют различные виды биологической активности.
Краун-эфир получают в основном конденсацией дигалогеналканов или диэфиров n-толуолсульфокислоты (дитозилатов) с полиэтиленгликолями, внутримолекулярной циклизацией монотозилатов полиэтиленгликолей, циклоолигомеризацией этиленоксида. Конденсацию проводят в присутствии катионов металлов (чаще К+, Cs+), внутримолекулярную циклизацию - в условиях высокого разбавления.
Краун-эфир широко используют в научных исследованиях как доступные и разнообразные модели при изучении сложных природных супрамолекулярных систем. С помощью краун-эфира можно избирательно выводить из организма ионы тяжёлых металлов или вводить малые количества нужных ионов или молекул. Краун-эфиры применяют для концентрирования, разделения, очистки и регенерации металлов, в том числе лантаноидов, для разделения нуклидов, энантиомеров; для создания ионоселективных датчиков и мембран; в межфазном катализе и для ускорения реакций, проходящих с участием анионов; как лекарственные препараты, пестициды, антидоты.
Лит.: Хираока М. Краун-соединения. Свойства и применения. М., 1986; Химия комплексов «гость-хозяин» / Под редакцией Ф. Фегтле, Э. Вебера. М., 1988.
О. Б. Рудаков.
knowledge.su
Документ Microsoft Word
КРАУН-ЭФИРЫ
Историческая справка
Краун-эфиры – макроциклы, содержащие в своем составе наряду с метиловыми звеньями (–СН2–СН2–) кислородные атомы, в некоторых случаях часть атомов О заменена атомами N или S. Открытие и синтез краун-эфиров – одна из наиболее ярких страниц в развитии органической химии последних десятилетий. Первый из этого класса макроциклических соединений – дибензо-18-краун-6 – был получен Ч. Педерсеном (США) в 1967 г. (За открытие нового класса соединений он был удостоен Нобелевской премии по химии в 1987г.) Педерсен изучал свойства различных стабилизаторов каучуков, нефтяных масел, резиновых материалов. Основное назначение этих стабилизаторов заключалось в предотвращении разрушения антиоксидантов, которое инициировалось присутствием следовых количеств металлов. Синтезируя дезактиватор катиона ванадия VO2+, Педерсен в качестве побочного продукта выделил макроцикл, содержащий в цикле 12 углеродных и 6 кислородных атомов. Впоследствии Педерсен получил в общей сложности 60 полиэфиров с числом кислородных атомов от 4 до 20 и размером цикла от 12 до 60-членного. Все атомы кислорода как бы выведены из плоскости цикла и ориентированы в одну сторону, что очень облегчает их последующее полярное взаимодействие с катионом металла[24].
Обратив внимание на удивительную способность этих макроциклов заключать в свою полость катионы металлов – "короновать" их, Педерсен и предложил соответствующее название этому новому классу веществ – краун - соединения (от англ. crown – корона) .
Появление краун-эфиров заметно расширило возможности экспериментальной химии. Стало возможным переводить в органическую среду типичные неорганические соединения и проводить с ними различные реакции.
КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых сигментов –СН2–СН2– и атомов кислорода являются полидентатными лигандами в комплексах с катионами металлов.. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название (англ. crown – корона).
Номенклатура краун-эфиров.

СОСТАВЛЕНИЕ НАЗВАНИЙ ДЛЯ КРАУН-ЭФИРОВ
Свойства краун-эфиров.
Формально все краун-эфиры можно отнести к классу гетероциклических соединений, однако необычные свойства таких соединений позволили выделить их в самостоятельный класс, в связи с чем для составления названий были предложены специальные правила. Название содержит слово «краун», цифра перед этим словом обозначает общее число атомов в цикле, а цифра в конце названия указывает на количество гетероатомов O, N и S .В названии не указывают наличие в цикле атомов О (это подразумевается), но если в цикле есть иные гетероатомы (кроме кислорода), например, азот или сера, то их количество указывают, добавляя к названию приставки ди- или три-, а положение в цикле – с помощью числовых индексов, предварительно нумеруются все атомы в цикле.Константы устойчивости комплексов катионов (lg
Краун-эфиры содержат фрагмент С–О–С, характерный для простых эфиров, а также могут включать фрагменты амина C–NH–C, или тиоэфира C–S–C .Характерное свойство этих классов соединений – образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла. В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы. Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 наиболее прочно захватывает катион лития, 15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия .

КОМПЛЕКСЫ КРАУН-ЭФИРОВ с катионами щелочных металлов (пунктирными линиями показаны координационные связи)
Более наглядно взаимосоответствие внутренней полости цикла и размера катиона можно показать с помощью объемных моделей .

У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживаеся. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона .

Подобные комплексы менее устойчивы, чем те, у которых размер катиона точно соответствует величине внутренней полости.
Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т.е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMnO4практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4–, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Получение краун-эфиров.
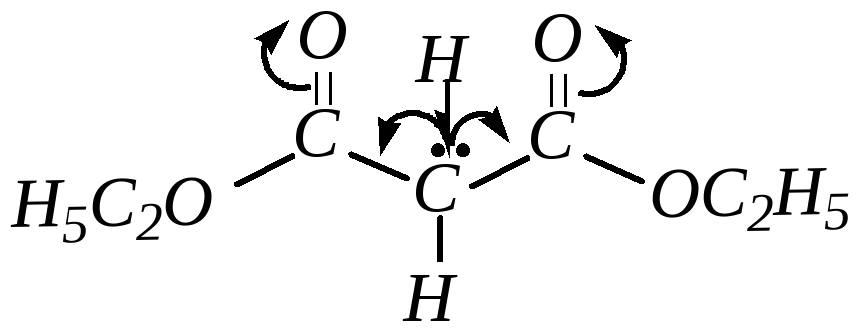
Обычно для синтеза краун - соединений используют реакцию Вильямсона:  . Для подавления образования побочных линейных полимеров часто применяются следующие методы: способ высокого разбавления, двухстадийная конденсация, матричные реакции.
. Для подавления образования побочных линейных полимеров часто применяются следующие методы: способ высокого разбавления, двухстадийная конденсация, матричные реакции.
С 1978 г. с использованием вышеупомянутых методов промышленностью производятся такие краун-эфиры, как дибензо-18-краун-6, дибензо-24-краун-8, дициклогексил-18-краун-6 и др.
При конденсации дихлоралкилов, содержащих в цепи простые эфиры группировки С–О–С, с полиэтиленгликолями протекает циклизация, приводящая к образованию краун-эфира. В зависимости от длины цепочки исходных соединений получают краун-эфиры с различной величиной цикла. Азотсодержащие краун-эфиры получают конденсацией диаминов, содержащих эфирные группировки, с хлорангидридами дикарбоновых кислот. В результате получаются циклические амиды, которые затем восстанавливают, при этом карбонильные группы С=О превращаются в метиленовые СН2. Серосодержащие краун-эфиры получают по схеме А, при этом исходные соединения содержат тиоэфирные группировки С–S–С.
.
Применение краун-эфиров
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Наибольшее распространение получили краун-эфиры, содержащие только гетероатомы О. Их применяют в технологических процессах, связанных с выделением и очисткой солей щелочных и щелочноземельных металлов, в аналитических исследованиях и работах, связанных с синтезом, когда нужно перевести неорганические соединения из водной фазы в органическую среду.
В радиохимии краун-эфиры помогают решать проблему переработки отходов ядерных производств. Первый этап – удаление с помощью краун-эфиров из переработанного ядерного горючего наиболее активных изотопов (стронций-90, цезий-137, технеций-99), на этой стадии предпочтительны S-содержащие краун-эфиры, поскольку они обладают повышенной радиационной стойкостью. Извлеченные изотопы используются затем в установках радиодиагностики, заменяющих рентгеновские аппараты, а также при создании долговременных источников тока для метеостанций, метеозондов и космических аппаратов. Следующий этап переработки ядерного топлива – извлечение с помощью краун-эфиров (специально подобранного состава) неизрасходованных урана и плутония, после чего объем подлежащих утилизации отходов становятся заметно меньше и к тому же отходы обладают слабой радиоактивностью.
На основе краун-эфиров созданы электропроводящие материалы нового типа.
Библиография: Даффа реакция — Меди// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1990. — Т. 2. — 671 с.
Нейланд, О. Я. Органическая химия. — М.: Высш. шк., 1990. — 751 с.
Хараока М. Краун-соединения. М., Мир, 1986
Давыдова С.Л. Удивительные макроциклы. Л., 1989
Федеральное Государственное Образовательное Учреждение Высшего Профессионального Образования «Московская государственная Академия Ветеринарной Медицины И Биотехнологии
Им.К.И.Скрябина
Реферат
На тему: КРАУН-ЭФИРЫ .
Выполнил:
Студент 2 курса ВБФ
группы№3
Дербуш С.А.
studfiles.net
КРАУН-ЭФИРЫ • Большая российская энциклопедия
-
-
-
В книжной версии
Том 15. Москва, 2010, стр. 654
-
Скопировать библиографическую ссылку:
Авторы: О. Б. Рудаков

КРА́УН-ЭФИ́РЫ (краун-соединения), макрогетероциклические соединения, содержащие в цикле св. 11 атомов, из которых не менее 4 – гетероатомы (O, N, S), связанные между собой этиленовыми мостиками. Молекулы краун-соединений имеют конформацию короны, что и определило назв. веществ этого класса (от англ. crown – корона). Впервые синтезированы Ч. Педерсеном в 1967. За открытие и исследование свойств макрогетероциклических соединений Ч. Педерсену, Д. Краму и Ж. М. Лену присуждена Нобелевская пр. (1987).

Структура простейшего К.-э. представлена формулой I. Получены краун-соединения, содержащие в цикле др. гетероатомы (Р, Si, As), функциональные группы (сложноэфирные и пр.), а также конденсированные с одним или несколькими бензольными, циклогексановыми кольцами (в т. ч. замещёнными). В тривиальных названиях К.-э. общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят соответственно перед и после слова «краун»; напр., 12-краун-4 (формула I), циклогексано-15-краун-5 (II), дибензо-18-краун-6 (III), 1,10-диаза-18-краун-6 (IV), 1,7-дитиа-15-краун-5 (V).
К.-э. – вязкие жидкости или кристаллич. вещества; растворяются в воде и в большинстве органич. растворителей. Химич. свойства определяются природой гетероатома и функциональных групп. К.-э. образуют макроциклические комплексные соединения как с катионами, так и с нейтральными молекулами. В комплексах К.-э. с катионами металлов (щелочных, щёлочноземельных и др.) катион включается во внутримолекулярную полость К.-э. и удерживается там благодаря ион-дипольному взаимодействию с гетероатомами (один из способов расположения катиона металла в полости К.-э. представлен формулой VI). Селективность связывания и устойчивость образуемых К.-э. комплексов зависит от ряда факторов – геометрич. соответствия размеров внедряющейся частицы и полости макроцикла, природы растворителя, хелатного и макроциклического эффектов, заряда внедряющейся частицы, природы противоиона и пр. За счёт комплексообразования К.-э. повышают растворимость солей щелочных и щёлочноземельных металлов в малополярных растворителях; пример – образование малинового бензола и оранжевого бензола (окислительных реагентов) при растворении в бензоле соответственно KMnO4 или K2Cr2O7 в присутствии К.-э. Щелочные металлы в присутствии К.-э. растворяются в координирующих органич. растворителях; интенсивный синий цвет образующихся растворов объясняется присутствием в них сольватированной формы свободных электронов (получаемый раствор является восстановительным реагентом). К.-э. способны селективно экстрагировать ионы металлов и некоторые органич. соединения (амины, аминокислоты и др.) из водной фазы в органическую, энантиоспецифически связывать хиральные молекулы (в частности, протонированные формы аминокислот). За счёт влияния на ионную и субстратную проницаемость биологич. мембран, на ферментные системы и др. биохимич. процессы К.-э. проявляют разл. виды биологич. активности.
К.-э. получают в осн. конденсацией дигалогеналканов или диэфиров п-толуолсульфокислоты (дитозилатов) с полиэтиленгликолями, внутримолекулярной циклизацией монотозилатов полиэтиленгликолей, циклоолигомеризацией этиленоксида. Конденсацию проводят в присутствии катионов металлов (чаще K+, Cs+), внутримолекулярную циклизацию – в условиях высокого разбавления.
К.-э. широко используют в науч. исследованиях как доступные и разнообразные модели при изучении сложных природных супрамолекулярных систем. С помощью К.-э. можно избирательно выводить из организма ионы тяжёлых металлов или вводить малые количества нужных ионов или молекул. К.-э. применяют для концентрирования, разделения, очистки и регенерации металлов, в т. ч. лантаноидов, для разделения нуклидов, энантиомеров; для создания ионоселективных датчиков и мембран; в межфазном катализе и для ускорения реакций, проходящих с участием анионов; как лекарственные препараты, пестициды, антидоты.
bigenc.ru
КРАУН-ЭФИРЫ | Энциклопедия Кругосвет
Содержание статьиКРАУН-ЭФИРЫ (от англ. crown корона) крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков СН2СН2 и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название (англ. crown корона).
Номенклатура краун-эфиров.

Рис. 1. СОСТАВЛЕНИЕ НАЗВАНИЙ ДЛЯ КРАУН-ЭФИРОВ
Свойства краун-эфиров.
Формально все краун-эфиры можно отнести к классу гетероциклических соединений, однако необычные свойства таких соединений позволили выделить их в самостоятельный класс, в связи с чем для составления названий были предложены специальные правила. Название содержит слово «краун», цифра перед этим словом обозначает общее число атомов в цикле, а цифра в конце названия указывает на количество гетероатомов O, N и S (рис.1). В названии не указывают наличие в цикле атомов О (это подразумевается), но если в цикле есть иные гетероатомы (кроме кислорода), например, азот или сера, то их количество указывают, добавляя к названию приставки ди- или три-, а положение в цикле с помощью числовых индексов, предварительно нумеруются все атомы в цикле.
Краун-эфиры содержат фрагмент СОС, характерный для простых эфиров, а также могут включать фрагменты амина CNHC, или тиоэфира CSC (см. СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ). Характерное свойство этих классов соединений образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла. В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы. Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 (рис. 1) наиболее прочно захватывает катион лития, 15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия (рис. 2).

Рис. 2. КОМПЛЕКСЫ КРАУН-ЭФИРОВ с катионами щелочных металлов (пунктирными линиями показаны координационные связи)
Более наглядно взаимосоответствие внутренней полости цикла и размера катиона можно показать с помощью объемных моделей (рис. 3).

У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживаеся. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда (рис. 4А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. 4Б).

Подобные комплексы менее устойчивы, чем те, у которых размер катиона точно соответствует величине внутренней полости.
Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т.е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMnO4 практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Получение краун-эфиров.
При конденсации дихлоралкилов, содержащих в цепи простые эфирны группировки СОС, с полиэтиленгликолями протекает циклизация, приводящая к образованию краун-эфира (рис. 5А). В зависимости от длины цепочки исходных соединений получают краун-эфиры с различной величиной цикла. Азотсодержащие краун-эфиры получают конденсацией диаминов, содержащих эфирные группировки, с хлорангидридами дикарбоновых кислот. В результате получаются циклические амиды, которые затем восстанавливают, при этом карбонильные группы С=О превращаются в метиленовые СН2 (рис. 5Б). Серосодержащие краун-эфиры получают по схеме А (рис. 5), при этом исходные соединения содержат тиоэфирные группировки СSС.
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Наибольшее распространение получили краун-эфиры, содержащие только гетероатомы О. Их применяют в технологических процессах, связанных с выделением и очисткой солей щелочных и щелочноземельных металлов, в аналитических исследованиях и работах, связанных с синтезом, когда нужно перевести неорганические соединения из водной фазы в органическую среду.
Краун-эфиры обладают противомикробной и противопаразитарной активностью, кроме того, из организма с их помощью выводятся ионы токсичных тяжелых металлов, а также радиоактивных изотопов цезия и стронция.
В радиохимии краун-эфиры помогают решать проблему переработки отходов ядерных производств. Первый этап удаление с помощью краун-эфиров из переработанного ядерного горючего наиболее активных изотопов (стронций-90, цезий-137, технеций-99), на этой стадии предпочтительны S-содержащие краун-эфиры, поскольку они обладают повышенной радиационной стойкостью. Извлеченные изотопы используются затем в установках радиодиагностики, заменяющих рентгеновские аппараты, а также при создании долговременных источников тока для метеостанций, метеозондов и космических аппаратов. Следующий этап переработки ядерного топлива извлечение с помощью краун-эфиров (специально подобранного состава) неизрасходованных урана и плутония, после чего объем подлежащих утилизации отходов становятся заметно меньше и к тому же отходы обладают слабой радиоактивностью.
На основе краун-эфиров созданы электропроводящие материалы нового типа (см. ЭЛЕКТРИДЫ).
За развитие химии макрогетероциклических соединений американский химик Ч.Педерсен, фактически создавший новый класс соединений краун-эфиры, в 1987 (совместно Д.Крамом и Ж.Леном) был удостоен Нобелевской премии.
Михаил Левицкий
www.9.www.krugosvet.ru
Лекция
Лекция №30
ПРОСТЫЕ ЭФИРЫ
План
- Классификация и номенклатура простых эфиров.
- Способы получения диалкиловых эфиров, их физические и химические свойства.
- Циклические эфиры.
- Оксираны и краун – эфиры.
Простые эфиры можно рассматривать как производные спиртов, в которых атом водорода гидроксильной группы замещен на углеводородный радикал.
По характеру атомов углерода, связанных с кислородным атомом, простые эфиры можно подразделить на следующие типы:
1. Эфиры, содержащие связи С(sp3)¾O.
К ним относятся эфиры структуры ROR/и циклические эфиры.
 2. Эфиры содержащие связь С(sp2)¾O
2. Эфиры содержащие связь С(sp2)¾O
К ним относятся
- алкилалкениловые (виниловые) эфиры

- диалкениловые эфиры

- алкилариловые эфиры

- диариловые эфиры
 3. Эфиры, содержащие связь С(sp)¾O
3. Эфиры, содержащие связь С(sp)¾O
RCº C-OR/
Диалкиловые эфиры
Диалкиловые эфиры являются наиболее важными представителями класса простых эфиров. Их эмпирическая формула Сnh3n+ 2O или Сnh3n+ 1OCmh3m + 1.
Изомерия и номенклатура
Наименование диалкиловых эфиров по рациональной номенклатуре образуют путем перечисления заместителей и прибавления слова "эфир".
Номенклатура IUPAC рассматривает эфир как производное углеводорода, замещенного на алкоксигруппу, причем в основе названия лежит наиболее длинная углеводородная цепь.

Способы получения диалкиловых эфиров
- Синтез Вильямсона.

Можно видеть, что этот способ удобен для получения несимметричных эфиров.
- Межмолекулярная дегидратация спиртов.

Реакция эффективна при получении симметричных эфиров. Следует иметь в виду, что при повышении температуры будет прогрессировать реакция нуклефильного отщепления, особенно если обьектом дегидратации являются разветвленные спирты (вторичные и третичные)
- Алкилирование спиртов алкенами.

Функция кислоты – катализатора заключается в генерировании карбкатионов, которые эффективно атакуются нуклеофилом – спиртом:



Эффективность реакции определяется стабильностью карбкатиона, поэтому соблюдается следующий ряд реакционной способности алкенов.

- Алкоксимеркурирование алкенов.

или суммарно

Физические свойства и строение
Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира) со своеобразным запахом и низкими температурами кипения, что свидетельствует о слабом межмолекулярном взаимодействии. Это является показателем низкой полярности диалкиловых эфиров и отсутствия (в отличие от спиртов) предпосылок для образования водородных связей. В отличие от спиртов эфиры обладают более сильными электронодонорными свойствами, о чем свидетельствует значение потенциалов ионизации. Увеличение электронодонорных свойств обьясняется положительным индуктивным эффектом алкильных групп. Валентный угол приближается к тетраэдрическому и равен109–1120.
Химические свойства
- Основность
Основность простых эфиров проявляется в их взаимодействии с кислотами Бренстеда и Льюиса. С Бренстедовскими кислотами умеренной силы взаимодействие осуществляется посредством водородной связи.

В случае сильных Бренстедовских кислот происходит протонирование эфиров и образование оксониевых кислот.

Простые эфиры – слабые основания и начинают протонироваться в ощутимых количествах в растворе 30 - 40%-ной серной кислоты.
С кислотами Льюиса диалкиловые эфиры образуют стабильные продукты присоединения – эфираты.

В этих соединениях образуется донорно–акцепторная связь за счет неподеленной пары атома кислорода.
Способность простых эфиров сольватировать катионы различных металлов имеет исключительное значение для получения металоорганических соединений в растворах диалкиловых эфиров или тетрагидрофурана.
- Реакции при a - углеродном атоме диалкиловых эфиров.
Простые эфиры могут вступать в реакции свободнорадикального хлорирования и автоокисления, причем обьектом этих реакций является a - углеродный атом эфиров.

Основанием для такого направления является стабильность a - алкилалкоксирадикалов,

обуслoвливающая энергетическую выгодность реакции инициирования (в случае автоокисления) и развития цепей (в случае автоокисления и хлорирования)

где Х. – радикал цепи при хлорировании (Cl.) и автоокислении

Образующиеся в результате автоокисления гидропероксиды являются взрывчатыми веществами. Они могут образовываться в эфирах при хранении в условиях доступа воздуха и в прозрачных бутылках. Поэтому эфиры после длительного хранения перед употреблением подлежат обработке с целью разрушения гидропероксидов.
- Реакции расщепления С ¾ О – связи
Эфиры расщепляются под действием сильных кислот, например, иодоводородной, бромоводородной, суперкислот:


При действии суперкислот на эфиры при низких температуах генерируются карбкатионы, которые могут претерпевать различные перегруппировки и распад до алкенов.

При этом легче расщепляются простые эфиры, которые содержат разветвленные группы, так как в результате протонирования образуются более устойчивые карбкатионы.
Алкилвиниловые эфиры.
Методы получения
- Винилирование спиртов

- Дегидрогалогенирование a - галогендиалкиловых эфиров

Химические свойства алкилвиниловых эфиров
Основными реакциями алкилвиниловых эфиров являются:
- Электрофильное присоединение

Можно показать, что порядок присоединения HНal и других протонных кислот определяется стабильностью промежуточных карбкатионов.
- Полимеризация

Эти реакции могут осуществляться по свободнорадикальному или карбкатионному механизмам. В первом случае в качестве инициаторов используют органические пероксиды или азобисизобутилонитрил, во втором - реакции катализируются протонными кислотами, причем во избежание электрофильного присоединения кислоты - катализатора НХ к двойной связи, кислоте должен соответствовать слабый нуклефил Х.
Циклические эфиры
Циклические эфиры – производные алкандиолов, в которых эфирная связь образована внутримолекулярно.
Циклические эфиры подразделяются на несколько групп в зависимости от величины цикла и числа кислородных атомов в цикле. Их часто называют оксидами.
В этом плане различают:


Эпоксиды (оксираны)
Основу названия этих соединений составляет наименование углеводорода, а на присутствие кислородного мостика указывает приставка "эпокси". Для простейших соединений сохраняется название этиленоксид и пропиленоксид. Используется также номенклатура гетероциклических соединений "оксираны". Например,

Методы получения
- Дегидрогалогенирование галогеналканолов (галогенгидринов)

- Окисление (эпоксидирование) алкенов (реакция Прилежаева)

В качестве катализаторов используют кислые соли вольфрамовой кислоты (Н2О2) и соединений молибдена (ROOH). Реакцию можно осуществлять некаталитически, если в качестве эпоксидирующего агента использовать органические надкислоты.

Первый член гомологического ряда этиленоксид, в промышленности получают парофазным окислением кислородом или воздухом.

Химические свойства
Химическое поведение оксиранов определяется тремя факторами: поляризацией связей С ¾ О с образованием частичного положительного заряда на углероде оксидного цикла, электронодонорными свойствами атома кислорода и напряженностью оксидного цикла. Поэтому наиболее характерными реакциями оксиранов являются реакции нуклеофильного присоединения по положительно заряженному углероду цикла, сопровождающиеся разрывом связи С¾ О цикла, облегчаемым протонированием кислородного атома под действием протонодонорного агента.
Совместное действие этих факторов отчетливо проявляется в некаталитической реакции этиленоксида с водой

или суммарно:

Эта реакция протекает медленно, поскольку вода является слабым протонодонорным агентом. Для ускорения этой реакции необходимо использовать высокую температуру и давление.
Другие более сильные нуклеофилы (Nh4, RNh3, RMgX) реагируют более легко.



Приведенные реакции имеют важное препаративное и промышленное значение. Получаемый гидратацией этилена этиленгликоль являются антифризом и исходным веществом для синтеза лавсана, этаноламины используются в качестве абсорбентов для извлечения кислых примесей из газов. Оксиэтилирование реактивов Гриньяра – важный способ увеличения длины углеродной цепи органических соединений на два углеродных атома.
Если в реакциях нуклеофильного замещения оксиранов участвуют нуклеофилы HNu, обладающие слабой нуклефильной активностью и слабой кислотностью (h3O, h3S, RSN), то для эффективного проведения этих реакций используют кислотный или основной катализ. Например, кислотно–каталитическая реакция со спиртами связана с эффективным протонированием оксирана, приводящим к увеличению положительного заряда на его углеродных атомах и делающим атаку нуклеофила более эффективной:

Или суммарно

Образующиеся в этих реакциях целлозольвы и карбитолы – универсальные растворители.
При основном катализе под действием основания продуцируется более эффективный нуклеофил, например, в реакциях с ROH, RSH, h3S, HCN, эффективно атакующий углеродный атом оксиранового цикла:


или суммарно:

Краун – эфиры
Краун-эфиры - макроциклические полиэфиры с четырьмя и более кислородными атомами в цикле. В большинстве случаев они являются производными этиленгликоля. В названии соединений цифра в квадратных скобках указывает число атомов в макроцикле, а вторая - число кислородных атомов.

Краун - эфиры получают по реакции Вильямсона из соответствующих гликолятов и дигалогеналканов:

или галогенов b , b ’ – дигалогеналкиловых эфиров.

Самое важное свойство краун–эфиров – образование комплексов с катионами металлов.

Ион металла находится в полости макроцикла и прочно удерживается благодаря донорно–акцепторным связям кислород – металл, причем чем ближе ионный диаметр металла к диаметру полости, тем устойчивее комплекс.
Краун – эфиры используют для улучшения растворимости неорганических солей в органических растворителях, в качестве межфазных катализаторов, для генерирования несольватированных анионов в неорганических растворителях. Благодаря этому можно ускорить реакцию нуклеофильного замещения этими анионами. Соединения типа краун – эфиров играют большую роль в биологических системах – они осуществляют транспорт ионов через биологические мембраны
trotted.narod.ru