Расчет молярных веществ, температуры кристаллизации и кипения растворов неэлектролитов. Эфира молярная масса
помогите решить задачи по химии (органика)
1. Ответ: 8 линейных (нециклических) изомерных аминов. . Ch3=CH-Ch3Ch3-Nh3 Ch4-CH=CH-Ch3-Nh3 Ch4Ch3CH=CH-Nh3 (Ch4)2C=CH-Nh3 Ch4-CH=CH-NH-Ch4 СН2=СH-NH-Ch3Ch4 Ch4-NH-Ch3-CH=Ch3 Сh3=CH-N(Ch4)2 Возможны еще и циклические: пирролидин С4Н8NH, или циклопропилметиламин С3Н6СН2Nh3. 2. Поскольку в третичном амине содержится один атом азота, то молярная масса третичного амина будет равна 14/0,1918 = 73 г/моль Масса углерода равна 73*0,6575 = 48 ( что соответствует четырем атомам углерода) , а водорода 72 * 0,1507 = 11 Таким образом суммараная формула амина С4h21N, это диметилэтиламин 3. Определите формулу сложного эфира аминоуксусной кислоты, массовая доля кислорода в котором составляет 36%. В сложном эфире аминоуксусной ксилоты два атома кислорода, их масса равна 2, значит молярная масса эфира равна 89. Молярная масса фрагмента Nh3-СН2-СОО равна 74, значит на алкильный остаток приходится 89-74 = 15, то есть это - метил Ответ: Nh3-СН2-СООСН3 4 Первичный амин образует с бромоводородом соль, массовая доля брома в которой составляет 71,4%. Определите формулу амина и назовите его. Точно так же по доле брома определяем молярную массу гидробромида: 80/0,714= 112, Отнимая молярную массу HBr (81) получаем молярную массу амина 31. Это - метиламин Сh4Nh3
А что это у Вас курсовая работа такая маленькая?
touch.otvet.mail.ru
Задача Предложите формулу спирта, молярная масса которого в 2 раза превышает молярную массу самого лёгкого углеводорода (1 балл)
Решение:Щелочной гидролиз сложных эфиров, образованных спиртами, происходит в соответствии с уравнением:
R-CO-O-R1 + NaOH → RCOONa + R1OH
«Б»
Если для реакции гидролиза требуется вдвое большее количество щелочи, то это значит, что R1OH реагирует со щелочью, т.е. R1OH – фенол:
R2-CO-O-С6Н4-R3 + 2NaOH → R2COONa + NaO-С6Н4-R3 + h3O
«А»
Следовательно, вещество «Б» - сложный эфир спирта, а вещество «А» - сложный эфир фенола.
Найдем молярную массу сложного эфира «А» из второго уравнения:
ν(NaOH) = CV = 0,075 л ∙0,1 М = 0,075 моль
ν(R2-CO-O-С6Н4-R3) = ν(NaOH)/2 = 0,00375 моль
M(R2-CO-O-С6Н4-R3) = m/ ν = 0,563/0,00375 = 150 г/моль
M(R2+R3)= 150 – M(-CO-O-С6Н4-) = 30 г/моль
Возможны три варианта распределения 30 г/моль между радикалами R2 и R3:
1) R2 = Н, R3 = С2Н5 – этот вариант не подходит, т.к. эфир не даёт реакции серебряного зеркала и, следовательно, не является эфиром муравьиной кислоты.
2) R2 = СН3, R3 = СН3 – в этом варианте оба заместителя в бензольном кольце -СН3-СО-О- и СН3- -орто-пара-ориентанты. По условию задачи известно, что эфир «А» легко нитруется с образованием двух изомерных мононитропроизводных , значит, условию задачи удовлетворяет сложный эфир уксусной кислоты и пара-метилфенола: СН3-CO-O-С6Н4-СН3
3) R2 = С2Н5, R3 = Н – в этом варианте вещество «А» – сложный эфир пропионовой кислоты и фенола: С2Н5СООС6Н5; при нитровании этого эфира преимущественно образуются только два мононитропроизводных, в которых нитрогруппы находятся в в орто- и пара- положениях по отношению к группе С2Н5СОО-.
В сложном эфире «Б» бензольное кольцо находится со стороны кислоты, поэтому эфир может быть образован бензойной кислотой и этанолом: С6Н5-СО-О-С2Н5 или о-, м-, п- метилбензойной кислотой и метанолом СН3- С6Н4- СО-О-СН3,
бензиловым спиртом и уксусной кислотой. С6Н5-СН2-О-CO-СН3
.
- При полном гидролизе смеси дипептидов в растворе обнаружены аланин, лизин, аспарагиновая и глутаминовая кислоты. Образец одного из дипептидов разделили на 3 равные по массе части. Одну часть обработали избытком гидрокарбоната калия, при этом выделилось 6,72 л газа (н.у.). Вторая часть вступила в реакцию солеобразования с 200 мл 3М раствора бромоводородной кислоты. При полном гидролизе третьей части масса продуктов оказалась на 5,4 г больше массы дипептида. Установите формулу дипептида. (МГУ - 2000) (5 баллов)
1) Определим количество вещества дипептида, которое равно количеству воды
ν(дипептида) = ν(h3O) = 5,4 г/18г/моль = 0,3 моль;
2) Определим количество карбоксильных групп, которое равно количеству углекислого газа: ν(-COOH) = n(CO2) = 6,72 л /22,4 л/моль = 0,3 моль;
3) Определим количество аминогрупп, которое равно количеству бромоводорода: ν(-Nh3) = n(HBr) = 200∙3/1000 = 0,6 моль.
Из расчетов видно, что аминогрупп в два раза больше , чем карбоксильных групп в дипептиде.
Таким образом, дипептид имеет 1 свободную карбоксильную группу в молекуле и две аминогруппы => дипептид состоит из остатка аланина и лизина (Ala-Lys или Lys-Ala).
- При реакции образца углевода с избытком уксусного ангидрида в пиридине образовалось 7,38 г сложного эфира и 5,4 г уксусной кислоты. Такой же образец углевода при нагревании с избытком аммиачного раствора оксида серебра дает 6,48 г осадка. Установите формулу углевода. (МГУ - 1999) (5 баллов)
1) Из реакции с аммиачным раствором оксида серебра:
CxHyOz + 2[Ag(Nh4)2]ОН → CxHy-1Oz+1Nh5 + 2Ag + 2h3O+ 3Nh4
следует, что углевод является альдозой и что его количество равно:
ν(CxHyOz) = ν(Ag)/2 = (6,48/108)/2 = 0,03 моль.
2) Реакция этерификации проходит с участием всех гидроксильных групп углевода по уравнению:
CxHyOz + m (Ch4CO)2O → CxHyOz(C2h3O)m + m Ch4COOH
Количество вещества уксусной кислоты равно: ν(Ch4COOH) = 5,40/60 = 0,09 моль.
Поскольку количество вещества исходного углевода равно 0,03 моль, число гидроксильных групп в молекуле углевода равно 0,09/0,03 = 3.
3) Молярная масса сложного эфира равна: M(CxHyOz(C2h3O)m) = 7,38 г/0,03 моль = 246 г/моль,
M(CxHyOz) = 246– 3M(C2h3O) = 120 г/моль.
Этой молярной массе соответствует углевод – C4H8O4 – альдотетроза
.
moyamatem.ru
Молярная масса растворенного вещества | 168
Молярная масса растворенного вещества
Задание 168. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465°С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 342 г/молы.Решение: Температура кристаллизации чистой воды равна 0oС, следовательно, = 0 - (-0,465) = +0,4650. Масса неэлектролита (m1), приходящегося на 1000 г растворителя (воды) равна:
= 0 - (-0,465) = +0,4650. Масса неэлектролита (m1), приходящегося на 1000 г растворителя (воды) равна:
m1 = (25,65 . 1000)/300 = 85,5 г.
Тогда с расчётом того, что неэлектролит растворён в 1000 г воды, получим:
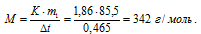
Ответ: 342 г/моль.
Криоскопическая константа
Задание 169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65°С. Ответ: 3,9°С.Решение:Понижение температуры кристаллизации равно:  = 16,65 – 15,718 = 0,9320. М(С14Н10) = 178 г/моль. криоскопическую константу уксусной кислоты вычислим, используя уравнение Рауля:
= 16,65 – 15,718 = 0,9320. М(С14Н10) = 178 г/моль. криоскопическую константу уксусной кислоты вычислим, используя уравнение Рауля:

К – криоскопическая константа; m1– масса растворённого вещества; m2 – масса растворителя; М – молярная масса растворённого вещества;  – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
Отсюда
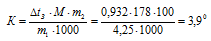
Ответ: 3,9°С.
Расчет количества атомов серы
Задание 170. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81°С. Сколько атомов содержит молекула серы в этом растворе. Эбулиоскопическая константа бензола 57°С. Ответ: 8.Решение:Для расчета используем уравнение:

Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г;М – молярная масса растворённого вещества;  – повышение температуры кипения раствора.
– повышение температуры кипения раствора.
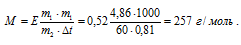
Для нахождения формулы серы нужно полученную молярную массу разделить на атомную массу серы (32,066 г/моль):
n = M/Ar(S) = 257/32,066 = 8 атомов
Формула вещества имеет вид - S8.
Ответ: 8 атомов серы.
Молярная масса растворенного вещества
Задание 171. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0,558°С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86 . Ответ: 442 г/моль.Решение:Температура кристаллизации чистой воды равна 00С, следовательно,  = 0 - (-0,558) = +0,5580. Для расчета используем уравнение:
= 0 - (-0,558) = +0,5580. Для расчета используем уравнение:

К – криоскопическая константа; m1 – масса растворённого вещества; m2 – масса растворителя; М – молярная масса растворённого вещества;  – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
Тогда
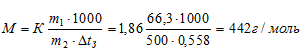
Ответ: 442 г/моль.
Расчет массы анилина в растворе
Задание 172.Какую массу анилина C6H5Nh3 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбулиоскопическая константа этилового эфира 2,12о. Ответ: 1,16 г.Решение:Для расчета используем уравнение:

Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М(C6H5Nh3) = 93 г/моль];  – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
Отсюда
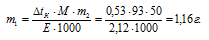
Ответ: 1,16 г.
Температура кристаллизации раствора
Задание 173. Вычислите температуру кристаллизации 2%ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1,860. Ответ: -0,825oС.Решение:Для расчета понижения температуры кристаллизации этилового спирта используем уравнение:
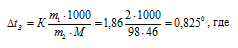
К – криоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М(С2Н5ОН) = 46 г/моль];  – понижение температуры замерзания раствора.Вода кристаллизуется при 0оС, следовательно, температура кристаллизации раствора равна:
– понижение температуры замерзания раствора.Вода кристаллизуется при 0оС, следовательно, температура кристаллизации раствора равна:
 = 0 - 0,825 = -0,825оС.
= 0 - 0,825 = -0,825оС.
Ответ: -0,825оС.
Рассчет массы мочевины в растворе
Задание 174.Сколько граммов мочевины (Nh3)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86°. Ответ: 1,12 г.Решение:М((Nh3)2CO) = 60 г/моль. Для нахождения массы мочевины используем уравнение:

К – криоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М(С2Н5ОН) = 46 г/моль];  – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
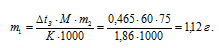
Ответ: 1,12 г.
buzani.ru
| Таблица. Молярная масса газов (г/моль = кг/кмоль) от азота до хлористого этила.
|
tehtab.ru



















