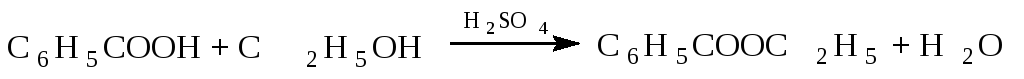Диглицидиловый эфир диоксиэтилированного резорцина для синтеза ударопрочных эпоксиполимеров. Диглицидиловый эфир
Диглицидиловые эфиры - Справочник химика 21
Образующийся хлоргидрин в присутствии щелочи нестабилен и превращается в диглицидиловый эфир [c.37]Работа 31. Получение эпоксидной смолы из дикарбоновых кислот и диглицидилового эфира [c.85]
ДГР + ДАП 2 — диглицидиловый эфир триэтиленгликоля + АП [c.17]
В таком полимерном диглицидиловом эфире имеются реакционноспособные эпоксидные группы на концах молекулярной цепи и вторичные гидроксильные группы, расположенные через определенные промежутки вдоль всей цепи. В действительности конечный продукт является результатом многих реакций, протекающих как одновременно, так и последовательно при этом образуются смеси, содержащие хлоргидринные, фенольные и диольные группы. Могут происходить, например, следующие превращения - [c.37]
Диглицидиловый эфир бутандиола-1,4, НгО Продукты раскрытия эпоксидных колец 2п(Вр4)г—НС1 25—90° С [709] [c.652]Глицидиловые эфиры дифенилолпропана. Эпоксидные полимеры. При конденсации эпихлоргидри-на или различных диэпоксидов с двухатомными фенолами, в частности с дифенилолпропаном, получаются соответствующие простые эфиры. Получение диглицидилового эфира дифенилолпропана [c.36]
Получающийся диглицидиловый эфир отличается высокой реакционной способностью и может дальше взаимодействовать с фенольными гидроксилами дифенилолпропана, что приводит к полиэфиру следующего строения [c.37]
Диглицидиловый эфир Фенолфталеин [c.85]
Методика работы. Вариант 1. В трехгорлую колбу, снабженную мешалкой и термометром, помещают 2 г (0,013 г/моль) адипиновой кислоты, 3,6 г (0,027 г/моль) диглицидилового эфира и 17 мл диоксана. Содержимое перемешивают в течение 10 мин, после чего добавляют катализатор — 0,02 г хлорида железа (1% от массы кислоты). Реакцию проводят при 90°С в течение 5 ч. [c.85]
Далее диглицидиловый эфир последовательно взаимодействует с дифенилолпропаном и эпихлоргидрином, в результате чего образуется олигомер — эпоксидная смола. [c.215]
Изучены кинетические закономерности образования сетчато го полимера в процессе реакции взаимодействия диглицидилового эфира резорцина с и-фенилендиамином, а также линейного поли мера при взаимодействии диглицидилового эфира резорцина с анилином. Предложенная кинетическая модель позволяет опи сать ход кинетической кривой от начала до конца процесса. [c.84]
Примечание. ДГР — диглицидиловый эфир резорцина ДЭГ — диглицидиловый эфир диэтиленгликоля л-ФДА — д -фенилендиамин [c.17]
Выводы, сделанные при анализе моделей сетки, получили экспериментальное подтверждение выявлено определяющее значение среднемассового размера цикла сетки для величины равновесного модуля [110] на примере реакции диглицидилового эфира резорцина с л1-фенилендиамином показано явление топологического предела реакции и его зависимость от соотношения реагентов [42]. [c.27]
Тем не менее метод Гордона был использован в ряде работ, и с его помощью описывали процессы поликонденсации адипиновой кислоты с пентаэритритом и триметилолпропаном [12], дикарбоновых кислот различной длины с пентаэритритом [52], диглицидилового эфира дифенилолпропана с алифатическими и ароматическими аминами [69, 70] [c.73]
Количественных подходов к описанию процесса формирования сетчатого полимера в условиях микрогетерогенного характера в настоящее время нет. Можно только качественно показать ее влияние. Тот факт, что в данном случае определяющим фактором является именно микрогетерогенность, подтверждается сопоставлением полученных результатов с данными по характеру процесса образования сетчатого полимера на основе другой системы, с существенно более низким уровнем светорассеяния диглицидиловый эфир диэтиленгликоля — 4,4 -диаминодифенилсульфон. [c.85]
В табл. 14 приведены данные но среднемассовым молекулярным массам, выходу золя и его функциональности в процессе конденсации мягкой системы (полимер на основе диглицидилового эфира диэтиленгликоля). [c.85]
Следует отметить, что эти эпоксидные смолы представляют собой смесь молекул различной длины (с разным значением п), в том числе они содержат и диглицидиловый эфир дифенилолпро-панола (п = 0). Последний в особенно больших количествах присутствует в низкомолекулярных (жидких) эпоксидных смолах. Поэтому для них среднее значение п меньше 1. Молекулярная масса эпоксидных смол определяется мольным соотношением эпихлоргидрин дифенилолпропан чем вуше это соотношение, тем меньше средняя молекулярная масса смолы. Так, для получения широко применяемых эпоксидных смол ЭД-16 и ЭД-20 эпихлоргидрин и дифенилолпропан берутся в мольном соотношении 2,3 1 и (5 -Ь 7) 1 соответственно. Щелочь вводится в количестве 2 моль на 1 моль дифенилолпропана. [c.215]
Описан ряд способов, в которых получение низкомолекулярных продуктов, состоящих преимущественно из чистого диглицидилового эфира дифенилолпропана, осуществляется в две стадии. На первой стадии получают дихлоргидриновый эфир дифенилолпропана, а затем проводят его дегидрохлорирование едкими щелочами " . В одном из этих способов предлагается нагревать 1 моль дифенилол-пропана с 0) моль эпихлоргидрина в присутствии 1% триэтанол-амина и 3% хлористого натрия (15%-ный водный раствор) дегидрохлорирование проводится 20%-ным водным раствором едкого натра в присутствии 0,12 моль трихлоргидринового эфира глицерина. Рекомендуется непрерывный способ получения эпоксидных полиме- [c.38]
На второй стадии (дегидрохлорирования) дихлоргидриновый эфир под действием щелочи превращается в диглицидиловый эфир [c.103]
Цель работы. 1. Получение эпоксидной смолы из адипиновой и себациновой кислот и диглицидилового эфира. [c.85]
Для изготовления специальных покрытий рекомендуется применять битумы со следующими добавками 10—20 вес.% моноглицидилового эфира и 25—60 вес. /о диглицидилового эфира (для изготовления прочных и химически стойких противокоррозионных покрытий) [c.383]
Изучены спектроскопические проявления различных видов изометрии в ряду эпоксисоединений. Установлены изомерные эффекты в инфракрасных спектрах ароматических и алициклических эпоксидов. Определены специфические полосы, по которым можно различить геометрические изомеры диглицидилового эфира гидрохинона, структурные изомеры диглицидилового эфира диоксидифенилолметана, геометрические изомеры диокиси биспентила, структурные изомеры алициклических эпоксидов, моделирующих фрагменты промышленной эпоксидной смолы УП-632. [c.68]
В 1984 г Окахара [4131 разработал способ получения бис(лариат-эфиров), заключающийся в алкилировании по Вильямсону диола Р44, синтезированного с высоким выходом из диглицидилового эфира этиленгликоля и монометилового эфира этиленгликоля [c.155]
Структурирование тонкодисперсных ПВАД осуществляется с помощью сшивающих агентов, реагирующих непосредственно с функциональными группами срполимеров ВА. Например, композиции из дисперсий сополимеров, имеющих в своем составе звенья акриловой или малеиновой кислоты и диглицидиловых эфиров MOHO-, ди- или триэтиленгликоля, образуют покрытия и пленки, приобретающие трехмерную структуру при нагреванин до 110—115°С [а. с. СССР 299513]. Указанные структурирующие агенты одновременно выполняют роль пластификаторов дисперсии. [c.62]
При взаимодействии диглицидиловых эфиров олигоэтиленгликолей с аминами образуются б с(аминометил)этиленгликоли (Р45), алкилирование которых дитозилатами в присутствии оснований дает быс(аминометил)замещенный макроциклический полиэфир Ь309 [414 [c.155]
Диглицидиловый эфир обладает некоторыми преимуществами по сравнению с другими эпоксисоединениями, так как он ил1еет высокий эпоксидный эквивалент, низкое давление паров и полностью растворим в воде. Обе эпоксидные группы имеют эквивалентную реакционную способность. [c.203]
Фторированные смолы представляют собой диглицидиловые эфиры 4,4 -ди-оксиоктафтордифенилбензола (Р1) и 1,3-бпс-(гексафтор-2-оксипропил)-бензола (Рз). Их получали из соответствующих диоксисоединений по методу Келли, Ландуа и Маршалля [5]. [c.323]
Триоксан (I), окись этилена (И), бутен-2-дион-1,4-диглицидиловый эфир (III) Сополимер BFg. 0( 4Hg)2, 85% от смеси мономеров, в циклогексане (1 80) в атмосфере N2, в присутствии 0,01% соединений, содержащих мети-лольные группы, от —50 до - -100° С, 1 11 III = 98 2 0,1 (%) [251]. См. также [252] [c.122]
В качестве примера рассмотрим процесс образования полимера на основе диглицидилового эфира резорцина и 4,4 -диаминодифенилсульфоиа [71]. Для этой системы характерен высокий уровень светорассеяния. [c.82]
В качестве примера приведем схему расчета Tg полимеров на основе диглицидиловых эфиров бисфенолов и 4,4 -диаминодифенилсульфона (4,4 -ДАДФС), структура повторяющегося звена которых имеет вид [c.214]
Специальные исследования показали, что величина КМУ слабо связана с топологической структурой полимера. Так, для системы диглицидиловый эфир резорцина (ДГР) фенилглицидиловый эфир (ФГЭ) -J- диаминопен-тан при изменении соотношения между ДГР и ФГЭ меняется плотность сетки, количество свободных концов, однако плотность упаковки меняется незначительно, проявляя тенденцию к увеличению с плотностью сетки [178, 179] (табл. 9). [c.153]
| Рис. 11. Зависимость Те полимеров на основе изомерных диглицидиловых эфиров бисфе ПОПОВ и диаминов в координатах уравнения (6 ) | 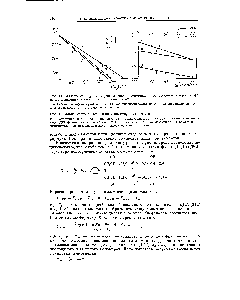 |
chem21.info
Диглицидиловый эфир , -камфорной кислотыв качестве связующего для оптически-прозрачныхматериалов
(ю"е ?ip л ффффф
ЯВ Йм l лФ- т1вв. лФ
a6n lurid. а ЬЕ, ПИС (1)736584
Союз Советски в
Социалистических
Республик
О АНИЕ
ИЗОБРЕТЕН ИЯ Ою
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (61) Дополнительное к авт. свин-ву (22) Зачвлено 22. 08. 78 (21) 2689507/23-04 с присоединением заявки ¹ (5! )М. Кл, С 07 D 303/04
С 07 С 69/74//
//С 08 L 63/00
Гасударстввнный камнтет
СССР (23) Приоритет по делам иэааретений
И OTKPblTHH
Опубликовано 30.06.81 ° Бюллетень ¹ 24
Дата о
Институт физико-органической химии и углехимии
АН Украинской ССР (7I ) Заявитель (54) ДИГЛИЦИДИЛСВЬЙ ЭФИР 0,L-КАМФОРНОЙ КИСЛОТЫ
В КАЧЕСТВЕ СВЯЗУн)П;ЕГО ДЛЯ ОПТИЧЕСКИПРОЗРАЧНЬБ МАТЕРИАЛОВ
Изобретение относится к новым химическим веществам, которые могут найти применение в качестве связу- ющих для оптически-прозрачных материалов.
Известны диглицидиловые эфиры дикарбоновых кислот, таких как фталевой, тетрагицрофталевой, метилтетрагидроф.плевой, и способ их получения (I) .
Недостатком этих соединений является то, что получить их бесцветными можно только путем перегонки в вакууме, при этом выход составляет только 10-30%.
Кроме того, известен способ получения диглицидиловых эфиров дикарбоновых кислот, заключающийся во взаимодействии карбоновых кислот или их ангидридов с эпттхл 1ргидрином в присутствии катализаторов . (третичные амины, четырехзамещенные аммониевые основания или их соли). Причем катализатор ис,пользуют в количестве О,1 — 1,0%. от веса кислоты. Полученный в результате синтеза хлоргидрпновый эфир карбоновой кислоты подвергают дегидрохлорированию основаниями с" после5 дующим выделением целевых продуктов известными методами. Этим способом получают глицидиловые эфиры алифатических, циклоалифатических или ароматических кислот с выходом 7280% при 78-96%-ном содержании эпоксидного кислорода.
Однако высокое содержание органического хлора в синтезированных соединениях (0,7-1,9%) отрицательно гро.ляет себя в изготовленных на основе глицидиловых эфиров материалах.
Попытка дополнительного дегидрирования не приводит к увеличению содержания основного вещества в целевом продукте, а лишь увеличивает молекулярный вес и вязкость, Цель изобретения — расширение ассортимента соединений, которые моТаблица 1 предлагаемый 97,0 6,12 97,3 0,45
96,5 6,19 98,0 0,40
96.,8 6,10 97,0 0,55
D,1 -Камфорная
D, 1 -Камфорная 2
D,L-Камфорная
D,L-Камфорная
Тетрагидрофталевая
Известный
Гексагидрофталевая
Терефталевая l
3 73658
= гут ""использбваться в качестве связующих"для оптически-прозрачных материалов.
Это достигается свойствами диглицидилового эфира D, L-камфорной кислоты, который получают путем взаимодействия 0 L-камфорной кислоты с эпи) хлоргидрином в присутствии катализатора.
Исходные реагенты — О, 1 -камфор- 1о кую кислоту, эпихлоргидрин и катализатор берут в соотношении 1:6:0,01.
Реакцию конденсации проводят при
70-80 С, предпочтительно при 65ОС.
В качестве катализаторов исполь— зуют амины, четвертичные аммониевые основания, их соли и соли щелочных металлов (лучше триметиламин t. îëÿíîкислый 63Х-ный). Для удаления побочных продуктов из целевого вещества 2О реакционную смесь обрабатывают растворами едких щелочей (2-10%) при комнатной температуре.
Процесс дегидрохлорирования ведут
"" " "стехиометрическим количеством 45%-но- zs го раствора едкого натра при 20-45ОС.
Целевой продукт выделяют известными методами. Выход 97%.
Полученный диглицидиловый эфир циклоалифатической дикарбоновой кис- 30 лоты имеет слабо-желтый оттенок, 1 от которого легко избавляются следующим образом.
4 4
Продукт растворяют в легкокипяuieM растворителе (бензоле, этилаце— тате и пр.) и добавляют активированный уголь. После удаления растворителя и активированного угля получают обесцвеченный продукт, из которого можно изготовлять оптически-прозрачные материалы, Пример. 200 г 0 L-камфорной кислоты (1,0N) 543 r эпихлбргидрина (6,0 М), 2,5 r бензилтриэтиламмонийхлорида и 2 мл воды перемешивают и нагревают до 10QOC. В реакционную массу прибавляют по каплям в течение
2 ч 100 г NaOH в виде 50Х-ного раствора, одновременно отгоняя азеотроп эпихлоргидрин-вода, и прикапывая эпихлоргидрин при постоянном объеме реакционной массы. Процессы проводят в течение 3 ч. Выпавший осадок отфильтровывают, фильтрат упаривают в вакууме при 40-50ОС, остаток растворяют в 100 мл бензола, при 0 С промывают 2%-ным раствором NaOH u трижды водой, удаляют растворитель, получают 314,5 г (97% от теории) низковязкого продукта. Эпоксидное число 26,3 (97,3% от теории), С1
0,45%, 0,1% летучих веществ.
Сравнительные характеристики диглицидиловых эфиров по предлагаемому и известному способам приведены в табл 1.
97 0 6,19 98,0 0,35
94,1 6,61 93,2 1,1
96,0 6,23, 88,5 1,80
89,0 6,4 90i5 1,50
736584
Продолжение табл. l
Тетрагидротерефталевая
95,0 6,48 91,0 1,68
Гексагидротерефталевая
80,5 6,51 91,5 0,70
Х
Катализаторы . 1- бензилтриэтиламмонийхлорид, 2 — бензилтриметиламмонийхлорид, 3 — триэтиламин, 4 — триметиламин солянокислый.
Составы композиций, полученных на предлагаемого диглицидилового эфиоснове известного диглицидилового ра О, L-камфорной кислоты, эфира метилтетрафталевой кислоты и вес.ч.:
100
0,15
30 ная методом термогравиметрического анализа, приведены в табл. 2, Механическая прочность композиций и термостабильность, определенТаблица 2
Потеря в весе, Х при температуре
200оС
0
220ОС
250оС
0
2750С
300оС
Предел проч- ности при растяжении, кг/см
160 340 360 320
Предлагаемая
Диглицидиловый эфир О,L-камфорной кислоты 100
Изо-метилтетрагидрофталевый ангидрид 77-91,6
2,4,6-трис-диметил-аминометил-фенол 0,15
Известная
Диглицидиловый эфир метилтетра гидрофталевой кис" лоты
Изо-метилтетрагидрофталевый ангидрид
2,4,6-трис-диметил-аминометил-фенол
» . = фЬ Ч4».. .: - . .".-
Формула изобретения
Диглицидиловый эфир Р,L-камфорной кислоты в качестве связующего для оптически - прозрачных материалов. Источники информации, принятые во внимание при экспертизе
1, Патент 1Чвейцарии М - 480324, кл. С 07 0 1/18, 1969.
С: 61,01-61,21
Найдено, %
Вычислено:
Найдено, % (С,Н,Р,) .
Вычислено:
61,52.
Н: 7065-7,47
7.74.
Составитель В.Жестков
Техред С. Мигунова
Редактор Т.Колодцева
Корректор М.Шаро««и
Заказ 4505
17 Тираж 443 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
s фф» "®
Еф»Е»»» l4 ффТ (Ъф» м»Я»«»ф. «
° W м меЧ@йбь
Композиции на бснове диглйцид»««- 11К-спектры 1 1730 см, фо 1120, лового эфира D, L-камфорной кислоты 1270 см, 1с н 2970, 2980 см, превосходят известную композицию К 910 см -, % пропускания 10 мм по термостабильности и механической лри 3 360 нм после очистки активи- пр6чности. рованным углем 86-90%.
Получаемый продукт представляет Благодаря высокому коэфф«п«кенту собой практически чистый мономер— светопропускания целевого продукта диглицидиловый эфир Dp-камфорно ки в видимой области его можно испольлоты, СтрУктурная «««ормула показа . зовать для получения оптически прозрач элементным и спектральным анализом 10 ных материалов, а отсутствие примесей органи «еского хлора и высокое содержание (92-97% от теории) кислорода сообщает материалам, изготовленным на основе предложенных диглициди15 ловых эфиров, высокую -прбчность и длительйость в эксплуатации.




www.findpatent.ru
Диглицидиловый эфир дифенилолпропана - Справочник химика 21
Тем не менее метод Гордона был использован в ряде работ, и с его помощью описывали процессы поликонденсации адипиновой кислоты с пентаэритритом и триметилолпропаном [12], дикарбоновых кислот различной длины с пентаэритритом [52], диглицидилового эфира дифенилолпропана с алифатическими и ароматическими аминами [69, 70] [c.73] Эти компоненты, взятые в мольном соотношении- 1 2, образуют диглицидиловый эфир дифенилолпропана [c.128]Ввиду летучести низкомолекулярных аминов, в частности гексаметилендиамина, и токсичности их паров целесообразнее отверждение эпоксидных смол производить значительно менее летучими аддуктами диглицидилового эфира дифенилолпропана или других низкомолекулярных эпоксидных смол. Наличие в ад-дукте свободных аминогрупп обусловливает его способность отверждать эпоксидные смолы. [c.153]
При отверждении комплексом ВРз количество прореагировавших эпоксидных групп диглицидилового эфира дифенилолпропана и связанное с этим образование простых эфирных связей и возникновение гидроксильных групп через 30 мин после начала реакции составляет только 58% (рис. 8). Вполне вероятно, что это вызвано повышением вязкости композиции и началом процесса [c.50]
Ниже приведены показатели некоторых свойств сетчатого полимера на основе диглицидилового эфира дифенилолпропана и л-фенилендиамина [c.501]
Глицидиловые эфиры дифенилолпропана. Эпоксидные полимеры. При конденсации эпихлоргидри-на или различных диэпоксидов с двухатомными фенолами, в частности с дифенилолпропаном, получаются соответствующие простые эфиры. Получение диглицидилового эфира дифенилолпропана [c.36]
Описан ряд способов, в которых получение низкомолекулярных продуктов, состоящих преимущественно из чистого диглицидилового эфира дифенилолпропана, осуществляется в две стадии. На первой стадии получают дихлоргидриновый эфир дифенилолпропана, а затем проводят его дегидрохлорирование едкими щелочами " . В одном из этих способов предлагается нагревать 1 моль дифенилол-пропана с 0) моль эпихлоргидрина в присутствии 1% триэтанол-амина и 3% хлористого натрия (15%-ный водный раствор) дегидрохлорирование проводится 20%-ным водным раствором едкого натра в присутствии 0,12 моль трихлоргидринового эфира глицерина. Рекомендуется непрерывный способ получения эпоксидных полиме- [c.38]
Из опробованных эпоксидных связующих наиболее прочным и деформационно устойчивым при —269 °С оказался продукт взаимодействия диглицидилового эфира дифенилолпропана (бисфе-нол А или Ер1со1 828) и отвердителя МЫА (5-метилэндометилен-1,2,3,4-тетрагидрофталевый ангидрид) [113]. [c.163]
Ниже представлены данные о совместном влиянии двух наполнителей на свойства клея на эпоксидной смоле Эпон 828 (жидкая смола на основе диглицидилового эфира дифенилолпропана), отвержденной диангидридом 3, 3, 4, 4 -бензофенон-тетракарбоновой кислоты (массовое соотношение 10 6) этим клеем склеивали образцы из алюминиевого сплава, поверхность которых была подвергнута травлению в кислой ванне [140]. [c.104]
Существенным недостатком низкомолекулярных алифатических и ароматических аминов является токрдчнпсть их паров. Этот недостаток удается устранить путем применения так называемых ад-дуктов, получаемых модифицированием аминов диглицидиловым эфиром дифенилолпропана или другими низкомолекулярными эпоксидными смолами Соотношение компонентов берется с избыткам амина для того, чтобы получаемые аддукты имели свобод- [c.134]
Испытания клеевых соединений металлов на клеях на основе новолачных эпоксидных смол с триэтилентетр-амином в качестве отвердителя, с асбестовым наполнителем и без него при температурах от —55 до 150°С показали, что клей ВХ-401, состоящий из 50 вес. ч. эпоксидной новолачной смолы (DEN 438), 50 вес. ч. диглицидилового эфира дифенилолпропана (DER 332) и асбестового наполнителя, образует клеевые соединения, прочность которых при температурах от —55 до + 120°С равна 140 кгс/см (после отверждения при комнатной температуре клей дополнительно отверждается при 74 °С). Предел прочности при сдвиге клея ВХ-402/ТЕТА с асбестовым наполнителем (после отверждения при комнатной температуре) составляет 105 кгс/сж2 при 150 °С и около 35 /сгс/сж при 180 °С. При дополнительном отверждении в течение 4 ч при 74 °С предел прочности при сдвиге клеевых соединений на клее ВХ-402/ТЕТА может быть повышен до 130 кгс1см , [c.137]Диглицидиловый эфир дифенилолпропана имеет молекулярную массу 340 и может рассматриваться и как простейший эпоксид, и как мономер для получения эпоксиолигомеров. [c.265]
ЯМРмеханизма отверждения эпоксидных смол. По спектру ПМР было установлено [157], что на первой стадии реакции фенилглицидилового эфира с пиперидином образуется третичный амин (подробно об этом см. в разд 1.2.4). Этот вывод подтвержден [158] изучением системы диглицидиловый эфир дифенилолпропана — пиперидин методом ЯМР С. [c.73]
На первой стадии реакции диглицидиловых эфиров с аминами образуется линейный плавкий и растворимый полимер, на второй стадии — рост цепей прекращается и происходит их поперечное соединение в результате взаимодействия оставщихся эпоксидных групп со вторичными водородными атомами аминогрупп. Гелеобразование наступает после того, как в реакцию вовлекается 55—60% водородных атомов аминогрупп. Полимер, образующийся на этой стадии, еще пластичен и способен набухать в органических растворителях. По мере дальнейшего вступления в реакцию оставшихся атомов водорода аминогрупп, полимер утрачивает пластичность и его способность к набуханию резко снижается. Взаимодействие прекращается как только температура стеклования полимера превысит температуру, при которой проводится реакция. Если температуру реакции поддерживать несколько выше температуры стеклования образующегося полимера, то можно достигнуть полного использования аминных и эпоксидных групп. Анализ плотности полученных таким методом полимерных сеток показывает, что теоретически рассчитанная длина эффективных цепей практически совпадает с экспериментально установленной. Длина эффективных цепей полимерных сеток зависит и от соотношения диэфира и диамина. Так, при эквимолярном соотношении диглицидилового эфира дифенилолпропана [c.500]
Известен способ модификации эпоксидных олигомеров, заключающийся в изменении их вязкоупругих свойств непосредственно на склеиваемых поверхностях в процессе отверждения. Для этого используют диглицидиловые эфиры дифенилолпропана, способные в неотвержденном состоянии образовывать с модификатором — эластифицирующим полимером — гомогенную дисперсию. В ходе отверждения растворимость изменяется и начинается осаждение модификатора в виде равномерно распределенной фазы с размерами частиц 4000 и 400 А. Эта фаза и обеспечивает высокую прочность и эластичность клея. Клеевые соединения на клее такого типа (PL-717, фирма Goodri h ) имеют разрушающее напряжение при сдвиге при 20 °С 37—47, а при 80 °С 22—29 МПа, прочность при отдире Т-образного образца при 20 °С составляет 7,45 кН/м, а при отдире барабаном при 20 и 80 °С — 430 Н-м/м [45]. [c.34]
chem21.info
Диглицидиловый эфир бисфенола - Справочник химика 21
Сополимер диглицидиловый эфир бисфенола А — сополимер бутадиен — акрилонитрил Сополимер стирол — бутадиен — стирол [c.289] Эпоксидная смола на основе диглицидилового эфира бисфенола А [74, 274, 394, 811] [c.417]Типичный пример, иллюстрирующий зависимость /С и Со от содержания отвердителя ф, показан на рис. 2.13 для системы диглицидиловый эфир бисфенола А — дициандиамид (отверди-тель). Как видно, зависимости К и Со от ф антибатны, причем при достаточно высоком содержании отвердителя они вырождаются, достигая постоянных значений. [c.46]
Сополимер диглицидилового эфира бисфенола А с пиперидином [c.583]
В США производство диглицидилового эфира бисфенола А для промышленных нужд в период с 1948 по 1954 г. ежегодно увеличивалось примерно на 9 тыс. т в последующие годы наблюдается дальнейшее увеличение производства в 1957 г. ежегодный прирост составил около 13,6 тыс. г, а в период с 1957 по 1965 г.— свыше 49,8 тыс. т. В 1963 г. рынок США,был заполнен смолами на основе диглицидилового эфира бисфенола А следующих применений [c.4]
Большинство производимых ранее эпоксидных смол составляли твердые смолы. Однако в 1960 г. производство жидкого диглицидилового эфира бисфенола А по своему объему не уступало производству твердого [Л. 1-28]. [c.6]
Диглицидиловый эфир бисфенол-гексафтор [c.23]
Зависимость реакционной способности диглицидилового эфира бисфенола А от основности третичного амина [Л. 3-9] [c.27]
В качестве примера приведем схему расчета Tg полимеров на основе диглицидиловых эфиров бисфенолов и 4,4 -диаминодифенилсульфона (4,4 -ДАДФС), структура повторяющегося звена которых имеет вид [c.214]
Патент США, № 3975322, 1975 г. Диглицидиловый эфир дифенола, например, диглицидиловый эфир бисфенола А, при взаимодействии с бисфенолом 5 образует высокополимерную эпоксидную смолу. Эта высокомолекулярная смола затем при взаимодействии с жирной кислотой, полученной из вьi ыxaющeгo масла, например, льняного, образует эфир. Образующаяся эпоксиэфирная смола с некоторыми растворителями используется как быстро сохнущее покрытие. Покрытие может использоваться и как грунтовка. [c.116]Синтез полиоксиэфира с молекулярным весом 43 ООО. В реакционный сосуд, содержащий метилэтилкетон, вводят бисфенол А почти 100%-ной степени чистоты, диглицидиловый эфир бисфенола А такой же чистоты, 60%-ный водный раствор бензилтриметиламмонийоксида в мольном соотношении 1,0 1,0 0,02. Такая смесь содержит 67 вес.% реакционноспособных веществ. Раствор при перемешивании нагревают до кипения и выдерживают при этой температуре в течение 13 ч. Затем добавляют хлороформ, доводя концентрацию реагентов (включая полимер) до 57 вес.%. После 28 ч выдержки реакционной смеси, считая от начала реакции, добавляют еще некоторое количество хлороформа и доводят концентрацию реагентов до 50 вес.%. Спустя 57 ч после начала реакции раствор охлаждают, добавляют равный объем хлороформа и полученный раствор дважды промывают водой, количество которой равно объему раствора полимера. Фазу, содержащую полимер, прогревают в течение 6 в вакуум-шкафу при 160 °С и 50 мм рт. ст. [c.27]
Полимеркаптаны получают также обработкой полигалогенсодержащих или эпоксидных полимеров гидросульфидом натрия [62] или сероводородом. Например, при взаимодействии диглицидилового эфира бисфенола А с сероводородом получают аддукт с высоким содержанием Н8-групп, пригодный для использования в отверждающихся композициях и герметиках. [c.27]
При помощи импульсной спектроскопии ЯМР изучена [70] связь времени релаксации с молекулярным движением для неструктурированного диглицидилового эфира бисфенола А и эфира, обработанного 4,4 -метилендианилином [71, 72], а также исследован сам процесс структурирования. В работе [73] изучено влияние хелатов европия и празеодима на спектр ЯМР глици-дилового эфира бисфенола А. Авторы наблюдали больший химический сдвиг для протонов, присоединенных к эпоксидному кольцу, чем для протонов экзоциклической ОСНг-группы (в растворе тетрахлорида углерода). Добавление грег-бутилового спирта, образующего комплексы преимущественно с хелатами, приводило к обращению спектров ЯМР. [c.469]
Состав эпоксидных смол, армированных полиамидными волокнами, определяли по относительной интенсивности пиков при 1660 M- (волокна) и 1042 см (смола) [509]. Из рассмотрения ИК-спектров продуктов реакции глицидилфенилового эфира и диглицидилового эфира бисфенола А со вторичными спиртами можно сделать вывод, что образование эпоксидных поперечных связей происходит в результате взаимодействия между вторичными спиртовыми группами, образующимися при расщеплении глицидилового кольца, и эпоксидными группами исходного материала [510]. Фотодеструкцию отвержденных эпоксидных олигомеров исследовали [511] методом ИК-спектроскопии пленок толщиной 20—30 мкм. [c.534]
Рассмотрим твердые эпоксидные смолы. Основная область применения смол на основе твердого диглицидилового эфира бисфенола А — покрытия, наносимые из раствора. Смолы с более высоким молекулярным весом модифицируются соответствующими высыхающими маслами или метилолсодержащими смолами. Структурное строение эпоксидных смол придает им эластичность, устойчивость к истиранию и химостойкость. Поперечное сшивание твердых смол среднего молекулярного веса может быть достигнуто в результате гомо-или гетерополимеризации. Таким способом могут быть получены пленки, отверждающиеся при комнатной температуре, которые по своим свойствам не отличаются 15ЛИ превосходят пленки большинства лаков горячей сушки. [c.7]
Как правило, вязкость замещенного продукта ниже вязкости незамещенного продукта, одиако уменьшение вязкости далеко не всегда прямо пропорционально длине полимерной цепи заместителя (рис. 2-7), точно так же как и яе все заместители снижают вязкость. Например, вязкость дициглидилового эфира тетрабром-бисфенола А составляет около 98 ООО спз при 60 °С вязкость же незамещенного продукта (смола той же функциональности) составляет около 8 700 спз при той же температуре диглицидиловый эфир тетрахлорбис-фенола А размягчается при 35 °С, в то время как вязкость жидкого незамещенного диглицидилового эфира бисфенола А составляет 40 ООО спз при комнатной температуре. [c.14]
ЯВЛЯЮТСЯ представителями половины молекулы диглицидилового эфира бисфенола А. Каждая такая половина может свободно вступать в реакцию, даже при условии наличия ее в смоле продукты реакции, не имеющие поперечных сшивок, растворимы и могут подвергаться химическому анализу. Подобным же образом дитолиловый эфир глицерина [c.26]
Была исследована возможность применения полиме-тилендиаминов (h3N h3Nh3) линейного строения с п, изменяющимся от О до 6, в качестве отвердителей диглицидилового эфира бисфенола А. [c.72]Имины подобного типа нащли широкое применение в композициях, характеризующихся продолжительной жизнеспособностью и отверждающихся при комнатной температуре эти композиции используются в качестве покровных лаков без растворителя. Наиболее часто отвердители этого типа применяются со смолами на основе диглицидилового эфира бисфенола А, при этом количество вводимого отвердителя составляет около 25—30 частей на 100 частей смолы. Подобные смеси обладают текучестью, могут храниться примерно 8 ч, сохраняя при этом способность отверждаться в тонких пленках в течение нескольких часов при комнатной температуре. Толщина отвержденной лаковой пленки, как правило, составляет 0,1—0,2 мм, что значительно пре-вьпнает толщину однослойной пленки, полученной из смолы с растворителями. [c.87]
chem21.info
Диглицидиловый эфир диоксиэтилированного резорцина для синтеза ударопрочных эпоксиполимеров
она з " Й=ЙЙ
ОПИСА
ИЗОБРЕТЕНИЯ
Сеооз Советскик
Сецрелистическик
Реса блик
К АВТОРСКОМУ СВИ ЕТИЛЬСТВУ (61) Дополнительное к авт. свид-ву (22) Заявлено 04.01.76(21) 2307395/23-04 (5!)М. Кл. с присоединением заявки Йо
С 07 D 303/30
Государственный комитет
СССР оо делам изобретений н открытий (23) Приоритет
Опубликовано 051279. Бюллетень Но 45 (53) УДК 547. 27 (088.8) Дата оаубликовання описания
t (72) Авторы
ИЗОбрбтВНИя A. Н.Сорокина, (0.М.Парамонов и В.П.Сорокнн (71) Заявитель
ДИГЛИЦИДИЛОВЫЙ ЭФИР
ДИОКСИЭТИЛИРОВАННОГО РЕЭОРЦИНА ДЛЯ СИЧТЕЭА
УДАРОПРОЧНЫХ ЭПОК СИПОЛИМЕРОВ (54) б .
СН ОАЭИ СИ вЂ” СИ
Изобретение относи тс я к диглицидиловому эфиру диоксиэтилированного резорцина, который может найти применение для получения эпоксидных компаундов.
В литературе известно применение диглицидилового эфира резорцина для получения эпоксидных компаундов (1), однако последние не обладают достаточно высокими механическими свойствами.
Целью изобретения является расширение ассортимента диглицидиловых эфиров, которые обладают улучшенными свойствами по сравнению с известными и могут быть использованы для получения эпоксидных компаундов.. Диглицидиловый эфир диоксиэтилированного резорцина формулы
Г
0СН СН,ОСБ2 н — 112 получают конденсацией диоксиэтилированного резорцина с эпихлоргидрином, взятым в избытке, при нагревании до 65-75 С в присутствии щепочи с выходом до 94%.
Исходный диоксиэтилированный резорцин получают взаимодействием резорцина с этиленхлоргидрином или окисью этилена в присутствии оснований.
Целевой диглицидиловый эфир пред" ставляет собой низковязкую жидкость (500 спз при 25ОС) желтого цвета, т.кип. 218-220 C/5 мм, содержащую
26,9% (по теории 27,7Ъ), эпоксидной, группы.
В ИК-спектре соединения не имеется полос поглощения при 36503400 см ", что свидетельствует об отсутствии гидроксильных групп.
Пример 1. В смесь 110 г реэорцина, 161 г этиленхлоргидрина, 150 мл изопропилового спирта при
О
65 С в течение 2 ч прибавляют по каплям 200 r 40%-ного раствора едкого натра, нагревают до 70-75 С и выдерживают 30 мин.
После фильтрации и удаления в вакууме растворителя получают диоксиэтилированный резорцин с количествен ным выходом.
702017
1650-1710
Прочность при сжатии, кгс/см
1675
1630-1727
850-910 ббб б 75-1002
Прочность при растяжении, кгс/см
2. Прочность при изгибе, кгс/см
1500-1700
1390
1310-1330
15-18
29 б
19,1-36,2
Относительное удлинение, кгс см/см ..
4,9-6,5 б
0«a4H 0«>4m-ÑÍ
Формула изобретения
ЦНИИПИ Заказ 7534/26 Тираж 513 Подписное
Филиал ППП ™Патент, г. Ужгород, ул. Проектная, 4
Полученный продукт растворяют в
925 r эпихлоргидрина, нагревают до
65-70 С и десятью равными порциями вводят 32 г" raepgoro едкого натра в течение 2 ч, выдерживают 20 мин " "6 вакбууме, создаваемом водоструйным
="йасосом, бтгоняют воду в смеси с
- -эпйхлоргидрином, соль отделяют на фильтре.
В обезвоженную смесь вводят эпихлоргидрин взамен отогнанного и подают следующие порции щелочи .(24 г восемью порциями за 1,5 ч), обезвоживают и фильтруют, как указа нб йИйе; и, наконец, восемью порциями подают 24 r твердой щелочи в течение 2 ч. После фильтрации и обез.-воживания раствор упаривают в вакууме, создаваемом водоструйным насо. сом, при 100-105 C и получают
288,8 r (94%) низковязкой жидкости (500 спз при 25 С), содержащей
26,9% (по теории 27,7%) эпоксидной группы и 0,15% общего хлора.
После перегонки в вакууме при
218-220 С/5 мм получают диглициди Удельйая ударная вязкость, кгс - см/см
Как видно из приведенных данных, эпоксиполимеры на основе диглицидилового эфира диоксиэтилированного резорцина обладают более высокими механическими свойствами, чем эпокси полимеры на основе смолы УП-637.
Диглицидиловый эфир диоксиэтили ованного резорцина формулы ловый эфир диоксиэтилированного резорцина в виде бесцветной жидкости," и> 1,5225; d 4 1,2056.
Найдено, В: С 62, 0; 62, 15; rf 7, 0;
7, 1 4; э пок сиди ые группы 2 7, 6-2 7, 7;
МНр 78, 68;
С46 Н22О
Вычислено,Ъ: С 61,93; rI 7,15; эпоксидные группы 27,78; MR 77,95.
В тонком слое окиси алюминия да1р ет одно пятно
В ИК-спектре при 3650-3400 см поглощение отсутствует.
Пример 2. 100 r диглицидилового эфира, полученного в примере 1, смешивают при 70-80 С с 16,33 r м-фенилендиамина.
Композицию помещают в стандартные металлические формы и отверждают при 150 С в течение 8 ч.
В таблице приведены характеристики эпоксиполимеров, полученных на основе диглицидилового эфира диоксиэтилированного резорцина (эпоксиполимер ) и смолы УП-637 (эпоксиполимер 11 ). гО,, 0СН,СН 0СН 0Н-СН . для синтеза ударопрочных эпоксиполи55 меров ° .
Источники информации, принятые во внимание при экспертизе
1. Справочник по пластмассам под .редакцией Катаева В.М. и др. M. лимия, 1975, с. 215,


www.findpatent.ru
Диглицидиловый эфир - бисфенол - Большая Энциклопедия Нефти и Газа, статья, страница 1
Диглицидиловый эфир - бисфенол
Cтраница 1
Диглицидиловый эфир бисфенола - А, ангидрид метилнадиковой кислоты. [1]
Диглицидиловый эфир бисфенола - А, т-фенилендиамин. [2]
Патент США, № 3975322, 197& г. Диглицидиловый эфир дифенола, например, диглицидиловый эфир бисфенола А, при взаимодействии с бисфенолом S образует высокополимерную эпоксидную смолу. Эта высокомолекулярная смола затем при взаимодействии с жирной кислотой, полученной из высыхающего масла, например, льняного, образует эфир. Образующаяся эпоксиэфирная смола с некоторыми растворителями используется как быстро сохнущее покрытие. Покрытие может использоваться и как грунтовка. [3]
При помощи импульсной спектроскопии ЯМР изучена [70] связь времени релаксации с молекулярным движением для неструктурированного диглицидилового эфира бисфенола А и эфира, обработанного 4 4 -метилендианилином [71, 72], а также исследован сам процесс структурирования. В работе [73] изучено влияние хелатов европия и празеодима на спектр ЯМР глици-дилового эфира бисфенола А. [4]
Была исследована возможность применения полиме-тилендиаминов ( h3NCh3Nh3) линейного строения с п, изменяющимся от 0 до 6, в качестве отвердителей диглицидилового эфира бисфенола А. [6]
ТВ - инкремент одной связи бензольного кольца, индексы ДГГ, ДГР и ДГП обозначают эпоксидные фрагменты межузловых цепей на основе изомерных ( тг-1 м -, о -) диглицидиловых эфиров бисфенолов соответственно. [8]
Полимеркаптаны получают также обработкой полигало-генсодержащих или эпоксидных полимеров гидросульфидом натрия [62] или сероводородом. Например, при взаимодействии диглицидилового эфира бисфенола А с сероводородом получают аддукт с высоким содержанием HS-групп, пригодный для использования в отверждающихся композициях и герметиках. [10]
Имины подобного типа нашли широкое применение в композициях, характеризующихся продолжительной жизнеспособностью и отверждающихся при комнатной температуре; эти композиции используются в качестве покровных лаков без растворителя. Наиболее часто отвердители этого типа применяются со смолами на основе диглицидилового эфира бисфенола А, при этом количество вводимого отвердителя составляет около 25 - 30 частей на 100 частей смолы. Подобные смеси обладают текучестью, могут храниться примерно 8 ч, сохраняя при этом способность отверждаться в тонких пленках в течение нескольких часов при комнатной температуре. Толщина отвержденной лаковой пленки, как правило, составляет 0 1 - 0 2 мм, что значительно превышает толщину однослойной пленки, полученной из смолы с растворителями. [12]
Как правило, вязкость замещенного продукта ниже вязкости незамещенного продукта, однако уменьшение вязкости далеко не всегда прямо пропорционально длине полимерной цепи заместителя ( рис. 2 - 7), точно так же как и не все заместители снижают вязкость. Например, вязкость дициглидилового эфира тетрабром-бисфенола А составляет около 98 000 спз при 60 С; вязкость же незамещенного продукта ( смола той же функциональности) составляет около 8 700 спз при той же температуре; диглицидиловый эфир тетрахлорбис-фенола А размягчается при 35 С, в то время как вязкость жидкого незамещенного диглицидилового эфира бисфенола А составляет 40 000 спз при комнатной температуре. [14]
Смолы, полученные в результате синтеза эпихлор-гидрина с бисфенолом А, явились завершающим этапом исследований в области получения серии производных на основе окиси этилена, проводившихся рядом исследователей на протяжении нескольких десятилетий. Greenlee, следует упомянуть и более ранних исследователей, обосновавших возможность получения эпоксидных смол и предвидевших пути их синтеза, что ускорило промышленное использование смол на основе диглицидилового эфира бисфенола А после второй мировой войны. [15]
Страницы: 1 2
www.ngpedia.ru
Способ получения кристаллического диглицидилового эфира 4, 4'-диоксидифенилсульфона
Способ получения кристаллического диглицидилового эфира 4,4'-диоксидифенилсульфона путем конденсации 4,4'-диоксидифенилсульфона с эпихлоргидрином при температуре кипения и дегидрохлорирования водным раствором гидроокиси натрия при повышенной температуре, отличающийся тем, что, с целью ускорения и упрощения процесса, конденсацию ведут в присутствии катализатора - насыщенного водного раствора солянокислого триметиламина, затем к реакционной массе добавляют изопропиловый спирт и проводят дегидрохлорирование при 60 - 80oC.
Изобретение относится к синтезу мономерных кристаллических глицидиловых эфиров бисфенолов и касается усовершенствования способа получения кристаллического диглицидилового эфира 4,4'-диоксидифенилсульфона (бисфенола S), который используют в качестве основы для создания компаундов для герметизации изделий электронной техники. Целью изобретения являются ускорение и упрощение процесса за счет использования эффективного катализатора и растворителя. Пример 1. В трехгорлую колбу, снабженную мешалкой, капельной воронкой и обратным холодильником, загружают 50 г (0,2 моль) бисфенола S, 185 г (2,0 моль) эпихлоргидрина (ЭХГ) и 1,0 мл 63%-ного насыщенного водного раствора триметиламина солянокислого (0,007 моль), нагревают при перемешивании реакционную смесь до температуры кипения (114 - 115oC) и кипятят в течение 1 ч. Затем температуру снижают до 60oC, разбавляют реакционную смесь 120 мл (1,6 моль) изопропилового спирта и при указанной температуре производят дегидрохлорирование, для чего 16,2 г (0,41 моль) едкого натра в виде 33%-ного водного раствора прибавляют в колбу в течение 1,5 ч при перемешивании. Перемешивание продолжают при той же температуре еще 1 ч, после чего фильтрованием отделяют осадок хлорида натрия, фильтрат охлаждают в кристаллизаторе до 4 - 5oC, выпавшие кристаллы отфильтровывают, тщательно промывают водой на фильтре и сушат. Выход 65,3 г (90,1% от теоретического), т. пл. 162 - 163oC, общее время протекания процесса 3,5 ч. После дробной перекристаллизации из толуола выход 83%, т. пл. 164 - 165oC, содержание эпоксидных групп 22,6% (23,7% от теоретического). Пример 2. В условиях, описанных в примере 1, вводят в реакцию 50 г (0,2 моль) бисфенола S, 130 г (1,4 моль) ЭХГ и 1,3 мл 63%-ного водного раствора триметиламина солянокислого (0,009 моль). После проведения первой стадии (0,8 ч) температуру снижают до 70oC, реакционную смесь разбавляют 120 мл (0,6 моль) изопропилового спирта и при указанной температуре проводят дегидрохлорирование раствором едкого натра аналогично примеру 1 в течение 1 ч. Затем реакционную смесь выдерживают при той же температуре и перемешивании еще 0,5 ч, после чего выделяют целевой продукт, как в примере 1. Выход 69,1 г (95,3% от теоретического), т. пл. 163 - 164oC, общее время протекания процесса 2,3 ч. После перекристаллизации из толуола выход 85%, т. пл. 165oC, содержание эпоксидных групп 22,9%. Пример 3. В условиях, описанных в примере 1, вводят в реакцию 50 г (0,2 моль) бисфенола S, 95,5 г (1 моль) ЭХГ и 1,75 мл 63%-ного водного раствора триметиламина солянокислого (0,012 моль). После проведения первой стадии (0,5 ч) температуру снижают до 80oC, разбавляют реакционную смесь изопропиловым спиртом (120 мл, 1,6 моль) и проводят дегидрохлорирование раствором едкого натра аналогично примеру 1 в течение 1 ч. Затем продолжают перемешивание при той же температуре еще 0,5 ч и выделяют целевой продукт, как в примере 1. Выход 65,1 г (89,8% от теоретического), т. пл. 162 - 163oC, общее время протекания процесса 2 ч. После перекристаллизации из толуола выход 83%, т. пл. 164 - 165oC, содержание эпоксидных групп 22,7%. Предлагаемый способ позволяет сократить продолжительность процесса до 2 - 3 ч по сравнению с 10 - 12 ч в известном способе, а также упростить процесс за счет снижения температуры дегидрохлорирования с 110 до 60oC и исключения использования инертного газа и азеотропной отгонки.
Формула изобретения
Способ получения кристаллического диглицидилового эфира 4,4'-диоксидифенилсульфона путем конденсации 4,4'-диоксидифенилсульфона с эпихлоргидрином при температуре кипения и дегидрохлорирования водным раствором гидроокиси натрия при повышенной температуре, отличающийся тем, что, с целью ускорения и упрощения процесса, конденсацию ведут в присутствии катализатора - насыщенного водного раствора солянокислого триметиламина, затем к реакционной массе добавляют изопропиловый спирт и проводят дегидрохлорирование при 60 - 80oC.www.findpatent.ru