Справочник химика 21. Аллилфениловый эфир
Аллилфениловый эфир - Справочник химика 21
Перегруппировка Кляйзена. Термическая изомеризация аллилфенилового эфира в о-аллилфенол [c.318]Реакция. Сигматропная [3,3]-перегруппировка аллилфенилового эфира в аллил фенол (перегруппировка Кляйзена) [107]. [c.256]
Используя способность аллилфениловых эфиров в определенных условиях претерпевать п-изомеризацию, при наличии свободного о-положения, Брюсова и Иоффе разработали простой и удобный синтез ценного душистого вещества эвгенола путем описанной выше изомеризации, с выходом на эвгенол до 38%. Однако и в данном случае, как и при изомеризации алкилфениловых эфиров, наряду с основным продуктом изомеризации — эвгенолом, образуются и другие продукты гваякол, аллиловый эфир эвгенола и т. д. [c.268]
Если, например, используют аллилфениловый эфир, в котором 5% молекул содержат в положении 3 атом " 0, то после реакции следует четко установить, в каком положении находится меченый атом. Это можно сделать путем химической деструкции продукта реакции [c.165]В пользу такого механизма говорит, в частности, результат перегруппировки с меченым " С-аллилфениловым эфиром. [c.80]
Кляйзена перегруппировка - термическая изомеризация аллилфенилового эфира в о-аллилфенол. Перегруппировка имеет циклическое переходное состояние, в котором связи разрываются и образуются синхронно, и относится к числу сигматропных перегруппировок. Перегруппировка имеет внутримолекулярный характер. [c.83]
Задача 18.8. Нагревание аллилфенилового эфира при высокой температуре ведет к перегруппировке Кляйзена. Предложите механизм этой перегруппировки, который объясняет строение продукта реакции. [c.110]
Аллилфениловый эфир Альдегиды Сц, Со2(СО)в 130° С, 30—60 мин [950]. См. также [951] [c.642]
При получении аллилфениловых эфиров, 2-замещенных 2,2-ди-нитро-1-алкиловых эфиров и арилоксиацетонов для ускорения реакции добавляют иодистый калий в последнем случае наблюдается повышение выхода с 20 до 90% и более [б1. Для реакции Вильямсона действие апротонного растворителя (диметилсульфоксид) не Сравнивалось с действием других растворителей, но можно ожидать, что нуклеофильность алкокси-аниона в этом растворителе будет повышаться и скорости замещения будут возрастать, особенно для пространственно затрудненных фенолов [7] [c.327]
Попытки проведения термической перегруппировки М-аллиланилинов стали предприниматься сразу после того, как стало известно о классической перегрупировке Кляйзена в ряду аллилфениловых эфиров. Однако, долгое время эти попытки оставались безуспешными, так как при термолизе К-алли л анилина в интервале 250-275 °С вместо ожидаемого 2-аллиланилина были выделены анилин, пропилен и этилен. [c.42]
Если реакция замещения контролируется кинетически, то состав продуктов реакции определяется относительной нуклео-фильностью каждого из электронодонорных атомов амбидентно-го аниона по отнощению к данному электрофильному агенту. На ход реакции влияют многие факторы (в том числе природа противоиона и других присутствующих в реакционной смеси веществ, концентрации, температура, давление, структура уходящей группы и алкилирующего агента), а растворитель штрает определяющую роль в ориентации электрофильного агента эта проблема обсуждается в обзорах [364—367, 367а, 3676]. Еще в 1923 г. Кляйзен отмечал, что в реакции фенола с 3-бромпропе-ном в присутствии карбоната калия относительные количества образующихся продуктов О- и С-алкилирования зависят от растворителя, используемого в качестве реакционной среды [369]. В ацетоне образуется главным образом аллилфениловый эфир, а в растворителе типа бензола или толуола основным продуктом реакции является о-аллилфенол [369]. [c.342]
Свеженарезанный. тонко измельченный литий (4 2 г 0 6 моль) суспендируют в сухом ТГФ в трехгорлой колбе емкостью 500 мл снабженной мешалкой и капельной воронкой с отводом для выравнивания давления и заполненной аргоном. Суспензию перемешивают и охлаждают в бане при -15 С, добавляя по каплям раствор аллилфенилового эфира (6Л г, 50 моль) в сухом диэтиловом эфире (25 мл) в течение 45 мин. (Если после добавления небольшой части аллилового эфира не появляется бледно-зеленая или синяя окраска, к смеси добавляют немного дифенила.) Охлаждающую баню убирают, и смесь, темнокрасную суспензию, перемешивают еще 15 мин. Раствор декантируют через стекловату для удаления избытка лития. Выход аллилития - 65%. [c.54]
Аллил-и-толиловый эфир Аллилтрисульфид Аллилфениловый эфир [c.412]
Иной механизм имеет перегруппировка Кляйзена (1912 г.). Она проводится при нагревании аллилфениловых эфиров до 190-220 °С и ведет к получению о-аллилфенолов. Для реакции применяют высококипящие растворители дифениловый эфир, тетралин, КД-диалкиланилины. [c.80]
Триоксан (I), аллилацетат (аллилэти-ловый эфир, аллил-бромид, аллилмет-акрилат, аллилцианид, аллилглицидный эфир, аллиловый спирт или аллилфениловый эфир, диаллилфенилфосфат) (II) Сополимеры BFg в безводной среде, 40—70° С. 1 сополимери-зуется с каждым из мономеров II [270] [c.187]
При расщеплении диаллилового эфира под действием бромистого н-бутил-, третичнобутил- и фенилмагния образуются как продукты нормального расщепления по механизму 1,2-присоединения, так и аномальные продукты. Из диаллилового эфира и бромистого н-бутилмагния выделены пропе-наль (8%), аллиловый спирт (55%) и гептен-1 (24%). Изу-фенил-у -метил-диаллиловогоэфира и бромистого фенилмагния получены аллилбензол (42%) и аллилфенол (6 6%). Из аллил-2-аллилфенилового эфира и бромистого этилмагния получены бутен-2-ол-1 с выходом 31% и 1-фенилпентен-1 с выходом 30% [15]. [c.326]
Диметиловые эфиры гидрохинонов и пирокатехинов окисляются с образованием соответственно п- и о-хинонов. Хорошие выходы получаются при действии оксида серебра в кислом диоксане гидроксильные и альдегидные функциональные группы при этом не затрагиваются [18]. Имеется обзор по общим вопросам окисления арилалкиловых эфиров [186]. Восстановительное расщбпле-ние простых эфиров достигается при действии лития и бифенила (реагентом служит дилитийбифенил) [19]. Легкость расщепления аллилфениловых эфиров при действии лития используют для получения аллиллития. [c.436]
Синтезы гетероциклических соединений - выпуск 4 (1959) -- [ c.53 , c.54 ]Методы синтеза с использованием литийорганических соединений (1991) -- [ c.54 ]
Органическая химия (1979) -- [ c.165 ]
Реакции органических соединений (1939) -- [ c.170 ]
Реагенты для органического синтеза Том 7 (1974) -- [ c.402 ]
Методы синтеза с использованием литийорганических соединений (1988) -- [ c.54 ]
Теоретические проблемы органической химии (1956) -- [ c.404 , c.405 ]
Реакции органических соединений (1966) -- [ c.586 ]
Органикум Часть2 (1992) -- [ c.285 ]
Справочник показателей качества химических реактивов Книга 1,2 (1968) -- [ c.14 ]
Радиационная полимеризация (1967) -- [ c.214 ]
Курс физической органический химии (1972) -- [ c.345 ]
chem21.info
Аллилфениловый эфир Аллилфенол - Справочник химика 21
Перегруппировка Кляйзена. Термическая изомеризация аллилфенилового эфира в о-аллилфенол [c.318]Кляйзена перегруппировка - термическая изомеризация аллилфенилового эфира в о-аллилфенол. Перегруппировка имеет циклическое переходное состояние, в котором связи разрываются и образуются синхронно, и относится к числу сигматропных перегруппировок. Перегруппировка имеет внутримолекулярный характер. [c.83]
Интересным типом молекулярных реакций является перегруппировка некоторых арильных эфиров, протекающая при нагревании (перегруппировка Кляйзена) (ОР, 2, 7). Простейшим примером такой реакции является изомеризация аллилфенилового эфира в 2-аллилфенол. Четыре атома в боковой цепи и два атома в кольце, по-видимому, образуют шестичленное квазициклическое соединение образование фенола может затем протекать с перемещением электронов, как указано на следующей схеме тремя изогнутыми стрелками [c.586]
По другому способу [39] полимеризацию ведут в присутствии сложных эфиров некоторых спиртов или простых аллилфениловых эфиров. До 130—180 °С последние не препятствуют полимеризации, но с повышением температуры до 190—195 °С происходит перегруппировка в аллилфенолы, которые дезактивируют щелочные катализаторы. Полученные в присутствии аллилфениловых эфиров полимеры окрашены. [c.25]Если реакция замещения контролируется кинетически, то состав продуктов реакции определяется относительной нуклео-фильностью каждого из электронодонорных атомов амбидентно-го аниона по отнощению к данному электрофильному агенту. На ход реакции влияют многие факторы (в том числе природа противоиона и других присутствующих в реакционной смеси веществ, концентрации, температура, давление, структура уходящей группы и алкилирующего агента), а растворитель штрает определяющую роль в ориентации электрофильного агента эта проблема обсуждается в обзорах [364—367, 367а, 3676]. Еще в 1923 г. Кляйзен отмечал, что в реакции фенола с 3-бромпропе-ном в присутствии карбоната калия относительные количества образующихся продуктов О- и С-алкилирования зависят от растворителя, используемого в качестве реакционной среды [369]. В ацетоне образуется главным образом аллилфениловый эфир, а в растворителе типа бензола или толуола основным продуктом реакции является о-аллилфенол [369]. [c.342]
Иной механизм имеет перегруппировка Кляйзена (1912 г.). Она проводится при нагревании аллилфениловых эфиров до 190-220 °С и ведет к получению о-аллилфенолов. Для реакции применяют высококипящие растворители дифениловый эфир, тетралин, КД-диалкиланилины. [c.80]
При расщеплении диаллилового эфира под действием бромистого н-бутил-, третичнобутил- и фенилмагния образуются как продукты нормального расщепления по механизму 1,2-присоединения, так и аномальные продукты. Из диаллилового эфира и бромистого н-бутилмагния выделены пропе-наль (8%), аллиловый спирт (55%) и гептен-1 (24%). Изу-фенил-у -метил-диаллиловогоэфира и бромистого фенилмагния получены аллилбензол (42%) и аллилфенол (6 6%). Из аллил-2-аллилфенилового эфира и бромистого этилмагния получены бутен-2-ол-1 с выходом 31% и 1-фенилпентен-1 с выходом 30% [15]. [c.326]
Кляйзен показал [73], что при нагревании до 200° аллиловых эфиров фено лов образуются алкилированные в ядро фенолы. Аллильная группа мигри рует от кислородного атома к углероду бензольного кольца, вступая пре имущественно в о-положение. Так, например, аллилфениловый эфир превра щается в о-аллилфенол , [c.404]
Типичный пример — реакция фенолята [сходного с енолятом в схеме 1Г.2.23)] с аллилбромидом. В апротонном диметиловом эфире этиленглнко-ля и в протонном слабокислотном метаноле (р/Снл 15,2) или в воде (рЯнА 15,7) образуется 100% аллилфенилового эфира (продукт 0-алкилиро-вания), в более кислом феноле (рКнл 9,9) —только 23% аллилфенилового эфира и 77% смеси о- и л-аллилфенолов (продукты С-алкилирования), [c.264]
Ле Нобль [10] исследовал влияние давления (до 7 кбар) на гомогенную реакцию феноксид-иона с хлористым аллилом при 30° С. В большинстве органических растворителей эта реакция протекает с образованием только аллилфенилового эфира, т. е. алкилирование нроисходит только по атому кислорода. Однако в воде протекает также С-алкилирование с образованием о- и п-аллилфенолов [c.308]
Механизм о-перегруппировки аллилфениловых эфиров был исследован изотопным методом в работе А. С. Фоменко, Г. П. Миклухина и Е. А. Садовниковой [199] тем же путем, который был применен для водородной перегруппировки. Реакция велась в смеси аллилфенилового эфира с фенолом, в котором водород в т-положениях замещен дейтерием. Как уже указывалось, в этих положениях дейтерий остается стабильно связанным. Если перегруппировка идет через ступень расщепления на ионы (или радикалы), то должны образовываться смешанные продукты легкий фенол и тяжелый аллилфенол с дейтерием в т-положениях [c.260]
Один ИЗ методов проведения клайзеновской перегруппировки, т. е. превращения аллилфенилового эфира в о-аллилфенол, заключается в нагревании эфира при 200° С в течение 6 ч (см. обзор в работе Gerrard et al., 1957). Таким образом, способ с треххлористым бором, для которого требуются несравненно более мягкие условия, заслуживает внимания. [c.68]
Фоменко, Миклухин и Садовникова [199] исследовали механизм перегруппировки аллилфенилового эфира в присутствии фен-3,5-с12-ола в качестве изотопного индикатора. Ими найдено, что 2-аллилфенол, образующийся при нагревании этих соединений, не содержит дейтерия, связанного с углеродом. Если бы процесс перегруппировки протекал по бимолекулярному механизму (7,4), то следовало бы ожидать, что отщепляющийся аллильный ион присоединялся бы с равной степенью вероятности и к обычному фенолятному иону, образующемуся при диссоциации аллилфенола, и к фенолятному-3,5-о 2-иону, возникающему при диссоциации тяжелого фенола [c.459]
Отсутствие дейтерия в продукте перегруппировки показывает, что реакция не протекает по механизму, изображенному схемой (7,4). Результаты этого исследования не исключают, однако, возможности расщепления аллилфенилового эфира не на ионы, а на радикалы, так как в этом случае фенол-3,б-сЗг мог бы не быть акцептором образующихся аллильных радикалов. С целью исключения этого, вообще говоря, мало вероятного механизма и для дальнейшего проникновения в механизм реакции Клайзена, Фоменко и Садовникова [200] исследовали распределение дейтерия в продуктах совместной перегруппировки смеси цин-намилфенилового эфира (е) и аллилфенилового-3,5-с12 эфира (ж) в чн-этиламиновом растворе. Выделенный из смеси о- (а-фенилаллил)-фенол не содержал дейтерия, связанного с углеродом. Очевидно, что если бы реакция шла бимолекулярным путем — ионным или ра.дикальным — безразлично, то в продуктах реакции должен был бы присутствовать в более или менее значительных количествах, как легкий >аллилфенол, так и содержащий дейтерий о- (а-фенилаллил)-фенол-3,5-с12 (з). [c.459]
Приготовление. Чтобы приготовить аллиловыеэфиры, обычно смешивают фенол с бромистым аллилом и поташом в растворе ацетона и эту смесь кипятят в течение нескольких часов. Так 188 г фенола, 242 г бромистого аллила, 280 г поташа и 300 г ацетона обеспечивают после 8 часов кипячения и вакуумной разгонки 86%-ный выход аллилфенилового эфира. Техника перегруппировки очень проста. Обычно эфир нагревается ниже температуры кипения, иногда в присутствии инертных растворителей. Часто реакция сильно экзотермична, и в отдельных случаях теплота реакции заметно сказывается. 80%-ный выход о-аллилфенола получается при нагревании эфира в течение 6 часов при 190—220° (т. е. при температуре кипения). Растворением фенола в щелочи и экстрагированием метилкумарана нефтяным эфиром можно выделить кумаран с выходом в 4—6%. [c.200]
chem21.info
Фенилаллиловый эфир - Справочник химика 21
Фенилаллиловый эфир получают по реакции Вильямсона из фенолята натрия и аллилбромида в полярных растворителях. [c.338]Фенилаллиловый эфир — фенилпропиловый эфир +0.947 [c.168]
Необычайно легко удается получить фенилаллиловый эфир. [c.203]
При обсуждении вопроса о С- и 0-алкилировании фенолятов возникают те же вопросы, что и при алкилировании енолят-ионов (1, разд. 15-2, Б). Обычно происходит только 0-алкилирование. Однако в случае аллилгалогенидов соответствующим подбором растворителя можно направить реакцию по тому или иному пути. При реакции с фенолятом натрия более полярные растворители, подобные ацетону, направляют реакцию в сторону образования фенилаллилового эфира, тогда как в неполярных растворителях, подобных бензолу, основным продуктом является о-аллилфенол. [c.309]
Фенилаллиловый эфир реагирует при —80° с хлористым бором, давая соединение, которое после гидролиза превращается исключительно в о-аллилфенол . [c.144]ЧТО фенилаллиловый эфир при температурах выше 200 С перегруппировывается в о-аллилфенол. Такие перегруппировки носят весьма общий характер их называют перегруппировками Кляйзена. [c.310]
Перегруппировка Кляйзена катализируется кислотами [31], например о-аллилфенол получают из фенилаллилового эфира в трифторуксусной кислоте при комнатной температуре, а в присутствии солей титана(IV)—в метиленхлориде при —78°С. Изучены сигматропные сдвиги диенона (14) с различными катализаторами. В трифторуксусной кислоте [3,3]-сдвиги происходят [c.441]
В замещенных фенилаллиловых эфирах, содержащих хлор в о- или п-положении бензольного кольца или фенильные группы и атомы хлора в положении 3 аллильного радикала, гидрогенолиз проходит легче. Метильная группа в этих положениях вызывает противоположный эффект. Фенилпропиловый н фенилбутен-З-ило-вый эфиры не расщепляются [2842]. [c.352]
Объясните следующие факты а) фенетол расщепляется бромистым и иодистым водородом до фенола и этилгалогенида, а дифениловый эфир не реагирует с Н1 даже при 200 °С б) аллил-фениловый эфир при 200 °С изомеризуется с образованием о-ал-лилфенола, а пропилфениловый эфир в этих условиях не изменяется в) фенолят натрия реагируете хлористым аллилом в ацетоне с образованием фенилаллилового эфира, а в бензоле основным продуктом является о-аллилфенол. [c.167]
Перегруппировка Кляйзена катализируется кислотами. Так, например, орто-аллилфенол образуется нз фенилаллилового эфира в трифторуксусной кислоте уже прн 20 °С, а в нрисутствин хлорида титана (IV) в хлористом метилене даже при -78 [c.1769]
При 200 фенилаллиловый эфир перегруппировывается в 2-аллилфенол. Подобная перегруппировка Кляйзена (1912 г.) [2 2.15] наблюдается и в случае других арилаллиловых эфиров. Обычно аллильная группа мигрирует в орго-положение, но если оно занято, то получаются л-изомеры. [c.338]
Простейшие галогенпроизводные, подобно бромистому аллилу, дают главным образом фенилаллиловый эфир, в то время как более сложные галогенпроизводные, как, например, 4-бромгексен-2 или 4-хлоргексен-2, образуют сложную смесь продуктов аллилирования по атомам углерода и кислорода [5]. [c.301]
Продукт перегруппировки эфира (I) подвергли мягкому окислению. Образовавшийся гликоль был разложен с помощью крепкого HI. Получившийся в итоге муравьиный альдегид не содержал активности. с другой стороны, более глубокое окисление продукта перегруппировки фенилаллилового эфира с помощью KMnOj при- [c.237]
Очень легко и гладко расщепляются фенилаллиловые эфиры. И с жирными, и с ароматическими реактивами Гриньяра реакция протекает уже при 50—75° С (тогда как фенилалкиловые эфиры реагируют лишь при 160— 200°С). Реакция эта может с успехом служить для синтеза непредельныл углеводородов [c.325]
Фенилаллиловый эфир при нагревании перегруппировывается в о-аллил-фенол. Эта реакция, называемая также кляйзеновской, вероятно, протекает по циклическому механизму. [c.559]
Возможность переноса нуклеофильного или анионного фрагмента в аллильных соединениях впервые четко установили Бартон и Ингольд [169], изучившие перегруппировку фенилаллиловых эфиров и других соединений. Они обосновали свою точку зрения исходя из того, что в общем тенденция мигрирующей группы к образованию аниона изменяется параллельно с легкостью перегруппировки, которая ускоряется также электронодопорными заместителями в молекуле. Далее, эта перегруппировка переходит в замещение в присутствии посторонних анионов, что указывает на промежуточное образование свободного мезомерного карбониевого иона. Этот факт, по-видимому, лучше всего объясняется гетеролизом молекулы на свободный карбониевый ион и анион, которые затем имеют возможность объединиться с образованием изомерного продукта перегруппировки по схеме 5. [c.239]
В настоящее время известно, что прежняя точка зрения относительно необходимости кислотного катализатора для такой перегруппировки сложных эфиров неверна, хотя в отдельных случаях это может произойти. Это крайне удивительно, еспи иметь в виду природу сложноэфирной функции, которая легко протонируется по алкильному кислороду с последующим расщеплением связи, давая карбониевый ион спирта (уравнение 15). Было показано, например, что перегруппировка фенилаллилового эфира и-нитробензойной кислоты в хлорбензоле катализируется ге-нитробензойной кислотой [178]. [c.241]
В определенных случаях, например при изомеризации а-фенилаллилового эфира га-нитробензойной кислоты [149, 150] и а-фенил-у-метилаллилового эфира п-нитробензойной кислоты [123], атом кислорода исходного сложного эфира становится алкоксильным кислородом его изомера. На первый взгляд это может служить доказательством 8механизма. Однако, как указывали Уинстейн и Робинсон [61], такие результаты можно объяснять образованием промежуточной внутренней ионной пары, в которой ионы могут вращаться относительно друг друга, если только они смогут преодолеть довольно значительные электростатические силы. [c.433]
Перемещение двойной связи в аллильном радикале было показано на примере перегруппировки фенил- -фенилаллилового эфира (И1) в о-(ж-фенилаллил)-фенол (IV), а также при перегруппировке л-крезилаллилового эфира, содержащего в у-положении аллильного радикала меченый атом [c.143]
Так же ведет себя у-фенилаллиловый эфир енольной формы ацетоуксусного эфира [66] [c.766]
Расщепление некоторых аллиловых эфиров также, по-видимому, протекает по 5дг2 -механизму. Так, при обработке н-бутил-у-фенилаллилового эфира н-гептилмапшйбромидом образуется 3-фенилдецен-1 (52"и) и -бутиловый спирт (76%) [10] [c.397]
Известна также миграция в пара-положение например, о-ацетамидо-фенилаллиловый эфир образует смесь о- и л-аллилацетамидофенолов [c.587]
Фенилаллиловый и фенилбензиловый эфиры претерпевают гидрогенолиз при действии ЫЛ1Н4 в кипящем эфире в присутствии хлористого кобальта, образуя фенол и соответствующий углеводород, причем расщепление проходит на 25 и 10% соответственно [1648]. В присутствии хлористого никеля фенилаллиловый эфир расщепляется в кипящем тетрагидрофуране в течение 24 ч на 82,6%. Применение солей меди и марганца в этой реакции также приводит к более высоким выходам продуктов расщепления, чем в случае солей кобальта. Степень гидрогенолиза зависит и от применяемого растворителя. Наряду с тетрагидрофураном в этом случае хорошие результаты получены при использовании диоксана при температуре его кипения и диэтилкарбитола при 35° С, тогда как в диэтиловом эфире гидрогенолиз проходит неудовлетворительно. [c.352]
Брауэр [24] исследовал перегруппировку Клайзена. Она представляет собой внутримолекулярную перегруппировку, при которой, в частности, фенилаллиловые эфиры превращаются в соответствующие оряго-аллилфенолы [c.190]
Фенилаллиловый эфир и замещенные в ядро фенилаллиловые. эфиры склонны к перегруппировке Клайзена, но соответствующие серусодержащие соединения типа VIII в присутствии щелочей [c.122]
chem21.info
Реакции фенолов
Фенолы могут реагировать как по гидроксильной группе, так и по бензольному кольцу.
1. Реакции по гидроксильной группе
Углерод-кислородная связь в фенолах гораздо прочнее, чем в спиртах. Например, фенол не может быть превращен в бромбензол действием на него бромоводорода, тогда как циклогексанол при нагревании с бромоводородом легко превращается в бромциклогексан:

 (22)
(22) Как и алкоксиды феноксиды реагируют с алкилгалогенидами и другими алкилирующими реагентами с образованием смешанных эфиров:
 (23)
(23) Фенетол
 (24)
(24) Анизол
Алкилирование фенолов галогенуглеводородами или диметилсульфатом в щелочной среде представляет собой модификацию реакции Вильямсона. По реакции алкилирования фенолов хлоруксусной кислотой получают такие гербициды как 2,4-дихлорфеноксиуксусная кислота (2,4-Д).
 (25)
(25) 2,4-Дихлорфеноксиуксусная кислота (2,4-Д)
и 2,4,5-трихлорфеноксиуксусная кислота (2,4,5-Т).
 (26)
(26) 2,4,5-трихлорфеноксиуксусная кислота (2,4,5-Т)
Исходный 2,4,5-трихлорфенол получают по схеме:
 (27)
(27) 1,2,4,5- Тетрахлорфенол 2,4,5-трихлорфеноксид натрия 2,4,5-трихлорфенол
При перегреве на стадии получения 2,4,5-трихлорфенола вместо него может образовываться очень токсичный 2,3,7,8-тетрахлордибензодиоксин:
 (28)
(28) 2,3,7,8-Тетрахлордибензодиоксин
Фенолы являются более слабыми нуклеофилами, чем спирты. По этой причи-не они в отличие от спиртов не вступают в реакцию этерификации. Для получения сложных эфиров фенолов используют хлорангидриды и ангидриды кислот:
 (29)
(29) Фенилацетат
 (30)
(30) Дифенилкарбонат
Упр.17. Тимол (3-гидрокси-4-изопропилтолуол) содержится в тимьяне и используется в качестве антисептика средней силы в зубных пастах и жидкостях для полоскания рта. Его получают алкилированием по Фриделю – Крафтсу
м -крезола 2-пропанолом в присутствии серной кислоты. Напишите эту реакцию.
2. Замещение в кольцо
Оксигруппа фенола очень сильно активирует ароматическое кольцо по отношению к реакциям электрофильного замещения. В качестве промежуточных соединений вероятнее всего образуются оксониевые ионы:


При проведении реакции электрофильного замещения в случае фенолов необходимо применять специальные меры для того, чтобы предотвратить полизамещение и окисление.
3. Нитрование
Фенол нитруется гораздо легче бензола. При действии на него концентриро-ванной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота):

Пикриновая кислота
Наличие в ядре трех нитрогрупп резко увеличивает кислотность фенольной группы. Пикриновая кислота является, в отличие от фенола, уже довольно сильной кислотой. Наличие трех нитрогрупп делает пикриновую кислоту взрывчатой, она используется для приготовления мелинита. Для получения мононитрофенолов необходимо использовать разбавленную азотную кислоту и проводить реакцию при низких температурах:

Получается смесь о- и п- нитрофенолов с преобладанием о- изомера. Эта смесь легко разделяется благодаря тому, что только о- изомер обладает летучестью с водяным паром. Большая летучесть о- нитрофенола объясняется образованием внутримолекулярной водородной связи, в то время как в случае
п- нитрофенола возникает межмолекулярная водородная связь.


4. Сульфирование
Сульфирование фенола осуществляется очень легко и приводит к образованию в зависимости от температуры преимущественно орто - или пара -фенолсульфокислот:

5. Галогенирование
Высокая реакционная способность фенола приводит к тому, что даже при его обработке бромной водой происходит замещение трех атомов водорода:
 (31)
(31) Для получения монобромфенола необходимо принимать специальные меры.
 (32)
(32) п -Бромфенол
Упр.18. На 0.94 г фенола действуют небольшим избытком бромной воды. Какой продукт и в каком количестве при этом образуется?
6. Реакция Кольбе
Диоксид углерода присоединяется к феноксиду натрия по реакции Кольбе, представляющей собой реакцию электрофильного замещения, в которой электрофилом является диоксид углерода
 (33)
(33) Фенол Феноксид натрия Салицилат натрия Салициловая кислота
Механизм:
 (М 5)
(М 5) Действием на салициловую кислоту уксусного ангидрида получают аспирин:
 (34)
(34) Ацетилсалициловая кислота
Если оба орто -положения заняты, то замещение проходит по пара- положению:
 (35)
(35) Реакция проходит по следующему механизму :
 (М 6)
(М 6)

7. Конденсация с карбонилсожержащими соединениями
При нагревании фенола с формальдегидом в присутствии кислоты образуется фенолформальдегидная смола:
 (36)
(36) Фенолформальдегидная смола
Конденсацией фенола с ацетоном в кислой среде получают 2,2-ди(4-гидроксифенил)пропан, получивший промышленное название бисфенол А:
 (37)
(37) Бисфенол А
2,2-ди(4-гидроксифенил)пропан
ди(4-оксифенил)диметилметан
Обработкой бисфенола А фосгеном в пиридине получают лексан:
 (38)
(38) Лексан
В парисутствии серной кислоты или хлорида цинка фенол конденсируется с фталевым ангидридом с образованием фенолфталеина:
 (39)
(39) Фталевый ангидрид Фенолфталеин
При сплавлении фталевого ангидрида с резорцином в присутствии хлорида цинка происходит аналогичная реакция и образуется флуоресцеин:
 (40)
(40) Резорцин Флуоресцеин
Упр.19. Изобразите схему конденсации фенола с формальдегидом. Какое практическое значение имеет эта реакция?
8. Перегруппировка Кляйзена
Фенолы вступают в реакции алкилирования по Фриделю-Крафтсу. Например, при взаимодействии фенола с аллилбромидом в присутствии хлорида алюминия образуется 2-аллилфенол:
 (41)
(41) Этот же продукт образуется и при нагревании аллилфенилового эфира в результате внутримолекулярной реакции называемой перегруппировкой Кляйзена:
(42)
Аллилфениловый эфир 2-Аллилфенол
Реакция (43)
(43) Проходит по следующему механизму:
 (44)
(44) Перегруппировка Кляйзена происходит также и при нагревании аллилвинилового эфира или 3,3-диметил-1,5-гексадиена:
 (45)
(45) Аллилвиниловый эфир 4-Пентеналь
 (46)
(46) 3,3-Диметил- 2-Метил-2,6-
1,5-гексадиен гексадиен
Известны и другие реакции этого типа, например, Реакция Дильса-Альдера. Их называют перициклическими реакциями.
mirznanii.com
Галогенопроизводные со связью С(sp3)-галоген. Карбонильные соединения, страница 7
Аллилфениловые эфиры фенолов термодинамически неустойчивы и при нагревании изомеризуются в устойчивые орто-аллилфенолы (перегруппировка Кляйзена).
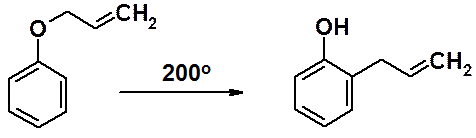
Образование сложных эфиров
Образование сложных эфиров фенолов возможно только в реакциях с ангидридами или хлорангидридами карбоновых кислот, но не с сами кислотами.
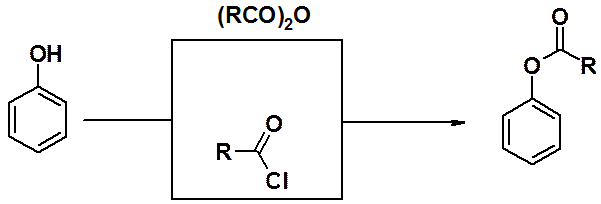
Сложные эфиры фенолов соединения термодинамически неустойчивые. В присутствии кислот Льюиса они вступают в перегруппировку Фриса. При температуре более 100о ацильная группа мигрирует в орто-, а при комнатной – в пара-положение.

Гидрирование и окисление фенолов
Каталитическое восстановление фенола приводят к циклогексанолу – важному исходному соединению в синтезе искусственных волокон.
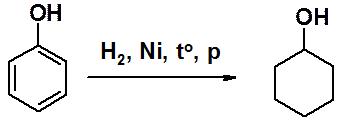
Фенолы окисляются уже при стоянии на воздухе, что объясняется повышенной, по сравнению с бензолом, электронной плотностью в цикле. Окисление фенола приводит к орто- и пара-хинонам, причем тщательным подбором условий удается провести селективное окисление. Значительно легче вступают в окисление с образованием соответствующих хинонов двухатомные фенолы.
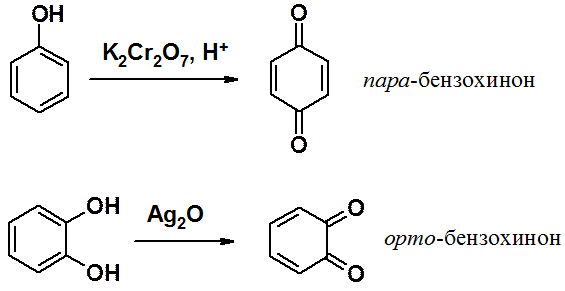
Реакции ароматического электрофильного замещения
ОН-Группа – активирующий заместитель, орто-пара-ориентант. Активирующие свойства гидроксигруппы столь велики, что для получения монобромпроизводного исходным соединением является не фенол, а сложный эфир фенола. После бромирования ацильную группу гидролизуют.
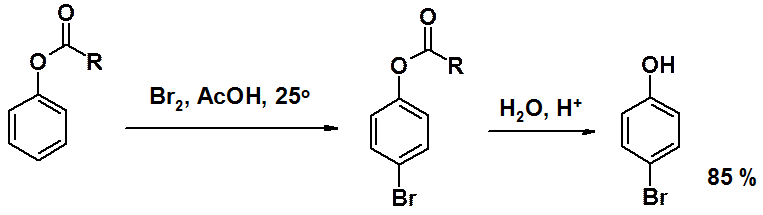
Реакция фенола с трехкратным избытком бромной воды останавливается только тогда, когда электрофил занимает все положения кольца, которые может атаковать.
В большем избытке бромной воды результатом реакции становится «тетрабромфенол». Таким образом, активирующее действие ОН-группы столь велико, что возможно протекание реакций с нарушением ароматической системы.
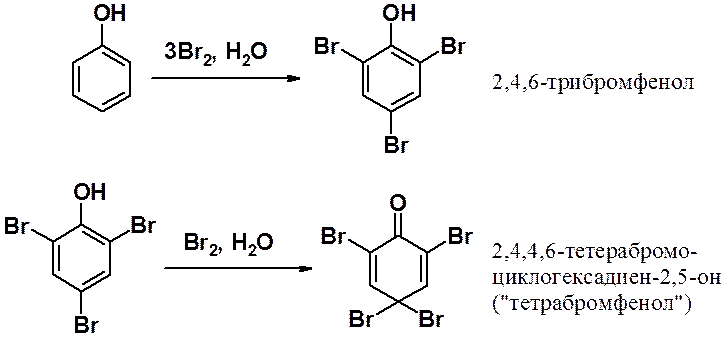
Нитрование фенола легко протекает при комнатной температуре разбавленной азотной кислотой. Образуется смесь орто- и пара-нитрофенолов, которую легко разделить перегонкой с водяным паром (более летучий орто-изомер перегоняется с водяным паром).

Строение продуктов сульфирования фенола сильно зависит от температуры и времени проведения реакции. Сульфирование при комнатной температуре приводит к кинетически контролируемому орто-изомеру, реакция при 100о к пара-изомеру - продукту термодинамического контроля. Обратимость сульфирования позволяет нагреванием превратить орто-изомер в продукт пара-замещения.
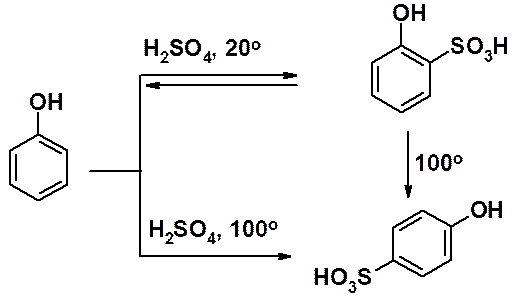
Алкилирование и ацилирование по Фриделю-Крафтсу
В фенольном ряду эти реакции имеют некоторые особенности, связанные с тем, что фенолы образуют комплексы с кислотами Льюиса и дальнейшая реакция алкилирования не происходит.
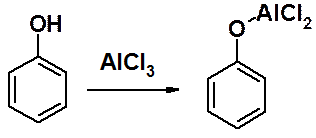
Поэтому сначала проводят О-алкилирование фенола, затем С-алкилирование или ацилирование по Фриделю-Крафтсу, после чего регенерируют ОН-группу.
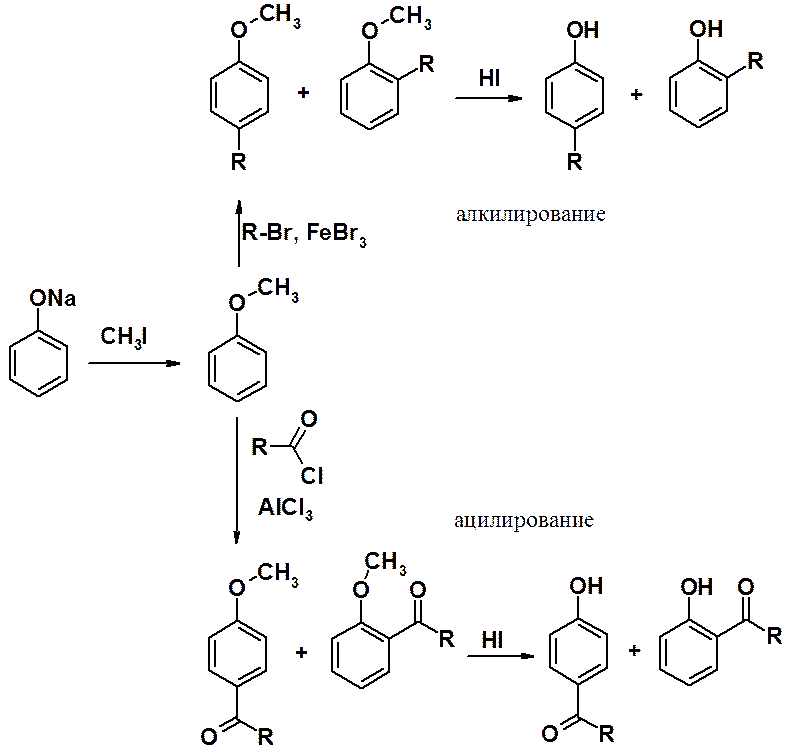
Известный индикатор – фенолфталеин – продукт ацилирования фенола фталевым ангидридом.
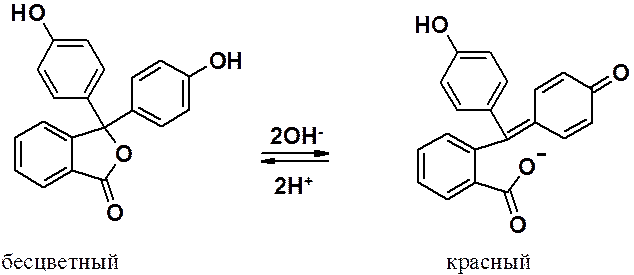
Активирующие свойства гидроксильной группы в фенолах столь велики, что позволяют осуществлять превращения, невозможные в бензольном ряду.
Карбоксилирование (реакция Кольбе-Шмитта)
Фенолят-анионы способны вступать в реакцию ароматического электрофильного замещения со столь слабым электрофилом как оксид углерода IV (углекислый газ).
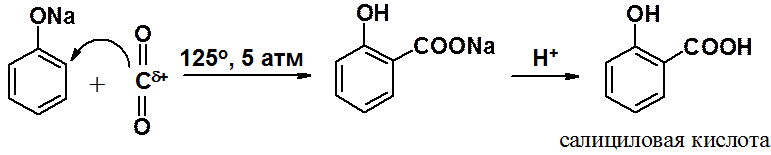
Реакция Кольбе-Шмитта промышленный метод получения салициловой кислоты, предшественника широко распространенного лекарства – ацетилсалициловой кислоты (аспирина).
Формилирование (реакция Раймера-Тимана)
Нагревание фенола с хлороформом в присутствии щелочи приводит к введению в орто-положение бензольного кольца альдегидной группы. Электрофилом в этой реакции является дихлоркарбен (:ССl2), образующийся при взаимодействии хлороформа со щелочью. Далее проходит обычная реакция SEAr. В условиях реакции дихлорбензильное производное гидролизуется, затем отщепляет молекулу воды, превращаясь в альдегид.
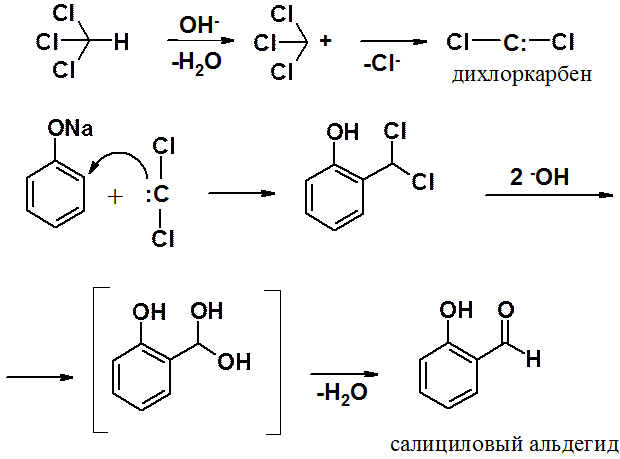
Лекция № 29
Простые эфиры.
· Диалкиловые эфиры. Классификация, изомерия, номенклатура. Физические свойства. Химические свойства: образование оксониевых солей, расщепление кислотами, автоокисление. Получение межмолекулярной дегидратацией спиртов и действием алкилгалогенидов на алкоголяты. Получение и применение в синтезе краун-эфиров. Виниловые эфиры. Получение, гидролиз и причины легкости его протекания, полимеризация.
· Простые циклические эфиры. Эпоксисоединения: получение, реакции с водой, спиртами, галогеноводородами, аммиаком и аминами, реактивами Гриньяра. Тетрагидрофуран, диоксан.
· Токсикологические свойства и техника безопасности при работе с простыми эфирами.
Тиоаналоги спиртов, фенолов и эфиров.
· Общая характеристика, номенклатура. Получение алкилтиолов реакцией алкилирования сероводорода и его солей. Получение арентиолов восстановлением аренсульфонилхлоридов. Физические свойства тиолов, полярность связи S-H. Кислотные свойства тиолов, реакции алкилирования и окисления. Диметилсульфоксид. Тиоэфиры (сульфиды), их получение, физические свойства. Реакции алкилирования и окисления тиоэфиров. Токсичность бис(2-хлорэтил)сульфида. Техника безопасности при работе с органическими соединениями серы. Антидоты.
Простые эфиры
Простыми эфирами называют соединения общей формулы R-O-R’, где R и R’ углеводородные радикалы. Простые эфиры бывают алифатическими, ароматическими, смешанными, симметричными и несимметричными, а также циклическими.
Получение
Некоторые способы получения эфиров: межмолекулярной дегидратацией спиртов, синтезом Вильямсона в спиртах и фенолах и присоединением спиртов к алкинам были рассмотрены ранее.
Часто используют методы, которые можно назвать «модифицированными синтезами Вильямсона», заключающиеся во взаимодействии алкоксид аниона с алкилирующими агентами. К наиболее распространенным алкилирующим агентам относятся диметилсульфат и эфиры пара-толуолсульфокислоты.
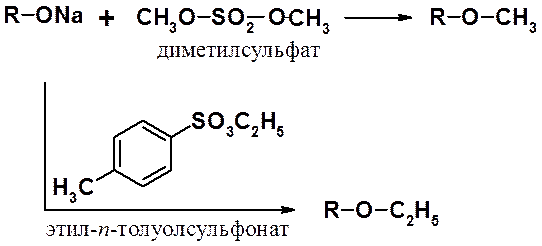
Эфиры могут быть получены также получены присоединением спиртов к алкенам в присутствии кислот Льюиса при нагревании и повышенном давлении.
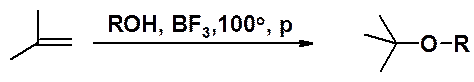
Получение оксиранов см. раздел «Алкены». Пяти- и шестичленные циклы с эфирным кислородом получают внутримолекулярной дегидратацией 1,4- или 1,5-диолов, соответственно.
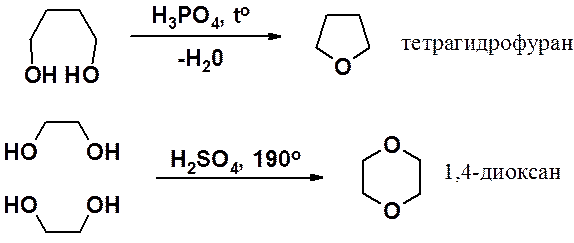
vunivere.ru
Аллилфенолы - Справочник химика 21
Перегруппировка Кляйзена. Термическая изомеризация аллилфенилового эфира в о-аллилфенол [c.318]Эвгенол (2-метокси-4-аллилфенол) представляет собой бесцветнук> жидкость. Он часто встречается в растениях, и его получают в больших количествах из гвоздичного масла. Под действием щелочи эвгенол перегруппировывается в а-пропенильное соединение — изоэвгенол [c.300]
Аллилариловые эфиры при нагревании перегруппировываются в о-аллилфенолы эта реакция носит название перегруппировки Кляйзена [478]. Если в исходном соединении оба орто-положения заняты, аллильная группа мигрирует в пара-положение (в этом случае процесс часто называют пара-перегруппировкой Кляйзена). Иногда /гара-замещенные продукты получаются и из тех эфиров, в которых одно или даже оба орто-положения свободны [479], однако в целом можно сказать, что когда одно или оба орто-положения не заняты, продуктом будет о-аллилфенол, а когда заняты оба орго-положения, продуктом будет ара-соединение. Если замещены пара- и оба ортоположения, реакция не идет. Миграция в жега-положения не наблюдалась. При миграции в орто-положение аллильная группа всегда претерпевает аллильный сдвиг, т. е. заместитель в а-положении к кислороду оказывается в -положении к кольцу, и наоборот (как показано в приведенной выше схеме). При миграции в /гара-положение аллильного сдвига не происходит и аллильная группа сохраняет ту же структуру, что и в исходном эфире. Пропаргильные группы (т. е. группы, содержащие тройную связь в соответствующем положении), как правило, в эту реакцию не вступают. [c.207]Ненасыщенные полиарилаты могут быть получены также поликонденсацией дифенилолпропана с дихлорангидридами ненасыщенных дикарбоновых кислот (например, фумаровой) или совместной лоликонденсацией дихлорангидрида дикарбоновой кислоты с дифенилолпропаном и о-аллилфенолом . Такие ненасыщенные полиарилаты способны отверждаться сами по себе при нагревании или за счет сшивания с помощью винильных мономеров . [c.49]
Присоединение и конденсация, вероятно, проходят за счет водорода фенольного гидроксила и водорода бензольного ядра с образованием сложной смеси фенольных и эфирных соединений, из которых были идентифицированы в относительно чистом состоянии только р-бромизопропилфениловый эфир и аллилфенол [59]. [c.194]
Аллилены галоидные 106 Аллиловый спирт 105, 117, 142, 143, 215, 401 озонид 315 Аллиловый эфир 547 Аллилфенол 543, 546, 547 Аллильная перегруппировка 143 Аллильные производные 105 Аллит 433 [c.1157]
Объясните следующие факты а) фенетол расщепляется бромистым и иодистым водородом до фенола и этилгалогенида, а дифениловый эфир не реагирует с Н1 даже при 200 °С б) аллил-фениловый эфир при 200 °С изомеризуется с образованием о-ал-лилфенола, а пропилфениловый эфир в этих условиях не изменяется в) фенолят натрия реагируете хлористым аллилом в ацетоне с образованием фенилаллилового эфира, а в бензоле основным продуктом является о-аллилфенол. [c.167]
Насыщенные 0-алкиловые эфиры устойчивы к нагреванию. Поскольку фенол в отношении кислотности и способности сочетаться с солями диазония сходен с енольной формой ацетоуксусного эфира, Клайзен занялся изучением поведения аллилового эфира фенола и установил, что при температуре кипения (т. кип. 192 °С) он медленно перегруппировывается, образуя с хорошим выходом о-аллилфенол (т. кип. 220 °С) [c.313]
Поскольку эфиры I, о-положение которых свободно, перегруппировываются в о-аллилфенолы, и так как воздействию подвергается у-углеродный атом аллильной группы, то реакция должна протекать через стадию циклического переходного состояния IV. Первичным продуктом взаимодействия является диенон V, который енолизуется в стабилизованный сопряжением о-аллилфенол VI [c.314]
Джеррард (1957) установил, что при пзаимодействии алллилового эфира фенола с треххлористым бором при —80°С и последующем гидролизе продукта реакции образуется исключительно о-аллилфенол. [c.317]
В 1912 году Л.Кляйзен открыл интересную и своеобразную иерегрупинровку аллнловых эфиров фенолов в аллилфенолы, которая стала прототипом для многих родственных сигматронных перегруппировок, приведенных в главе 26. Аллиловый эфир фенола прн нагревании до 200-220 С превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-иоложение бензольного кольца. [c.1767]
Перегруппировка Кляйзена катализируется кислотами. Так, например, орто-аллилфенол образуется нз фенилаллилового эфира в трифторуксусной кислоте уже прн 20 °С, а в нрисутствин хлорида титана (IV) в хлористом метилене даже при -78 [c.1769]
Другой, побочной реакцией, иногда вызывающей затруднения, является образование соединений типа ЫУ (см. стр. 25). При перегруппировке самого аллилфеннлового эфира наряду с 2-аллилфенолом [65 а] образуется небольшое количество -1—б 7(,) метилди гидробензофура на вероятно, [c.22]
chem21.info