Серный эфир: формула, свойства и применение. Сернистый эфир
сернистый эфир - это... Что такое сернистый эфир?
сернистый эфирestere solforico
Dictionnaire technique russo-italien. 2013.
- сернистый свинец
- серно-кадмиевый фотоэлемент
Смотреть что такое "сернистый эфир" в других словарях:
Этилен сернистый — представляет собой простой эфир дитиогликоля Ch3(HS).Ch3(HS). Известен только в виде полимеров C4H8S2 или (C2h5S)3, а может быть даже более сложного, получаемых при действии водного или спиртового раствора K2S на бромистый этилен. При этом при… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ГРИБЫ — (Fungi, Mycetes), класс низших или слоевцовых растений, лишенных хло рофила (приблизительно 70.000 видов). То, что называют Г. в общежитии (различные шляпные и др. Г.), представляет только известные части (т. н. плодовые тела) некоторых наиболее… … Большая медицинская энциклопедия
МАССАЖ — МАССАЖ, методическое механическое воздействие на поверхность тела б ного, состоящее из ряда описанных ниже приемов. А н а т . физиол. обоснованиям. Методика М. должна быть основана на знании условий лимфообращения. Движение лимфы в тканях… … Большая медицинская энциклопедия
Маслобойное и маслоэкстракционное производства* — Для получения растительных жирных масел применяются преимущественно семена растений, частью плоды. Значительное число растений, семена которых служат для добывания жирных масел, принадлежит к семейству крестоцветных (Cruciferae), как, напр., рапс … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Маслобойное и маслоэкстракционное производства — Для получения растительных жирных масел применяются преимущественно семена растений, частью плоды. Значительное число растений, семена которых служат для добывания жирных масел, принадлежит к семейству крестоцветных (Cruciferae), как, напр., рапс … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ОТРАВЛЕНИЕ — ОТРАВЛЕНИЕ. Под отравлением разумеют «расстройства функций животн. организма, вызываемые экзогенными или эндогенными, химически или физико химически действующими веществами, к рые в отношении качества, количества или концентрации чужды… … Большая медицинская энциклопедия
Эфирные масла* — Под общим названием Э. масел собирают большое количество веществ, имеющих, в сущности, общего только то, что они все образуются в растениях и обладают запахом, да и то это последнее качество надо принять с оговоркой. Некоторые Э. масла не… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Эфирные масла — Под общим названием Э. масел собирают большое количество веществ, имеющих, в сущности, общего только то, что они все образуются в растениях и обладают запахом, да и то это последнее качество надо принять с оговоркой. Некоторые Э. масла не… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сера химический элемент — (Soufre франц., Sulphur или Brimstone англ., Schwefel нем., θετον греч., лат. Sulfur, откуда символ S; атомный вес 32,06 при O=16 [Определен Стасом по составу сернистого серебра Ag 2 S]) принадлежит к числу важнейших неметаллических элементов.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сера, химический элемент — (Soufre франц., Sulphur или Brimstone англ., Schwefel нем., θετον греч., лат. Sulfur, откуда символ S; атомный вес 32,06 при O=16 [Определен Стасом по составу сернистого серебра Ag2S]) принадлежит к числу важнейших неметаллических элементов. Она… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Газы сжиженные и в критическом состоянии — Во времена Лавуазье (см. это имя) переход Г. в жидкое и твердое состояние казался весьма вероятным, так как при химических реакциях часто совершается подобная перемена физического состояния ( Oeuvres de Lavoisier , т. II 804). В начале XIX… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
polytechnic_ru_it.academic.ru
Серный эфир: формула, свойства и применение
Образование 16 мая 2018В современной мире нужно постоянно развиваться, узнавать что-то новое, нельзя стоять на месте. Однако, по непонятным причинам, под развитием многие понимают только лишь погоню за моделями айфонов, освоение появляющихся и уже существующих социальных сетей, просмотр видеороликов (в большинстве случаев абсолютно бесполезных) или же изучение лишь определенной тематики. Едва ли многие не химики могут сказать, что такое серный эфир. Или рассказать о его свойствах. А кто знает, где применяется это вещество? Почему серный эфир называется именно так? К сожалению, ответить на все эти вопросы могут лишь единицы. Что же такое эфир в принципе? Какова формула, свойства и применение серного эфира?
Классы соединений под названием "Эфир"
Изначально все классы соединений, относящиеся к эфирам, так и назывались – эфиры, не было разделения на три группы, которые существуют на сегодняшний день:
- Простые эфиры - это класс соединений, в которых между двух углеводородных радикалов находится кислород, то есть, оба радикала имеют по связи с одним и тем же кислородом. Наиболее известным представителем этого класса является этиловый эфир.
- Сложные эфиры - так называют производные карбоновых и минеральных кислот (так называемых оксикислот), у которых в молекуле вместо гидроксильной группы (-ОН) кислой функции находится спиртовой остаток. Безусловно, определение сложное и непонятное, общая формула таких соединений: R-C(=O)-R'. Представителями являются этилацетат, бутилбутират, бензилформиат.
- Полиэфиры - это класс высокомолекулярных соединений. Их получают в результате поликонденсации многоосновных кислот, то есть они содержат два атома и более водорода. Например, соляная кислота - HCl - одноосновная кислота, азотная - HNO3 - тоже. А вот серная - h3SO4 - и фосфорная - h4PO4 - многоосновные (серная - двухосновная, фосфорная - трех), как и их альдегиды с многоатомными спиртами (у этих спиртов две и более гидроксильных -ОН групп).

Что такое серный эфир?
Достоверно неизвестно где, когда, как и кем был впервые получен диэтиловый эфир. Причем здесь это вещество? Да просто у серного эфира несколько названий, в числе которых еще и этиловый. Этоксиэтан (еще одно название) - это простой эфир, молекула которого состоит из двух этильных групп (-С2Н5) и кислорода, с которым оба радикала (этильные группы) связаны. Доподлинно неизвестно, когда и кем был впервые получен – по этому вопросу имеется несколько точек зрения. Есть предположения, что в девятом веке Джабир ибн Хайян был первым, кто получил диэтиловый эфир. Но также возможно, что лишь в 1275 году каталанский миссионер Раймунд Луллий смог стать первопроходцем в области синтеза этоксиэтана. Относится вещество к алифатическим простым эфирам (то есть не имеет ароматических связей).

Видео по теме
Способы получения
Название серного эфира тесно связан со способом получения, которым был освоен еще в средние века. Речь идет о перегонке этилового спирта и серной кислоты. Но название было дано этому веществу, точнее именно эфиром он назван, лишь в 1729 году. До этого момента можно встретить такое название как «сладкое купоросное масло» (раньше серную кислоту называли купоросным маслом).
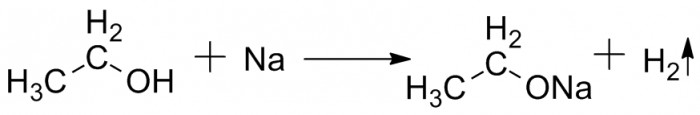
Однако это не единственный метод синтеза диэтилового эфира. Его можно получить в качестве побочного продукта в результате гидратации этилена в среде серной или фосфорной кислот. Основная часть диэтилового эфира образуется на стадии гидролиза сульфатов. Химическая формула серного эфира выглядит следующим образом: (С2Н5)2О. Систематическое название (по международной системе СИ) - 1,1-окси-бис-этан. Брутто-формула вещества - С4Н10О.
Физические свойства
Серный эфир является легколетучей жидкостью, которая очень подвижна. Он не имеет цвета, полностью прозрачен. У этой жидкости достаточно специфический запах и очень жгучий вкус. Диэтиловый эфир разлагается под воздействием света, влаги, воздуха. При нагревании он также разлагается, как и от вышеперечисленных факторов. В результате его разложения образуются достаточно токсичные вещества, которые оказывают раздражающее действие на дыхательные пути.
Этиловый эфир относится к легковоспламеняющимся жидкостям, его пары образуют с воздухом и кислородом взрывоопасные смеси. При взаимодействии с водой образует азеотропную смесь.

Серный эфир: свойства химические
Для диэтилового эфира, как представителя класса простых эфиров, характерны свойства этого класса соединений. В результате разложения образует альдегиды, пероксиды, кетоны. При взаимодействии с сильными кислотами образует оксониевые соли, которые являются весьма нестойкими соединениями. С кислотами Льюиса (химические соединения, которые являются акцепторами электронной пары), напротив, образует достаточно стабильные соединения. Смешивается с этиловым спиртом, бензолом в любых соотношениях.

Применение этоксиэтана
Существует две основные области применения этилового эфира: медицина (фармакология) и техника. С точки зрения действия на организм человека, диэтиловый эфир является общеанестезирующим веществом, то есть используется в качестве наркоза, обезболивающего. Во время проведения подготовительных операций для пломбирования (стоматологическая практика) используется местно "дырочек" в зубах от кариеса и корневого канала. Хирурги же применяют этоксиэтан в качестве ингаляционного наркоза: пациент вдыхает пары эфира, в результате воздействия которого центральная нервная система «обездвиживается». Такой эффект полностью проходит.
Нашел применение серный эфир и в качестве растворителя. Речь идет уже о технической области применения. Также может применяться в качестве теплоносителя, гораздо реже выступает в роли хладагента. В авиамодельных двигателях компрессионного типа используется как один из компонентов топлива.

Алкилсерные кислоты (сложные эфиры серной кислоты)
Алкилсерные кислоты являются одними из важнейших представителей сложных эфиров неорганических кислот (минеральных), которые имеют немаловажное значение в области синтеза органических соединений. Сложный эфир серной кислоты, формула общая этих соединений, представители наиболее значимые являются интересной темой для обсуждения. Итак, общая формула алкилсерных кислот выглядит следующим образом: R-Ch3-O-SO2-OH. Эти вещества достаточно просто получить - они легко образуются при взаимодействии серной кислоты со спиртами. В ходе реакции также выделяется вода. Наиболее важными представителями этого класса соединений являются эфиры метилового (метилсерная кислота) и этилового (этилсерная кислота) спиртов.

Выводы
Итак, серный эфир - это алифатический простой эфир, который представляет собой прозрачную, бесцветную жидкость со своеобразным запахом и жгучим вкусом. Получается из спирта этилового при воздействии на него кислот (в частности серной). Применяется в медицине и технике.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
 Образование Сложные эфиры: химические свойства и применение
Образование Сложные эфиры: химические свойства и применениеСложными эфирами принято называть соединения, полученные по реакции этерификации из карбоновых кислот. При этом происходит замещение ОН- из карбоксильной группы на алкоксирадикал. В результате образуются сложные эфиры...
 Образование Серная кислота. Формула, свойства, получение и применение
Образование Серная кислота. Формула, свойства, получение и применениеСерная кислота имеет историческое название: купоросное масло. Изучение кислоты началось с древних времен, в своих трудах ее описывали: греческий врач Диоскорид, римский натуралист Плиний Старший, исламские алхимики Ге...
 Образование Формула полипропилена. Свойства и применение полипропилена
Образование Формула полипропилена. Свойства и применение полипропиленаПолимеры и изготовленные из них материалы, предметы быта, оборудование - это важная часть промышленности и жизни человека в целом. Природные ресурсы, к сожалению, сильно истощились за время их использования. Поэтому л...
 Автомобили Универсальный растворитель «Бензин-калоша»: свойства и применение
Автомобили Универсальный растворитель «Бензин-калоша»: свойства и применениеРастворители – химические соединения, применяемые для растворения различных веществ. Для практических бытовых целей они необходимы не менее, нежели для применения в промышленном производстве. На прилавках строит...
 Бизнес Горючие газы: названия, свойства и применение
Бизнес Горючие газы: названия, свойства и применениеГорючие газы – вещества с низким порогом теплоты сгорания. Это основной компонент газообразного топлива, которое используется для газоснабжения городов, в промышленности и других сферах жизнедеятельности. Физико...
 Бизнес Металлы платиновой группы: обзор, список, свойства и применение
Бизнес Металлы платиновой группы: обзор, список, свойства и применениеМеталлы платиновой группы – это шесть благородных драгоценных химических элементов, которые расположены рядом в периодической таблице. Все они являются переходными металлами 8–10 групп 5–6 периода.
 Бизнес Графит: температура плавления, свойства и применение
Бизнес Графит: температура плавления, свойства и применениеГрафит относится к минералам, которые отличаются многофункциональностью в практическом использовании. Обычно принято ассоциировать его с красящими веществами, но этим его возможности не ограничиваются. В то же время н...
 Бизнес Все о HDPE: что это такое, свойства и применение
Бизнес Все о HDPE: что это такое, свойства и применениеГеомембраны представляют собой современные рулонные полимерные материалы, толщина которых может изменяться от 1 до 4 мм. Они изготавливаются из полиэтилена, полипропилена, поливинилхлорида и других материалов с минима...
 Бизнес Полиэтилен: температура плавления, потребительские свойства и применение
Бизнес Полиэтилен: температура плавления, потребительские свойства и применениеСегодня человечество не может обойтись без искусственных материалов. Они обладают рядом уникальных качеств, доступны и значительно удешевляют производство. Одним из таких материалов выступает полиэтилен. Температура п...
 Бизнес Слоистые пластики: свойства и применение
Бизнес Слоистые пластики: свойства и применениеВ системах изоляции сложных устройств и конструкций, к которым предъявляются повышенные эксплуатационные требования, используют специальные композитные материалы. Как правило, это не универсальные, а узкоспециализиров...
monateka.com
Серный эфир: формула, свойства и применение
В современной мире нужно постоянно развиваться, узнавать что-то новое, нельзя стоять на месте. Однако, по непонятным причинам, под развитием многие понимают только лишь погоню за моделями айфонов, освоение появляющихся и уже существующих социальных сетей, просмотр видеороликов (в большинстве случаев абсолютно бесполезных) или же изучение лишь определенной тематики. Едва ли многие не химики могут сказать, что такое серный эфир. Или рассказать о его свойствах. А кто знает, где применяется это вещество? Почему серный эфир называется именно так? К сожалению, ответить на все эти вопросы могут лишь единицы. Что же такое эфир в принципе? Какова формула, свойства и применение серного эфира?
Классы соединений под названием "Эфир"
Изначально все классы соединений, относящиеся к эфирам, так и назывались – эфиры, не было разделения на три группы, которые существуют на сегодняшний день:
- Простые эфиры - это класс соединений, в которых между двух углеводородных радикалов находится кислород, то есть, оба радикала имеют по связи с одним и тем же кислородом. Наиболее известным представителем этого класса является этиловый эфир.
- Сложные эфиры - так называют производные карбоновых и минеральных кислот (так называемых оксикислот), у которых в молекуле вместо гидроксильной группы (-ОН) кислой функции находится спиртовой остаток. Безусловно, определение сложное и непонятное, общая формула таких соединений: R-C(=O)-R'. Представителями являются этилацетат, бутилбутират, бензилформиат.
- Полиэфиры - это класс высокомолекулярных соединений. Их получают в результате поликонденсации многоосновных кислот, то есть они содержат два атома и более водорода. Например, соляная кислота - HCl - одноосновная кислота, азотная - HNO3 - тоже. А вот серная - h3SO4 - и фосфорная - h4PO4 - многоосновные (серная - двухосновная, фосфорная - трех), как и их альдегиды с многоатомными спиртами (у этих спиртов две и более гидроксильных -ОН групп).

Что такое серный эфир?
Достоверно неизвестно где, когда, как и кем был впервые получен диэтиловый эфир. Причем здесь это вещество? Да просто у серного эфира несколько названий, в числе которых еще и этиловый. Этоксиэтан (еще одно название) - это простой эфир, молекула которого состоит из двух этильных групп (-С2Н5) и кислорода, с которым оба радикала (этильные группы) связаны. Доподлинно неизвестно, когда и кем был впервые получен – по этому вопросу имеется несколько точек зрения. Есть предположения, что в девятом веке Джабир ибн Хайян был первым, кто получил диэтиловый эфир. Но также возможно, что лишь в 1275 году каталанский миссионер Раймунд Луллий смог стать первопроходцем в области синтеза этоксиэтана. Относится вещество к алифатическим простым эфирам (то есть не имеет ароматических связей).

Способы получения
Название серного эфира тесно связан со способом получения, которым был освоен еще в средние века. Речь идет о перегонке этилового спирта и серной кислоты. Но название было дано этому веществу, точнее именно эфиром он назван, лишь в 1729 году. До этого момента можно встретить такое название как «сладкое купоросное масло» (раньше серную кислоту называли купоросным маслом).
Однако это не единственный метод синтеза диэтилового эфира. Его можно получить в качестве побочного продукта в результате гидратации этилена в среде серной или фосфорной кислот. Основная часть диэтилового эфира образуется на стадии гидролиза сульфатов. Химическая формула серного эфира выглядит следующим образом: (С2Н5)2О. Систематическое название (по международной системе СИ) - 1,1-окси-бис-этан. Брутто-формула вещества - С4Н10О.
Физические свойства
Серный эфир является легколетучей жидкостью, которая очень подвижна. Он не имеет цвета, полностью прозрачен. У этой жидкости достаточно специфический запах и очень жгучий вкус. Диэтиловый эфир разлагается под воздействием света, влаги, воздуха. При нагревании он также разлагается, как и от вышеперечисленных факторов. В результате его разложения образуются достаточно токсичные вещества, которые оказывают раздражающее действие на дыхательные пути.
Этиловый эфир относится к легковоспламеняющимся жидкостям, его пары образуют с воздухом и кислородом взрывоопасные смеси. При взаимодействии с водой образует азеотропную смесь.

Серный эфир: свойства химические
Для диэтилового эфира, как представителя класса простых эфиров, характерны свойства этого класса соединений. В результате разложения образует альдегиды, пероксиды, кетоны. При взаимодействии с сильными кислотами образует оксониевые соли, которые являются весьма нестойкими соединениями. С кислотами Льюиса (химические соединения, которые являются акцепторами электронной пары), напротив, образует достаточно стабильные соединения. Смешивается с этиловым спиртом, бензолом в любых соотношениях.

Применение этоксиэтана
Существует две основные области применения этилового эфира: медицина (фармакология) и техника. С точки зрения действия на организм человека, диэтиловый эфир является общеанестезирующим веществом, то есть используется в качестве наркоза, обезболивающего. Во время проведения подготовительных операций для пломбирования (стоматологическая практика) используется местно "дырочек" в зубах от кариеса и корневого канала. Хирурги же применяют этоксиэтан в качестве ингаляционного наркоза: пациент вдыхает пары эфира, в результате воздействия которого центральная нервная система «обездвиживается». Такой эффект полностью проходит.
Нашел применение серный эфир и в качестве растворителя. Речь идет уже о технической области применения. Также может применяться в качестве теплоносителя, гораздо реже выступает в роли хладагента. В авиамодельных двигателях компрессионного типа используется как один из компонентов топлива.

Алкилсерные кислоты (сложные эфиры серной кислоты)
Алкилсерные кислоты являются одними из важнейших представителей сложных эфиров неорганических кислот (минеральных), которые имеют немаловажное значение в области синтеза органических соединений. Сложный эфир серной кислоты, формула общая этих соединений, представители наиболее значимые являются интересной темой для обсуждения. Итак, общая формула алкилсерных кислот выглядит следующим образом: R-Ch3-O-SO2-OH. Эти вещества достаточно просто получить - они легко образуются при взаимодействии серной кислоты со спиртами. В ходе реакции также выделяется вода. Наиболее важными представителями этого класса соединений являются эфиры метилового (метилсерная кислота) и этилового (этилсерная кислота) спиртов.

Выводы
Итак, серный эфир - это алифатический простой эфир, который представляет собой прозрачную, бесцветную жидкость со своеобразным запахом и жгучим вкусом. Получается из спирта этилового при воздействии на него кислот (в частности серной). Применяется в медицине и технике.
загрузка...
fjord12.ru
Сернистая кислота эфиры - Справочник химика 21
Производные обеих таутомерных форм сернистой кислоты широко известны среди органических соединений сложных эфиров сернистой кис-Н-О.. [c.572]Средние эфиры симметричной формы сернистой кислоты, алкил-сульфиты, образуются из тионилхлорида и спиртов [c.147]
Следовательно, превращение протекает в две ступени—через хлорид сложного эфира сернистой кислоты, который при нагреве отщепляет сернистый ангидрид, превращаясь в хлористый алкил [120]. [c.195]
Реакционную смесь оставляют на ночь п])и 65° для завершения реакции образования сложного эфира сернистой кислоты, а затем 24 часа кипятят при 90° с обратным холодильником для разложения сложного эфира с отщеплением сернистого ангидрида. [c.195]Диамиловый эфир сернистой кислоты [c.144]
Этансульфокислота. В этом разделе приведены только реакции, не упомянутые при рассмотренип общих методов получения сульфокислот. Встряхивание диэтилсульфита с иодистым этилом [54] в щелочном растворе или просто гидролиз диэтилсульфита холодным раствором 20%-ной щелочи [87] ведет к образованию некоторого количества щелочной соли этансульфокислоты. Аналогичные. результаты дает действие иодистого этила на натриевую соль кислого этилового эфира сернистой кислоты. Последняя в присутствии солеи, например роданида натрия, претерпевает перегруппировку, превращаясь в натриевую соль этансульфокислоты [88]. Сернистокислый натрий может быть алкилирован [89] путем нагревания с натриевой солью этилсерной кислоты в концентрированном водном растворе до температуры 110—120° в течение 3 час. [c.122]
При взаимодействии галоидного алкила со щелочной солью сернистой кислоты в водном растворе скорее можно ожидать образования сульфокислоты [36, 37], чем эфира сернистой кислоты. В случае замены щелочной соли сернистокислым аммонием [38] получающаяся аммониевая соль сульфокислоты легче превра- [c.109]
По исходному фазовому состоянию (г, ж или т) растворяемого вещества жидкие растворы можно разделить на три группы (ж + г), (ж Н- ж) и (ж + т). К первой из них относятся такие системы, как раствор Og в воде (угольная кислота), соляная, сероводородная, сернистая кислоты и др. Ко второй группе относятся растворы эфиров, спиртов, серной и азотной кислот и др. При этом растворителем считается тот компонент, содержание которого является более высоким. Третья группа растворов самая многочисленная, так как к ней относятся растворы большинства солей, щелочей, твердых кислот (например, борной), амальгамы металлов и т. п. [c.192]
В последующем другие исследователи [121] на основе изучения этого пр Оцесса также пришл к выводу, что промежуточным продуктом при образовании хлористых алкилсв из спиртов и хлористого тионила являются хлориды сложных эфиров сернистой кислоты. [c.195]
Дистиллят, содержащий, кроме эфира, воду, спирт и сернистую кислоту, дважды промывают в делительной воронке 100 мл холодного 5%-ного раствора едкого натра. Эфирный слой после отделения дважды промывают 50%-ным раствором хлористого кальция, взятым в количестве, равном половине объема дистиллята. [c.342]
Дестиллат, кроме эфира, содержит воду, спирт и сернистую кислоту. Его взбалтывают в делительной воронке с 10%-ным раствором едкого натра, взятым в количестве /3 объема полученного дестиллата (для удаления сернистой кислоты). Отделив раствор едкого натра, эфир (для удаления спирта) обрабатывают насыщенным раствором хлористого кальция раствор последнего берут в количестве, равном половине объема дестиллата. [c.78]
В делительную воронку вместимостью 100 мл вливают 40 мл диэтилового эфира, 10 мл воды и 1 мл 6%-ного раствора сернистой кислоты. Встряхивают 1 мин и после расслаивания отделяют водную фазу. В стакан к раствору пробы добавляют 0,5 мл 10%-ного раствора гипофосфита натрия, 0,5 мл 6%-ного раствора сернистой кислоты и перемешивают. Через 30 с переводят раствор с 5 мл 6,5 М раствора НС1 в делительную воронку к обработанному сернистой кислотой эфиру и экстрагируют Ga (IV) в течение 30 с. После разделения фаз спускают водную фазу в стакан и выпаривают на водяной бане почти досуха. После охлаждения добавляют 1 мл 10%-ного раствора солянокислого гидроксиламина, 2 мл 0,25%-ного раствора о-фенантролина, 1 мл 25%-иого раствора лимоннокислого натрия, 1 мл 10%-ного раствора ЭДТА и перемешивают. Устанавливают pH 3—4 аммиаком (1 1), переводят в мерную колбу вместимостью 25 мл н разбавляют до метки во-дой. Через 30 мин измеряют оптическую плотность при 510 им по воде. Градуировочный график строят для, области от 1 до 15 мкг Fe. [c.59]
Под алкоксисер нистой кислотой понимают эфир алифатического спирта и сернистой кислоты [c.357]
Молекулярная масса полимера легко регулируется количеством катализатора, введенного в реакционную среду. Молекулярномассовое распределение может регулироваться как путем изменения числа реакторов для проведения процесса (чем меньше число реакторов в непрерывном процессе, тем шире ММР), так и применением специальных веществ и приемов, способствующих расширению ММР. Одни из них, такие, как дивинилбензол, эфиры сернистой кислоты [41], ЗпСЦ [42], являются сшивающими агентами и при добавлении в раствор живого полимера удваивают молекулярную массу части цепей. Другие, например толуол, 1-бутин(эти-лацетилен), 1-бутен-З-ин (венилацетилен), в процессе полимеризации способствуют переносу цепи и тем самым расширяют ММР. [c.276]
Принимая во внимание, что этиловый эфир хлорсульфоновой кислоты обычно ведет себя как алкилирующий агент, кажется странным, что он не алкилирует натриевые производные этиловых эфиров ацетоуксусно и малоново кислот. В сухом этиловом эфире при НИЗКО температуре вместо этого происходит только хлорирован1 е и образование натриевой соли кислого этилового эфира сернистой кислоты [c.42]
Ди-(р-хлорэтил)-сульфат. Физические свойства этого соединения приведены в табл. 9. Единственным хорошо охарактеризованным галоидным производным диэтилсульфата является соединение, полученное из этиленхлоргидрина. Ди-( -хлорэтил)-сульфат синтезирован действием хлористого сульфурила па этиленхлоргидрин [456] и на р-хлорэтилнитрит [457]. Он образуется с хорошим выходом также при действии -хлорэтилового эфира хлорсульфоновой кислоты на ди-р-хлорэтиловый эфир сернистой кислоты [446] [c.79]
Ди-(у-хлор-и-пропил) сульфат приготовлен действием пропилового эфира хлорсульфоновой кислоты на эфир сернистой кислоты [464]. Химические свойства его не изучены. [c.81]
Реакция без побочных процессов гладко протекает лишь с третичными спиртами. Первичные и вторичные спирты, кроме галогеналкилов, образуют эфиры сернистой кислоты [c.72]
Эфиры сернистой кислоты. Сернистая кислота принадлежит к минеральным кислотам, способным реагировать в таутомсрнон форме. Некоторые ее неорганические соли являются производными формы (I), другие —формы (И) [c.147]
Тот факт, что при алкилировании сульфитов образуются эфиры не сернистой кислоты, а алкилсульфокислот, может быть объяснен очень легко протекающей перегруппировкой диалкнлсульфитов и алкилсерни-стокислых солей в алкилсульфокислоты. Хорошим средством для осуществления этой перегруппировки является иодид калия [c.158]
А м и н ы на ф т а л и и о в о г о ряда, особенно нафтиламино-сульфокислоты с амнногрунпон в пара-положении к сульфогруппе, очень легко превращаются в фенолы при нагревании с бисульфитом натрия (Бухерер). Сначала образуются эфиры сернистой кислоты, которые затем разлагают щелочью [c.537]
Как только начнется довольно быстрое выделение этилена, прибавляют из капельной воронки смесь спирта и серной кислоты, все время поддерживая температуру 160° С (маленькое пламя) реакция должна идти с такой скоростью, чтобы ток выделяющегося этилена был равномерным и не было сильного вспенивания. Для очистки этилена от спирта и образующегося попутно эфира его пропускают через промывную склянку с концентрированной серной кислотой для удаления сернистой кислоты газ пропускают через предохранительную склянку с тремя тубусами, в которой находится 4 н. раствор едкого натра. Затем газ поступает в две скляики, содержащие бром, с целью получения бромистого этилена (см. стр. 82). [c.171]
Для работы требуется Прибор (см. рис. 82). — Штативы с пробирками. — Ступка фарфоровая. — Держатель для пробирок. — Склянки широкогор-лые с резиновыми пробками и отводными трубками, 3 шт. — Крючок стеклянный. — Стаканы емк. 100 мл, 2 шт. и емк. 50 мл, 2 шт. — Цилиндр мерный емк. 50 мл. — Часы песочные на 15 мин. — Железные предметы для оксидирования.— Пластинки из котельного железа 25X80 мм, 3 шт. — Гвозди железные. — Струна фортепианная. — Бумага лакмусовая. — Бумага миллиметровая. — Бумага фильтровальная. — Железо (опилки). — Сера в порошке. — Соль Мора пере-кристаллизованная. — Тиомочевина. — Метанитроанилин. — Спирт. — Эфир. — Азотная кислота дымящая. Серная кислота концентрированная. — Соляная кислота, 2 н. и 5%-ный растворы. — Едкий натр, 2 н. раствор. — Серная кислота, 20%-ный и 2 н. растворы. — Сульфид аммония, 2 н. раствор. — Сернистая кислота, насыщенный раствор. — Перманганат калия, 0,05 н. раствор. — Роданид калия, 0,5 н. раствор. — Красная кровяная соль, 1 н. раствор. — Желтая кровяная соль, 1 н. раствор. — Хлорид железа (111), 1 н. раствор. — Сульфат меди (II), 0,5 н. раствор. — Раствор, содержащий в 1 л 600 г едкого натра н 60 г нитрита натрия. — Бумага наждачная. [c.324]
Бутиловый эфир сернистой кислоты, натриевая соль см. Бутилсернистой кислоты натриевая соль [c.104]
Бутиловый эфир сернистой кислоты, натриевая соль Бутилсульфит натрия СНз ( h3)зOS02Na [c.106]
Избыток хлора или брома удаляют нз реакционной смеси при помощи тока воздуха, двуокиси углерода или водяного пара, а также химическими средствами при помощи сернистой кислоты, бисульфита натрия или ртути (HgBtg, растворяется в эфире). Не вошедший в реакцию хлор, увлекаемый продуктами реакции, поглощают известковым молоком. [c.176]
Эфирный раствор осторожно декантируют при помощи согнутой трубки, вставленной в колбу для отсасывания, присоединяемую к водоструйному насосу. Кашицеобразную массу основной соли магния 4—5 раз тщательно промывают эфиром (по 30—40 мл) при перемешивании, декантируя эфир после отстаивания. Соединенные эфирные вытяжки обрабатывают повторно 40-проц. раствором бисульфита натрия (2—3 раза по ЬОмл для удаления неизмененного фурфурола), сливают в колбу с прокаленным поташем и оставляют на ночь для высушивания. На следующий день добавляют 3—4 капли анилина (для удаления следов сернистой кислоты), фильтруют эфирный раствор через складчатый фильтр, отгоняют эфир и фракционируют остаток в вакууме. [c.123]
chem21.info
Серный этиловый эфир - Справочник химика 21
При низких температурах простые эфиры с трудом реагируют с концентрированной серной кислотой. При продолжительном нагревании происходит разложение этилового эфира с образованием этилсерной кислоты [187]. [c.36]Из окиси этилена, при взаимодействии ее с этиловым спиртом в присутствии серной кислоты, намечено получать этиловый эфир этиленгликоля, так называемый этилцеллозольв, который, как указывалось выше, применяется для растворения нитроцеллюлозы и ацетилцеллюлозы. [c.319]
Сырье установки алкилирования не должно содержать также примеси бутадиена и этилена. Этилен образует стабильные сложные этиловые эфиры с серной кислотой и действует как разбавитель кислоты. Бутадиен может или подвергаться алкилированию изобутаном, или [c.66]Для получения 1 т спирта на абсорбцию идет около 2 т концентрированной серной кислоты, а затем приходится упаривать уже 4 т разбавленной кислоты. Такой кислотооборот осложняет производство и вызывает значительные трудности из-за сильной коррозии и тял елых условий труда. По сернокислотному методу из 1 т этилена вырабатывается 1,2 т спирта-ректификата и около 100 кг этилового эфира. Превращение этилена в спирт достигает 90%. [c.171]
Первым случаем сознательного применения катализаторов Г. М. Шваб [3] считает образование этилового эфира из спирта с помощью серной кислоты, открытое в VHI в. Поиски философского камня во времена алхимического средневековья приравнены к поискам катализатора [3]. [c.5]
При превращении этилового спирта в этиловый эфир действием серной кислоты эта последняя реакция и является, повидимому, той реакцией, которая проходит при значительно более [c.77]
Как впервые отметил Магнус [235, 236], действием серного ангидрида на этиловый спирт или этиловый эфир получается этионовая кислота, которая при гидролизе переходит в изэтионовую кислоту [c.145]
Получение диэтилсульфата. Диэтилсульфат получен многими путями, большинство из которых имеет лишь второстепенное значение для изготовления этого реагента в больших количествах. Небольшой выход диэтилсульфата получен действием олеума или серного ангидрида на этиловый эфир или этиловый спирт [435], обработкой этилата натрия или этилового спирта хлористым сульфурилом или этилхлорсульфатом [436], а также путем медленной перегонки этилсерной кислоты в вакууме [4371. Можно несколько повысить выход, перегоняя этилсерную кислоту над безводным сернокислым натрием [438]. Диэтилсульфат обра- [c.75]
Обстоятельное исследование действия серного ангидрида на этиловый эфир [239] привело к выделению ряда продуктов и позволило установить, что реакция носит ступенчатый характер и протекает следующим образом [c.146]
Этиловый спирт. Этилен легко поглощается 98—100%-ной серной кислотой при температуре 75—80° С. Более высокие температуры вызывают нежелательные окислительно-восстановительные реакции, а высокая концентрация кислоты вызывает потерю этилена, связанную с превращением его в этионовую кислоту и карбил-сульфат [239, 240]. Образование полимеров в данном случае значения не имеет. Образуются как моно-, так и диэтил сульфаты после разбавления водой и нагревания происходит энергичный гидролиз. Вторичная реакция между нейтральным эфиром и спиртом ведет к образованию этилового эфира [c.577]
Простейшие эфиры газообразны (метиловый кипит при — 23°, метилэтиловый— при -[-11°). Остальные эфиры жидки (этиловый кипит при -j-34,6°). По мере усложнения частицы температуры кипения все повышаются. Вообще же эфиры кипят значительно ниже соответствующих сйиртов, благодаря отсутствию водных остатков, которые отягощают частицу, делают ее мало летучей. Благодаря тому же отсутствию ОН, эфиры мало растворимы в воде (серный эфир растворим в воде не во всех отношениях). Зато сами эфиры являются великолепными растворителями для различных органических соединений и применяются в лабораторной и заводской пр1актике для их очищения перекристаллизацией. Эфиры удельно легче воды. Серный (этиловый) эфир обладает особенно характерным запахом. [c.191]
Исследуемая фракция в количестве 2,246 г по каплям добавлялась к смеси серной и дымящей азотной кислот (2—1). После этого смесь нагревалась на водяной бане в продолжение нескольких часов и после охлаждения переносилась в чашку с водой и оставлялась на ночь. Образовавшееся нигросоединение состояло из двух фаз (желтая маслянистая жидкость и кристаллы). Обработкой этиловым эфиром был выделен белый, в эфире нерастворимый осадок, который перекристаллизовывался из бензола и ацетона. После перекристаллизации из ацетона выделились белые, блестящие кристаллы с температурой плавления 171 —173°. В бензоле растворимый осадок плавился при температуре 166—167°. [c.80]
Катализаторы. Как уже упоминалось выше, кислотные катализаторы можно подразделить на два класса соли галоидоводородных кислот тина Фриделя —Крафтса и кислоты, способные к переносу протона. Из последнего класса для промышленных процессов алкилирования предложены два катализатора — серная кислота и фтористый водород как наиболее подходящие, так как они являются жидкостями и обращение с ними проще. Однако алкилирование этиленом в их присутствии проходит нелегко, вероятно, вследствие устойчивости образующихся нри этом сложных этиловых эфиров. Этилирование изобутана проходит с исключительно высоким выходом в присутствии хлористого алюминия и некоторых других катализаторов типа катализаторов Фриделя—Крафтса. Разработан промышленный процесс производства 2,3-ди1 етплбутана по [c.309]
Сендерс и Додж [46] рассмотрели термодинамические данные по гидратации этилена и пришли к следующему заключению Ясно, что в настоящее время (1934 г.) невозможно получить константу равновесия, отклоняющуюся от теоретической менее чем в сто раз . Они изучали гидратацию этилена в паровой фазе при 360—380° и давлениях от 35 до 135 ат над окисью алюминия и окисью вольфрама в качестве катализаторов. На основании своих результатов и результатов других исследователей они пришли к выводу, что еще не найден активный катализатор для реакции гидратации. Выдано большое количество патентов по гидратации этилена в присутствии кислых солей и фосфорной кислоты на носителях [39] в паровой фазе при высоких температурах и давлениях. Один из таких процессов, в котором в качестве катализатора используется фосфорная кислота, применяется в промышленности. Этилен может реагировать с разбавленной 10 %-ной серной кислотой при температурах 240—260° и давлениях около 141 кг/см , при этих условиях образуется равновесная смесь этилена, этанола и этилового эфира. Спирт или эфир монполучения другого продукта, но технические трудности процесса помешали его промышленному использованию [29]. [c.355]
В работах [9, 10] рассматривалась реакция получения этилового эфира уксусной кислоты из этилена и уксусной кислоты. Катализатором процесса служила серная кислота, нанесенная на внутреннюю поверхность частиц силикагеля. Эффективность работы катализатора изучалась в реакторе с неподвижным слоем в стационарных и нестационарных условиях. Нестационарность создавалась периодической степенчатой подачей уксусной кислоты на вход в реактор. Расход этилена при этом не изменялся. Величина оптимального периода изменения состава 30 мпн. [c.34]
Л.Т. Гурвич описывает друго11 способ выделения фенолов пз нафтеновых кислот 1141. К смеси кислот и фенолов прибавляют метиловый или этиловый спирт и в присутствии соляной или серной кислоты переводят нафтеновые кислоты в метиловые или этиловые эфиры. Затем последние во избежаппе гидролитического расщепления обрабатывают на хо.юду 3%-ным водным раствором едкого натра, извлекающего фенолы. Для выделения фенолов водный раствор разлагают соляной пли серной кислотой. [c.459]
Следует отметить, что при взаимодействии этилена с серной кислотой образуется не только этиловый спирт. Идут и некоторые побочные реакции, образуются эфир, ацетальдегид и полимеры. При ректификации спирта-сырца, помимо этилового спирта, выход которого составляет около 85%, получается также этиловый эфир С2Н5ОС2Н5, на долю которого приходится около 12%. [c.328]
Пиридиновый комплекс является наименее реакционноснособпым, тогда как продукт присоединения серного ангидрида к дихлор-этиловому эфиру обладает, повидимому, наибольшей активностью. Пиридиновое соединение вступает в реакцию с ненасыщенными спиртами, почти не затрагивая двойные связи [28]. Дио-ксансульфотриоксид реагирует со спиртовой группой быстрее, чем с ненасыщенной связью, но, присутствуя в избытке, он присоединяется по двойной связи. [c.12]
При более поздней попытке [175] приготовить чистый эфир лучший образец содержал 84,5% этилсерной кислоты. Дальнейшее повышение концентрации оказалось невозможным вследствие разложения. Из данных по растворимости этого продукта высчитано, что чистая этилсерная кислота должна растворяться в сухом этиловом эфире в количестве 1,27 г в 100 мл при 30°. Такая низкая растворимость представляется сомнительной, так как Клессон [34а] описал то же самое соединение как маслообразное, растворимое в этиловом эфире вещество, которое не смешивается с эфиром в случае разбавления его эквимолекулярным количеством воды. Лучшие методы получения чистой этилсерной кислоты основаны, повидимому, на реакции между серным ангидридом и безводным спиртом [145] ИЛИ па реакции диэтилсульфата с избытком спирта [176] с последующим удалением пепрореагировавшего спирта и образовавшегося этилового эфира в вакууме при температуре ниже 40° [c.33]
Вследствие технической важности для получения эфиров серной кислоты, спирта и этилового эфира подробно изучена реакция серной кислоты с этиленом. Присутствие этилена в крекинггазах и в различных газах, используемых для топливных целей, обес-печивает значительные его ресурсы. При ранних исследованиях [177а—в] этой реакции отмечено, что этилен очень медленно реагирует с концентрированной серной кислотой при обычных температурах, но при 100° и выше он абсорбируется быстро. При температурах значительно выше 110—120° происходит заметное обугливание [177г], причем побочные реакции можно обнаружить уже при более низких температурах. [c.34]
Берт [474] приготовил ряд смешанных эфиров серной кислоты действием этилового эфира хлорсульфоновой кислоты на суснензии алкоголятов натрия в эфире прп —10"". Физические свойства смешанных сульфатов приведены в табл. 8. [c.84]
Этиловые эфиры уксусной и хлоруксусноп кислот [188] разлагаются при действии концентрированной серной кислоты, причем степень распада составляет соответственно 15,3 и 32,9% при расчете из уравнения [c.36]
Этиловый эфир хлорсульфоновой кислоты впервые получен действием дымящей серной кислоты на хлористый этил [204а,б] [c.38]
Реакция соировождается образованием изэтионовой кислоты в качестве побочного продукта. Из 2 кг серного ангидрида Пургольд [204в] получил 600 г этилового эфира хлорсульфоновой кислоты. Этот же эфир он приготовил, кроме того, действием нятихлористо-го фосфора на этилсульфат калия [c.38]
Взаимодействие этилового эфира хлорсульфоновой кислоты с ди-метиланилином в растворе хлороформа при низкой температуре ведет к образованию хлористого этила и продукта присоединения диметиланилина к серному ангидриду наряду с хлористым диметил этилфениламмонием [c.41]
По первому уравнению получается примерно 80% продуктов реакции. Продукт присоединения серного ангидрида нри нагревании до 60 претерпевает перегруппировку в п-сульфокислоту. Последняя получается также действием этилового эфира хлорсульфоновой кислоты на диметиланилин при более высокой температуре. Четвертичная аммониевая соль не могла образоваться из хлористого этила и диметиланилина, так как эти вещества нри низкой температуре реагируют очень медленно. [c.42]
Этиловый эфир хлорсульфоновой кислоты действием серного ангидрида переводится в сульфосоединение [207а], которое легко гидролизуется в изэтионовую кислоту [c.43]
Скорость гидролиза изоамилсульфата натрия в кислом растворе [231 ] примерно вдвое меньше скорости гидролиза этилового эфира серной кислоты. При нагревании изоамилсульфата калия с азотнокислым калием [232] в значительных количествах образуется нитрит. [c.45]
Известны некоторые смешанные алкильные эфиры серной кислоты. Метилэтилсульфат [4731 с небольшим выходом получается действием этилового эфира хлорсульфоновой кислоты на метиловый спирт [c.84]
Из 1,3 кг этилового эфира и 1,5 кг серного ангидрида получено 600 г диэтилсульфата. Увеличение количества серного ангидрида до 2,1 кг привело к образованию 750 г изэтионовой кислоты. Из 100 г диэтилсульфата п 88 г серного ангидрида получено 5,4 г метионата бария СН2( 0з),Ва. Наилучшин метод получения изэтионовой кислоты состоит в сульфировании сухого этилового эфира газообразным серным ангидридом при 0°, после чего реакционная смесь обрабатывается водой для удаления диэтилсульфата (диэтилсульфат можно подвергнуть последующему сульфированию) и этионовая кислота гидролизуется кинячением водного раствора. [c.146]
Ангидрид этионовой кислоты получен также в качестве первичного продукта [241] при взаимодействии серного ангидрида с этиловым сииртом. Для проведения сульфированпя олефинов и спиртов с цепью приготовления изэтионовой кислоты и ее гомологов запатентован [242] в качестве растворителя жидкий сернистый ангидрид. Этионовая кислота получается в небольших количествах [243] гидролизом продукта дальнейшего сульфирования этилового эфира хлорсульфоновой кислоты. Этот продукт образуется в условиях присоединения хлорсульфоновой кислоты к этилену наряду с ее этиловым эфиром, являющимся основным продуктом реакции. [c.146]
Нагревание этилового эфира 1-нафталинсульфокислоты с водой до 150° приводит к полному гидролизу с образованием нафталина, серной кислоты и спирта [207а]. Обработка -хлорэтилового эфира бензолсульфокислоты 0,1 н раствором едкого кали [2076] показывает, что сульфогруппа гидролизуется в три раза скорее, чем атом хлора, но в случае 8, р -дихлоризопропирового эфира бензолсульфокислоты атомы хлора отщепляются с большей скоростью, чем сульфогруппа. Этот эфир гидролизуется, однако, очень медленно даже в кипящем 30%-ном растворе едкого натра. [c.360]
Метионовая кислота получается в небольших количествах при помощи ряда реакций, ведущихся с применением серного ангидрида или дымящей серной кислоты. Она выделена из реакционной смеси, полученной сульфированием этилового эфира [432] диэтилсульфата [433], ацетонитрила, ацетамида, сульфоуксусной [434], уксусной [435] и молочной кислот [436]. Ацетилен легко растворяется в 50%-ной дымящей серной кислоте [437], образуя в качестве основного продукта формилметионовую кислоту, небольшая часть которой разлагается на окись углерода и метионовую кислоту [c.175]
Реакции сульфирования моноалкильных эфиров резорцина, повидимому, не исследованы. При нагревании в течение 1 часа с 2 эквивалентами серной кислоты диметиловый эфир превращается практически полностью в 4-сульфокислоту [361а]. Как из метилового, так и из этилового эфиров резорцина получается при [c.57]
Диметиловый эфир гидрохинона дает с серной кислотой [370] при 125° моносульфокислоту. Как из метилового, так и из этилового эфиров получаются при действии хлорсульфоновой кислоты [c.58]
Сульфирование эфиров нафтолов. Как при комнатной температуре [673], так и при 100° серная кислота превращает 1-нафтил-этиловый эфир [674] в 4-сульфокислоту. При кристаллизации последней из воды следует соблюдать осторожность, так как при 75° идет уже заметный гидролиз. 2-Нафтилметиловый эфир в сероуглеродном растворе дает с хлорсульфоновой кислотой [675] смесь [c.104]
chem21.info