18.8.1.Б. Реакции переэтерификации. Реакция переэтерификации сложных эфиров
18.8.1.Б. Реакции переэтерификации
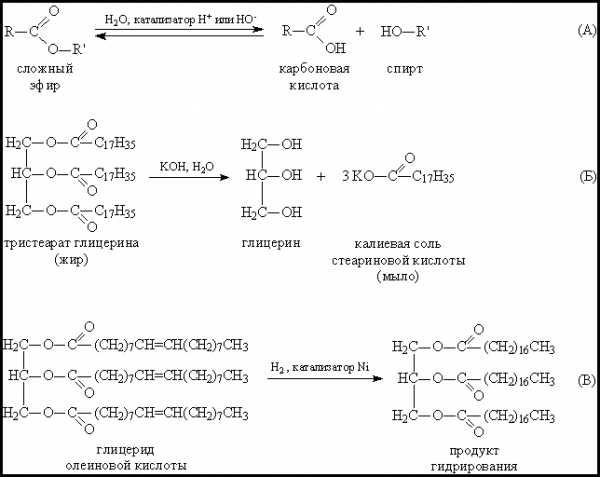
Сложные эфиры могут быть получены с помощью переэтерификации, катализируемой кислотами или основаниями. Смесь сложного эфира и большого избытка спирта нагревают в присутствии кислотного или основного катализатора.
Реакция имеет практическое значение только в том случае, когда оба сложных эфира можно легко разделить перегонкой. Этот метод особенно полезен для получения метиловых и этиловых эфиров высших карбоновых кислот при переэтерификации жиров, а также для синтеза сложных эфиров третичных спиртов.
Исключительно удобный путь синтеза сложных эфиров в нейтральных условиях состоит в этерификации карбоновых кислот с помощью ортомуравьиного эфира или диэтилацеталя диметилформамида.
Синтетические возможности этого метода ограничиваются только доступностью исходных реагентов, поэтому практически он применим только для получения метиловых и этиловых эфиров.
18.8.1.В. Алкилирование карбоксилат-ионов
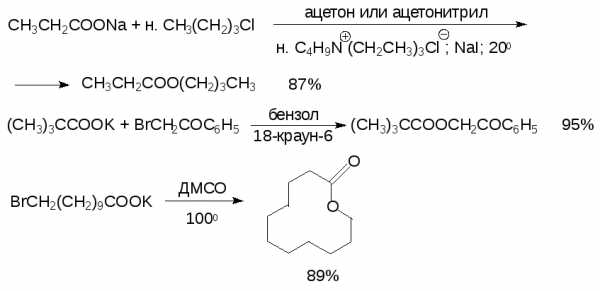
Нуклеофильное SN2 -замещение галогена в первичных и вторичных алкилгалогенидах под действием карбоксилат-иона в качестве нуклеофильного реагента широко используется сейчас для получения сложных эфиров. Ранее эта обычная реакция бимолекулярного нуклеофильного замещения имела крайне ограниченную область применения из-за низкого выхода сложных эфиров в протонных растворителях (вода, спирты), где карбоксилат-ион сильно сольватирован с помощью водородной связи и поэтому обладает низкой реакционной способностью. Метод межфазного катализа (см. гл.9) позволяет устранить этот недостаток за счет растворимости тетраалкиламмониевых солей карбоновых кислот в полярных и малополярных апротонных растворителях, и в настоящее время этот способ часто применяется для получения сложных эфиров самых разнообразных, в том числе и пространственно затрудненных кислот, где он особенно полезен. В качестве катализаторов межфазного переноса целесообразно использовать 18-краун-6-полиэфир.
18.8.1.Г. Алкоголиз нитрилов
Катализируемый кислотами алкоголиз нитрилов является хорошим и легко доступным способом создания сложноэфирной группы. Обычно из нитрила и сухого газообразного хлористого водорода в эфире после добавления спирта получается гидрохлорид имидоэфира, который выделяют в индивидуальном виде, а затем после гидролиза превращают в эфир.
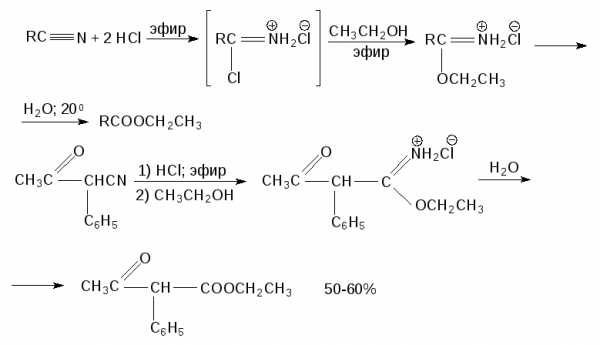
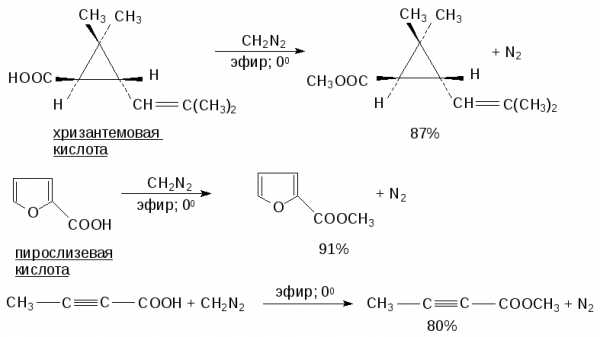
18.8.1.Д. Метилирование карбоновых кислот диазометаном
Лучшим, но и самым дорогостоящим методом получения метиловых эфиров, является открытая Г. Пехманом в 1894 году этерификация карбоновых кислот диазометаном.
Метиловый эфир образуется в исключительно мягких условиях практически с количественным выходом.
18.8.1.Е. Алкоксикарбонилирование алкилгалогенидов и винилгалогенидов
Современные методы синтеза сложных эфиров основаны на широком использовании гомогенного металлокомплексного катализа, где исходными соединениями являются алкилгалогениды, винилгалогениды и арилгалогениды. Винил- и арилгалогениды вступают в реакцию с тетракарбонилом никеля и метанолом в присутствии метилата натрия, образуя метиловые эфиры с вполне удовлетворительным выходом.
Для алкилгалогенидов можно использовать ту же самую каталитическую систему, но в качестве основания более эффективен трет-бутилат калия.
Алкоксикарбонилирование арил- , винил- и бензилгалогенидов катализируется также и фосфиновыми комплексами Pd(II) в присутствии третичного амина.
studfiles.net
Реакция этерификации и переэтерификации сложных эфиров — Мегаобучалка
СИНТЕЗ УКСУСНОИЗОАМИЛОВОГО ЭФИРА
Лабораторная работа № 1
по дисциплине «Органическая химия»
Специальность 1-49 01 02 Технология переработки и хранения животного сырья
Специализация 1-49 01 02 02 Технология молока и молочных продуктов
| Проверил к.х.н., доцент _____________Г.Н. Рогонов «___»____________2014 г. | Выполнил студент группы ТЖМ-131 _____________________ «___»___________2014 г. |
Могилев, 2014
Цель работы: Получение уксусноизоамилового эфира из 16 мл ледяной уксусной кислоты и изоамилового спирта.
Методика синтеза
Способ 1 (исходя из уксусной кислоты)
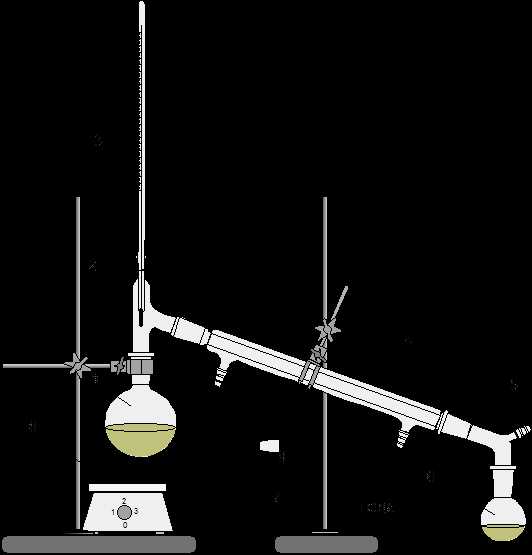
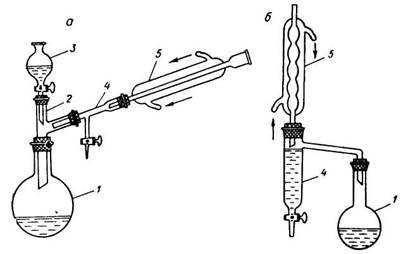
1 – перегонная колба; 2 – насадка Вюрца; 3 – термометр; 4 – холодильник нисходящий; 5 – аллонж; 6 – колба-приемник; 7 – электронагреватель;8 – штативы лабораторные.
Рисунок 1 – Установка для перегонки при атмосферном давлении
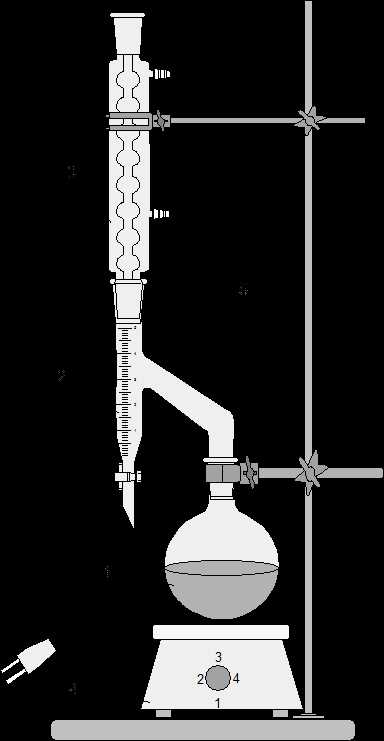
1 – реакционная колба; 2 – водоотделитель; 3 – обратный холодильник; 4 – электронагреватель; 5 – штатив лабораторный.
Рисунок 2 – Установка для синтеза с удалением воды из реакционной смеси
Выполнение синтеза
В круглодонную колбу на 100 см3 с ловушкой и обратным водяным холодильником (рис. 2) помещают смесь 14,3 см3 ледяной уксусной кислоты и 27,7 см3 изоамилового спирта. Прибавляют 4 капли концентрированной серной кислоты, бросают несколько «кипелок» и нагревают на электроплитке (рис. 2). Реакционная смесь должна кипеть. Постепенно в ловушке собирается жидкость, разделяющаяся на два слоя. Реакция считается законченной, когда количество выделившейся воды (нижний слой) будет равно вычисленному по уравнению реакции. Верхний слой из ловушки с помощью делительной воронки возвращают обратно в колбу.
После охлаждения реакционную смесь из колбы переливают в делительную воронку, промывают водой, затем 5%-ным раствором кальцинированной соды и вновь водой (до нейтральной реакции по лакмусу). Уксусноизоамиловый эфир сушат безводным сульфатом натрия или магния (до прозрачности раствора). Затем продукт перегоняют (рис.1). Собирают фракцию, кипящую при 138-142°С.
Общие методы получения сложных эфиров данного класса
Реакция этерификации и переэтерификации сложных эфиров
Реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров:
В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего бедный электронами углеродный атом карбонильной группы.
Реакции этерификации обратимы и, следовательно, ограничены состоянием равновесия. Превращение эквимолекулярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира по причине обратимости реакции невозможно. В результате реакции образуется некоторое максимальное количество эфира (которое всегда ниже теоретического) и остаются непрореагировавшие спирт и кислота. Например, при нагревании с обратным холодильником эквимолекулярных количеств уксусной кислоты и этилового спирта в реакцию вступает лишь 2/3 г-мол каждого компонента, поэтому максимальный выход эфира в этих условиях составляет лишь 2/3 теоретического, т. е. 66,7%.
По мере того как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (эфира и воды), скорость обратной реакции, вначале незначительная, возрастает. При этом скорость прямой реакции постепенно уменьшается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько же молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Одинаковой скоростью этих противоположно протекающих процессов обусловлен постоянный состав системы. Поскольку скорость бимолекулярной реакции пропорциональна произведению концентраций реагирующих веществ, мы можем для скоростей прямой и обратной реакций написать уравнения:
где v1— скорость реакции этерификации; v2— скорость реакции гидролиза; К1и К2— константы скорости обеих реакций; Ск, Сс, Сэ и Св — концентрации реагирующих и получающихся веществ (кислоты, спирта, эфира, воды).
В состоянии равновесия скорости реакций, протекающих в противоположных направлениях, равны, т. е. V1= V2. Тогда К1СкСс= КгСэСвили:
Частное К2/К1является константой равновесия и обозначается буквой К.
Из полученного уравнения следует, что в состоянии равновесия отношение произведений концентраций реагирующих веществ обратно отношению констант скоростей реакций. В случае реакции образования уксусноэтилового эфира в состоянии равновесия, как упомянуто выше, в реакционной смеси содержится по 1/3 моля кислоты и спирта и по 2/3 моля эфира и воды. Поэтому
Однако можно изменить состояние равновесия и повысить выход сложного эфира, увеличивая концентрацию спирта (или кислоты). Например, если взять уксусную кислоту и спирт в молярном отношении, равном 1:2, выход эфира (из расчета на кислоту) повышается до 85%. Действительно, пусть концентрация эфира в состоянии равновесия (в молях) будет равна х, т. е. Сэ = х. Тогда и Св = х. Концентрация кислоты Ск = 1—х, концентрация спирта Сс = 2 — х. Следовательно,
После решения этого уравнения находим, что х = 0,85 моля, то есть выход эфира равен 85% теоретического.
Часто применяется и другой способ смещения равновесия в сторону большего выхода сложного эфира — удаление сложного эфира или воды из сферы реакции. Легко можно видеть, что уменьшение концентраций эфира или воды влечет уменьшение концентраций спирта и кислоты, поскольку величина константы равновесия К при данной температуре неизменна. Так, в случае получения низкокипящих сложных эфиров (например, уксусно-этилового с температурой кипения 77°С) в ходе реакции отгоняют эфир из реакционной колбы. При получении высококипящих сложных эфиров (например, уксуснобутилового с температурой кипения 125°С или уксусноизоамилового с температурой кипения 142°С) удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропа с парами соответствующего спирта. При конденсации паров в холодильнике происходит расслоение этих ограниченно смешивающихся жидкостей и вода, как более тяжелая, собирается на дне поставленной на пути конденсата «ловушки» (см. рис. 27). Азеотропную отгонку воды можно использовать и в случае этерификации кислот этиловым или пропиловым спиртом, которые в жидкой фазе смешиваются с водой во всех отношениях. В этом случае для отделения воды от сконденсировавшегося в холодильнике спирта в реакционную смесь приходится добавлять третий компонент, образующий с водой и спиртом нераздельно кипящую смесь, но в жидкой фазе с водой не смешивающийся. Его роль состоит в том, что он экстрагирует из конденсата спирт и возвращает его в реакционный сосуд. В качестве такого компонента могут использоваться бензол, хлороформ, четыреххлористый углерод и некоторые другие жидкости, но из перечисленных только бензол можно использовать в «ловушках». Хлороформ и четыреххлористый углерод обладают большей плотностью, чем вода, и для отделения воды от реакционной смеси в случае использования этих жидкостей требуется «ловушка» другой конструкции.
При комнатной температуре реакция протекает очень медленно. При смешении эквимолярных количеств спирта и кислоты для достижения равновесных концентраций требуется до 16 лет. Повышение температуры ускоряет реакцию (так, в случае взаимодействия этилового спирта с уксусной кислотой при 110° С равновесие достигается через 10 дней, а при (155° С — через несколько часов).
Особенно сильное ускорение реакции этерификации достигается применением катализаторов — водородных ионов, получающихся при диссоциации сильных минеральных кислот. В качестве катализаторов чаще всего используются концентрированная серная кислота или сухой хлористый водород, ток которого пропускается через реакционную смесь. Найдено, что скорость реакции возрастает с увеличением количества катализатора; однако известно также, что добавка 0,01% серной кислоты достаточна для образования этилацетата из спирта и уксусной кислоты. Следует иметь в виду, что катализаторы повышают скорость реакции этерификации, но не могут вызывать сдвига равновесия.
Карбоновые кислоты, как видно из вышесказанного, реагируют со спиртами относительно медленно. Это объясняется слабой активностью карбонильной группы в кислотах по отношению к нуклеофильным агентам по сравнению с активностью той же группы в ангидридах и хлорангидридах кислот, поскольку +М-эффект гидроксильной группы приводит к уменьшению положительного заряда карбонильного углерода
Скорость этерификации карбоновой кислоты тем выше, чем больше положительный заряд карбонильного углерода. Величина δ+ на углероде карбоксильной группы зависит от характера радикала кислоты. Электронодонорные группы, связанные с карбоксилом, понижают дробный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем препятствуют взаимодействию кислоты с нуклеофилом; электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной. Поэтому кислоты типа трихлоруксусной, щавелевой, муравьиной быстро реагируют со спиртами даже без добавок минеральной кислоты-катализатора, а ароматические кислоты, особенно те, которые в ароматическом ядре содержат электронодонорные заместители, взаимодействуют со спиртом значительно труднее и требуют больших количеств катализатора.
Сильное влияние на скорость реакции этерификации оказывают также пространственные факторы. С увеличением объема связанных с карбоксилом углеводородных радикалов и с повышением объема этерифицируемых спиртов скорость этерификации уменьшается. Среди спиртов одного молекулярного веса быстрее всего взаимодействуют с кислотами первичные, медленнее — третичные спирты.
Реакцию этерификации можно проводить и в паровой фазе над твердыми катализаторами. Пары спирта и кислоты при 280—300° С пропускают через трубку с катализатором (ThO2 или TiO2). Выходы сложных эфиров в этом случае такие же, как и при реакциях в гомогенной фазе.
Аминокислоты образуют сложные эфиры при взаимодействии со спиртами в присутствии сухого хлористого водорода. Роль хлористого водорода здесь не ограничивается катализом реакции или сдвигом равновесия за счет связывания воды. В присутствии хлористого водорода аминокислота, находившаяся ранее в форме внутренней соли, превращается в хлористоводородную соль аминокислоты, причем карбоксильная группа из неактивной формы аниона переходит в реакционноспособную форму —СООН:
В результате этерификации в этих условиях эфиры также получаются в виде солей. Например, из аминоуксусной кислоты (гликоколя) и абсолютного этилового спирта образуется хлористоводородная соль эфира гликоколя
Свободный эфир из соли можно получить, удаляя хлористый водород окисью серебра:
megaobuchalka.ru
Переэтерификация — Википедия
Материал из Википедии — свободной энциклопедии
Переэтерификация через алкоголизПереэтерификация (рандомизация) — химическая реакция обмена структурных элементов сложных эфиров и гидроксильных групп спиртов. Используется в пищевой промышленности для снижения температуры плавления жиров, повышения их пластичности и стабильности к окислению кислородом воздуха.
- Обмен радикалами жирных кислот между молекулами двух разных глицеридов (межмолекулярная переэтерификация)
- Перемещение в глицеридах радикалов кислот из а- в Р-положение, и наоборот (внутримолекулярная переэтерификация)
- Обмен радикалами между глицеридом и спиртом (алкоголиз)
- Обмен радикалами между глицеридом и кислотой (ацидолиз)
Реакцию переэтерификации обеспечивает взаимодействие карбонильной группы С-0 сложного эфира со спиртовыми группами ди- и моноглицеридов.
Как катализатор обычно применяют алкоголяты щелочных металлов (метилат натрия, этилат натрия и др.), а также металлический натрий, сплав натрий-калий и др. Требуется среда инертного газа или под вакуумом при температуре 25-90 °C. В конце катализатор разрушают подкисленной водой.
При переэтерификации смесей растительных масел и животных жиров (в том числе с саломасом) получают кулинарные жиры, основу для маргаринов или спредов. Переэтерификация позволяет увеличить дозировку в маргаринах и спредах негидрированных растительных масел, что снижает содержание трансжиров.
При внутри- и межмолекулярной переэтерификации расплавленного (жидкого) жира или смеси жиров достигается статистическое распределение жирных кислот в смеси триглицеридов. Примером межмолекулярной переэтерификации может служить гидропереэтерифицированный продукт смеси подсолнечного м
ru.wikipedia.org
Сложные эфиры переэтерификация - Справочник химика 21
Взаимодействие с алкоксидами в растворе соответствующего спирта ведет к обмену алкильных групп сложного эфира (переэтерификация). Реакция является обратимой [c.576]
Равновесие переэтерификации А. др. спиртом М (OR) -(-nR OH M(OR ) -(-и ROH сдвигают вправо отгонкой азеотропа ROH с бензолом или многократным введением новых порций ROH. В случае близких т-р кипения обоих спиртов целесообразна замена ROH сложным эфиром [c.97]Упомянутые обзоры и сводки касаются всех реакций, катализируемых кислотами и основаниями гидролиза гидратации дегидратации синтеза простых и сложных эфиров переэтерификации алКилирования . конденсации разных типов полимеризации разнообразных перегруппировок и специфических реакций типа Манниха, Принса, Михаэля, Кневенагеля и т. п. Отсылая читателя к сводкам, упомянутым выше, необходимо добавить, что поток информации о применении ионитов в лабораторных и технических синтезах не иссякает. В качестве примеров приведем некоторые оригинальные работы, опубликованные в последнее время. [c.321]
Основным промышленным процессом получения из жиров базовых масел сложноэфирного типа является переэтерификация одноатомными спиртами. Наиболее распространенным является получение из растительных масел сложных метиловых, этиловых и бутиловых эфиров путем реакции алкоголиза — обмена спиртов в сложных эфирах. Экономично и технически целесообразно использование метанола, как дешевого реагента, обеспечивающего глубину алкоголиза более 90% при умеренных температурах сушественно повышает выход эфиров предварительная рафинация сырых масел (табл. 4.30, 4.31). Алкоголиз — быстро протекающая реакция, катализируемая щелочами или оксидами щелочных металлов [c.241]
Реакция переэтерификации широко используется для получения полимерных сложных эфиров, в частности полиэфиров двухосновных кислот и гликоля. [c.169]
Возможны обменные реакции между глицеридами. Жиры пред-етавляют собой смеси триглицеридов, в которых ацильные группы обычно расположены хаотично. Во время реакций переэтерификации (катализатор — оксид щелочного металла, 80—100°С, 30—60 мин) ацильные группы могут перераспределяться. Если в процессе участвуют два различных типа глицеридов (молярное соотнощение 1 1), по окончании реакции продукт имеет полностью отличные от сырья физико-химические, реологические и трибологические свойства (табл. 4.32). В том числе может повыщаться И гидролитическая стабильность (у затрудненных сложных эфиров). Такие процессы могут иметь ряд преимуществ с экономи- [c.243]
Алкоголиз сложных эфиров. Переэтерификация. [c.130]
Сложные эфиры могут быть получены реакцией карбоновой кислоты или другого ацильного производного со спиртом или подобным соединением (этерификация), реакцией сложного эфира со спиртом (алкоголиз), кислотой (ацидолиз) или другим сложным эфиром (переэтерификация). Для каждого процесса обычно необходим кислотный или основной катализатор. [c.65]
Реакция переэтерификации, или алкоголиза. Алкоголиз заключается в замещении одной спиртовой группы в сложном эфире другой спиртовой группой и протекает по схеме [c.169]
Алкоголиз сложных эфиров. Нагревание сложных эфиров в растворе спиртов может привести к обмену алкогольных радикалов (переэтерификация) [c.255]
Алкоголиз ж. протекает намного легче, чем гидролиз, поскольку в снирте Ж. более растворимы, чем в воде, п реакция в атом случае идет в гомогенной среде. Алкоголиз, так же как и гидролиз, ускоряется катализаторами (газообразный НС1). Триглицериды способны также к реакциям ацидолиза (замена одного кислотного остатка в молекуле триглицерида на другой при нагревании в присутствии соответствующей свободной жирной к-ты) и переэтерификации (взаимный обмен кислотными остатками между двумя сложными эфирами). Переэтерификации может происходить между различными триглицеридами, между триглицеридом и к.-л. другим сложным эфиром, а также внутри молекулы одного и того же триглицерида, напр. [c.32]
При получении неионогенных веществ из высших карбоновых кислот необходимо учитывать одну существенную особенность. Сложные эфиры склонны, как известно, к реакциям алкоголиза и переэтерификации, особенно при катализе алкоголятом, образующимся из щелочи. В результате этого продукты реакции представляют собой равновесную смесь полигликолей и их моно- и диэфиров [c.294]
Сложные эфиры спиртов, которые обычно реагируют с органическими кислотами с трудом, можно получать с помощью реакции переэтерификации. Последняя заключается в том, что при реакции сложного эфира со спиртом алкоксильный радикал, присутствовавший в исходном эфире, может заменяться другим по реакции [c.346]
Реакция переэтерификации в щелочной среде проводится в том случае, когда кислота, из которой был получен сложный эфир, термически неустойчива (например, -оксокарбоновая кислота) или когда в результате реакции образуется спирт, неустойчивый в кислой среде. Щелочными агентами служат алкок-сиды натрия и калия, гидроксид натрия или карбонат калня. [c.177]
Описанным методом не удается провести переэтерификацию с получением сложного эфира третичного спирта. В этом случае используют не сам третичный спирт, а его формиат [c.177]
При действии на сложные эфиры алкоголятом происходит переэтерификация [c.141]
Сложные эфиры в кислой среде могут вступать во взаимодействие со спиртами - реакция переэтерификации или алкор.ализ. При этом происходит обмен между спиртом и спиртовой частью сложного эфира [c.120]
Переэтерификация. Точно так же, как сложный эфир может подвергаться гидролизу, так эфир одного спирта может вступать в условиях кислого катализа в реакцию с другим спиртом, образуя равновесную смесь двух возможных эфиров. Аналогично эфир одного спирта будет реагировать с [c.159]
Монопальмитат и моностеарат сахарозы относятся к классу неионогенных поверхностно-активных веществ. Сложные эфиры сахарозы обычно получают переэтерификацией по схеме [c.167]
ИЗ СЛОЖНЫХ ЭФИРОВ и СПИРТОВ (РЕАКЦИЯ ПЕРЕЭТЕРИФИКАЦИИ [c.296]
ИЗ СЛОЖНЫХ ЭФИРОВ и кислот (РЕАКЦИЯ ПЕРЕЭТЕРИФИКАЦИИ) [c.298]
ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ и ПЕРЕЭТЕРИФИКАЦИЯ [c.117]
ПЕРЕЭТЕРИФИКАЦИЯ. Основная стадия катализируемого кислотами гидролиза сложных эфиров представляет собой атаку молекулы воды на протонированный эфир [c.121]
Переэтерификация. Превращение одиого сложного эфира в другой, отличающийся от первого спиртовым остатком. Переэтерификацию осуществляют обычно, нагревая до кипения (с обратным холодильником) раствор сложного эфира с избытком спнрта в присутствии следовых количеств сильной кислоты. [c.153]
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами, как показано в гл. 13 Карбоновые кислоты , разд. А.2. Р-Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Ъутиловый спирт, однако, обменивается очень медленно [118]. [c.297]
Аналогично проводят и реакции переэтерификации тетраалк-оксисиланов со сложными эфирами карбоновых кислот по общей схеме [c.546]
Этерификация спиртов, механизм которой был улсе рассмотрен на стр. 97, может быть осуществлена со всеми неорганическими и органическими кислотами или их производными (галоидангидридами, ангидридами и т. п.). С получающимися при этом весьма важными продуктами, сложными эфирами, мы подробно ознакомимся в другой главе. Здесь мы приведем лишь одно из общих свойств эфиров, заключающееся в том, что при нагревании с другими спиртами или другими сложными эфирами они, как показали Клайзен, Пурди, Бертони, Халлер, Анри и др., вступают в реакцию обмена, причем спиртовые остатки более или менее полно меняются местами. Эта реакция носит название переэтерификации и каталитически ускоряется в присутствии небольших количеств кислот или щелочей [c.116]
При этом сложный эфир одного состава превращается в сложный эфир другого состава (остаток одного спирта замещается остатком другого спирта). Такая реакция называется переэтерификацией. Полученный переэтерификацией дигликолевый эфир терефталевой кислоты при более высокой температуре (270—280° С) конденсируется по схеме [c.218]
Механизмы переэтерификации (см. обзор [553]) идентичны механизмам гидролиза сложных эфиров, за исключением того, что вместо НОН действуют ROH, т. е. это механизмы с разрывом связи между ацильной группой и атомом кислорода. Если происходит алкильное расщепление, то образуется кислота и простой эфир [c.130]
Тенденция к аналогичному разрыву связи алкил — кислород имеет место также в случае эфиров таких вторичных спиртов, как РЬгСНОН, образующих наиболее устойчивые карбониевые ионы. Попытки осуществить переэтерификацию сложных эфиров, образованных такими спиртами, привели не к ожидаемому новому сложному эфиру, а к смеси кислота простой эфир [c.228]
Для получения сложных эфиров можно использовать в качестве исходных веществ также эфиры соответствующей кислоты с другими спиртами. Подобный алкоголиз эфиров карбоновых кислот (переэтерификация) может в отличие от обычной этерификации катализоваться как кислотами, так и основаниями. (Напишите уравнения реакций ) В этом случае также имеют место типичные равновесные превращения. [c.78]
В трехгорлой колбе емкостью 1 л, снабженной мешалкой, обратным холодильником, капельной воронкой и хлоркальциевой трубкой, готовят раствор алкоголята натрия, исходя из 1 г-атом натрия и 500 мл абсолютного спирта (при реакциях со сложными эфирами спирт должен быть тот, остаток которого содержится в эфире, если только не ставится цель провести переэтерификацию методику приготовления раствора алкголята иатрия см. в разд. Е). К еще горячему раствору алкоголята прибавляют по каплям 1 моль 3-дикарбонильного соединения и затем 1,05 моля алкилирующего средства. Прибавление ведут при перемешивании с такой скоростью, чтобы реакционная смесь умеренно кипела. Затем реакционную смесь нагревают при перемешивании до тех пор, пока проба не будет показывать нейтральную реакцию (2—16 ч) отгоняют основную массу спирта в слабом вакууме при перемешивании (иначе кипение сопровождается сильными толчками из-за осадка соли). Спирт может быть использован для повторных аналогичных сиитезов (регенерируется абсолютный спирт. Перегонную колбу охлаждают и к остатку прибавляют такое количество ледяной воды, чтобы ее как раз хватило для растворения выделившейся соли, отделяют в делительной воронке органический слой, а водный дважды экстрагируют эфиром. Объединенные органические слои сушат сульфатом натрия, отгоняют растворитель, а остаток фракционируют на 30-сантиметровой колонке Вигре. [c.176]
Надуксусная [20, 211, надбензойная [22] и надтрифторуксусная [231 кислоты, перекись водорода с трех фтористым бором [24], кислота Каро [19], надмалеиновая кислота [251 и имеющаяся в продаже м-хлорнадбензойная кислота — все эти реагенты применяют в качестве окислителей. Из них особенно привлекательна надтрифторуксусная кислота. При применении этого реагента можно избежать переэтерификации сложного эфира кислотой, проводя реакцию в буферном растворе, например в кислом динатрийфосфате. Выходы в этой реакции получаются различные, но они могут составлять и 80— 90%. [c.313]
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, см. Элемент.ы химические. ПЕРЕЭТЕРИФИКАЦИЯ, замена одного спиртового или кислотного остатка в молекуле сложного эфира на другой. Происходит ири взаимод. эфира со спиртом (алкоголг53, р-ция 1), с карбоновой к-той (ацидолиз, р-ция 2) или с др. сложным эфиром (двойной обмен, р-ция 3) [c.431]
Благодаря каталитическому влиянию алкоголятов алюминия на переэтерификацию сложных эфиров восстановление сложных эфиров оксикетонов обычно сопровождается отщеплеиисм ацильного остатка и продукт реакции представляет собой гликоль. Простые эфиры и йцетали при этом не расщепляются. Примером может служить восстановление уксуснокислого эфира LII, f результате которого был получен гликоль LIII с выходом 94 /,, [42]. [c.210]
Лаб. способы получения сложных эфиров действие,на целлюлозу изоцианатов (Ц. э. карбаминовой к-ты - замещ -ные уретаны, карбанилаты целлюлозы) переэтерификация (бораты, фосфаты, стеарат целлюлозы). При синтезе Ц. э. в кислой среде побочные продукты почти не образуются. [c.338]
chem21.info
Переэтерификации реакция - Справочник химика 21
Переэтерификация Реакцию этого типа можно пред-ить следующим образом [c.679]
Взаимодействие с алкоксидами в растворе соответствующего спирта ведет к обмену алкильных групп сложного эфира (переэтерификация). Реакция является обратимой [c.576]
Обычно для реакции переэтерификации применяют в качестве катализаторов едкую щелочь или алкоголят. Используя избыток высококипящего спирта R OH и непрерывно отгоняя из реакционной смеси низкокипящий спирт R OH, равновесие реакции (10) можно полностью сдвинуть в правую сторону. [c.346]
Термостабильность таких смешанных поликарбонатов меньше, чем ароматических, что должно быть принято во внимание при переэтерификации реакцию следует проводить в мягких условиях, применяя очень небольшие количества щелочных катализаторов. Это возможно во многих случаях потому, что температура плавления смешанных поликарбонатов из ароматических и алифатических диоксисоединений ниже, чем чистых ароматических поликарбонатов или смешанных поликарбонатов с большим содержанием ароматических звеньев. Температура переэтерификации не должна превышать 200° С (максимальная 250° С). При более высокой температуре смешанный поликарбонат на основе 2,2-ди-(4-оксифенил)-про-пана и этиленгликоля превращается в ароматический [c.69]
Основным промышленным процессом получения из жиров базовых масел сложноэфирного типа является переэтерификация одноатомными спиртами. Наиболее распространенным является получение из растительных масел сложных метиловых, этиловых и бутиловых эфиров путем реакции алкоголиза — обмена спиртов в сложных эфирах. Экономично и технически целесообразно использование метанола, как дешевого реагента, обеспечивающего глубину алкоголиза более 90% при умеренных температурах сушественно повышает выход эфиров предварительная рафинация сырых масел (табл. 4.30, 4.31). Алкоголиз — быстро протекающая реакция, катализируемая щелочами или оксидами щелочных металлов [c.241]
Равновесие при алкоголизе, ацидолизе и переэтерификации определяется равновесием соответствующих реакций этерификации. Так, при алкоголизе и [c.237]
В каких условиях проводится переэтерификация ДМТ этиленгликолем и как обеспечивается полнота протекания этой реакции [c.368]
В четырехгорлую колбу помещают льняное масло, глицерин и углекислый натрий и содержимое колбы нагревают при перемешивании до 240° С. Эту температуру выдерживают до тех пор, пока не пройдет реакция переэтерификации. Реакцию считают законченной, если проба растворяется в этиловом спирте-ректификате (1 10). По окончании реакции содержимое колбы охлаждают до 200° С и вводят фталевый ангидрид. Затем включают обогрев и с постоянной скоростью добавляют ксилол (предварительно разделительный сосуд заполняют ксилолом до переливной трубки). [c.45]
Переэтерификация ДМТ этиленгликолем представляет обратимую реакцию алкоголиза, описываемую уравнением [c.366]
При получении неионогенных веществ из высших карбоновых кислот необходимо учитывать одну существенную особенность. Сложные эфиры склонны, как известно, к реакциям алкоголиза и переэтерификации, особенно при катализе алкоголятом, образующимся из щелочи. В результате этого продукты реакции представляют собой равновесную смесь полигликолей и их моно- и диэфиров [c.294]
Реакции переэтерификации, по-видимому, часто протекают в организмах животных и растений. [c.116]
Эффективность действия катализатора реакции переэтерификации характеризуется объемом метанола V, отгоняемого в единицу времени (рис. 16.7). Из рисунка следует, что из двух катализаторов (ацетата цинка и ацетата кобальта) более эффективным является первый. При этом, на обоих катализаторах [c.366]
Возможны обменные реакции между глицеридами. Жиры пред-етавляют собой смеси триглицеридов, в которых ацильные группы обычно расположены хаотично. Во время реакций переэтерификации (катализатор — оксид щелочного металла, 80—100°С, 30—60 мин) ацильные группы могут перераспределяться. Если в процессе участвуют два различных типа глицеридов (молярное соотнощение 1 1), по окончании реакции продукт имеет полностью отличные от сырья физико-химические, реологические и трибологические свойства (табл. 4.32). В том числе может повыщаться И гидролитическая стабильность (у затрудненных сложных эфиров). Такие процессы могут иметь ряд преимуществ с экономи- [c.243]
Побочными продуктами реакции переэтерификации являются низкомолекулярные полиэфиры со степенью полимеризации 2—4. [c.367]
Сложные эфиры спиртов, которые обычно реагируют с органическими кислотами с трудом, можно получать с помощью реакции переэтерификации. Последняя заключается в том, что при реакции сложного эфира со спиртом алкоксильный радикал, присутствовавший в исходном эфире, может заменяться другим по реакции [c.346]
Реакция переэтерификации, или алкоголиза. Алкоголиз заключается в замещении одной спиртовой группы в сложном эфире другой спиртовой группой и протекает по схеме [c.169]
Реакции алкоголиза имеют и техническое значение. Например, борнилацетат пихтового масла с метиловым спиртом превращается в борнеол и метилацетат. Метилацетат, полученный при сухой перегонке древесины методом переэтерификации с бутанолом или пен-танолом, можно перевести в бутил- или амилацетаты. [c.546]
Практическое значение эта реакция имеет в том случае, когда Н = СНз. Тогда образующийся в результате переэтерификации метиловый эфир можно отгонять из сферы реакции. [c.176]
Исследована переэтерификация рисового масла непосредственно после рафинации в присутствии серной кислоты в качестве катализатора [233]. При использовании метанола процесс проходит в течение 15 мин с получением практически чистых метиловых эфиров реакция с этанолом менее эффективна. [c.243]
Реакция переэтерификации. В ходе этой реакции происходит замеш,ение группы 01 на ОК", Она катализируется как кислотами, так и щелочами [c.176]
Реакция переэтерификации в щелочной среде проводится в том случае, когда кислота, из которой был получен сложный эфир, термически неустойчива (например, -оксокарбоновая кислота) или когда в результате реакции образуется спирт, неустойчивый в кислой среде. Щелочными агентами служат алкок-сиды натрия и калия, гидроксид натрия или карбонат калня. [c.177]
Среди синтетических масел, обладающих высокой термической стабильностью и отличными низкотемпературными свойствами, одно из ведущих мест занимают сложноэфирные масла. Синтезировано очень много различных эфиров органических кислот, которые были испы таны в качестве основы синтетических масел, и выявлены наиболее эффективные из них. Все сложноэфирные масла получают по единой технологии взаимодействием спиртов и кислот в присутствии кислотного катализатора при повышенной температуре (100—200 °С) с удалением из зоны реакции образовавшейся воды. Реже применяют реакцию переэтерификации. В качестве катализаторов используют серную кислоту, сульфокислоты, катиониты и др. - [c.156]
Механизм переэтерификации в щелочной среде соответствует механизму, описанному для щелочного гидролиза. При катализе щелочами собственно реакции переэтерификации предшествует равновесный процесс [c.177]
Термодинамика реакций этерификации. Взаимодействие спиртов с карбоновыми кислотами в жидкой фазе протекает практически без какого-либо поглощения или выделения тепла (АЯ = 0). Соответствеино, алкоголиз, ацидолиз и переэтерификация также имею тепловой эффект, близкий к нулю. Следовательно, константы равновесия этих реакций ие зависят от температуры. В отличие от этого, этерификация спиртов хлораигидрндами кислот, а также первая стадия этерификации спиртов ангидридами являются экютермическими процессами. [c.205]
Снятие ацетильных защитных групп при переэтерификации (реакция мплена) и бензилиде-новой защитной группы гидрогенолизом Число стадий 7 Общий выход 15% [c.643]
Для расщепления связи пептид-полимер с образованием эфира пептида Бейерман [34г] предложил катализируемую третичными аминами триэтиламин, М-метилпиперидчн) переэтерификацию. Реакция проводится в мягких условиях (4—15 час, комнатная температура). [c.221]Гидроксильные и алкоксигруппы на концах макромолекул полисилоксанов обладают высокой реакционной способностью, намного превосходящей активность спиртовой гидроксильной и эфирной группы. Это свойство полисилоксанов открывает широкие возможности для синтеза разнообразных полимерных кремнийорганических соединений. Свойства полисилоксанов можно модифицировать путем химического взаимодействия низкомолекулярных фракций полисилоксана с различными органическими соединениями, в том числе и с органическими полимерами. Так, полиорганосилоксаны, содержащие на концах макромолекул алкоксигруппы, вступают в реакцию переэтерификации с алкидными смолами, имеющими гидроксильные концевые группы, а также с эпоксидными полимерами. При взаимодействии алкилацетоксисиланов со спиртами в молекулы мономера можно вводить различные радикалы, содержащие функциональные группы. Пользуясь этой реакцией, можно ввести в состав полисилоксана эпоксигруппы [c.496]
Диэтиленгликольдиметакрилат в лабораторных условиях можно получать из метилметакрилата и диэтиленгликоля методом переэтерификации. Реакция идет по схеме [c.143]
Он назвал этот тип переэтерификации реакция перераспределения и нашел, что при 223 и 254° С константы скорости реакции перераспределения составляют 1,9-10 н 12-10 л-молъ -час , соответственно, т. е. являются величинами того же порядка, что и константы скорости поликонденсации. Интересно, что благодаря более высокой энергии активации реакции перераспределения (31 ккал/моль против 23 ккал моль Для ноликонденсации) при высоких температурах (например, при 280° С), характерных для синтеза полиэтилентерефталата на последних стадиях проведения процесса, константа скорости перераспределения превышает константу скорости поликонденеации. Это наглядно показывает, какую большую роль может играть обменное взаимодействие между полимерными цепями. Протекая при высоких температурах [c.78]
Еще более высокомолекулярные линейные полимеры получают [1ереэтерификацией метиловых или этиловых эфиров двухосновных кислот гликолями, так как выделяющийся при этом спирт (метиловый или этиловый) легче удаляется из сферы реакции, чем вода. В связи с. этим для получения линейных высокомолекулярных полиэфиров предпочитают использовать третий метод поликонденсации—переэтерификацию. В процессе поликонденса-цин бифункциональных веществ количество функциональных групп в образующейся полимерной цепи на всех ступенях реакции остается постоянным (две группы). Такую реакцию очень легко прекратить экранированием хотя бы одной функциональной группы. [c.418]
Пример VII1-9. В трехступенчатом каскаде реакторов с мешалками, проводится реакция переэтерификации трифенилхлорметана в растворе бензола с добавкой пиридина. Уравнение реакции [c.312]
Низкомолекулярньи продукты поликонденсации многоатомных спиртов и фталевого ангидрида легко вступают в реакцию этерификации с ненасыщенными высшими жирными кислотами илп в реакцию переэтерификации с высыхающими маслами. [c.425]
Эта реакция до 280 С протекает очень медленно. Небольшое ускоряющее действие оказывают кислотные катализаторы, однако наиболее эффективны вещества основного характера щелочные и щелочноземельные металлы и их окислы, а также гидриды, амиды, окислы других металлов (цинка, свинца, сурьмы) Условия проведения переэтерификации следующие . Вследствие того что переэтерификация является равновесной реакцией, для получения высокомолекулярного поликарбоната с высокими выходами необходимо удалять образующийся фенол из реакционной смеси. Реакцию проводят при 150—300 X в вакууме. Основное количество фенола удаляется до 210 °С и при остаточном давлении 20 мм рт. ст. Затем давление понижают до 0,2 мм рт. ст., а температуру повышают до 280 X. При этом удаляются остатки фенола, а образовавшийся на первой стадии низкомолекулярный поликарбонат с концевыми фенилкарбонатными группами превращается в высокомолекулярный поликарбонат [c.45]
Реакции каталитического алкоголиза и переэтерификации находят значительное применение для синтеза труднодоступных иными методами элементоорганических, в частности кремнеорганических, соединений. Исходя из доступных тетраметокси- (СНзО)431 или тетраэтоксисиланов (С2Н50)451 нагреванием с любыми одно-или многоатомными спиртами, фенолами или гомологами фенола, можно получать соответствующие тетраалк(ар)оксисиланы [c.546]
Аналогично проводят и реакции переэтерификации тетраалк-оксисиланов со сложными эфирами карбоновых кислот по общей схеме [c.546]
Сложные эфиры в кислой среде могут вступать во взаимодействие со спиртами - реакция переэтерификации или а.шоголиз. При этом происходит обмен между спиртом и спиртовой частью сложного эфира [c.120]
Этерификация спиртов, механизм которой был улсе рассмотрен на стр. 97, может быть осуществлена со всеми неорганическими и органическими кислотами или их производными (галоидангидридами, ангидридами и т. п.). С получающимися при этом весьма важными продуктами, сложными эфирами, мы подробно ознакомимся в другой главе. Здесь мы приведем лишь одно из общих свойств эфиров, заключающееся в том, что при нагревании с другими спиртами или другими сложными эфирами они, как показали Клайзен, Пурди, Бертони, Халлер, Анри и др., вступают в реакцию обмена, причем спиртовые остатки более или менее полно меняются местами. Эта реакция носит название переэтерификации и каталитически ускоряется в присутствии небольших количеств кислот или щелочей [c.116]
Полимерные эфиры угольной кислоты получают взаимодействием хлорангидрида угольной кислоты с многоатомными спиртами и дифенолами в присутствии веществ, вступающих в реакцию с выделяющимся хлористым водородом. Поликарбонаты можно получать и другими методами, например переэтерификацией эфиров угольной кислоты диоксисоединениями в присутствии катализаторов (соли, окислы металлов и др.). В зависимости от выбора многоатомного спирта или фенола можно получить полимеры линейной или пространственной структуры. Наибольший интерес представляют термопластичнрле полимеры, синтез которых осуществляется с участием двухатомных фенолов. Высокомолекулярные поликарбонаты, молекулярный вес которых достигает 50 ООО, получают прп действии фосгена на дифенилолпро-пан в присутствии щелочного катализатора при 150—300° [c.426]
Эфиры ортотитановой кислоты и одноатомных спиртов Ti(OR) . легковступают в реакцию переэтерификации с высшими спиртами, особенно с многоатомными. Эфиры ортотитановой кислоты и многоатомных спиртов устойчивы к гидролитическому воздействию воды и водяного пара. Очевидно, между многоатомными спиртами и титаном возникают не только ковалентные, но и координационные связи, что приводит к повышению стабильности таких соединений. [c.498]
Реакция переэтерификации эфиров титановой кислоты типа Т1(0К) с многоатомными спиртами протекает настолько быстро, что нет необходимости повышать температуру. Реакцию переэтерификации можно приостановить введением оксикетонов, оксиальде-гидов, дикетонов. После удаления этих веществ вновь начинается переэтерификация эфиров титановой кислоты. [c.499]
chem21.info
Переэтерификация катализируемая спиртами - Справочник химика 21
Для получения сложных эфиров можно использовать в качестве исходных веществ также и эфиры соответствующей кислоты с другими спиртами. Подобный алкоголиз эфиров карбоновых кислот (переэтерификация) может в противоположность обычной этерификации катализироваться как кислотами, так и основаниями. (Напишите уравнения реакций ) В этом случае также имеют место типичные равновесные превращения. [c.389]
Быстрый обмен алкильных групп может быть вызван и присутствием каталитического количества алкоголята натрия. Боргидрид натрия также катализирует переэтерификацию. Так, если использовать этиловый спирт в качестве растворителя при восстановлении метилового эфира кетокислоты боргидридом натрия, то продуктом восстановления может оказаться этиловый эфир оксикислоты. [c.441]Реакции переэтерификации между органическими эфирами и спиртами, или между двумя органическими эфирами хорошо катализируются ортотитанатами [74]. [c.56]
Переэтерификация катализируется кислотами или основаниями [551]. Это обратимая реакция и равновесие необходимо смещать в желаемую сторону. Во многих случаях низкокипя-щие эфиры можно превратить в более высококипящие путем отгонки низкокипящего спирта по мере его образования. Эта реакция была использована как метод ацилирования первичных ОН-групп в присутствии вторичных ОН-групп. Диол обрабатывают этилацетатом в присутствии нейтрального оксида алюминия по Вёльму [552]. Лактоны легко раскрываются при обработке спиртами и образуются гидроксиэфиры с открытой цепью [c.130]
При щелочном гидролизе нуклеофильная атака гидроксильным ионом происходит по карбонильному атому углерода молекулы сложного эфира (механизм АсВг). Все стадии реакцир обратимы, кроме стадии, на которой образуется карбоксилатный ион, не присоединяющий протон. Однако реакция переэтерификации эфира спиртом в отсутствие воды обратима и катализируется ионом алкоголята. [c.95]
На.ми предложен метод синтеза алкильных эфиров салициловой кислоты с К С3 в алкильном остатке переэтерификацией метилсалицилата спиртами в присутствии катализаторов основного характера — 5—10%-ных растворов алкоголятов щелочных и щелочноземельных металлов, Серная кислота и л-толуолсульфохлорид (в количестве 10 мол. %) не катализируют обмен алкоксильной группы в салицилатах. [c.236]
Переэтерификация спирта ми, фенолами и меркаптанами, как правило, требует применения кислотного катализатора, в то время как в случае карбоновых кислот, по-видимому, сам реагент обладает достаточной кислотностью, чтобы катализировать реакцию. Очевидно, ЧТО в этих условиях реакции переэтерификации протекают с участием карбониевого катиона по следующему механизму [c.33]
Алкоголяты титана являются эффективными катализаторами переэтери-фикации сложных эфиров одноатомными спиртами [1, 2]. Тетрабутоксититан (ТБОТ) производится отечественной промышленностью. В отличие от алко-голятов щелочных металлов, широко используемых в качестве катализаторов переэтерификации, ТБОТ не катализирует реакции присоединения спиртов по двойным связям акрилатов и метакрилатов. [c.42]
Указанных недостатков практически лишен совмещенный реак-ционно-ректифйкационный процесс, разработанный Явшицем и Рейхсфельдом [382]. В этом процессе катионит КУ-2-8 не только катализирует реакцию переэтерификации, но и выполняет роль насадки в ректификационной колонне, служащей для разделения продуктов реакции. Благодаря этому не вступившие в реакцию высококипящие продукты — метилметакрилат и высшие спирты — могут реагировать в ходе ректификации, а легкий продукт реакции — метиловый спирт — удаляться из сферы реакции, что обеспечивает сдвиг равновесия в сторону целевого продукта. [c.323]
Некоторые эфиры метакриловой кислоты, в частности бензил-метакрилат, удается синтезировать с высокой степенью чистоты переэтерификацией при щелочном катализе [141. Для этого приготавливают безводный бензилалкоголят, катализирующий пере-этерификацию метилметакрилата, приче.м спиртовой компонент вступает в реакцию. В ходе реакции выделяется метанол, который тотчас же отгоняется. После его удаления производят отгонку избыточного метилметакрилата и непрореагировавшего бен-зилового спирта, а оставшуюся смесь после промывки перегоняют под высоким вакуумо.м, получая чистый бензилметакрилат. [c.15]
Точно так же можно произвести переэтерификацию метилового или этилового эфира, нагревая его с избытком какого-либо иного безводпого спирта. Эту обратимую реакцию катализируют пе только сильными кислотами, например серной или ароматической сульфокислотой, но и алкоголятами [2051, 2091а, 2124—2135], например [c.442]
Важным методом синтеза эфиров, в основном тех, которые затруднительно получить прямой этерификацией, является переэтерификация, которую катализируют основаниями. Используют также и другие подходы действие на спирты ангидридами и хлорангидридами карбоновых кислот (в присутствии оснований) взаимодействие карбоновых кислот с олефинами (кислый катализ, повышенное давление) карбонилирова-ние спиртов в присутствии олефинов (катализ карбонилами кобальта и рения). [c.88]
chem21.info
Эфиры карбоновых кислот переэтерификация - Справочник химика 21
Переэтерификация. При алкоголизе возможно заменить один спиртовый остаток в сложном эфире карбоновой кислоты на другой. Эта переэтерификация с обменом спиртовой компоненты катализируется как кислотами, так и основаниями. [c.413]
Реакции гидроксильных производных с функциональными производными карбоновых кислот. Спирты, фенолы и другие гидроксильные производные легко реагируют с ацилхлоридами и ангидридами кислот. Известны также реакции спиртов со сложными эфирами карбоновых кислот, особенно в присутствии кислот или оснований (реакции переэтерификации) [c.574]
Термодинамика реакций этерификации. Взаимодействие спиртов с некоторыми неорганическими кислотами (серной, азотной) является экзотермическим процессом, но с карбоновыми кислотами они реагируют практически без выделения или поглощения тепла (—АНш О). Соответственно кислотный гидролиз эфиров карбоновых кислот, а также алкоголиз, ацидолиз и переэтерификация тоже имеют тепловой эффект, близкий к нулю. Следовательно, константы равновесия всех этих реакций должны мало зависеть от температуры. [c.258]
Механизм переэтерификации эфиров карбоновых кислот аналогичен рассмотренному [c.138]
Аналогично эфирам карбоновых кислот в реакцию переэтерификации вступают также эфиры неорганических кислот, например борной кислоты [c.185]
При попытке переэтерификации метилметакрилата 3-нафтолом образуется метакриловая кислота. В этом случае вместо ожидаемого -нафтил-метакрилата был получен метиловый эфир Р-нафтола и свободная метакриловая кислота. Это редчайший случай, когда эфир карбоновой кислоты ведет себя как алки-лирующий агент [c.99]
Основными промышленными методами получения пластификаторов являются этерификация карбоновых кислот гидроксилсодержащими соединениями, взаимодействие ангидридов карбоновых кислот со спиртамII или фенолами, синтез из хлорангидридов карбоновых кислот и спиртов, переэтерификация эфиров карбоновых кислот спиртами, или гликолями. В последнее время появились сообщения о некоторых специальных методах синтеза, которые могут рассматриваться как перспективные для производства пластификаторов. [c.7]
Одновременно возможно протекание и побочных реакций гидрогенизация спиртов до углеводородов, дегидратация спиртов, переэтерификация сложных эфиров. Однако эти реакции до сих пор практически не изучены. Предполагают, что гидрирование протекает в несколько стадий. Вначале при взаимодействии с эфиром карбоновой кислоты образуется полуаце- [c.104]
При получении неионогенных веществ из высших карбоновых кислот необходимо учитывать одну существенную особенность. Сложные эфиры склонны, как известно, к реакциям алкоголиза и переэтерификации, особенно при катализе алкоголятом, образующимся из щелочи. В результате этого продукты реакции представляют собой равновесную смесь полигликолей и их моно- и диэфиров [c.294]
Эфиры можно также получить при взаимодействии спирта с ацилхлоридами (разд. 8.5.2), с ангидридами карбоновых кислот (разд. 8.5.2) в условиях кислого катализа с амидами (разд. 8.9.3) или нитрилами, а также путем переэтерификации. [c.158]
Переэтерификацией называют также реакции замены радикалов в сложных эфирах прн взаимодействии с карбоновыми кислотами или сложными эфи- [c.308]
Сложные эфиры могут быть получены реакцией карбоновой кислоты или другого ацильного производного со спиртом или подобным соединением (этерификация), реакцией сложного эфира со спиртом (алкоголиз), кислотой (ацидолиз) или другим сложным эфиром (переэтерификация). Для каждого процесса обычно необходим кислотный или основной катализатор. [c.65]
Спирты применяют для перекристаллизации самых разнообразных органических соединений, включая и соли органических кислот и оснований. Следует помнить, что при перекристаллизации сложных иров может произойти переэтерификация (алкоголиз) с образованием сложного эфира того спирта, который является растворителем. При перекристаллизации органических кислот из спиртов также легко могут образовываться сложные эфиры особенно легко происходит образование сложных эфиров из хлоргидратов аминокислот. Аналогично при перекристаллизации карбоновых кислот из этилацетата нередко наблюдается образование соответствующих этиловых эфиров. [c.53]
Наибольшее значение имеет алкоголиз сложных эфиров, нередко используемый для практических синтезов. Алкоголиз, ацидолиз и переэтерификация, как и этерификация карбоновыми кислотами, катализируются сильными кислотами. [c.194]
Аналогично проводят и реакции переэтерификации тетраалк-оксисиланов со сложными эфирами карбоновых кислот по общей схеме [c.546]
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами, как показано в гл. 13 Карбоновые кислоты , разд. А.2. Р-Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Ъутиловый спирт, однако, обменивается очень медленно [118]. [c.297]
Эфиры ортотитановой кислоты используются и в качестве катализаторов полимеризации непредельных соединений — как компоненты каталитической системы Циглера — Натта и непосредственно — для полимеризации а-олефинов, бутадиена, изопрена,, стирола и т. д. Эфиры ортотитановой кислоты являются хорошими катализаторами и для реакций переэтерификации. Так, при проведении реакций переэтерификации эфиров карбоновых кислот спиртами или другими эфирами может быть использован в качестве катализатора тетраизопропоксититан. Различные тетраалкоксититаны можно также использовать в реакциях переэтерификации эфиров ортокремневой кислоты спиртами, фенолами или эфирами карбоновых кислот. [c.380]
Первоначально образующийся монооксалат глицерина подвергается декарбоксилированию с образованием моиоформиата глицерина, из которого переэтерификацией if M. раздел 2.2.5.2, реакции эфиров карбоновых кислот, реакция (2)] с избытком щавелевой кислоты выделяется муравьиная кислота. [c.398]
Среди большого числа методов синтеза эфиров карбоновых кислот flOl] широкое практическое применение получили методы, основанные на взаимодействии сп1фтов с карбоновыми кислотами или шс ангидридами (этери икация), сложншш эфирами (переэтерификация) или хлор-ангидридами кислот. [c.33]
Если хотят получить высший эфир карбоновой кислоты, то лучше всего взять в качестве исходного вещества метиловый эфир этой карбоновой кислоты и отгонять из равновесной смеси метиловый спирт (см. табл. 89 тери-леновое волокно). За исключением этого случая, спирт, который желательно превратить в сложный эфир, всегда необходимо вводить в избытке. Препаративный пример переэтерификации приведен также на стр. 465 (метиловый эфир 4-фенилацетоуксусной кислоты из этилового эфира 2-фе-нилацетоуксусной кислоты). (Напишите схему превращения ) [c.389]
Реакция (1-156) включает простую переэтерификацию, в то время как в реакции (1-157) продукты переэтерификации отщепляют уксу сную кислоту, в результате чего регенериру-ется нуклеофил. Таки.м образом, можно провести определенную аналогию в поведении гидратированной карбоиильно[ группы в части активного центра гидролитических ферментов. Константы скорости второго порядка реакции замещенного фенолят-иона с л-нитрофенилацетатом связаны с величиной рК а фенолов соотношением Бренстеда. Ни фенолят-, нн хлорат-анионы не способны реагировать с алкиловыми эфирами карбоновых кислот путем замещения более основного алкокси-иона. [c.110]
В ряде реакций в качестве катализатора используются алкоголяты калия. Сложные эфиры вторичных и третичных спиртов получают переэтерификацией эфиров карбоновых кислот соответствующими спиртами. Реакция проводится в исходном эфире при его кипении . Из фурола с хорошим выходом образуется -2-фур ил-акриловая кислота а из бигуанамида и эфира ароматической карбоновой кислоты— арилгуанамины . Реакциями циклизации получены продукты замещения 2,5-дигидрофурана и индолов 2°. [c.179]
Метод переэтерификации метиловых или этиловых эфиров карбоновых кислот МЭ в присутствии тетрабутоксититана в условиях азеотропной отгонки выделяющихся спиртов (растворитель толуол) позволяет получать МЭБ высокой чистоты с выходом 50—52% от теоретического. Для получения МЭЭ дикарбоновых кислот применение этого метода не це 1есооб разно из-за низкого выхода (25—30%) и трудности выделения целевых нродуктов. [c.81]
Изопропилортотнтанат приведен в качестве примера катализатора реакции переэтерификации эфиров карбоновых кислот [c.241]
Димеколин получают переэтерификацией этилового эфира 1, 6-ди-метилггаперидин-2-карбоновой кислоты (I) Р-диметиламиноэтанолом [3]. Образующийся при этом р-диметиламиноэтиловый эфир 1, 6-диметил-пиперидин-2-карбоновой кислоты (II) при взаимодействии с йодистым метилом образует димеколин (III) [4]. [c.201]
Сложные эфиры получаются при взаимодействии кислот со спиртами (этерификация), при взаимодействии хлорангидридов или ангидридов кислот со спиртами, в результате реакции переэтерификации или алкоголйза, при действии галогеналкилов на соли карбоновых кислот, диазометановым методом, по реакции В. Е. Тищенко и т. д. [c.152]
Переэтер1 икация сложных эфиров осуществляется щЗи воздейст-вш на них как спиртов, так и карбоновых кислот и представляет собой равновесный процесс, который можно вести в заданном направлении [lOl], Однако промыпшенная применимость переэтерификации ограничена малой доступностью исходных сложных эфиров, [c.33]
Так, например, в процессе щелочного гидролиза сложных эфиров нуклеофильная атака иона ОНЭ на карбонильную группу приводит к образованию структуры I, дальнейшие превращения которой могут протекать по двум направлениям. Согласно схеме б, это превращение сопровождается отщеплением гидроксила, что эквивалентно простому разложению. Согласное, наоборот, отщепляетсяалкок-сигруппа и образуется свободная карбоновая кислота (II). Хотя алкокси-ион является более основным, чем ион ОНЭ, реакция нап-, равляется по пути в, поскольку равновесие постоянно сдвигается вследствие того, что сильное основание К—0 связывает протоны, возникающие в результате диссоциации кислоты II, или отним а-ет протоны от среды. Реакции переэтерификации происходят по аналогичной схеме. Течение их всегда полностью обратимо, замещение одной алкоксильной группы на другую приводит к образованию сложного эфира, не способного к ионизации. [c.190]
Циклогексанкар-боновая кислота, С12 0 б р а 3 Терефталевая кислота, метиловый спирт Хлорциклогексан-карбоновая кислота звание сложных Диметилтерефталат Хлориды, оксихлориды, окислы и кислородные кислоты Sb 30—100° С [186] эфиров. Переэтерификация SbjOg с добавками элементарных Мп, Си и Zn, их солей и окислов (0,01—0,5% от веса SbaOg) 260° С, 20 мин [4341 [c.698]
Диэтилазодикарбоксилат (ДАД) и третичные фосфины образуют комплексы, способные активировать гидроксильные группы. При такой активации реакции замещения гидроксила протекают в мягких условиях и не сопровождаются перегруппировками, как показано на примере взаимодействия частично ацилированного глицерина (64) с карбоновыми кислотами в присутствии трифенилфосфина и ДАД (уравнение 97) [103]. Предложен простой метод получения простых алкилариловых эфиров [104] путем обработки спирта фенолом (или енолом) в присутствии третичного-фосфина и ДАД. Эта реакция протекает с обращением конфигурации у спиртового атома углерода. Комплексы третичный фосфин — ДАД могут использоваться также для активации карбонильной группы примером может служить катализ реакции переэтерификации, протекающей в мягких нейтральных условиях.. В этом случае фосфиновый комплекс действует, по-видимому, как. бифункциональный катализатор (см. схему 98) [105]. [c.635]
chem21.info