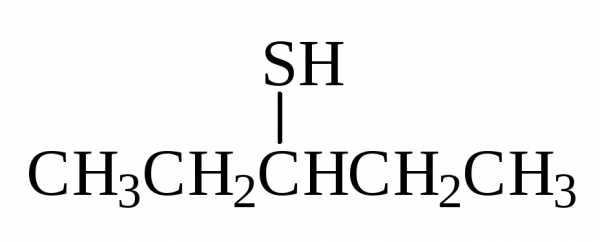1. Кислотное расщепление простых эфиров. Расщепление эфирной связи простые эфиры
2.21. Расщепление простых эфиров кислотами
Простые эфиры расщепляются при нагревании до 120-150 °С с концентрированными водными растворами НВr или HI. В таких же жестких условиях расщепляются простые эфиры фенолов:
ROR + HBr → ROH + RBr
C6H5OCh4 + HBr → C6H5OH + Ch4Br
Очень легко расщепляются эфиры, содержащие третичную алкильную группу:
Кислотное расщепление простых эфиров следует рассматривать как типичный случай реакции нуклеофильного замещения у насыщенного атома углерода. В зависимости от природы алкильных групп, связанных с кислородом, реализуется SN2- или SN1-механизм. Если эфир содержит первичные или вторичные алкильные группы, реализуется SN2-механизм, в котором бромид- или йодид-ион атакует протонированную форму эфира по менее замещенному атому углерода:
Простые эфиры, содержащие третичную алкильную, бензильную или аллильную группу, реагируют по SNl-механизму с образованием карбокатиона в качестве промежуточной частицы. Эти реакции идут в очень мягких условиях, а в качестве кислотного агента вместо HI и НВr можно использовать более слабую трифторуксусную кислоту:
Расщепление эфиров с первичными и вторичными алкильными группами с помощью HI и НВr осуществляется в очень жестких условиях.
Глава 3. Тиолы и сульфиды
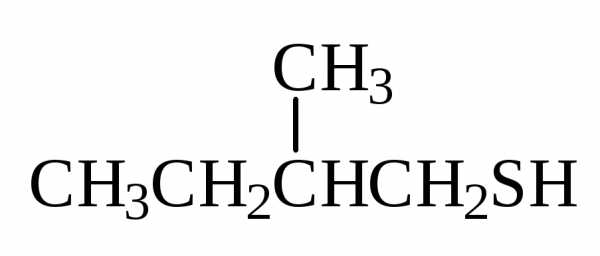
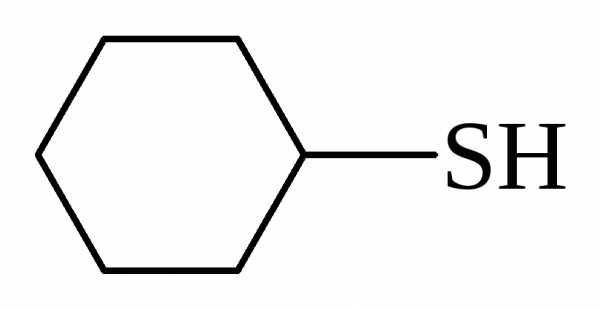
Тиолы RSH и сульфиды R1SR2 следует рассматривать как сернистые производные спиртов и эфиров. Тиолы в номенклатуре IUPAC имеют окончание тиол:
|
2-метилбутантиол-1 |
пентантиол-3 |
|
циклогексантиол | пропантиол-1 |
Старое название сернистых аналогов спиртов - меркаптаны и SH-группы как меркапто- в настоящее время редко употребляется.
Согласно номенклатуре IUPAC сульфиды называются алкилтиоалка-нами. Префикс алкилтио- подобен префиксу алкокси- в названии простых эфиров. Как и у простых эфиров, большая из алкильных групп дает название главной цепи алкана:
Из курса общей химии известно, что для водородных соединений элементов главных подгрупп с увеличением атомного номера элемента наблюдается уменьшениее прочности связи элемент-водород и уменьшение полярности этой связи, а также увеличение кислотности водородных соединений. Отсюда следует, что 1) тиолы должны быть гораздо менее ассоциированы в жидкой фазе по сравнению со спиртами, вследствие менее прочных водородных связей; 2) тиолы должны быть гораздо более сильными кислотами, чем спирты. В Таблице 3 приведены температуры кипения и величины pKa для низших спиртов и тиолов, которые находятся в соответствии с этими предсказаниями.
Таблица 3
Сравнение свойств спиртов и тиолов
| Т. кип. °C | pKa | |
| h3O | 100 | 15,7 |
| Ch4OH | 64 | 15,5 |
| C2H5OH | 78 | 15,9 |
| изо-C3H7OH | 82 | 17,1 |
| h3S | - 60 | 7.05 |
| Ch4SH | 6 | 10.5 |
| C2H5SH | 35 | 10.6 |
| изо-C3H7SH | 60 | 10.9 |
Гидроксил-ион практически полностью превращает тиол в тиолат-ион:
в то время как в случае спиртов, аналогичное равновесие смещено влево.
Отличительной чертой тиолов является отвратительный запах. Челове-ческий нос распознает запах тиола в концентрации 10-7- l0-8 моль/л, которая не достижима для многих спектральных и хроматографических методов. Тиолы в очень низкой концентрации вводят в природный гaз для того, чтобы по запаху можно было определить утечки газа в помещении.
studfiles.net
Реакции простых эфиров. Расщепление кислотами
Расщепление простых эфиров становится возможным после превращения алкокси-группы в хорощую уходящую группу (см. разд. 11.4). Это осуществляется переводом простых эфиров в оксониевые соединения. Примерами могут служить реакции расщепления простых эфиров галогеноводородами галогенид-анион играет роль нуклеофила, а в качестве уходящей группы выступает молекула спирта. В соответствии с нуклеофильной силой галогенид-анионов в протонных средах (см. разд. 2.1.1) расщепление простых эфиров легче всего будет происходить под действием иодоводородной кислоты [c.204]
Сравнительно новым прямым методом расщепления простых эфиров с образованием галогенпроизводных является метод образования сложных эфиров борной кислоты по следующей стехиометри-ческой реакции (пример в) [c.389]Простые эфиры можно расщепить нагреванием с концентрированными растворами иодоводородной или бромоводородной кислоты [813]. Использование НС1 редко бывает успешным. НВг взаимодействует медленнее, чем HI, но часто оказывается более удачным реагентом, так как дает меньше побочных реакций. Для этого превращения был использован и межфазный катализ [814]. В реакцию вступают как диалкиловые, так и алкилариловые эфиры. В последнем случае разрывается связь между алкильной группой и кислородом. Как и в реакции 10-68, уходящей группой в действительности является не 0R , а OHR. И хотя алкилариловые эфиры всегда расщепляются, давая алкилгалогенид и фенол, для диалкиловых эфиров такого общего правила не существует. Часто расщепление происходит по обе стороны от кислорода так, что получается смесь двух спиртов и двух алкилгалогенидов. Однако метиловые эфиры реагируют обычно таким образом, что продуктом оказывается ме-тилбромид или метилиодид. Избыток Н1 или НВг превращает получающийся спирт в алкилгалогенид, поэтому из диалкиловых [c.169]
Электрофильный катализ. Подвижность вяло реагирующих замещаемых групп часто повышается посредством комплексообразования с электрофиль-ными реагентами. Два примера такого рода катализа уже были рассмотрены. Это катализ реакций спиртов и простых эфиров посредством доноров протонов и катализ реакций галогенидов с помощью иона серебра. При расщеплении простых эфиров и спиртов используют также и другие кислоты Льюиса, такие, как хлористый алюминий и трехфтористый бор. [c.246]
Диалкиловые эфиры можно расщепить действием безводного хлорида железа(III) в уксусном ангидриде [580]. В этой реакции обе алкильные группы R входят в состав ацетатов. Выходы составляют от средних до высоких. Расщепление простых эфиров можно проводить и действием смешанного ангидрида уксусной и л-толуолсульфоновой кислот [581]. [c.134]
Простые эфиры — довольно инертные соединения. Эфирная связь очень устойчива к действию оснований, окислителей и восстановителей. Если говорить о разрыве самой эфирной связи, то эфиры подвергаются только одной реакции — расщеплению кислотами. [c.540]
Имеется обзор по различным аспектам механизма расщепления простых эфиров минеральными кислотами, включая реакции в безводных условиях [183]. Существующие данные говорят в пользу Лг-механизма расщепления первичных алифатических простых эфиров при действии галогеноводородов, однако при наличии разветвления в а-положении действует уже механизм А и Следствием действия механизма Лг является получение галогенида менее затрудненной алкильной группы из несимметричного эфира уравнение (114) [184]. При расщеплении первичных простых эфиров серной кислотой при увеличении концентрации кислоты наблюдается переход от механизма Лг к механизму Ai [22]. Катализируемое кислотой расщепление алкил-гр г-бутиловых эфиров карбоновыми кислотами [185] дает возможность получить сложные эфиры, как показано в уравнении (115). [c.338]
Щелочное расщепление простых эфиров 17-3. Пиролиз сложных эфиров карбоновых кислот 17-4. Пиролиз ксантатов (реакция Чугаева) [c.410]
В разд. Б, посвященном реакциям электрофильного типа, рассматривается также ряд галогенпроизводных, дающих простые эфиры по реакциям типа S l. Ввиду того что такие галогензамещенные соединения, как, например, трифенилметилхлорид, дифенилметил-хлорид и соединения аллильного типа, в спиртовой среде ионизованы, отпадает необходимость присутствия аниона алкоголята и, напротив, может оказаться полезным введение слабого основания, например коллидина, для предотвращения расщепления эфира кислотой. [c.326]
Заслуживает упоминания интересный пример образования простого эфира из сложных эфиров бензойной кислоты. В этом случае преобладающей реакцией, несомненно, является ацилирование аниона, но, так как эта реакция обратима, продукт, который должен был бы получиться в результате этой реакции, не выделяется. Поэтому становится заметной более медленная реакция алкильного расщепления [38] [c.331]
При обработке простого эфира иодистоводородной кислотой происходит расщепление простого эфира. Иодистоводородная кислота — достаточно сильная кислота для протонирования простого эфира, а образующийся иодид-ион обладает достаточной нуклеофильностью, чтобы произошла необходимая реакция замещения [c.350]
В заключение можно сказать, что проведение омыления в условиях МФК синтетически выгодно в случае стерически затрудненных эфиров. При этом следует использовать систему твердый гидроксид калия/толуол и краун-эфиры или криптанды в качестве катализаторов. Кроме того, скорость гидролиза простых эфиров карбоновых кислот концентрированным водным раствором гидроксида натрия значительно выше для гидрофильных карбоксилатов. Хорошими катализаторами являются четвертичные аммониевые соли, особенно BU4NHSO4 и некоторые анионные и неионные ПАВ. Это указывает на то, что может осуществляться любой из трех возможных механизмов реакции на поверхности, мицеллярный катализ или истинная МФК-реакция. В зависимости от условий может реализоваться каждый из этих механизмов. Как было показано раньше, при МФК возможна экстракция кислот в форме ионной пары R4N+X----HY [57]. Ранние работы, в которых рассматривалось кислотное МФК-омыление, оказались ошибочными [1202, 1348]. Однако недавно было описано мягкое и селективное расщепление трет-бутиловых эфиров, которое происходит при перемешивании с [c.250]
Расщепление эфира может протекать и одновременно по двум механизмам - 5 1 и 5д,2, что приводит к смеси двух алкилиодидов и двух спиртов. При проведении реакции в избытке иодоводородной кислоты спирты превращаются в алкилиодиды. Этот способ расщепления применяется для определения строения простых эфиров. [c.98]
Реакция сложных эфиров неорганических кислот и галогенид-ионов 10-68. Реакция спиртов с галогеноаодородами или галогеиоаигидридами неорганических кислот 10-69. Расщепление простых эфиров действием НГ или НВг 10-71. Расщепление сложных эфиров действием ЬП [c.411]
Интенсивность протекания побочных реакций зависит от условий процесса [114]. Малая продолжительность контакта благоприятствует протеканию главной реакции. Увеличение продолжительности реакции и применение более высоких температур усиливают протекание реакций II, III и IV. Образование свободных алифатических кислот (VI и X) из олефина и воды, получающейся в реакциях III, VII и IX, весьма незначительно столь же незначительна и интенсивность реакции V расщепления сложного эфира. Образован е простого эфира (VII) протекает главным образом прн применении метанола в качестве спиртового компонента. [c.64]
Выделяющийся бромистый водород отводят через обратный холодильник в наполненную до половины водой колбу Эрленмейера, которая соединяется с холодильником с помощью пробки со стеклянной трубкой и резинового (лучше полихлорвинилового) шланга. Газоотводная трубка не должна быть погружена в воду, а должна оканчиваться на расстоянии около 1 см от поверхности воды (почему ). Образующуюся разбавленную бромистоводородную кислоту очищают, перегоняя на короткой колонке собирают азеотропно кипящую при 126°/760 мм 48%-ную бромистоводородную кислоту (используется для реакции этерификации и расщепления простых эфиров см. гл. 2, часть IV). [c.148]
Простые эфиры обычно не вступают в ионные реакции (например, So,l, 8 2, El и Е2). Они пе реагируют с основаниями, такими, как гидроксид-ион. Пожалуй, наиболее важной реакцией простых эфиров является их расщепление под действием кислоты, причем промежуточным реакционноспособным продуктом служит 0-протонированиый эфир. Чаще всего в этих реакциях на эфпр действуют иодистоводородной кислотой (водным раствором иодистого водорода). [c.443]
Аналогично может быть определена этоксигруппа. Расщепление простых эфиров иодистоводородной кислотой используется также в препаративных целях в реакции используют KI и 95%-ную Н3РО4 [c.464]
Реакция простых эфиров с концентрированной бромистоводородной или иодистоводородной кислотой приводит к их расщеплению. Механизм включает первоначальное протонирование эфирного кислорода с образованием относительно хорошо уходящей группы (спирта). Образующийся спирт реагирует дальше, давая вторую молекулу алкилгалогенида (рис. 6.13, а). Заметим, что когда расщепляется арилалкиловый эфир, продуктами реакции являются алкилгалогенид и фенол (рис. 6.13,6), Фенол дальше не реагирует, поскольку даже в протонированиой форме он не подвергается нуклеофильному замещению (разд. 6.3). [c.130]
При взаимодействии р-пропиолактона с водными растворами хлористого натрия или гидросульфида натрия, а также с раствором аммиака в ацетонитриле с высоким выходом получаются р-замещенные пропи-оновые кислоты. Интересно, что при катализируемом основаниями метанолизе р-пропиолактон раскрывается с образованием сложного эфира гидракриловой кислоты, тогда как при взаимодействии с метанолом в отсутствие катализаторов н при реакции, катализируемой кислотами, происходит расщепление не сложноэфирной, а простой эфирной связи лактонного кольца и получается р-метоксипропионо-вая кислота [c.73]
Хотя механизм реакции остается далеко не ясным, можно все же полагать, что он связан с промежуточным расщеплением фуранового цикла пирослизевой кислоты. Во всяком случае, этот факт можно сопоставить с успешным применением рядом авторов (см., напр., 181—184) простых эфиров для алкилирования бензола и фенолов в присутствии А1С1з, [c.23]
Сложные эфиры можно получить из а,а-дихлоралкилзамещенных простых эфиров при гидролизе их водой [161]. Для гидролиза а,а-дифторалкилзамещенных простых эфиров необходимо применять более сильные гидролизующие агенты, такие, как 95%-ную серную кислоту [162, 163]. Выходы при этих реакциях гидролиза составляют от 55 до 83%. Механизм этого расщепления точно не установлен [163], но можно предполагать, что этот гидролиз протекает с большей легкостью, чем гидролиз тригалогензамещенных, в результате влияния простой эфирной группы [c.305]
В разд. 17.9 уже обсуждалась реакция расщепления простых эфиров под действием кислот. Расщепление метилариловых эфиров концентрированной иодистоводородной кислотой лежит в основе важного аналитического метода —метода Цейзеля (разд. 17.12). [c.764]
Простые эфиры расщепляются при нагревании до 120-150 X с концентрированными (48%) водными растворами НВг или Н1. Эта реакция была открыта в 1861 г. А.М.Бутлеровым на примере расщепления 2-этоксипропановой кислоты под действием 48%-й йодистоводородной кислоты. В столь же жестких условиях расщепляются простые эфиры фенолов, например [c.300]
Реакция (6) [20f] — это всего лишь еще один пример расщепления простого эфира под действием кислот Льюиса. Однако в отличие от других кислот Льюиса, требующих довольно жестких условий проведения реакции, триме-тилсилилиодид вызывает это превращение уже при комнатной температуре. Благодаря этому обстоятельству, которое, вообще говоря, могло бы показаться второстепенным, метоксигруппа, ранее считавшейся тупиковой для осу-ществлегшя трансформационных переходов, теперь может рассматриваться как один из удобных вариантов временной защиты спиртовой функции. [c.153]
Простые эфиры — малореакционноспособные вещества, инерт-116 к щелочам, больщинству кислот и других реагентов. Простые )иры алифатического ряда в обычных условиях не гидролизуют-1. Расщепление эфирной связи в этих соединениях по реакции уклеофильного замещения происходит лищь в жестких условиях, апример при взаимодействии простых эфиров с концентрирован-ой бромоводородной или иодоводородной кислотой при нагре-ании. [c.157]
О карбонилировании сложных эфиров до ангидридов упоминалось ранее (см. разд. 6.2.2.2) как о побочной реакции в катализируемом соединениями никеля синтезе сложных эфиров из простых эфиров при повыщенных температурах и высоких давлениях монооксида углерода. Однако сейчас имеются сведения, что ангидриды, в частности уксусный ангидрид [103], могут быть получены в гораздо менее жестких условиях (25— 80 атм, 150—200 °С) при использовании промотированных иодом родиевых катализаторов [схема (6.116)], как в синтезе уксусной кислоты из метанола. По-видимому, реакция включает (см. разд. 6.2.1.1, 6.2.2.2) расщепление исходного соединения иодоводородом, в данном случае до уксусной кислоты и метилиодида, который каталитически карбонилируется в ацетилиодид. Конденсация последнего с уксусной кислотой приводит к ангид- [c.231]
Безводный СгОз в уксусной кислоте был использован для превращения метиловых простых эфиров в соответствующие формиаты с выходами я 50% [124] [схема (8.56)]. Так как формиаты легко гидролизуются в соответствующие спирты, эту реакцию можно использовать для удаления метильной группы, введенной для защиты алифатической гидроксигруппы. При окислении вгор-алкиловых простых эфиров образуются продукты расщепления. Например, при окислении диизопропило-вого эфира с помощью хромовой кислоты в 45%-й серной кислоте с выходом 97% получается ацетон [125]. [c.352]
При взаимодействии простых эфиров с концентрированной серной кислотой происходит их расщепление с образованием спирта и ал-килгидросульфата. Эта реакция характерна только для низших алифатических простых эфиров. Она протекает в более жестких условиях — при пропускании паров эфира в концентрированную серную кислоту. [c.196]
Диалкиловые эфиры в виде молекулярных соединений с фтористым бором расщепляются органическими кислотами, подобно винил- и ал-лилалкиловым эфирам, но нри более высоких температурах, и образуют алкиловые эфиры карбоновых кислот выход этих эфиров том выше, чем сильнее кислота. Следовательно, расщепление простых эфиров кис.лотами с катализатором BF3-0( jH5)2 является общей реакцией и обусловлено наличием атома кислорода у эфиров, повышающего их способность обра-зовывать с фтористым бором молекулярные соединения, в которых активация молекулы эфира идет не по двойной связи, а но углерод-кислород-ной связи. В результате расщепление по кислородной связи идет легче, чем присоединение кислот по двойной связи. [c.314]
Нуклеофильная атака по алкильному остатку в (6) приводит к расщеплению эфира теория мягких и жестких кислот и оснований предполагает, что эффективный реагент должен быть построен из жесткой кислоты и мягкого основания, и, в соответствии с этим, для данной цели издавна используются гидроиодид и гидробромид. Реакция с. иодидом водорода лежит в основе определения метилариловых эфиров по Цейзелю. Гидрогалогениды пиридина или анилина также используются для деалкилироваиия простых эфиров фенолов в жестких условиях. Кислоты Льюиса, особенно хлорид алюминия, трихлорид бора и трибромид бора [c.434]
Ионы диалкилоксония более реакционноснособны в реакциях нуклеофильного замещения и реакциях элиминирования, чем нейтральные молекулы простых эфиров причина этого та же, что в случае активирования спиртов сильными кислотами (стр. 271). Вследствие этого для более легкого протекания реакций расщепления эфиров требуется сильнокислая среда. [c.369]
chem21.info
1. Кислотное расщепление простых эфиров
Простые эфиры расщепляются при нагревании до 120-150о с концентрированными водной 48% HBr или HI. В столь же жестких условиях расщепляются простые эфиры фенолов.
Однако эфиры, содержащие третичную алкильную группу, расщепляются очень легко.
Кислотное расщепление простых эфиров следует рассматривать как реакцию нуклеофильного замещения у насыщенного атома углерода. В зависимости от природы алкильных групп, связанных с кислородом, реализуется либо SN1, либо SN2- механизмы. Если эфир содержит первичные или вторичные алкильные группы, реализуется SN2- механизм, в котором бромид- или иодид-ион атакует протонированную форму эфира по менее замещенному атому углерода. В этом случае расщепление отличается высокой региоселективностью и, как правило, образуется только один их двух возможных спиртов (вторичный) и первичный алкилгалогенид.
Хлорид- и фторид-ионы в воде сильно сольватированы за счет водородных связей и обладают недостаточной нуклеофильностью для кислотного расщепления простых эфиров по SN2- механизму.
Простые эфиры с третичной алкильной, бензильной или аллильной группами реагируют по SN1- механизму с образованием карбокатиона в качестве интермедиата. Эти реакции идут в мягких условиях, а в качестве кислотного агента можно использовать трифторуксусную кислоту.
В препаративном отношении гораздо более удобными реагентами для расщепления эфиров являются BCl3 или BBr3. В этих случаях расщепление проходит уже при -20оС. Это особенно необходимо при наличии других функциональных групп или тогда, когда возможна изомеризация углеродного скелета.
| [предыдущий раздел] | [содержание] | [следующий раздел] |
2. Радикальные реакции простых эфиров
Подобно алканам простые эфиры вступают в реакции радикального замещения, однако галогенирование эфиров отличается региоселективностью и осуществляется в a-положение по отношению к атому кислороду. Столь высокая региоселективность галогенирования объясняется относительной стабильностью радикала
где неспаренный электрон на 2р-орбитали перекрывается с неподеленной парой 2р-электронов атома кислорода.
Атом галогена в a-галогензамещенных эфирах легко замещается под действием различных нуклеофилов, например:
Простые эфиры проявляют повышенную склонность к автоокислению в присутствии кислорода с образованием перекисей. Эта реакция протекает по цепному радикальному механизму.
studfiles.net
Свойства простых эфиров
Общие свойства
Простые эфиры по отношению ко многим реагентам достаточно инертные соединения. Эфирная связь не поддается воздействиям восстановителей, окислителей, оснований. Простые эфиры не расщепляются: комплексными гидридами алюминия и бора, амидами и гидридами щелочных металлов, металлоорганическими соединениями.
Простые эфиры:
- горят на воздухе с образованием углекислого газа и воды;
- играют важную роль растворителей при образовании магнийорганических и некоторых других металлоорганических соединений, участвуют в реакциях восстановления алюмогидридом лития и его производными;
- проявляют свойства жестких оснований Льюиса, чем и объясняется их сольватирующая способность.
Например: простые эфиры тетрагидрофуран, диэтиловый, диоксан, диметиловый эфир диэтиленгликоля, диметоксиэтан и др. способны образовывать прочные комплексы с реактивами Гриньяра $RMgX$, литийорганическими соединениями, которые содержат жесткие кислоты (катионы лития или магния).
Разрыв эфирной связи возможен при воздействии галогеноводородных кислот:
Рисунок 1.
Реакционная способность галогеноводородов уменьшается в ряду:
Рисунок 2.
Разрыв эфирной связи происходит в жестких условиях: с концентрированными кислотами, при нагревании.
Из алкиловых эфиров при разрыве эфирной связи образуются спирт и алкилгалогенид. Спирт реагирует дальше с образованием алкилгалогенида.
Алкилариловые эфиры подвергаются расщеплению по связи кислород - алкил, в результате реакции образуются фенол и алкилгалогенид.
Основной характер простых эфиров проявляется в их растворимости в концентрированной серной кислоте и выделении оксониевых солей при низкой температуре.
Диэтиловый эфир применяют в реакции Гриньяра в качестве растворителя. По отношению к кислому магнию он выступает как основание. С хорошим выходом реактивы Гриньяра получают в бензоле в присутствии триэтиламина в роли основания. Расщепление происходит в результате нуклеофильной атаки протонированного эфира ионом галогена. При этом происходит замещение молекулы слабоосновного спирта.
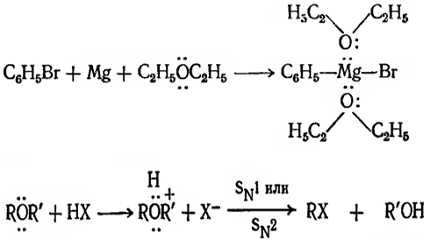
Рисунок 3.
Первичная алкильная группа имеет тенденцию к $S_N2$-замещению, а третичная - к $S_N1$-замещению.
Простые эфиры могут образовывать прочные комплексы с жесткими кислотами Льюиса состава 1:1 или 1:2 - $AlR_3$, $AlBr_3$, $BF_3$, $SbF_5$, $SbCl_5$, $ZnCl_2$, $SnCl_4$ и т.д.
Рисунок 4.
В качестве оснований Льюиса, простые эфиры участвую в образовании комплексов с галогенами. В комплексе галоген играет роль акцептора, эфир - донора. Прочность комплекса можно оценить по спектрам поглощения в УФ области. В ней появляется новая полоса поглощения - полоса переноса заряда. Эти комплексы называют комплексами с переносом заряда (КПЗ).
Образование солей оксония
Впервые соли триалкилоксония были получены Г. Меервейном в 1937-1940 гг.
Соли триалкилоксония образуются при взаимодействии простых эфиров с сильными алкилирующими агентами:
Рисунок 5.
В результате взаимодействия эфирата трехфтористого бора с эпихлоргидрином образуется триэтилоксонийборфторид (реакция протекает в абсолютном эфире):
Рисунок 6.
В настоящее время для получения солей триалкилоксония проводят реакции простых эфиров с алкилфторсульфонатами или с алкилтрифлатами.
Катион триалкилоксония является сильным алкилирующим агентом для любого нуклеофильного агента:
Рисунок 7.
Способность простых эфиров образовывать соли оксония используется в органическом синтезе при расщеплении простых эфиров под действием йодистоводородной, бромистоводородной кислот, тригалогенидов бора.
Электрофильное замещение в ароматических эфирах
При электрофильном замещении в ароматическом кольце алкоксигруппа $-OR$ ориентирует в орто- и пара-положения и активирует само кольцо. При этом активация кольца алкоксигруппой проходит сильнее, чем $R$, но слабее чем $-OH$.
При атаке в орто- и пара-положения образуется карбониевый ион. Считают, что он стабилизирован вкладом структур I и II:
Рисунок 8.
Эти структуры очень устойчивы, так как в них каждый атом имеет полный октет электронов.
Способность кислорода разделять больше одной пары электронов с кольцом и аккумулировать положительный заряд согласуется с основным характером простых эфиров.
spravochnick.ru
Расщепление - эфирная связь - Большая Энциклопедия Нефти и Газа, статья, страница 3
Расщепление - эфирная связь
Cтраница 3
Метилмеркаптан, образующийся при сульфатной варке, при использовании в варочном процессе по делигнифицирующей активности не уступает сульфиду натрия. Одной из основных реакций при щелочной варке является реакция расщепления эфирных связей структурных единиц лигнина. Это и реакция деметилирования лигнина с образованием пирокатехиновых единиц, которая подтверждается не только повышенным выходом диметилсульфида, но и заметным снижением содержания меток-сильных групп в лигнине щелока по сравнению с обычной сульфатной варкой. С увеличением концентрации метилмеркаптана в варочном щелоке содержание метоксилов в лигнине снижается. [31]
Недавно [8] исследован процесс ожижения угля в восстановительной среде, протекающий через ряд превращений, включающих свободнорадикальные реакции и реакции элиминирования. При восстановительном алкилировании электроны присоединяются к ароматическим ядрам и образуются соответствующие анионы, вслед за чем протекает С-алкилирование. Расщепление эфирных связей приводит к образованию фенолят-анионов, которые при последующем О-алкилировании дают жидкие продукты. [32]
Простые эфиры - малореакционноспособные вещества, инерт - je к щелочам, большинству кислот и других реагентов. Простые жры алифатического ряда в обычных условиях не гидролизуют-1. Расщепление эфирной связи в этих соединениях по реакции уклеофильного замещения происходит лишь в жестких условиях, апример при взаимодействии простых эфиров с концентрирован-ой бромоводородной или иодоводородной кислотой при нагре-ании. [33]
С скорость превращения невелика. Вместе с тем, нуж: ять, что Р - эфирная связь у у-арилэфира гваяцилглицерина V ает более высокой реакционной способностью, чем обыч ] одается у алкил-ариловых эфиров. С в теч 7 ч расщепление эфирной связи произошло только на 7 % [ 3 ( ересно, что в отличие от реакций в кислой среде алкилироваш эльного гидроксила у соединения VIII не вызывает снижет ионной способности Р - алкил-арилэфирной связи, скорее дела. Исследования, яовлено, что если по соседству с алкил-арильной эфирной связь спиртовая гидроксильная группа, то эфирная связь знач: о легче гидролизуется в щелочной среде. Считается, что в щело среде при достаточной концентрации щелочи образуется алког г-анион, который, будучи мощным нуклеофилом, внутримолек; рно атакует углерод, связанный р-эфирной связью, расщепля педнюю. [34]
Алкилсульфаты и алкилэфиросульфаты исследуются методом газовой хроматографии после гидролиза соляной кислотой для выделения исходных спиртов или эфи-ров спиртов. Извлекаемые при этом образцы, содержащие до 7 моль оксида этилена, определяются без превращения в какие-либо производные. Для образцов, включающих большее количество молей этоксилатов, необходимо расщепление эфирных связей в этиленоксидной или пропиленоксидной цепи йодоводородной или бромоводо-родной кислотой [32], с образованием алкилйодидов или бромидов, соответствующих спиртам, которые используются для получения алкоксилатов. [35]
Система имеет универсальный характер и свободна от многих недостатков D / L-системы. Однако в применении к производным глицерина она не отражает многие важные структурные и биохимические взаимоотношения. Так, значительная часть химических и биохимических реакций в ряду производных глицерина включает образование и расщепление простых и сложных эфирных связей. Хотя эти превращения не затрагивают ни одну из четырех связей асимметрического атома при Сь однако при этом часто происходят изменения пространствен - Ьых обозначений. [36]
Этот факт свидетельствует о том, что при омылении освобождаются фенолы, находившиеся в химически связанном состоянии. Появление фенолов в рафинате после омыления подтверждено данными потенциометрического титрования. Такая взаимосвязь позволяет предположить, что одним из путей образования фенолов является расщепление эфирных связей. [37]
Выделенные из мочи С1 ( - стероиды, строение которых полностью или почти полностью установлено, приведены в таблице 41, а их формулы в схеме на стр. Некоторые из этих веществ являются продуктами превращения. Свободные оксикетоны устойчивы в применяемых условиях гидролиза. Однако показано, что в процессе кислотного гидролиза сульфата андростерона ш происходит как расщепление эфирной связи, так и отщепление серной кислоты. [38]
По Адкинсу, при восстановлении ароматического ядра каталитическое действие никеля Ренея уступает аналогичным свойствам никеля на кизельгуре. Но, для того чтобы сделать обоснованные выводы о применимости никеля Ренея как катализатора восстановления ароматических соединений, имеющиеся опытные данные недостаточны. Действительно, на основании сравнительных экспериментов никель Ренея с меньшей активностью катализирует эту реакцию, чем никель на кизельгуре, хотя температура реакции выше и концентрация катализатора больше. Например, количественное восстановление бензола в циклогек-сан при прочих равных условиях происходит в течение 10 мин. Эфиры фенолов гидрируются лишь при высокой температуре ( выше 170) и с плохими выходами [96], Выходы восстановленных эфиров фенолов зависят от строения эфира, так как наряду с восстановлением может происходить и расщепление эфирной связи. Для бензиловых эфиров расщепление является главной реакцией. [39]
Продукты реакции разделялись на растворимые в жидком аммиаке и на нерастворимые. При обработке метиловым спиртом нерастворимые в аммиаке вещества частично переходили в метанольный раствор. При опытах с древесиной в метанольный раствор переходит лигнин, а целлюлоза и углеводы остаются нерастворенными. Следовательно, в результате действия металлического калия на каждую структурную единицу прибавилось 0 8 моля гидроксильной группы; из них 0 3 приходится на гид-роксильные группы, получающиеся за счет частичного разложения метоксильных групп гваяциловых остатков. ОН-группы образуются, попредположениюФрейденберга, в основном за счет расщепления фурановых колец, имеющихся в лигнине. Небольшая часть гидроксильных групп образуется за счет расщепления других эфирных связей ( не входящих в цикл), связывавших отдельные структурные звенья друг с другом. [40]
Содержание растворимой в ацетоне фракции весьма невелико. При комнатной температуре он постепенно испаряется и при долгом стоянии на воздухе полностью улетучивается. Параформальдегид медленно растворяется в холодной воде и быстро в горячей, при этом он разлагается и образует водный раствор формальдегида. Параформальдегид часто используют в промышленности в качестве источника формальдегида. Штаудингер [35] предположил, что механизмы разложения параформальдегида в кислой и щелочной средах различны. В щелочной среде атакуются концевые гидроксильные группы, при этом от концов цепей последовательно отщепляются молекулы формальдегида. В кислой среде происходит расщепление эфирных связей внутри цепей, и большие молекулы распадаются на фрагменты. [41]
Страницы: 1 2 3
www.ngpedia.ru