Способы получения простых эфиров. Функциональная группа простых эфиров
Способы получения простых эфиров
Синтез диэтилового эфира из этанола.
Из алкоголятов натрия или калия и галогенопроизводных.
Пример:
Ch4-ONa + C2H5I Ch4-O-C2H5 + NaI
2.3.2. Альдегиды и кетоны
Альдегиды и кетоны содержат функциональные группы:
|
| карбонильная группа |
|
| альдегидная или формильная группа |
Номенклатура альдегидов и кетонов
Альдегиды:

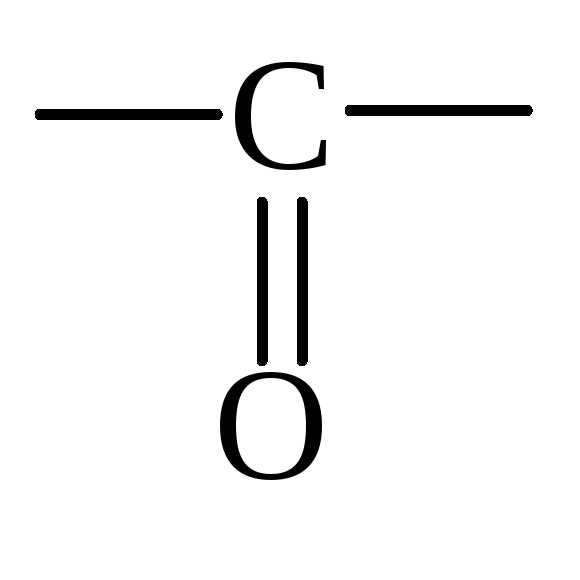
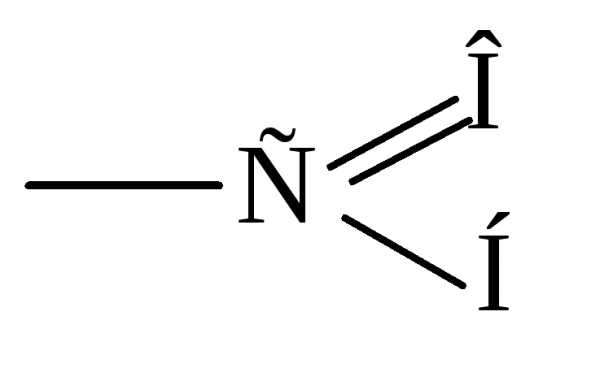
Строение карбонильной группы:
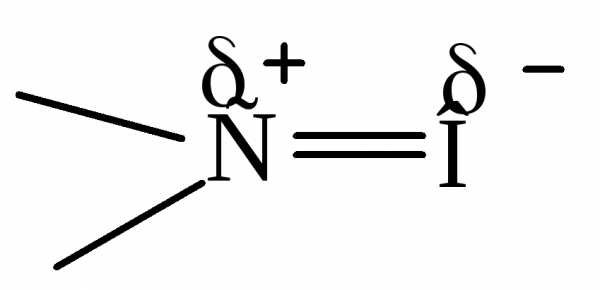 l С=О= 0.120нм
l С=О= 0.120нм 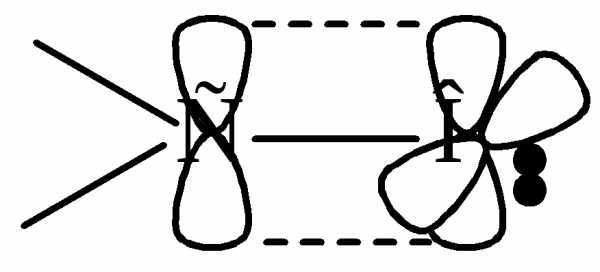
Атом углерода находится в sp2 состоянии гибридизации. Атом кислорода не гибридизован. Одна электронная пара атома кислорода находится на р-орбитали, а другая на s – орбитали. Группа полярная ( = 2.5 - 2.6D для альдегидов и = 2.7 – 2.8D для кетонов).
Химические свойства
Реакции нуклеофильного присоединения по карбонильной группе.
Важнейшей стадией этих реакций является образование связи нуклеофильного реагента с электронодефицитным атомом углерода.
Общий механизм:
Альдегиды более реакционноспособны, чем кетоны т.к. реакционный центр кетонов пространственно более затруднен и несет меньший положительный заряд.
Реакции присоединения:
Присоединение синильной кислоты.
Пример:
Присоединение бисульфита натрия.
Пример:
Бисульфитные соединения гидролизуются в кислых и щелочных средах.
В избытке насыщенного раствора бисульфита натрия бисульфитные соединения осаждаются. Реакция используется для выделения альдегидов из реакционной смеси.
Присоединение воды.
Пример:
гидрат формальдегида
40% -ный водный раствор формальдегида – формалин
Присоединение спиртов.
Пример:
полуацеталь ацеталь
Присоединение аммиака.
Пример: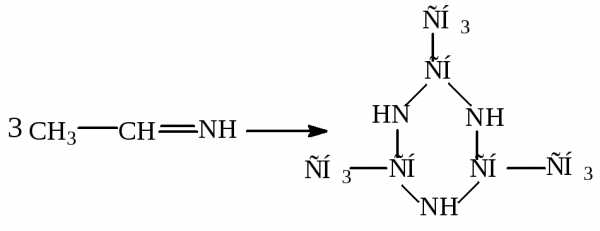
производное гексагидро-1,3,5-триазина
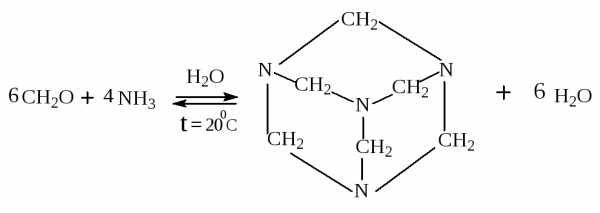
(уротропин)
При нитровании уротропина получают мощное бризантное взрывчатое вещество – гексоген.
Галогенирование.
Пример:
Восстановление альдегидов и кетонов.
Пример:
Окисление альдегидов и кетонов.
Окислители: KMnO4, Cr2O3, HNO3, HCrO4 и др.)
Пример:
Альдегиды окисляются очень легко, даже такими мягкими окислителями, как аммиачный раствор оксида серебра (качественная реакция на альдегиды).
Кетоны окисляются сильными окислителями (HNO3 при нагревании или горячим щелочным раствором KMnO4).
Пример:
Реакции полимеризации.
паральдегид
При упаривании водных растворов формальдегида в вакууме образуется полимер параформ. При нагревании параформ деполимеризуется. Его удобно использовать в синтезах вместо формальдегида.
nCh3O + h3O HO-(-Ch3O-Ch3-)nOH, (n = 8-100)
Физические и пожароопасные свойства альдегидов и кетонов, их применение
Уксусный альдегид (ацетальдегид). Это очень летучая, легко воспламеняющаяся жидкость с резким запахом, хорошо растворимая в воде, спирте и многих органических растворителях. Острое отравление приводит к воспалению легких и плевры. Предельно допустимая концентрация паров уксусного альдегида в воздухе производственных помещений 5мг/м3.
Ацетальдегид используют для получения уксусной кислоты, бутадиена и других важных соединений.
Муравьиный альдегид (формальдегид). Формальдегид – бесцветный газ с острым запахом, хорошо растворимый в воде и в органических растворителях. Он широко используется для получения различных полимеров (фенолформальдегидные смолы, карбамидные смолы). При полимеризации безводного формальдегида в инертных растворителях получают высокомолекулярный полиформальдегид (СН2О)n. Полимер размягчается при 170-1800С, его используют для получения волокон, пленок и конструкционных деталей.
Ацетон. Ацетон - бесцветная, легко воспламеняющаяся жидкость с характерным запахом. Ацетон хорошо растворяется в воде, спиртах, эфирах, маслах и сам является растворителем смол, жиров и др. Пары ацетона ядовиты, в 2 раза тяжелее воздуха и образуют с ним взрывчатые смеси. Концентрационные пределы воспламенения: НПВ-2,2%, ВПВ-13%. Температурные пределы воспламенения ацетона: НПВ -200С, ВПВ + 60С.
При горении ацетон прогревается в глубину, образуя гомотермический слой. Температура прогретого слоя достигает 560С. Скорость выгорания ацетона со свободной поверхности составляет 20см/ч. Определенную пожарную опасность представляют водные растворы ацетона. Водный раствор, содержащий только 10% (масс.) ацетона, является легко воспламеняющейся жидкостью с температурой вспышки 110С. Ацетон самовозгорается при контакте с сильными окислителями. Температура самовоспламенения ацетона 4650С. При действии ультрафиолетовых лучей ацетон разлагается на этан и оксид углерода. В присутствии щелочи он реагирует с хлором, бромом и иодом, образуя соответственно хлороформ, бромоформ и иодоформ.
СН3СОСН3 + 4NaOH + 3I2 CHI3 + Ch4COONa +3NaI + 3h3O
Ацетон – широко используемый растворитель. Его применяют в производстве лаков, хлороформа, иодоформа, красок, кинопленок. Он является сырьем для получения синтетического каучука, красителя индиго, в производстве кож, при экстрагировании пищевых продуктов, лекарственных веществ. Он используется для растворения нитроцеллюлозы, ацетилцеллюлозы.
studfiles.net
Функциональные производные эфиры сложные - Справочник химика 21
Реакции. 1. Карбоксильная группа образует нормально соли и функциональные производные хлорангидриды, сложные эфиры, амиды и т.д. [c.736]
Сложный эфир - функциональное производное карбоновой кислоты - продукт замещения ОН-группы в карбоксиле на алкоксигруппу. [c.377]
Хлорангидриды и ангидриды легко вступают в реакции ацилирования. Из них можно получать практически любые функциональные производные карбоновых кислот. Карбоновые кислоты и сложные эфиры значительно менее активные ацилирующие агенты, реакции нуклеофильного замещения с их участием проводятся в присутствии катализаторов. Амиды же вступают в реакции ацилирования еще трудней, чем кислоты и сложные эфиры. [c.271]
Гидроксил кислоты может быть замещен рядом других групп — С1, 0R, NHs, что приводит к образованию соединений, известных под названием хлорангидриды, сложные эфиры и амиды. Эти соединения называют функциональными производными кислот все они содержат ацильную груп- [c.565]
Карбоновые кислоты, по-видимому, гораздо чаще превращают в хлорангидриды, чем в какие-либо другие функциональные производные. Из чрезвычайно реакционноспособных хлорангидридов кислот можно затем получить многие другие типы соединений, включая сложные эфиры и амиды (разд. 20.8). [c.573]
Карбоновым кислотам родственна группа органических соединений, также сходных между собой и известных под названием функциональных производных карбоновых кислот хлорангидриды, ангидриды, амиды и сложные эфиры. Эти производные представляют собой соединения, в которых ОН в карбоксильной группе замещен на С1, ООСН, КНз или ОН [c.628]
Сульфохлориды — важные промежуточные соединения при синтезе других функциональных производных, поскольку последние нельзя получить прямо из сульфокислот. Сульфохлориды реагируют со спиртами или фенолами, давая сложные эфиры, и с аммиаком, давая амиды [c.673]
Поскольку разделение и очистку продуктов гидролиза провести довольно трудно, то производные сложных эфиров лучше всего получать непосредственно из самих эфиров. Сложные эфиры, содержащие другие функциональные группы, часто можно идентифицировать, превращая их в твердые производные с помощью различных реакций, таких, как галогенирование, нитрование или аце-тилирование. [c.343]
Реакции гидроксильных производных с функциональными производными карбоновых кислот. Спирты, фенолы и другие гидроксильные производные легко реагируют с ацилхлоридами и ангидридами кислот. Известны также реакции спиртов со сложными эфирами карбоновых кислот, особенно в присутствии кислот или оснований (реакции переэтерификации) [c.574]
Реакции нуклеофильного замещения. Сложные эфиры реагируют с нуклеофильными реагентами, образуя соответствующую карбоновую кислоту или различные функциональные производные этой кислоты [c.575]
Реакции в карбоксильной группе, Галогенкарбоновые кислоты образуют все известные функциональные производные, например ацилхлориды, сложные эфиры, амиды [c.606]
Указанный выше ряд относительной реакционной способности важен для получения функциональных производных карбоновых кислот. В этом ряду каждое последующее производное получают из предыдущего, но не наоборот. Например, хлорангидрид или сложный эфир нельзя получить из амида. [c.227]
Сложные эфиры. Одной из важнейших групп функциональных производных карбоновых кислот являются сложные эфиры. Они широко распространены в природе, многие из них используются в качестве лекарственных средств. Л [c.264]
Сложные эфиры — это функциональные производные карбоновых кислот, в которых гидроксильная группа заменена остатком спирта или фенола —ОК. [c.264]
Амиды. Другой важной группой функциональных производных карбоновых кислот являются амиды. Амиды также широко распространены в природе, достаточно сказать, что основа живых организмов — пептиды и белки — содержит многочисленные амидные группировки (см. 16.2). Как и сложные эфиры, амиды используются в медицине в качестве лекарственных средств. [c.269]
Функциональные производные карбоновых кислот. Классификация и номенклатура. Получение и свойства сложных эфиров, хлорангидридов, ангидридов и амидов кислот, надкислот и перекисей ацилов. [c.191]
Реакции нуклеофильного замещения. Дикарбоновые кислоты, подобно монокарбоновым, вступают в реакции нуклеофильного замещения с участием одной или двух функциональных групп и образуют функциональные производные — сложные эфиры, амиды, хлор-ангидриды. [c.279]
Спирты могут реагировать с образованием сложных эфиров не только с карбоновыми кислотами, но и с некоторыми функциональными производными кислот [c.100]
Таким образом, кроме альдегидов и кетонов к карбонильным соединениям могут быть также причислены сложные эфиры карбоновых кислот, другие их функциональные производные и сами кислоты. [c.119]
Функциональные производные. К ним отнесены ацетали, оксимы, гидразоны, сложные эфиры, галогенангидриды, амиды, арилиды, уреиды и т. п., а также соли органических оснований с неорганическими (например, хлоргидраты, сульфаты) или с органическими (ацетаты, бензоаты) кислотами, или соли органических кислот с органическими основаниями (например, с пиридином, пиперази-ном и т. п.). Как уже указано, названия функциональных производных (светлый щрифт) помещены после материнских названий или после названий замещенных производных. При этом повторяющиеся материнские названия или названия замещенных символизируются прочерком с запятой (—,), а иногда, в случае сложных замещенных производных, — двумя (—, —,) прочерками. [c.394]
Целый ряд функциональных производных карбоновых кислот галогенангидриды, сложные эфиры, нитрилы, диалкнламиды могут быть в одну стадию превращены в альдегиды ири действии сиецифических восстановителей. Подробное ошюаиие этих реакций будет проведено в гл. 18 (ч.З), посвященной свойствам производных карбоновых кислот. Здесь приведены только некоторые наиболее типичные примеры [c.1244]
Некоторые функциональные производные кислот могут быть восстановлены в соответствуюпще альдегид и рервичный спирт. Наиболее простой путь восстановления кислоты в альдегид — это реакция Розенмунда (см. стр, 136). Наиболее распространенный способ перехода от кислоты к спирту (реакция Буво) — восстановление сложного эфира карбоновой кислоты чистым (свободным от калия, В. В. Лонгинов) металлическим натрием в абсолютном этиловом спирте [c.169]
Из схемы 9.1 очевидно, что фундаментом всей органической химии являются углеводороды. От алканов происходят все остальные классы углеводородов. Из углеводородов в результате химических реакций замещения Н-атома С-Н-связи и присоединения реагентов по л-связям возникают основные классы функциональных производных углеводородов — галогенопроизводные, сульфопроиз-водные, нитросоединения, спирты, простые и сложные эфиры, альдегиды, кегоны и карбоновые кислоты. Дальнейшее химическое преобразование (химический дизайн) этих производных за счет замещения или химического видоизменения функциональных групп создает все труднообозримое многообразие полифунк-ционапьных органических соединений, в том числе аминокислоты, пептиды, и белки, жиры и углеводы, гетероциклы различной сложности, витамины, гормоны, нуклеотиды и нуклеиновые кислоты, ферменты. [c.317]
Эти функциональные производные карбоновых, кислот могут быть получены из гидроксиламина и сложных эфиров (см. выше)- и ацилга-логенидов (см. выше) или же по реакций Анжели — Римини из альде-гидов и бензолсульфонилгидроксиламина [c.419]
Сульфокислоты, подобно карбоновым кислотам, образуют галогенангвдриды, ангидриды, амиды и сложные эфиры. Методы получения этих функциональных производных по существу аналогичны методам, применяемым для получения производных карбоновых кислот. Один из методов получения хлорангидридов сульфокислот (сульфохлоридов) заключается в обработке сухой натриевой соли тионилхлоридом в ДМФА [c.494]
Наиболее важными функциональными производными карбоновых кислот являются соли, сложные эфиры и тиоэфиры, амиды, галогенангидриды, ангидриды. Все эти соединения содержат моди-фйцированную карбоксильную группу и при гидролизе образуют карбоновую кислоту. По этому принципу к функциональным производным карбоновых кислот можно отнести и нитрилы Р—С=Ы. [c.181]
Важное свойство карбоновых кислот связано с превращением их карбоксильной группы —СООН в разнообразные функциональные производные, содержащие группу —СОХ, где X — атом галогена (в галогенангидридах) или группы —NHg (в амидах), —OR (в сложных эфирах), —O OR (в ангидридах). Из всех функциональных производных карбоновых кислот наибольшее прикладное значение имеют сложные эфиры. Общая формула сложных эфиров [c.357]
Различную реакционную способность функциональных производных можно связать со стабильностью уходящей группы (аниона), т. е. использовать тот же подход, что и в случае галогеналканов (см. 4.4.2) и спиртов (см. 5.2.4.2) чем стабильнее уходящая группа, тем легче прогекает реакция, в данном случае реакция ацилирования. Высокая ацилирующая активность галогенангидридов и ангидридов объясняется тем, что при ацилировании они отщепляют стабильные анионы галогенид- и карбоксилат-ионы. Низкая реакционная способность карбоновых кислот, сложных эфиров и амидов связана с малой сгабиль-носгью соответственно гидроксид-, алкоксид- и амид-ионов. [c.271]
Окисление эфиров функциональных производных пропанола-2 изучено недостаточно. Из окислительных реагентов для этой цели широко применен реактив Дисоноа(смесь СгОд, I SO , Н2О). Однако, наряду с образованием соответствукщего кетона, протекает процесс окислительного расщеш1ения, приводящей к сложной смеси карбонилсодержащих соединений. [c.116]
В функциональных производных кислот нет такой выровненности углерод-кислородных связей, как в карбоксилат-анионе. Поэтому, например, такие производные кислот, как сложные эфиры R—С=0, вступают во взаимодействие с магнийорганическими со- [c.233]
chem21.info
1.2 Функциональные группы
При образовании связей атомов углерода с атомами других элементов возникают функциональные группы. Функциональные группы являются реакционными центрами и вступают в определенные реакции, находясь в самых разных молекулах. Поэтому функциональные группы являются основой классификации и номенклатуры органических соединений.
А. Спирты
Функциональной группой спиртов является -ОН (гидроксильная) группа, связанная с атомом углерода.
функциональная спирт
группа (этанол)
Вместо структурной формулы для изображения молекулы спирта можно использовать сжатую структурную формулу, в которой связи атома углерода с водородом не показываются СН3_СН2_О_Н. Чаще пользуются еще более сжатой структурной формулой, в которой связи атомов углерода со всеми атомами не показываются СН3СН2ОН.
В зависимости от количества атомов углерода связанных с атомом углерода несущим гидроксильную группу _ОН спирты классифицируют как первичные (1о), вторичные (2о), или третичные (3о).
1о спирт 2о спирт 3о спирт
Упр. 5. Изобразите структуры Льюиса и сжатые структурные формулы спиртов с молекулярными формулами (а) С3Н8О, (б) С4Н10О и (в) С5Н12О. Какие из них являются первичными (1о), вторичными (2о) и третичными (3о) спиртами?
Ответ (а) Изобразим цепь из трех атомов углерода. Атом кислорода гидроксильной группы может быть присоединен к одному из крайних или к центральному атому углерода.
углеродная цепь две локации гидроксильной группы
Добавим недостающие атомы водорода связанные с атомами углерода.
Формулы Льюиса
Сжатые структурные формулы
Каркасные (черточные) формулы
первичный спирт вторичный спирт
Б. Амины
Функциональной группой аминов является аминогруппа; в ней атом азота связан с одним, двумя или тремя атомами углерода. В первичном (1о) амине атом азота соединен одинарной связью с одним атомом углерода. Во вторичном (2о) амине атом азота соединен одинарными связями с двумя атомами углерода и в третичном (3о) амине атом азота соединен с тремя атомами углерода.
аммиак метиламин диметиламин триметиламин
(1о амин) (2о амин) (3о амин)
Упр. 6. Напишите сжатые структурные формулы (а) двух первичных аминов с молекулярной формулой С3Н9N, (б) трех вторичных аминов с молекулярной формулой С4Н11N.
Ответ (а) Изобразим два атома азота с присоединенными к ним двумя атомами водорода и одним атомом углерода, затем присоединим к их атомам углерода по два атома углерода, но различными способами.
В. Альдегиды и кетоны
Функциональной группой альдегидов и кетонов является С=О (карбонильная) группа. В простейшем альдегиде формальдегиде СН2О атом углерода карбонильной группы соединен с двумя атомами водорода, а во всех других альдегидах он соединен с одним атомом водорода и с одним атомом углерода. В структурных формулах альдегидная группа может изображаться двумя способами: _СН=О и _СНО. В кетонах атом углерода карбонильной группы соединен с двумя атомами углерода.
функциональная ацетальдегид функциональная ацетон
группа (альдегид) группа (кетон)
Упр. 7. Напишите сжатые структурные формулы (а) двух альдегидов с молекулярной формулой С4Н8О, (б) трех кетонов с молекулярной формулой С5Н10О.
Ответ (а) Изобразим две функциональные группы и присоединим к ним по три атома углерода, но различными способами
Г. Карбоновые кислоты
Функциональной группой карбоновых кислот является _СООН (карбоксильная) группа. В структурных формулах карбоксильная группа может изображаться также _СО2Н.
функциональная уксусная кислота
группа (карбоновая кислота)
Упр. 8. Напишите сжатые структурные формулы кислот с молекулярной формулой (а) С3Н6О2, (б) С4Н8О2 и (в) С5Н10О2.
Ответ (а) Изобразим функциональную группу кислот и присоединим к ней два атома углерода с присоединенными к ним атомами углерода.
СН3СН2СООН
Д. Эфиры карбоновых кислот или эстеры
Эфиры карбоновых кислот или эстеры являются производными карбоновых кислот, в которых атом водорода карбоксильной группы замешен на атом углерода.
функциональная метилацетат
группа (эстер)
Упр. 9. Напишите сжатые структурные формулы эстеров с молекулярной формулой (а) С3Н6О2 и (б) С4Н8О2.
Ответ (а) Изобразим функциональную группу кислот и присоединим к ней два атома углерода с присоединенными к ним атомами водорода.
СН3СООСН3 НСООСН2СН3
studfiles.net
Реакция - функциональная группа - Большая Энциклопедия Нефти и Газа, статья, страница 1
Реакция - функциональная группа
Cтраница 1
Реакции функциональных групп могут иметь очень важное практическое применение в промышленном использовании краун-соединений. Значительная часть ведущихся исследований в области краун-соединений направлена на использование их свойств в различных сферах практики, однако остаются некоторые проблемы, связанные, например, с растворимостью и токсичностью краун-соединений ( гл. [1]
Реакции функциональных групп могут иметь очень важное практическое применение в промышленном использовании краун-соединений. [2]
Реакция функциональной группы макромолекулы с низкомолекулярным соединением является бимолекулярной. [3]
Благодаря реакции функциональных групп мономер может взаимодействовать с мономером или полимером, а полимер кроме мономера может конденсироваться с полимером. В результате набора этих одинаковых реакций по мере протекания процесса возрастает средняя молекулярная масса системы. Кинетика поликонденсации при таком рассмотрении становится довольно простой. [4]
К реакциям функциональных групп относятся главным образом реакции спиртовых групп - вторичных и первичных. К ним относятся также реакции отщепления ацетильных групп от гемицеллюлоз, реакции декарбоксилирования уроновых кислот, реакции окисления спиртовых групп. [5]
Широко известны реакции функциональных групп поливинилового спирта, целлюлозы, крахмала, в результате которых получаются имеющие большое практическое значение полиаще-тали поливинилового спирта, простые и сложные эфиры целлюлозы, полимеризующиеся эфиры крахмала. [6]
Широко известны реакции функциональных групп поливинилового спирта, целлюлозы, крахмала, в результате которых получаются имеющие большое практическое значение полиаце-тали поливинилового спирта, простые и сложные эфиры целлюлозы, полимеризующиеся эфиры крахмала. [7]
Кинетические особенности реакций функциональных групп в твердых конденсационных полимерах в общих чертах те же, что и для радикальных реакций в аддишюнных полимерах: вследствие диффузионных и стерических ограничений константы скорости образования или исчезновения функциональных групп представляют собой эффективные величины. В частности, важную роль играют низкомолекулярные вещества с большой диффузионной подвижностью. Однако связь эффективных и истинных кинетических параметров взаимодействия функциональных групп в твердом состоянии и в расплаве для конденсационных полимеров исследовалась мало, хотя необходимость такого рода исследований не вызывает сомнений. [8]
После циклизации реакцией функциональных групп X и расщепления кетальной и N-арил связей получается обычный катенан 604 или дважды продетый катенан 603 в зависимости от того, в какой конформации осуществляется циклизация. Если X - объемные концевые группы, то в результате таких превращений образуется дважды продетый ротаксан. [9]
К внутримолекулярным относятся реакции функциональных групп ( - МЩ - СООН, - ОН, - COOR, - СО, - CN), находящихся в орто-положении к амидной группе. При реакции этих групп с амидной группой получаются такие важные полимеры, как полибензимидазолы, полипиромеллитимиды, полибензокс-азолы и др. Эти реакции, называемые полициклизацией, подробно освещены, например, в работе [94] и здесь не рассматриваются. [11]
Большое практическое применение имеют реакции функциональных групп с получением новых искусственных полимеров - различных сложных и простых эфиров целлюлозы. Процессы получения сложных и простых эфиров целлюлозы представляют основные направления ее химической переработки. [12]
Выше был приведен ряд реакций функциональной группы ОН. Однако для фенолов характерны также реакции ароматического ядра, главным образом реакции замещения. Последние протекают значительно легче, чем у ароматических углеводородов. Нитрование фенола можно осуществить разбавленной азотной кислотой, тогда как в случае бензола необходима смесь азотной и серной кислот. Таким образом, группа ОН является заместителем, активирующим содержащее ее ядро. Новые заместители входят в орто - и пара-положения относительно фенольного гидроксила. [13]
Выше был приведен ряд реакций функциональной группы ОН. Однако для фенолов характерны также реакции ароматического ядра, главным образом реакции замещения. Последние протекают значительно легче, чем у ароматических углеводородов. Нитрование фенола можно осуществить разбавленной азотной кислотой, тогда как в случае бензола необходима смесь азотной и серной кислот. Таким образом, группа ОН является заместителем, активирующим содержащее ее ядро. [14]
Выбор катализатора отверждения определяется характером реакций функциональных групп олигомеров. Полимеризация олигомеров по эпоксидным группам, а также реакции этих групп с гид-роксильпыми, карбоксильными, ангидридными и др. группами наиболее эффективно катализируются третичными аминами и к-тами Льюиса. [15]
Страницы: 1 2 3 4
www.ngpedia.ru