Большая Энциклопедия Нефти и Газа. Фосфорный эфир
Фосфорный эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Фосфорный эфир
Cтраница 1
Фосфорные эфиры при облучении в водном растворе дают неорганический фосфат и превращаются в легко гидролизуемую форму. Нуклеиновые кислоты ведут себя подобным же образом, но дополнительно участвуют в многочисленных других реакциях. Молекулярный вес нуклеиновых кислот уменьшается во время облучения и продолжает уменьшаться впоследствии. Эти изменения молекулярного веса, по крайней мере частично, могут быть вызваны действием на фосфатные эфирные группы. Хотя действие излучения на нуклеопротеины и имеет большое значение, оно непонятно, потому что сами нуклеопротеины недостаточно изучены. [1]
Фосфорные эфиры углеводов разделяют с помощью бумажной хроматографии в системе пропиловый спирт - муравьиная кислота. Для определения положения фосфорных эфиров углеводов на бумажных хроматограммах используют метод, предложенный Ваде и Морганом. Таким образом, в местах нахождения фосфорных эфиров образуются белые пятна. Количественный метод сводится к определению фосфора после минерализации элюата, полученного из того места хроматограммы ( не проявленной), тде было зафиксировано положение эфира углевода. [2]
Неустойчивые фосфорные эфиры образуются как в присутствии, так и в отсутствие кислорода. [3]
Фосфорный эфир пиридоксаля по оксиметильной группе положения 5 ( CLXVII) в свободном виде получается с трудом. [4]
Образуются фосфорные эфиры Сахаров. Под действием фермента гексоки-назы и адениловых кислот, являющихся донаторами и акцепторами фосфорной кислоты, глюкоза превращается в глюкогшранозо-6 - фосфат. Гексокиназа катализирует перенос одной фосфорной группы с АТФ на глюкозу. При этом АТФ превращается в АДФ, а остаток фосфорной кислоты присоединяется по месту шестого углеродного атома. Действие фермента активируется ионами магния. Глкжокиназная реакция определяет скорость процесса брожения. [5]
Синтез фосфорного эфира 2-метил - 1 4-нафтохинона был осуществлен в 1964 г. в Радиевом институте по схеме, состоящей из шести стадий и отличающейся от синтеза Физера, Фрея [69] и Эндрюса с сотрудниками [70] характером выполнения некоторых стадий: фосфорилирования, выделения фосфорного эфира и гидрирования, в которые были введены новые растворители и применен другой катализатор. [6]
Хроматографирование фосфорных эфиров в виде калиевых или аммониевых солей более целесообразно, чем Хроматографирование свободных эфиров, полученных при обессоливании раствора катионитом. [7]
Образование многочисленных фосфорных эфиров в процессе окисления различных веществ в животном организме играет важную биологическую роль. Дело в том, что при расщеплении связей фосфорной кислоты с углеродом в условиях животного организма освобождается большое количество энергии ( 12000 кал на 1 моль фосфорной кислоты), в силу чего эта связь называется макроэргической. Эфиры фосфорной кислоты, несущие в себе большой запас энергии, являются в животном организме своеобразными аккумуляторами энергии. Энергия, освобождающаяся в процессе окисления различных органических веществ, не расходуется сразу, а откладывается, если так можно выразить, в запас в виде сложных эфиров фосфорной кислоты. Запасенная энергия расходуется по мере надобности, освобождаясь в результате расщепления эфиров фосфорной кислоты. [8]
Образование многочисленных фосфорных эфиров в процессе окисления различных веществ в животном организме играет важную биологическую роль. [9]
В ДНК фосфорные эфиры образуются за счет связей только между 3 и 5 углеродными атомами дезоксирибозы, причем межнуклеотидные связи возникают у 3 углерода пентозы. [10]
На хроматограмме фосфорные эфиры углеводов располагаются в следующем порядке ( снизу вверх): фруктозодифосфат, глюкозо-6 - фос-фат, фруктозо-6 - фосфат, фосфоглицериновая кислота. Пятна неорганического фосфата располагаются выше пятен фосфорных эфиров углеводов. [11]
Фодек-2, фосфорный эфир крахмала ( ТУ 88 УССР 192 - 78), горючий порошок. [12]
Дипольный момент фосфорных эфиров значительно выше дипольного момента фосфористых эфиров. [13]
Для окраски фосфорных эфиров в компонентах НК была предложена следующая пропись. Реагент стоек в течение нескольких часов. [14]
Одним из простейших фосфорных эфиров является этилфос-фат. Ацетилфосфат медленно разлагается, особенно в кислых средах, давая неорганический фосфат. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Фосфорные эфиры - Госстандарт
- (Ch4O)P(O)(OH)2 — метилфосфат
- (Ch4O)2P(O)OH — диметилфосфат
- (Ch4O)3PO — триметилфосфат
Фосфаты органические, эфиры фосфорной кислоты общей ф-лы (RО)nР(О)(ОН)3_n, где R - орг. радикал, n = 1-3. Различают полные (n = 3; средние, или третичные Фосфорные эфиры) и кислые Ф.о. (n = 1,2, соотв. первичные и вторичные Ф.о.).
Назв. Фосфорные эфиры включает назв. орг. радикала (радикалов) в алкоксильной группе, которые являются префиксами к слову "фосфат", иногда Фосфорные эфиры наз. как эфир фосфорной кислоты [напр., C2H5OP(O)(OH)2 - этилфосфат, или этиловый эфир фосфорной кислоты]; кислые Фосфорные эфиры наз. также органил- и диорганилфос-форными кислотами [напр., (C2H5O)2P(O)OH - диэтилфосфор-ная кислота].
Кислые Фосфорные эфиры, в которых R - остаток глицерина, углевода, аминоспиртов и др. (напр., аденозинмонофосфат циклический, нуклеиновые кислоты, нуклеотиды, тейхоевые кислоты, фосфолипиды), распространены во всех живых организмах и имеют важное значение для их жизнедеятельности.
Физико-химические свойства. Как правило, фосфорные эфиры с низшими алифа-тич. радикалами - подвижные (n = 3) или вязкие (n =1,2) жидкости, остальные - кристаллич. вещества или масла (табл.). Большинство кислых и полных фосфорных эфиров с низшими алифатич. радикалами раств. в воде; многие Фосфорные эфиры раств. в спиртах, CHCl3 и др. полярных орг. растворителях; третичные и вторичные фосфорные эфиры с R = Alk, Ar раств. также в простых эфирах, бензоле, галогенуглеводородах.
Свойства органических фосфатов
| Соединение | T. кип., 0С/мм рт. ст. | Т. пл., 0С. | d204 | n20D | Хим. сдвиг в спектре ЯМР3IР, м.д. |
| C2H5OP(O)(OH)2 | Разлагается при нагр. | Сироп | — | — | — |
| PhOP(O)(OH)2 | — | 98 b1 | — | — | -5,6 |
| (Ch4O)2P(O)OH | 80/10-4 | Сироп | 1,3337 | 1,4049 | — |
| (C4H9O)2P(O)OH | 135-138/10-2 | Масло | — | 1,4288 | -3(b1) |
| (н-C6h23O)2P(O)OH | 136/10-4 | Масло | 1,0180* | 1,4350 | - |
| (PhO)2P(O)OH | — | 70 | — | — | -10 |
| (4-BrC6h5O)2P(O)OH | — | 200 | — | — | -9 |
| (Ch4O)3PO | 192/760 | — | 1,2144 | 1,3963 | + 1,5 |
| (C4H9O)3PO | 160/15 | — | 0,9766 | 1,4250 | -1 |
| (C5h21O)3PO | 167/5 | — | 0,9608 | 1,4319 | -4 |
| (Ch3 = CHO)3PO | 58/4 | — | 1,1209 | 1,4289 | — |
| (PhO)3PO | 245/11 | 50 | — | — | -18 |
| (4-Ch4C6h5O)3PO | 220-222/2 | — | 1,1785 | 1,5566 | -17 |
Кислые фосфорные эфиры (их соли также наз. фосфатами) - более сильные кислоты, чем h4PO4 [напр., рКа для Ch4OP(O)(OH)2 1,54 и 6,31, для глюкозо-6-фосфата 0,94 и 6,11, для (Ch4O)2P(O)(OH) 1,29]. Диалкилфосфаты в растворе обычно ди-мерны, моноалкилфосфаты в гексане, бензоле и CCl4 - оли-гомеры (степень олигомеризации 8-14), в метаноле - мономеры.
Конфигурация молекул - тетраэдрическая с атомом P в центре. Величины дипольных моментов фосфорных эфиров колеблются в пределах 7,6· 10-30- 1,067· 10-29Кл·м. В ИК спектрах полосы поглощения связи P = O 1200-1320, P-OH 820-1030, P-OC 1087-1242, C-OP ок. 1030, О —H 2525-3000 и 2000-2400 см -1. В спектрах ЯМР 31P хим. сдвиги от -23 до +28 м. д.; константы спин-спинового взаимод. атомов Р-0-Нб-11 Гц.
Химические свойства. Триарилфосфаты обычно устойчивы до 300-350 0C; алкил- и арил(алкил)фосфаты разлагаются при температуре выше 150 0C (разложение полных фосфатов катализируют кислые примеси). При термич. разложении алкилфосфа-тов обычно образуются олефины.
Получение фосфорных эфиров Общий метод синтеза фосфорных эфиров в промышленности основан на реакции POCl3 со спиртами или фенолами (в присутствии акцепторов HCl или с его отдувом) либо с их Na- или К-производными. Атомы Cl в POCl3 можно последовательно замещать на разл. группы RO. Образующиеся первоначально хлорфосфаты путем гидролиза можно превращать в кислые Фосфорные эфиры, а действием эпоксидов – в хлоралкилфосфаты.
Кислые Фосфорные эфиры получают также алкоголизом P2O5. В зависимости от соотношения реагентов и др. условий образуются преим. первичные или вторичные фосфаты, либо эквимоляр-ная смесь этих соединений.
Пром. значение имеют также след, методы синтеза Фосфорные эфиры: взаимод. PCl3 или белого P со спиртами и хлором; получение (C2H5O)3PO реакций P2O5 с диэтиловым эфиром в атмосфере этилена при 180 0C; действие ROH на диалкилфосфиты в среде CCl4 в присутствии третичных аминов (см. Тодда-Атертона реакция). Винилфосфаты получают взаимод. (RO)3P с a-гало-генкарбонильными соед.
himiya.gosstandart.info
эфиры фосфорной кислоты и их применение в качестве смачивающего вещества и диспергатора - патент РФ 2402557
Настоящее изобретение относится к эфиру фосфорной кислоты и его соли формулы I, которые можно использовать в качестве смачивающих веществ или диспергаторов
 ,
,
где фрагмент А - представляет собой производное групп С1-С20-алкил(АО)х-ОН, ацил(АО)х-ОН, С1-С20алкил-(АО)х-(ГК)у-ОН, ацил(АО)х-(ГК)у-ОН, С1-С20алкил-(АО)х-(ДК-АО)у-ОН, ацил(АО)х-(ДК-АО)у-ОН, МС-(ГК)у-ОН или МС-(ДК-АО)у-ОН; где ацил представляет собой остаток лауриновой, миристиновой, стеариновой, арахиновой, олеиновой или линолевой кислоты; АО обозначает остаток полиС2-С3алкиленгликоля, ГК обозначает остаток  -капролактона или
-капролактона или  -валеролактона; ДК обозначает остаток янтарной, малеиновой, малоновой, глутаровой, адипиновой, фталевой, себациновой, щавелевой, дигликолевой кислоты и ангидридов этих кислот; МС обозначает остаток н-бутанола, 2-этил-1-гексанола, цетилового спирта, олеилового спирта, линолеилового спирта, оксоспиртов, циклогексанола, фенола, фенилэтанола и бензилового спирта; х и у - числа от 2 до 50, В обозначает остаток яблочной или лимонной кислоты; n обозначает от 1 до 2; m обозначает от 1 до 4. Технический результат - получение новых эффективных смачивающих веществ и диспергаторов. 2 н.п. ф-лы, 7 табл.
-валеролактона; ДК обозначает остаток янтарной, малеиновой, малоновой, глутаровой, адипиновой, фталевой, себациновой, щавелевой, дигликолевой кислоты и ангидридов этих кислот; МС обозначает остаток н-бутанола, 2-этил-1-гексанола, цетилового спирта, олеилового спирта, линолеилового спирта, оксоспиртов, циклогексанола, фенола, фенилэтанола и бензилового спирта; х и у - числа от 2 до 50, В обозначает остаток яблочной или лимонной кислоты; n обозначает от 1 до 2; m обозначает от 1 до 4. Технический результат - получение новых эффективных смачивающих веществ и диспергаторов. 2 н.п. ф-лы, 7 табл.
Настоящее изобретение относится к эфирам фосфорной кислоты и их солям и к применению этих эфиров фосфорной кислоты и солей в качестве диспергаторов.
Для введения твердых веществ, таких как пигменты, в жидкие среды требуются большие механические усилия. В значительной степени это зависит от способности твердого вещества смачиваться окружающей средой, а также от сродства с этой средой. С целью уменьшить эти диспергирующие усилия обычно используют диспергаторы, которые упрощают введение веществ. Это относится главным образом к поверхностно-активным агентам или поверхностно-активным веществам анионоактивной или катионоактивной, или неионогенной структуры. В относительно небольших добавляемых количествах эти вещества либо наносят непосредственно на твердое вещество, либо добавляют в дисперсионную среду. Благодаря такому поверхностно-активному веществу значительно уменьшается энергия, необходимая для диспергирования.
Более того известно, что таким твердым веществам после диспергирования свойственна повторная агломерация, которая сводит к нулю первоначально индуцированную энергию диспергирования и приводит к серьезным проблемам. Это явление может быть объяснено, помимо прочего, силами Лондона/Ван дер Ваальса, благодаря которым твердые вещества взаимно притягиваются. Для того чтобы свести к нулю эти силы притяжения, твердые вещества должны быть снабжены адсорбционными слоями. Этого добиваются путем применения таких поверхностно-активных веществ или полимеров.
Однако во время и после диспергирования возникает взаимодействие окружающей среды с твердой частицей, вследствие чего может происходить десорбция поверхностно-активного вещества в обмен на окружающую среду, содержащуюся в более высокой концентрации. Однако в большинстве случаев эта окружающая среда неспособна к образованию таких стабильных адсорбционных слоев, вследствие чего система в целом флокулирует. Это становится очевидным, помимо прочего, вследствие повышения вязкости жидких систем, потери блеска, изменений цвета красок и покрытий, недостаточного проявления интенсивности окраски окрашенных с помощью пигментов пластмасс и лаков, а также уменьшения механической прочности армированных пластиков.
В ЕР 0417490 В1 (фирма Byk-Chemie) описаны эфиры фосфорной кислоты и их соли, соответствующие формуле (НО)3-n-РО-(OR)n, в которой R обозначает алифатический, циклоалифатический и/или ароматический остаток, содержащий по меньшей мере один атом кислорода простого эфира (-O-) и по меньшей мере одну группу эфира карбоновой кислоты (-СОО-) и/или уретановую группу (-NHCOO-) без атома водорода Церевитинова. В качестве примера описано соединение следующей формулы: алкил-[O(СН2)х]z-[O-С=O(СН 2)х]у-O-Р=O(ОН)2.
В ЕР 765356 В1 (фирма Zeneca) описан диспергатор, который может быть получен реакцией полиэтиленгликоля с гидроксикарбоновой кислотой и/или с алкиленоксидом с получением полимерного диола и фосфатированием диола.
Эфиры фосфорной кислоты, обладающие свободной карбоксильной группой, или эфиры фосфорной кислоты, которые разветвлены посредством свободной карбоксильной группы, не описаны.
Объектом настоящего изобретения является получение диспергатора, обладающего улучшенными диспергирующими свойствами для органических и неорганических пигментов, а также для наполнителей и сухих разбавителей в водных и неводных системах.
Изобретение относится к эфиру фосфорной кислоты и его солям общей формулы I

в которой
А обозначает моногидроксильный остаток;
В обозначает остаток моно-, ди-, три- или полигидроксиди-, три- или - мультикарбоновой кислоты, который связан посредством гидроксильной группы с фосфорной кислотой и посредством одной из карбоксильных групп с моногидроксильным остатком [А], оставшаяся карбоксильная группа (группы) свободна или эстерифицирована другим моногидроксильным остатком [А] с образованием разветвленных эфиров;
n обозначает от 1 до 2;
m обозначает от 1 до 4.
Существенной особенностью предлагаемых по изобретению эфиров фосфорной кислоты является наличие остатка [В] моно-, ди-, три или полигидроксиди-, три- или -мультикарбоновой кислоты.
Что касается [В], то важно, чтобы либо содержалась по меньшей мере одна свободная карбоксильная группа, либо чтобы в результате эстерификации свободной карбоновой кислоты образовывался по меньшей мере один центр разветвления. Если выбирают три- или мультикарбоновую кислоту, то содержатся две или большее число свободных карбоксильных групп. Существует возможность того, что свободные карбоксильные группы остаются свободными, являются полностью эстерифицированными с образованием разветвленных соединений или являются частично эстерифицированными с образованием разветвленных соединений, обладающих свободной карбоксильной группой. Во всех случаях свободные карбоксильные группы могут быть превращены в соль.
Моно-, ди-, три- или полигидроксиди-, три- или мультикарбоновая кислота [В], предусмотренная для применения, может представлять собой, например, винную кислоту, яблочную кислоту, лимонно-яблочную кислоту (2-метил-яблочную кислоту), 3-гидрокси-3-метилглутаровую кислоту, 5-гидроксиизофталевую кислоту, аскорбиновую кислоту или лимонную кислоту, предпочтительно яблочную кислоту (гидроксибутандикарбоновую кислоту) или лимонную кислоту.
Мультикарбоновая кислота представляет собой любую кислоту, которая включает больше трех карбоксильных групп, например гидроксибензол-1,2,4,5-тетракарбоновая кислота.
Моногидроксильный остаток [А] может включать цепь простого полиэфира, цепь сложного полиэфира или цепь смешанного простого полиэфира-сложного полиэфира, благодаря чему соответствующие группы могут находиться в виде блоков или размещаться неупорядоченно.
В предпочтительном варианте [А] включает полиС 2-С4алкиленгликольмоноэфир и/или полиС2 -С4алкиленгликольмоноэфир карбоновой кислоты. Приемлемые полиС2-С4алкиленгликольмоноэфиры представляют собой С1-С20алкильные эфиры, предпочтительно метильные эфиры (Ме-ПЭГ), (Ме-ППГ), бутильные эфиры (Bu-ППГ), алкилфенольные эфиры (АФЭ), простые эфиры жирных С12 -С20спиртов или простые эфиры С10-С 15оксоспиртов.
ПолиС2-С4 алкиленгликолевые эфиры карбоновых кислот представляют собой, например, полиС2-С4алкиленгликольмонолаурат, полиС2-С4алкиленгликольмоностеарат, полиС 2-С4алкиленгликольмоноолеат и полиС2 -С4алкиленгликольбензоат.
ПолиС 2-С4алкиленгликолевый моноэфир и/или полиС 2-С4алкиленгликолевый сложный моноэфир может быть эстерифицирован посредством [В] или может быть связан с [В] посредством сложных полиэфирных звеньев, дериватизированных из гидроксикарбоновой кислоты или ее лактона [ГК], и/или посредством звеньев, дериватизированных из дикарбоновой кислоты [ДК], которая связана с диолом посредством C2-С4алкиленоксидной [АО] структуры.
Таким образом могут быть получены следующие моногидроксильные соединения [А]
С 1-С20-алкил(АО)х-ОН или ацил(АО)х-ОН
С1-С20алкил-(АО)х-(ГК)у-ОН или ацил(АО)х-(ГК)у-ОН С1-С20алкил-(АО)х-(ДК-АО)у-ОН или ацил(АО)х-(ДК-АО)у-ОН,
у которых
С1-С20 алкил представляет собой прямоцепочечный или разветвленный углеводородный остаток,
ацил представляет собой остаток ароматической карбоновой кислоты, такой как, например, остаток бензойной кислоты или остаток насыщенной или ненасыщенной жирной кислоты, такой как, например, лауриновая кислота, миристиновая кислота, стеариновая кислота, арахиновая кислота, олеиновая кислота, линолевая кислота и т.п.,
АО обозначает полиС2-С 4алкиленгликолевый остаток, такой как, например, полиэтиленгликолевый (ПЭГ), полипропиленгликолевый (ППГ), полибутиленгликолевый, включая блок-сополимер этиленоксида и пропиленоксида,
ГК обозначает гидроксикарбоновую кислоту или ее лактон, такую как, например, молочная кислота, гликолевая кислота, 6-гидроксигексановая кислота, 12-гидроксистеариновая кислота, 12-гидроксидодекановая кислота, 5-гидроксидодекановая кислота, 5-гидроксидекановая кислота, 4-гидроксидекановая кислота, или лактоны, такие как  -пропиолактон,
-пропиолактон,  -бутиролактон,
-бутиролактон,  -валеролактон или
-валеролактон или  -капролактон, включая блок-сополимер, такой как, например,
-капролактон, включая блок-сополимер, такой как, например,  -капролактон/
-капролактон/ -валеролактон,
-валеролактон,
ДК обозначает дикарбоновую кислоту, такую как, например, янтарная кислота, малеиновая кислота, малоновая кислота, глутаровая кислота, адипиновая кислота, фталевая кислота, себациновая кислота, щавелевая кислота, дигликолевая кислота, или ангидриды этих кислот,
х обозначает число от 1 до 250, предпочтительно от 2 до 50, более предпочтительно от 5 до 15,
у обозначает число от 1 до 250, предпочтительно от 2 до 50, более предпочтительно от 2 до 15.
Сложное полиэфирне звено можно также начать с моноспирта, целесообразно содержащего от 4 до 30, предпочтительно от 4 до 20, углеродных атомов, такого как н-бутанол и 2-этил-1-гексанол, цетиловый спирт, олеиловый спирт, линолеиловый спирт, оксоспирты, циклогексанол, фенол, фенилэтанол и бензиловый спирт.
Таким образом могут быть получены следующие моногидроксильные соединения [А]
МС-(ГК)у-ОН или МС-(ДК-АО)у-ОН,
у которых
МС обозначает моноспирт, как он представлен выше,
ГК обозначает гидроксикарбоновую кислоту или ее лактон, как они представлены выше,
ДК обозначает дикарбоновую кислоту, как она представлена выше,
АО обозначает полиС2-С4алкиленгликолевый остаток, как он представлен выше.
В моногидроксильное соединение [А] могут быть включены другие звенья, такие как уретановые или амидные звенья/функциональные группы.
Отношение молекулярной массы звена [А] к молекулярной массе звена [В] составляет от 1,5:1 до 8:1, предпочтительно от 2:1 до 5:1.
Предпочтительные эфиры фосфорной кислоты представляют собой те, которые дериватизированы из Ме-ПЭГ-ОН, обладающего молекулярной массой от 250 до 750. Предпочтительно также, чтобы  -капролактон содержался в виде гидроксикарбоновой кислоты. Предпочтительной гидроксидикарбоновой кислотой является яблочная кислота.
-капролактон содержался в виде гидроксикарбоновой кислоты. Предпочтительной гидроксидикарбоновой кислотой является яблочная кислота.
Эфир фосфорной кислоты формулы I может быть получен проведением известных реакций эстерификации. Полиалкиленгликолевый эфир, предпочтительно Ме-ПЭГ-ОН, при повышенных температурах, например от 100 до 250°С, вводят в реакцию с моно-, ди-, три- или полигидроксиди-, три- или мультикарбоновой кислотой в присутствии катализатора эстерификации, такого как, например, дибутилоловодилаурат, тетра-алкилтитанат, п-толуолсульфоновая кислота и ацетилацетонат двухвалентного железа.
Если содержится звено гидроксикарбоновой кислоты, такое как, например, капролактон, вначале полиалкиленгликолевый эфир эстерифицируют гидроксикарбоновой кислотой, а затем моно-, ди-, три- или полигидроксиди-, три- или мультикарбоновой кислотой.
Катализатор обычно используют в количестве от 0,005 до 0,5 моля на 100 молей гидроксиди- или трикарбоновой кислоты. Можно добавлять инертный растворитель, однако, в предпочтительном варианте эстерификация протекает в отсутствие растворителя.
Эфиры фосфорной кислоты формулы I получают реакцией одной из гидроксильных групп остатка моно-, ди-, три- или полигидроксиди-, три- или мультикарбоновой кислоты блок-сополимера, полученного по вышеизложенному, с соединением фосфора, которое образует эфиры фосфорной кислоты, по методу, который известен. Предпочтительное соединение фосфора представляет собой полифосфорную кислоту или P2O5. Если в качестве фосфорной кислоты используют P2O5 , то получают смесь моно- и диэфиров.
Соли эфира фосфорной кислоты могут быть получены нейтрализацией гидроксидом щелочного металла, аммиаком, амином, алканоламином или четвертичным аммониевым соединением.
Другим объектом изобретения является получение смесей эфиров фосфорной кислоты формулы I с эфирами фосфорной кислоты простых полиС2-С4 алкиленгликольмоноэфиров и/или полиС2-С4 алкиленгликольмоноэфиров карбоновой кислоты, или с другими технически доступными смачивающими веществами и диспергаторами, такими как, например, EFKA-5066, EFKA-5070, EFKA-5207, EFKA-5244, EFKA-6220, EFKA-6225, EFKA-6230, EFKA-8503, EFKA-8510, EFKA-8511, EFKA-8530, EFKA-8531, EFKA-8532 и т.п.
Предпочтительны смеси эфиров фосфорной кислоты формулы I с эфирами фосфорной кислоты простых полиС2-С4алкиленгликольмоноэфиров в массовом отношении 0,01 к 99,99, предпочтительно 10 к 90, более предпочтительно 50 к 50.
Объектом изобретения является также применение эфиров фосфорной кислоты формулы I в качестве диспергаторов и в качестве стабилизаторов дисперсий. Диспергаторы в соответствии с изобретением можно использовать для получения покрытий из водоразбавляемого лакокрасочного материала и лакокрасочного материала с органическим растворителем и печатных красок. Те диспергаторы, которые не являются водорастворимыми, могут проявлять в воде эффект самоэмульгирования, вследствие чего они приемлемы для применения в покрытиях из водоразбавляемого лакокрасочного материала и лакокрасочного материала с органическим растворителем, а также в печатных красках. По другому варианту им можно придать полную водорастворимость нейтрализацией эфирных групп фосфорной и карбоновых кислот гидроксидами щелочных металлов, подобными раствору гидроксида калия, или аминами, такими как аммиак, диметилэтаноламин и т.п. Степень нейтрализации составляет от 0,5 до 2 экв. нейтрализующего агента на эквивалент диспергатора, предпочтительно от 0,8 до 1,5 экв. нейтрализующего агента. В связи с этим покрытия из водоразбавляемого лакокрасочного материала и лакокрасочного материала с органическим растворителем и печатные краски, которые упоминаются в настоящем описании, также относятся к тем продуктам, которые частично включают органические сорастворители. Пигменты, используемые в данной области техники, представляют собой органические и неорганические пигменты, не растворяющиеся в используемой жидкости, например сажа, полициклические пигменты, оксиды железа и т.д.
Диспергаторы в соответствии с изобретением могут быть также использованы при получении смол, включающих твердые частицы, такие как пигменты, наполнители и волокна. Такие системы известны как листовые формовочные материалы (ЛФМ) или стеклонаполненные композиции для прессования (СКП) и основаны на ненасыщенных сложных полиэфирных смолах. Для того чтобы добиться в современной области техники целевых физических свойств конечного продукта, эти системы должны обладать высоким содержанием таких твердых частиц (как правило >250 част./100). Вследствие высокой вязкости, вызванной высоким содержанием твердых частиц, отмечают недостаточное смачивание армирующих волокон и захват воздуха. Применение диспергаторов в соответствии с изобретением приводит к достаточному снижению вязкости для усиления смачивания волокон при таких высоких степенях наполнения.
Примеры сухих разбавителей и наполнителей, которые могут быть диспергированы, представляют собой, в частности, карбонат кальция, оксид алюминия, тригидроксид алюминия (ТГА), песок, белую глину, тальк, каолин, диоксид кремния, бариты и мел, стеклянные волокна, стеклянный бисер или металлические порошки.
Для специалиста в данной области техники является очевидным и обычным тот факт, что эти примеры служат просто выбором возможностей, которые существуют, и ни в коем случае не рассматриваются в качестве ограничения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Общий метод получения эфиров фосфорной кислоты и примеры
Пример 1
Метод А. эфир фосфорной кислоты А: Ме-(ЕО) 7-МА-Р
В азотной атмосфере полиэтиленгликольмонометиловый эфир (MPEG 350, MW: 350, 65,3 г, 1 экв.) и яблочную кислоту (25,0 г, 1 экв.) загружали в реактор при комнатной температуре и нагревали до 180°С. В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. В течение нескольких часов из реактора удаляли реакционную воду, до тех пор, пока не достигали кислотного числа от 105 до 115 мг КОН/г. За последующим охлаждением светло-желтой жидкости до 60°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота (РРА 116), 20,8 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты А получали при комнатной температуре в виде прозрачной вязкой желтоватой жидкости.
Пример 2
Метод Б. эфир фосфорной кислоты Б-1: Me-(EO)7-CL2-MA-P
В азотной атмосфере полиэтиленгликольмонометиловый эфир (MW: 350, 44,4 г, 1 экв.) и капролактон (28,3 г, 2 экв.) загружали в реактор при комнатной температуре и нагревали до 180°С. В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. Реакционную смесь перемешивали в течение нескольких часов, до тех пор, пока не достигали содержания сухого вещества >98%.
Реакционную смесь охлаждали до 140°С и добавляли яблочной кислоты (16,6 г, 1 экв.). В дальнейшем реакционную смесь нагревали до 180°С и в течение нескольких часов из оборудования удаляли реакционную воду, до тех пор, пока не достигали кислотного числа от 60 до 70 мг КОН/г. За последующим охлаждением светло-желтой жидкости до 60°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота, 13,8 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты Б получали в виде прозрачной вязкой оранжевой жидкости, которая при комнатной температуре медленно затвердевала.
Пример 3
Метод Б, эфир фосфорной кислоты Б-2: Ме-(ЕО)7-CL4-МА-Р
В азотной атмосфере полиэтиленгликольмонометиловый эфир (MW: 350, 44,4 г, 1 экв.) и капролактон (56,63 г, 4 экв.) загружали в реактор при комнатной температуре и нагревали до 180°С. В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. Реакционную смесь перемешивали в течение нескольких часов, до тех пор, пока не достигали содержания сухого вещества >98%.
Реакционную смесь охлаждали до 140°С и добавляли яблочной кислоты (16,6 г, 1 экв.). В дальнейшем реакционную смесь нагревали до 180°С и в течение нескольких часов из оборудования удаляли реакционную воду, до тех пор, пока не достигали кислотного числа от 50 до 60 мг КОН/г. За последующим охлаждением светло-желтой жидкости до 60°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота, 13,8 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты Б получали в виде прозрачной вязкой оранжевой жидкости, которая при комнатной температуре медленно затвердевала.
Пример 4
Метод В, эфир фосфорной кислоты В: Me-(EO)7-CL4-CA-P
В азотной атмосфере полиэтиленгликольмонометиловый эфир (MW: 350, 43,3 г, 1 экв.) и капролактон (28,3 г, 2 экв.) загружали в реактор при комнатной температуре и нагревали до 180°С. В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. Реакционную смесь перемешивали в течение нескольких часов, до тех пор, пока не достигали содержания сухого вещества >98%.
Реакционную смесь охлаждали до 140°С и добавляли лимонной кислоты (23,8 г, 1 экв.). В дальнейшем реакционную смесь нагревали до 180°С и в течение нескольких часов из реактора удаляли реакционную воду, до тех пор, пока не достигали кислотного числа от 130 до 140 мг КОН/г. За последующим охлаждением светло-желтой жидкости до 60°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота, 13,8 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты В получали при комнатной температуре в виде прозрачной вязкой коричневатой жидкости.
Пример 5
Метод Г (Ме-(ЕО)7)2 -МА-Р
Аналогично методу А или Б, но с отношением 2 экв. полимерного моноспирта к 1 экв. яблочной кислоты, полностью эстерифицированных на первой стадии.
Пример 6
Аналогичным путем получали следующие продукты:
| Эфир фосф. кис-ты | Метод | Исходные материалы * | (MW) | Эквиваленты |
| Г (желтая жидк.) | Г | Ме-ПЭГ-ОН | 500 | 2 |
| Д (желтая жидк.) | А | Ме-ППГ-ОН | 200 | 1 |
| Е (желтая жидк.) | А | Вu-ППГ-ОН | 1100 | 1 |
| Ж (оранжевая жидк.) | Б | 2-Этил-1-гексанол | 130 | 1 |
| Капролактон/Валеролактон | 2:3 | |||
| 3 (белое твердое вещество) | Б | Цетиловый спирт | 242 | 1 |
| Капролактон | 7 | |||
| К-1 (не совсем белая паста) | В | Ме-ПЭГ-ОН | 350 | 2 |
| Капролактон | 6 | |||
| К-2 (желтоватая паста) | В | Ме-ПЭГ-ОН | 350 | 3 |
| Капролактон | 9 | |||
| К-3 (желтоватая жидк.) | В | Ме-ПЭГ-ОН | 350 | 2 |
| К-4 (коричневатая жидк.) | В | Ме-ПЭГ-ОН | 350 | 3 |
| *ПЭГ: полиэтиленгликоль | ||||
| *ППГ: полипропиленгликоль |
Пример 7
Эфир фосфорной кислоты К-1: (Me-(EO)7-CL2)2-CA-P
Аналогично методу В, но с отношением 2 экв. полимерного моноспирта к 1 экв. лимонной кислоты, полностью эстерифицированных на первой стадии.
Пример 8
Эфир фосфорной кислоты К-2: (Me-(EO)7-CL2)3 -CA-P
Аналогично методу С, но с отношением 3 экв. полимерного моноспирта к 1 экв. лимонной кислоты, полностью эстерифицированных на первой стадии.
Пример 9
Эфир фосфорной кислоты К-3: (Ме-(ЕО)7)2-СА-Р
Аналогично методу В, но с отношением 2 экв. МПЭГ 350 к 1 экв. лимонной кислоты, полностью эстерифицированных на первой стадии.
Пример 10
Эфир фосфорной кислоты К-4: (Me-(EO7)3-CA-P
Аналогично методу В, но с отношением 3 экв. МПЭГ 350 к 1 экв. лимонной кислоты, полностью эстерифицированных на первой стадии.
Пример 11
Метод Л, эфир фосфорной кислоты Л
В азотной атмосфере полиэтиленгликольмонометиловый эфир (MW: 350, 35 г, 1 экв.), адипиновую кислоту (36,5 г, 2,5 экв.) и дипропиленгликоль (33,5 г, 2,5 экв.) загружали в реактор при комнатной температуре и нагревали до 190°С. В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. В течение 6 ч из этой смеси удаляли реакционную воду. Полученную желтоватую жидкость охлаждали до 140°С и в дальнейшем проводили реакцию с яблочной кислотой (13,4 г, 1 экв.) и полифосфорной кислотой (11,0 г, 0,33 экв.), как указано в методе Б. При комнатной температуре эфир фосфорной кислоты Л представлял собой темно-желтую жидкость.
Пример 12
Метод М, эфир фосфорной кислоты М (смесь эфиров фосфорной кислоты)
В азотной атмосфере полиэтиленгликольмонолаурат (MW: 600, 24 г, 1 экв.) и капролактон (13,7 г, 3 экв.) загружали в реактор при комнатной температуре и нагревали до 180°С. В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. Реакционную смесь перемешивали в течение нескольких часов, до тех пор, пока не достигали содержания сухого вещества >98%. Реакционную смесь охлаждали до 140°С и добавляли яблочной кислоты (5,36 г, 1 экв.). В дальнейшем все нагревали до 180°С, выдерживали в течение нескольких часов и из реактора удаляли реакционную воду до тех пор, пока не достигали кислотного числа от 50 до 60 мг КОН/г. Содержимое реактора охлаждали до 60°С и добавляли полиэтиленгликольмоноалкилового эфира (Lutensol TO 8 (фирма BASF) MW: приблизит. 540, 21,6 г, 1 экв.). После равномерного перемешивания в процессе следовало при интенсивном перемешивании медленное добавление полифосфорной кислоты (тетрафосфорная кислота, 9,05 г, 0,66 экв.). Полученную смесь перемешивали при 100°С в течение одного часа. Эфир фосфорной кислоты М получали в виде прозрачной вязкой желтоватой жидкости, которая при комнатной температуре затвердевала до слегка желтой пасты.
(фирма BASF) MW: приблизит. 540, 21,6 г, 1 экв.). После равномерного перемешивания в процессе следовало при интенсивном перемешивании медленное добавление полифосфорной кислоты (тетрафосфорная кислота, 9,05 г, 0,66 экв.). Полученную смесь перемешивали при 100°С в течение одного часа. Эфир фосфорной кислоты М получали в виде прозрачной вязкой желтоватой жидкости, которая при комнатной температуре затвердевала до слегка желтой пасты.
Пример 13
Метод H
Аналогично методу А или Б. Вместо полифосфорной кислоты на последней стадии синтеза использовали пентоксид фосфора (1 экв. на 3 экв. полимерного моноспирта) с получением смеси 1:1 моно- и диэфиров фосфорной кислоты. Реакционные условия: добавление P2O5 в моноспирт при 50°С и интенсивном перемешивании с последующими медленным повышением температуры до 80°С и перемешиванием в течение 1 ч.
| Эфир фосф.кис-ты | Метод | Исходные материалы * | (MW) | Эквиваленты |
| Н (желто-коричневая жидк.) | Н | Ме-ПЭГ-ОН | 500 | 1 |
| O (белая паста) | Н | Ме-ППГ-ОН | 350 | 1 |
| Капролактон | 2 | |||
| П (желтоватое твердое вещество) | Н | 1-Додеканол | 186 | 1 |
| Капролактон | 3 | |||
| *ПЭГ: полиэтиленгликоль |
Пример 14
Эфир фосфорной кислоты Р
Эфир фосфорной кислоты Б (100 г, MW: приблизит.775, 1 экв.) при комнатной температуре диспергировали в 125 мл деминерализованной воды. В эту смесь медленно, в течение 30 мин добавляли раствор КОН (25%-ный в воде, 26 г, 0,9 экв.) при одновременном повышении температуры до 40°С. Полученный прозрачный раствор перемешивали при 40°С в течение еще 30 мин. В результате в виде слегка желтоватой жидкости с 41%-ным содержанием сухого вещества получали эфир фосфорной кислоты Р (калиевая соль эфира Б) (сушилка Mettler Halogen, 150°C, 0,5 г).
Пример 15
Эфир фосфорной кислоты С
В азотной атмосфере эфир фосфорной кислоты Б (80 г, MW: приблизит. 775, 1 экв.) при комнатной температуре диспергировали в 100 мл деминерализованной воды. В эту смесь медленно, в течение 1 ч добавляли N,N-диметилэтаноламина (8,3 г, 0,9 экв.) при одновременном повышении температуры до 35°С. Полученный прозрачный раствор при 40°С перемешивали в течение 30 мин. В результате в виде желтоватой жидкости с 42%-ным содержанием сухого вещества получали эфир фосфорной кислоты С (аммониевая соль эфира Б) (сушилка Mettler Halogen, 150°C, 0,5 г).
Пример применения
Готовили следующие композиции:
Композиция 1
| Laropal A81 60% | 19,41 мас.% (смола для измельчения фирмы BASF) |
| Solvesso 100 | 05,15 мас.% (ароматический углеводородный растворитель фирмы Exxon) |
| МПА | 05,15 мас.% (метоксипропилацетат, растворитель, фирма Kluthe) |
| Saci 300 А | 01,00 мас.% (вещество, препятствующее оседанию пигмента, |
 | фирма Stoney Creek Technologies, LLC) |
| Kronos 2310 | 67,93 мас.% (диоксид титана, фирма Kronos) |
| Стеклянный бисер |  |
| 3-миллиметровый | 100,0 мас.% (вспомогательное для измельчения вещество) |
| Эфир фосфорной кислоты | 01,36 мас.% |
Приготовление: образцы в соответствии с вышеприведенным составом встряхивали в стеклянной бутылке в течение 1 ч в приборе Skandex of Fluid Management. Затем эти образцы охлаждали до комнатной температуры в течение 24 ч с последующим определением реологических свойств в пластометре Haake RS 600.
Композиция 2
| MEG | 04,75 мас.% (моноэтиленгликоль) |
| Дем. вода | 16,88 мас.% |
| Bentone EW | 00,20 мас.% вещество, препятствующее оседанию |
 | пигмента, фирма Rheox Inc.) |
| AMP 90 | 00,15 мас.% (аминовая нейтрализация, фирма Angus Chemie) |
| EFKA-2550 | 00,20 мас.% (пеногаситель, добавки фирма EFKA) |
| Parmetol | 00,20 мас.% (фунгицид, фирма Schuike & Mayr GmbH) |
| Kulubrite 5 | 76,19 мас.% (СаСО3, фирма Idwala Ind. Holdings (Pty) Ltd.) |
| Эфир фосфорной кислоты | 01,43 мас.% |
Приготовление: образцы в соответствии с вышеприведенным составом диспергировали с растворителем при 4000 об/мин в течение 2 мин. В дальнейшем образцы охлаждали до комнатной температуры в течение 24 ч и их свойства определяли в пластометре Haake RS 600.
Измерения вязкости осуществляли при скорости сдвига в пределах от 5 до 50 [1/с].
Композиция 1
BYK-W 9010 представляет собой диспергатор в соответствии с ЕР 417490
Disperbyk 110 представляет собой диспергатор в соответствии с ЕР 417490.
Композиция 2
BYK-W 9010 представляет собой диспергатор в соответствии с ЕР 417490.
Пример 16
Пример формулы Ацил-(АО) х-ОН, ацил = остаток лауриновой кислоты.
В азотной атмосфере полиэтиленгликоль (PEG 400, MW 400, 39,1 г, 1 экв.) и лауриновую кислоту (Ch4-(Ch3 )10-COOH) (20,0 г, 1 экв.) загружали в реактор при комнатной температуре и нагревали до 180°С. В течение нескольких часов из реактора удаляли реакционную воду, до тех пор, пока не достигали кислотного числа 5-10 мг КОН/г. За последующим охлаждением до 100°С следовало медленное добавление яблочной кислоты (13,1 г, 1 экв.). Реакционную смесь нагревали до 170°С, перемешивали несколько часов и из реактора удаляли реакционную воду, до тех пор, пока не достигали постоянного кислотного числа.
За последующим охлаждением коричневой жидкости до 60°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота 10,9 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты остаток лауриновой кислоты-(АО)8-9ОН получали в виде прозрачной вязкой коричневой жидкости, которая была немного затвердевшей при комнатной температуре, и значение кислотного числа составляет 321 мг КОН/г.
Пример 17
Пример формулы Ацил-(АО)х-ОН, ацил = остаток стеариновой кислоты.
В азотной атмосфере полиэтиленгликоль (PEG 400, MW 400, 45,4 г, 1 экв.) и стеариновую кислоту (33,0 г, 1 экв.) загружали в реактор при комнатной температуре и нагревали до 150°С. В течение нескольких часов из реактора удаляли реакционную воду, до тех пор, пока не достигали кислотного числа 5-10 мг КОН/г. За последующим охлаждением до 100°С следовало медленное добавление яблочной кислоты (15,2 г, 1 экв.). Реакционную смесь нагревали до 170°С, перемешивали несколько часов и из реактора удаляли реакционную воду, до тех пор, пока не достигали постоянного кислотного числа.
За последующим охлаждением коричневой жидкости до 60°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота 12,6 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты остаток стеариновой кислоты-(АО)8-9ОН получали в виде прозрачной вязкой коричневой жидкости, которая была немного затвердевшей при комнатной температуре, и значение кислотного числа составляет 254 мг КОН/г.
Пример 18
Пример формулы Ацил-(АО) х(НА)у-ОН, ацил = остаток лауриновой кислоты.
В азотной атмосфере полиэтиленгликоль (PEG 400, MW 400, 39,1 г, 1 экв.) и лауриновую кислоту (20,0 г, 1 экв.) загружали в реактор при комнатной температуре и нагревали до 170°С. В течение нескольких часов из реактора удаляли реакционную воду, до тех пор, пока не достигали кислотного числа 5-10 мг КОН/г. За последующим охлаждением до 100°С следовало медленное добавление капролактона (22,3 г, 2,0 экв.). В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. Реакционную смесь перемешивали в течение нескольких часов при температуре 170°С, до тех пор, пока не достигали содержания сухого вещества >98%. Реакционную смесь затем охлаждали до 140°С и добавляли яблочную кислоту (13,1 г, 1 экв.). Затем реакционную смесь нагревали до 170°С, перемешивали несколько часов и из реактора удаляли реакционную воду, до тех пор, пока не достигали постоянного кислотного числа.
За последующим охлаждением коричневой жидкости до 100°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота 10,9 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты остаток лауриновой кислоты-(ЕО)8-9 -(CL)2-ОН получали в виде прозрачной вязкой коричневой жидкости, которая была немного затвердевшей при комнатной температуре, и значение кислотного числа составляет 192 мг КОН/г.
Пример 19
Пример формулы Ацил-(АО)х (НА)у-ОН, ацил = остаток стеариновой кислоты.
В азотной атмосфере полиэтиленгликоль (PEG 400, MW 400, 45,4 г, 1 экв.) и стеариновую кислоту (33,0 г, 1 экв.) загружали в реактор при комнатной температуре и нагревали до 170°С. В течение нескольких часов из реактора удаляли реакционную воду, до тех пор, пока не достигали кислотного числа 5-10 мг КОН/г. За последующим охлаждением до 100°С следовало медленное добавление капролактона (25,9 г, 2,0 экв.). В качестве катализатора эстерификации добавляли две капли дибутилоловодилаурата. Реакционную смесь перемешивали в течение нескольких часов при температуре 170°С, до тех пор, пока не достигали содержания сухого вещества >98%. Реакционную смесь затем охлаждали до 140°С и добавляли яблочную кислоту (15,2 г, 1 экв.). Затем реакционную смесь нагревали до 170°С, перемешивали несколько часов и из реактора удаляли реакционную воду, до тех пор, пока не достигали постоянного кислотного числа.
За последующим охлаждением коричневой жидкости до 100°С при интенсивном перемешивании следовало медленное добавление полифосфорной кислоты (тетрафосфорная кислота 12,6 г, 0,33 экв.). Эту смесь перемешивали при 100°С в течение одного часа. Во время всего процесса растворителя не добавляли. Эфир фосфорной кислоты остаток стеариновой кислоты-(ЕО)8-9 -(CL)2-ОН получали в виде прозрачной вязкой коричневой жидкости, которая была немного затвердевшей при комнатной температуре, и значение кислотного числа составляет 207 мг КОН/г.
Композиция 3
Используется СаСО3.
Композиция 3
69 мас.% пигмента СаСО 3 (Idwala Ind. Holdings (Pty) Ltd.)
19 мас.% Laropal A 81 связующее альдегидная смола (60% тверд.) (50 Solvesso 100/50 МРА-1-метоксипропилацетат)
5,3 мас.% Solvesso 100
5.3 мас.% МРА
1.4 мас.% эфира фосфорной кислоты.
Дисперсия приготовлена смешением вышеуказанных компонентов и дисперсия затем применяется как красящий кондиционер (SKANDEX).
Измерения вязкости осуществляли при скорости сдвига в пределах от 0,01 до 1020 [1/с].
 | вязкость, мПа | ||||||||
| скорость сдвига | 0,01 | 0,1 | 1,0 | 10,0 | 16,0 | 100,0 | 128 | 1000 | 1020 |
| пример 16 | 261000 | 43800 | 8470 | 1760 | 1380 | 633 | 589 | 567 | 568 |
| пример 17 | 108000 | 16500 | 4580 | 1280 | 1030 | 536 | 508 | 496 | 495 |
| Disperbyk 110 | 231000 | 40200 | 10100 | 1600 | 1160 | 426 | 388 | 268 | 268 |
| BYK-W 9010 | 382000 | 54400 | 8090 | 1400 | 1050 | 446 | 414 | 316 | 316 |
Данные, приведенные в таблице, демонстируют, что, в случае использования композиции, с ацил-(АО)х-ОН в качестве диспергатора, обладают улучшенными дисперсионными свойствами по сравнению с BYK продуктом.
Композиция 4
Используется другой пигмент (Bayferrox 130 М).
Композиция 4
69 мас.% пигмента Bayferrox 130 М
19 мас.% Laropal А 81 связующее альдегидная смола (60% тверд.) (50 Solvesso 100/50 МРА-1-метоксипропилацетат)
5.3 мас.% Solvesso 100
5.3 мас.% MPA
1.4 мас.% эфира фосфорной кислоты.
 | вязкость, мПа | ||||||||
| скорость сдвига | 0,01 | 0,1 | 1,0 | 10,0 | 16,0 | 100,0 | 128 | 1000 | 1020 |
| пример 18 | 3930000 | 445000 | 66500 | 8280 | 4980 | 1060 | 886 | 346 | 345 |
| пример 19 | - | - | 339000 | 63600 | 27600 | 2920 | 2360 | 326 | 321 |
| Disper-byk 110 | 460000 | 99200 | 81400 | 19000 | 10300 | 1730 | 1460 | 449 | 446 |
| BYK-W 9010 | 62900 | 132000 | 47400 | 22300 | 13200 | 2720 | 2360 | 625 | 611 |
Данные, приведенные в таблице, демонстируют, что, в случае использования композиции, с ацил-(АО)х(НА)у-ОН в качестве диспергатора, обладают улучшенными дисперсионными свойствами по сравнению с BYK продуктом, если ацил - это лауриновая кислота (пример 18). Если используется производное стеариновой кислоты (пример 19) и оно сравнивается с BYK диспергатором, то оно лучше при скорости сдвига 100/с и выше.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Эфир фосфорной кислоты общей формулы I, и его соли  в которой А обозначает остаток, дериватизированный из моногидроксильных групп, представляющих собой: С1 -С20-алкил(АО)x-ОН или ацил(АО)x -ОН; или С1-С20алкил-(АО)x-(ГК) y-ОН или ацил(АО)x-(ГК)y-ОН; или С1-С20алкил-(АО)x-(ДК-АО) y-ОН или ацил(АО)x-(ДК-АО)y-ОН;или МС-(ГК)y-ОН или МС-(ДК-АО)y-ОН,где ацил представляет собой остаток насыщенной или ненасыщенной жирной кислоты, выбранной из лауриновой кислоты, миристиновой кислоты, стеариновой кислоты, арахиновой кислоты, олеиновой кислоты или линолевой кислоты;АО обозначает полиС2 -С3алкиленгликолевый остаток;ГК обозначает остаток
в которой А обозначает остаток, дериватизированный из моногидроксильных групп, представляющих собой: С1 -С20-алкил(АО)x-ОН или ацил(АО)x -ОН; или С1-С20алкил-(АО)x-(ГК) y-ОН или ацил(АО)x-(ГК)y-ОН; или С1-С20алкил-(АО)x-(ДК-АО) y-ОН или ацил(АО)x-(ДК-АО)y-ОН;или МС-(ГК)y-ОН или МС-(ДК-АО)y-ОН,где ацил представляет собой остаток насыщенной или ненасыщенной жирной кислоты, выбранной из лауриновой кислоты, миристиновой кислоты, стеариновой кислоты, арахиновой кислоты, олеиновой кислоты или линолевой кислоты;АО обозначает полиС2 -С3алкиленгликолевый остаток;ГК обозначает остаток  -капролактона или остаток
-капролактона или остаток  -валеролактона;ДК обозначает остаток дикарбоновой кислоты, где дикарбоновая кислота выбирается из янтарной кислоты, малеиновой кислоты, малоновой кислоты, глутаровой кислоты, адипиновой кислоты, фталевой кислоты, себациновой кислоты, щавелевой кислоты, дигликолевой кислоты и ангидридов этих кислот;МС обозначает остаток моноспирта, где моноспирт выбирается из н-бутанола, 2-этил-1-гексанола, цетилового спирта, олеилового спирта, линолеилового спирта, оксоспиртов, циклогексанола, фенола, фенилэтанола и бензилового спирта;x обозначает число от 2 до 50;y обозначает число от 2 до 50;В обозначает остаток яблочной кислоты или остаток лимонной кислоты;n обозначает от 1 до 2;m обозначает от 1 до 4.
-валеролактона;ДК обозначает остаток дикарбоновой кислоты, где дикарбоновая кислота выбирается из янтарной кислоты, малеиновой кислоты, малоновой кислоты, глутаровой кислоты, адипиновой кислоты, фталевой кислоты, себациновой кислоты, щавелевой кислоты, дигликолевой кислоты и ангидридов этих кислот;МС обозначает остаток моноспирта, где моноспирт выбирается из н-бутанола, 2-этил-1-гексанола, цетилового спирта, олеилового спирта, линолеилового спирта, оксоспиртов, циклогексанола, фенола, фенилэтанола и бензилового спирта;x обозначает число от 2 до 50;y обозначает число от 2 до 50;В обозначает остаток яблочной кислоты или остаток лимонной кислоты;n обозначает от 1 до 2;m обозначает от 1 до 4.
2. Смесь эфира фосфорной кислоты по п.1 с эфиром фосфорной кислоты простых моноэфиров полиС 2-С4-алкиленгликоля в массовом отношении 0,01:99,99; предпочтительно 10:90, более предпочтительно 50:50, для применения в качестве диспергатора.
www.freepatent.ru
3.5.2. Эфиры фосфорной кислоты
В соответствии со структурой ортофосфорной кислоты возможно образование и существование её алкиловых эфиров:
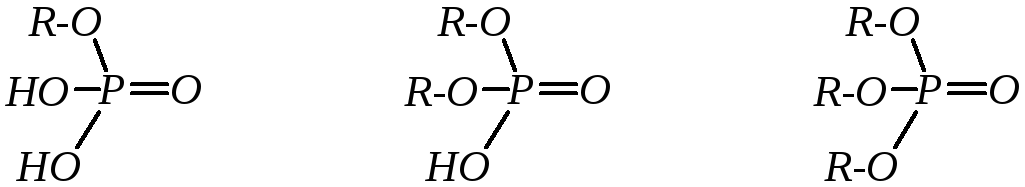
алкилдигидрофосфат диалкилгидрофосфат триалкилфосфат
Эфиры фосфорной кислоты в обычных условиях — достаточно стабильные соединения, но в кислой или щелочной среде могут подвергаться гидролизу. Эти реакции являются типичным нуклеофильным замещением у атома углерода эфирной связи, причём гидролиз кислых фосфатов обычно ускоряется в кислой, а полных — в щелочной среде:
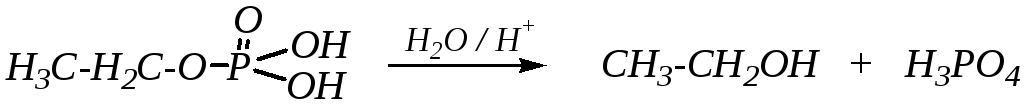
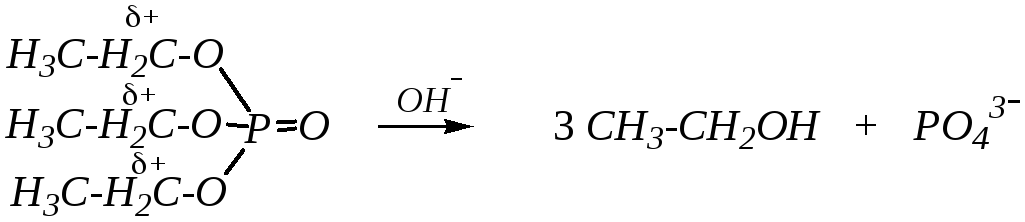
Это, по-видимому, связано со способностью кислых эфиров к диссоциации с образованием соответствующего аниона, который не взаимодействует с гидроксид-ионом.
Но в целом в щелочной среде гидролиз протекает необратимо вследствие стабильности аниона уходящей группы (фосфат-анион) и невозможности осуществления по нему нуклеофильной атаки.
Эфиры фосфорной кислоты получают главным образом из галогенидов фосфора и спиртов. Например:
POCl3 + 3 C2H5OH O=P(OC2H5)3 + 3 HCl
триэтилфосфат
Кислые фосфаты получают также взаимодействием спиртов с оксидом фосфора (V).
Эфиры фосфорной кислоты в живых организмах играют две ключевые роли. Во-первых, они служат структурными компонентами клеточных мембран и нуклеиновых кислот. Основу клеточных мембран составляют фосфолипиды (гл. 6.5.6). Остов нуклеиновых кислот состоит из рибозо- и дезоксирибозофосфатных цепей (гл. 12.5.5). Во-вторых, эфиры фосфорной кислоты, точнее полифосфорных кислот, в организме аккумулируют и переносят энергию (гл. 7.1.3).
3.6. Тиоспирты и тиоэфиры
Названия этих классов соединений означают, что они являются тиоаналогами соответственно спиртов и эфиров. С другой стороны, их можно рассматривать как органические производные сероводорода, в которых один или два атома водорода замещены предельными углеводородными радикалами: R-SH и R-S-R соответственно.
Сами соединения называют обычно по заместительной и радикало-функциональной номенклатурам ИЮПАК (гл. 1.5.1 и 1.5.2). Например:
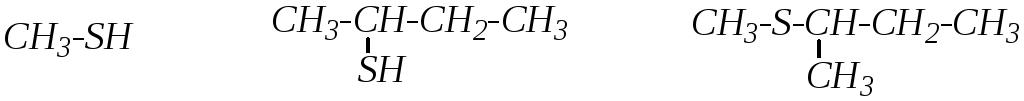
метантиол, бутантиол-2, 2-метилтиобутан,
метилмеркаптан втор-бутилмеркаптан метил-втор-бутилсульфид
Тиоспирты (меркаптаны, алкантиолы, или просто тиолы) во многом отличаются от своих кислородных аналогов. Так, их первые представители, в отличие от спиртов, плохо растворяются в воде и кипят при значительно более низких температурах. Например, метилмеркаптан при обычных условиях — газ (температура кипения 279 К), а метиловый спирт — жидкость (температура кипения 337 К). Эти различия определяются способностью к образованию водородных связей за счёт ОН-групп в спиртах и SH-групп в меркаптанах.
Меркаптаны обладают неприятным запахом, который обнаруживается в чрезвычайно малых концентрациях. Например, запах метилмеркаптана чувствуется уже при содержании его в воздухе 2.510-7%.
Тиоэфиры (сульфиды) — это также бесцветные соединения с неприятным запахом. Их температуры кипения выше, чем у аналогичных простых эфиров. Низшие представители являются жидкостями.
Тиоспирты обладают слабокислыми свойствами (для этантиола рКа= 10.6), и кислотность их выражена сильнее, чем спиртов (на 4—5 порядков) за счёт большей поляризуемости атома серы по сравнению с кислородом (подобно тому, чтоh3S является более сильной кислотой, чемh3O). Поэтому с водными растворами щелочей они образуют соли, например:
С2Н5-SH + NaOH С2Н5-S¯Na+ + h3O
этантиол, этантиолят натрия,
этилмеркаптан этилмеркаптид натрия
Тиоляты являются сильными нуклеофилами и легко алкилируются. Это типичная реакция нуклеофильного замещения, в которой субстратом обычно является галогеналкан:
R-S¯Na+ + R-X R-S-R + NaX
Образующиеся тиоэфиры могут алкилироваться дальше. Продуктом исчерпывающего алкилирования является соль триалкилсульфония:
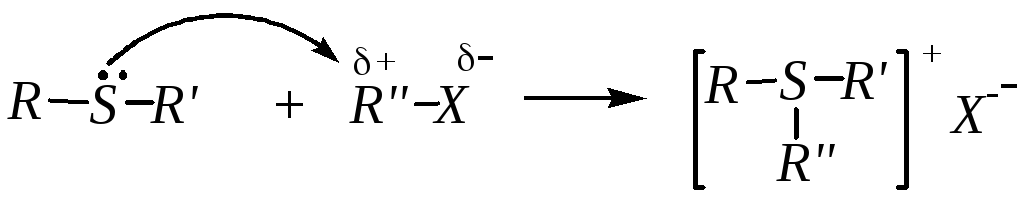
Например, горчичный газ (или иприт), ClCН2CН2SCН2CН2Cl может самопроизвольно превращаться с образованием хлорида тризамещённого сульфония. Это внутримолекулярная SN2-реакция:
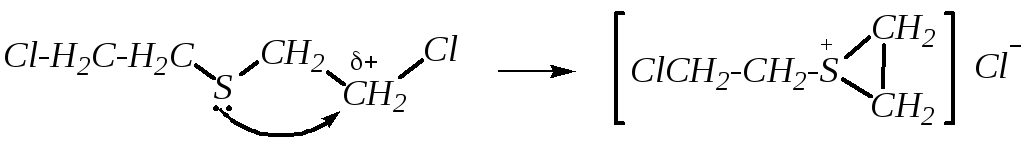
Наличие трёхчленного малого цикла придаёт ему высокую реакционную способность. Он легко подвергается нуклеофильной атаке аминогруппами, входящими в состав белковых молекул, что приводит к алкилированию белка. В этом состоит причина кожно-нарывного действия горчичного газа и поражения слизистых оболочек.
Как тиоспирты, так и тиоэфиры являются очень слабыми основаниями, значительно слабее, чем их соответствующие кислородные аналоги.
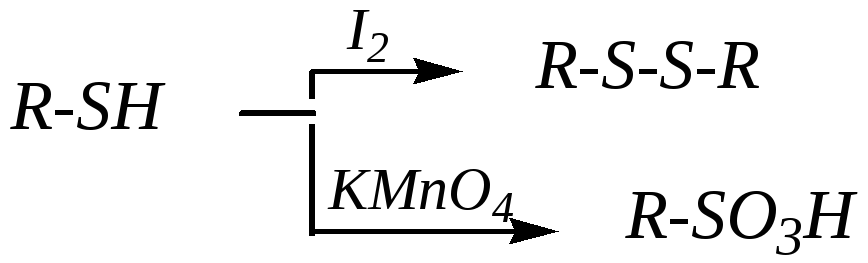
Тиолы и сульфиды легко окисляются до различных продуктов. Тиоспирты при окислении йодом образуют дисульфиды R-S-S-R, более энергичные окислители могут их окислить до алкансульфоновых кислот R-SO3H:
Тиоэфиры окисляются до сульфоксидов и сульфонов (например, пероксикислотами R-COOOH — гл. 6.4.6):
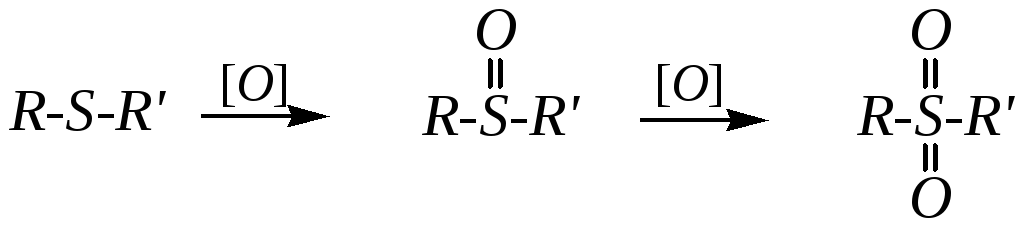
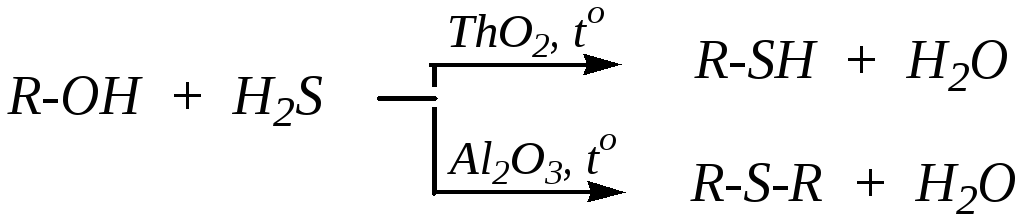
Тиоспирты и тиоэфиры могут быть получены взаимодействием галогеналканов с кислыми и средними солями сероводородной кислоты:
Na+ ¯SH + R-X R-SH + NaX
Na2+ S 2-+ R-X R-S-R + 2NaX
Эти реакции, относящиеся к нуклеофильному замещению в галогеналканах, рассмотрены в главе 3.2.2.1.
Тиоэфиры могут быть получены также из тиоспиртов, как было показано выше.
В промышленности для получения меркаптанов и сульфидов используют каталитическое алкилирование сероводорода спиртами в газовой фазе (при 600—670 К):
Диметилсульфид— бесцветная летучая жидкость с неприятым запахом. Получают каталитически из метанола и сероводорода. Используют для производства диметилсульфоксида.
Горчичный газ,иприт — бесцветная жидкость; температура кипения 488К.Очень токсичное вещество кожно-нарывного действия. Получают взаимодействием этилена с хлоридами серы.
Некоторые поли- и гетерофункциональные тиолы образуют прочные комплексы с ионами тяжёлых металлов, на чём основано их использование в качестве противоядий (антидотов) при отравлении соединениями ртути, свинца, кадмия, сурьмы, мышьяка. Одним из первых антидотов был 2,3-димеркаптопропанол-1 (британский антилюизит, БАЛ). Позже нашли применение такие тиолы, как 2-амино-3-меркапто-3-метилбутановая кислота (пеницилламин) и 2,3-димеркаптопропансульфонат натрия (унитиол).
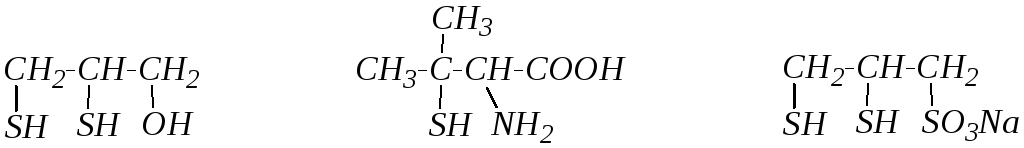
БАЛ пеницилламин унитиол
studfiles.net
Фосфорный эфир - Большая Энциклопедия Нефти и Газа, статья, страница 3
Фосфорный эфир
Cтраница 3
Среди производных моносахаридов, кроме фосфорных эфиров, большой биологический интерес представляют аминопроизводные. [31]
Аналогичная реакция наблюдается при конденсации фосфорных эфиров с а-галогенальдегидами или а-галогенкетонами. При этом вместо ожидаемых кетоалкилфосфонатов ( разд. [32]
Это объясняется большой гидролитической прочностью фосфорных эфиров и необходимостью при гидролизе разорвать алкилкислородную связь О - СН2, что не входит в функцию холинэстеразы. Таким образом, ацетилхолинэстераза оказывается выключенной из сферы действия на длительный срок и в синаптических узлах накапливается ацетилхолин. В результате резко нарушаются функции всех органов, имеющих холинэргическую иннервацию, и происходит отравление организма. [33]
В организме образуется в виде фосфорного эфира в пентозофосфатном цикле окисления глюкозы. Играет важную роль в обмене веществ, особенно в биосинтезе нуклеиновых кислот. [34]
Гораздо более непонятным является образование фосфорных эфиров. [35]
Методика приготовления бумаги для хроматографирования фосфорных эфиров приведена выше ( см. стр. По данным Опеньской-Блаут и сотрудников [2], при разделении эфиров в системе н-бутанол - пиридин-5 % - пая трихлоруксусная кислота в соотношении 40: 25: 45 промывание бумаги оказывается излишним, та-к как никакого влияния на форму пятен оно не оказывает. [36]
Основным недостатком химического метода гидролиза фосфорных эфиров на бумаге является деструкция целлюлозы сильными кислотами, хотя даже при применении для гидролиза весьма сильных кислот некоторые фосфаты остаются негидролизовашшми. Поэтому Доман и Каган и Щимона, а также Сакловска-Шимонова проводят гидролиз таких эфиров на бумаге раствором фермента фосфатазы ( Д 45в) с последующим проявлением неорганического фосфата ранее указанным способом. При ферментативном гидролизе фосфорных эфиров в процессе инкубирования хроматограммы в водной среде наблюдается расплывание ( диффузия) пятен; во избежание этого Флетчер и Мальпросс перед опрыскиванием раствором фермента пропитывают бумагу хлористым кальцием ( Д 45г), в результате чего освобожденный при инкубировании с фосфатазой фосфат дает с хлористым кальцием фосфорнокислый кальций и форма пятен сохраняется. [37]
Из эфиров тиамина важное значение имеют фосфорные эфиры ( тиамин-моно - и дифосфат), которые получают обработкой тиамина хлорокисью фосфора [31 ] или смесью пирофосфорной кислоты и фосфорного ангидрида [32] с последующим хроматографическим разделением продуктов на колонках. Пирофосфорный эфир тиамина известен под названием кокарбоксилазы. [38]
Никотинамидадениндинуклеотид ( НАД) и его фосфорный эфир ШАД-Ф) легко вступают в окислительно-восстановительные реакции, обез печивая перенос водорода; эти превращения имеют очень большое значение в жизни человека я животных, поэтому понятно, что недостаток никотиновой кислоты столь пагубно отражается на организме. Суточная потребность в никотиновой кислоте ( ее амиде) составляет для человека 20 - 30 мг. [39]
Существенным продуктом фотосинтеза в зеленом листе являются фосфорные эфиры Сахаров ( гексозо-фосфаты), которые, освобождая фосфорную кислоту, могут конденсироваться в ди-сахарид - сахарозу или в полисахарид - крахмал. В некоторых случаях гексозо-фосфаты де-фосфорилируются, образуя свободные моносахариды - чаще всего глюкозу и фруктозу. Только первые фазы фотосинтеза световые, остальные не требуют света и являются темновыми реакциями. Первичные продукты фотосинтеза вовлекаются во внутриклеточные химические процессы и служат исходным материалом для построения других, часто очень сложных органических соединений. Результатом фотосинтеза является также образование нуклеиновых кислот, белков и других сложных веществ. [40]
Специфичность фосфатаз разнообразна: одни фосфатазы гидролизуют различные фосфорные эфиры, другие характеризуются групповой специфичностью, третьи - узкой. Кроме гидролитической, фосфатазы обладают я трансферазной функцией. [41]
В результате реакции фосфористый эфир окисляется до фосфорного эфира. При реакции происходит выделение бромистого этила. [42]
Так как триалкиламмониевые соли способствуют увеличению растворимости фосфорных эфиров в безводных растворителях, то для синтеза ФАД можно использовать алкиламмониевые соли мононуклеотидов. В качестве нуклеозидфосфоамида преимущество имеет применение нуклеозидфосфо-морфолидов. [43]
Таким образом, вопрос об образовании как средних фосфорных эфиров, так и кислых фосфористых при реакции треххлористого фосфора на алко-голяты спиртов должен считаться, по моему мнению, открытым и требует новых специальных и тщательных исследований с количественным учетом всех продуктов реакции. [44]
Из сложных эфиров с минеральными кислотами следует отметить фосфорные эфиры. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
фосфорный эфир - это... Что такое фосфорный эфир?
фосфорный эфир adjtextile. Phosporsäureester
Универсальный русско-немецкий словарь. Академик.ру. 2011.
- фосфорный состав
- фосфороксотриамид
Смотреть что такое "фосфорный эфир" в других словарях:
Уксусноэтиловый эфир — Этилацетат Этилацетат (этиловый эфир уксусной кислоты) СН3 СОО Сh3 Сh4 бесцветная летучая жидкость с приятным фруктовым запахом. Содержание 1 Получение … Википедия
Этиловый эфир уксусной кислоты — Этилацетат Этилацетат (этиловый эфир уксусной кислоты) СН3 СОО Сh3 Сh4 бесцветная летучая жидкость с приятным фруктовым запахом. Содержание 1 Получение … Википедия
аденозинтрифосфат — (АТФ; син.: аденилпирофосфат, аденилпирофосфорная кислота устар., аденозинтрифосфорная кислота) три фосфорный эфир аденозина, содержащий аденин, рибозу и три остатка фосфорной кислоты; А. универсальный аккумулятор энергии в живых организмах и… … Большой медицинский словарь
Род Псилоцибе (Psilocybe) — В настоящее время род псилоцибе насчитывает около 20 видов. При этом американские и азиатские виды изучены слабо. Виды этого рода являются космополитами и широко распространены почти по всем континентам. Грибы рода псилоцибе сапрофиты.… … Биологическая энциклопедия
Коферме́нты — (синоним коэнзимы) органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Соединяясь с белковой частью молекулы фермента апоферментом, К. образуют каталитически активный комплекс… … Медицинская энциклопедия
ФЛАВИНМОНОНУКЛЕОТИД — ФМН, рибофлавинфосфат, 5 фосфорный эфир рибофлавина (витамина В2), кофермент нек рых флавинзависимых дегидрогеназ (оксидаз L амииокислот, НАД Н и НАДФ Н де гидрогеназ и др.), присутствующих во всех живых клетках. Изоаллоксазиновое кольцо Ф.… … Биологический энциклопедический словарь
ПИРИДОКСАЛЬФОСФАТ — Действующее вещество ›› Пиридоксальфосфат (Pyridoxalphosphate) Латинское название Pyridoxalphosphatum АТХ: ›› A11HA06 Пиридоксальфосфат Фармакологическая группа: Витамины и витаминоподобные средства Нозологическая классификация (МКБ 10) ›› B18.9… … Словарь медицинских препаратов
Pyridoxalphosphatum — ПИРИДОКСАЛЬФОСФАТ ( Руridoxalphosphatum ). 5 Фосфорный эфир 2 метил 3 окси 4 формил 5 оксиметилпиридина. Светло желтый кристаллический порошок. Неустойчив на свету. Мало растворим в воде, практически нерастворим в спирте. Является коферментной… … Словарь медицинских препаратов
ФОСФАДЕН — ( Рhosphadenum ). Аденозин 5 монофосфорная кислота, или фосфорный эфир 9b D рибофуранозида аденина. Синонимы: Аденил, Аденозинмонофосфат, АМФ, Аdenil, Аdenovite, Аdenyl, АМР, Cardiomone, Fosfostimol, Monophosaden, Рhosaden, Vitamin В8. Белый… … Словарь медицинских препаратов
Phosphadenum — ФОСФАДЕН ( Рhosphadenum ). Аденозин 5 монофосфорная кислота, или фосфорный эфир 9b D рибофуранозида аденина. Синонимы: Аденил, Аденозинмонофосфат, АМФ, Аdenil, Аdenovite, Аdenyl, АМР, Cardiomone, Fosfostimol, Monophosaden, Рhosaden, Vitamin В8.… … Словарь медицинских препаратов
нуклеотид — nucleotide нуклеотид. Фосфорный эфир нуклеозида, мономер нуклеиновых кислот <nucleic acid>; Н. входят в состав НАД, НАДФ, кофермента А <coenzyme A> и др. биологически активных соединений; Н. являются некоторые макроэргические… … Молекулярная биология и генетика. Толковый словарь.
universal_ru_de.academic.ru
Методы получения эфиров фосфорной кислоты
В настоящее время разработано довольно значительное число методов введения остатка фосфорной кислоты в молекулу моносахарида (так называемые методы фосфорилирования). Наиболее старым, но наименее удовлетворительным методом является получение фосфорных эфиров прямым действием хлорокиси фосфора на углевод с последующим гидролизом получающегося хлорангидрида — эфира [c.77] Методы получения эфиров фосфорной кислоты [c.62]Гидраты. В этом разделе для большинства соединений рассмотрены наиболее распространенные и часто встречаемые кристаллогидратные формы, для которых и приведены данные по содержанию кристаллизационной воды. Эфиры фосфорной кислоты и их соли часто гигроскопичны, и содержание кристаллизационной воды в индивидуальных образцах может широко варьировать в зависимости от метода получения и условий хранения. Поэтому следует полагаться на информацию производителя коммерческих препаратов или еще лучше провести анализ интересующего препарата на содержание воды. [c.56]
Специальные методы получения эфиров фосфорной кислоты. Для [c.405]
Реакция диалкилфосфитов с хинонами может служить примером, иллюстрирующим возможность использования этого метода для получения эфиров фосфорной кислоты [c.396]
Несимметричные диэфиры и полифосфаты. Изучено много надежных методов синтеза моноэфиров фосфорной кислоты сложного строения. Выше были рассмотрены методы получения диэфиров, ко-которые дают удовлетворительные результаты в случае симметричных соединений, но не вполне пригодны для синтеза несимметричных эфиров. Большинство встречающихся в природе диэфиров и полифосфатов относится к соединениям второго типа. Проблемы [c.101]
Сам по себе хлористый водород образует хлоргидрин [119], а хлористый водород с хлористым цинком [116], бромистый водород с серной кислотой [117], хлорокись фосфора с серной кислотой [120] и иодистый калий с фосфорной кислотой [111] —соответствующие дигалогенпроизводные. При действии на циклический эфир хлорангидрида в присутствии хлористого цинка получают хлорзамещен-ные сложные эфиры [121], Этот метод иногда используют для получения дигалогенпроизводных [1181. Выходы дигалогенпроизводных. [c.389]
Триалкилфосфаты были получены по крайней мере 100 лет назад а синтез трифенилфосфатов относится к 1854 г. Однако сложные эфиры фосфорной кислоты не представляли промышленного интереса до начала 20-х годов настоящего столетия, когда была сделана попытка найти заменители пластификатора для нитрата целлюлозы, чтобы ликвидировать монополию Японии в области производства камфоры. В последние годы третичные эфиры фосфорной кислоты нашли широкое применение в качестве пластификаторов, противопенных присадок, присадок к маслам и моторным топливам, а также огнестойких гидравлических жидкостей и синтетических смазочных масел. Методы получения этих соединений могут быть рассмотрены на примерах синтеза трех типов эфиров фосфорной кислоты триа-рил-, триалкил- и алкиларилфосфатов. [c.38]
Анализ сложных эфиров фосфорной кислоты, полученных этим методом, показывает содержание 15-20% непрореагировавших неионогенных ПАВ. Это объясняется тем фактом, что данная смесь содержит моно- и диэфиры пирофосфатов, которым необходима более высокая температура для взаимодействия с гидроксильными соединениями [122]. Короткоцепные эфиры фосфорной кислоты, такие как бутил-фосфорная кислота, являются сильными кислотами с антикоррозионными, антибактериальными, смачивающими и диспергирующими свойствами наряду с хорошей растворимостью. Эфиры с более длинной цепью обладают худшей растворимостью в воде и являются более слабыми кислотами. Превращение в натриевые соли улучшает водорастворимость и чувствительность к жесткой воде. Они хорошие смачивающие агенты и эмульгаторы. Моноэфиры склонны сдерживать пенообразование в присутствии сильных анионов, являются мягкими по отношению к коже и поэтому используются в средствах личной гигиены (чаще всего в Японии). Сложные эфиры фосфорной кислоты гидролитически стабильны, особенно в сильнощелочных условиях, что дает возможность использовать их в смесях для чистки поверхности, применяемых в жестких условиях [123, 124]. [c.54]
Остановлюсь кратко на перегруппировке Арбузова. Перегруппировка Арбузова остается и в настоящее время в центре внимания и как синтетический метод получения производных пятивалентного фосфора из производных трехвалентного фосфора, и с точки зрения изучения механизма этой реакции. Основной интерес, однако, сосредоточен в последние годы на неклассическом направлении перегруппировки, когда в перегруппировке вместо галоидопроизводных участвуют иные типы соединений, или перегруппировка приводит к эфирам фосфорной кислоты, а не фосфиновых кислот. [c.7]
Поверхностно-активные вещества на основе эфиров фосфорной кислоты. Их получают из жирных спиртов или из продуктов конденсации алкилфенолов или жирных спиртов с окисью этилена [4], Наиболее распространенным методом получения является добавление к спиртам фосфорного ангидрида при 50 °С выход теоретический. Товарные продукты являются эквимольной смесью моно- и диалкиловых эфиров. [c.200]
Разработка промышленно-приемлемых методов получения некоторых предельных эфиров фосфорной кислоты и испытание их в качестве пластификаторов. [c.279]
К анионным ПАВ относятся также эфиры фосфорных кислот. Эти соединения благодаря своим ингибирующим коррозию свойствам находят применение в составах для чистки металлов и в металлообработке. Эти соединения получают из спиртов или из продуктов конденсации алкилфенолов или спиртов с оксидом этилена. Наиболее распространенным методом получения является добавление фосфорного ангидрида к спиртам при 50 °С выход — стехиометрический. Товарные продукты являются эквимольной смесью моно-и диалкиловых эфиров. [c.508]
Наиболее простой метод получения неполных эфиров фосфорной кислоты состоит во взаимодействии спиртов или фенолов с пятиокисью фосфора и с метафосфорной кислотой. Аналогичные высокомолекулярные соединения получаются при взаимодействии с пятиокисью фосфора полиоксисоединений. Для [c.29]
Из изложенного выше следует, что перегруппировку Арбузова можно рассматривать как специальный метод получения эфиров фосфиновых и фосфоновых кислот. Однако известны реакции -очень напоминающие по своему характеру перегруппировку Арбузова, при помощи которых можно получать эфиры фосфорной кислоты [c.387]
Непредельные эфиры фосфорной кислоты, содерн ащие винильные и замещенные винильные группы, еще в недавнем прошлом не были известны. Однако в настоящее время описан ряд методов получения представителей этого класса. [c.34]
Недавно опубликован американский патент (без описания эксперимента) о методе получения виниловых и замещенных виниловых эфиров фосфорных кислот при обработке последних ацетиленом или его производными в присутствии солей ртути [177]. [c.35]
Исследования полимеризации аллиловых эфиров фосфорных кислот в массе, растворах и эмульсиях показали, что весьма интересным и перспективным направлением является получение их галоидированных полимеров. Такие вещества получаются несколькими методами [c.149]
Остаток в колбочке Арбузова был перегнан при обыкновенном давлении в пределах 184—212°. Получено 1.4 г бесцветной жидкости, хорошо растворимой в воде. Судя по температуре ее перегонки, можно предполагать, что она представляет собой смесь диэтилфосфористой кислоты (т. кип. 184—186°) и этилового эфира фосфорной кислоты (т. кип. 214—215°). Это предположение подтверждается еще и тем, что при получении этилового эфира фосфористой кислоты методом Арбузова в качестве побочных продуктов всегда обнаруживались названные выше соединения. Ближе эта фракция нами не исследовалась. [c.302]
При исследовании системы из пасты поливинилхлорида марки опалой 410 и пластификатора (60 40) применялся микрометод, заключающийся в определении температуры, при которой уже нельзя различить частиц смолы (скорость нагревания 2° в минуту). Для фталатов и эфиров алифатических дикарбоновых кислот температура растворения повышается с увеличением молекулярного веса эфира. При рассмотрении сложных эфиров ароматических спиртов наблюдается отклонение от этой зависимости в гомологическом ряду эфиров фосфорной кислоты. Величины растворяющей способности сложных эфиров ароматических спиртов зависят от метода их определения полученные по микрометоду они выше, чем полученные при определении критической температуры растворения по методу, разработанному автором. [c.33]
Хотя ЭТОТ метод вполне пригоден для получения эфиров фосфорной кислоты несложного строения, он все же имеет весьма ограниченное значение из-за недостаточной растворимости исходных веществ и недоступности многих замещенных диазометанов. [c.139]
Параллельно с исследованиями инсектицидного действия различных представителей этого класса веществ шло развитие синтетических возможностей, открывающихся при использовании классических реакций, и были открыты новые пути синтеза. Все вместе взятое решающим образом революционизировало химию органических соединений фосфора. К числу новых препаративных методов относится получение эфиров фосфорной кислоты при действии третичных фосфитов на а-галоидкарбонильные соединения — реакция, открытая Перковым, которую затем развили советский химик А. Н. Пудовик и американские химики Аллен и Джонсон. Реакция с различными органическими соединениями серы, в которой исходными веществами также являются третичные фосфиты, как было найдено, открывает новые пути синтеза эфиров тиофосфорной килоты (Моррисон, 1955 г. К- А. Петров и Г. А. Сокольский, 1956 г. Ми-хальский и Виечорковский, 1957 г.). [c.17]
Рамирец (1961) описал новый метод получения циклической ди-ацилперекиси VI, заключающийся в озонолизе кристаллического циклического аддукта V (т. пл. 74°С), полученного из фенантренхинона и 1 риметилового эфира фосфорной кислоты [c.348]
В течение последних лет были накоплены данные, свидетельствующие о том, что многие биологически важные реакции ацилирования связаны с промежуточным образованием ацилфосфатов (смещанных эфиров фосфорной и карбоновой кислот). К этим реакциям относится и активация карбоксильной группы аминокислот на одной из стадий биосинтеза белка [201, 311]. В связи с этим полезно кратко обсудить методы получения ацилфосфатов. Вследствие большой нey foйчивo ти они в известной мере отличаются от эфиров фосфорной кислоты. Как смешанные ангидриды кислот ацилфосфаты гидролитически неустойчивы и по реакциднной способности напоминают пирофосфаты и ангидриды фосфатов с другими сильными кислотами. Как и ожидалось, в трех группах ацилфосфатов устойчивость возрастает в порядке СЬХXXVIII СХС- [c.142]
В простейших реакциях фосфорилирования (фосфорильного переноса) используется замещение галогена у углеродного атома. При обработке серебряной соли или сложного эфира фосфорной кислоты ацил- или алкилгалогенидом выпадает в осадок хлорид серебра и получается фосфорилированное производное (схема (23) . Метод был использован для получения динуклеозидфосфа-Т013, фосфолипидов и ацилфосфатов, но в основном он заменен другими методами, поскольку продукты реакции обычно получаются с низкими выходами и недостаточно чистыми. Альтернативные методы фосфорилирования включают активацию ортофосфорной кислоты и основная проблема состоит в селективном проведении процесса и в мягких условиях [50—52]. [c.154]
Этот метод сходен с разработанным Фетизоном методом получения Д2-стероидов восстановленнем лнтием —аммиаком енольных диэтиловых эфиров фосфорной кислоты, получаемых из 2-бромке-тоноВ З (см. Триэтилфосфит в этом томе). [c.120]
Браун [3] осуществил на пластинках силикагеля Г, полученных стандартным методом, хроматографический анализ большого числа пластификаторов, используя в качестве растворителя метиленхлорнд. При этом особое внимание было обращено на возможность разделения близких по структуре соединений различных классов (табл. 85). В случае каждого пластификатора были приготовлены 1—5%-ные растворы в бензоле пли эфире и наносились объемы, содержащие около 100 хг вещества. Для анализа на содержание пластификаторов пластмассовых пленок последние экстрагировали метилен-хлорндом. В качестве стандартного реактива для опрыскивания использовали пятихлористую сурьму (реактив № 13). Большинство пластификаторов после опрыскивания и нагревания при 120° можно обнаружить в виде коричневых пятен на светлом фоне другие пластификаторы обнаруживаются после нагревания лишь в УФ-свете. Кроме того, эфиры фталевой кислоты можно окрасить раствором резорцина, а эфиры фосфорной кислоты — реактивом диазония (реактив № 37). [c.357]
Важные результаты, полученные при исследовании встречающихся в природе эфиров фосфорной кислоты, особенно фосфатов сахаров, выдвигают новые интересные проблемы стереохимии. Изучение этих проблем было предпринято Кораной и сотр. [143], которым удалось найти ряд правил, позволяющих установить конфигурацию многих фосфатов сахаров. Метод состоит в обработке фосфата LXXVIII дициклогексилкарбоди-имидом (ДЦК), в результате чего при благоприятной стереохимии соединения может образоваться циклический фосфорный эфир LXXIX (с участием вицинальной оксигруппы) [c.588]
Фирма Эссо рисерч энд энджиниринг также предложила применение присадки, в частности, сочетание нескольких присадок, как метод предотвращения электризации. В одном патенте этой фирмы [61] предложено применять тетраалкиламмониевые соли оксикислот. В другом ]74] описано применение таких солей совместно со сложными эфирами фосфорной кислоты, предпочтительно в соотношении от 80 20 до 50 50. Во втором патентном описании, в частности, приводятся результаты опытов, полученные при применении сочетания аммонийной соли сложного эфира ди- и триметил соя спирта и яблочной кислоты (под термином соя здесь подразумеваются длинные алкильные цепи, содержащиеся в спиртовых остатках сложных эфиров соевого масла), со смесью моно- и диизо-октилфосфатов. При дозировке сложных эфиров яблочной и фосфорной кислот соответственно 80-10" % и 20-10 % электропроводность базового топлива повышалась с 4 до 1400- 10" (вместо соответственно [c.192]
Исследованы два метода синтеза смол путем одновременной загрузки мочевины, формалина и бутанола с последующим обезвоживанием смолы по окончании реакции и путем предварительной конденсации мочевины и формальдегида в нейтральной или щелочной среде с последующей этерификацией полученных метилолмочевин бутанолом в кислой среде. Исследовано также влияние основных факторов производственного процесса на свойства смол и покрытий на их основе. Установлено, что вязкость смолы зависит не только от степени конденсации,, но и в значительной мере от содержания метилольных групп евз В патентах приводятся различные лаковые композиции совмещенных с алкидными смолами мочевиноформальдегидных смол композиция для покрытий, образующая при отверждении твердые, глянцевые эластичные пленки (20—70% алкидной смолы, 10—70% мочевиноформальдегидной смолы и -10— 70% латекса синтетического полимера, например, полистирол, поливинилхлорид и др.) лакокрасочные покрытия с повышенной стойкостью к действию дезинфицирующих сред из глифталевых мочевиноформальдегидных смол и полимеров дивинилацетилена бензостойкие покрытия горячей сушки из мочевиноформальдегидных смол в сочетании с алкидными смолами алкидномочевинные лаки кислотного отверждения с применением алкилового эфира фосфорной кислоты (этиловый эфир) и алкидно-карбамидный лак холодной сушки для отделки футляров радиоприемников . [c.372]
Второй метод получения фосфатов — окисление триалкилфосфи-тов. Такие эфиры фосфорной кислоты, как трибутилфосфат, используются при экстракции некоторых четырехзарядных ионов металлов (разд. 26.2) из водных растворов. [c.349]
В методе внутренней добавки в бумажную массу - до подачи ее в бумагоделательную машину - вводят 0,5-2% перфторалкилового эфира фосфорной кислоты, фиксируя его на волокне с помощью закрепляющих агентов катионного типа, и затем из полученной массы изготавливают бумагу. Недостаток этого способа заключается в потерях препарата в виде водных растворов, в связи с чем его необходимо вводить в некотором избытке. Однако, поскольку препарат содержится во всем объеме бумаги, а не только на поверхности, повышенная маслоотталкиваюшая устойчивость сохраняется и на срезах. Обработанная фторсодержащими препаратами бумага почти полностью сохраняет газопронипаемость, мягкость, цвет, прочность и другие характеристики, которыми обладает необработанная бумага. [c.419]
Зервас [2658] предложил принципиально иной метод синтеза несимметричных пептидов цистина. Исходными соединениями в этом методе служат два 5-замещенных производных цистеина, имеющих различные карбоксилзащитиые группировки эти эфиры цистеина ацилируют по аминогруппе таким образом, что образуется производное нитробензилового эфира фосфорной кислоты (116). Удаление 5-защитных групп и последующее окисление приводят к несимметричному производному цистина (117), дисульфидный обмен у которого невозможен, поскольку связь 5—5 участвует в образовании циклической фосфорсодержащей системы. Селективное отщепление той или иной С-за-щитной группы открывает путь к получению несимметричных пептидов. [c.309]
Шмит и др. [50] сообщили об использовании ТСХ как вспомогательного метода идентификации полученных при газохроматографическом анализе пиков пестицидов. Людвиг и Фрей-мут [51], определяя остатки инсектицидов в пищевых продуктах, смогли разделить DDT, ВПС и метоксихлор на тонких слоях супергеля Эдер и др. [52] методами хроматографии на бумаге и ТСХ разделили и идентифицировали 21 инсектицид — хлорированные углеводороды и эфиры фосфорной кислоты. Следы этих инсектицидов были выделены из фруктов и бобовых. Нивагучи [53] определял ВНС спектрофотометрически, переводя его в 1,2,4-трихлорбензол после выделения с помощью ТСХ. Это превращение проводили за 30 мин при нагревании с большим избытком спиртового раствора гидроксида калия. [c.158]
Оценка совместимости различных пластификаторов, относящихся к фталатам, фосфатам, цитратам, к эфирам алифатических карбоновых кислот, а также к сульфамидам с ацетопропионатом целлюлозы, осложняется необходимостью вводить в систему растворители для получения пленок методом налива. Следующей переменной является концентрация вводимого пластификатора. Мало отличаются друг от друга по совместимости эфиры фосфорной кислоты и спиртов алифатического, ароматического и жирноароматического ряда. Наименьшая совместимость присуща три-(2-этилгексил)-фосфату. То же относится и к совместимости ди-(этил-гексил)-фталата и дибутилсебацината. Толуолсульфамид совмещается с ацетопропионатом в количестве 25—50% в расчете на эфир целлюлозы. Особенно хорошо совмещаются с ацетопропионатом целлюлозы эфиры лимонной и ацетиллимонной кислот. [c.71]
Опубликован новый метод получения органических иодистых производных [136], основанный на разложении эфиров смесью 95%-ной фосфорной кислоты с иодистым калием в молярном отношении приблизн- [c.200]
Среди низкомолекулярных алифатических спиртов, получаемых гидратацией, ведущее место принадлежит этиловому спирту. Наиболее крупный потребитель этанола — промышленность синтетического каучука. Кроме того, он идет на получение уксусного альдегида, уксусной кислоты, диэтилового эфира, этилацетата. В СССР синтетический этиловый спирт получают преимущественно прямой гидратацией этилена, применяя в качестве катализатора фосфорную кислоту на силикагеле. Примерный план аналитического контроля одного из таких цехов представлен в приложении I. Независимо от метода гидратации этилена, на синтетический этиловый спирт по ГОСТ П547—65 предъявляются единые требования (табл. 33). [c.151]
Реакция, аналогичная фосфонатной модификации реакции Виттига (том I 13.20), используется для получения различных ненасыщенных азотсодержащих соединений (Уэдсворт, Эммонс, 1962). Необходимый реагент, например диэтиловый эфир циклог ексиламида фосфорной кислоты 111, получают по методу Тодда (1945) взаимодействием диэтилфосфита [c.253]
chem21.info