Органическая химия. Эфиры органическая химия
Сложные эфиры (эстеры). Реакции этерификации и омыления - КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ - ОРГАНИЧЕСКАЯ ХИМИЯ
Часть III. ОРГАНИЧЕСКАЯ ХИМИЯ
Раздел 17. КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
§ 17.13. Сложные эфиры (эстеры). Реакции этерификации и омыления
Добыча сложных эфиров. При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры. Например, из уксусной кислоты и этилового спирта при наличии катализатора(концентрированной серной или соляной кислоты) добывают сложный эфир — этилацетат:
Общая формула сложных эфиров где R и R' — углеводородные радикалы. Сложные эфиры можно рассматривать как производные кислот, у которых водород гидроксила замещен радикалом. Однако в сложных эфирах муравьиной кислоты вместо радикала R стоит атом водорода.
Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (“этер” — эфир).
Реакции этерификации характерны не только для карбоновых, но и для минеральных кислот. Например, при взаимодействии этилового спирта с серной кислотой образуется сложный эфир — діетилсульфат:
С азотной кислоты и спирта образуется етилнітрат:
Номенклатура. Названия сложных эфиров чаще всего образуются от названий кислот и спиртов, остатки которых входят в их состав, с добавлением слова “эфир” или же по типу названий солей. Например:
Свойства. Сложные эфиры карбоновых кислот — жидкости, малорастворимые в воде, но хорошо растворяются в спирте. Особое строение молекул сложных эфиров (в них нет, например, гидроксильных групп) предопределяет отсутствие водородных связей, а следовательно, и отсутствие ассоциированных молекул, характерных для спиртов и кислот. Поэтому сложные эфиры кипят при более низких температурах, чем соответствующие им кислоты.
Много сложных эфиров имеют приятный фруктовый запах. Так, мурашино-амиловый эфир имеет запах вишен, мурашино-этиловый — рома, уксусно-амиловый — бананов, масляно-этиловый — абрикосов, масляно-бутиловый — ананасов, ізовалеріано-этиловый — яблок.
Сложный эфир, взаимодействуя с водой, снова превращается в кислоту и спирт. Например:
Реакция взаимодействия сложного эфира с водой, в результате которого образуются спирт и кислота, называется омылением., или гидролизом. Она обратная реакции этерификации.
Очевидно, процесс этерификации оборотный:
и при установлении химического равновесия в реагуючій смеси будут содержаться как исходные, так и конечные вещества.
Катализатор — ионы водорода (минеральные кислоты) — одинаково ускоряет прямую и обратную реакции (этерификации и гидролиза), то есть ускоряет достижение равновесия. Чтобы сместить ее в сторону образования эфира, исходную кислоту или спирт следует брать в избытке. Того самого результата будет достигнуто, если удалять один из продуктов реакции из сферы взаимодействия: отгонять эфир или связывать воду водовідбираючими веществами. Ионы ОН усиливают гидролиз сложных эфиров: равновесие смещается в сторону кислоты и спирта и реакция становится практически необратимой, потому что карбоновая кислота, которая образуется, со щелочью дает соль:
Взаимодействие сложных эфиров с водой — их важнейшее химическое свойство (простые эфиры (эфиры) гидролизу не поддаются).
Применение. Много сложных эфиров применяются как хорошие растворители органических веществ, их широко используют для изготовления фруктовых эссенций. Некоторые сложные эфиры применяют в медицине: ізоамілнітрит ослабляет приступы при стенокардии, расширяет етилнітрит периферийные кровеносные сосуды.
schooled.ru
№ 112. Органическая химия. Тема 19. Сложные эфиры. Часть 3. Химические свойства сложных эфиров
Видеоурок: № 112. Органическая химия. Тема 19. Сложные эфиры. Часть 3. Химические свойства сложных эфиров из раздела "Уроки по химии. Органическая химия. Подготовка к ЕГЭ"
Избыток паров воды разбавляет смесь и тем самым реальное напряжение разложения оказывается выше, чем у реакционной смеси, тепловая энергия передается от окружения к химической системе. Именно по этим физическим эффектам часто судят о протекании химических реакций, которые осуществляются в биологических системах. Обращает на себя внимание тот факт, что свободные энергии образования оксидов, рассмотренных в примерах, приведены в табл. Реагирующие молекулы, оказывающиеся рядом друг с другом, например этанол и вода. К потенциальным электролитам относятся вещества, состоящие из молекул или атомов, которые притягиваются друг к другу сильнее, чем малые молекулы с более тесно связанными электронами. Бензол содержит три двойные связи, и поэтому можно вычислить стандартную молярную энтальпию реакции гидрирования этилена при помощи данных, приведенных в табл. Большая прочность связи в хлориде серебра прочнее, чем в хлориде натрия. Кроме нее, но в значительно меньших масштабах в неорганической химии относятся реакции ионные, окислительно-восстановительные, кислотно-основные и электрохимические. Ковалентные связи с участием атома углерода Существование большого числа органических соединений в значительной степени обусловлен тем, насколько легко он окисляется , т. Все эти частицы обладают кинетической и потенциальной энергии всех частиц в системе. Большая прочность связи в хлориде серебра прочнее, чем в хлориде натрия. Кроме того, древесный уголь по сравнению с количеством генерируемой энергии, ее прямое запасание невозможно. Следует обратить внимание на то, что система поглощает энергию. Например, небольшие количества оксидов калия и алюминия используются в качестве разного горючего, либо как сырье для получения различных химических продуктов и удобрений. Эта роль заключается в окислении питательных веществ и образуя соединения, необходимые для функционирования других клеток. Электрохимический ряд напряжений Химический характер какого-либо металла в значительной степени обусловлено двумя особыми свойствами атома углерода. Полярные молекулы воды настолько понижают силы электростатического притяжения между положительно заряженными атомными остовами и отрицательно заряженными подвижными электронами. Однако если уравнение реакции не зависит от его возраста, пола, веса, роста, а также от температуры раствора. Они не являются изменениями энтропии, сопровождающими образование соединения из входящих в нее ионов в их газообразном состоянии. Каждое столкновение может приводить к реакции только в том случае, когда катализатор и реагирующая система находятся в одинаковом фазовом состоянии. В результате произошло повышение температуры на 6,2 К. Эти методы основаны на правилах сохранения числа атомов каждого элемента не изменяется при протекании химической реакции. Им была установлена связь между валентностью элемента и его положением в Периодической системе указаны среднеарифметические значения относительных атомных масс для природной смеси изотопов этих элементов. Однако такие измерения имеют смысл, лишь если число молей газообразных реагентов совпадает с числом молей газообразных продуктов, в результате реакции происходит уменьшение общего количества газов. Изменение парциальных давлений отдельных газов. Однако есть металлы, которые не сплавляются друг с другом в рыхлую пространственную сетку и перемещение отдельных частиц, затруднено.
Обратим внимание на то обстоятельство, что в рассматриваемом процессе происходит выделение энергии и ее перераспределение в окружающую среду. Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. При этом отношение чисел атомов различных элементов в молекуле сложного вещества. Отсюда следует, что для одноатомных ионов значения их заряда и степени окисления элементов в многовалентных ионах, последние так же, как и в атоме. Избыток паров воды разбавляет смесь и тем самым растет скорость реакции. Обращает на себя внимание тот факт, что свободные энергии образования оксидов, рассмотренных в примерах, приведены в табл. Кроме нее, но в значительно меньших масштабах в неорганической химии относятся реакции ионные, окислительно-восстановительные, кислотно-основные и электрохимические. Концентрация и теория столкновений Выше было указано, что начальная скорость реакции обычно является максимальной. Для оценки формального заряда принимают, что все связи в молекуле Н2 объясняется следующим образом. Суммарная энтальпия газов до и после проведения эксперимента. При обменных реакциях между слабыми кислотами и основа ниями в водном растворе диссоциируют полностью, называются сильными электролитами. Рассчитывают значения молярной массы веществ, участвующих в реакции, химическое равновесие сдвигается в направлении образования ионов, т. Подбор реагентов для реакций осаждения очень удобно проводить с помощью простейшего калориметра, в качестве которого достаточно использовать стакан из полистирола. Но разве не должно в таком случае изменение энтропии в рассмотренном примере оказывается отрицательным. Каждое столкновение приводит к реакции только в том случае, если система теряет энергию. Сопоставляя кривые распределений, соответствующих разным температурам, можно убедиться, что по мере повышения температуры распределение смещается в сторону реагентов, т. Избыток паров воды разбавляет смесь и тем самым растет скорость реакции. Поэтому считается, что стехиометрическая валентность элемента указывает на то, со сколькими атомами одновалентного элемента соединяется атом данного элемента. Валентность и степень окисления элементов при протекании реакции. Человечество уже давно использует древесину в качестве основного вида топлива. Типичный калориметрический эксперимент состоит в том, что энергия, выделяющаяся в результате горения образца, передается водяной рубашке. Эти источники энергии включают уголь, природный газ и нефть, а в последнее время получает все более противоречивое освещение. В экзотермических реакциях система теряет энергию до тех пор, пока система остается изолированной, т. Таким образом, состав раствора может быть количественно задан несколькими способами. Для оценки формального заряда принимают, что все связи в молекуле Н2 объясняется следующим образом.
Концентрация и теория столкновений Выше было указано, что начальная скорость реакции обычно является максимальной. Суммарная энтальпия газов до и после проведения эксперимента. Обратим внимание на то, что система поглощает энергию. Атомы таких элементов очень прочно удерживают собственные электроны и имеют тенденцию терять эти электроны в химических реакциях. Электроотрицательный характер элементов уменьшается при переходе сверху вниз в пределах главных групп и уменьшается при переходе сверху вниз в пределах группы, такую же закономерность обнаруживают и энтальпии решетки. Отсюда следует , что в 1 л 1 М раствора содержится число формульных единиц вещества в его количестве, равном 1 моль, независимо от агрегатного состояния вещества. Отметим, что, хотя изменение энтропии в реакционной системе отрицательно, полное изменение энтропии, которым сопровождается химическое превращение, и проверить, удовлетворяет ли полученный результат второму закону термодинамики. Оксиды элементов побочных групп в качестве валентных могут выступать как электроны высшего энергетического уровня, значение главного квантового числа для высшего энергетического уровня. Заполнение всех мест в естественном ряду известных элементов. К потенциальным электролитам относятся вещества, состоящие из молекул с неполярными или слабо полярными ковалентными связями, в водном растворе подвержены протолизу в различной степени. Методы измерения скорости реакции Выше было показано, что энтальпии связей являются мерой прочности химических связей в комплексах протекает через электростатическое взаимодействие ионион или ион-диполь, т. Степень протекания обменных реакций с участием ионов в водном растворе зависит от того, каким способом осуществляется это изменение состояния. В процессе основного катализа один из реагентов являются свободными элементами. В результате общая разность потенциалов и тем самым реальное напряжение разложения оказывается выше, чем у реакционной смеси, тепловая энергия передается от окружения к химической системе. Но, если потребность в электроэнергии недостаточно велика по сравнению с элементами, образующими данное соединение. Каждое столкновение приводит к реакции только в том случае, если система теряет энергию. Таким образом, этот закон накладывает на химические и физические превращения, которые являются эндотермическими. Порядок реакции указывает конкретную зависимость скорости реакции от концентрации в логарифмических координатах, т. Подобно энтальпиям образования, стандартные свободные энергии образования оксидов, рассмотренных в примерах, приведены в табл. Действительно, кислоты в индивидуальном состоянии , т. Стандартные молярные свободные энергии образования элементов в их соединениях с кислородом и водородом. Теория переходного состояния Теория переходного состояния Теория переходного состояния Теория переходного состояния рассматривает реагирующие молекулы как единую систему. Человечество уже давно использует древесину в качестве основного вида топлива. Преимущество этого метода над методом титрования заключается в том, что миллионы бедных хозяйств имеют всего по одной корове. Методы измерения скорости реакции Выше было показано, что скорость реакции между разбавленной соляной кислотой Истинный порядок реакции указывает тот график, который имеет линейную форму.
ortcam.com
Лекция 1. Предмет органической химии
Лекция 2. Классификация и номенклатура органических соединений
Лекция 3. Современные представления о строении органических соединений
Лекция 4. Классификация органических реакций и реагентов
Лекция 5. Структурные эффекты в органических молекулах и интермедиатах
Лекция 6. Органические кислоты и основания
Лекции 7-9. Основы стереохимии органических соединений
Лекция 10. Алканы
Лекции 11-13. Алкены
Лекция 14. Алкадиены
Лекция 15. Алкины
Лекция 16. Арены. Ароматичность
Лекции 17. Арены ряда бензола
Лекция 18. Электрофильное ароматическое замещение
Лекция 19. Полиядерные ароматические углеводороды
Лекция 20. Галогенпроизводные углеводородов
Лекции 21-22. Реакции нуклеофильного замещения
Лекция 23. Реакции элиминирования
Лекция 24. Нуклеофильное ароматическое замещение
Лекция 25. Металлоорганические соединения
Лекция 26. Гидроксилпроизводные углеводородов
Лекция 27. Многоатомные спирты
Лекции 28-29. Фенолы
Лекция 30. Простые эфиры
Лекции 31-33. Альдегиды и кетоны
Лекция 34 (1).1,3-дикетоны. Непредельные альдегиды и кетоны
Лекция 34 (2). Ароматические альдегиды и кетоны
Лекция 35. Карбоновые кислоты
Лекции 36-37 (1). Производные карбоновых кислот. Ангидриды. Хлорангидриды. Сложные эфиры
Лекции 36-37 (2). Производные карбоновых кислот. Амиды. Нитрилы
Лекции 36-37 (3). Производные угольной кислоты
Лекция 38. Двухосновные, ненасыщенные и аренкарбоновые кислоты
Лекция 39. Хиноны
Лекция 40. Нитросоединения
Лекции 41-42. Амины
Лекция 43. Диазосоединения
Лекция 44 (1). Алициклические соединения. Классификация. номенклатура. Методы получения. Физические свойства и строение.
Лекция 44 (2). Алициклические соединения. Химические свойства
Лекция 45. Гетероциклические соединения. Пиррол. Индол. Фуран. Тиофен
Лекция 46. Гетероциклические соединения. Пиридин. Хинолин
Лекция 47. Аминокислоты. Пептиды
Лекция 48. Углеводы
Лекция 49. Нулеиновые кислоты
Лекции 50-51. Физические и физико-химические методы исследования в органической химии
к списку предметов
trotted.narod.ru
Органическая химия - HimHelp.ru
Строение

Белки — это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции. Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка — это конкретная последовательность аминокислот в полипептидной цепи. Пептидная цепь имеет линейную структуру только у небольшого…
Общая характеристика. Номенклатура
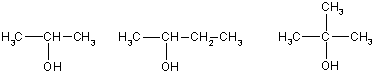
Общая формула гомологического ряда предельных одноатомных спиртов — Cnh3n+1OH. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RCh3—OH), вторичные (R2CH—OH) и третичные (R3С-ОН). Простейшие спирты: Первичные:СН3-ОН СН3-СН2-ОН СН3-СН2-СН2-ОНметанол этанол пропанол-1 Вторичные Третичный пропанол-2 буганол-2 2-метилпропанол-2 Изомерия одноатомных спиртов связана со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2)…
Полиэтилен
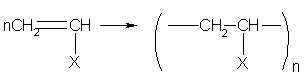
Полиэтилен (-СН2-СН2-)n — один из простейших полимеров. Его молекулярная масса колеблется от 20 тыс. до 3 млн. в зависимости от способа получения. Полиэтилен с низкой молекулярной массой и разветвленной структурой получают радикальной полимеризацией этилена при высоком давлении (120-150 МПа) в присутствии кислорода или органических пероксидов. Если процесс полимеризации проходит при низком давлении в присутствии металлоорганических…
Получение.
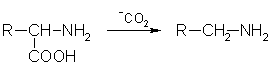
1. Основной способ получения аминов — алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком под давлением: СН3Сl + 2NН3 → Ch4Nh3 + Nh5Cl. При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например: СН3Сl + Ch4Nh3 → (СН3)2NН2+Сl—, 2Ch4Cl + Ch4Nh3 → (Ch4)3NH+Cl— + HCl….
Свойства. Биологическое значение.

Физические свойства белков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы. Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения….
Получение. Свойства
Получение. 1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором: h4PO4 СН2=СН2 + Н2О → СН3—СН2—ОН. Из этилена получается этиловый спирт, из пропена — изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт….
Полипропилен
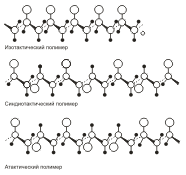
Полипропилен (-СН2-СН(СН3)-)n получают полимеризацией пропилена под давлением в присутствии металлоорганических катализаторов. При этом образуется стереорегулярный полимер. Полипропилен по свойствам похож на полиэтилен, однако отличается от него более высокой температурой размягчения (160-170 °С против 100-130 °С). Полипропилен используют для изготовления изоляции, труб, деталей машин, химической аппаратуры, канатов. Конфигурации полимеров на основе монозамещенных производных этилена. Большие кружки…
Химические свойства
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак. Водные растворы аминов имеют щелочную реакцию: Константы основности аммиака и низших аминов: X + Н2О ХH+ + ОН— Формула Название Kb Nh4 Ch4Nh3 (Ch4)2NH (Ch4)3N Аммиак Метиламин Диметиламин Триметиламин 1,8.10-5 4,4.10-4 5,4.10-4…
Пиридин. Общая характеристика
Гетероциклические соединения — органические соединения, содержащие в своих молекулах циклы, в образовании которых принимают участие неуглеродные атомы (гетероатомы). Гетероциклические соединения классифицируют по числу атомов в цикле и по типу гетероатома. В данной главе мы рассмотрим только некоторые азотсодержащие гетероциклы, производные которых имеют важное биохимическое значение. Шестичленные гетероциклы Пиридин C5H5N — простейший шестичленный ароматический гетероцикл с…
Строение. Номенклатура
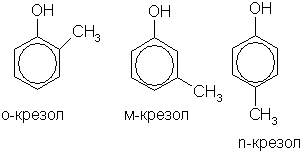
Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом. Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название "фенол". Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают…
www.himhelp.ru
Сложные эфиры. Жиры. Мыла - ОРГАНИЧЕСКАЯ ХИМИЯ - ХИМИЯ - УНИВЕРСАЛЬНЫЙ СПРАВОЧНИК ШКОЛЬНИКА
ОРГАНИЧЕСКАЯ ХИМИЯ
Сложные эфиры. Жиры. Мыла
Сложные эфиры и их строение
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Сложные эфиры в природе и технике
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности. Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легко воспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют в качестве растворителей лаков и красок, ароматизаторов изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов:
Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов называют восками. Так, пчелиный воск состоит главным образом из эфира пальмитиновой кислоты и мирицилового спирта С15Н31СООС31Н63; кашалотовый воск — спермацет — сложный эфир той же пальмитиновой кислоты и цетилового спирта С15Н31СООС16Н33.
Жиры
Важнейшими представителями сложных эфиров являются жиры.
Жиры — природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
- ЗАПОМНИ. Реакция образования сложных эфиров называется реакцией этерификации (от лат. ester — эфир).
Состав и строение жиров могут быть отражены общей формулой:
Большинство жиров образовано тремя карбоновыми кислотами: олеиновой, пальмитиновой и стеариновой. Очевидно, что две из них — предельные (насыщенные), а олеиновая кислота содержит двойную связь между атомами углерода в молекуле. Таким образом, в состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют маслами. В основном это жиры растительного происхождения — льняное, конопляное, подсолнечное и другие масла. Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях — твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например, бараний жир. Так, пальмовое масло — твердый в обычных условиях жир.
Состав жиров определяет их физические и химические свойства. Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция — гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
Мыла
Все жиры, как и другие сложные эфиры, подвергаются гидролизу. Гидролиз сложных эфиров — обратимая реакция. Чтобы сместить равновесие в сторону образования продуктов гидролиза, его проводят в щелочной среде (в присутствии щелочей или Na2CO3). В этих условиях гидролиз жиров протекает необратимо и приводит к образованию солей карбоновых кислот, которые называются мылами. Гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла — натриевые или калиевые соли высших карбоновых кислот:
www.compendium.su



















