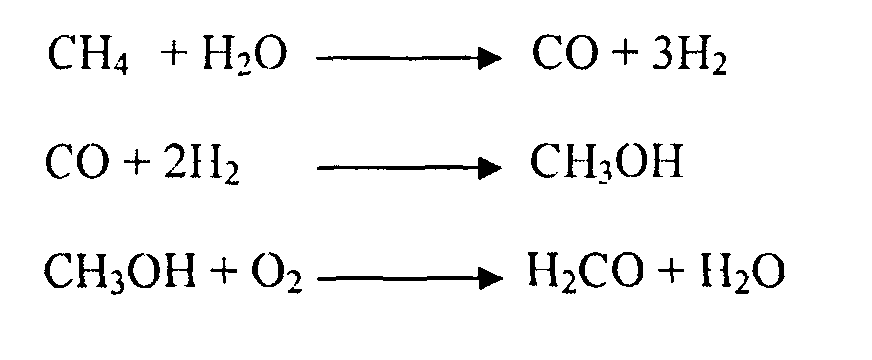Сложные эфиры азотной кислоты. Эфиры азотной кислоты
Сложные эфиры азотной кислоты
Количество просмотров публикации Сложные эфиры азотной кислоты - 574
Азотная кислота образует с многоатомными спиртами (этиленгликолем, глицерином, клетчаткой и др.) сложные эфиры. В молекулах этих эфиров группа N02 соединена не прямо с атомом углерода, как в нитросоединениях, а через кислород.
Нитроглицерин. Физические и химические свойства. Нитроглицерин — густая, бесцветная, маслянистая жидкость плотностью 1600 кг/м3, вязкость его в 2,5 раза больше вязкости воды, но меньше вязкости глицерина. Он хорошо растворяется в большинстве органических растворителей; метиловом спирте, ацетоне, эфире, амилацетате, бензоле, толуоле, ксилоле, нитробензоле и т. д. В воде нитроглицерин растворяется плохо. Нитроглицерин сам является хорошим растворителем нитросоединений и нитроклетчатки. Совершенно чистый, свободный от малейших следов кислоты нитроглицерин в обычных условиях является довольно устойчивым соединением. В присутствии кислот медленно разлагается даже при комнатной температуре. Водные растворы щелочей легко разлагают нитроглицерин, при этом образуются нитраты и нитриты. При быстром нагревании до 180°С нитроглицерин взрывается. При поджигании нитроглицерин дает только местную вспышку, сопровождающуюся его расплескиванием, устойчивого горения не происходит. При этом при ударе и трении нитроглицерин способен взорваться, в связи с этим в свободном виде его перевозить не разрешается.
Нитроглицерин способен к переохлаждению при понижении температуры. Во время затвердевания возможно образование двух форм нитроглицерина: нитроглицерин одной формы затвердевает при 2,1°С, а другой — при 13,2°С. При взрыве 1 кг нитроглицерина выделяется 715 л газообразных продуктов, из них 58,15% С02, 19,82% Н20, 18,50% N2, 3,53% О2. Давление взрыва составляет 119560 МПа, процесс сопровождается выделением 6237 кДж/кг, при этом развивается температура выше 4000°С. На практике для возбуждения детонации нитроглицерина и нитроглицериновых взрывчатых веществ используют капсюль-детонатор.
Получение и применение. Нитроглицерин получается при взаимодействии глицерина со смесью азотной и серной кислот.
С3Н5(ОН)3 + ЗНОNО2 C3H5(ONO2)3 + 3h3O
Реакцию этерификации проводят при температуре не выше 25°С. Полученный нитроглицерин промывают в свинцовых баках теплой водой и 2%-ным содовым раствором. Промытый нитроглицерин фильтруют через фланель и по специальному трубопроводу переводят в свинцовые баки для хранения.
Поскольку нитроглицерин чувствителен к различным механическим воздействиям, его как самостоятельное взрывчатое вещество в технике не используют. Из нитроглицерина изготовляют нитроглицериновые пороха и ди- намиты. В очень малых дозах нитроглицерин применяют как лекарственное вещество.
Нитроклетчатка.Физические и химические свойства.Нитроклетчатка (нитрат целлюлозы) — сложный эфир клетчатки и азотной кислоты. Клетчатка (целлюлоза) является основой всякого вида растений, а потому чрезвычайно распространена в природе. Древесина различных пород деревьев содержит около 50 — 60% целлюлозы, волокна хлопчатника — около 92 — 93%. Лен, пенька также в основном состоят из целлюлозы. Целлюлоза по химической природе относится к классу углеводородов и является высокомолекулярным соединением. Молекулярная масса ее может достигать 500000. Молекула целлюлозы состоит из остатков глюкозы С6Н10О5. Формула целлюлозы имеет вид (С6Н10О5)п (где п — число глюкозных остатков).
По внешнему виду нитроклетчатка почти не отличается от обычной целлюлозы, она имеет белый или слегка желтоватый цвет и волокнистое строение, плотность в среднем равна 1,6 г/см3. Нитроцеллюлоза не растворима ни в холодной, ни в горячей воде, в связи с этим ее можно продолжительное время промывать водой в процессе производства.
Получение и применение.Получают нитроцеллюлозу действием на целлюлозу смеси азотной и серной кислот. Учитывая зависимость отусловий реакции на нитратные группы могут замещаться не все гидроксильные группы, а толь- ко часть их, в связи с этим получается нитроцеллюлоза с различной степенью нитрации.
Степень замещения гидроксилов целлюлозы остатками азотной кислоты определяется по содержанию азота в нитроцеллюлозе. Предельное содержание азота в нитроцеллюлозе может достигать 14,14%.
Для производства высококачественной нитроцеллюлозы применяют чистую целлюлозу, полученную из растительного сырья после специальной химической обработки.
Практически различают следующие виды нитроцеллюлозы:
коллоксилин, содержащий 11,5—12% азота͵ полностью растворимый в смеси спирта с эфиром;
пироксилин № 2, содержащий 12,05—12,4% азота͵ растворимый в смеси спирта и эфира не менее чем на 90%;
пироколлодий Менделеева, содержащий 12,45% азота͵ растворимый в смеси спирта с эфиром не менее чем на 95%;
пироксилин № 1, содержащий 13,0 — 13,5% азота͵ растворимый в смеси спирта с эфиром на 5 — 10%.
Широкое применение в промышленности нашел пироксилин, на базе которого получают порох. Способ получения бездымного пороха в России был изобретен Д. И. Менделеевым.
Пироксилин является взрывчатым веществом (бризантным), в сухом состоянии может взрываться от удара и трения. В небольших количествах сгорает спокойно, в количестве выше 200 кг горение заканчивается взрывом. Во влажном состоянии (20—30% влажности) пироксилин представляет собой совершенно безопасное вещество плотностью около 1650 г/м3, с температурой самовоспламенения 160-180 оС. Пироксилин способен при длительном хранении разлагаться с выделением тепла. Механизм разложения сводится в основном к отщеплению азотной кислоты, сопровождаемому разогревом. Разложение ускоряется в присутствии примесей сульфоэфиров, нитратов целлюлозы и нитратов продуктов гидролиза целлюлозы. При действии света͵ особенно ультрафиолетовых лучей, пироксилин разлагается.
При сгорании пироксилина образуются следующие продукты: 24,7% N0, 41,9% СО, 18,4% СО2, 7,9% Н2, 5,8% N2 и 1,3% СН4). При взрыве пироксилин разлагается с выделением газов другого состава. Сухой пироксилин электризуется при трении, но теряет это свойство уже при незначительном содержании воды.
Коллоксилин широко используют в производстве лаков (нитролаков) для мебельной промышленности.
Целлулоид.Физические и химические свойства. Целлулоид представляет собой твердый раствор нитроклетчатки и камфоры в соотношении 2 : 1. Это прозрачная масса, твердая при обычной температуре и размягчающаяся при нагревании. Целлулоид не растворим в холодной и горячей воде. В тонких пластинах он гибок и эластичен. Плотность целлулоида 1340—1440 кг/м3. На морозе целлулоид становится хрупким и ломким, но при нагревании хрупкость и ломкость исчезают.
Целлулоид в горячем состоянии хорошо штампуется и вальцуется, а в холодном состоянии хорошо обрабатывается на различных станках. Целлулоид не проводит электричество, в связи с этим при трении он сильно электризуется. На целлулоид не действуют слабые растворы кислот и щелочей, однако концентрированные кислоты вызывают немедленную реакцию. Целлулоид хорошо растворяется в ацетоне, бутиловом спирте, амилацетате и других органических растворителях; является огнеопасным материалом. Температура самовоспламенения его не превышает 200 °С, она может снижаться после длительного хранения, что обусловлено улетучиванием камфоры. Целлулоид сгорает с большой скоростью. Горение сопровождается образованием факела значительной высоты. Так, 70 г целлулоида дают факел высотой 1 м, 100 г — 2м. При горении большого количества целлулоида высота факела может достигать 25 м (температура пламени до 1700 °С). Сгорая, целлулоид выделяет большое количество газообразных продуктов. Так, при сгорании 1 кг целлулоида при 1100 °С и нормальном давлении выделяется около 4 м3 газообразных продуктов. Большое содержание кислорода в целлулоиде способствует его горению при малом доступе воздуха.
Разогретый целлулоид разлагается без доступа воздуха. При неполном сгорании выделяются газообразные продукты разложения, способные образовывать с воздухом взрывчатые смеси; в состав продуктов разложения входят такие отравляющие и горючие вещества, как оксид N0 и диоксид N02 азота͵ оксид углерода СО, синильная кислота НСN. Объем газа, выделяющегося при разложении целлулоида, зависит от температуры. С повышением температуры увеличиваются объём и давление газов.
Огнетушащими средствами для целлулоида являются вода, четыреххлористый углерод, диоксид углерода, песок. Воду можно применять в виде сильных компактных струй (под давлением 0,5 МПа и более), в распыленном состоянии или в виде пара.
Получение. Целлулоид получают из коллоксилина, к которому добавляют пластификаторы (дибутилфталат, камфору, касторовое масло и т. д.), пигменты и красители в присутствии растворителей.
Целлулоид применяют для остекления измерительных приборов, изготовления планшетов, угольников, линеек, клавиатуры, музыкальных инструментов, игрушек и различных галантерейных товаров.
referatwork.ru
Сложные эфиры азотной кислоты — КиберПедия
Азотная кислота образует с многоатомными спиртами (этиленгликолем, глицерином, клетчаткой и др.) сложные эфиры. В молекулах этих эфиров группа N02 соединена не прямо с атомом углерода, как в нитросоединениях, а через кислород.
Нитроглицерин. Физические и химические свойства. Нитроглицерин — густая, бесцветная, маслянистая жидкость плотностью 1600 кг/м3, вязкость его в 2,5 раза больше вязкости воды, но меньше вязкости глицерина.Он хорошо растворяется в большинстве органических растворителей; метиловом спирте, ацетоне, эфире, амилацетате, бензоле, толуоле, ксилоле, нитробензоле и т. д. В воде нитроглицерин растворяется плохо. Нитроглицерин сам является хорошим растворителем нитросоединений и нитроклетчатки. Совершенно чистый, свободный от малейших следов кислоты нитроглицерин в обычных условиях является довольно устойчивым соединением. В присутствии кислот медленно разлагается даже при комнатной температуре. Водные растворы щелочей легко разлагают нитроглицерин, при этом образуются нитраты и нитриты. При быстром нагревании до 180°С нитроглицерин взрывается. При поджигании нитроглицерин дает только местную вспышку, сопровождающуюся его расплескиванием, устойчивого горения не происходит. Однако при ударе и трении нитроглицерин способен взорваться, поэтому в свободном виде его перевозить не разрешается.
Нитроглицерин способен к переохлаждению при понижении температуры. Во время затвердевания возможно образование двух форм нитроглицерина: нитроглицерин одной формы затвердевает при 2,1°С, а другой — при 13,2°С. При взрыве 1 кг нитроглицерина выделяется715 л газообразных продуктов, из них 58,15% С02, 19,82% Н20, 18,50% N2, 3,53% О2. Давление взрыва составляет 119560 МПа, процесс сопровождается выделением 6237 кДж/кг, при этом развивается температура выше 4000°С. На практике для возбуждения детонациинитроглицерина и нитроглицериновых взрывчатых веществ используют капсюль-детонатор.
Получение и применение. Нитроглицерин получается при взаимодействии глицерина со смесью азотной и серной кислот.
С3Н5(ОН)3 + ЗНОNО2 C3H5(ONO2)3 + 3h3O
Реакцию этерификации проводят при температуре не выше 25°С. Полученный нитроглицерин промывают в свинцовых баках теплой водой и 2%-ным содовым раствором. Промытый нитроглицерин фильтруют через фланель и по специальному трубопроводу переводят в свинцовые баки для хранения.
Поскольку нитроглицерин чувствителен к различным механическим воздействиям, его как самостоятельное взрывчатое вещество в технике не используют. Из нитроглицерина изготовляют нитроглицериновые пороха и ди-намиты. В очень малых дозах нитроглицерин применяют как лекарственное вещество.
Нитроклетчатка.Физические и химические свойства.Нитроклетчатка (нитрат целлюлозы) — сложный эфир клетчатки и азотной кислоты. Клетчатка (целлюлоза) является основой всякого вида растений, а потому чрезвычайно распространена в природе. Древесина различных пород деревьев содержит около 50 — 60% целлюлозы, волокна хлопчатника — около 92 — 93%. Лен, пенька также в основном состоят из целлюлозы. Целлюлоза похимической природе относится к классу углеводородов и является высокомолекулярным соединением. Молекулярная масса ее может достигать 500000. Молекула целлюлозы состоит из остатков глюкозы С6Н10О5. Формулацеллюлозы имеет вид (С6Н10О5)п (где п — число глюкозных остатков).
По внешнему виду нитроклетчатка почти не отличается от обычной целлюлозы, она имеет белый или слегка желтоватый цвет и волокнистое строение, плотность в среднем равна 1,6 г/см3. Нитроцеллюлоза не растворимани в холодной, ни в горячей воде, поэтому ее можно продолжительное время промывать водой в процессе производства.
Получение и применение.Получают нитроцеллюлозу действием на целлюлозу смеси азотной и серной кислот. В зависимости от условий реакции на нитратные группы могут замещаться не все гидроксильные группы, а толь-ко часть их, поэтому получается нитроцеллюлоза с различной степенью нитрации.
Степень замещения гидроксилов целлюлозы остатками азотной кислоты определяется по содержанию азота в нитроцеллюлозе. Предельное содержание азота в нитроцеллюлозе может достигать 14,14%.
Для производства высококачественной нитроцеллюлозы применяют чистую целлюлозу, полученную из растительного сырья после специальной химической обработки.
Практически различают следующие виды нитроцеллюлозы:
коллоксилин, содержащий 11,5—12% азота, полностью растворимый в смеси спирта с эфиром;
пироксилин № 2, содержащий 12,05—12,4% азота, растворимый в смеси спирта и эфира не менее чем на 90%;
пироколлодий Менделеева, содержащий 12,45% азота, растворимый в смеси спирта с эфиром не менее чем на 95%;
пироксилин № 1, содержащий 13,0 — 13,5% азота, растворимый в смеси спирта с эфиром на 5 — 10%.
Широкое применение в промышленности нашел пироксилин, на основе которого получают порох. Способ получения бездымного пороха в России был изобретен Д. И. Менделеевым.
Пироксилин является взрывчатым веществом (бризантным), в сухом состоянии может взрываться от удара и трения. В небольших количествах сгорает спокойно, в количестве выше 200 кг горение заканчивается взрывом. Во влажном состоянии (20—30% влажности) пироксилин представляет собой совершенно безопасное вещество плотностью около 1650 г/м3, с температурой самовоспламенения 160-180 оС. Пироксилин способен при длительном хранении разлагаться с выделением тепла. Механизм разложения сводится в основном к отщеплению азотной кислоты, сопровождаемому разогревом. Разложение ускоряется в присутствии примесей сульфоэфиров, нитратов целлюлозы и нитратов продуктов гидролиза целлюлозы. При действии света, особенно ультрафиолетовых лучей, пироксилин разлагается.
При сгорании пироксилина образуются следующие продукты: 24,7% N0, 41,9% СО, 18,4% СО2, 7,9% Н2, 5,8% N2 и 1,3% СН4). При взрыве пироксилин разлагается с выделением газов другого состава. Сухой пироксилин электризуется при трении, но теряет это свойство уже при незначительном содержании воды.
Коллоксилин широко используют в производстве лаков (нитролаков) для мебельной промышленности.
Целлулоид.Физические и химические свойства. Целлулоид представляет собой твердый раствор нитроклетчатки и камфоры в соотношении 2 : 1. Это прозрачная масса, твердая при обычной температуре и размягчающаяся при нагревании. Целлулоид не растворим в холодной и горячей воде. В тонких пластинах он гибок и эластичен. Плотность целлулоида 1340—1440 кг/м3. На морозе целлулоид становится хрупким и ломким, но при нагревании хрупкость и ломкость исчезают.
Целлулоид в горячем состоянии хорошо штампуется и вальцуется, а в холодном состоянии хорошо обрабатывается на различных станках. Целлулоид не проводит электричество, поэтому при трении он сильно электризуется. На целлулоид не действуют слабые растворы кислот и щелочей, однако концентрированные кислоты вызывают немедленную реакцию. Целлулоид хорошо растворяется в ацетоне, бутиловом спирте, амилацетате и других органических растворителях; является огнеопасным материалом. Температура самовоспламенения его не превышает 200 °С, она может снижаться после длительного хранения, что обусловлено улетучиванием камфоры. Целлулоид сгорает с большой скоростью. Горение сопровождается образованием факела значительной высоты. Так, 70 г целлулоида дают факел высотой 1 м, 100 г — 2м. При горении большого количества целлулоида высота факела может достигать 25 м (температура пламени до 1700 °С). Сгорая, целлулоид выделяет большое количество газообразных продуктов. Так, при сгорании 1 кг целлулоида при 1100 °С и нормальном давлении выделяется около 4 м3 газообразных продуктов. Большое содержание кислорода в целлулоиде способствует его горению при малом доступе воздуха.
Разогретый целлулоид разлагается без доступа воздуха. При неполном сгорании выделяются газообразные продукты разложения, способные образовывать с воздухом взрывчатые смеси; в состав продуктов разложения входят такие отравляющие и горючие вещества, как оксид N0 и диоксид N02 азота, оксид углерода СО, синильная кислота НСN. Объем газа, выделяющегося при разложении целлулоида, зависит от температуры. С повышением температуры увеличиваются объем и давление газов.
Огнетушащими средствами для целлулоида являются вода, четыреххлористый углерод, диоксид углерода, песок. Воду можно применять в виде сильных компактных струй (под давлением 0,5 МПа и более), в распыленном состоянии или в виде пара.
Получение. Целлулоид получают из коллоксилина, к которому добавляют пластификаторы (дибутилфталат, камфору, касторовое масло и т. д.), пигменты и красители в присутствии растворителей.
Целлулоид применяют для остекления измерительных приборов, изготовления планшетов, угольников, линеек, клавиатуры, музыкальных инструментов, игрушек и различных галантерейных товаров.
Аминосоединения
Аминами называются продукты, полученные в результате замены в молекуле аммиака одного, двух или трех атомов водорода углеводородными радикалами. По числу атомов водорода, замещенных углеводородными радикалами, различают первичные, вторичные и третичные амины.
Физические и химические свойства. Амины взаимодействуют с кислотами, образуя соли. При действии щелочей полученные соли разлагаются с образованием свободного амина.
Водные растворы аминов проявляют подобно аммиаку щелочные свойства (окрашивают лакмус в синий цвет). В отличие от аммиака амины легко воспламеняются от маломощных источников зажигания. Все аминыэнергично взаимодействуют с сильными окислителями. Процесс взаимодействия обычно заканчивается воспламенением амина. При тушении аминов необходимо учитывать возможность появления в продуктах горения(особенно при недостаточном количестве воздуха) токсичных веществ — цианистого водорода и оксидов азота. При нагревании до высоких температур без доступа воздуха амины разлагаются также с образованием циани-стого водорода.
Применение. Наиболее широкое применение получил анилин — ароматический амин; он используется как исходное сырье для получения красителей, фармацевтических препаратов, ускорителей вулканизации каучука и синтеза многих органических веществ.
Широкое применение в производстве синтетических волокон находит гексаметилендиамин, а в производстве пресс-порошков — гексаметилентетрамин (уротропин).
11 СВОЙСТВА И ПОЖАРНАЯ ОПАСНОСТЬЭЛЕМЕНТООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
К элементоорганическим соединениям относятся вещества, в молекулах которых содержатся атомы кремния, фосфора или металла. Элементоорганические соединения в последнее время находят все большее практическое применение в различных отраслях народного хозяйства. Многие из этих соединений по своим свойствам и степени пожарной опасности отличаются от всех других органических соединений и поэтому заслуживают специального рассмотрения.
cyberpedia.su
Эфиры азотной кислоты - Справочник химика 21
Взаимодействие с кислородсодержащими кислотами. Спирты реагируют с кислотами, образуя сложные эфиры, которые рассмотрены в 27.1. Например, при взаимодействии метанола с азотной кислотой получается сложный эфир азотной кислоты — метилнитрат [c.367]Напишите структурные формулы а) пропилового эфира азотной кислоты, б) среднего этилового эфира серной кислоты. [c.146]
Нитроглицерин — тривиальное название. Правильно его называть тринитрат глицерина (сложный эфир азотной кислоты и глицерина). [c.120]Спирты образуют сложные эфиры и с неорганическими (минеральными) кислотами. Так, известны эфиры азотной кислоты азотнокислые эфиры) [c.109]
Метиловый эфир азотной кислоты (метилнитрат) [c.532]
Из сложных эфиров низкомолекулярных нитроспиртов с неорганическими кислотами технический интерес представляют эфиры азотной кислоты, так как они имеют большое значение для промышленности взрывчатых веществ. [c.330]
Из эфиров азотной кислоты практическое значение имеют тринитрат глицерина (нитроглицерин) и динитрат гликоля (см. с. 117). [c.169]
КИСЛОТ. Так, из нитрата серебра и галоидного алкила образуются эфиры азотной кислоты [c.100]
Это еще более расширяет аналогию между сложными эфирами и солями, уже отмеченную нами выше при описании способов их получения. Аналогия эта находит отражение и в том, что названия различных сложных эфиров, например метилацетат (метиловый эфир уксусной кислоты), этилнитрат (этиловый эфир азотной кислоты) и т. п., напоминают названия неорганических солей. [c.116]
Эфиры азотной кислоты. Алкил нитраты обычно получают из спиртов и концентрированной или 100 7о-ной азотной кислоты [c.145]
Азот. Аммиак, соли аммония, амиды металлов, нитриды. Оксиды азота. Азотистая и азотная кислоты н их солн. Эфиры азотной кислоты [c.299]
Сложным эфиром азотной кислоты и глицерина является тринитроглицерин [c.416]
Ароматические нитросоединения нолучаются обычно прямым нитрованием соответствующих соединений. Ароматические нитросоединения применяются в больших количествах как красители и взрывчатые вещества, а также в парфюмерной промышленности. Они используются также в качестве растворителей и химических реагентов. Нитрогруппа может действовать как хромофорная группа в красителях, особенно если имеется несколько нитрогрупн и они располагаются в кольце таким образом, что становятся частью сложной сопряженной системы. Значительно чаще нитрогруппа используется как исходная группа для получения соответствующего анилина в результате применения восстановления в довольно мягких условиях. Использование нитросоединений в промышленности взрывчатых веществ направлено в первую очередь на военные цели. Промышленное производство взрывчатых веществ основано больше на нитроглицерине, т. е. на сложном эфире азотной кислоты, чем на истинных нитросоединениях. Некоторым, весьма существенным исключением являются нитрокарбонитратные пороха, содержащие нитрат аммония и незначительные количества тринитротолуола или динитротолуола. В парфюмерной промышленности нитросоединения используются в качестве синтетических мускусов. Большая группа производных полинитро-/к/)т-бутилбензола обладает запахом, напоминающим мускус. [c.543]
Амилнитрат см. Амиловый эфир азотной кислоты [c.22]
Амиловый эфир азотной кислоты [c.23]
ЭФИРЫ АЗОТНОЙ КИСЛОТЫ [c.301]
Ди нитрохлорбензол, динитротолуол, динитронафталин, перекись бензоила, прикраминовая исяо-та, эфиры азотной кислоты (этилнитрат, бутил-нитрат), селитра аммиачная, этиловый эфир и др. I, III, IV, V, VI, VII и VIII [c.139]
Новые данные о преимущественном вхождении нитрогруппы в положение 2 приводят Титов и Шитов [85]. Изучая нитрование гептана и октана пятиокисью азота, протекающее с образованием нитропарафинов и алкилнитратов, они установили, что эфиры азотной кислоты омыляются во вторичные спирты. При окислении последние переходят в кетоны, состоящие преимущественно из метилкетонов, т. е. из метиламил-кетона или метилгексилкетона, которые были идентифицированы в виде семикарбазонов или 2,4-диннтрофенилгидразонов, В нитропарафинах, которые составляли меньшую часть продуктов реакции, нитрогруппа также была расположена у второго атома углерода. [c.567]
Найдено, что при проведении нитрования для препаративных целей наиболее эффективными нитрующими агентами являются смеси, состоящие из концентрированных азотной и серной кислот. Роль серной кислоты, в смеси этих кислот часто приписывают ее эффективному связыванию воды, образующейся в результате реакции. Серная кислота не может заставить реакцию дойти до конца в результате простого удаления воды, поскольку реакция нитрования является необратимой реакцией. (Это отличает ее от реакций нитрования спиртов, которые не дают нитросоединений, а образуют сложные эфиры азотной кислоты здесь же серная кислота действует как дегидратирующий агент.) Данные, говорящие в пользу существования иона нитрония, и вероятность, что он должен быть сильным нитрующим агентом, заставляют предполагать, что действие серной кислоты можно объяснить ее сильной кислотной природой, обусловливающей индуцирующий эффект ее на образование иона нитрония [c.558]
Нитрование сложными эфирами азотной кислоты (нитрат амила, ацетила и т. д.) NH NH- O- h4 Л + h4 00N02 — QJj То же [c.33]
С НиОЛ Изоамиловый эфир азотной кислоты (изоамилннтрат). ..... 5,2 40.3 67.6 88,6 126,5 147,5 [c.632]
Наконец, при действии на полиолы смеси азотной и концентрированной серной 1СИСЛОГЫ образуются эфиры азотной кислоты [c.37]
Эфиры азотной кислоты представляют собой легкоподвижные жидкости с приятным запахом, взрываюш,иеся при перегреве (осторожность при перегонке ). Практическое ззачение имс й)т азотнокислые эфиры многоатомных спиртов, например н и i р о г л и ц е р и н (азотнокислый эфир глицерина) и нитроцеллюлоза (азотнокислый эфир целлюлозы), нашедшие исключительно большое применение в качестве взрывчатых веществ я порохов (стр. 401 и 462). [c.145]
I. К каким клаооам органических соединений относится нитра-нол а. Соль первичного амина б. Соль вторичного амина в. Соль третичного амина г. Сложный эфир азотной кислота д. Сложный эфир азотистой кислоты е. Нитросоединение [c.235]
Для работы требуется Прибор (см. рис. 82). — Штативы с пробирками. — Ступка фарфоровая. — Держатель для пробирок. — Склянки широкогор-лые с резиновыми пробками и отводными трубками, 3 шт. — Крючок стеклянный. — Стаканы емк. 100 мл, 2 шт. и емк. 50 мл, 2 шт. — Цилиндр мерный емк. 50 мл. — Часы песочные на 15 мин. — Железные предметы для оксидирования.— Пластинки из котельного железа 25X80 мм, 3 шт. — Гвозди железные. — Струна фортепианная. — Бумага лакмусовая. — Бумага миллиметровая. — Бумага фильтровальная. — Железо (опилки). — Сера в порошке. — Соль Мора пере-кристаллизованная. — Тиомочевина. — Метанитроанилин. — Спирт. — Эфир. — Азотная кислота дымящая. Серная кислота концентрированная. — Соляная кислота, 2 н. и 5%-ный растворы. — Едкий натр, 2 н. раствор. — Серная кислота, 20%-ный и 2 н. растворы. — Сульфид аммония, 2 н. раствор. — Сернистая кислота, насыщенный раствор. — Перманганат калия, 0,05 н. раствор. — Роданид калия, 0,5 н. раствор. — Красная кровяная соль, 1 н. раствор. — Желтая кровяная соль, 1 н. раствор. — Хлорид железа (111), 1 н. раствор. — Сульфат меди (II), 0,5 н. раствор. — Раствор, содержащий в 1 л 600 г едкого натра н 60 г нитрита натрия. — Бумага наждачная. [c.324]
Следует всегда отличать нитросоединения Р—ЫОг от нитроэфиров R—О—N02, которые нужно рассматривать как эфиры азотной кислоты (сложные эфиры). Нитроэфирные группы тоже вносят внутренний окислитель в состав органической молекулы и также образуют ряд очень сильных взрывчатых веществ [c.465]
Эфиры азотной кислоты носят название нитратов, например этилнитрат (азотноэтиловый эфир) СгНбОМОг азотистой кислоты — нитритов, например метилнитрит СНзОЫО серной кислоты — сульфатов, например ди-метилсульфат (СНз)3804. [c.159]
Книга состоит нз трех частей, охватывающих трн важнейших класса индивидуальных взрывчатых веществ. В первой части описываются нитросоединения, во второй — ннтроамины и в третьей — эфиры азотной кислоты. [c.3]
Химия и технология бризантных взрывчатых веществ (1960) -- [ c.301 , c.357 ]Органическая химия (1964) -- [ c.346 , c.420 ]
Капельный анализ органических веществ (1962) -- [ c.197 , c.227 , c.692 ]
Комплексные гидриды в органической химии (1971) -- [ c.238 ]
Органическая химия Том 1 (1963) -- [ c.486 ]
Органическая химия (1964) -- [ c.346 , c.420 ]
Полярографический анализ (1959) -- [ c.486 ]
Органическая химия Том 1 (1962) -- [ c.486 ]
Пластификаторы (1964) -- [ c.486 ]
Современные методы эксперимента в органической химии (1960) -- [ c.345 ]
Органический анализ (1981) -- [ c.563 , c.570 ]
chem21.info
Эфир - азотная кислота - Большая Энциклопедия Нефти и Газа, статья, страница 1
Эфир - азотная кислота
Cтраница 1
Эфиры азотной кислоты, особенно с многоатомными спиртами, обычно весьма взрывчаты. Некоторые эфиры азотной и азотистой кислот с одноатомными и чаще многоатомными спиртами вызывают расширение сосудов и понижают кровяное давление. Эти вещества применяются в медицине в качестве спазмолитических и сосудорасширяющих средств. [1]
Эфиры азотной кислоты применяются также для приготовления искусственного шелка по способу де - Шардонне. Нитроклетчатка тянется в виде тонких нитей, по лоску напоминающих шелк. Из таких нитей может быть приготовлена ткань, но ткань эта чрезвычайно опасна, так как легко воспламеняется. Чтобы сделать ее безопасной, группы NO2 удаляются обработкой гидросернистым натрием. Остается чистая целлюлоза, блестящая как шелк, но уже не представляющая такой опасности. [2]
Эфиры азотной кислоты получаются непосредственным действием азотной кислоты на спирты указанным выше образом. Алкилнитраты представляют собой бесцветные жидкости, которые можно перегонять без разложения, но которые взрывают при перегревании их паров, что может произойти в конце перегонки. [3]
Эфиры азотной кислоты ( нитраты) образуются при взаимодействии азотной кислоты с одноатомными, двухатомными и многоатомными спиртами. Все эти эфиры взрывоопасны. [4]
Эфиры азотной кислоты представляют собой легкоподвижные жидкости с приятным запахом, взрывающиеся при перегреве ( осторожность при перегонке. Практическое значение имеют азотнокислые эфиры многоатомных спиртов, например нитроглицерин ( азотнокислый эфир глицерина) н н и трон, е л л ю л о з а ( азотнокислый эфир целлюлозы), нашедшие исключительно большое применение в качестве взрывчатых веществ и порохов ( стр. [5]
Эфиры азотной кислоты получаются непосредственным действием азотной кислоты на спирты указанным выше образом. Алкилнитраты представляют собой бесцветные жидкости, которые можно перегонять без разложения, но которые взрывают при перегревании их паров, что может произойти в конце перегонки. [6]
Эфиры азотной кислоты лишь очень медленно гидролизуются водой, но довольно быстро в присутствии кислот или щелочей. Они разрушаются также под действием раствора Na2S, причем происходит восстановление нитратной группы и отщепление ее от спирта в виде гидр-оксиламина. [7]
Эфиры азотной кислоты все в большей или меньшей степени обладают взрывчатыми свойствами, причем у эфиров одноатомных спиртов эти свойства выражены слабее, чем у эфиров многоатомных спиртов. Наибольшее практическое значение имеют тринитрат глицерина и динитрат гликоля ( стр. [8]
Эфиры азотной кислоты в большей или меньшей степени обладают взрывчатыми-свойствами, причем наименее эти свойства выражены у эфиров одноатомных спиртов. Наибольшее практическое значение из них имеют тринитрат глицерина ( нитроглицерин) и дннитрат гликоля, описанные выше ( стр. [9]
Эфиры азотной кислоты и алифатических спиртов применяют в качестве пластификаторов только при переработке нитрата целлюлозы в пороха и взрывчатые вещества. Следует напомнить, что давно известный нитрат глицерина очень медленно растворяет или, как говорят, переводит в гель нитрат целлюлозы при обычной температуре. [10]
Эфиры азотной кислоты получаются также приливанием спирта ( при охлаждении льдом) в смесь азотной кислоты с тройным количеством серной. [11]
Эфиры азотной кислоты в большей или меньшей степени обладают взрывчатыми свойствами, причем у эфиров одноатомных спиртов эти свойства выражены слабее, чем у эфиров многоатомных спиртов. [12]
Эфиры азотной кислоты все в большей или меньшей степени обладают взрывчатыми свойствами, причем у эфиров одноатомных спиртов эти свойства выражены слабее, чем у эфиров многоатомных спиртов. Наибольшее практическое значение имеют тринитрат глицерина и диншпрат гликоля ( стр. [13]
Эфиры азотной кислоты могут быть обнаружены также в пряже и в тканях. Если нужно обнаружить нитраты и нерастворимые в воде нитросоединения, то готовят водную вытяжку. После центрифугирования или фильтрования прозрачный раствор исследуют на нитрат ( стр. [14]
Эфиры азотной кислоты представляют собой легкоподвижные жидкости с приятным запахом, взрывающиеся при перегреве ( осторожность при перегонке. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Нитраты Эфиры азотной кислоты - Справочник химика 21
КИСЛОТ. Так, из нитрата серебра и галоидного алкила образуются эфиры азотной кислоты [c.100]Эфиры азотной кислоты. Алкил нитраты обычно получают из спиртов и концентрированной или 100 7о-ной азотной кислоты [c.145]
Широко применяются также нитраты металлов в серной кислоте, окислы азота, смесь азотной и уксусной кислот, смешанные ангидриды азотной кислоты и органических кислот (ацетилнитрат и бензоилнитрат), а также эфиры азотной кислоты. Выбор нитрующего агента определяется как характером нитруемого соединения, так и числом нитрогрупп, которое следует ввести в это соединенную. [c.9]
Эфиры азотной кислоты. В некоторых случаях для введения нитрогруппы в мягких условиях применяются эфиры азотной кислоты этилнитрат и нитрат ацетонциангидрина. Этил-нитрат получают взаимодействием концентрированной азотной кислоты (освобожденной от примеси азотистой кислоты) и абсолютного этилового спирта [c.12]Взрывчатые вещества (ВВ) — химические соединения или смеси веществ, способные к быстрому самораспространяющемуся химическому превращению с выделением больших количеств теплоты и образованием газов. Из химических соединений применяют полинитросоединения ароматических и других углеводородов и их производных (тринитротолуол — тротил, тринитрофенол — пикриновая кислота и др.), нитроамины (гексоген), эфиры азотной кислоты и многоатомных спиртов (нитроглицерин, нитроцеллюлоза), соли азотной кислоты (нитрат аммония). Важнейшие смеси — пороха, смеси нитроглицерина с нитратами, аммониты, динамиты, оксиликвиты. [c.30]
Нитраты целлюлозы после получения необходимо стабилизировать, т. е. удалить остаточные кислоты и гидролизовать группы посторонних сложных эфиров (сульфата, фосфата, ацетата), образовавшихся в результате побочных реакций. Запатентованы способы обработки водными растворами нитрата магния, азотной кислоты, органических кислот, а также аминами [95]. В лабораторных условиях стабилизацию осуществляют кипящей водой или метанолом [74, 172]. Энергия активации термической деструкции стабилизированного нитрата целлюлозы составляет 157,4 кДж/моль [150]. [c.383]
Для увеличения полноты выделения урана диэтиловым эфиром и вообще при экстрагировании любым экстрагентом в экстрагируемый раствор часто вводят различные соли в качестве высаливателей. При выборе высаливателя руководствуются соображениями его доступности и эффективности. Само собою разумеется, высаливатель не должен при этом сам переходить в заметных количествах в органическую фазу. При извлечении урана в виде уранилнитрата в качестве высаливателей применяют нитраты или азотную кислоту. [c.290]
Нитратами называют эфиры азотной кислоты [c.347]
Динитробензол получается нитрованием бензола в одну или две стадии. Полинитросоединения ароматических углеводородов наряду с нитратами и эфирами азотной кислоты составляют основную массу бризантных и метательных взрывчатых веществ. В 1881 г. стали известны бризантные свойства тринитрофенола (пикриновая кислота или мелинит), применявшегося ранее (с 1783 г.) как желтый краситель. Затем было получено более [c.523]
Соли и эфиры азотной кислоты (см. 32.6) называются нитратами. Тривиальные названия некоторых нитратов [c.348]
О нитратах целлюлозы, также являющихся сложными эфирами азотной кислоты, см. 36.3. [c.493]
Эфиры азотной кислоты (нитраты) [c.230]
Ароматические нитросоединения нолучаются обычно прямым нитрованием соответствующих соединений. Ароматические нитросоединения применяются в больших количествах как красители и взрывчатые вещества, а также в парфюмерной промышленности. Они используются также в качестве растворителей и химических реагентов. Нитрогруппа может действовать как хромофорная группа в красителях, особенно если имеется несколько нитрогрупн и они располагаются в кольце таким образом, что становятся частью сложной сопряженной системы. Значительно чаще нитрогруппа используется как исходная группа для получения соответствующего анилина в результате применения восстановления в довольно мягких условиях. Использование нитросоединений в промышленности взрывчатых веществ направлено в первую очередь на военные цели. Промышленное производство взрывчатых веществ основано больше на нитроглицерине, т. е. на сложном эфире азотной кислоты, чем на истинных нитросоединениях. Некоторым, весьма существенным исключением являются нитрокарбонитратные пороха, содержащие нитрат аммония и незначительные количества тринитротолуола или динитротолуола. В парфюмерной промышленности нитросоединения используются в качестве синтетических мускусов. Большая группа производных полинитро-/к/)т-бутилбензола обладает запахом, напоминающим мускус. [c.543]
Нитрование сложными эфирами азотной кислоты (нитрат амила, ацетила и т. д.) NH NH- O- h4 Л + h4 00N02 — QJj То же [c.33]
Ди нитрохлорбензол, динитротолуол, динитронафталин, перекись бензоила, прикраминовая исяо-та, эфиры азотной кислоты (этилнитрат, бутил-нитрат), селитра аммиачная, этиловый эфир и др. I, III, IV, V, VI, VII и VIII [c.139]
Эфиры азотной кислоты носят название нитратов, например этилнитрат (азотноэтиловый эфир) СгНбОМОг азотистой кислоты — нитритов, например метилнитрит СНзОЫО серной кислоты — сульфатов, например ди-метилсульфат (СНз)3804. [c.159]
При трехкратном избытке натриймалонового эфира диэтиловый эфир нитромалоновой кислоты получают с выходом 45%. В кэ честве способа получения нитромалонового эфира нитрование нитратом ацетонциангидрина уступает нитрованию налонового эфира азотной кислотой, при кЬто юм всегда получают выход более 90% [63] (см. стр. 153). [c.140]
Эфиры азотной кислоты. Нитраты углеводов имеют большое практическое значенпе как взрывчатые вещества нптраты полисахаридов, особенно нптраты целлюлозы, служат основой бездымных порохов. [c.76]
Присутствие в молекуле вещества атома азота, связанного с кисло-. родом кратной связью, почти всегда обусловливает токсичность соедине,-ния. Причина этого, вероятно, заключается в том, что вещества этого рода легко восстанавливаются, т.-е. отщепляют кислород, н являются таким образом сильными окислителями. Поэтому, все подобные соединения, как то нитросоединения R-NO,, нитрозосоединения R-NO, эфиры азотистой кислоты — нитриты R О N0 и эфиры азотной кислоты — нитраты R-O-NOg, — по существу действуют на организм, аналогичным 06pa30Mj при чем в первую очередь разрушают гемогло- бин крови, окисляя его в метгемоглобин. Кроме того, ядовитое действие их проявляется и во всех клетках и тканях организма. [c.119]
Нитраты органические — органические соединения, содержащие в молекуле одну или несколько групп —О—NOj, связанных с атомами углерода, т.е. являются эфирами азотной кислоты Hj —О—NOj — ме-тилнитрат, jHj—О—NOj — этилнитрат и т. д. [c.202]
В06Х иавестных сложных эфиров азотной кислоты наибольшее распространение и приыенение как в мирной, так и в военной промышленности, имеют нитраты клетчатки или нитроклетчатки. [c.6]
Механизм образования эфиров азотной кислоты по мнению Фармера яа оснований работ Гантша и его сотрудников следует объяснить следующим образом Шефер в ряде работ показал, что спектры поглощения ультрафиолетовых лучей водных растворов азотной кислоты подобны спектрам поглощения металлических нитратов, а спектры безводной или растворенной в инертных растворителях азотной кислоты, подобны спектрам поглощения эфиров азотной кислоты. [c.81]
Нарушение химической стойкости нитратов клетчатки обус-/овлйзаетоя Двумя основными причинами - термическим разложением и гидролизом. В первом случае скорость разложения воараатает с температурой, во втором алучае - гидролиз евойствэяея эфирам азотной кислоты. [c.104]
Помимо двух ооновных, разобранных выше сложных эфиров азотной кислоты, пирокоилина ( или нитрата клетчатки ) и нитроглицерина (или глицеридтринитрата ),нашедших себе обширное применение как в военном деле, так и в мирной промышленности, мы имеем бше целый >яД эфиров азотной кислоты, на рассмотрении которых кратко останоэимои. [c.140]
При действии на спирты смеси азотной и серной кислот легко обра-тся эфиры азотной кислоты, носящие общее название нитратов [c.311]
Эфиры азотной кислоты. Нитроглицерин, тетрил, гек соген и др. открывают реакцией Грисса после восстановдания их до нитратов. [c.141]
Все эфиры азотной кислоты в той или иаой степени взрывчаты. Эфиры одноатомных спиртов (алкилнитраты) менее взрывчаты, чем эфиры многоатомных спиртов, но все же нагревание их выше известной температуры представляет некоторую опасность. Реакции нитратов во многих отнощениях аналогичны реакциям средних эфиров серной кислоты, но применение нитратов менее удобно. Эти реакции будут рассматриваться на примере эфиров серной кислоты (см. стр. 232). [c.230]
Прямое замещение водорода итрогруппой производится с помощью нитрующих агентов. В качестве нитрующих агентов применяются 1) азотная кислота различной концентрации 2) смесь концентрированных азотной и серной кислот (нитрующая смесь) 3) нитраты щелочных металлов в присутствии серной кислоты 4) нитраты металлов в присутствии уксусного ангидрида и уксусной кислоты 5) азотная кислота или смесь азотной и серной кислот с уксусным ангидридом или ледяной уксусной кислотой 6) эфиры азотной кислоты (органические нитраты) 7) Окислы азота. [c.77]
chem21.info
Эфиры сложные азотной кислоты - Справочник химика 21
При взаимодействии целлюлозы с концентрированной азотной кислотой в присутствии концентрированной серной кислоты в качестве водоотнимающего средства образуется сложный эфир — тринитрат целлюлозы [c.403]Этиленгликоль и пропиленгликоль употребляются как антифризы. В смеси с водой ими охлаждают автомобильные двигатели, так как такие смеси не замерзают зимой. Этиленгликоль, применяют также для производства растворителей типа диоксана, карбитола (см. раздел Простые эфиры ). Его сложный эфир с азотной кислотой (динитрат гликоля) — взрывчатое вещество. [c.110]
Взаимодействие с кислородсодержащими кислотами. Спирты реагируют с кислотами, образуя сложные эфиры, которые рассмотрены в 27.1. Например, при взаимодействии метанола с азотной кислотой получается сложный эфир азотной кислоты — метилнитрат [c.367]Нитроглицерин — тривиальное название. Правильно его называть тринитрат глицерина (сложный эфир азотной кислоты и глицерина). [c.120]
Напишите уравнения реакций образования сложных эфиров при действии азотной кислоты на следующие спирты [c.33]
Нитраты целлюлозы представляют собой сложные эфиры целлюлозы, получаемые этерификацией ее азотной кислотой [c.102]
Разбавленная азотная кислота применяется и для нитрования некоторых ароматических соединений, например фенола, ализарина. Фенол, его простые и сложные эфиры нитруются на холоду разбавленной азотной кислотой (плотн. 1,П). При этом образуются о- и п-нитрофенолы в соотношении 2 1 [c.85]
Спирты образуют сложные эфиры и с неорганическими (минеральными) кислотами. Так, известны эфиры азотной кислоты азотнокислые эфиры) [c.109]
Большое значение имеют реакции этерификации гидроксильных групп глицерина, приводящие к образованию сложных эфиров. Здесь мы остановимся лишь на взаимодействии глицерина с тремя молекулами азотной кислоты в присутствии концентрированной серной кислоты [c.125]
В виде сложного эфира с азотной кислотой пентаэритрит применяется как взрывчатое вещество пентрит (стр. 118). [c.113]
Из сложных эфиров низкомолекулярных нитроспиртов с неорганическими кислотами технический интерес представляют эфиры азотной кислоты, так как они имеют большое значение для промышленности взрывчатых веществ. [c.330]
Так, почти всегда образуются следы сложных серного и нитрозил-серного эфиров, а азотная кислота окисляет целлюлозу обе кислоты каталитически ускоряют гидролиз как самой целлюлозы, так и этих эфиров. [c.371]
Из сложных эфиров целлюлозы наиболее важными являются эфир минеральной азотной кислоты—нитроцеллюлоза и органической уксусной кислоты—ацетилцеллюлоза. [c.17]
Целлюлоза устойчива к действию разбавленных щелочей путем комбинированной обработки концентрированными и разбавленными неорганическими кислотами ее можно постепенно расщепить реагирует с концентрированными безводными кислотами с образованием сложных эфиров (эфир с азотной кислотой - нитрат целлюлозы, эфир с уксусной кислотой - ацетат целлюлозы). [c.210]
Целлюлоза находит огромное применение в производстве искусственного волокна (ацетатный и вискозный шелк), ее сложный эфир с азотной кислотой (пироксилин) служит для приготовления бездымного пороха. [c.168]
Полистирол практически водостоек, обладает высокой стойкостью к действию кислот, щелочей (он разрушается только под действием азотной кислоты и олеума). Растворяется в ароматических и хлорированных углеводородах, сложных эфирах, кетонах. Нерастворим в спиртах и в бензине. [c.19]
Маточный раствор представляет собой смесь щавелевой, янтарной, глутаровой и части адипиновой кислоты, растворенных в слабой азотной кислоте. Разработан ряд способов его переработки с целью регенерации азотной и дикарбоновых кислот. Вначале маточный раствор упаривают и получают слабую азотную кислоту, которая идет на укрепление . Затем можно выделить дикарбоновые кислоты — дробной кристаллизацией, экстракцией, превращением в сложные эфиры и т. д. [c.394]
Это еще более расширяет аналогию между сложными эфирами и солями, уже отмеченную нами выше при описании способов их получения. Аналогия эта находит отражение и в том, что названия различных сложных эфиров, например метилацетат (метиловый эфир уксусной кислоты), этилнитрат (этиловый эфир азотной кислоты) и т. п., напоминают названия неорганических солей. [c.116]
Более легкий способ получения алкилсульфокислот заключается в окислении меркаптанов (азотной кислотой) или алкилировании сульфитов в последнем случае при избытке алкилирующего средства образуются сложные эфиры алкилсульфокислот [c.158]
Ароматические нитросоединения нолучаются обычно прямым нитрованием соответствующих соединений. Ароматические нитросоединения применяются в больших количествах как красители и взрывчатые вещества, а также в парфюмерной промышленности. Они используются также в качестве растворителей и химических реагентов. Нитрогруппа может действовать как хромофорная группа в красителях, особенно если имеется несколько нитрогрупн и они располагаются в кольце таким образом, что становятся частью сложной сопряженной системы. Значительно чаще нитрогруппа используется как исходная группа для получения соответствующего анилина в результате применения восстановления в довольно мягких условиях. Использование нитросоединений в промышленности взрывчатых веществ направлено в первую очередь на военные цели. Промышленное производство взрывчатых веществ основано больше на нитроглицерине, т. е. на сложном эфире азотной кислоты, чем на истинных нитросоединениях. Некоторым, весьма существенным исключением являются нитрокарбонитратные пороха, содержащие нитрат аммония и незначительные количества тринитротолуола или динитротолуола. В парфюмерной промышленности нитросоединения используются в качестве синтетических мускусов. Большая группа производных полинитро-/к/)т-бутилбензола обладает запахом, напоминающим мускус. [c.543]
Нитроклетчатка (нитраты целлюлозы). Сюда относятся сложные эфиры целлюлозы и азотной кислоты. Различается по степени нитрования. [c.241]
Глицерин с азотной кислотой образует сложный эфир. Напишите уравнение реакции получения этого эфира, дайте ему название и укажите применение, [c.89]
Сложным эфиром азотной кислоты и глицерина является тринитроглицерин [c.416]
Найдено, что при проведении нитрования для препаративных целей наиболее эффективными нитрующими агентами являются смеси, состоящие из концентрированных азотной и серной кислот. Роль серной кислоты, в смеси этих кислот часто приписывают ее эффективному связыванию воды, образующейся в результате реакции. Серная кислота не может заставить реакцию дойти до конца в результате простого удаления воды, поскольку реакция нитрования является необратимой реакцией. (Это отличает ее от реакций нитрования спиртов, которые не дают нитросоединений, а образуют сложные эфиры азотной кислоты здесь же серная кислота действует как дегидратирующий агент.) Данные, говорящие в пользу существования иона нитрония, и вероятность, что он должен быть сильным нитрующим агентом, заставляют предполагать, что действие серной кислоты можно объяснить ее сильной кислотной природой, обусловливающей индуцирующий эффект ее на образование иона нитрония [c.558]
Нитрование сложными эфирами азотной кислоты (нитрат амила, ацетила и т. д.) NH NH- O- h4 Л + h4 00N02 — QJj То же [c.33]
Рафинирование обессмояенного воска проводится путем окисления примесей смолы азотной, хромовой кислотами, в результате чего смолы окисляются до СО2 и воды. Одновременно происходит частичная деградация восков - сложные эфиры омыляются до кислот и спиртов, последние в свою очередь окисляются до алифатических карбоновых кислот. В конечном итоге получается продукт, основу которого составляют предельные карбоновые кислоты (до 90 мас.%). [c.23]
НИТРОЦЕЛЛЮЛОЗА (нитроклетч.зт-ка) — сложные эфиры целлюлозы и азотной кислоты, например, тринитроклет-чатка [СаН, (ONOa).,] . Н.— вторичное взрывчатое вещество, легко воспламеняющееся и чувствительное к ударам и трению. Применяют для приготовления нитролаков, кинопленок, целлулоида, пироксилина, коллодия и др. [c.176]
I. К каким клаооам органических соединений относится нитра-нол а. Соль первичного амина б. Соль вторичного амина в. Соль третичного амина г. Сложный эфир азотной кислота д. Сложный эфир азотистой кислоты е. Нитросоединение [c.235]
К практически важным реакциям полисахарида целлюлозы (СвНюОв) следует отнести получение ее ксантогената и сложных эфиров уксусной и азотной кислот [c.164]
При использовании солей нитрония ЫОг+ присутствует, конечно, с самого начала. Сложные эфиры и галогенангидриды азотной кислоты диссоциируют, давая N62+. [c.335]
Образование сложного эфира хромовой кислоты из енольной формы кетона аналогично реакции бромирования (т. 2, реакция 12-4). Показано, что похожий механизм реализуется и при использовании азотной кислоты [144]. Однако в некоторых случаях происходит непосредственная атака на кетон, а не на енольную форму [145]. [c.279]
Следует всегда отличать нитросоединения Р—ЫОг от нитроэфиров R—О—N02, которые нужно рассматривать как эфиры азотной кислоты (сложные эфиры). Нитроэфирные группы тоже вносят внутренний окислитель в состав органической молекулы и также образуют ряд очень сильных взрывчатых веществ [c.465]
chem21.info
Сложные эфиры азотной кислоты, разложение
Однако в сложных эфирах азотной кислоты атом азота нитрогруппы присоединен к углероду через атом кислорода, чем обусловливается легкость разложения (гидролиза) сложных эфиров даже реакционной водой. Поэтому реакция этерификации обратима. Вследствие своей непрочности сложные эфиры азотной кислоты легко взрываются (нитроглицерин, нитроклетчатка). [c.62] Известно несколько реакций, связанных с термическим разрывом связи N—О. Лучшим примером их являются реакции разложения сложных эфиров азотной и азотистой кислот. Обзор по химии сложных эфиров азотной кислоты опубликован недавно Бошаном, Мерроу и Ван Дола [283]. К наиболее понятным случаям относится разложенпе этилнитрата. Согласно Леви [284], в газовой фазе при 160—200° оно идет по схеме [c.416]Азотная кислота получается путем окисления аммиака, окисления азота воздуха, разложения нитратов, главным образом нитрата натрия (природной чилийской селитры, или искусственно приготовленной, искусственной селитры ), а также Са(КОз)2 (норвежской селитры) или NH NOg кроме того, ее можно получать при денитрации отбросных кислот, являющихся отходом при производстве органических сложных эфиров азотной кислоты (нитроглицерина, нитроклетчатки) и нитросоединений ароматического ряда (нитробензола, тринитротолуола, пикриновой кислоты и т. п.). [c.92]
Нитраты. За последние годы развитию исследований по экстракции нитратов металлов органическими растворителями способствовало главным образом то важное значение, которое имеет этот метод для отделения уранил-нитрата. Ряд трех- и четырехвалентных нитратов металлов экстрагируется из азотнокислых растворов такими кислородсодержащими растворителям-и, как простые и сложные эфиры, кетоны, спирты. При комнатной температуре в том случае, когда исходные объемы фаз одинаковы, из 8 М азотной кислоты этиловым эфиром экстрагируются следующие количества металлов (в процентах) Сг (VI) > 15 (разложение) Zr 8 Au (III) 97 Hg (II) 4,7 Tl (III) 7,7 Bi 6,8 As (V) 14,4 e (IV) 96,8 Th 34,6 U (VI) 65 Некоторые другие элементы экстрагируются в меньшей степени. Такие высаливающие реагенты, как нитрат аммония, лития, железа (III), алюминия, увеличивают экстрагируемость урана и позволяют осуществлять экстракцию при более низких концентрациях азотной кислоты (см. подробности на стр. 811). Нитрат лития (но не нитрат аммония) способствует экстракции тория. Скандий экстрагируют из сильно концентрированных растворов нитрата лития. Для нитрата тория диэтилкетон и другие кетоны как экстрагенты более эффективны, чем эфиры. Три-н-бутилфосфат — хороший растворитель для нитратов церия, тория и уранилнитрата [c.52]
МИТОМ. Это соединение отличается весьма положительными свойствами, так как оно не только способствует желатинированию, но действует также и в качестве стабилизатора нейтрализуя продукты разложения сложных эфиров азотной кислоты и удлиняя, таким образом, срок полезной службы ВВ. [c.12]
В целях утилизации Х-масла, содержащегося в циклогексаноле-сырце, нами были проведены исследования по его окислению азотной кислотой, а также по окислению Х-масла, предварительно омыленного 16%-ным раствором ЫаОН. При омылении Х-масла за счет разложения сложных эфиров образуются циклогексанол и циклогексанон, а их окисление азотной кислотой дает дополнительное количество адипиновой кислоты. [c.37]
Испытуемое вещество извлекают из лекарственных средств спиртом. В результате омыления эфира раствором едкого натра в присутствии сплава Деварда связанную азотную кислоту восстанавливают до аммиака, последний после перегонки титруют в при- емнике (так же, как и по методу Кьельдаля). Поскольку в лекарственных формах может присутствовать в качестве продукта разложения свободная азотная кислота, ее определяют наряду со связанной азотной кислотой. С этой целью спиртовую вытяжку, разбавленную водой, многократно встряхивают с хлороформом. В слой хлороформа переходит только сложный эфир, а свободная азотная кислота остается в водном слое. После отгонки хлороформа связанйую азотную кислоту определяют титрованием полученного при ее восстановлении аммиака, а свободную азотную кислоту после восстановления до аммиака в водном растворе определяют спектрофотометрическим методом, основанным на взаимодействии с реактивом Несслера (см. УП. а). [c.235]
chem21.info