Польза и вред феноксиэтанола в косметике. Гликолевый эфир это
польза и вред применения в косметике
В современном мире, который меняется быстро на смену одним химическим веществам приходят другие. Если верить ученным, то все совершается во благо человечества, одно непригодное соединение заменяется другим менее опасным. Так, в косметологии на смену химически вредным парабенам пришел феноксиэтанол. Но так ли он безопасен?
Что это за «зверь»?
С точки зрения химии феноксиэтанол – это сложный эфир, который проявляет все характерные для него свойства:
- жидкость маслянистая на ощупь;
- приятный фруктовый запах;
- хорошо растворим в жирах, воде;
- горький вкус;
- среда раствора – кислая, рН =6,5.
Благодаря своему составу и определенной последовательности соединения между атомов химических элементов Кислорода, Водорода и Углерода данное вещество нашло широкое применение в медицине и косметологии.
Используют феноксиэтанол в качестве антисептика и консерванта.
Данное вещество проявляет выраженное антибактериальное действие в отношении как грамположительных, так и грамотрицательных бактерий, дерматофитов некоторых грибов и липофильных вирусов. Установлено в ходе лабораторных исследований, что феноэкситанол при неповрежденной коже практически не проникает в центральный кровоток. Это вещество не накапливается в организме.
Чем опасна косметика с феноксиэтанолом?
Использование данного эфира в косметологии критикуется многими, по таким причинам, он:
- Мутаген. Данное утверждение было подтверждено на лабораторных крысах, у которых наблюдались хромосомные мутации. Также негативное воздействие было и на репродуктивную систему, особенно у самцов. Однако подобные исследование не проводились на людях и в косметических средствах дозы вещества очень малы. Также тест Эймса на мутагенность дал отрицательный результат.
- Канцероген. Сам феноксиэтанол не вызывает развитие раковых опухолей, но фенол и ацетальальдегид, которые образуется при его распаде довольно опасны для организма и могут их провоцировать. В организме человека в ходе естественных биохимических реакций, при попадании эфира в капилляры, происходит такое разложение на составляющие.
- Аллерген. В опытах на животных было отмечено, что при длительном воздействии в больших дозах препарат вызывает зуд, шелушения кожи. В реальной жизни через косметические средства в организм человека такая доза вещества попасть не может.
- Токсичен. Концентрированный раствор является ядом, вызывая поражения дыхательной и нервной систем. Схожее действие проявляется при попадании вещества во внутрь организма. Именно поэтому американское Управление по контролю качества FDA выпустило предупредительный пресс-релиз, касающейся крема для сосков содержащего феноксиэтанол. В данном посыле говорилось, что попадая в молодой организм эфир этиленгликоля способен вызывать рвоту, диарею и угнетать центральную нервную систему.
Все эти факты правдивы и подтверждены исследованиями, но при их проведении брались высокие дозы препарата и частое его использование. В косметических средствах и медпрепаратах концентрация феноксиэтанола менее 1%.
При этом выбирая средства по уходу за младенцами и кормящими матерями, нужно помнить, что детский растущий организм очень уязвим, и требует к себе бережного отношения и использования как можно меньше агрессивных, опасных веществ.
Зачем в косметике этот гликолевый эфир?
Данное вещество считается универсальным консервантом, продлевающим жизнь косметическим средствам. Именно поэтому открытый шампунь или крем можно использовать 6-12 месяцев. Если же феноксиэтанола там не было, то в косметику попадали бактерии из воздуха, поверхности кожи, воды и вызывали б не только его порчу, но и наносили серьезный урон здоровью.
Феноксиэтанол благодаря своему составу, активно взаимодействует с верхним слоем дермы, производя омолаживающий эффект. Действительно кожа становится более гладкой, ровной, но эффект к сожалению, недолговременный.
Данный эфир отличный фиксатор ароматов, поэтому используется в парфюмерной промышленности. Также он ценится в качестве ароматизатора.
Антибактериальные свойства позволяют применять его в средствах по уходу за проблемной кожей. Такие косметологические продукты подойдут для лечения акне, розовых прыщей и воспалений кожи. Также данное вещество можно встретить в составе таких косметических продуктов:
- сыворотка и крем для ухода за кожей вокруг глаз;
- декоративная косметика;
- средства для умывания, снятия макияжа;
- ночной крем;
- скрабы;
- средства для волос;
- детские влажные салфетки;
- детские кремы, лосьоны.
Феноксиэтанол в органической косметике
Феноксиэтанол до недавнего времени можно было обнаружить в органической косметике. Натуральный гликолевый эфир получали путем органического синтеза из грейпфрута. Хоть это вещество и имеет «натуральные» корни, но по химическому составу и свойствам идентично синтетическому, полученному в лаборатории, поэтому на человека действует схоже. Единый европейский стандарт качества органической продукции COSMOS вывел его из списка разрешенных продуктов в натуральной косметике.
Если же на продукции стоит отметка, что это «органик», но в ней присутствует феноксиэтанол, значит это еще старая этикетка или подделка. Данное вещество может быть записано в составе так:
- phenoxyethanol;
- 2-phenoxyethanol;
- С8Н10О2;
- этиленгликоля монофениловый эфир;
- фенилцеллозольв;
- в составе композиций — Euxyl K 300, K 700, PE 0910.
Применение гликолевого эфира в других странах
При подборе косметических средств, особенно во время беременности и лактации, нужно внимательно изучать состав. Ведь разрешен в использовании, не означает – безопасен для здоровья.
В США использование феноксиэтанола в косметической продукции подверглось жесткой критике. Поводом тому стали частые жалобы и обращения граждан о плохом влиянии данного вещества на кожу, некоторые люди говорили о появлении шрамов, рубцов и ожогов. Однако достоверных подтверждений этому не было. Применение его ограничено.
В Японии существует строгий запрет на использование данного вещества. Если оно будет обнаружено в продукции, предприятие ожидает потеря лицензии и судебные разбирательства.
На территории ЕС феноксиэтанол отнесен в категорию веществ-раздражителей, поэтому его использование строго контролируется и не допускается превышение 1%. В Германии были проведены исследования, доказывающее его опасность при частом использовании. Данный эфир провоцирует развитие кожных заболеваний.
Также нужно помнить, что если гликолевый эфир находится в средствах, которые смываются с кожи (шампунь, гель для душа) то его «вредность» сводится к нулю. При нанесении крема, масок, которые впитываются, отрицательное влияние возрастает.
Выбирая косметическое средство с феноксиэтанолом, помним о возможных негативных последствиях при длительном использовании. Также людям с чувствительной кожей, экземой, дерматитами, склонных к аллергии, беременным и кормящим женщинам, детям до года стоит исключить продукцию, содержащую гликолевый эфир.
womaninstinct.ru
Физические свойства эфиров гликолей - Справочник химика 21
Это один из вариантов очистки газов физической абсорбцией. В качестве абсорбента применяют диметиловых эфир полиэтилен-гликоля [199, 249—255], основные физико-химические свойства которого приведены ниже [c.269]Как было указано выше, в смешанных сложных эфирах возможны два вида гликолевых группировок. Полиэтиленгликоль имеет повторяющуюся группу (—О—СНг—СНг—) простого эфира, тогда как диол с длинной цепью, например диметилол-гептан (ДМГ), не имеет повторяющихся простых эфирных групп. Как видно из табл. III. 3, смешанные сложные эфиры с группировкой простого эфира второго вида имеют более низкий индекс вязкости и меньшую вязкость при 98,9° С. Мак-Тэрк установил, что смешанные сложные эфиры из диолов с длинной цепью обычно уступают по физическим свойствам полиэтилен-гликолям, содержащим эфирные связи. [c.96]
Физические свойства эфиров этилен- и пропиленгликолей прежде сего зависят от молекулярной массы эфирной группы. С ее ростом Увеличиваются температура кипения и коэффициент преломления, о уменьшаются плотность и растворимость эфира гликоля (табл. 84, [c.291]Учитывая электростатическую природу водородной связи, можно предполагать значительное влияние стерических затруднении на межмолекулярную водородную связь и, как следствие, на физические свойства эфиров гликолей. В табл. 83 приведены. свойства простых этиловых эфиров гликолей, полученных из различных окисей. С увеличением молекулярной массы окисп возрастают температура кипения и коэффициент преломления эфиров. При более высокой температуре кипит изомер с первичной ОН-группоя. [c.291]
Физические свойства эфиров гликолей [c.289]
В книге описаны физические п химические свойства, методы получения, области применения, условия транспортирования, хранения и методы анализа ряда наиболее важных производных окисей этилена и пропилена этиленгликоля, ДИ-, три- и тетраэтиленгликолей, пропилен-, дипропилен-и трипропиленгликолей, эфиров гликолей и полимеров окиси этилена и окиси пропилена. Рассмотрены также токсические свойства указанных продуктов, условия обращения с ними. [c.2]
Гликоли. Наибольшее применение в синтезе ненасыш,енных полиэфиров нашли 1,2-пропилен-, этилен- и диэтиленгликоли. Это связано не только с их доступностью, но и с хорошими свойствами полиэфиров на их основе. Строение гликоля существенно влияет на физические свойства олигомеров — совместимость с мономерами, температуру размягчения, склонность к кристаллизации и т.д. От длины цепи гликоля зависит степень ненасыщенности полиэфира и, следовательно, прочность, теплостойкость и деформируемость его сополимеров. Путем применения некоторых гликолей (аллиловый эфир глицерина, полиалкиленгликоли и т.п.) удается устранить ингибирующее действие кислорода воздуха на процесс отверждения полиэфира. [c.12]
Физические свойства простых эфиров гликолей [c.267]
Практическое применение получили только некоторые эфиры этой труппы, представляющие собой фосфаты гликолей, частично превращенных в простые эфиры, или фосфаты смешанных простых эфиров гликолей и низкомолекулярных одноатомных спиртов. Некоторые физические свойства и данные о растворяющей способности этих эфиров приведены в табл. 174—176 (см. стр. 410—413). [c.423]
Физические свойства. Низшие гликоли являются довольно густыми бесцветными жидкостями, не имеющими запаха, обладающими сладким вкусом, откуда и произошло их название (греч. гликюс — сладкий). Этиленгликоль смешивается с водой и со спиртом. Все низшие гликоли хорошо растворимы в воде и спирте и довольно трудно — в эфире. Высшие же гликоли трудно растворимы в воде и гораздо лучше растворимы в спирте и эфире. [c.481]
Физические свойства. Большинство гликолей — густые жидкости, высшие же гомологи, а также двутретачные глнколп—твердые кристаллические вещества. Второй гидроксил в молекуле сильно влияет на физические свойства соединения. Значительно повышается температура кипения если этанол кипит при 78, 4° С, то этандиол — при 197, 2° С. Плотность диолов большею частью выше единицы. Этанол и этандиол имеют при 0° С соответственно плотность 0,806 и 1, 130. У гликолей уже почти нет специфического запаха и появляется сладкий вкус. Низшие гликоли хорошо растворяются в воде и спирте, но трудно в эфире, а высшие гомологи — трудно в воде и лучше в спирте и эфире. [c.173]
Химическую активность эфиров гликолей целесообразно рассмотреть в зависимости от тех же факторов, которые определяют их физические свойства степени замещения исходного гликоля, строения и числа оксиалкиленовых групп, природы эфирной связи (простая или сложная), а также от свойств заместителей. [c.300]
Третий тип систем с НКТР включает воду или глицерин в смеси с эфирами гликолей или органическими основаниями типа алкилпи-ридинов. Вероятно, повышение температуры вызывает разрыв некоторых связей, что способствует разделению жидкостей. Долголенко [729] предположил, что эти связи возникают благодаря образованию гидратов. Журавлев [746] исследовал иррациональности в вязкостях и плотностях некоторых двойных водных систем, содержащих триэтиламин. Он сделал следующее заключение Двойные расслаивающиеся системы с нижней критической температурой растворения — это всегда системы с химическим взаимодействием компонентов. Изотермы физических свойств системы триэтиламин — вода подтверждают это . [c.19]
Физические свойства полимеров и степень их полимеризации зависят от условий процесса. Так, при полимеризации метилметакрилата в растворе в присутствии перекиси бензоила в качестве инициатора на молекулярный вес полимера оказывает влияние концентрация мономера [2208]. Другим важным фактором, влияющим на степень полимеризации, является температура. От степени полимеризации зависит растворимость полимера. Полученные обычным способом полимеры имеют средний молекулярный вес от 100 ООО до 175 ООО. Они представляют собой светлые твердые массы, похожие по внешнему виду на стекло, однако отличающиеся от последнего своими замечательными механическими свойствами, главным образом прочностью и неспособностью к растрескиванию.. Эти массы очень легко поддаются обработке. По способности пропускать ультрафиолетовые лучи опи превосходят обычное стекло, однако уступают в этом отношении кварцевому стеклу. Полимеры растворяются в органических растворителях, например в ароматических и галогенозамещенных углеводородах, в эфирах, в уксусной кислоте и т. п., образуя вязкие растворы, однако они нерастворимы в воде, малорастворимы в глицерине или гликоле полиакрилаты, полученные фотонолимери-зацией, абсолютно нерастворимы даже в органических растворителях. Химически активные вещества относительно легко разрушают полиакрилаты и полиметакрилаты [2243], которые, например, гидролизуются кислотами и п елочами при повышенной температуре [2142, 2243]. При нагревании до 300° полиакрилаты разлагаются на димеры и тримеры, тогда как полиметакрилаты деполимеризуются до мономера (см. стр. 436). Исходя из способности полиметакрилатов легко деполимеризоваться, Штаудингер припистл-вает им линейную структуру [2105]. [c.460]
Этиленгликоль. Этиленгликоль представляет собой бесцветную жидкось с температурой кипения 197,6 (760 мм). Смешивается во всех отношениях с водой, различными спиртами, ацетоном, глицерином, ледяной уксусной кислотой, пиридином, фурфуролом. Не смешивается с ароматическими углеводородами, хлороформом, четырех хлористым углеводородом, хлорбензолом, сероуглеродом, малорастворим в эфире (100 частей эфира растворяют 1,1 части гликоля). Этиленгликоль обладает сладким вкусом и по физическим свойствам близок к глицерину. [c.64]
chem21.info
Гликолевая кислота, эфиры - Справочник химика 21
Гликолевой кислоты эфир [c.373]Данный метод синтеза этилгликоля основан на наиболее дешевом углеводороде — метане (метан-)-синтез-газ- метанол->-форм-альдегид- -гликолевая кислота->-эфир этиленгликоль). Однако по сравнению с обычным способом получения этиленгликоля через окись этилена такой метод является слишком многостадийным и не имеет каких-либо преимуществ. [c.762]
Метиловый эфир гликолевой кислоты (простой). . . . Метиловый эфир уксусной [c.119]Реакцию окиси углерода с формальдегидом проводят при 150—200 " и 700 ат в присутствии серной кислоты или трехфтористого бора как катализатора [135]. Метиловый эфир гликолевой кислоты восстанавливают нри 200—225° над катализатором медь — хромит бария водородом под давлением 20-40 а/га [136]. [c.405]
Согласно патентным данным, процесс проводят при 150—200° под давлением порядка 700 ат, причем катализатором служит серная кислота или фтористый бор [5]. Если воду заменить спиртами, то образуются непосредственно эфиры гликолевой кислоты [6]. [c.296]
Гликолевая кислота легко этерифицируется метиловым спиртом в метиловый эфир гликолевой кислоты. Парофазное гидрирование этого эфира большим избытком водорода при 200—225° и давлении 20—40 ата в присутствии хромита меди приводит к получению этиленгликоля с высоким выходом [7] выделяющийся при гидрировании метиловый спирт возвращают в процесс [c.297]
Другой промышленный способ получения этиленгликоля заключается в действии окиси углерода на формальдегид. В результате конденсации образуется гликолевая кислота, метиловый эфир которой восстанавливают в паровой фазе в этиленгликоль (гл. 16, стр. 296). В 1954 г. в США 83% этиленгликоля было получено из окиси этилена, а 17% — из формальдегида и СО [1]. Последний способ нельзя использовать для производства окиси этилена хотя теоретически этиленгликоль и может превратиться при повышенной температуре и низком давлении в окись этилена, на практике основными продуктами реакции, проведенной при этих условиях, являются ацетальдегид или диоксан, более устойчивые, чем окись этилена. [c.354]
Все алифатические диазосоединения чрезвычайно реакционноспособны. Вода, содержащая следы серной кислоты, разлагает диазо-уксусный эфир на эфир гликолевой кислоты и азот [c.358]
Карбоксиметилцеллюлоза (КМЦ) — представляет собой простой эфир целлюлозы и гликолевой кислоты. КМЦ — порошок белого или кремового цвета, относительно медленно растворяющийся в воде. Свойства КМЦ зависят от степени полимеризации (СП) и степени этерификации (СЭ). Чем выше СЭ, тем лучше растворяется КМЦ. КМЦ маркируют по величине СЭ и СП (КМЦ-85/250 КМЦ-85/350 КМЦ-65/500, КМЦ-85/600 и т. д.) или по вели- [c.263]
Превращение гликолевой кислоты в метиловый эфир [c.702]
Наличие в молекуле оксикислот карбоксильной и гидроксильной групп приводит к тому, что эти соединения могут реагировать и как спирты и как кислоты. Например, взаимодействуя с этиловым спиртом, гликолевая кислота образует сложный этиловый эфир [c.285]
ЭТИЛОВЫЙ эфир гликолевой кислоты [c.285]
Эфирные вытяжки сушат в течение 3—4 час. пад 15 г безводного сернокислого кальция (примечание 2) и фильтруют. К фильтрату прибавляют 10 мл абсолютного метилового спирта и эфир отгоняют на паровой бане (примечание 3). Остаток перегоняют в вакууме, пользуясь колбой с елочным дефлегматором. После отделения небольшого головного погона (2—3 мл) гладко перегоняется нитрил гликолевой кислоты при 86 — 88° (8 м.и) [102— 104° (16 мл1)]. Выход чистого вещества (примечание 4) составляет [c.354]
Подобным же образом с соляной кислотой образуется эфир монохлоруксусной кислоты, а с иодом — эфир дииодуксусной кислоты. с органическими кислотами образуются эфиры кислотных производных гликолевой кислоты (эфиры ацидил-гликолевой кнслоты) [c.320]
Синтетические моющие средства, особенно соли сульфокислот и алкилсульфлты, пе обладают способностью удерживать смытую грязь в растворе, т. е. способностью предотвращать товторное поглощение волокном окрашенной грязи — свойством, которым мыло обладает в очень высокой мере. Окрашенные загрязнения, состоящие из пыли и прочих неорганических составных частей, частично удерживаются на ткани органическими веществами, именно как жиры, масла и пот. Если эти вещества моющим средством извлекаются из ткани, переходя в эмульгированное состояние, то загрязнения в значительной мере теряют свою связь и также отделяются от волокна и связываются с мицеллами натурального мыла, что препятствует их обратному поглощению волокном. В случае синтетических средств типа солей сульфокислот, у которых вследствие слабовыраженного коллоидного характера мицеллы образуются лишь в меньшей мере, способность удержания смытой грязи в растворе выражена значительно слабее. Синтетические моющие средства обладают большой диспергирующей способностью, в результате чего грязь, переходя в раствор, оказывается сильно диспергированной и в таком виде вновь частично поглощается хлопчатобумажным волокном. Это приводит к тому, что со временем наблюдается посерение белья, которое, правда, становится заметным лишь после повторных стирок. Чтобы предупредить такое посерение белья, необходимо к синтетическим моющим веществам, не обладающим способностью удержания смытой грязи в растворе, прибавлять вещества, способные выполнить роль мицелл мыла. Такие вещества были найдены, -например, в виде тилозы НВК (эфира целлюлозы и гликолевой кислоты, являющегося продуктом реакции алкилцеллюлозы с моно-хлоруксуснокислым натрием — карбоксиметилцеллюлозы), применяемой либо самостоятельно, либо в смеси с силикатом натрия. В настоящее время их прибавляют в определенном количестве к каждому синтетическому моющему средству, особенно к мыльным порошкам. [c.409]
Получение этиленгликоля из формальдегида организовано в США фирмой Е. I. du Pont de Nemours and o. По этому способу смесь паров формальдегида и воды (объемное соотношение 1 1) абсорбируется водным раствором гликолевой кислоты (мольное соотношение 1 2) с примесью каталитических количеств серной кислоты и затем пропускается через реактор вместе с избытком окиси углерода при 200 "С и 70 МПа (время контакта 5 мин). В результате образуется гликолевая кислота (выход 90—95%), выделяемая перегонкой прн пониженном давлении. После этерификации гликолевой кислоты метиловым спиртом и очистки зфира перегонкой, проводится гидрирование метилового эфира гликолевой кислоты при 200 °С и 3 МПа в присутствии катализатора медь—хромат бария. На стадии восстановления получают этиленгликоль с выходом 90%. Данный метод не получил широкого распространения вследствие многостаднйности и высокой коррозионности среды, но может быть перспективным при снижении стоимости и расщирении производства синтез-газа. [c.274]
Амальгама натрия восстанавливает ее в изэтионовую кислоту при действии перманганата бария она окисляется в бромсульфо-уксусную кислоту окисление окисью серебра ведет к получению гликолевой кислоты азотная кислота дает в качестве конечного продукта щавелевую кислоту. При нагревании калиевой соли 1-бром-2-оксиэтан-1-сульфокислоты до 225° образуется простой эфир, как и из солей изэтионовой кпслоты [c.148]
Карбоксиметшцеллюлоза (КМЦ) является натриевой солью простого эфира целтаолозы и гликолевой кислоты. Промышленность поставляет высоковязкие (КМЦ-500, КМЦ-600) и низковязкие (КМЦ-300, КМЦ-250) реагенты. Цифры в обозначении указывают степень полимеризации, т. е. число элементарных звеньев в цепочке макромолекулы высокомолекулярного соединения. КМЦ представляет собой беловатое волокнистое вещество, медленно растворимое в воде с образованием вязкого коллоидного раствора. [c.54]
Из водяного газа получают синтетичес]окисп углерода при высокой температуре под давлением получают гликолевую кпслоту, которую этери-фицируют метиловым спиртом. Метиловый эфир гликолевой кислоты переводят каталитическим гидрированием в гликоль и метанол. Выпускаемый на рынок этой фирмой антифриз иод названием зерекс и является этиленгли-колем, который производят именно этим способом [134]. [c.405]
КМЦ представляет собой натриевую соль простого эфира целлюлозы и гликолевой кислоты. Ее можно получать с заранее заданными коллоидно-химическими свойствами. Свойства КМЦ и пригодность ее для практического использования в основном определяются величинами степени замеш,ения и степени по.пиме-ризации. Ранее было показано [45, 90], что наилучшими стабилизирующими свойствами в отношении минерализованных промывочных кидкостеп обладают препараты КМЦ со степенью замещения (80—85. Однако исследованные препараты К МЦ не были охарактеризованы величинами степени полимеризации. К роме того, исследования стабилизирующих свойств препаратов КМЦ проводили в основном при комнатной температуре или при нагревании не выше 95 С. [c.114]
Под действием соляной кислоты получается эфир хлоруксусной кислоты органические кислоты, взаимодействуя с диазоуксусным эфиром, образуют ацильные производные эфира гликолевой кислоты [c.358]
Простые соединення этого рода довольно трудно доступны, но все же исследование их подтвердило гипотезу Вант-Гоффа. Так, Колеру с сотрудниками удалось получить в оптически деятельных формах эфир, образованный из а, -дифенил-т -нафтилалленкарбоновой и гликолевой кислот (I), а Миллсу н Мейтленду — дифенилди-а-нафтилаллен (И) [c.833]
Лактоны. — Карбоновые кислоты, содержащие спиртовую гидроксильную группу, относятся к нагреванию или к действию водоотнимающих средств по-разному, в зависимости от отюси-тельного расположения обеих функциональных групп. а-Оксикислота НО—СНг—СООН (гликолевая) содержит группы обоих требуемы> для этерификации типов и, следовательно, под влиянием кислых катализаторов этерификации или при нагревании здесь возможно образование либо внутренней эфирной связи, либо полиэфира. Действительно поликонденсацией гликолевую кислоту можно превратить в полиэфир — полигликолид (т. пл. 223 °С), а при взаимной этерификации двух молекул кислоты получается циклический эфир — гликолид (т. пл. 86 °С)г НО-СНа-СООН (СЛОа) [c.72]
С4Н803 Этиловый эфир гликолевой кислоты Нагревание [c.121]
КАРБОКСИЛАТНЫЕ кАучуки СМ. Поли-1,3-бутадиен КАРБОКСимЕтилЦЕЛЛЮЛОЗА, НАТРИЕВАЯ СОЛЬ — натриевая соль простого эфира гликолевой кислоты и целлюлозы f 6H70(0H)з-x(0 h3 00Na) ,l , где л = 0,4 1,2 СП = 200 1500 мягч 170 р. в., р-рах (30—40%) ац. + в. и диокс. + в. н. р. орг. р-лях при действии к-т на р-ры — осаждение карбоксиметил-целлюлозы, гидролиз. Прим. стабилизатор суспензий, флотореагент, компонент моющих средств, клеящее в-во для отделки тканей [c.206]
Карбоксилметилцеллюлоза (КМЦ) — простой эфир целлюлозы и гликолевой кислоты. Для технических целей обычно используют натриевую соль карбоксилметилцеллюлозы [c.227]
При реакции 2-феннл-4-бром-5-оксазолона с этиловым эфиром гликолевой кислоты -после обработки водой с целью замены брома на гидроксил) был получеи карбэтокскметиловый эфир га-оксигиппуровой кислоты. Этот активированный эфир реагирует с этиловым эфиром глицина и с этиловым эфиром фенилаланина с образованием пептидных производных [322]. [c.254]
chem21.info
Способ получения эфиров гликолевой кислоты
Изобретение относится к процессам переработки углеводородных газов с получением жидких химических продуктов, в частности к получению эфиров гликолевой кислоты. Способ получения метилового эфира гликолевой кислоты включает стадии карбонилирования формальдегида и этерификации гликолевой кислоты, где этан или этансодержащий углеводородный газ смешивают с кислородом или с кислородсодержащим газом в мольном соотношении этан : кислород, равном 40÷1:1, проводят окисление при температуре 350-550°C и давлении 20-40 бар, полученные продукты охлаждают и разделяют на поток (I), содержащий формальдегид и воду, и поток (II), содержащий СО, метиловый и этиловый спирты, непрореагировавшие этан и метан, поток (I) направляют на стадию карбонилирования формальдегида полученным в процессе СО, поток (II) направляют на стадию этерификации гликолевой кислоты входящими в состав потока метиловым и этиловым спиртами, после которой получают поток продуктов этерификации (III), из которого известными приемами выделяют метиловый эфир гликолевой кислоты, и поток (IV), содержащий СО, непрореагировавшие этан и метан, который направляют на стадию карбонилирования, непрореагировавшие этан и метан после стадии карбонилирования частично возвращают на парциальное окисление и/или используют в виде топливного газа. По сравнению с известными способами получения эфиров гликолевой кислоты достигается существенное упрощение технологии, исключается высоко энерго- и капиталоемкая стадия получения синтез-газа. 4 пр., 1 ил.
Изобретение относится к процессам переработки углеводородных газов с получением жидких химических продуктов с высокой добавленной стоимостью (процессам «газ-в-жидкость»), в частности получению эфиров гликолевой кислоты, используемых в химической промышленности в качестве полупродукта для синтезов ряда продуктов. Особенно перспективным процессом, в котором используются эфиры гликолевой кислоты, является альтернативный способ получения одного из важнейших нефтехимических продуктов - этиленгликоля. В настоящее время промышленный метод получения этиленгликоля базируется на использовании нефтяного сырья, дистилляцией которого получают нафту, перерабатываемую далее в этилен, из которого получают окись этилена, при последующей гидратации последней получают этиленгликоль-сырец, который очищают ректификацией.
Хотя нефть до сих пор является основным сырьевым источником для получения этиленгликоля, но из-за ограничения и трудностей освоения новых ресурсов нефти, по прогнозам, нефтяная отрасль в течение ближайших лет войдет в режим, когда добыча вступит в противоречие с растущим спросом на нефть. Следствием этого является существенный рост цен на этот продукт. Поэтому производство традиционных продуктов нефтехимической промышленности рассматривает другие источники углеводородов, прежде всего, природные углеводородные газы. В работе [S.A.I. Barri, D. Chadwick // Catalysis Letters, V. 141, Iss. 6, pp 749-753] описан альтернативный путь получения этиленгликоля - через синтез-газ, получаемый переработкой метана, источником которого может быть природный газ или биомасса, по схеме:
метан → синтез-газ → метанол → формальдегид → гликолевая кислота → метиловый эфир гликолевой кислоты → этиленгликоль.
Таким образом, должны быть осуществлены химические превращения, при которых из метана последовательно в несколько стадий получают сначала СО, затем метанол, из которого далее получают формальдегид и только после этого синтезируют сначала гликолевую кислоту, а затем целевой продукт - эфир гликолевой кислоты:
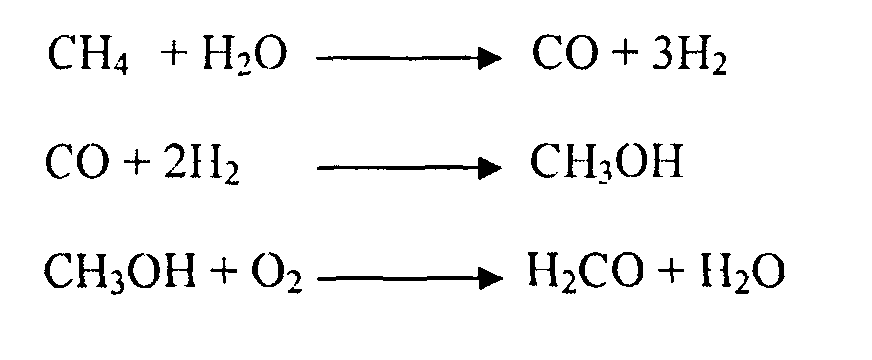

Гидрированием последнего может быть получен этиленгликоль.
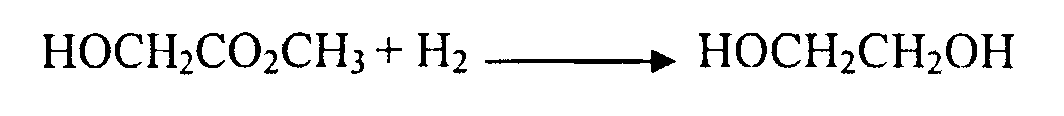
Следовательно, перед проведением известных стадий получения метилового эфира гликолевой кислоты - карбонилирования формальдегида с получением гликолевой кислоты и ее этерификации метанолом, должны быть осуществлены стадии получения синтез-газа, синтез метанола и синтез формальдегида. Получение каждого из этих продуктов широко и давно используется в промышленности, процессы их получения защищены многочисленными патентами в различных странах и подробно описаны в литературе, например (Н.Н. Лебедев. Основной органический синтез. Химическая энциклопедия). Реализуемое на последующих стадиях карбонилирование формальдегида в присутствии гомогенных или гетерогенных кислот и цеолитов с получением гликолевой кислоты и ее этерификация метанолом описаны патентах (U.S. Pat. No. 2,152,852 (1939), U.S. Pat. No. 2,285,448 (1942), U.S. Pat. No. 3,911,003 (1975), US Patent Application 20010039364). Недостатками описанного комплексного метода получения метилового эфира гликолевой кислоты исходя из метана и получаемого из него синтез-газа является многостадийность, сложная технология и наличие высоко энерго- и капиталоемкой стадии получения синтез-газа.
Формальдегид и метанол могут быть получены без стадии получения синтез-газа прямым окислением этансодержащего газа, например, как это описано в патенте РФ 2283829. При этом в качестве побочного продукта получают СО. Чтобы ограничить его получение и увеличить выход целевого продукта - формальдегида - в патенте РФ 2283829 жестко ограничивают условия проведения процесса - температура не выше 450°С, содержание кислорода 2-10%. Недостатком способа, описанного в патенте РФ №2283829, является низкая степень химической переработки углерода углеводородного газа в целевой продукт - формальдегид (согласно примерам патента: 11-15 кг/ на 1000 м3 углеводородного газа или 0,4-0,5 кмоль на 45 кмоль этана, то есть всего лишь ~ 1 атом углерода исходного углеводородного газа из 200 полезно перерабатывается химически в целевой продукт), и отсутствие решения полезного химического использования газовой смеси после реакции, кроме сжигания этой смеси в виде топливного газа.
Задачей изобретения является обеспечение улучшенного экономичного способа производства эфиров гликолевой кислоты и этиленгликоля на их основе.
Технический результат заявляемого изобретения заключается в упрощении технологии получения эфиров гликолевой кислоты, уменьшении капитальных затрат за счет снижения числа создаваемых производств получения исходных продуктов и устранении высоко энерго- и капиталоемкой стадии получения синтез-газа.
Технический результат достигается тем, что все четыре главных химических соединения, участвующих в синтезе эфиров гликолевой кислоты, - формальдегид, метанол, этанол и СО - получают в одну стадию, проводя окисление этана или этансодержащего углеводородного газа в условиях, когда с высоким выходом одновременно образуются все три указанных соединения. Это достигается тем, что этан или этансодержащий углеводородный газ смешивают с кислородом или с кислородсодержащим газом в мольном соотношении этан:кислород, равном 40÷1:1, проводят окисление этана при температуре 350-550°С и давлении 20-40 бар, полученные продукты охлаждают и разделяют на поток (I), содержащий формальдегид и воду, и поток (II), содержащий СО, метиловый и этиловый спирты, непрореагировавшие этан и метан, поток (I) направляют на стадию карбонилирования, поток (II) направляют на стадию этерификации гликолевой кислоты, после которой получают поток продуктов этерификации (III), из которого известными приемами выделяют эфиры гликолевой кислоты, и поток (IV), содержащий СО, непрореагировавшие этан и метан, который направляют на стадию карбонилирования; непрореагировавшие этан и метан после стадии карбонилирования частично возвращают на парциальное окисление и/или используют в виде топливного газа. На фиг.1 представлены стадии процесса и схема получаемых на них потоков.
Основными химическими стадиями процесса согласно изобретению являются парциальное окисление этана или этансодержащего углеводородного газа кислородом или кислородсодержащим газом, карбонилирование получаемого на первой стадии формальдегида с помощью СО, также получаемого на первой стадии, и этерификация получаемой на второй стадии гликолевой кислоты получаемым на первой стадии метанолом и/или этанолом. Процесс включает также вспомогательные операции - сепарацию потока реакционной смеси первой стадии на жидкий поток (поток I) раствора формальдегида в воде и газовый поток (поток II), содержащий метанол, СО, этанол, непрореагировавший этан и примеси других газов; другая вспомогательная операция - выделение и очистка целевого продукта - эфира гликолевой кислоты. В соответствии с изобретением на первой стадии процесса этан или этансодержащий углеводородный газ смешивают с кислородом или с кислородсодержащим газом в мольном соотношении этан:кислород, равном 40÷1:1, проводят одноступенчатое или многоступенчатое окисление этана при температуре 350-550°С и давлении 20-40 бар, полученную реакционную смесь охлаждают и разделяют на поток (I), содержащий формальдегид и воду, и поток (II), содержащий СО, метиловый и этиловый спирты, непрореагировавшие этан и метан. Поток (I) направляют на стадию карбонилирования, поток (II) направляют на стадию этерификации гликолевой кислоты. Карбонилирование формальдегида с получением гликолевой кислоты проводят на второй стадии в присутствии гомогенных или гетерогенных кислот и цеолитов в условиях, описанных в патентах (U.S. Pat. No. 2,152,852 (1939), U.S. Pat. No. 2,285,448 (1942), U.S. Pat. No. 3,911,003 (1975), US Patent Application 20010039364), с помощью СО, поступающего со стадии этерификации в виде потока IV. Полученную на второй стадии гликолевую кислоту в виде потока V направляют на третью стадию - стадию этерификации гликолевой кислоты метанолом, поступающим на стадию этерификации в составе потока II, проводят этерификацию известными приемами, после которой получают поток продуктов этерификации (III), и поток (IV), содержащий СО, непрореагировавший этан и примеси других газов (метан, водород, СО2). Поток (IV) компримируют и направляют на стадию карбонилирования, непрореагировавший этан с примесью других газов после стадии карбонилирования в виде потока (VI) частично возвращают на парциальное окисление и/или на сдувку, которая может быть использована в виде топливного газа. Из потока продуктов этерификации (III) известными приемами выделяют эфиры гликолевой кислоты, например, последовательно проводя отгонку воды гетероазеотропной осушкой, выделение кислотных катализаторов, спиртов и дистилляцию. Кроме того, наряду с метиловым эфиром гликолевой кислоты дополнительно получают этиловый эфир гликолевой кислоты.
Таким образом, в соответствии с изобретением в одну стадию сразу же получают все три необходимые для получения эфиров гликолевой кислоты соединения - формальдегид, метиловый спирт, этиловый спирт и СО, так что получение этиленгликоля может быть осуществлено по следующей упрощенной схеме:
этан → формальдегид, метанол, СО → гликолевая кислота → эфиры гликолевой кислоты → этиленгликоль
По сравнению с известными способами получения метилового эфира гликолевой кислоты достигается существенное упрощение технологии, устраняется высоко энерго- и капиталоемкая стадия получения синтез-газа.
Примеры осуществления предложенного способа
Пример 1. Этансодержащий газ с содержанием этапа 94,2% (объемн.) при давлении 25 бар в количестве 0,4 нм3 в час нагревают до температуры 350°С и при температуре от 350 до 500°С подвергают трехступенчатому окислению кислородом, который подают в количестве по 10 л/час на каждую ступень окисления (суммарно 30 л/час). В результате парциального окисления получают газовую смесь в количестве 0,44 нм3/час, содержащую 11,3 г формальдегида, 18,9 г метанола, 15,0 г СО, 15,2 г Н2О, 4,9 г этанола. Конверсия этана составляет около 6%, конверсия кислорода ~ 100%. Смесь охлаждают до температуры 150°С и сепарируют, получая поток I формальдегида и воды в количестве 25,7 г/ч и газовый поток в количестве 0,42 нм3/час. Поток I направляют на стадию карбонилирования, где при 100% конверсии формальдегида и селективности около 90% получают 26,1 г/ч гликолевой кислоты. Раствор гликолевой кислоты направляют на стадию этерификации метанолом и этанолом, полученными на первой стадии процесса, в результате чего получают 24,5 г/ч метилового эфира гликолевой кислоты и 6,4 г/ч этилового эфира гликолевой кислоты.
Пример 2. Этансодержащий газ с содержанием этана 83,7% (объемн.) при давлении 30 бар в количестве 0,45 нм3 в час нагревают до температуры 400°С и при температуре от 400 до 500°С подвергают трехступенчатому окислению кислородом, который подают на стадию окисления суммарно в количестве 58 л/час. В результате парциального окисления получают газовую смесь в количестве 0,56 нм3/час, содержащую 15 г формальдегида, 32,6 г метанола, 48 г СО, 26,6 г Н2О, 7,2 г этанола. Конверсия этана составляет ~ 11%, конверсия кислорода ~ 100%. Смесь охлаждают до температуры 160°С и сепарируют, получая поток I формальдегида и воды в количестве 40,5 г/ч и газовый поток в количестве 0,52 нм3/час. Поток I направляют на стадию карбонилирования, где при 100% конверсии формальдегида и селективности около 90% получают 34,7 г/ч гликолевой кислоты. Раствор гликолевой кислоты направляют на стадию этерификации метанолом и этанолом, полученными на первой стадии процесса, в результате чего получают 28,2 г/ч метилового эфира гликолевой кислоты и 8 г/ч этилового эфира гликолевой кислоты.
Пример 3. Этансодержащий газ с содержанием этана 11,2% (объемн.) при давлении 40 бар в количестве 0,51 нм3 в час нагревают до температуры 450°С и при температуре от 450 до 500°С подвергают одноступенчатому окислению кислородом воздуха, который подают на стадию окисления в количестве 0,21 нм3/час. В результате парциального окисления получают газовую смесь в количестве 0,77 нм3/час, содержащую 11,0 г формальдегида, 27,7 г метанола, 19,9 г СО, 42 г Н2О, 1,1 г этанола. Конверсия этана составляет около 67%, конверсия кислорода ~ 100%. Смесь охлаждают до температуры 150°С и сепарируют, получая поток I формальдегида и воды в количестве 51,7 г/ч и газовый поток в количестве 0,71 нм3/час. Поток I направляют на стадию карбонилирования, где при 100% конверсии формальдегида и селективности около 90% получают 25,3 г/ч гликолевой кислоты. Раствор гликолевой кислоты направляют на стадию этерификации метанолом и этанолом, полученными на первой стадии процесса, в результате чего получают 22,5 г/ч метилового эфира гликолевой кислоты и 1,0 г/ч этилового эфира гликолевой кислоты.
Пример 4. Этансодержащий газ с содержанием этана 94,2% (объемн.) при давлении 40 бар в количестве 0,05 нм3 в час и рециркулирующий газ (часть потока VI) в количестве 494 л, содержащий 34% этана, 41,5% СО и 24,5% примесей, нагревают до температуры 450°С и при температуре от 450 до 550°С подвергают двухступенчатому окислению техническим кислородом (95%), который подают в количестве по 29 л/час на каждую ступень окисления (суммарно 58 л/час). После парциального окисления получают газовую смесь в количестве 0,56 нм3 /час, содержащую 9,0 г формальдегида, 25,6 г метанола, 298 г СО, 36 г h3O, 2,3 г этанола. Смесь охлаждают до температуры 150°С и сепарируют, получая поток I формальдегида и воды в количестве 42 г/ч и газовый поток в количестве 0,51 нм3/час. Поток I направляют на стадию карбонилирования, где при 100% конверсии формальдегида и селективности около 90% получают 20,5 г/ч гликолевой кислоты. Раствор гликолевой кислоты направляют на стадию этерификации метанолом и этанолом, полученными на первой стадии процесса, в результате чего получают 17,5 г/ч метилового эфира гликолевой кислоты и 2,2 г/ч этилового эфира гликолевой кислоты.
Способ получения метилового эфира гликолевой кислоты, включающий стадии карбонилирования формальдегида и этерификации гликолевой кислоты, отличающийся тем, что этан или этансодержащий углеводородный газ смешивают с кислородом или с кислородсодержащим газом в мольном соотношении этан : кислород, равном 40÷1:1, проводят окисление при температуре 350-550°C и давлении 20-40 бар, полученные продукты охлаждают и разделяют на поток (I), содержащий формальдегид и воду, и поток (II), содержащий СО, метиловый и этиловый спирты, непрореагировавшие этан и метан, поток (I) направляют на стадию карбонилирования формальдегида полученным в процессе СО, поток (II) направляют на стадию этерификации гликолевой кислоты входящими в состав потока метиловым и этиловым спиртами, после которой получают поток продуктов этерификации (III), из которого известными приемами выделяют метиловый эфир гликолевой кислоты, и поток (IV), содержащий СО, непрореагировавшие этан и метан, который направляют на стадию карбонилирования, непрореагировавшие этан и метан после стадии карбонилирования частично возвращают на парциальное окисление и/или используют в виде топливного газа.
www.findpatent.ru
Эфир - гликоль - Большая Энциклопедия Нефти и Газа, статья, страница 2
Эфир - гликоль
Cтраница 2
Химическую активность эфиров гликолей целесообразно рассмотреть в зависимости от тех же факторов, которые определяют ях физические свойства: степени замещения исходного гликоля, строения и числа оксиалкиленовых групп, природы эфирной связи ( простая или сложная), а также от свойств заместителей. [16]
Гидроксильные группы эфиров гликолей устойчивы к замещению на хлор большинством хлорирующих агентов. [17]
Для получения эфиров гликолей используют главным образом окиси олефинов, непосредственно олефины, а-гликоли и их галогенпроиз-водные. [18]
Промышленный синтез эфиров гликолей, освоенный в США с 30 - х годов, к 1972 г. достиг 270 тыс. т зфиров этиленгликолей, в том числе 208 тыс. т эфиров моноэтиленгликоля ( целлозольва) и 36 тыс. т эфиров диэтиленгликоля. [20]
Что касается азотного эфира гликоля, полученного приведенной выше реакцией, то наши опыты показали, что этот эфир в зависимости от условий ведет себя различно. При нагревании в кислой среде он частично переходит в нафталин, воду и азотную кислоту, при простом гидролизе - в гликоль, ранее полученный Бамбергером и Леру. [21]
В общем же эфиры гликолей менее эффективны, чем эфи-ры двухосновных кислот. [22]
Специфические реакции на эфиры гликолей, по-видимому, отсутствуют. Простейшей качественной пробой на эфир гликоля, а именно на ОН-группу, является реакция с металлическим натрием. Определению мешают вода, спирты и сложные эфиры оксикислот. В случае сложной смеси рекомендуется вначале провести разделение на индивидуальные компоненты, например, ректификацией. [23]
Синтезированы и описаны смешанные аллилметакриловые, аллилкарбаллиловые, карбаллилметакриловые и бис-карбаллшювые эфиры гликолей. [24]
Показана эффективность использования эфиров гликолей в качестве добавок к ДЭГ для разделения углеводородных смесей. [25]
Приведенные общие формулы эфиров гликолей объединяют практически неограниченное число соединений, которые могут иметь самые разнообразные физико-химические свойства. [26]
К этой группе эфиров гликолей относится большое число соединений, занимающих промежуточное положение между растворителями и истинными неионогенными поверхностно-активными веществами. Как правило, это - жидкие или пастообразные вещества с высокой, температурой кипения. По классификации Ребиндера [23], они относятся ко 2-ой группе поверхностно-активных веществ и прежде всего являются диспергаторами. [27]
Его получают из политетраметиленового эфира гликоля и толуолдиизоцианата. В отсутствие влаги этот продукт стабилен. Он имеет светло-желтую окраску и консистенцию меда. Взаимодействием концевых изоцианатных групп практически с любыми соединениями, содержащими два или больше активных водородных атома, его можно превратить в твердый эластомер. Как показал опыт, оптимальное сочетание свойств достигается при применении ароматических диаминов в качестве структурирующего агента. В литературе рассматриваются [111] свойства эластомеров типа адипрен в качестве конструкционного материала. [28]
К-кетоны, Г - эфиры гликоля, С-спирты ( н - низшие, в - высшие), Т - толуол, X - ксилол, Б - углеводороды, содержащиеся в бензине; - ( - - - - растворяются, х - ограниченно растворяются, - не растворяются. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Гликолевая кислота метиловый эфир - Справочник химика 21
Гликолевая кислота легко этерифицируется метиловым спиртом в метиловый эфир гликолевой кислоты. Парофазное гидрирование этого эфира большим избытком водорода при 200—225° и давлении 20—40 ата в присутствии хромита меди приводит к получению этиленгликоля с высоким выходом [7] выделяющийся при гидрировании метиловый спирт возвращают в процесс [c.297]Получение этиленгликоля из формальдегида организовано в США фирмой Е. I. du Pont de Nemours and o. По этому способу смесь паров формальдегида и воды (объемное соотношение 1 1) абсорбируется водным раствором гликолевой кислоты (мольное соотношение 1 2) с примесью каталитических количеств серной кислоты и затем пропускается через реактор вместе с избытком окиси углерода при 200 "С и 70 МПа (время контакта 5 мин). В результате образуется гликолевая кислота (выход 90—95%), выделяемая перегонкой прн пониженном давлении. После этерификации гликолевой кислоты метиловым спиртом и очистки зфира перегонкой, проводится гидрирование метилового эфира гликолевой кислоты при 200 °С и 3 МПа в присутствии катализатора медь—хромат бария. На стадии восстановления получают этиленгликоль с выходом 90%. Данный метод не получил широкого распространения вследствие многостаднйности и высокой коррозионности среды, но может быть перспективным при снижении стоимости и расщирении производства синтез-газа. [c.274]
Метиловый эфир гликолевой кислоты (простой). . . . Метиловый эфир уксусной [c.119]Другой промышленный способ получения этиленгликоля заключается в действии окиси углерода на формальдегид. В результате конденсации образуется гликолевая кислота, метиловый эфир которой восстанавливают в паровой фазе в этиленгликоль (гл. 16, стр. 296). В 1954 г. в США 83% этиленгликоля было получено из окиси этилена, а 17% — из формальдегида и СО [1]. Последний способ нельзя использовать для производства окиси этилена хотя теоретически этиленгликоль и может превратиться при повышенной температуре и низком давлении в окись этилена, на практике основными продуктами реакции, проведенной при этих условиях, являются ацетальдегид или диоксан, более устойчивые, чем окись этилена. [c.354]
Решение. При взаимодействии гликолевой кислоты с метиловым спиртом и уксусной кислотой образуются следующие простые и сложные эфиры [c.76]
Метиловый эфир гликолевой кислоты, метиловый эфир оксиуксусной кислоты. [c.65]
Превращение гликолевой кислоты в метиловый эфир [c.702]
При помощи каких реакций можно различить следующие два изомерных соединения метиловый эфир гликолевой кислоты н метоксиуксусную кислоту [c.57]
ТВИН-20 2 —твин-60 3 — твии-80 4 — ТВИН-40 5 — метиловый эфир полиэтилен-гликолевого эфира стеариновой кислоты с числом оксиэтилированных звеньев л=30 б — то же. что и 5, с /г=40 7 твин-61 в —ТВИН-85 3 твин-65 10 — то же, что и 5, с я=130 и 160. [c.34]
Реакцию окиси углерода с формальдегидом проводят при 150—200 " и 700 ат в присутствии серной кислоты или трехфтористого бора как катализатора [135]. Метиловый эфир гликолевой кислоты восстанавливают нри 200—225° над катализатором медь — хромит бария водородом под давлением 20-40 а/га [136]. [c.405]
Гликолевый альдегид В4.163 Г7,11.266.0 Метиловый эфир муравьиной кислоты С9,Й. [c.12]
Эфирные вытяжки сушат в течение 3—4 час. пад 15 г безводного сернокислого кальция (примечание 2) и фильтруют. К фильтрату прибавляют 10 мл абсолютного метилового спирта и эфир отгоняют на паровой бане (примечание 3). Остаток перегоняют в вакууме, пользуясь колбой с елочным дефлегматором. После отделения небольшого головного погона (2—3 мл) гладко перегоняется нитрил гликолевой кислоты при 86 — 88° (8 м.и) [102— 104° (16 мл1)]. Выход чистого вещества (примечание 4) составляет [c.354]
По интенсивности сладкого вкуса это соединение в 1000 раз превосходит сахарозу н в 2 раза сахарин. Исходными веществами прн синтезе служит метиловый эфир тио-гликолевой кислоты н акриловая кислота (схема 3.5) [c.76]
Алкиловые эфиры расщепляются оксикарбоновыми кислотами [79] или их эфирами[80—82] в присутствии ВРз, а также его комплексов с эфирами и водой с образованием алкоксикислот или их эфиров. Расщепление диметилового эфира гликолевой кислотой и ее метилового эфира можно представить схемой [c.300]
Последовательные стадии образования гликолевой кислоты (пли ее метилового эфира) из формальдегида и окиси угле- [c.24]
Гликолевая кислота синтезируется в промышленности в некоторой степени сходным методом формальдегид, вода и окись углерода конденсируются в присутствии серной и уксусной кислот в течение часа при 160— 170°. Если вместо воды используется метанол, то получается метиловый эфир гликолевой кислоты. [c.126]
Напишите уравнения реакций образования натриевой соли оксиуксусной, кальциевой соли яблочной, кислой и средней калиевой и кальциевой солей виннокаменной кислоты, полной натриевой соли лимонной кислоты (цитрата натрия) метилового и пропилового эфиров оксиуксусной (гликолевой) кислоты, этилового эфира молочной кислоты, лактида из двух молекул а) гликолевой и б) молочной кислот, 7"Лактона из у-оксимасляной кислоты. Напишите схемы реакций получения фенилгидра-зона пировиноградной кислоты и взаимодействия а-кето-масляной кислоты с бисульфитом натрия. [c.59]
Из водяного газа получают синтетичес]окисп углерода при высокой температуре под давлением получают гликолевую кпслоту, которую этери-фицируют метиловым спиртом. Метиловый эфир гликолевой кислоты переводят каталитическим гидрированием в гликоль и метанол. Выпускаемый на рынок этой фирмой антифриз иод названием зерекс и является этиленгли-колем, который производят именно этим способом [134]. [c.405]
Действительно, метиловый эфир поли-сг-бромакриловой кислоты при взаимодействии с К1 выделяет свободный ион, а образующаяся при щелочном омылении поли-а-бромметакрилата натриевая соль поли-а-оксиакриловой кислоты окисляется йодной кислотой. Эти факты ука зывают на наличие 1,2-гликолевых группировок. [c.316]
Задача 28.2. Этиленгликоль получают в промышленности не только из этилена, но также из метилового эфира гликолевой кислоты (СН2ОНСООСН3). Как это можно осуществить [c.834]
Из реактора гидрирования смесь гликоля с метанолом и остатки неиро-реагировавшего метилового эфира гликолевой кислоты поступают ва ректификацию. Расход основных видов сырья на 1 т этиленгликоля составляет (в т) [c.68]
Согласно патентным данным при октелении 1, 1-дихлор-этилена при 40° С в присутствии воды образуется гликолевая кислота замена воды метанолом ведет к получению соответствующего метилового эфира. [c.499]
Приведенный метод применим для определения всех типов тиолов. Нельзя определить только тиогликолевую кислоту и ди-тиоэтиленгликоль, однако метиловый и бутиловый эфиры тио-гликолевой кислоты поддаются определению. [c.547]
Метиловый эфир гликолевой кислоты СзНвОз. См. Метилгликолят [c.816]
Получаемый метиловый эфир метоксиуксусной кислоты может быть прогидрирован в этиленгликоль также, как и образующийся в процессе Ои Роп1 метиловый эфир гликолевой кислоты. При давлении оксида углерода 8,0 МПа и температуре 150—200°С селективность образования метилового эфира метоксиуксусной кислоты составляла 75—90% при конверсии метилаля 10% [202, с. 36 248, с. 40 249]. В ряду исследованных твердых кислотных катализаторов селективность образования метилового эфира метоксиуксусной кислоты (значение селективности в %) указана в скобках) возрастала в ряду НУ-98 (5) = СоЫ НУ (5)[c.309]
Этерификация муравьиной кислоты Этерификация алифатических кислот (щавелевой, янтарной) в метиловые эфиры этерификация алифатических кислот дает лучшие выходы, чем этерификация ароматических кислот (бензойная кислота с сусной кислотой получены этиловый, изопропиловый и гликолевый эфиры из двуосновных кислот получаются главным образом диметиловые эфиры оба, монометиловый и диметиловый эфиры, получаются при адипиновой кислоте органические кислоты (0,5—I моль) нагреваются до кипения (с обратным холодильником) в колбе на 500 м.1 с безводным спиртом, взятым в избытке (3—6 мол.) в продолжение 2—4 часов, избыток кислоты удаляют промыванием раствором бикарбоната натрия и полученный эфир экстрагируют серным эфиром, продукты реакции фракционируют Получение метилацетата этерификацией (реакция применима также для приготовления пропионовой кислоты из окиси углерода и пропилового спирта) [c.210]
Метиловые эфиры органических кислот могут быть получены также путем пиролиза их тетраметиламмониевых солей, который проводится в нагретой камере устройства для ввода пробы [29]. Тетраметиламмониевые соли кислот рекомендуется получать или титрованием раствора кислот в метаноле раствором К(СНз)40Н или методом ионного обмена [30]. Пиролиз тетраметиламмониевых солей анализируемых кислот проводится в испарителе при 330—365° С. Выход эфиров уксусной, масляной, валериановой, каприловой, лауриновой, миркетиновой, пальмитиновой, бензойной, коричной, левулиновой, гликолевой и молочной кислот составляет 86—99%. Эфиры двухоснов-. ных кислот (щавелевой, молочной, яблочной и лимонной) в этих условиях не образуются. Показано, что выход эфиров при пиролизе тетраметиламмониевых солей понижается при величинах пробы, меньших 0,05 мг. Метод может быть рекомендован для качественного и полуколичествен-ного анализов (когда не требуется достижения высокой точности). [c.64]
Например, 100 ч. омыленного сополимера винилхлорида и малеинового ангидрида смешивают с 30 ч. глицерина. При 120° и высоком давлении формуют эластичные плиты. Беря сополимер метилового эфира малеиновой кислоты и ви-ннлацетата, его омыляют и из 100 ч. омыленного продукта с 30 ч. гликолевой кислоты, 80 ч. воды и 50 ч. сажи получают пасту, которую при 80° можно прес-совать в трубки, обладающие высокой механической прочностью и стойкие к действию воды и органических растворителей [c.534]
Из метилового спирта и неорганических реагентов синтезируйте а) диметиловый эфир тиодиуксусной кислоты б) тио-гликолевую кислоту. [c.70]
chem21.info
Гликолевой эфир - Большая Энциклопедия Нефти и Газа, статья, страница 3
Гликолевой эфир
Cтраница 3
При окислении более простых непредельных соединений, не содержащих арильных групп, образование эпоксидных производных и гликолевых эфиров становится преобладающим. Замена бензальдегида алифатическими альдегидами ( ацетальдегидом или пропионовым альдегидом) приводит к снижению выхода эпоксидного соединения. [31]
Из рассмотренных смесей наиболее высокими значениями индекса вязкости и смазочной способности характеризуются двух-компонентные композиции гликолевых эфиров фракции С5 - С, СЖК и депарафинизированного остаточного компонента, содержащие 1 5 % каптакса. [33]
Из рассмотренных смесей наиболее высокими значениями индекса вязкости и смазочной способности характеризуются двух-компонентные композиции гликолевых эфиров фракции С5 - Q СЖК и депарафинизированного остаточного компонента, содержащие 1 5 % каптакса. [35]
Растворимость в воде 0; растворяется в спиртах, сложных эфирах, кетонах, гликолевых эфирах, ацетатах гликолевых эфиров, хлорированных углеводородах и углеводородах бензольного ряда; морозо -, тепло - и светостоек; совмещается с нитро -, этил - и бензнлцел-люлозой, полиакрилатами, хлоркаучуком, поливинилацетатом, полистиролом и по-ливинилхлоридом; не совмещается с аце-тилцеллюлозой. [36]
Растворимость в воде 0; растворяется в спиртах, сложных 1фирах, кетонах, гликолевых эфирах, эце-гатах простых моноэфиров гликоля, алифатических, ароматических и хлорированных углеводородах. [37]
Растворимость в воде 0; растворяется в спиртах, сложных эфирах, кетонах, гликолевых эфирах, ацетатах гликолевых эфиров, алифатических, ароматических и хлорированных углеводородах. Применение, композиции из поливинилхлорида для пленок, шлангов, профилированных изделий и искусственной кожи. [38]
Растворимость в воде 0; растворяется в спиртах, сложных эфирах, кетопах, гликолевых эфирах, ацетатах гликоловых эфиров, хлорированных углеводородах и углеводородах бензольного ряда; морозо -, тепло - и светостоек; совмещается с нитро -, этил - и бензплцел-люлозой, полиакрилатами, хлоркаучуком, полившшлацстатом, полистиролом и по-лишгаилхлоридом; но совмещается с аце-тилцеллюлозой. [39]
Растворимость в воде 0; растворяется в спиртах, сложных эфнрах, кетонах, гликолевых эфирах, аце-гатах простых моноэфиров гликоля, алифатических, ароматических и хлорированных углеводородах. [40]
Радикал R в этом соединении может быть остатком низших алифатических спиртов и циклических, или простых гликолевых эфиров. Несмотря на наличие большого числа атомов кислорода в структуре этих карбонатов, они очень слабо растворяются в воде. Ацилирование лактатов хлорформиатом проводят в присутствии пиридина и серного эфира при температуре около - 18 С. Эти сложные эфиры представляют собой большей частью бесцветные вязкие жидкости. В ряду спиртов жирного ряда нормального строения или простых к-алкилгли-колевых эфиров вязкость уменьшается с увеличением длины цепи. С разветвлением спиртового остатка, с введением радикала циклической структуры или гетероатома вязкость всегда возрастает. Отношение вязкостен при 40 и 20 С возрастает для гомологического ряда с увеличением числа атомов углерода в спиртовых остатках. [41]
Для улучшения указанных свойств его модифицируют сополимеризацией метилметакрилата с полифункциональными соединениями, такими, например, как гликолевые эфиры метакриловои кислоты, аллил - и винилметакрилаты, аллилфталат, метакриловый ангидрид. [42]
Растворимость в иоде 0; растворяется в спиртах, сложных эфнрах, кетонах, глнколсвых офпрах, ацетатах гликолевых эфиров, алифатических, ароматических и хлорированных тлсводородах. Применение: композиции из нолившшдхлорида для пленок, шлангов, профилированных изделий п искусственной кожи. [43]
Растворимость в воде 0; растворяется в спиртах, сложных эфирах, кетонах, гликолевых эфирах, ацетатах гликолевых эфиров, хлорированных углеводородах и углеводородах бензольного ряда; морозо -, тепло - и светостоек; совмещается с нитро -, этил - и бензнлцел-люлозой, полиакрилатами, хлоркаучуком, поливинилацетатом, полистиролом и по-ливинилхлоридом; не совмещается с аце-тилцеллюлозой. [44]
Растворимость в воде 0; растворяется в спиртах, сложных эфирах, кетонах, гликолевых эфирах, ацетатах гликолевых эфиров, алифатических, ароматических и хлорированных углеводородах. Применение, композиции из поливинилхлорида для пленок, шлангов, профилированных изделий и искусственной кожи. [45]
Страницы: 1 2 3 4
www.ngpedia.ru















