2.2. Аммонолиз сложных эфиров. Аммонолиз сложных эфиров
2.2. Аммонолиз сложных эфиров
Действие аммиака, первичных или вторичных аминов на сложные эфиры карбоновых кислот приводит, обычно в довольно мягких условиях, к образованию амидов карбоновых кислот.
В реакции аммонолиза сложных эфиров наблюдаются следующие основные закономерности:
метиловые эфиры легче подвергаются аммонолизу, чем этиловые; эфиры первичных спиртов реагируют легче, чем эфиры вторичных спиртов;
первичные амины реагируют с большей скоростью, чем аммиак; вторичные амины в большинстве случаев реагируют значительно медленнее аммиака;
реакция катализируется небольшими количествами воды; более эффективными катализаторами являются алкоголяты щелочных металлов (особенно при ацилировании ароматических аминов).
Для получения незамещенных амидов часто бывает достаточно перемешивания сложных эфиров с концентрированным водным раствором аммиака:
Вместо водного раствора аммиака часто используют раствор аммиака в метаноле или этаноле:
Диэтиловые эфиры алкилмалоновых кислот легко реагируют с аммиаком в метаноле в присутствии каталитических количеств метилата натрия; в то же время диэтиловые эфиры диалкилмалоновых кислот в эту реакцию не вступают:
Взаимодействие эфиров с первичными и вторичными аминами, если оба компонента жидкие, можно проводить без растворителей:
Если термическая стабильность и летучесть компонентов позволяют проводить реакцию при повышенных температурах, то продолжительность реакции значительно сокращается:
Важное значение аммонолиз сложных эфиров имеет в синтезе -кетокислот, так как сами кислоты и их хлорангидриды неустойчивы. Например, при кипячении (145-1500С) этилового эфира бензоилуксусной кислоты с анилином в ксилоле с выходом 84 % получают бензоилацетанилид (N-фениламид бензоилуксусной кислоты):
Скорость реакции взаимодействия сложных эфиров с аминами во многих случаях повышается при применении в качестве ацилирующих агентов таких сложных эфиров, спиртовые остатки которых легко поддаются замещению. Такими наиболее легко уходящими группами в сложных эфирах являются цианометильная (NCCh3), п-нитрофенильная (4-O2NC6h5) и изопропенильная [СН2=С(СН3)-]. Например, изопропенилацетат бурно реагирует с аминами уже при комнатной температуре, при этом из реакционной смеси отгоняется образующийся ацетон:
Из многочисленных реакций сложных эфиров карбоновых кислот с амидами наибольшее значение имеют реакции циклизации, протекающие при взаимодействии диэфиров дикарбоновых кислот с мочевиной в присутствии эквивалентных количеств алкоголята щелочного металла:
Гораздо легче, чем амины, с эфирами карбоновых кислот реагирует гидразин (реакция гидразинолиза). Простейшие эфиры алифатических кислот чаще всего превращаются в гидразиды кислот (N-ацилгидразины) уже при комнатной температуре в результате экзотермической реакции, однако лучше проводить реакцию при непродолжительном нагревании на водяной бане:
Так же, как при аммонолизе, эфиры карбоновых кислот с разветвлением в -положении реагируют с гидразингидратом медленнее, чем неразветвленные сложные эфиры. Продолжительность реакций сокращается при использовании в качестве растворителей спиртов с более высокой температурой кипения (например, бутанола-l, т. кип. 1180С) или при взаимодействии с безводным гидразином.
studfiles.net
2.2. Аммонолиз сложных эфиров
Действие аммиака, первичных или вторичных аминов на сложные эфиры карбоновых кислот приводит, обычно в довольно мягких условиях, к образованию амидов карбоновых кислот.
В реакции аммонолиза сложных эфиров наблюдаются следующие основные закономерности:
метиловые эфиры легче подвергаются аммонолизу, чем этиловые; эфиры первичных спиртов реагируют легче, чем эфиры вторичных спиртов;
первичные амины реагируют с большей скоростью, чем аммиак; вторичные амины в большинстве случаев реагируют значительно медленнее аммиака;
реакция катализируется небольшими количествами воды; более эффективными катализаторами являются алкоголяты щелочных металлов (особенно при ацилировании ароматических аминов).
Для получения незамещенных амидов часто бывает достаточно перемешивания сложных эфиров с концентрированным водным раствором аммиака:
Вместо водного раствора аммиака часто используют раствор аммиака в метаноле или этаноле:
Диэтиловые эфиры алкилмалоновых кислот легко реагируют с аммиаком в метаноле в присутствии каталитических количеств метилата натрия; в то же время диэтиловые эфиры диалкилмалоновых кислот в эту реакцию не вступают:
Взаимодействие эфиров с первичными и вторичными аминами, если оба компонента жидкие, можно проводить без растворителей:
Если термическая стабильность и летучесть компонентов позволяют проводить реакцию при повышенных температурах, то продолжительность реакции значительно сокращается:
Важное значение аммонолиз сложных эфиров имеет в синтезе -кетокислот, так как сами кислоты и их хлорангидриды неустойчивы. Например, при кипячении (145-1500С) этилового эфира бензоилуксусной кислоты с анилином в ксилоле с выходом 84 % получают бензоилацетанилид (N-фениламид бензоилуксусной кислоты):
Скорость реакции взаимодействия сложных эфиров с аминами во многих случаях повышается при применении в качестве ацилирующих агентов таких сложных эфиров, спиртовые остатки которых легко поддаются замещению. Такими наиболее легко уходящими группами в сложных эфирах являются цианометильная (NCCh3), п-нитрофенильная (4-O2NC6h5) и изопропенильная [СН2=С(СН3)-]. Например, изопропенилацетат бурно реагирует с аминами уже при комнатной температуре, при этом из реакционной смеси отгоняется образующийся ацетон:
Из многочисленных реакций сложных эфиров карбоновых кислот с амидами наибольшее значение имеют реакции циклизации, протекающие при взаимодействии диэфиров дикарбоновых кислот с мочевиной в присутствии эквивалентных количеств алкоголята щелочного металла:
Гораздо легче, чем амины, с эфирами карбоновых кислот реагирует гидразин (реакция гидразинолиза). Простейшие эфиры алифатических кислот чаще всего превращаются в гидразиды кислот (N-ацилгидразины) уже при комнатной температуре в результате экзотермической реакции, однако лучше проводить реакцию при непродолжительном нагревании на водяной бане:
Так же, как при аммонолизе, эфиры карбоновых кислот с разветвлением в -положении реагируют с гидразингидратом медленнее, чем неразветвленные сложные эфиры. Продолжительность реакций сокращается при использовании в качестве растворителей спиртов с более высокой температурой кипения (например, бутанола-l, т. кип. 1180С) или при взаимодействии с безводным гидразином.
studfiles.net
2_Osnovy_Stroenia_I_Reaktsionnoy_Sposobnosti_Ug_1 - Стр 5
Симметричное строение аниона, равноценность атомов кислорода, одинаковые длины связей углерод—кислород подтверждаются данными рентгеноструктурного анализа.
Строение радикала влияет на кислотные свойства карбоновых кислот. В целом электроноакцепторные заместители усиливают кислотность, а электронодонорные — снижают. Длина и разветвленность насыщенного алкильного радикала не оказывают существенного влияния на кислотные свойства. Так, значения рКа насыщенных алифатических кислот С2—С9 изменяются в пределах 4,8—5,0.
Ненасыщенные и ароматические кислоты обладают несколько большей кислотностью, чем насыщенные алифатические кислоты. Ароматические кислоты с заместителем в орто-положении более сильные кислоты, чем мета- и пара-изомеры, независимо от типа заместителя. В ряде случаев, например, у салициловой кислоты, повышенная кислотность орто-изомеров объясняется стабилизацией аниона за счет образования внутримолекулярных водородных связей:
Влияние электроноакцепторных заместителей на кислотные свойства карбоновых кислот в алифатическом ряду подчиняется довольно четким закономерностям как по числу этих заместителей, так и по взаимному расположению электроноакцепторной и карбоксильной групп. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга.
Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
Реакции нуклеофильного замещения.
Одну из важнейших групп реакций, характерных для карбоновых кислот, составляют реакции нуклеофильного замещения у sp2-12C карбоксильной группы, в результате которых гидроксильная группа замещается на другой нуклеофил. За счет положительного мезомерного эффекта гидроксильной группы электрофильность атома углерода карбоксильной группы значительно ниже, чем у атома углерода карбонильной группы альдегидов и кетонов, поэтому реакции нуклеофильного замещения в карбоксильной группе проводятся в присутствии кислотного катализатора. Используются также иные приемы, суть которых сводится к превращению плохой уходящей группы НО- в хорошую. В результате этих реакций образуются функциональные производные карбоновых кислот — сложные эфиры, амиды, ангидриды, галогенангидриды и др.
Реакции замещения у sp2-гибридизованного атома углерода карбоксильной группы по своему результату относительно участвующего во взаимодействии нуклеофильного реагента могут рассматриваться как реакции ацилирования, поскольку они сопровождаются введением в молекулу нуклеофильного реагента ацильной группы R—СО—. Важнейшие ацильные группы — ацетил СН3СО—, формил НСО—, бензоил С6Н5СО—.
Образование сложных эфиров. При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а сама реакция называется реакцией этерификации:
В качестве катализаторов используют концентрированную серную кислоту, газообразный хлороводород, сульфоновые кислоты, катионообменные смолы в Н+-форме.
В случае сильных карбоновых кислот, таких, как щавелевая, муравьиная, трифтороуксусная, отпадает необходимость добавления минеральной кислоты, так как подобные карбоновые кислоты сами катализируют реакцию:
Реакция этерификации, как и многие другие реакции замещения у тригонального атома углерода, чаще всего протекает по тетраэдрическому механизму, обозначаемому ААС2 (кислотнокатализируемая ацильная бимолекулярная реакция). На стадии катализа протонируется карбонильный атом кислорода молекулы карбоновой кислоты; гидроксильная группа не присоединяет протон, потому что неподеленная пара электронов атома кислорода находится в сопряжении с карбонильной группой. Возникший карбокатион (I) обладает значительно более сильными электрофильными свойствами, чем исходная карбоновая кислота, и поэтому может присоединять даже слабый нуклеофил, каким является молекула спирта. В образовавшемся катионе (II) происходит перенос протона к одной из гидроксильных групп, и при этом формируется хорошая уходящая группа — молекула воды. После отщепления воды от катиона (III) и возврата катализатора образуется сложный эфир.
Все стадии реакции этерификации обратимы; обратная реакция представляет собой катализируемый кислотой гидролиз сложных эфиров. При получении сложных эфиров смещение равновесия вправо достигается разными способами: удалением воды азеотропной отгонкой или с помощью осушителей, либо с применением большого избытка спирта или кислоты, если тот или другой реактив достаточно доступен. Смещение равновесия достигается также путем отгонки образующегося сложного эфира.
Одним из доказательств приведенного выше механизма является то, что при гидролизе сложных эфиров водой, меченной по кислороду, изотопная метка целиком оказывается в образовавшейся кислоте:
Образование галогенангидридов. При взаимодействии карбоновых кислот с галогенидами фосфора(III) или фосфора(V), а также с фосфорилхлоридом РOС13, образуются галогенангидриды, иначе называемые ацилгалогенидами:
Для получения хлорангидридов, особенно высококипящих, часто используют также тионилхлорид SOC12:
Механизм реакции включает образование промежуточного смешанного ангидрида карбоновой и сернистой кислот (I), неорганическая часть которого является хорошей уходящей группой. Далее смешанный ангидрид подвергается нуклеофильной атаке хлорид-ионом и через тетраэдрический интермедиат (II) превращается в хлорангидрид.
Образование ангидридов. Под действием такого сильного водоотнимающего средства, как оксид фосфора(V), карбоновые кислоты превращаются в ангидриды:
Образование амидов. При нагревании аммониевых солей карбоновых кислот получаются амиды:
При взаимодействии карбоновых кислот с первичными или вторичными аминами образуются соответственно моно- и дизамещенные амиды:
Функциональные производные карбоновых кислот. Реакции нуклеофильного замещения у sp2–гибридного атома углерода (вопр. 43 и др.), механизм, роль кислотного и основного катализа. Ацилирующая способность функциональных производных карбоновых кислот. Химическая идентификация функциональных производных.
Функциональными производными называют производные карбоновых кислот, у которых ОН-группа замещена нуклеофильной частицей Z. Нуклеофильное замещение в карбоксильной группе приводит к образованию функциональных производных карбоновых кислот общей формулы R— C(О)Z. Химическая природа фрагмента Z варьирует в широком диапазоне, что обусловливает разнообразие функциональных производных.
Функциональные производные, подобно карбоновым кислотам, способны вступать в реакции ацилирования, и поэтому их можно рассматривать как ацильные производные различных нуклеофилов. Реакции ацилирования приводят к образованию других функциональных производных карбоновых кислот.
Реакции ацилирования с участием функциональных производных карбоновых кислот представляют собой реакции нуклеофильного замещения у sp2-гибридизованного атома углерода:
Реакционная способность функциональных производных в реакциях ацилирования (ацилирующая способность) зависит от природы частицы Z и коррелируется со стабильностью уходящего аниона Z-: (!) чем стабильнее анион, тем выше реакционная способность ацильного производного.
Наибольшей ацилирующей активностью обладают галогенангидриды и ангидриды, так как их ацильные остатки соединены с хорошими уходящими группами — галогенид-ионами и анионами карбоновых кислот. Сложные эфиры и амиды проявляют более низкую ацилирующую способность, потому что соответственно алкоксид- и амид-ионы не относятся к стабильным анионам и не являются хорошими уходящими группами. Такой подход к оценке ацилирующей способности показан ниже на примере сопоставления наиболее важных функциональных производных карбоновых кислот:
Место других ацильных производных в этом ряду можно прогнозировать, сравнивая относительную стабильность уходящих групп. При этом положение в ряду функциональных производных не следует рассматривать как раз и навсегда заданное. Например, известно, что сложные эфиры менее реакционноспособны, чем карбоновые кислоты, но имеются случаи, когда уходящая группа R'O- более стабильна, чем гидроксид-ион.
Так, сложные эфиры п-нитрофенола продуцируют хорошую уходящую группу — п-нитрофенолят-ион, а потому являются более сильными ацилирующими агентами, чем карбоновые кислоты (это обстоятельство используется в пептидном синтезе).
Реакции ацилирования протекают в основном по тетраэдрическому механизму, который включает две стадии. Первая, медленная стадия состоит в присоединении нуклеофила по двойной связи С=О и образовании тетраэдрического интермедиата. На стадии происходит отщепление уходящей группы.
Реакции ацилирования катализируются как кислотами, так и основаниями. Катализируемая кислотами бимолекулярная реакция ААС2 включает дополнительно стадию присоединения протона (катализатора) и стадию регенерации катализатора. По этому механизму протекают уже упоминавшиеся реакции этерификации и кислотного гидролиза сложных эфиров. Тетраэдрический механизм реализуется также в условиях основного катализа и сокращенно обозначается ВАС2, т. е. катализируемая основанием ацильная бимолекулярная реакция.
Галогенангидриды.
Галогенангидридами называются функциональные производные карбоновых кислот общей формулы RC(О)Hal. Термин «галогенангидрид» нельзя признать удачным, так как «ангидрид» означает удаление воды, чего не наблюдается при превращении карбоновой кислоты в галогенангидрид. Тем не менее именно этот термин используется в русской химической номенклатуре.
Галогенангидриды представляют собой жидкости или твердые вещества с резким навязчивым запахом, сильно раздражают кожу и слизистые оболочки. Практическое значение имеют ацилхлориды и ацилбромиды.
Реакции ацилирования. Галогенангидриды относятся к наиболее активным ацилирующим агентам, их используют для получения большинства других функциональных производных карбоновых кислот [(2)-(6)]. Ацилгалогениды очень легко гидролизуются в карбоновые кислоты [(1)], поэтому их хранят в условиях, исключающих доступ влаги воздуха. C помощью галогенангидридов удается проацилировать такие соединения, которые не вступают в реакцию с другими ацилирующими агентами, например, третичные спирты и фенолы.
Восстановление. Галогенангидриды восстанавливают комплексными гидридами металлов в первичные спирты:
Гидрирование галогенангидридов на палладиевом катализаторе приводит к альдегидам:
Ангидриды.
Ангидридами называются функциональные производные карбоновых кислот общей формулы RC(O)OC(O)R’.
Ангидриды можно рассматривать как продукты отщепления воды от карбоксильных групп двух молекул монокарбоновой кислоты или одной молекулы дикарбоновой кислоты. Существуют три основных типа ангидридов — симметричные, включающие остатки одинаковых карбоновых кислот, смешанные, содержащие остатки разных кислот, в том числе минеральных, и циклические ангидриды — производные дикарбоновых кислот:
Ангидриды представляют собой жидкости или твердые вещества, низшие ангидриды имеют раздражающий запах, похожий на запах соответствующей кислоты.
Реакции ацилирования. Высокая ацилирующая способность ангидридов используется для получения большинства функциональных производных карбоновых кислот, как показано на примере уксусного ангидрида:
Реакции ацилирования протекают в условиях как кислотного, так и основного катализа или без катализатора. В качестве кислотных катализаторов применяют серную и фосфорную кислоты, хлорид цинка, n-толуолсульфоновую кислоту и др. Ацетат натрия, алкоголяты и феноляты щелочных металлов применяют как основные катализаторы. Ангидриды, как и галогенангидриды, способны ацилировать такие малоактивные нуклеофилы, как третичные и другие пространственно затрудненные спирты, алкилфенолы, низкоосновные ароматические амины.
Из симметричных ангидридов наибольшее значение имеет уксусный ангидрид (ацетангидрид). Использование других симметричных ангидридов в реакциях ацилирования не оправдано из-за того, что при ацилировании ангидридами на один моль нуклеофила расходуется один моль ангидрида, т. е. идет двойной расход исходной карбоновой кислоты.
С помощью смешанных ангидридов в молекулу нуклеофила вводится остаток более слабой кислоты, потому что анион сильной кислоты является хорошей уходящей группой. Так, при ацилировании муравьиноуксусным или уксуснотрифтороуксусным ангидридом уходящими группами будут соответственно формиат- и трифтороацетат-ионы:
Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
Сложными эфирами называются функциональные производные карбоновых кислот обшей формулы RC(О)ОR'.
Сложные эфиры карбоновых кислот (а также сульфоновых кислот) называют аналогично солям, только вместо названия катиона употребляют название соответствующего алкила или арила, которое помещается перед названием аниона и пишется с ним слитно. Наличие сложноэфирной группы —COOR также можно отразить описательным способом, например, «R-овый эфир (такой-то) кислоты» (такой способ менее предпочтителен ввиду его громоздкости):
Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости, с приятным запахом, плохо растворимые в воде и хорошо — в большинстве органических растворителей. Запахи сложных эфиров напоминают запахи разных фруктов, благодаря чему в пищевой промышленности из них готовят эссенции, имитирующие фруктовые запахи. Повышенную летучесть сложных эфиров используют в аналитических целях.
Гидролиз. Важнейшей из реакций ацилирования является гидролиз сложных эфиров с образованием спирта и карбоновой кислоты:
Реакция осуществляется как в кислой, так и в щелочной среде. Кислотно-катализируемый гидролиз сложных эфиров — реакция, обратная этерификации, протекает по тому же самому механизму ААС2:
Нуклеофилом в этой реакции является вода. Смещение равновесия в сторону образования спирта и кислоты обеспечивается добавлением избытка воды.
Щелочной гидролиз необратим, в процессе реакции на моль эфира расходуется моль щелочи, т. е. щелочь в этой реакции выступает в качестве расходуемого реагента, а не катализатора:
Гидролиз сложных эфиров в щелочной среде протекает по бимолекулярному ацильному механизму ВАС2 через стадию образования тетраэдрического интермедиата (I). Необратимость щелочного гидролиза обеспечивается практически необратимым кислотно-основным взаимодействием карбоновой кислоты (II) и алкоксид-иона (III). Образовавшийся анион карбоновой кислоты (IV) сам является довольно сильным нуклеофилом и потому не подвергается нуклеофильной атаке.
Аммонолиз сложных эфиров. Амиды получают с помощью аммонолиза сложных эфиров. Например, при действии водного аммиака на диэтилфумарат образуется полный амид фумаровой кислоты:
При аммонолизе сложных эфиров аминами с низкой нуклеофильностью последние предварительно превращают в амиды щелочных или щелочно-земельных металлов:
Амиды карбоновых кислот: номенклатура; строение амидной группы; кислотно–основные свойства; кислотный и щелочной гидролиз; расщепление гипобромитами и азотистой кислотой; дегидратация в нитрилы; химическая идентификация.
Амидами называются функциональные производные карбоновых кислот обшей формулы R—С(О)—Nh3-nR'n, где п = 0-2. В незамещенных амидах ацильный остаток соединен с незамещенной аминогруппой, в N-замещенных амидах один из атомов водорода замещен одним алкильным или арильным радикалом, в N,N-замещенных — двумя.
Соединения, содержащие одну, две или три ацильные группы, присоединенные к атому азота, носят родовое название амиды (соответственно первичные, вторичные и третичные). Названия первичных амидов с незамещенной группой — Nh3 производят от названий соответствующих ацильных радикалов заменой суффикса -оил (или -ил) на -амид. Амиды, образованные от кислот с суффиксом -карбоновая кислота, получают суффикс -карбоксамид. Амиды сульфоновых кислот также называют по соответствующим кислотам, используя суффикс -сулъфонамид.
Названия радикалов RCO—NH— (как и RSО2—NH—) образуют от названий амидов, изменяя суффикс -амид на -амидо-. Они применяются в том случае, если в остальной части молекулы имеется более старшая группа или замещение происходит в более сложной структуре, чем радикал R:
В названиях N-замещенных первичных амидов RCO—NHR' и RCO—NR'R" (а также подобных сульфонамидов) названия радикалов R' и R" указывают перед названием амида с символом N-:
Амиды такого типа часто называют вторичными и третичными амидами, что ИЮПАК не рекомендуется.
N-Фенилзамещенные амиды получают в названиях суффикс -анилид. Положение заместителей в остатке анилина указывается цифрами со штрихами:
Сохранились, кроме того, полусистематические названия, в которых суффикс -амид соединен с основой латинского названия карбоновой кислоты (формамид, ацетамид), а также некоторые тривиальные названия, такие, как «анилиды» (ацилированные анилины) или «толуидиды» (ацилированные толуидины).
Амиды представляют собой кристаллические вещества с относительно высокими и четкими температурами плавления, что позволяет использовать некоторые из них в качестве производных для идентификации карбоновых кислот. В редких случаях являются жидкостями, например, амиды муравьиной кислоты — формамид и N,N-диметилформамид — известные диполярные апротонные растворители. Низшие амиды хорошо растворимы в воде.
Амиды являются одними из самых устойчивых к гидролизу функциональных производных карбоновых кислот, благодаря чему широко распространены в природе. Многие амиды применяются в качестве лекарственных средств. Уже около века используются в медицинской практике парацетамол и фенацетин, являющиеся замещенными амидами уксусной кислоты.
Строение амидов. Электронное строение амидной группы в значительной степени сходно со строением карбоксильной группы. Амидная группа является p,π-сопряженной системой, в которой неподеленная пара электронов атома азота сопряжена с электронами π-связи С=O. Делокализация электронной плотности в амидной группе может быть представлена двумя резонансными структурами:
За счет сопряжения связь С—N в амидах имеет частично двоесвязанный характер, длина ее существенно меньше длины одинарной связи в аминах, тогда как связь С=O несколько длиннее, чем связь С=O в альдегидах и кетонах. Амидная группа из-за сопряжения имеет плоскую конфигурацию. Ниже приведены геометрические параметры молекулы N-замещенного амида, установленные с помощью рентгеноструктурного анализа:
Важным следствием частично двоесвязанного характера связи С—N является довольно высокий энергетический барьер вращения вокруг этой связи, например, для диметилформамида он составляет 88 кДж/моль. По этой причине амиды, имеющие у атома азота разные заместители, могут существовать в виде π-диастереомеров. N-Замещенные амиды существуют преимущественно в виде Z-изомеров:
В случае N,N-дизамещенных амидов соотношение Е- и Z-изомеров зависит от объема радикалов, соединенных с атомом азота. Стереоизомеры амидов конфигурационно неустойчивы, их существование доказано в основном физико-химическими методами, в индивидуальном виде они выделялись лишь в отдельных случаях. Это связано с тем, что барьер вращения для амидов все-таки не такой высокий, как у алкенов, у которых он составляет 165 кДж/моль.
Кислотно-основные свойства. Амиды обладают слабыми как кислотными, так и основными свойствами. Основность амидов лежит в пределах значений РkBH+ от -0,3 до -3,5. Причиной пониженной основности аминогруппы в амидах является сопряжение неподеленной пары электронов атома азота с карбонильной группой. При взаимодействии с сильными кислотами амиды протонируются по атому кислорода как в разбавленных, так и в концентрированных растворах кислот. Такого рода взаимодействие лежит в основе кислотного катализа в реакциях гидролиза амидов:
Незамещенные и N-замещенные амиды проявляют слабые NH-кислотные свойства, сравнимые с кислотностью спиртов и отщепляют протон только в реакциях с сильными основаниями.
Кислотно-основное взаимодействие лежит в основе образования амидами межмолекулярных ассоциатов, существованием которых объясняются высокие температуры плавления и кипения амидов. Возможно существование двух типов ассоциатов: линейных полимеров и циклических димеров. Преобладание того или иного типа определяется строением амида. Например, N-метилацетамид, для которого предпочтительна Z-конфигурация, образует линейный ассоциат, а лактамы, имеющие жестко зафиксированную E-конфигурацию, образуют димеры:
N, N-Дизамещенные амиды образуют димеры за счет диполь-дипольного взаимодействия 2х полярных молекул:
Реакции ацилирования. Вследствие наличия в сопряженной системе амидов сильной электронодонорной аминогруппы электрофильность карбонильного атома углерода, а следовательно, и реакционная способность амидов в реакциях ацилирования очень низкая. Низкая ацилирующая способность амидов объясняется также и тем, что амид-ион Nh3- — плохая уходящая группа. Из реакций ацилирования значение имеет гидролиз амидов, который можно проводить в кислой и щелочной средах. Амиды гидролизуются намного труднее, чем другие функциональные производные карбоновых кислот. Гидролиз амидов проводится в более жестких условиях по сравнению с гидролизом сложных эфиров.
Кислотный гидролиз амидов — необратимая реакция, приводящая к образованию карбоновой кислоты и аммониевой соли:
В большинстве случаев кислотный гидролиз амидов протекает по механизму бимолекулярного кислотного ацилирования ААС2, т. е. похож на механизм кислотного гидролиза сложных эфиров. Необратимость реакции обусловлена тем, что аммиак или амин в кислой среде превращаются в ион аммония, не обладающий нуклеофильными свойствами:
Щелочной гидролиз тоже необратимая реакция; в результате ее образуются соль карбоновой кислоты и аммиак или амин:
Щелочной гидролиз амидов, как и гидролиз сложных эфиров, протекает по тетраэдрическому механизму ВАС2. Реакция начинается с присоединения гидроксид-иона (нуклеофила) к электрофильному атому углерода амидной группы. Образовавшийся анион (I) протонируется по атому азота, и далее в биполярном ионе (II) формируется хорошая уходящая группа — молекула аммиака или амина. Полагают, что медленная стадия - распад тетраэдрического интермедиата (II).
studfiles.net
Аммонолиз сложных эфиров - Справочник химика 21
Аммонолиз сложных эфиров. При действии аммиака, часто даже на холоду, сложные эфиры подвергаются расщеплению с образованием амидов кислот [c.255]Хлорангидриды кислот не являются единственными производными кислот, способными к реакции с аммиаком (и аминами). Как сложные эфиры, так и ангидриды кислот взаимодействуют с аммиаком и аминами с образованием амидов. Бурное протекание реакций ацилирования с использованием ацилгалогенидов (особенно ацетилхлорида) позволяет считать аммонолиз сложных эфиров удачным методом получения амидов. [c.125]
Лучшим конденсирующим агентом при автоконденсации сложных эфиров является гидрид натрия. Основная побочная реакция — взаимодействие сложных эфиров с основанием, например аммонолиз сложных эфиров при действии амида натрия. [c.213]Аммонолиз сложных эфиров аммиаком, первичными и вторичными аминами (замещение группы ОН на ЫНг, ЫНК и ЫКа) обычно катализируется кислотами и его механизм принципиально ничем не отличается от описанного ранее механизма кислотного гидролиза [c.111]
Опыт № 125. Получение полного амида щавелевой кислоты аммонолизом сложного эфира [c.108]
Аммонолиз является удобным методом деацетилирования (см. 8.25). Обычно аммонолиз сложных эфиров проводят при комнатной температуре действием водного или спиртового раствора аммиака. Иногда, чтобы избежать взаимодействия аммиака с другими имеющимися в [c.443]
Совершенно ясно, что все эти случаи катализированного аммонолиза сложных эфиров Л5 чше рассматривать как примеры катализа под действием электролитов [c.37]
По мнению авторов указанной работы, к реакциям, протекающим по диффузионно-контролируемому механизму, относятся также такие, как аммонолиз сложных эфиров, образование оксимов и осно-раиин Шифа и ряд других. [c.40]
Гидролиз простых эфиров енолов, ацеталей или ортоэфиров 10-11. Гидролиз сложных эфиров карбоновых кислот 10-13. Декарбонилирование карбоновых кислот 10-19. Переэтернфикация простых эфиров 10-25. Переэтернфикация 10-57. Аммонолиз сложных эфиров [c.442]
Щелочь, ПО-ВИДИМОМУ, оказывает каталитическое действие на течение реакции. Очевидно, возможна аналогия процесса амидирова-шш по лабильной метоксильной группе колхицина с аммонолизом сложных эфиров, дяя которого предложен механизм, предусматриваю-VS каталитическое воздействие основания (ом. схему Ш) и подтверждаемый кинетикой реакции При получении аминокислотных щюизводных колхишша процесс может быть выражен аналогичной схе-шй 1У. Пример влияния щелочности среды на аминолиз сложных эфиров взаимодействие фенилацетата и пиперидина, при котором увеличение pH среды содействует смещению процесса в сторону образова-шю амида [c.181]
Аммонолиз сложных эфиров — важный метод синтеза амидов. Типичным примером является получение хлорацетамида (СОП, 1, 476) и цианацетами- [c.300]
chem21.info
Карбоновые кислоты и их производные. Гетероциклические соединения, страница 3
· хлорангидриды > ангидриды > карбоновые кислоты.
· метанол > первичный > вторичный > третичный спирт
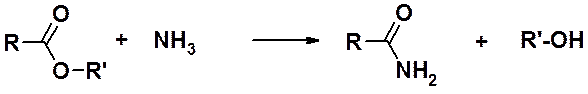
Аммонолиз сложных эфиров
Аммонолиз похож на реакции гидролиза и переэтерификации. В качестве нуклеофила, замещающего спиртовый фрагмент, используют аммиак, амиды щелочных и щелочноземельных металлов.
Восстановление
Каталитическое восстановление сложных эфиров протекает в присутствии медного катализатора при высоких температуре и давлении. Результатом всегда являются первичные спирты.

Восстановление до первичных спиртов может быть проведено также комплексными гидридами металлов или натрием в спирте.
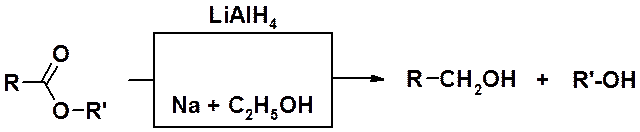
Сложноэфирная конденсация Кляйзена
СН-кислотность a-водородов сложноэфирной группы, является фактором обусловливающим возможность протекания конденсации в присутствии сильных оснований. Результат реакции – эфиры b-кетокислот.
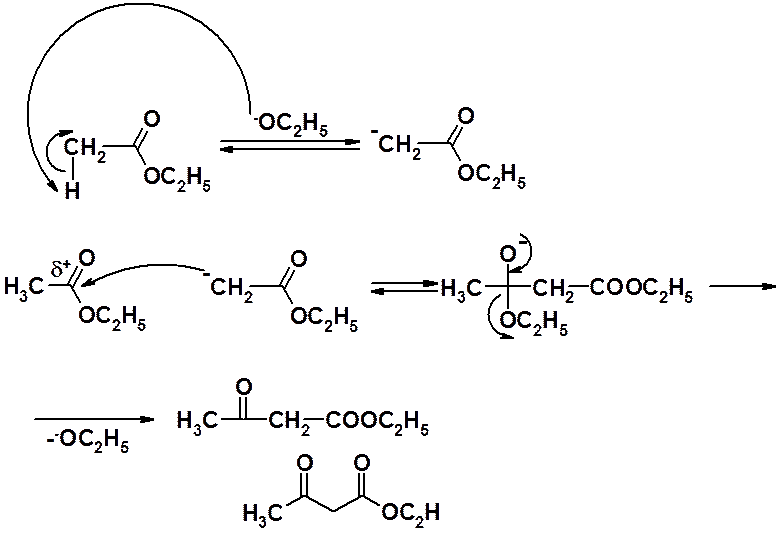
Лекция № 36
Карбоновые кислоты и их производные
Монокарбоновые кислоты.
Производные карбоновых кислот.
· Амиды. Получение: ацилирование аммиака и аминов. Химические свойства: амидное сопряжение, кислотно-основные свойства (сравнить с аминами), восстановление, перегруппировка Гофмана, алкилирование.
Амиды
Общая формула амидов:

Если:
· R’ и R” атомы водорода – незамещенные амиды;
· R’ – водород, R” – углеводородный радикал - монозамещенные амиды;
· R’ и R” - углеводородные радикалы - дизамещенные амиды.
Практическое значение имеют, в первую очередь, незамещенные и монозамещенные амиды.
Получение
Наиболее общие метод получения амидов (от незамещенных до дизамещенных) – ацилирование (введение ацильной группы) аммиака и его производных (аминов).
Простейший, на первый взгляд, и ошибочный метод – получение амида взаимодействием карбоновой кислоты с аммиаком.
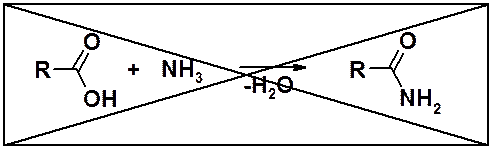
Следует помнить о кислотно-основных свойствах реагирующих веществ. Реакция получения амидов – нуклеофильное замещение ОН-группы. Взаимодействие кислоты с аммиаком приводит к аммонийным солям.
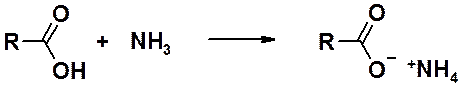
Карбоксилат-анион – частица с избытком электронной плотности, для которой реакция с нуклеофилами затруднена, если не невозможна.
В некоторых случаях аммонийная соль может быть превращена в амид нагреванием при температуре > 200о.
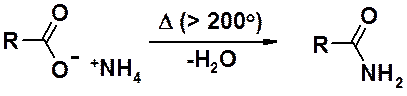
Реакция применима только для простейших кислот с углеводородным радикалом. Соединения, имеющие в углеводородной части молекулы функциональные группы обычно разлагаются при более низких температурах, чем необходимо для отщепления воды.
Гладко протекаю реакции ацилирования аммиака и аминов ангидридами и хлорангидридами кислот.
Ацилирование аммиака и его производных ангидридами

Недостатком этого метода является большой расход карбоновой кислоты, т.к. половина молекулы ангидрида расходуется впустую.
Ацилирование аммиака и его производных хлорангидридами
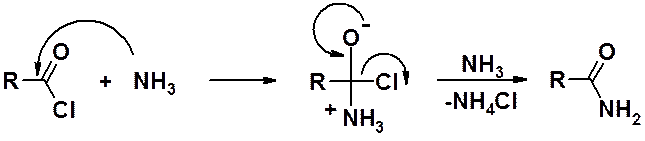
В реакции всегда используют двойной избыток аммиака: одна молекула для введения амидной группы, вторая – для связывания хлористого водорода.
Незамещенные амиды могут быть получены частичным гидролизом нитрилов.

Кислотно-основные свойства амидов
В отличие от большинства производных аммиака, проявляющих сильно основные свойства, амиды амфотерные соединения.
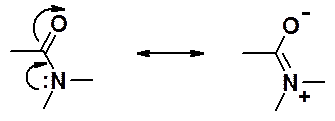
Сопряжение неподеленной пары электронов амидного азота с карбонильной группой, приводит к сдвигу электронной плотности в сторону кислорода. Связь C-N имеет частично двойной характер, ее длина (1,32 Å) заметно меньше длины одинарной C-N связи (1,47 Å).
В реакциях с сильными основаниями амиды проявляют кислые свойства. Кислотность амидов близка к кислотности спиртов (рКа 15-19). Кислотные свойства используют в реакциях алкилирования.

Основность амидов также низка. Только в реакциях с сильными кислотами происходит протонирование, причем оно проходит по атому кислорода.

Химические свойства
Восстановление
Восстановление незамещенных амидов комплексными гидридами щелочных металлов (LiAlh5) приводит к первичным аминам, а - моно- и дизамещенных соответственно к вторичным и третичным аминам.
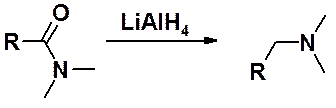
При восстановлении металлическим натрием в жидком аммиаке в присутствии этанола образуются альдегиды.

Гидролиз амидов
Кислотный гидролиз приводит к карбоновой кислоте и аммонийной соли.

В результате щелочного гидролиза образуется соль кислоты и амин или аммиак.

Перегруппировка Гофмана
Бромирование незамещенных амидов в щелочной среде ведёт к образованию первичных аминов.

Реакция состоит из нескольких стадий: первоначального образования N-бромамида, который перегруппировывается в изоцианат, гидролиз изоцианата до карбаминовой кислоты и декарбоксилирования последней в амин.

Очень важная особенность перегруппировки Гофмана в том, что она проходит с сохранением конфигурации, т.е. открывает возможность стереонаправленного синтеза. Например, взяв в качестве исходного соединения (+)-карбоновую кислоту и получив из нее (+)-амид, после перегруппировки будет получен (+)-первичный амин.
Лекция № 37
Карбоновые кислоты и их производные
Монокарбоновые кислоты.
Производные карбоновых кислот.
· Взаимопревращения амидов и нитрилов. Получение нитрилов дегидратацией амидов кислот. Химические свойства: гидролиз, аммонолиз, каталитическое гидрирование, восстановление алюмогидридом лития, использование в синтезе кетонов ароматического ряда.
Дикарбоновые кислоты
· Классификация, изомерия, номенклатура.
· Методы получения: гидролиз динитрилов, синтезы с использованием малонового эфира, окислительное расщепление циклоалкенов и циклических кетонов, окисление диолов, альдегидов, окисление диалкилбензолов.
· Химические свойства: кислотность и ее зависимость от взаимного расположения карбоксильных групп, константы кислотности для первого и второго карбоксила. Поведение дикарбоновых кислот при нагревании. Пиролиз кальциевых и ториевых солей. Получение, свойства и применение производных дикарбоновых кислот.
vunivere.ru
Алкоголиз сложных эфиров - Справочник химика 21
Алкоголиз сложных эфиров используется для перехода от эфиров низших спиртов к эфирам высших спиртов. Так, н-бутилакрилат может быть получен с 94%-ным выходом при нагревании метилакрилата с н-бутиловым спиртом при непрерывном удалении метанола по мере его образования (СОП, 4, 116). [c.291]Алкоголиз сложных эфиров. Нагревание сложных эфиров в растворе спиртов может привести к обмену алкогольных радикалов (переэтерификация) [c.255]
Наибольшее практическое значение имеет алкоголиз сложных эфиров. Указанные выше реакции также катализируются протонными кислотами. [c.473]Б. Алкоголиз сложных эфиров [c.309]
Алкоголиз сложных эфиров. Переэтерификация. [c.130]
ПЕРЕЭТЕРИФИКАЦИЯ, ИЛИ АЛКОГОЛИЗ СЛОЖНЫХ ЭФИРОВ [c.53]
Наибольшее значение имеет алкоголиз сложных эфиров, нередко используемый для практических синтезов. Алкоголиз, ацидолиз и переэтерификация, как и этерификация карбоновыми кислотами, катализируются сильными кислотами. [c.194]
При алкоголизе сложных эфиров применяют методы повышения степени конверсии, аналогичные используемым в случае этерификации. Наибольший эффект дает удаление образующегося спирта из сферы реакции, в связи с чем алкоголиз проводится в большинстве случаев с целью получения эфиров более высококипящих спиртов, например [c.196]
Наибольшее значение имеет алкоголиз сложных эфиров, нередко используемый для практических синтезов. [c.258]
Как и этерификация карбоновыми кислотами, алкоголиз, ацидолиз и переэтерификация катализируются сильными кислотами. Однако алкоголиз сложных эфиров более эффективно ускоряется веществами основного характера (в том числе алкоголятами, щелочами, солями слабых кислот), сохраняя в то же время равновесных характер [c.258]
Механизм с разрывом ацил-кислородной связи по реакции второго порядка реализуется и для щелочного гидролиза и алкоголиза сложных эфиров. В этом случае нуклеофильным реагентом при гидролизе является гидроксильный ион, а при алкоголизе — алкоголят-анион. С этими реагентами гидролиз и алкоголиз протекают значительно быстрее, чем при кислотном катализе, и активирование молекулы сложного эфира не требуется [c.261]
Алкоголиз протекает легко при взбалтывании сложных эфиров предельных или непредельных карбоновых кислот при обычной температуре с 10-кратным количеством спирта с добавкой металлического калия или натрия. Особенно легко протекает переэтерифи-кация первичных алкокси-радикалов, в случае же вторичных и третичных спиртов необходимо нагревание. Аналогично проводится и алкоголиз сложных эфиров гликолей, причем с абсолютным спиртом в присутствии натрия получается 75—85% этиленгликоля [c.545]
Согласно принятым в настоящее время представлениям реакция алкоголиза сложных эфиров протекает по механизму нуклеофильного присоединения с последующим отщеплением. При алкоголизе целлюлозой реакция в зависимости от характера катализатора может быть описана следующими схемами. [c.257]
Следовательно, скорость переэтерификации (а в случае алкоголиза низкомолекулярных сложных эфиров целлюлозой — и степень замещения образующегося эфира) должна определяться величиной положительного заряда на углероде карбонильной группы подвергаемого алкоголизу сложного эфира, т. е. от степени поляризации сложноэфирной связи, зависящей от строения ациль-ного и алкильного радикалов эфира. [c.258]
Данные, полученные при исследовании алкоголиза целлюлозой метиловых эфиров бензойной кислоты и ее замещенных п-хлор-, П-ОКСИ-, п- и о-нитробензойных кислот, а также метиловых эфиров замещенных уксусных кислот — монохлоруксусной, фенил-, фен-окси- и 2,4-дихлорфеноксиуксусной кислот, — подтвердили это предположение. Алкоголиз эфиров слабых карбоновых кислот протекает с расщеплением только связи ацил — кислород и образованием сложного эфира целлюлозы. С увеличением константы диссоциации кислоты степень замещения сложного эфира целлюлозы, полученного в одинаковых условиях проведения реакции алкоголиза, увеличивается. Однако при увеличении степени поляризации сложноэфирной связи эфира, подвергаемого алкоголизу целлюлозой, выше определенного предела (для эфиров карбоновых кислот с константой диссоциации больше 1 10 ) происходит частичное изменение механизма реакции алкоголиза сложного эфира. В этом случае алкоголиз протекает с разрывом как ацил-кислородной, так и алкил-кислородной связи с образованием смешанного эфира целлюлозы, содержащего ацильные и алкильные группы. [c.258]
Алкоголиз сложных эфиров в присутствии алкоголятов постепенно замедляется. Объясните причины этого и напишите элементарные стадии всех реакций. [c.73]
В реакциях алкоголиза сложных эфиров возможен нуклеофильный катализ другого типа, в котором в качестве катализатора используется сопряженное основание реагента. Так же как в реакциях присоединения, повышенная нуклеофильность сопряженного основания по сравнению с реагентом позволяет резко ускорить процесс (сравнительно с некаталитическим) [c.144]
Нуклеофильностью В по отношению к карбонильной группе. Относительные нуклеофильности определены из кинетических данных по гидролизу и алкоголизу сложных эфиров (табл. 11.6) [90]. [c.57]
То, что может быть образован промен уточный продукт присоединения, а также происходящий обмен кислорода указывают, но не доказывают, что тетраэдрический промежуточный продукт образуется при щелочном гидролизе и алкоголизе сложных эфиров. Так как реакция по своей природе симметрична и так как менее основный алкоголят-ион будет несомненно предпочтительно вытесняться из промежуточного продукта присоединения, скорость определяющая стадия для обеих реакций будет включать присоединение или отщепление более основного алкоголят-иона. [c.380]
Нлибольшее значение имеет алкоголиз сложных эфиров, нередко используемый для практических синтезов. Алкоголиз, ацидолиз и [c.204]
При алкоголизе сложных эфиров происходит переэтерификаиия, т. е. обмен алкокси-радикалами между спиртом и эфиром. В результате образуется равновесная смесь два спирта и два сложных эфира. [c.545]
Джувет и Вахи (1959), а также Джувет и Чиу (1961) исследовали термодинамику и кинетику алкоголиза сложных эфиров и ацеталей, при этом смесь состояла из шести веществ. [c.469]
Следующим объектом исследования была реакция нереэтери-фикации (алкоголиза) сложных эфиров (табл. 4, 5). Эта реакция приобретает в настоящее время особое значение в связи с развитием исследований и организацией производств новых синтетических продуктов. Мы изучали реакцию иереэтерификации на дву.зт [c.74]
Эта реакция может быть осуществлена нагреванием сложного эфира с избытком спирта з запаянной трубке при довольно высокой температуре Удобнее действовать на сложный эфир небольшим количеством алкоголята натрия, растворенного 3 соответствующем спирте. Реакция эта обратима и останавливается при достижении состояния равновесия. Систематическое изучение этой реакции было. впервые произведено Порди с сотрудниками хотя отдельные наблюдения в этой области отмечались и раньше . Алкоголиз сложных эфиров насыщенных жирных кислот, ароматических и ненасыщенных кислот протекает при комнатной температуре при взбалтывании приблизительно с 10-кратны,м по весу количеством соответственного первичного спирта, в котором предварительно было растворено небольшое количество натрия или калия. Для замеще-ция алкоксильной группы остатком вторичного или третичного спирта реакционную смесь необходимо нагревать [c.309]
Тем самым в реакции обнаруживается специфический кислотный катализ. Этот механизм применим к инверсии сахарозы (таблица 3, реакция 1), к гидролизу диазоуксусного эфира (реакция 2), ацеталей (реакция 3) и гидролизу или алкоголизу сложных эфиров, хотя [c.67]
Реакция алкоголиза, или переэсте-рификация. При взаимодействии сложных эфиров со спиртами происходит алкоголиз сложных эфиров, напоминающий [c.145]
Рассматриваемая работа показала, что как катализируемый кислотами, так и не катализируемый алкоголиз сложных эфиров третичн.-бутилового спирта протекает по второму механизму, а следовательно, отличается от соответствующих реакций сложных эфиров первичных и вторичных спиртов. Однако алкоголиз под влиянием оснований протекает по первому механизму. [c.444]
Присутствие всякого реагента, взаимодействующего с атомами главной цепи и, следовательно, ослабляющего связь между ними, способствует разрыву цепи. Примером такого взаимодействия может служить образование комплексов при гидролизе или алкоголизе сложных эфиров. Возникая за счет водородных связей, 011и 2 активируют соответствующую реакцию деструкции [c.37]
По калибровочной кривой для данной системы определяем содержание метанола в отгоне, соответствуюцее найденному значению скорости ультразвука. Затем находим степень переэтерификации диметилтерефталата (табл.Х). В табл.2 приведены данные по определению степени переэтерификации с помощью ультразвукового метода и по плотности отгона. Сравнение точности этих двух методов контроля показало, что ультразвуковой метод дает степень точности на порядок выше. Кроме этого, с помощью ультразвукового метода исследовался процесс алкоголиза различных сложных эфиров (табл.З, рис.З). Следовательно, ультразвуковой метод позволявт более глубоко проанализировать процессы, происходящие при алкоголизе сложных эфиров. [c.217]
Как следует из этого уравнения, в экспериментальную константу скорости второго порядка кроме к входит отношение констант скоростей распада промежуточного продукта которое может быть найдено из экспериментальных данных по скорости кислородного обмена в ходе реакции. По такому механизму протекают взаимодействие кислот и сложных эфиров с аммиаком и аминами, алкоголиз сложных эфиров при катализе основаниями, нуклеофильные реакции хлорангидридов органических и неорганических кислот (фосге на, хлоридов и оксихлоридов фосфора и др.), некаталитические превращения ангидридов [c.68]
По такому механизму протекают кислотнокаталитические реакции этерификации, гидролиза и алкоголиза сложных эфиров, гидролиза и этерификации амидов и ангидридов кислот. [c.70]
При гидролизе и алкоголизе сложных эфиров и ангидридов наблюдаются кислотный катализ, основной катализ, а также механизм, не зависящий от изменений pH. Среди этих путей протекания реакции наиболее доступен для понимания основно каталитический из-за его симметрии и относительно небольшого числа возможных механизмов катализа переноса протона. Тетраэдрический промежуточный продукт присоединения можно наблюдать непосредственно при добавлении этилат-иона к этиловому эфиру трифторуксусной кислоты в неполярном растворителе в условиях, когда собственно реакция переноса ацильной группы невозможна (схема (48) [3]. [c.379]
chem21.info
Химические свойства
1. Реакция гидролизапротекает как в кислой , так и в щелочной среде:
142.Напишите уравнения (и механизм) гидролиза сложных эфиров, приведенных в упражнении 139в кислой и щелочной средах.
2. Реакция алкоголиза сложных эфиров(переэтерификация) протекает при нагревании их с спиртами в присутствии минеральной кислоты или алкоголята (щелочная среда). Реакция обратимая, направление зависит от количества взятого спирта и других условий:

3. Аммонолиз сложных эфировпротекает часто даже на холоду с образованием амидов кислот и спиртов:
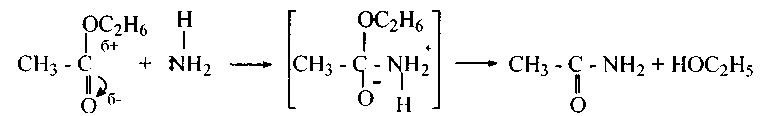
Механизм реакций гидролиза, алкоголиза и аммонолиза сложных эфиров аналогичный.
143.Приведите уравнения и механизм следующих реакций и назовите полученные соединения:
а) трет-пентил-2-метилпропаноат + 2-метилпропанол-1;
б) 2-метилбутилпропаноат + 25%-ный раствор аммиака;в) 3-метилбутилпропаноат + 2-метилпропанол-1;
г) изобутил-2-метилпропаноат + 25%-ный раствор аммиака;
д) изопентилпропаноат + пропанол-1;
е) 1-метилбутилпропаноат + 25%-ный раствор аммиака;
ж) трет-бутил-2-метилпропаноат + этиловый спирт;
з) втор-бутил-2-метилпропаноат + 25%-ный раствор аммиака.
4. Сложные эфиры реагируют с алкилмагнийгалогенидамиподобно альдегидам и кетонам. При этом отщепляется алкоголят магнийгалогенида и образуется кетон:
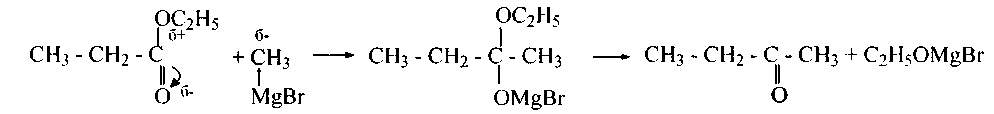
Реакцию можно остановить на этой стадии, если вести процесс при сильном охлаждении и недостатке алкилмагнийгалогенида. Иначе кетон реагирует далее до третичного спирта:
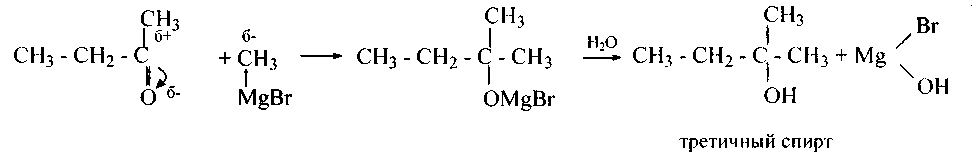
144.Напишите уравнения (и механизм) реакций этилмагнийиодида со следующими сложными эфирами и назовите полученные кетоны и третичные спирты: а) этилпропаноат; б) пропилэтаноат; в) изопропилбутаноат; г) изопропилэтаноат; д) метил-2-метилпропаноат; е) этил-2-метилпропаноат; ж) пропилбутаноат; з) бутилпропаноат.
5. Восстановление сложных эфировпротекает легче, чем самих кислот. Получается первичный спирт, соответствующий кислоте сложного эфира. Восстановителями являются литийалюминийгидрид, натрий в кипящем спирте, водород в присутствии скелетного никелевого или медно-хромового катализаторов:
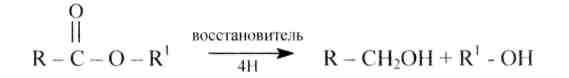
145.Напишите уравнения реакций восстановления сложных эфиров, приведенных в упражнении 144,а) литийалюминийгидридом; б) натрием в изопентиловом спирте; в) водородом в присутствии катализатора.
6. Сложные, эфиры устойчивы к действию окислителей.Вследствие этого для защиты спиртовых или фенольных групп в реакциях окисления эти группы предварительно этерифицируют, а по окончании окисления гидролизуют.
Б. ЖИРЫ
Главной составной частью растительных и животных жиров являются сложные эфиры глицерина и высших жирных кислот - триглицериды, содержащие остатки пальмитиновой, стеариновой, олеиновой, линолевой, линоленовой и других, кислот. В общем виде триглицериды имеют строение:

где R1, R2, R3 — радикалы жирных кислот, α, β, α1 - обозначения углеродных атомов глицерина, к которым прикреплены ковалентной связью ацилокси-группы (RCOO).
Если остатки R1 , R2 , R3 являются остатками одной и той же кислоты, то триглицерид называется простым, в противном случае - смешанным.
Большинство жиров содержат две или три главные кислоты и некоторые другие кислоты в меньшем количестве. Все кислоты распределены таким образом, что образуется большое число смешанных триглицеридов, в связи с этим β-углеродные атомы триглицеридов являются асимметрическими, например,

Жиры обладают всеми свойствами сложных эфиров, но практически используются реакции гидролиза (или омыления) — для приготовления мыла, гидрирования - для приготовления гидрожира, маргарина, саломаса, окисления по двойным связям кислот и полимеризации (высыхание масел при крашении масляными красками).
146.Напишите уравнения следующих реакций и назовите полученные триглицериды (укажите в них асимметрические атомы углерода звездочкой):
а) β-олео-α-стеарат глицерина + С 17Н 31 СООН →
б) β-стеарат глицерина + 2С17Н33СООН →
в) α, β-дистеарат глицерина + С17Н33 СООН →
г) α-стеарат глицерина + 2С17Н35СООН →
д) β-олеат глицерина + 2С17Н33СООН →
е) α, β-диолеат глицерина + С17Н 35СООН →
ж) β-линоло-α-стеарат глицерина + С17Н33СООН →
з) α-линоло-β-пальмитат глицерина + С17Н33СООН →и) α-олео-β-пальмитат глицерина + С17Н29СООН →к) β-линолено-α-олеат глицерина + С17Н31СООН →
XIV. АМИНЫ
Амины являются продуктами замещения водородов аммиака на углеводородные радикалы. В зависимости от того, сколько атомов водорода замещено на радикалы, различают амины первичные R—Nh3, вторичные R2NH и третичные R3N.
Здесь понятия первичный, вторичный и третичный связаны не с характером углеродного атома, а со степенью замещения водородов при атоме азота аммиака.
Похожие статьи:
poznayka.org