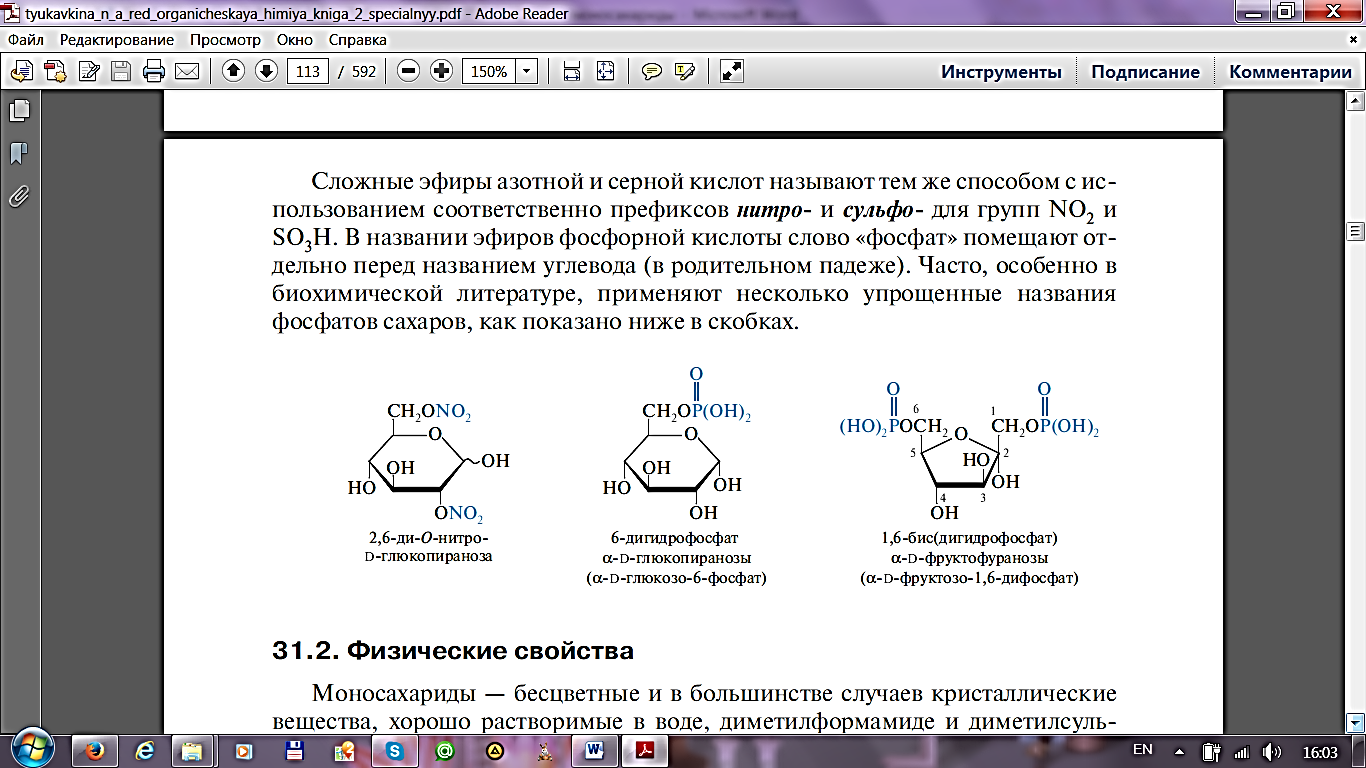
Синтез диэтиланилина. Синтез уксусноэтилового эфира
Синтез диэтиланилина
Уравнения основных реакций:
Реактивы
Основные:
| Анилин | 18.6 г. |
| Бромистый этил | 48 г. |
Вспомогательные:
| Едкий натр (25 %-ный) | 100 см3 |
Посуда и приборы:
| Колба круглодонная | 1 шт. |
| Холодильник обратный | 1 шт. |
| Холодильник нисходящий | 1 шт. |
| Трубка хлоркальциевая | 1 шт. |
| Воронка делительная | 1 шт. |
| Воронка коническая | 1 шт. |
| Электроплитка | 1 шт. |
Все детали прибора должны быть сухими!
В колбу загружают 18,6 г анилина, 24,0 г бромистого этила, присоединяют обратный холодильник и нагревают до кипения в течение 1,5 часа. В колбе образуется твердая масса бромоводородной соли моноэтиланилина. Колбу охлаждают и постепенно прибавляют 50 см325 %-ного раствора NаОН, при этом образуется два жидких слоя. Выделившийся моноэтиланилин (верхний жидкий слой) отделяют в делительной воронке, переливают в сухую колбу и сушат полчаса над твердой щелочью.
За это время прибор должен быть вымыт и высушен. Высушенный моноэтиланилин декантируют со щелочи в колбу, приливают 24 г бромистого этила и снова 2 часа осторожно кипятят с обратным холодильником до затвердевания всей массы.
К охлажденному продукту прибавляют 50 см325 % раствора NаОН, отделяют в делительной воронке диэтиланилин, высушивают твердой щелочью, декантируют и перегоняют, собирая фракцию при 214-216оС.
Выход диэтиланилина 20 г.
Техника безопасности.Анилин, относящийся к классу ароматичесих аминов, обладает токсичностью (проникает в организм через органы дыхания и через кожу. Поэтому все детали приборов при работе с ним должны быть тщательно уплотнены, а все операции по подготовке синтеза проводиться под тягой. Диэтиланилин - бесцветная маслянистая жидкость с неприятным запахом, ядовита; т. кип. 216С.
Ацилирование
Реакция ацилирования (определение).Ацильные радикалы, их номенклатура. Ацилирующие средства. Ряд активности ацилирующих средств. Влияние углеродного радикала и других группировок, связанных с карбонатом, на реакционную способность ацилирующих средств. Зависимость скорости реакции ацилирования от нуклеофильности реагента. Катализаторы и их роль в реакциях ацилирования.
Ацилирование спиртов. Реакция этерификации, ее механизм. Обратимость реакции и методы смещения равновесия. Факторы, влияющие на скорость реакции этерификации: катализатор, температура, строение кислоты и спирта. Реакция омыления сложных эфиров кислотами и основаниями и основаниями, ее механизм. Реакция переэтерификации. Реакции, сопутствующие этерификации: внутри- и межмолекулярная дегидратация спиртов.
Ацилирование фенолов. Условия проведения реакции и применяемые реагенты.
Сложные эфиры карбоновых кислот как фруктовые эссенции.
Синтез уксусноэтилового эфира
Уравнения основных реакций:
Побочные реакции:
Реактивы
Основные.
| Этиловый спирт, 95%-ный | 45 см3 |
| Уксусная кислота (ледяная) | 40 см3 |
Вспомогательные.
| Серная кислота | 5 см3 |
| Кальций хлорид | 8 г |
| Сода кальцинированная | |
| Дистиллированная вода (для приготовления раствора СаСl2) | 8 см3 |
| Сернокислый натрий Nа2SО4(безводный) |
Посуда и приборы
| Колба Вюрца (250 см3) | 1 шт. |
| Капельная воронка | 1 шт. |
| Холодильник Либиха | 1 шт. |
| Термометр | 1 шт. |
| Аллонж | 1 шт. |
| Колба коническая Эрленмейера (100 см3) | 2 шт. |
| Электроплитка | 1 шт. |
Выполнение синтеза
В колбу Вюрца (250 см3) , снабженную воронкой и соединенную с холодильником Либиха (Приложение В, рис.5), вливают 5 см3этилового спирта и 5 см3концентрированной серной кислоты и нагревают на электрической плитке с закрытой спиралью до 110-120С. (На этом этапе не следует сильно перегревать смесь спирта с серной кислотой, так как это может привести к разложению и обугливанию спирта и выделению едких паров диоксида серы (IV).Место капельной воронки на этом этапе заменяет термометр.Как только эта температура будет достигнута, начинают постепенно приливать из капельной воронки смесь 40 см3ледяной уксусной кислоты и 40 см3спирта с такой скоростью, с какой отгоняется образующийся эфир, при этом должна поддерживаться температура (110-120С), так как при более высокой температуре образуется диэтиловый эфир.
После окончания реакции содержимое приемника переносят в делительную воронку и промывают концентрированным раствором соды для удаления уксусной кислоты (проба на лакмус). Раствор углекислого натрия следует прибавлять постепенно, так как жидкость сильно вспенивается выделяющимся диоксидом углерода. Затем отделяют нижний водный слой, а верхний эфирный слой встряхивают с насыщенным раствором хлористого кальция (8 г хлористого кальция в 8 см3воды) для удаления непрореагировавшего спирта (с первичными спиртами хлористый кальций дает кристаллическое молекулярное соединение СаСl2 2С2Н5ОН, которое нерастворимо в уксусноэтиловом эфире).
Снова отделяют верхний эфирный слой и сушат его безводным сернокислым натрием (не менее 2-х часов). После высушивания эфир перегоняют на водяной бане из колбы Вюрца с водяным холодильником (Приложение В, рис.2). При 71-75 С будет отгоняться смесь спирта и уксусноэтилового эфира, а при 75-78С – сравнительно чистый уксусноэтиловый эфир.
Выход уксусноэтилового эфира 40 г.
Техника безопасности.Концентрированная уксусная кислота – едкая жидкость с резким удушающим запахом. Все подготовительные операции с ней проводить только под тягой. Сильно разъедает кожу, поэтому при попадании на нее немедленно смыть обильной струей воды и место ожога обработать раствором питьевой соды и опять водой. Уксусноэтиловый эфир и этанол – летучие огнеопасные жидкости, при работе с ними следует удалить источники открытого огня. Обладают слабым наркотическим действием.
studfiles.net
Уксусноэтиловый эфир получение - Справочник химика 21
Опыт 4. Получение уксусноэтилового эфира. Налейте в пробирку 1—2 л(уг этилового спирта и затем осторожно такой же объем концентрированной серной кислоты. Прибавьте немного сухого ацетата натрия, слегка нагрейте пробирку и понюхайте образовавшееся вещество. Напишите уравнение реакции. [c.271]Сколько граммов уксусной кислоты и этилового спирта потребуется для получения 17,6 г уксусноэтилового эфира, если выход составляет 100% Ответ. 12 г 9,2 г. [c.347]
Ацетальдегид находит широкое применение в промышленном органическом синтезе. Служит сырьем для получения уксусной кислоты, уксусноэтилового эфира, этанола, синтетических смол и т. д. [c.338]
Сколько граммов уксусноэтилового эфира можно получить из 15 г уксусной кислоты и 20 г этанола, если массовая доля полученного эфира составляет 75% от теоретического Ответ. 16,5 г. [c.347]
Как и в случае получения уксусноэтилового эфира, для ускорения реакции прибавляют серную кислоту. Так как бензойноэтиловый эфир труднолетуч, то для смещения равновесия вправо приходится прибавлять большой избыток спирта. [c.83]
Для получения более чистого трифениламина сырой прод тобратным холодильником приблизительно в 700 мл уксусноэтилового эфира. Полученный раствор быстро охлаждают при перемешивании, причем амин выделяется в виде почти бесцветных кристаллов. Концентрированием маточного раствора можно получить еще некоторое количество трифениламина. Последние порции могут быть окрашены, но после одной перекристаллизации из уксусноэтилового эфира получается почти бесцветный продукт (примечаиие 12). Общий выход трифениламина, окрашенного в светложелтый цвет и плавящегося при 126°, равен 200—210 г, или 82—85% теоретич. (примечание 13). [c.421]
На рис. 47 изображен прибор для лабораторного получения уксусноэтилового эфира. В колбу, помещенную для регулирования температуры в масляную баню, наливают смесь 50 мл эти- лового спирта и 50 мл концентрированной серной кислоты. Смесь подогревают до 140 °С и приливают к ней небольшой струей 400 мл смеси равных объемов спирта и уксусной кислоты. Образующий- [c.253]
СЯ сложный эфир и воду отгоняют в приемный сосуд. Отогнанный эфир взбалтывают для удаления примеси кислоты с раствором соды и для удаления спирта с раствором хлористого кальция. Затем эфир отделяют от воды в делительной воронке (он легче воды н с водой не смешивается), сушат хлористым кальцием и снова перегоняют. Этот общепринятый метод получения уксусноэтилового эфира был предложен в 1873 г. В. В. Марковниковым, им же дано объяснение механизма протекающей реакции. [c.254]
Полученный ацетамид достаточно чист для большинства работ. Вполне чистый продукт может быть получен перекристаллизацией сырого ацетамида из смеси 0 мл бензола 0.3 мл уксусноэтилового эфира или из серного эфира. [c.153]
В склянку к полученному концентрированному раствору аммиака добавляют уксусноэтиловый, эфир, собирающийся в виде слоя на дно, и немедленно плотно закупоривают склянку резиновой пробкой. Чтобы пробку не вышибло давлением аммиака, ее привязывают к горлу склянки при помощи бечевки или проволоки. Склянку оставляют стоять в прохладном месте. [c.154]
Количество катализатора может быть различным в зависимости от природы реагирующих компонентов. Известно, например, что для получения уксусноэтилового эфира достаточно добавить в реакционную смесь 0,01% серной кислоты. [c.165]
Полученный препарат можно перекристаллизовать с этой целью его растворяют в горячем уксусноэтиловом эфире (2 мл эфира на 1 г ангидрида) и к горячему раствору медленно прибавляют равный объем гексана или петролейного эфира (т. кип. 60—68 ). Затем раствору дают охладиться и, когда начнется кристаллизация (обычно при 40—50°), прибавляют к нему дополнительное количество гексана (2 мл гексана на 1 г ангидрида). После этого смесь охлаждают выпавшие в осадок кристаллы отфильтровывают и промывают Холодным гексаном (5 мл гексана на 1 г ангидрида). Выход при перекристаллизации достигает 90—92%. Препарат получается бесцветным т. пл. 95—96°. [c.59]
Бромаль был получен бромированием раствора паральдегида в уксусноэтиловом эфире пропусканием паров брома через абсолютный спирт а также действием на хлораль бромида какого-либо металла [c.103]
Дигидрохолестерин был получен восстановлением холестенона натрием в амиловом спирте а также гидрогенизацией хо.песте-рина. В присутствии платиновой черни или окиси платины были получены выходы от 6,5 до 40% в растворе эфира ацетона уксусноэтилового эфира и уксусной кислоты [c.197]
Приборы и реактивы. Прибор для получения уксусноэтилового эфира. Воронка Бюхнера с водоструйным насосом. Баня водяная. Штатив с пробирками. Пробирка со стеклянной трубкой (воздушным холодильником). Стаканы стеклянные. Стаканы фарфоровые. Стекла часовые. Чашки фарфоровые. Ци-линдм мерные. Термометр (0—300" С). Палочки стеклянные. Щипцы тигельные. Пробки корковые. Капилляры стеклянные. Карандаши восковые для стекла. Фильтры бумажные. Уксусная кислота (ледяная). Спирт этиловый. Бензойная кислота ijHj OOH. Уксусный ангидрид (СНзС0)20. Растворы гидроксида натрия (2 н., 30, 40%-ные), азотной кислоты (пл. 1,4 г см ), серной кислоты (пл. [c.244]Содержимое 5-литровой колбы переливают в 2-литровую для. фракционной разгонки (стр. 142), снабженную дефлегматором длиной в 40—50 см, и подвергают перегонке при атмосферном давлении. Холодильником служит стеклянная трубка. Фракция, кипящая до 210 , собирается отдельно объем ее — до 250—300 мл. В колбе остается почти чистый ацетамид, который перегоняется при 210—216 вес перегнанного продукта 1150—1200 г. Перегонкой фракции, кипящей до 210 , выход может быть увеличен до 1200-1250 г (87—90% теоретич.). Ацетамид, полученный таким путем, достаточно чист для большинства работ. Для получения совершенно чистого продукта достаточно подвергнуть перегнанный ацет-амнд кристаллизации из смеси бензола с уксусноэтиловым эфиром [c.64]
Для исследований мы пользовались кремнефторидом кальция, который был получен в процессе разложения апатита кремнефтористоводородной кислотой [10] и отмыт уксусноэтиловым эфиром. Полученный таким образом кремнефторид кальция вводили в водные растворы фосфорной кислоты одинаковой концентрации — 20% РаО ) и к ним добавляли в отдельности или вместе 0,5% ГсаОз 0,5% А120зи0,5% ЗЮз. Полученные данные сведены в табл. 2. [c.34]
Поскольку реакция этерификации является обратимой, выход эфира тем больше, чем в большем избытке взят спирт или кислота и чем полнее удаляются из реакционной смеси сложный эфир и вода. Так, например, при получении бензойноэтилового эфира берется избыток спирта при получении уксусноэтилового эфира отгоняется эфир, так как он кипит при температуре, которая ниже температуры кипения воды при получении уксусноизоамилового эфира отгоняется вода, так как ее температура кипения ниже температуры кипения образовавшегося эфира. В последнем случае вода отгоняется в виде азеотропной смеси с темп. кип. 94° С. Такой способ получения эфира называют азеотропной этерификацией. Иногда связывают воду с помощью водоотнимающих средств (И2864, гпСЦ, СаС , А12(804)3 и др.). [c.166]
Примером С-ацилироваипя является получение ацетоуксусного эфира из уксусноэтилового эфира в присутствии алкоголята натрия [c.142]
Этиловый эфир а.-ацетил-[ - 2,3-дижтоксифенил)-пропионовой кислоты. Вещество, полученное согласно указаниям, приведенным в предыдущем разделе, делят примерно на две равные части и к каждой из них прибавляют по 125 мл уксусноэтилового эфира и по 5 г 5%-ного палладиевого катализатора (на угле) (примечание 4). Каждый из растворов взбалтывают с водородом при давлении, равном 1,5—3,0 ат, в приборе для гидрирования прп низких давлениях. Для полного восстановления обычно требуется около 45 мин. Затем оба раствора соединяют вместе, отфильтровывают катализатор и промывают его уксусноэтиловым эфиром (20 мл). Растворитель отгоняют при атмосферном давлении, а остаток перегоняют в вакууме при 175—177° (3 мм). В результате получают 158—176 е (56—6394 теоретич., считая па 2,3-диметоксибенй-альдегид) бесцветного препарата пв 1,5042—1,5044 (примечания 3 и 5). [c.579]
В пробирку налейте пять капель 2 н. раствора гидроксида натрия, 2—3 каили фенолфталеина и 2—3 мл уксусноэтилового эфира СН3СООС2Н5, полученного н опыте 1, а или бензойноэтилового эфира С6Н5СООС2Н5, полученного в опыте 1, б. [c.245]
Этшювый эфир бензоилуксусной кислоты был получен конденсацией (в присутствии этилата натрия) уксусноэтилового эфира с бензойноэтиловым эфиром ацетофенона с угольным эфиром и ацетофенона с щавелевым эфиром с последующим нагреванием действием концентрированной серной кислоты на этиловый эфир фенилпропиоловой кислотыили на а-бромкоричную кислоту взаимодействием диазоуксусного эфира с бензальдегидом , конденсацией бензола с моноэтиловым эфиром хлорангидрида малоновой кислоты в присутствии хлористого алюминия , или [c.585]
Синтез бензоилацетона является примером получения [3-дике-тонов в результате конденсации энолята кетона с уксусноэтиловым эфиром. [c.182]
В скляике с притертой Пробкой смешивают 50 г уксусноэтилового эфира и 75 г 25%-ного раствора аммиака. Охлаждая смесь ледяной водой, насыщают ее газообразным аммиаком (при 8—10°) до получения гомогенной жидкости -тогда закупоривают склянку и оставляют реакционную массу иа [c.203]
Б. Бензогадроксамовая кислота. Смесь 35 г (0,2 мол.) калиевой соли и 160 мл 1,25 н. уксусной кислоты перемешивают и нагревают до получения прозрачного раствора, которому дают охладиться до комнатной температуры, а под конец охлаждают в бане со льдом. При этом бензогидроксамовая кислота выпадает в виде бесцветных кристаллов. После фильтрования и высушивания выход продукта с т. пл. 120—128° составляет 25— 26 г (91—95% теоретич.). Для очистки сырого продукта его растворяют в 4,5-кратном количестве по весу горячего уксусноэтилового эфира, отфильтровывают небольшое количество примеси и дают раствору охладиться до комнатной температуры. Выпавшие бесцветные кристаллы отфильтровывают, промывают небольшим количеством бензола и сушат на воздухе. Из 26 г неочищенного продукта получают 20 г перекристаллизованного с т. пл. 125—128° (77% примечание 5). [c.88]
Ацетоуксусный эфир может быть получен из уксусноэтилового эфира действием металлического натрия этилата натрия нат-рийамида и кальция . Если применять этилат натрия и конденсацию проводить так, чтобы образующийся спирт удалялся, то выход достигает 80% теоретического . [c.74]
Нами проверен и уточнен метод получения диэтилового эфира сукцииилянтарной кислоты конденсацией диэтилового эфира янтарной кислоты в присутствии металлического натрия в среде уксусноэтилового эфира [2]. [c.70]
Получение > )-ацетил-2-ацетоселенофена. В трехгорлую колбу емкостью 500 мл с мешалкой, обратным холодильником и капельной воронкой помещают 300 Л1л абсолютного эфира и вносят свежеприготовленный из 8,6 г натрия амид натрия (см. примечание 3), При 20° и перемешивании прибавляют к к амиду натрия раствор 30 г (0,17 М) 2-ацетоселенофена в 30 мл абсолютного эфира, а затем раствор 40 г (0,45 М) уксусноэтилового эфира в 40 мл абсолютного эфира. Смесь перемешивают 15 минут при 20° и 3 часа на водяной бане (70—80°) охлаждают, разлагают смесью 400 г льда и 90 мл концентрированной соляной кислоты, экстрагируют эфиром и высушивают эфирные вытяжки безводным сульфатом магния. После отгонки эфира остаток перегоняют в вакууме. Получают 26 г (71%) вязкого масла соломенно-желтого цвета, которое перегоняется при 146—146,5° (6 мм) и закристаллизовывается в приемнике т. пл. 33—33,5° (из спирта). [c.8]
chem21.info
Синтез диэтиланилина
Уравнения основных реакций:
Реактивы
Основные
| Анилин | 18.6 г. |
| Бромистый этил | 48 г. |
Вспомогательные
| Едкий натр (25 %-й) | 100 см3 |
Посуда и приборы:
| Колба круглодонная | 1 шт. |
| Холодильник обратный | 1 шт. |
| Холодильник нисходящий | 1 шт. |
| Трубка хлоркальциевая | 1 шт. |
| Воронка делительная | 1 шт. |
| Воронка коническая | 1 шт. |
| Электроплитка | 1 шт. |
Все детали прибора должны быть сухими!
В колбу загружают 18,6 г анилина, 24,0 г бромистого этила, присоединяют обратный холодильник и нагревают до кипения в течение 1,5 часов. В колбе образуется твердая масса бромоводородной соли моноэтиланилина. Колбу охлаждают и постепенно прибавляют 50 см325 %-го раствора NаОН, при этом образуется два жидких слоя. Выделившийся моноэтиланилин (верхний жидкий слой) отделяют в делительной воронке, переливают в сухую колбу и сушат полчаса над твердой щелочью.
За это время прибор должен быть вымыт и высушен. Высушенный моноэтиланилин декантируют со щелочи в колбу, приливают 24 г бромистого этила и снова 2 часа осторожно кипятят с обратным холодильником до затвердевания всей массы.
К охлажденному продукту прибавляют 50 см325 %-го раствора NаОН, отделяют в делительной воронке диэтиланилин, высушивают твердой щелочью, декантируют и перегоняют, собирая фракцию при 214-216оС.
Выход диэтиланилина 20 г.
Техника безопасности.Анилин, относящийся к классу ароматичесих аминов, обладает токсичностью (проникает в организм через органы дыхания и через кожу. Поэтому все детали приборов при работе с ним должны быть тщательно уплотнены, а все операции по подготовке синтеза проводиться под тягой. Диэтиланилин - бесцветная маслянистая жидкость с неприятным запахом, ядовита; Ткип= 216С.
Ацилирование
Реакция ацилирования (определение). Ацильные радикалы, их номенклатура. Ацилирующие средства. Ряд активности ацилирующих средств. Влияние углеродного радикала и других группировок, связанных с карбонатом, на реакционную способность ацилирующих средств. Зависимость скорости реакции ацилирования от нуклеофильности реагента. Катализаторы и их роль в реакциях ацилирования.
Ацилирование спиртов. Реакция этерификации, ее механизм. Обратимость реакции и методы смещения равновесия. Факторы, влияющие на скорость реакции этерификации: катализатор, температура, строение кислоты и спирта. Реакция омыления сложных эфиров кислотами и основаниями, ее механизм. Реакция переэтерификации. Реакции, сопутствующие этерификации: внутри- и межмолекулярная дегидратация спиртов.
Ацилирование фенолов. Условия проведения реакции и применяемые реагенты.
Сложные эфиры карбоновых кислот как фруктовые эссенции.
Синтез уксусноэтилового эфира
Уравнения основных реакций:
Побочные реакции:
Реактивы
Основные
| Этиловый спирт, 95%-й | 45 см3 |
| Уксусная кислота (ледяная) | 40 см3 |
Вспомогательные
| Серная кислота | 5 см3 |
| Кальций хлорид | 8 г |
| Сода кальцинированная | |
| Дистиллированная вода (для приготовления раствора СаСl2) | 8 см3 |
| Сернокислый натрий Nа2SО4(безводный) |
Посуда и приборы
| Колба Вюрца (250 см3) | 1 шт. |
| Капельная воронка | 1 шт. |
| Холодильник Либиха | 1 шт. |
| Термометр | 1 шт. |
| Аллонж | 1 шт. |
| Колба коническая Эрленмейера (100 см3) | 2 шт. |
| Электроплитка | 1 шт. |
Выполнение синтеза
В колбу Вюрца (250 см3) , снабженную воронкой и соединенную с холодильником Либиха (рис. В.5), вливают 5 см3этилового спирта и 5 см3концентрированной серной кислоты и нагревают на электрической плитке с закрытой спиралью до 110-120С. (На этом этапе не следует сильно перегревать смесь спирта с серной кислотой, так как это может привести к разложению и обугливанию спирта и выделению едких паров диоксида серы (IV).Место капельной воронки на этом этапе заменяет термометр.Как только эта температура будет достигнута, начинают постепенно приливать из капельной воронки смесь 40 см3ледяной уксусной кислоты и 40 см3спирта с такой скоростью, с какой отгоняется образующийся эфир, при этом должна поддерживаться температура 110-120С, так как при более высокой температуре образуется диэтиловый эфир.
После окончания реакции содержимое приемника переносят в делительную воронку и промывают концентрированным раствором соды для удаления уксусной кислоты (проба на лакмус). Раствор углекислого натрия следует прибавлять постепенно, так как жидкость сильно вспенивается выделяющимся диоксидом углерода. Затем отделяют нижний водный слой, а верхний эфирный слой встряхивают с насыщенным раствором хлористого кальция (8 г хлористого кальция в 8 см3воды) для удаления непрореагировавшего спирта (с первичными спиртами хлористый кальций дает кристаллическое молекулярное соединение СаСl2 2С2Н5ОН, которое нерастворимо в уксусноэтиловом эфире).
Снова отделяют верхний эфирный слой и сушат его безводным сернокислым натрием (не менее 2-х часов). После высушивания эфир перегоняют на водяной бане из колбы Вюрца с водяным холодильником (рис. В.2). При 71-75С будет отгоняться смесь спирта и уксусноэтилового эфира, а при 75-78С – сравнительно чистый уксусноэтиловый эфир.
Выход уксусноэтилового эфира 40 г.
Техника безопасности.Концентрированная уксусная кислота – едкая жидкость с резким удушающим запахом. Все подготовительные операции с ней проводить только под тягой. Сильно разъедает кожу, поэтому при попадании на нее немедленно смыть обильной струей воды и место ожога обработать раствором питьевой соды и опять водой. Уксусноэтиловый эфир и этанол – летучие огнеопасные жидкости, при работе с ними следует удалить источники открытого огня. Обладают слабым наркотическим действием.
studfiles.net
Сложные эфиры Получение уксусноэтилового эфира
Сложные эфиры применяются для получения альдегидов, кетонов и спиртов с помощью металлоорганических соединений (см. стр. 239), а также для получения первичных спиртов восстановлением. натрием в спиртовом растворе или литий-алюми-нийгидридом (см. стр. 200). Уксусноэтиловый эфир, или этил-ацетат, и уксусноизоамиловый эфир, или изоамилацетат, находят применение в технике как растворители и для других целей. Этилацетат приготовляется, кроме реакции этерификации, также из уксусного альдегида по реакции В. Е. Тищенко (см. стр. 252). Синтетически получаются также некоторые сложные эфиры, имитирующие природные эфирные масла, например искусственные фруктовые эссенции (грушевая эссенция — изоамилацетат, ананасная эссенция — этил-н-бутират, яблочная эссенция — изоамилизовалерат). [c.310] На рис. 47 изображен прибор для лабораторного получения уксусноэтилового эфира. В колбу, помещенную для регулирования температуры в масляную баню, наливают смесь 50 мл этилового спирта и 50 мл концентрированной серной кислоты. Смесь подогревают до 140° С и приливают к ней небольшой струей 400 мл смеси равных объемов спирта и уксусной кислоты. Образующийся сложный эфир и воду отгоняют в приемный сосуд, Отогнанный эфир взбалтывают для удаления примеси [c.253]Реакция этерификации органической кислоты в присутствии серной кислоты обычно идет в две стадии. Так, при получении уксусноэтилового эфира серная кислота вначале взаимодействует с этиловым спиртом, образуя сложный эфир серной кислоты, называемый этил- [c.242]
СЯ сложный эфир и воду отгоняют в приемный сосуд. Отогнанный эфир взбалтывают для удаления примеси кислоты с раствором соды и для удаления спирта с раствором хлористого кальция. Затем эфир отделяют от воды в делительной воронке (он легче воды н с водой не смешивается), сушат хлористым кальцием и снова перегоняют. Этот общепринятый метод получения уксусноэтилового эфира был предложен в 1873 г. В. В. Марковниковым, им же дано объяснение механизма протекающей реакции. [c.254]
Чтобы сместить равновесие в сторону образования продукта, т. е. повысить выход эфира, следует брать для реакции избыток кислоты или спирта или удалять из сферы реакции образующийся эфир или воду. При получении низкокипящих сложных эфиров (нанример, уксусноэтилового, т. кип. 77 °С) отгоняют из реакционной колбы эфир, а при получении высококипящих сложных эфиров (уксусноизоамилового, т. кип. 142 °С)—воду. [c.143]
Норма расхода сырья для получения 1 т уксусноэтилового эфира составляет 0,85 т уксусной кислоты и 0,652 т этилового спирта (в пересчете на 100%). Вычислить выход сложного эфира в процентах от теоретического. [c.65]
В одном из вариантов тривиальной номенклатуры сложных эфиров указываются кислота и спирт, из которых получен сложный эфир этиловый эфир уксусной кислоты, или уксусноэтиловый эфир,— из этилового спирта и уксусной кислоты изобутиловый эфир азотной кислоты, или азотноизобутиловый эфир,— из изобутилового спирта и азотной кислоты и т. д. [c.136]
Специфичны ли для винного спирта реакции получения уксусного альдегида и сложных эфиров (уксусноэтилового и бензойноэтилового) [c.62]
Другой способ сдвига реакции в сторону большего выхода эфира заключается в том, что удаляется одно из получающихся веществ из сферы реакции. При синтезе низкокипящих сложных эфиров отгоняется из реакционной колбы эфир, при получении высококипящих сложных эфиров отгоняется вода. Примером первого случая является получение уксусноэтилового эфира (т. кип. 77°) примером второго случая — получение уксусно-изоамилового эфира (т. кип. 42°). [c.112]
Пример 10. Реакции, связанные с получением сложных эфиров. Напишите уравнения всех реакций синтеза уксусноэтилового эфира из ацетилена [c.181]
Взаимодействие кислоты с металлами, основаниями, солями и спиртами (получение уксусноэтилового, уксусноизоамилового или другого сложного эфира). [c.21]
Часто применяется и другой способ сдвига равновесия в сторону большего выхода сложного эфира — удаление сложного эфира или воды из сферы реакции. Так, в случае получения низкокипящих сложных эфиров (например, уксусноэтилового с т. кип. 77° С) в ходе реакции отгоняют эфир из реакционной колбы. При получении высококипящих сложных эфиров (например, уксуснобутилового с т. кип. 125° с или уксусноизоамило-вого с т. кип. 142° С) удобнее отгонять воду в процессе реакции. Легко можно видеть, что уменьшение концентраций эфира йли воды влечет уменьшение концентраций спирта и кислоты, поскольку величина константы равновесия К при данной температуре неизменна. [c.74]
Поскольку реакция этерификации является обратимой, выход эфира тем больше, чем в большем избытке взят спирт или кислота и чем полнее удаляются из реакционной смеси сложный эфир и вода. Так, например, при получении бензойноэтилового эфира берется избыток спирта при получении уксусноэтилового эфира отгоняется эфир, так как он кипит при температуре, которая ниже температуры кипения воды при получении уксусноизоамилового эфира отгоняется вода, так как ее температура кипения ниже температуры кипения образовавшегося эфира. В последнем случае вода отгоняется в виде азеотропной смеси с темп. кип. 94° С. Такой способ получения эфира называют азеотропной этерификацией. Иногда связывают воду с помощью водоотнимающих средств (И2864, гпСЦ, СаС , А12(804)3 и др.). [c.166]
Подробный обзор экспериментальных данных, полученных до 1927 г., был составлен Рендаллом и Файлеем [64]. Этот материал, а также более поздние исследования по определению коэффициентов активности гелия, аргона и более сложных молекул, вроде уксусноэтилового эфира и диацетонового спирта, будут использованы для иллюстрации сложной природы наблюдаемых явлений. [c.375]
Получение уксусноэтилового эфира (203). Получение уксусноизоамилового эфира (206). Получение бензойноэтилового эфира (206). Получение салициловометилового эфира (207). Получение диметилового эфира щавелевой кислоты (207). Омыление сложных эфиров (207). Получение метилового эфира метакриловой кислоты из органического стекла (209). [c.266]
Из всех этих примеров ясно, что конденсация связана с наличием в сложном эфире, являющемся вторым компонентом реакции, свободного а-водородного атома (или, даже лучше, незамещенного метиленового звена, т. е. двух а-водородных атомов). По существу, реакция является ацилированием одним сложным эфиром другого по а-углеродному атому. Образующиеся сложные эфиры так и называются формил-уксусноэтиловый (реакция 1), ацетилуксусноэтиловый или, сокращенно, ацетоуксусный (реакция 2), щавелевоуксусный (реакция 3). Разумеется, полученные всеми этими реакциями сложные эфиры гидролизом могут быть превращены в свободные оксокислоты. [c.386]
Следует отметить, что в более ранних работах по получению замещенных ацетоуксусных эфиров химики осуществляли алкилирование непосредственно реакционной смеси, получающейся при сложноэфирной конденсации уксусноэтилового эфира. Однако в этих опытах, проведенных с применением металлического натрия в качестве конденсирующего средства для сложноэфирной конденсации, всегда получалась сложная смесь, состоящая из одно- и двузамещенных ацетоуксусных эфиров, я также эфиров одно- и двузамещенных уксусных кислот [1]. [c.685]
chem21.info
Синтез диэтиланилина
Уравнения основных реакций:
Реактивы
Основные:
| Анилин | 18.6 г. |
| Бромистый этил | 48 г. |
Вспомогательные:
| Едкий натр (25 %-ный) | 100 см3 |
Посуда и приборы:
| Колба круглодонная | 1 шт. |
| Холодильник обратный | 1 шт. |
| Холодильник нисходящий | 1 шт. |
| Трубка хлоркальциевая | 1 шт. |
| Воронка делительная | 1 шт. |
| Воронка коническая | 1 шт. |
| Электроплитка | 1 шт. |
Все детали прибора должны быть сухими!
В колбу загружают 18,6 г анилина, 24,0 г бромистого этила, присоединяют обратный холодильник и нагревают до кипения в течение 1,5 часа. В колбе образуется твердая масса бромоводородной соли моноэтиланилина. Колбу охлаждают и постепенно прибавляют 50 см325 %-ного раствора NаОН, при этом образуется два жидких слоя. Выделившийся моноэтиланилин (верхний жидкий слой) отделяют в делительной воронке, переливают в сухую колбу и сушат полчаса над твердой щелочью.
За это время прибор должен быть вымыт и высушен. Высушенный моноэтиланилин декантируют со щелочи в колбу, приливают 24 г бромистого этила и снова 2 часа осторожно кипятят с обратным холодильником до затвердевания всей массы.
К охлажденному продукту прибавляют 50 см325 % раствора NаОН, отделяют в делительной воронке диэтиланилин, высушивают твердой щелочью, декантируют и перегоняют, собирая фракцию при 214-216оС.
Выход диэтиланилина 20 г.
Техника безопасности.Анилин, относящийся к классу ароматичесих аминов, обладает токсичностью (проникает в организм через органы дыхания и через кожу. Поэтому все детали приборов при работе с ним должны быть тщательно уплотнены, а все операции по подготовке синтеза проводиться под тягой. Диэтиланилин - бесцветная маслянистая жидкость с неприятным запахом, ядовита; т. кип. 216С.
Ацилирование
Реакция ацилирования (определение). Ацильные радикалы, их номенклатура. Ацилирующие средства. Ряд активности ацилирующих средств. Влияние углеродного радикала и других группировок, связанных с карбонатом, на реакционную способность ацилирующих средств. Зависимость скорости реакции ацилирования от нуклеофильности реагента. Катализаторы и их роль в реакциях ацилирования.
Ацилирование спиртов. Реакция этерификации, ее механизм. Обратимость реакции и методы смещения равновесия. Факторы, влияющие на скорость реакции этерификации: катализатор, температура, строение кислоты и спирта. Реакция омыления сложных эфиров кислотами и основаниями и основаниями, ее механизм. Реакция переэтерификации. Реакции, сопутствующие этерификации: внутри- и межмолекулярная дегидратация спиртов.
Ацилирование фенолов. Условия проведения реакции и применяемые реагенты.
Сложные эфиры карбоновых кислот как фруктовые эссенции.
Синтез уксусноэтилового эфира
Уравнения основных реакций:
Побочные реакции:
Реактивы
Основные.
| Этиловый спирт, 95%-ный | 45 см3 |
| Уксусная кислота (ледяная) | 40 см3 |
Вспомогательные.
| Серная кислота | 5 см3 |
| Кальций хлорид | 8 г |
| Сода кальцинированная | |
| Дистиллированная вода (для приготовления раствора СаСl2) | 8 см3 |
| Сернокислый натрий Nа2SО4(безводный) |
Посуда и приборы
| Колба Вюрца (250 см3) | 1 шт. |
| Капельная воронка | 1 шт. |
| Холодильник Либиха | 1 шт. |
| Термометр | 1 шт. |
| Аллонж | 1 шт. |
| Колба коническая Эрленмейера (100 см3) | 2 шт. |
| Электроплитка | 1 шт. |
Выполнение синтеза
В колбу Вюрца (250 см3) , снабженную воронкой и соединенную с холодильником Либиха (Приложение В, рис.5), вливают 5 см3этилового спирта и 5 см3концентрированной серной кислоты и нагревают на электрической плитке с закрытой спиралью до 110-120С. (На этом этапе не следует сильно перегревать смесь спирта с серной кислотой, так как это может привести к разложению и обугливанию спирта и выделению едких паров диоксида серы (IV).Место капельной воронки на этом этапе заменяет термометр.Как только эта температура будет достигнута, начинают постепенно приливать из капельной воронки смесь 40 см3ледяной уксусной кислоты и 40 см3спирта с такой скоростью, с какой отгоняется образующийся эфир, при этом должна поддерживаться температура (110-120С), так как при более высокой температуре образуется диэтиловый эфир.
После окончания реакции содержимое приемника переносят в делительную воронку и промывают концентрированным раствором соды для удаления уксусной кислоты (проба на лакмус). Раствор углекислого натрия следует прибавлять постепенно, так как жидкость сильно вспенивается выделяющимся диоксидом углерода. Затем отделяют нижний водный слой, а верхний эфирный слой встряхивают с насыщенным раствором хлористого кальция (8 г хлористого кальция в 8 см3воды) для удаления непрореагировавшего спирта (с первичными спиртами хлористый кальций дает кристаллическое молекулярное соединение СаСl2 2С2Н5ОН, которое нерастворимо в уксусноэтиловом эфире).
Снова отделяют верхний эфирный слой и сушат его безводным сернокислым натрием (не менее 2-х часов). После высушивания эфир перегоняют на водяной бане из колбы Вюрца с водяным холодильником (Приложение В, рис.2). При 71-75 С будет отгоняться смесь спирта и уксусноэтилового эфира, а при 75-78С – сравнительно чистый уксусноэтиловый эфир.
Выход уксусноэтилового эфира 40 г.
Техника безопасности.Концентрированная уксусная кислота – едкая жидкость с резким удушающим запахом. Все подготовительные операции с ней проводить только под тягой. Сильно разъедает кожу, поэтому при попадании на нее немедленно смыть обильной струей воды и место ожога обработать раствором питьевой соды и опять водой. Уксусноэтиловый эфир и этанол – летучие огнеопасные жидкости, при работе с ними следует удалить источники открытого огня. Обладают слабым наркотическим действием.
studfiles.net
Синтез уксусноэтилового эфира - Справочник химика 21
Синтез уксусноэтилового эфира [c.74]Фурилакриловая кислота представляет лишь теоретический интерес. Эфиры ЭТОЙ КИСЛОТЫ, имеющие синтетическое значение, не могут быть получены из КИСЛОТЫ каким-либо удобным методом. Этиловый эфир 2-фу-рилакриловой кислоты служит в качестве промежуточного продукта для синтеза большого числа фурановых производных. Он легко получается конденсацией фурфурола с уксусноэтиловым эфиром в присутствии натрия [252]. [c.157]
А. э.— важный исходный продукт для приготовления фармацевтических препаратов — пирамидона, акрихина, витамина В1 и др., красителей для цветной кино- и фотопленки и других продуктов органического синтеза. А. э. получают конденсацией двух молекул уксусноэтилового эфира в присутствии катализаторов (натрия, этилата натрия) [c.37]Ацетальдегид находит широкое применение в промышленном органическом синтезе. Служит сырьем для получения уксусной кислоты, уксусноэтилового эфира, этанола, синтетических смол и т. д. [c.338]
Синтез уксусноэтилового эфира 129 [c.162]
ПРИМЕРЫ СИНТЕЗОВ УКСУСНОЭТИЛОВЫЙ ЭФИР [c.155]
Синтез уксусноэтилового эфира....... [c.230]
Ацетальдегид, получаемый из ацетилена, служит важным полупродуктом в промышленных синтезах спирта, уксусной кислоты, уксусноэтилового эфира (реакция Тищенко), кротонового и масляного альдегидов и целого ряда других продуктов. [c.152]
ПРИМЕРЫ СИНТЕЗОВ Уксусноэтиловый эфир [c.79]
Рчс. 29. Прибор для синтеза уксусноэтилового эфира полумикрометодом [c.80]
Классическим примером сложноэфирной конденсации является синтез ацетоуксусного эфира (этилового зфира ацето-уксусной кислоты) из уксусноэтилового эфира [c.340]Пример 10. Реакции, связанные с получением сложных эфиров. Напишите уравнения всех реакций синтеза уксусноэтилового эфира из ацетилена [c.181]
КАТЕХИНЫ — природные вещества, содержап(иеся в растениях, особенно чайных, виноградной лозе, в бобах какао. К.— бесцветные кристаллы с вяжущим вкусом, хорошо растворяются в воде, метаноле и этаноле, окрашиваются спиртовым раствором хлорида железа и зеленый цвет. К. относятся к группе флавана. Молекула К. содержит два асимметрических атома углерода для каждого К. известны 4 оптически активных изомера и 2 рацемата. К. можно разделить и извлечь влажным диэтиловым эфиром или смесью уксусноэтилового эфира с четыреххлористым углеродом. К. получают из растительного сырья, возможен синтез. К.— биологически высокоактивные вещества они регулируют проницаемость кровеносных капилляров и увеличивают упругость их стенок, способствуют лучшему усвоению организмами аскорбиновой кислоты. К. относят к веществам, обладающим Р-витаминной активностью, используют их для лечения заболеваний, связанных с нарушением функций капилляров. Окислительные [c.122]
Механизм реакции образования ацетоуксусного эфира был разобран выше. При проведении синтеза необходимо обратить внимание на тш,ательное высушивание как уксусноэтилового эфира, так и прибора, в котором проводится реакция. [c.179]
Прибор для проведения этого синтеза изображен на рис. 15. С одного конца прибора вводится фосген, а другой конец соединен с водоструйным насосом для создания небольшого разрежения. В 5-литровой колбе А насыщают при комнатной температуре фосгеном 500 мл сухого уксусноэтилового эфира (примечание 1). Фо- [c.383]
Уксусноэтиловый эфир (синтез дан на с. 210)......... 11 г [c.320]
Синтез проводится в приборе, изображенном на рис. 31, в. В трехгорлую колбу емкостью 500 мл помещают 7 г магниевой стружки и приливают смесь 7,5 г бромбензола с 18 мл абсолютного эфира. Колбу осторожно нагревают до начала реакции, после чего пускают в ход мешалку и колбу погружают в холодную воду. Из капельной воронки добавляют смесь 38 г бромбензола и 95 мл абсолютного эфира с такой скоростью, чтобы жидкость в колбе кипела. Когда все количество бромбензола будет прибавлено, перемешивание продолжают еще 10 мин. После этого реакционную смесь охлаждают погружением колбы в ледяную воду и постепенно приливают к ней смесь И г сухого уксусноэтилового эфира (примечание 1 и 2) и равного объема диэтилового эфира. По окончании прибавления эфира охлаждение прекращают, а перемешивание продолжают еще 10 мин. После этого колбу опять охлаждают ледяной водой и приливают в течение 3 мин, сначала очень медленно, раствор 12,5 г хлористого аммония в 38 мл воды, при этом выпадает пастообразный осадок. [c.334]
Уксусноэтиловый эфир (синтез дан на с. 210).......50 г(0,57 г-мол) [c.345]
Классическим примером сложноэфирной конденсации является синтез ацетоуксусного эфира из уксусноэтилового эфира в присутствии металлического натрия или этилата натрия. [c.276]
При синтезе ацетоуксусного эфира избыток уксусноэтилового эфира не только служит растворителем, но и препятствует образованию побочных продуктов сс-дикетона и ацилоина, которые могут получаться в присутствии больших количеств натрия. [c.277]
Первая практическая работа — синтез уксусноэтилового эфира прямой этерификацией. Мастер производственного обучения напоминает учащимся, что эта ошовная реакция пол)П1ения сложных эфиров обратима например, при взаимодействии этилового спирта и уксусной кислоты образуются уксусноэтиловый эфир и вода, которые, в свою очередь, могут взаимодействовать между собой, образуя исходные соединения [c.160]
Уксусноэтиловый эфир (этилацетат) СНдСООСаНг,. Представляет собой бесцветную жидкость с характерным запахом. Темп. кип. 77,2° С с( =0,901, довольно трудно растворим в воде. В технике широко используется как растворитель, особенно высокомолекулярных соединений — пластмасс входит в состав лаков и т. п. Применяется как исходное вещество в некоторых синтезах. [c.183]
Ацетальдегид СН3СНО используют в синтезе уксусной кислоты, этилового спирта, уксусноэтилового эфира и других важных продуктов. [c.287]
Выход ацетоуксусного эфира зависит от качества взятого уксусиоэтнлового эфнра. Он должен быть свободен от влаги и содержать не более 2% спирта. Обычно уксусноэтиловый эфир содержит большие количества спирта, что вызывает слишком бурную реакцию н снижает выход. Продажный эфир следует промыть насыщенным раствором хлористого кальция и высушить над сплавленным углекислым калием. Синтез ацетоуксусного эфира следует заканчивать в течение одного дня, так как перерыв в работе отрицательно влияет на выход. [c.179]
Синтез бензоилацетона является примером получения [3-дике-тонов в результате конденсации энолята кетона с уксусноэтиловым эфиром. [c.182]
Синтез этилового эфира а-гексилкратоновой кислоты. В двугорлой колбе, снабженной обратным холодильником, к 45 мл этилового спирта добавляют 0,9 г металлического натрия. После полного растворения натрия по каплям добавляют 81,6 г (0,3 моль) гексил-а-метоксиэтилацетоуксусного эфира. Смесь кипятят с одновременной отгонкой на колонке Вигре вы сотой 60 см образующегося уксусноэтилового эфира. После полной отгонки уксусноэтилового эфира нагревание прекра щают. К смеси добавляют 300 мл 5% -ной серной кислоты, вы делившийся эфирный слой отделяют, а водный трехкратно эк страгируют эфиром по 20 мл. Соединенные эфирные вытяжкг промывают 30 мл 10%-ного раствора бикарбоната натрия, за тем 30 мл воды и высушивают прокаленным сульфатом нат рия. Эфир отгоняют, а остаток перегоняют при пониженном давлении, собирая фракцию с т. кип. 9273 мм. [c.77]
Ацетоуксусный эфир можно получить кляйзеновской конденсацией уксусноэтилового эфира, присоединением этанола к дикетену или конденсацией ацетона с диэтиловым эфиром угольной кислоты. Эти пути синтеза через другие промежуточные стадии показывают, что исходными могут быть еще более простые вещества. В итоге получается, что исходными веществами могут быть пропилен и уксусная кислота. Теперь, руководствуясь определенными критериями (такими, например, как выход на отдельных стадиях синтеза, стоимость необходимых реагентов, длительность синтезов и т. д.), следует решить, какой же из путей синтеза наиболее целесообразен. [c.616]
Магнийорганическое соединение получают так же, как в предыдущем синтезе, но количества бромбензола и магния берут в два раза большие, так как в реакцию вступают две молекулы магнийбромфенила и одна молекула уксусноэтилового эфира (примечание). Реакцию проводят обычным путем. После промывки соединенных эфирных растворов содой их сушат безводным поташом, отгоняют эфир и оставшийся в колбе метилдифенилкарбинол перекристаллизовывают из лигроина (или из этилового спирта). Выход 15 г (60% теоретического), т. пл. 78° С. [c.321]
Синтез проводят в приборе, изображенном на рис. 21. В круглодонную колбу емкостью 200 мл наливают 50 г уксусноэтилового эфира (примечание 1), вставляют двурогий форштос, соединенный с обратным холодильником, верхний конец которого закрыт хлоркальциевой трубкой, и через второе отверстие форштоса, приоткрывая пробку, вносят 5 г мелконарезанного металлического натрия (примечание 2) и затем закрывают его пробкой. Вначале водород выделяется очень медленно, через некоторое время реакция заметно ускоряется. После того как течение реакции несколько замедлится, колбу нагревают на масляной бане и температуру регулируют так, чтобы уксусноэтиловый эфир слабо кипел (температура бани должна быть не выше 100—110° С). Смесь нагревают 3 ч, причем почти весь натрий растворяется (примечание 3). Жидкость охлаждают и осторожно подкисляют 30 мл 50 %-ной уксусной кислоты. Затем высаливают насыщенным раствором хлористого натрия и отделяют слой ацетоуксусного и уксуснозтилового эфира от нижнего, водного слоя. Промывают эфиры небольшим количеством насыщенного на холоду раствора бикарбоната натрия. Затем, осторожно нагревая на сетке, отгоняют уксуснозтиловый эфир, отбирая фракцию до 95° С. Оставшийся ацетоуксусный зфир перегоняют в вакууме. Температура кипения ацетоуксусного эфира при различных остаточных давлениях [c.346]
Синтез проводят в приборе, изображенном на рис. 21. В круглодонную колбу емкостью 250 мл, снабженную двурогим форштосом с капельной воронкой и обратным холодильником, закрытым сверху хлоркальциевой трубкой, помещают 80 мл абсолютного эфира и вносят 2,4 г тонконарезанного натрия. Затем прибавляют 15 г диэтилового эфира щавелевой кислоты и далее через капельную воронку медленно, по каплям, приливают хорошо высушенный згксусноэтиловый эфир (12 мл, т. е. 10,8 г). Реакция начинается сама собой. После того как весь уксусноэтиловый эфир прибавлен, реакционную смесь нагревают на водяной бане при 30° С до тех пор, пока весь натрий не растворится (на что требуется около 1,5 ч) и оставляют стоять в течение ночи. [c.347]
Применяемый уксусноэтиловый эфир должен быть сухим и содержать около 2—3"/ спирта продажный уксусноэтиловый эфир следует промыть двойным по объему количеством воды, высушить над плавленным поташсм, декантировать и немедленно использовать в синтезе. [c.79]
chem21.info
Синтез этилового эфира уксусной кислоты (этилацетата
СЛОЖНЫЕ ЭФИРЫ
При демонстрации способа получении сложных эфиров образующийся продукт обычно собирается в виде слоя над жидкостью, что трудно наблюдать учащимся на расстоянии. Наиболее убедительный признак образования эфира — появление характерного запаха. Поэтому первое ознакомление с получением эфиров лучше всего провести в виде лабораторного опыта.
Чтобы иметь возможность познакомить учащихся с получением различных эфиров и сделать заключение о том, что реакция этерификации является общей для образования веществ данного класса, можно одновременно дать учащимся синтез разных эфиров (например, метилового, этилового эфиров уксусной кислоты, этилового эфира муравьиной кислоты и др.).
Синтез этилового эфира уксусной кислоты (этилацетата). Опыт можно поставить так, чтобы одновременно показать влияние катализатора (серной кислоты) на скорость процесса.
1. В пробирку наливают 0.5 мл концентрированной уксусной кислоты (эссенции) и равный объем этанола. Запах эфира не обнаруживается даже при подогревании смеси.
После этого в пробирку добавляют 0,5—1 мл концентрированной серной кислоты. Появляется запах эфира, усиливающийся при дальнейшем нагревании.
2. В широкую пробирку (колбочку) наливают по 3 мл спирта, уксусной кислоты и концентрированной серной кислоты. Пробирку закрывают пробкой с обратным холодильником для конденсации паров спирта и эфира и нагревают в стакане с кипящей водой в течение 3—5 мин. Затем выливают жидкость в пробирку с насыщенным раствором поваренной соли. Серная кислота, а также не прореагировавшие спирт и уксусная кислота растворяются, эфир же высаливается и образует верхний слой, при этом ощущается сильный запах. Переливают смесь в делительную воронку и отделяют эфирный слой.
3. В небольшую колбу с отводной трубкой наливают по 10 мл этанола и уксусной кислоты и 5 мл концентрированной серной кислоты. Соединяют колбу с нисходящим холодильником (желательно водяным, так как точка кипения эфира 77°С) и отгоняют на кипящей водяной бане образующийся сложный эфир (до уменьшения объема в колбе наполовину).
Реакция этерификации обратима, но в этих условиях равновесие сдвигается вправо вследствие улетучивания эфира.
СН3СООН + НОС2Н5 СН3СООС2Н5 + Н2O
Вместе с эфиром частично перегоняется спирт и в некоторой степени уксусная кислота (обычно спирт для реакции берут в избытке по сравнению с теоретически рассчитанным количеством).
Добавляют немного воды к дистилляту и смесь взбалтывают. Кислота и спирт растворяются в воде, эфир собирается слоем сверху. Демонстрируют продукт в таком виде или после отделения от водного слоя с помощью делительной воронки.
. Получающийся эфир содержит еще некоторое количество спирта, кислоты и воды. Однако дальнейшая очистка его в условиях демонстрационного опыта нецелесообразна.
4. Чтобы убедительно показать учащимся отщепление воды oт молекул спирта и кислоты при этерификации, можно провести реакцию, взяв в качестве катализатора безводный сульфат меди. Посинение последнего укажет на образование воды в ходе реак-
ции. Некоторая сложность проведения опыта связана с тем, что для реакции требуются безводные реагенты (кислота и спирт).
В колбочку (рис. 34) наливают равные объемы спирта и кислоты и помещают 1—2 г безводного сульфата меди. К колбе присоединяют обратный холодильник с хлоркальциевой трубкой для защиты от атмосферной влаги. При встряхивании колбы уже без нагревания начинается постепенное посинение сульфата меди, что указывает на начало реакции. При нагревании смеси на водяной бане в течение 10 мин соль довольно быстро синеет и образуется значительное количество эфира. Запах становится очень сильным при выливании смеси в насыщенный раствор хлорида натрия.
5. С целью получения чистого образца этилацетата опыт ставят следующим образом (рис. 35).
В круглодонную колбу с капельной воронкой и отводной трубкой наливают 10 мл спирта и 10 мл концентрированной серной кислоты. Колбу нагревают через асбестированную сетку, чтобы термометр, опущенный в жидкость, показывал примерно 120°С, и добавляют из капельной воронки смесь 20 мл спирта и 20 мл уксусной кислоты с той же скоростью, с какой отгоняется эфир.
Чтобы освободить дистиллят от примеси уксусной кислоты, его нейтрализуют, добавляя постепенно насыщенный раствор карбоната натрия, контролируя с помощью лакмусовой бумажки рН среды. Смесь при этом пенится, особенно вначале, от выделяющегося углекислого газа. Отделяют эфир от водного слоя с помощью делительной воронки, взбалтывают с 10—15 мл 50-процентного водного раствора хлорида кальция. Хлорид кальция образует со спиртом молекулярное соединение и тем самым очищает эфир. Снова на делительной воронке отделяют эфир, добавляют к нему безводный сульфат натрия для связывания воды и перегоняют на водяной бане при температуре 77°С.
Получение этилового эфира бензойной кислоты (этилбензоата). В данном случае процесс этерификации протекает согласно следующему уравнению реакции:
С6Н5СООН + НОС2Н5 С6Н5СООС2Н5 + Н2О
В пробирке растворяют 1 г бензойной кислоты в 3-4 мл спирта и добавляют 7—8 капель концентрированной серной кислоты. При нагревании ощущается мятный запах эфира. При выливании в воду эфир всплывает наверх.
Синтез аспирина. Уксусный ангидрид является сильным ацилирующим средством и часто используется для получения сложных эфиров.
Ацилируя им салициловую кислоту (по фенольному гидроксилу), можно получить широко известное лекарственное средство — аспирин:
Как видно из формулы, аспирин одновременно является и ароматической кислотой, и сложным эфиром.
Для опыта взвешивают 1,3 г салициловой кислоты и 1,2 г уксусного ангидрида. Помещают вещества в небольшую колбочку, прибавляют к ним каплю концентрированной серной кислоты, за-
крывают колбу пробкой с обратным холодильником и нагревают смесь на водяной бане при 60°С в течение часа. Затем продолжают нагревание еще в течение часа при 90°С. После этого смесь в колбе охлаждают; отфильтровывают кристаллы аспирина (лучше это сделать на воронке Бюхнера) и промывают осадок ледяной водой. Для получения более чистого препарата необходимо дополнительно промыть его небольшим количеством холодного толуола. Сухой осадок взвешивают и определяют выход продукта по сравнению с теоретическим.
С аспирином можно проделать ряд опытов, но, разумеется, из-за недостаточной чистоты нельзя принимать его в качестве лекарства.
Гидролиз сложных эфиров. Опыты по гидролизу сложных эфиров расширяют общие представления учащихся о химической реакции, так как в весьма наглядной форме дополняют их сведениями об обратимости реакций и роли катализаторов.
Как известно, гидролиз катализируется минеральными кислотами, которые служат катализаторами и в реакции этерификации:
Не сдвигая равновесия в ту или другую сторону, минеральные кислоты значительно ускоряют наступление равновесия. Гидролиз эфиров в очень сильной степени ускоряется в присутствии щелочей, так как они связывают (превращают в соль, т.е. омыляют) образующуюся кислоту, вследствие чего реакция идет до конца в сторону разложения эфира.
а) В три пробирки помешают по нескольку капель этилацетата. В одну пробирку приливают воду в таком количестве, чтобы эфир только растворился в ней, в другую пробирку приливают раствор щелочи, в третью — раствор серной кислоты. Пробирки встряхивают и оставляют стоять или нагревают на водяной бане (в стакане с горячей водой). Через некоторое время убеждаются, что в пробирке со щелочью запах эфира быстро исчезает, в пробирке с кислотой он ослабевает, а в пробирке с водой остается без изменений.
В пробирке с кислотой удается обнаружить нары уксусной кислоты с помощью влажной лакмусовой бумажки (серная кислота нелетуча). В пробирке с водой не удается обнаружить кислоту даже в растворе (если препарат эфира был чистым).
б) В две пробирки помещают по 2 мл этилового эфира бензой-
ной кислоты. В одну пробирку приливают около 8 мл раствора серной кислоты (1 : 1), в другую — такой же объем воды. Нагревают пробирки в течение нескольких минут в пламени спиртовки. При охлаждении в первой пробирке выпадает осадок — кристаллы бензойной кислоты, во второй пробирке осадок не образуется, так как гидролиз не прошел.
в) В колбочку наливают 1 мл этилацетата и растворяют его в воде (около 20 мл). Убеждаются, что раствор (в отдельной пробе) не изменяет окраски лакмуса. Добавляют к раствору в колбе 2—3 капли фенолфталеина и очень немного раствора гидроксида натрия, чтобы только появилось не исчезающее при взбалтывании розовое окрашивание. Закрывают колбу пробкой с обратным холодильником и нагревают смесь в пламени горелки до кипения, после чего дают смеси остыть. Окраска фенолфталеина исчезает, так как щелочь нейтрализуется образующейся при гидролизе кислотой. Добавляют еще несколько капель щелочи и снова нагревают смесь до исчезновения окраски,
Прибавляя к образующемуся нейтральному раствору раствор хлорида железа (III), убеждаются в появлении уксусной кислоты при гидролизе эфира.
г) При длительном омылении эфира щелочью можно провести глубокий гидролиз и не только обнаружить, но и выделить образующиеся продукты.
Опыт можно дать для самостоятельной разработки учащимися.
Идея его такова. Если эфир кипятить со щелочью (25—30-процентной), взяв ее с некоторым избытком против количества, необходимого для нейтрализации образующейся кислоты, то через некоторое время эфирный слой вследствие гидролиза совершенно исчезнет. Чтобы эфир и спирт при этом не улетучивались (уксусная кислота будет в виде соли), кипячение следует вести в колбе с обратным холодильником. Пары спирта после окончания опыта .могут быть обнаружены по их горению. Кроме того, спирт можно отогнать и обнаружить иодоформной реакцией. Раствор ацетата натрия со щелочью можно обработать концентрированной серной кислотой, после чего отогнать уксусную кислоту.
Гидролиз аспирина. По месту сложноэфирной группировки аспирин может подвергаться гидролизу с образованием салициловой и уксусной кислот:
Салициловая кислота, содержащая в молекуле фенольный гидроксил, может быть обнаружена при помощи раствора хлорида железа (III).
Очень небольшое количество аспирина (примерно 0,1 г) растворяют в 4—5 мл воды. Часть раствора испытывают 1—2 каплями раствора хлорида железа. Характерной для фенолов окраски не наблюдается.
Другую часть раствора аспирина кипятят 2—3 мин и после охлаждения также испытывают хлоридом железа. В данном случае наблюдается характерное окрашивание, свидетельствующее о появлении в растворе салициловой кислоты (фенольного гидроксила).
Получение метилового эфира метакриловой кислоты (метилметакрилата) из органического стекла. Органическое стекло (плексиглас) широко применяется сейчас в технике и для изготовления многих предметов повседневного обихода (чернильницы, ручки, шкатулки, мундштуки, пуговицы и т.п.). Оно представляет собой полимер метилового эфира метилакриловой (метакриловой) кислоты
Строение полимера можно изобразить в виде следующей схемы:
В предыдущих темах учащиеся познакомились со свойствами высокомолекулярных веществ и с их получением путем полимеризации и поликонденсации. На примере данного эфира можно их познакомить с разложением (деполимеризацией) высокомолекулярного продукта.
Опыт очень легко осуществляется и производит большое впечатление на учащихся.
В пробирку или колбочку с отводной трубкой и нисходящим воздушным холодильником насыпают стружки или мелкие кусочки органического стекла. Нагревая колбу через асбестовую сетку или на голом пламени, деполимеризуют органическое стекло и перегоняют образующийся при этом эфир. Перегонку можно производить без контроля термометром. До полного разложения всего органического стекла опыт лучше не доводить, так как продукт начинает обугливаться и колбу после опыта бывает трудно отмыть. В
приемнике собирается прозрачная, бесцветная жидкость с эфирным запахом — метилметакрилат.
Если эфир имеет слегка желтую окраску, его повторно перегоняют. отбирая фракцию в интервале 97-103°С (чистый эфир кипит при 100°С).
Получение полиметилметакрилата. Превращение метилового эфира метакриловой кислоты в высокомолекулярный продукт — полиметилметакрилат — наиболее доступный для школы пример реакции полимеризации.
Наливают в пробирку около 10 мл очищенного метилметакрилата. добавляют очень немного сухой перекиси бензоила (0,05 г) и встряхивают до растворения.
Затем реакционную смесь нагревают на водяной бане при 80— 85°С. Через 15-20 мин замечается увеличение вязкости жидкости. При дальнейшем нагревании жидкость постепенно превращается в твердую стекловидную массу. Пробирку разбивают и извлекают стерженек образовавшегося полимера. Можно получить окрашенный образец, если к исходному мономеру добавить небольшое количество органического красителя. Иногда полимеризацию метилового эфира метакриловой кислоты удастся наблюдать без применения катализатора при длительном стоянии жидкости.
Опыты с полиметилметакрилатом. Кроме деполимеризации с полиметилметакрилатом можно провести следующие опыты.
а) Нагревают над пламенем горелки или на асбестовой сетке пластинку из органического стекла, затем сгибают ее. Убеждаются, что полимер обладает свойством термопластичности.
б) Поджигают кусочек полиметилметакрилата. Он горит голубым некоптящим пламенем с характерным потрескиванием; ощущается эфирный запах.
ЖИРЫ
Школьные опыты по разделу жиров немногочисленны. Но так как жиры играют исключительную роль в жизни человека и учащиеся повседневно имеют с ними дело, следует стремиться к тому, чтобы на внеклассных занятиях и в виде домашних работ был поставлен с жирами целый комплекс работ практического значения.
Растворимость жиров. В 4 пробирки наливают по 1 мл воды, спирта, бензина и эфира и помещают примерно по одинаковому кусочку жира или по нескольку капель растительного масла. Про-
бирки встряхивают и наблюдают, что жир лучше всего растворяется в эфире. Пробирки, где растворение идет плохо, подогревают на горелке. Убеждаются, что в воде жир не растворяется даже при нагревании.
Несколько капель раствора жира в эфире и бензине наносят на фильтровальную бумагу. Наблюдают образование жирных пятен на бумаге после испарения растворителя.
Экстрагирование жиров и масел. Растворимостью жиров и масел в органических растворителях пользуются для извлечения их из отходов скотобоен, из семян, а также для удаления жировых пятен с одежды и т.д. В качестве растворителей используются, кроме указанных выше веществ, дихлорэтан С2Н4СI2, четыреххлористый углерод ССI4 и др.
а) В небольшую колбочку насыпают 5 г предварительно измельченных в ступке сухих семян льна или подсолнечника и наливают 10—15 мл бензина, дихлорэтана или четыреххлористого углерода.
Измельчение семян должно быть по возможности тщательным. С этой целью растирание можно производить, смешав семена с чистым речным песком. Колбу закрывают пробкой с обратным холодильником и кипятят на горелке через асбестовую сетку в течение 10—15 мин. Затем отфильтровывают раствор жира и наблюдают жировое пятно на бумаге после испарения растворителя. Образование небольшого количества масла можно наблюдать и при осторожном выпаривании из фарфоровой чашки.
б) Довольно простой способ извлечения масла состоит в следующем: 2-3 г тонко измельченных в ступке семян подсолнечника или льна помещают в колбу, приливают 25—30 мл диэтилового эфира и закрывают колбу корковой пробкой. Встряхивают колбу время от времени в течение часа. Полученный раствор масла в эфире фильтруют (при погашенных горелках). Остаток семян в колбе промывают дважды небольшими порциями эфира, которые затем также фильтруют и присоединяют к основному раствору. Эфир отгоняют из раствора на водяной бане.
Учащимся может быть предложено произвести необходимые взвешивания при проведении опыта и вычислить содержание масла в семенах.
в) В лаборатории для извлечения масел из семян часто пользуются специальными приборами — экстракторами. Экстрактор (рис. 36) состоит из трех частей: колбы, где нагревается растворитель, экстрактора, где происходит процесс растворения, и обратного холодильника, предназначенного для улавливания паров растворителя.
Измельченные семена или другой материал, подвергающийся экстракции, помещают в гильзу из фильтровальной бумаги. Гильзу готовят, свертывая полоску фильтровальной бумаги в трубку и загибая края на одном конце внутрь трубки. В такую гильзу сначала помещают немного ваты, затем на нее насыпают материал, подвергаемый экстракции, снова кладут немного ваты и загибают внутрь верхние края гильзы. Гильзу помещают в экстрактор, а в колбу наливают растворитель (диэтиловый эфир) и герметично соединяют части аппарата. Нагревают колбу на водяной бане. Пары растворителя поднимаются в холодильник (обязательно заполненный водой) и конденсируются в нем. Жидкость из холодильника стекает в экстрактор, растворяет вещество и, заполнив экстрактор до определенного уровня, переливается по зигзагообразной сифонной трубке в колбу. За час кипячения растворителя может произойти 6—8 заполнений экстрактора и возвращений жидкости в колбу. Концентрация экстрагируемого вещества в колбе при этом все время возрастает. После отгонки растворителя получают нужный продукт.
Плавление и затвердевание жиров. Жиры представляют собой смесь различных веществ, преимущественно эфиров глицерина. Поэтому они, как и нефть, не имеют постоянной температуры кипения и плавления. Температурой плавления жира считается та конечная температура, при которой плавящийся жир превращается в прозрачную жидкость. Температурой застывания считается та максимальная температура, при которой происходит затвердевание жира.
Определение температуры плавления и затвердевания жира может быть выполнено в приборе, изображенном на рис. 37.
В пробирку помешают 2—5 г жира и закрывают пробкой с двумя отверстиями. Через одно отверстие проходит термометр, шарик которого находится в жире. Другое отверстие служит для выхода воздуха. Нагревают пробирку с жиром в стакане с водой. Наблюдают начало плавления жира, но в качестве температуры плавления отмечают ту температуру, при которой жир становится прозрачным.
Для определения температуры затвердевания в пробирку наливают растительное масло и охлаждают снегом или смесью снега с солью (в зависимости от сорта масла).
Чтобы охлаждение его было более равномерным, масло необходимо постоянно помешивать.
Когда масло начнет затвердевать, понижение столбика ртути вначале прекращается, затем уровень ртути немного повышается, после чего снова начинает падать. Максимальную температуру отмечают как температуру застывания масла.
Реакции непредельных жиров (масел). Растительные масла в своем составе содержат глицсриды непредельных кислот, таких как, олеиновая, линоленовая и др. Известно, что эти кислоты способны обесцвечивать бромную воду и раствор перманганата калия. Отметим, что аналогичным образом они ведут себя и в связанном состоянии, в виде жира.
а) В демонстрационную пробирку
наливают 5 мл жидкого масла (льняное, подсолнечное и др.) и концентрированную бромную воду (насыщенный раствор). При встряхивании пробирки бром обесцвечивается (белый фон!), образуется твердый продукт присоединения брома к глицериду. Таким же способом можно провести реакцию с раствором перманганата калия и испытать на непредельность другие масла (оливковое, кокосовое, рыбий жир).
Испытание различных масел с помощью перманганата калия может быть дано в качестве домашнего задания.
б) Кроме брома к непредельным жирам по месту двойной связи присоединяются хлор и иод. К 3—5 мл растительного масла добавляют 5 капель спиртового раствора йода. Встряхивают смесь и прибавляют к ней раствор крахмала. Синее окрашивание не образуется, так как иод вступил в реакцию с жиром. В контрольном опыте наблюдают синее окрашивание.
Реакцию с йодом используют на практике для характеристики жиров, так как по количеству расходуемого йода на насыщение двойных связей, по так называемому йодному числу, можно судить о степени непредельности жира.
Определение степени непредельности жиров. В непредельных углеводородных радикалах жиров может содержаться различное количество двойных связей. О степени непредельности жиров можно судить по количеству обесцвечиваемой ими бромной воды.
В пробирки помещают по 2-3 капли различных жиров (твердые жиры предварительно растапливают): свиного сала, коровьего масла, подсолнечного масла и др. Приливают к жирам по 1 мл четыреххлористого углерода или другого органического растворителя. Затем из бюретки добавляют в пробирки раствор брома до тех пор. пока окраска его не будет исчезать.
Сравнивают количество бромной воды, пошедшей на реакцию с разными жирами, и располагают жиры в ряд по возрастающей степени непредельности.
Определение содержания кислот в жирах. В жирах обычно всегда содержится некоторое количество свободных жирных кислот. Количество кислот возрастает при длительном хранении жиров вследствие частичного их разложения. С разложением жиров связано их прогоркание. О количестве кислот в жире можно сулить по количеству щелочи, идущей на нейтрализацию их в определенной навеске жира: по так называемому числу кислотности. Можно поставить два параллельных опыта: определение числа кислотности в свежем и прогорклом масле.
В конической колбочке растворяют 2 г животного масла в смеси 5 мл спирта и 5 мл эфира. К раствору добавляют 2 капли фенолфталеина и титруют 0,1 М раствором щелочи (добавляя его из бюретки по каплям) до появления розовой окраски, остающейся после встряхивания.
Вычисляют, сколько миллилитров раствора щелочи расходуется в том и другом случае на нейтрализацию 100 г жира. Убеждаются, что кислотное число прогорклого масла выше, чем свежего.
Омыление жиров. Получение мыла из жиров может быть выполнено в различных вариантах. Эти варианты отличаются друг от друга как по степени полноты гидролиза жира, так и по тому, в водной или спиртовой среде производится омыление. Производственный процесс осуществляется, как известно, в водной среде, но так как он идет довольно медленно, то на уроке омыление можно провести в спиртовом растворе. Спирт, обладающий свойством растворять не только щелочь, но и жир, создает гомогенную среду, что значительно ускоряет реакцию.
а) К 4—5 г топленого свиного сала или коровьего масла в колбочке приливают смесь 10 мл спирта, 5 мл воды и 2—3 г едкого кали. Колбочку закрывают пробкой с воздушным обратным холодильником (для конденсации паров спирта) и нагревают на горелке, время от времени перемешивая жидкость. Примерно через 10 мин кипячения омыление заканчивается, так как проба целиком растворяется в горячей дистиллированной воде (отсутствие жира). Часть полученного раствора выливают в стаканчик с 20—25 мл насыщен-
ного раствора поваренной соли. На поверхности выделяется (высаливается) мыло, которое собирают, отжимают в тряпке и используют для опытов (растворение в воде, образование пены, выделение жирных кислот при действии на него минеральных кислот). К другой части раствора прибавляют соляную кислоту. Выделяются нерастворимые в воде жирные кислоты.
б) В большой фарфоровой чашке расплавляют 10 г свиного или говяжьего жира и прибавляют 30 мл 30—35-процентного водного раствора щелочи. Смесь кипятят в пламени горелки, помешивая стеклянной палочкой, остерегаясь разбрызгивания. По мере выкипания в чашку добавляют воду. Минут через 10-15 пипеткой отбирают немного жидкости в пробирку с горячей водой. При взбалтывании получается непрозрачный раствор (эмульсия), так как часть жира к этому времени еще не разложится. Нагревание продолжают до тех пор, пока проба будет полностью растворяться в воде, образуя обильную пену. Это наступает примерно через час или более. После этого раствор упаривают минут 10 до образования густой массы (клеевого мыла) и охлаждают.
Часть полученного раствора выливают в стакан с насыщенным раствором хлорида натрия. Мыло всплывает в виде хлопьев (высаливается). Его собирают, отмывают, если нужно, водой от щелочи, а затем сплавляют в однородную массу. Пробуют мыть им руки и выполняют опыты, описанные ранее (с. 126).
Часть раствора обрабатывают соляной кислотой до выделения слоя жирных кислот. Если жидкость охладилась, кислоты выделяются в виде твердого слоя. Отфильтровывают осадок кислот, а фильтрат нейтрализуют осторожно содой и выпаривают медленно на водяной бане (не на голом огне, так как при сильном нагревании глицерин улетучивается с парами воды). Получают сиропообразный раствор глицерина. До полного удаления воды процесс можно не доводить.
Неудовлетворительные результаты опыта бывают иногда из-за того, что у учащихся не хватает терпения провести гидролиз до конца, и поэтому вместо мыла они иногда извлекают неразложившееся сало и, конечно, получают совершенно отрицательный результат при попытке вымыть этим продуктом руки.
В качестве классной демонстрации этот опыт может быть осуществлен в следующих вариантах:
1. Готовят смесь веществ для опыта, как сказано выше, и начинают ее нагревать. После этого сразу же переходят к опыту, начатому учащимися на внеклассных занятиях, в котором омыление жира доведено почти до конца. Заканчивают омыление, как указано выше, извлекают полученные продукты, устанавливают их природу.
2. Если урок химии двухчасовой, то начинают опыт, как указано выше, и поручают вести его подготовленному для этой цели ученику. Пока опыт идет, в классе разбираются следующие вопросы урока (например, получение стеарина, мыла и глицерина в промышленности, гидрогенизация жиров, проблема синтеза жиров и т.п.). Когда гидролиз в опыте закончится, внимание учащихся снова привлекается к нему, и последующие операции по выделению и исследованию продуктов служат одновременно средством повторения и закрепления материала.
ГЛАВА IX
УГЛЕВОДЫ
Тема «Углеводы» по насыщенности экспериментом занимает одно из первых мест в курсе органической химии. Здесь могут быть ярко показаны свойства веществ, играющих исключительную роль в жизни человека; здесь находят практическое использование ранее полученные учащимися знания (распознавание многоатомных спиртов, альдегидов и т.п.), дополняется экспериментальный материал предыдущих тем (получение спирта из полисахаридов), раскрываются важные процессы современной химической промышленности (гидролиз древесины, получение искусственного шелка и др.).
refdb.ru