Содержание
Простой эфир — гликоль — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Простые эфиры гликоля, например диоксан, применяются как ценные растворители.
[1]
Простые эфиры гликоля, например д и о к с а н, применяются как ценные растворители.
[2]
| Физические свойства моноэфиров этиленгликолей.
[3] |
Простые эфиры гликолей с близкой молекулярной массой обладают схожими свойствами. Замещение водорода гидроксильнон группы гликоля уменьшает вероятность межмолекулярной водородной связи, поэтому моно — и особенно диэфиры гликолей кипят прп более низкой температуре и имеют меньшую плотность, чем сами гликоли.
[4]
| Температуры кипения и плотности простейших эфиров гликолей.
[5] |
Области применения простых эфиров гликоля чрезвычайно-разнообразны. Однако количество изученных простых эфиров гликолей очень незначительно.
Однако количество изученных простых эфиров гликолей очень незначительно.
[6]
В слабощелочной среде простые эфиры гликолей не способны образовывать новые связи и поэтому могут длительное время храниться без изменений [52]; увеличение концентрации щелочи более 1 % и нагревание способствуют их осмолению.
[7]
В обычных условиях простые эфиры гликолей не подвергаются гидролизу и достаточно стабильны. Особенно сильно проявляется электронодонорная способность простых эфиров гликоля у 1 4-диоксана.
[8]
Окисление и самоокисление простых эфиров гликолей является автокаталитическим процессом, который идет уже при комнатной температуре и ускоряется при нагревании или повышении давления кислорода.
[9]
Следует упомянуть также о салицилатах моноалкиловых простых эфиров гликолей с числом атомов углерода в алкильном остатке более двух. Такие салицилаты, по-видимому, являются универсальными пластификаторами за.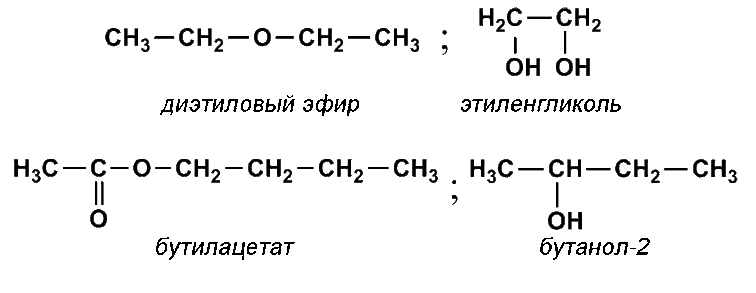
[10]
Растворяется в сложных эфи-рах, кетонах и простых эфирах гликоля. Желатинирует и совмещается с нитро -, ацетил — и бензилцеллюлозой, ацетобути-ратом целлюлозы; не желатинирует и не совмещается с хлоркаучуком и поливинил-хлоридом.
[11]
Растворяется в сложных эфи-рах, кетонах и простых эфирах гликоля. Желатинирует и совмещается с нитро -, ацетил — и бензилцеллюлозой, ацетобути-ратом целлюлозы; не желатинирует и не совмещается с хлоркаучуком и поливинил-хлоридом.
[12]
Катализатор, применяемый в реакции полиэтерифи-кации, не должен быть активным настолько, чтобы образовался простой эфир гликоля, так как протекание этой побочной реакции нарушило бы баланс реакцион-носпособных групп, а также могло бы привести к внедрению в полимерную цепь новых мономерных звеньев и, следовательно, к некоторой нерегулярности макромолекул полимера, в результате чего образовался бы низкоплавкий полимер со свойствами, отличающимися от свойств настоящего полиэфира, в состав которого входят остатки гликоля.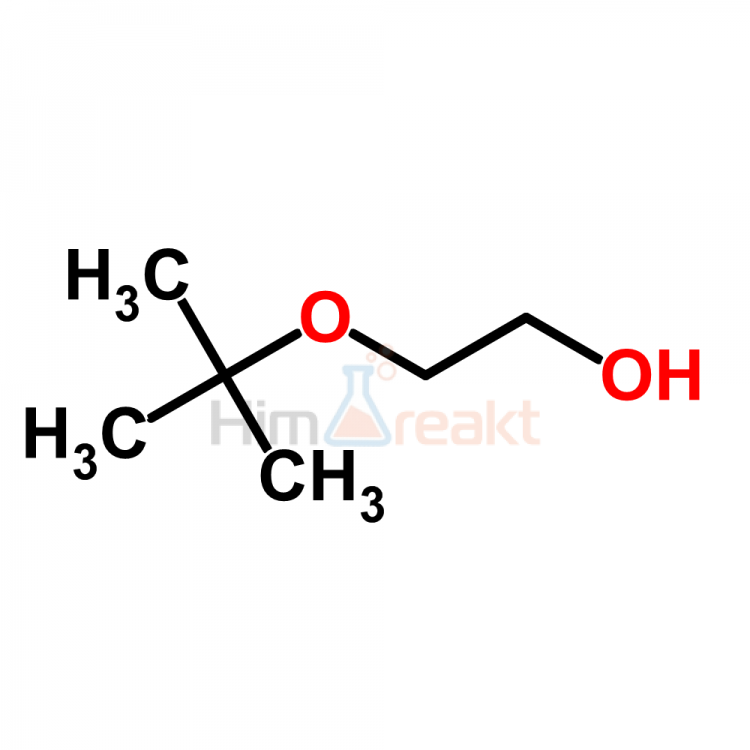
[13]
Три системы ТСХ, использующие подвижные фазы прогрессивно увеличивающейся полярности, сравнивали для разделения пары более простых эфиров гликоля.
[14]
Судя по превосходной растворяющей способности низших моно-и диалкиловых эфиров гликолей, а также сложных эфиров моноалкило-вых простых эфиров гликолей, можно было ожидать, что при соответствующем подборе компонентов для синтеза простых эфиров гликолей, обеспечивающем их нелетучесть, получатся удовлетворительные пластификаторы. Тем не менее полной неожиданностью явилось сообщение 15 о том, что монододециловый эфир этиленгликоля или моноэфир этилен-гликоля и трепг-бутшщиклогексилового спирта особенно пригодны для пластификации карбамидных смол. Эти неомыляющиеся эфиры не ухудшают водостойкости производных целлюлозы, каучука и других полимеров.
[15]
Страницы:
1
2
3
23-30_Galogenalkany_gidroxisoedinenia — Стр 3
Физические свойства
Двухатомные и трехатомные спирты представляют собой жидкости или кристаллические вещества с высокими температурами кипения и плавления (наличие водородных связей). Отличительной особенностью спиртов с несколькими гидроксильными группами является их сладковатый вкус, усиливающийся с увеличением числа ОН-групп.
Отличительной особенностью спиртов с несколькими гидроксильными группами является их сладковатый вкус, усиливающийся с увеличением числа ОН-групп.
Химические свойства
Двух- и трехатомные спирты вступают в аналогичные одноатомным спиртам реакции. Однако различное количество гидроксильных групп в спиртах определяет и некоторые их особенности.
Кислотные свойства. С увеличением числа гидроксильных групп в молекуле кислотные свойства спиртов усиливаются. Это связано с электроноакцепторным влиянием одной гидроксильной группы на другую (–I-эффект).
Гликоли являются более сильными ОН-кислотами, чем одноатомные спирты. Они образуют алкоголяты (гликоляты) не только со щелочными металлами, но и другими активными металлами (Al, Mg и т. д.), а также со щелочами и гидроксидами тяжелых металлов.
α-Гликоли способны реагировать с гидроксилом меди (II) с образованием комплексных соединений. Данная реакция является качественной на спирты, содержащие α-гликольный фрагмент.
21
Образование простых и сложных эфиров.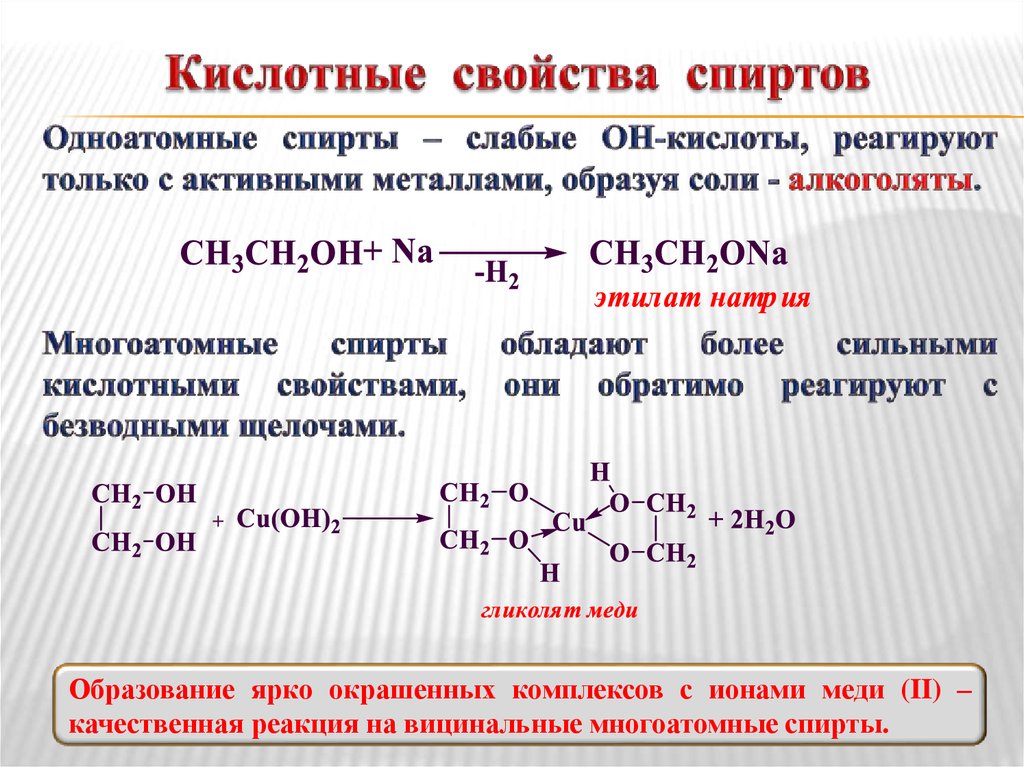 Гликоли образуют неполные и полные производные при взаимодействии со спиртами (простые эфиры), кислородсодержащими минеральными или карбоновыми кислотами (сложные эфиры).
Гликоли образуют неполные и полные производные при взаимодействии со спиртами (простые эфиры), кислородсодержащими минеральными или карбоновыми кислотами (сложные эфиры).
Окисление. Окисление гликолем в зависимости от природы окислителя может протекать поразному:
Для идентификации α-гликолей используют реакцию окисления йодной кислотой НIO4.
При окислении происходит разрыв химической связи между углеродными атомами α- гликольного фрагмента и образуются соответствующие карбонильные соединения. По продуктам окисления устанавливают положение диольного фрагмента вмолекуле.
Дегидратация. Гликоли под действием водотнимающих реагентов подвергаются внутри- и межмолекулярной дегидратации. Направление реакций определяется условиями их проведения.
22
Глицерин подвергается внутримолекулярной дегидратации с образованием непредельного альдегида акролеина:
Поликонденсация. Этиленгликоль в результате реакции поликонденсации способен образовывать полиэфир – полиэтиленгликоль HO–[–Ch3–Ch3–O]n–H
Полиэтилен гликоль с молекулярной массой до 400 используют в фармации в качестве растворителя лекарственных веществ, основы для мазей, связывающего вещества в производстве таблеток.
23
27) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ ПРОСТЫХ ЭФИРОВ
Простыми эфирами называют органические соединения, в которых два углеводородных радикала соединены атомом кислорода.
Общая формула простых эфиров R–О–R’, где R, R’ –- углеводородные радикалы.
Различают симметричные простые эфиры (содержат одинаковые углеводородные радикалы) и несимметрические или смешанные (углеводородные радикалы различны).
По радикало-функциональной номенклатуре названия простых эфиров образуют путем добавления к названию углеводородных радикалов суффикса -овый и слова эфир. В смешанных простых эфирах углеводородные радикалы перечисляют в алфавитном порядке.
По заместительной номенклатуре ИЮПАК простые эфиры рассматривают как производные углеводородов, в которых атом водорода замешен алкоксигруппой RO–. Более сложный по структуре радикал принимают за родоначальную структуру.
Простые эфиры – бесцветные легколетучие жидкости с характерным запахом, плохо растворимы в воде, хорошо растворимы в органических растворителях.
Способы получения
1.Межлюлекулярная дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты образуются простые симметричные эфиры.
2.Синтез Вильямсона. Алкилирование алкоголятов и фенолятов алкилгалогенидам и позволяет получить несимметричные простые эфиры.
24
28) ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ЭФИРОВ
Простые эфиры являются достаточно инертными веществами.
Образование оксониевых солей. Наличие в молекуле простого эфира атома кислорода со свободной электронной парой определяет их основные свойства. При взаимодействии простых эфиров с концентрированными минеральными кислотами образуются оксониевыесоли.
Расщепление простых эфиров.
а) Расщепление под действием щелочных металов. Простые эфиры под действием щелочных металлов (Na, К, Li) при нагревании способны расщепляется с образованием алкоголятов и натрийорганических соединений.
б) Расщепление под действием кислот (ацидолиз). Простые эфиры разлагаются концентрированной йодоводородной кислотой уже на холоду с образованием алкилйодида и спирта.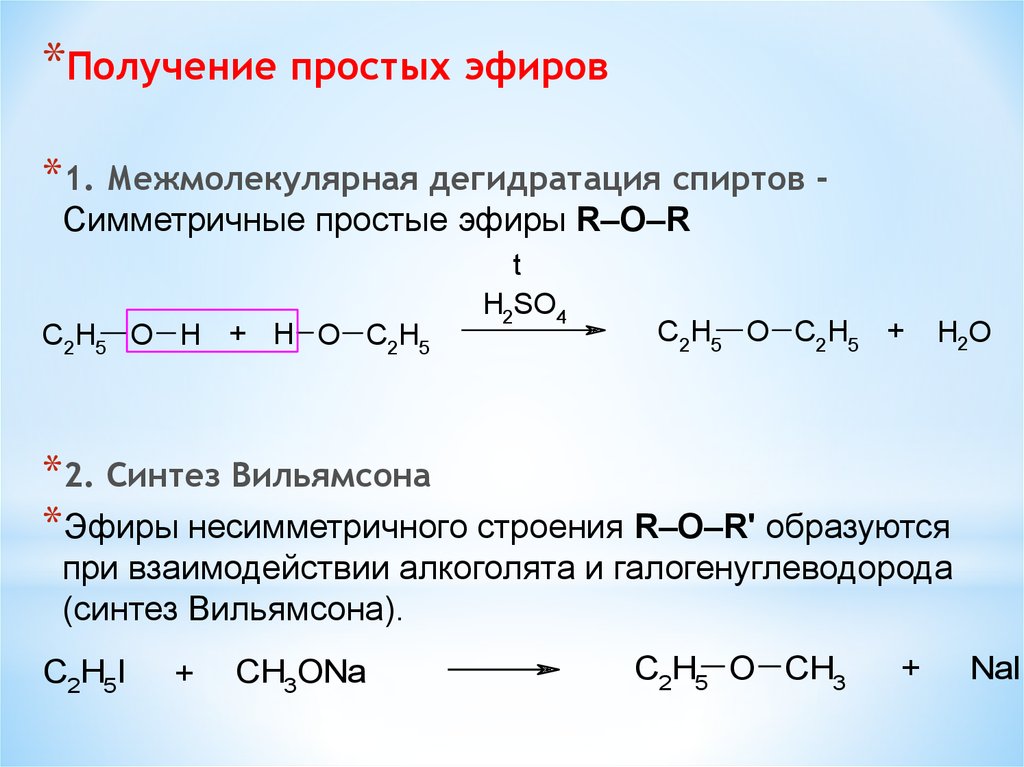
Реакция проходит по механизму SN2.
Если реакцию проводят при нагревании, то образуется вторая молекула этилйодида.
Окисление простых эфиров. Простые эфиры окисляются на воздухе при нормальной температуре. Легче всего окисление протекает по α-углеродному атому
Образующиеся пероксиды неустойчивы, легко взрываются. Работать с эфирами необходимо с большой осторожностью, предварительно убедившись в отсутствии пероксидных соединений.
ТИОЛЫ. ТИОЭФИРЫ
Тиолами (тиоспиртами, меркаптанами) называют соединения общей формулы R–SH (аналоги спиртов). Их можно рассматривать как производные сероводорода h3S, в котором один атом водорода замешен углеводородным радикалом.
По систематической номенклатуре названия тиолов образуют путем добавления к названию родоначального углеводорода суффикса -тиол. Префикс меркапто- используют, если в молекуле SH-rpynna не является старшей.
По рациональной номенклатуре тиолы называют меркаптанами.
25
Тиолы представляют собой жидкие или твердые вещества (за исключением метантиола), с неприятным запахом, ядовиты.
Получают тиолы из сероводорода и его кислых солей реакцией алкнлирования галогеналканами или спиртами.
Химические свойства
Тиолы во многом сходны со спиртами, обладают более выраженными кислотными свойствами. Реакции обусловлены поляризацией связи S–Н и нуклеофильными свойствами атома серы.
Образование тиолятов (меркаптидов). Тиолы образуют соли не только со щелочным и металлами, но и их гидроксидами, а также ионами тяжелых металлов.
Ацилирование. Реакция аналогична этерификации карбоновых кислот.
Окисление. В отличие от спиртов тиолы окисляются не по углеродному атому, а по атому серы. При окислении тиолов в мягких условиях (Н2О2, CuCl3 и др.) образуются диалкилдисульфиды, в жестких (КМnO4, HNO3 или НOI) – сульфокислоты.
Тиоэфирами (сульфидами) называют производные сероводорода h3S, в которых два атома водорода замещены углеводородными радикалами. Их можно рассматривать как тиоаналоги простых эфиров (R-S-R’).
Получают сульфиды в результате алкилирования алкилгалогенидами тиолятов и сульфидов щелочных металлов.
Сульфиды – бесцветные вещества с неприятным запахом. Практически нерастворимы в воде. При взаимодействии с кислотами образуют сульфониевые соли:
26
Окисление сульфидов в зависимости от природы окислителя и условий реакции протекает с образованием сульфоксидов R2SO или суль-фонов R2SO2
Сульфоксиды менее стабильны, чем сульфоны. Сульфоксиды относительно легко окисляются до сульфонов и восстанавливаются до сульфидов.
27
29) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ ФЕНОЛОВ
Фенолами называют производные ароматических углеводородов, у которых один или несколько атомов водорода в ароматическом ядре замешены на гидроксильную группу.
По числу гидроксильных групп фенолы делят на: одноатомные, двухатомные, трех- и полнатомные.
ОДНОАТОМНЫЕ ФЕНОЛЫ
К одноатомным фенолам относятся гидроксилсодержашие ароматические соединения, имеющие в своем составе одну гидроксильную группу:
Для названия фенолов применяют заместительную номенклатуру, в этом случае перед названием арена ставится префикс -гидрокси.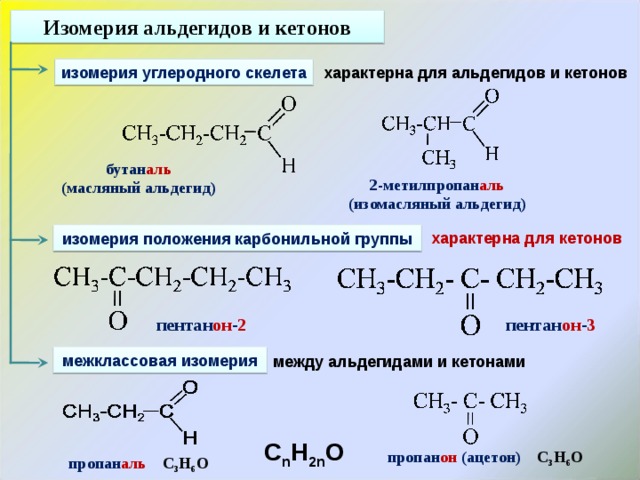
При наличии заместителей в ароматическом ядре за родоначальную структуру берут фенол. Наряду с заместительной номенклатурой в ряду фенолов широко применяются тривиальные
названия.
Метильные производные фенола называют крезолами, а 2-изо-пропил-5-метилфенол называют тимолом.
Для некоторых фенолов чаще используют тривиальные названия (ксилол, тимол и т. д.). Для названия гомологов фенола в качестве основы используют слово фенол.
Способы получения
1.Природные источники. Фенол получают при сухой перегонке каменноугольной смолы. Вторая фракция с tкип 150-230 °С содержит фенол. Впервые фенол был получен таким способом Ф. Рунге
в1834 г.
2.При нагревании галогенопроизводных бензола со щелочами в присутствии катализатора:
3.Сплавление натриевых солей сульфокислот со щелочами:
28
4.Разложение солей диазония:
5.Окисление кумола (кумольный способ). Это основной промышленный способ получения фенола:
Способ является экономически выгодным, так как позволяет кроме фенола получить и другой важный продукт – ацетон.
29
30) ХИМИЧЕСКИЕ СВОЙСТВА ФЕНОЛОВ
Для фенолов характерны два направления реакций: реакции по фенольному гидроксилу и по ароматическому ядру
Вмолекуле фенола имеет место сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с π-электронами бензольного ядра. Это приводит к довольно сильной поляризации связи O←Н, что объясняет более выраженный кислотный характер фенолов в сравнении со спиртами. Атомы водорода гидроксильной группы приобретают подвижность и довольно легко замешаются на другие атомы или атомные группы.
С другой стороны, наличие положительного мезомерного эффекта приводит к укорачиванию связи С-ОН, что делает практически невозможными реакции замещения фенольного гидроксила.
Реакции с участием группы ОН
1. Кислотные свойства. Фенолы обладают кислотным характером, они способны образовывать соли уже при действии щелочей:
Вводном растворе феноляты подвергаются частичному гидролизу т. к. образованы слабой кислотой и сильным основанием.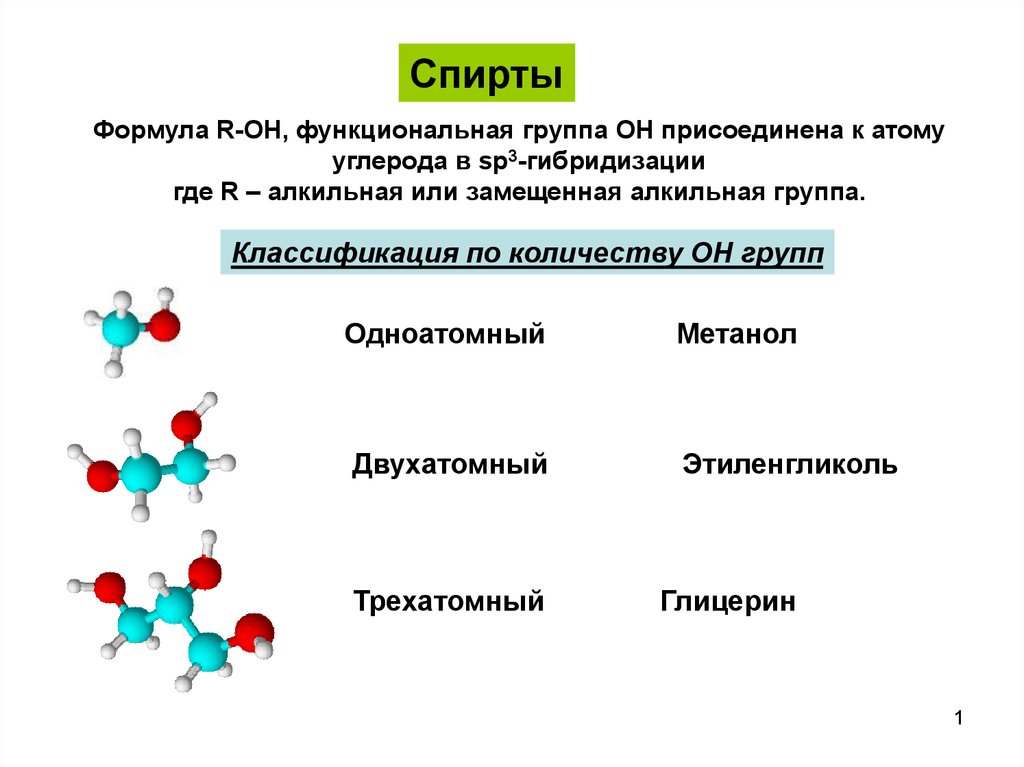 По этой причине их растворы имеют щелочную реакцию. Минеральные кислоты, втом числе и угольная, вытесняют фенолы из их солей.
По этой причине их растворы имеют щелочную реакцию. Минеральные кислоты, втом числе и угольная, вытесняют фенолы из их солей.
На кислотность фенола оказывают влияние заместители в ароматическом ядре. При наличии в п-положении электроноакдепторных заместителей (–NO2, –Br, –Cl, –CN и др.) кислотные свойства усиливаются. Если в п-положение ввести электронодонорные заместители (-Nh3, -ОСН3 и др.), то происходит снижение кислотных свойств, поскольку уменьшается смешение электронов связи О–
Нк атому кислорода, что затрудняет отрыв протона:
2. Образование простых и сложных эфиров. Простые эфиры фенола непосредственно из фенола получить не удается. Для их получения испапьзуют реакцию Вильямсона: взаимодействие феноксида натрия с галоидными алкилами или арилами.
При взаимодействии фенолятов с галогенаренами образуются ароматические простые эфиры:
30
Эфиры гликолей | LyondellBasell
Зарегистрироваться
Забыл пароль
- org/Breadcrumb»>
Продукты и технологии
Химикаты
- Гликолевые эфиры
Дом
Логин клиентаXPRESS
Запросить информацию о продукте
LyondellBasell предлагает широкий ассортимент гликолевых эфиров на основе этилена и пропилена. Эти растворители широко используются в красках и покрытиях, промышленных очистителях и чернилах.
Состав с эфирами гликоля Статья
Условные обозначения: PSB: Бюллетень по ответственному использованию продукции Паспорт безопасности: Паспорт безопасности
Просмотр товаров в:
АцетилыСпиртыАмины, амидыДиолы, гликолиЭпоксиды, эфирыЭфиры, карбонатыЭфиры гликолейОлефины, ароматические соединенияПероксидыПолиолы
Сузить результаты по:
Доступность
- Африка-Ближний Восток (11)
- Азиатско-Тихоокеанский регион (11)
- Австралия и Новая Зеландия (11)
- Европа (9)
- Северная Америка (20)
- Южная и Центральная Америка (12)
Категория
- Химикаты (22)
Применение — химические вещества
- Топливо (1)
- Растворители (21)
Химический тип
- Гликолевые эфиры (22)
ЭФИР ГЛИКОЛЯ DB
Технические характеристики
ЭФИР ГЛИКОЛЯ DE
Технические характеристики
ЭФИР ГЛИКОЛЯ ДМ ПРОМЫШЛЕННЫЙ
Технические характеристики
ЭФИР ГЛИКОЛЯ DM МАРКА ДЛЯ РЕАКТИВНОГО ТОПЛИВА
Технические характеристики
Эфир гликоля DPM
Технические характеристики
Эфир гликоля ДПНБ
Технические характеристики
Гликолевый эфир DPNP
Технические характеристики
ЭФИР ГЛИКОЛЯ ЭБ
Технические характеристики
ЭФИР ГЛИКОЛЯ HB
Технические характеристики
ЭФИР ГЛИКОЛЯ ОН
Технические характеристики
Воздействие 2-метоксиэтанола, 2-этоксиэтанола и их ацетатов (простых эфиров гликоля) на рабочем месте
29 CFR часть 1910
[Досье № H-044]
РИН 1218-AA84
Профессиональное воздействие 2-метоксиэтанола, 2-этоксиэтанола и их ацетатов (гликолевых эфиров)
АГЕНТСТВО: Управление по безопасности и гигиене труда (OSHA), Труд.
ДЕЙСТВИЕ: Отзыв предложенного правила; прекращение нормотворчества.
РЕЗЮМЕ: OSHA отзывает предложенный стандарт по воздействию 2-метоксиэтанола (2-МЭ), 2-этоксиэтанола (2-ЭЭ) и их ацетатов (2-МЭА, 2-ЭЭА) (четырехгликоль эфиры). Производство и использование четырех эфиров гликоля либо прекращены, либо практически ограничены «закрытыми системами», где уровни воздействия более 10 лет назад уже были на уровне или ниже предлагаемых допустимых пределов воздействия (ПДК). Поскольку осталось мало возможностей для воздействия этих эфиров гликоля на рабочем месте, если таковые имеются, и мало или вообще нет возможности воздействия в будущем из-за доступности менее токсичных заменителей, OSHA пришло к выводу, что предлагаемое правило больше не нужно.
ДАТЫ: Отзыв вступает в силу 31 декабря 2003 г.
ДЛЯ ДОПОЛНИТЕЛЬНОЙ ИНФОРМАЦИИ КОНТАКТЫ: OSHA, г-н Джордж Шоу, Управление коммуникаций, Министерство труда США, Комната N-3647, 200 Конституция Авеню, СЗ, Вашингтон, округ Колумбия 20210; телефон: (202) 693-1890 (телетайп OSHA: (877) 889-5627).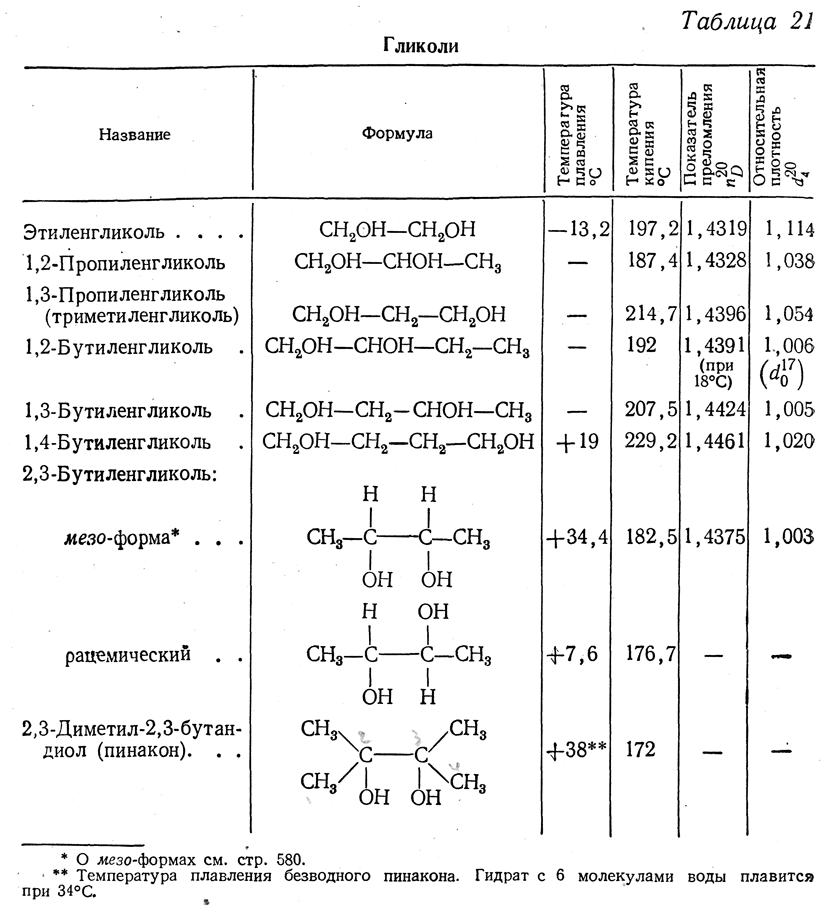
Для получения дополнительных копий этого уведомления Федерального реестра обращайтесь в OSHA, Управление коммуникаций, Министерство труда США, комната N-3101, 200 Конституция Авеню СЗ, Вашингтон, округ Колумбия 20210; телефон (202) 693-1888. Электронные копии этого уведомления Федерального реестра , а также пресс-релизы и другие соответствующие документы доступны на веб-странице OSHA в Интернете по адресу http://www.OSHA.gov.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ:
I. Предыстория
23 марта 1993 г. Управление по охране труда США (OSHA) предложило снизить существующие ПДК для четырех эфиров гликоля (2-ME, 2-EE, 2-MEA, 2-EEA) (58 FR 15526). Основываясь на обзоре научных исследований и других имеющихся данных, OSHA предварительно определило, что существующие PEL неадекватны для защиты примерно 46 000 рабочих, подвергшихся воздействию, от значительных рисков неблагоприятных последствий для репродуктивного здоровья и развития. Агентство провело неофициальные публичные слушания по предложению, и запись закрылась 19 марта. 94.
94.
8 августа 2002 г. Управление по охране труда и промышленной гигиене США (OSHA) вновь открыло запись о нормотворчестве, чтобы запросить информацию о том, в какой степени эти гликолевые эфиры все еще производятся и используются на рабочем месте (67 FR 51524). Агентство также запросило информацию о заменителях четырех гликолевых эфиров, которые могут использовать работодатели, включая информацию о способах использования, степени токсичности и уровнях воздействия заменителей на сотрудников. Период комментариев закончился 6 ноября 2002 г. OSHA получило только шесть комментариев. Хотя это действие не соответствует ни одному из критериев экономически значимого или важного правила, как указано в Исполнительном указе или соответствующих законодательных актах, оно было рассмотрено OMB в соответствии с Исполнительным указом 12866.
II. Причины отзыва предложенного стандарта
На основании данных о неблагоприятном воздействии на репродуктивную функцию и развитие, связанного с воздействием четырех эфиров гликоля ( , например, , Exs.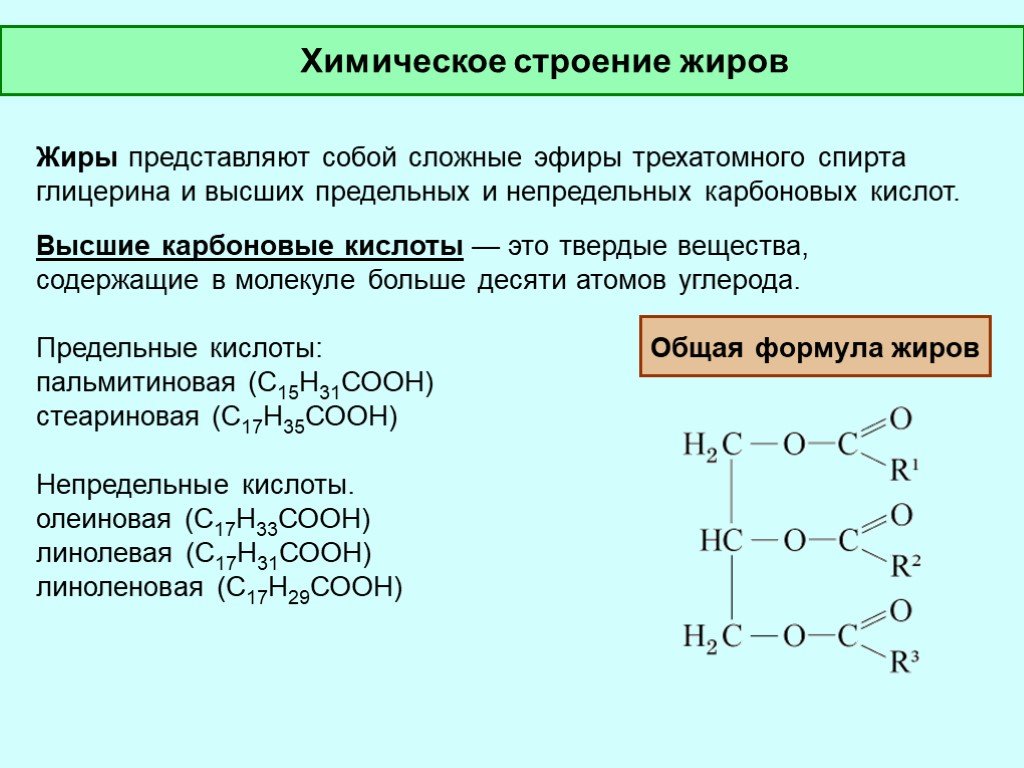 19, 19A, 19B, 24 A-C), некоторые комментаторы призвали OSHA выпустить окончательный стандарт на гликоль. простые эфиры ( , например, , пр. 64-2; 64-4; 64-5). Тем не менее, OSHA решило прекратить нормотворчество, потому что производство, использование и воздействие этих гликолевых эфиров прекращено или практически ограничено производством в закрытой системе, где мало возможностей для воздействия на сотрудников. Уровни воздействия в этих операциях уже находятся на уровне предлагаемых ПДК или ниже. Кроме того, использование этих гликолевых эфиров в значительной степени было заменено менее токсичными заменителями.
19, 19A, 19B, 24 A-C), некоторые комментаторы призвали OSHA выпустить окончательный стандарт на гликоль. простые эфиры ( , например, , пр. 64-2; 64-4; 64-5). Тем не менее, OSHA решило прекратить нормотворчество, потому что производство, использование и воздействие этих гликолевых эфиров прекращено или практически ограничено производством в закрытой системе, где мало возможностей для воздействия на сотрудников. Уровни воздействия в этих операциях уже находятся на уровне предлагаемых ПДК или ниже. Кроме того, использование этих гликолевых эфиров в значительной степени было заменено менее токсичными заменителями.
Производство и использование четырех эфиров гликоля существенно сократилось или полностью прекратилось с момента публикации предлагаемого правила. Начиная с 1990-х годов работодатели начали отказываться от использования этих гликолевых эфиров из-за растущей осведомленности об их неблагоприятном воздействии на здоровье. Уже в середине 1990-х годов производство и использование этих гликолевых эфиров снизились по сравнению с пиковыми уровнями производства в конце 1980-х годов (Пример 302-X, стр. 597; 67 FR 51524). Четыре гликолевых эфира были или были исключены из критически важных областей применения (9).0110 напр. , строительные краски и покрытия, печатные краски, топливо для военных реактивных двигателей) и ключевые отрасли промышленности ( например, , автомобилестроение, электроника, полупроводники) (Примеры 11-18; 19B; 28; 29A; 48; 53; 58 302-Х, стр. 596-600). Например, эти гликолевые эфиры больше не использовались при окраске автомобилей, на которые приходилось около 86 процентов пострадавших предприятий и 57 процентов всех подвергшихся воздействию рабочих. Производство 2-МЭА было полностью прекращено, и использование 2-МЭ в качестве добавки к реактивному топливу для военных реактивных двигателей, его основное применение, должно было быть прекращено до 2000 г. (Пример 302-X, стр. 59).7-98). Таким образом, к концу периода нормотворчества в 1994 г. большая часть последующего использования была устранена (Пример 58; 302-X, стр. 596-600). Там, где 2-МЕ, 2-ЭЭ и 2-ЭЭА все еще производились, их производство было практически ограничено «закрытыми системами», где даже более 10 лет назад среднее воздействие (как среднее арифметическое, так и среднее геометрическое) уже было на уровне или ниже предложенные PEL (Пример 302-X, стр.
597; 67 FR 51524). Четыре гликолевых эфира были или были исключены из критически важных областей применения (9).0110 напр. , строительные краски и покрытия, печатные краски, топливо для военных реактивных двигателей) и ключевые отрасли промышленности ( например, , автомобилестроение, электроника, полупроводники) (Примеры 11-18; 19B; 28; 29A; 48; 53; 58 302-Х, стр. 596-600). Например, эти гликолевые эфиры больше не использовались при окраске автомобилей, на которые приходилось около 86 процентов пострадавших предприятий и 57 процентов всех подвергшихся воздействию рабочих. Производство 2-МЭА было полностью прекращено, и использование 2-МЭ в качестве добавки к реактивному топливу для военных реактивных двигателей, его основное применение, должно было быть прекращено до 2000 г. (Пример 302-X, стр. 59).7-98). Таким образом, к концу периода нормотворчества в 1994 г. большая часть последующего использования была устранена (Пример 58; 302-X, стр. 596-600). Там, где 2-МЕ, 2-ЭЭ и 2-ЭЭА все еще производились, их производство было практически ограничено «закрытыми системами», где даже более 10 лет назад среднее воздействие (как среднее арифметическое, так и среднее геометрическое) уже было на уровне или ниже предложенные PEL (Пример 302-X, стр. 597-98; 58 FR 15582).
597-98; 58 FR 15582).
Более свежие данные подтверждают, что использование и воздействие этих гликолей
эфиры еще больше пришли в упадок и в настоящее время очень ограничены (Исх. 64-1; 64-1-
1. См. также , SRI, Справочник по экономике химии (CEH) 663.5000 и далее . (сентябрь 2000 г.)). К 1999 году использование 2-ЭЭ упало на 70 процентов по сравнению с пиковым значением в 175 миллионов фунтов в 1980 году, а использование 2-МЭ упало на 96 процентов, до всего 3 миллионов фунтов, по данным Группы по эфирам этиленгликоля Американской химии. Совет (ACC), ранее называвшаяся Ассоциацией производителей химической продукции (Ex. 64-1-1; CEH 663.5001A-H). Из все еще производимых гликолевых эфиров более 55 процентов было экспортировано, а более 40 процентов было использовано для производства 2-ЭЭА в закрытых системах, где средние уровни воздействия находятся на уровне предлагаемых ПДК или ниже и в большинстве случаев составляют менее половины ПДК. предлагаемые PEL (пример 64-1-1; 58 FR 15582, таблица VIII-2).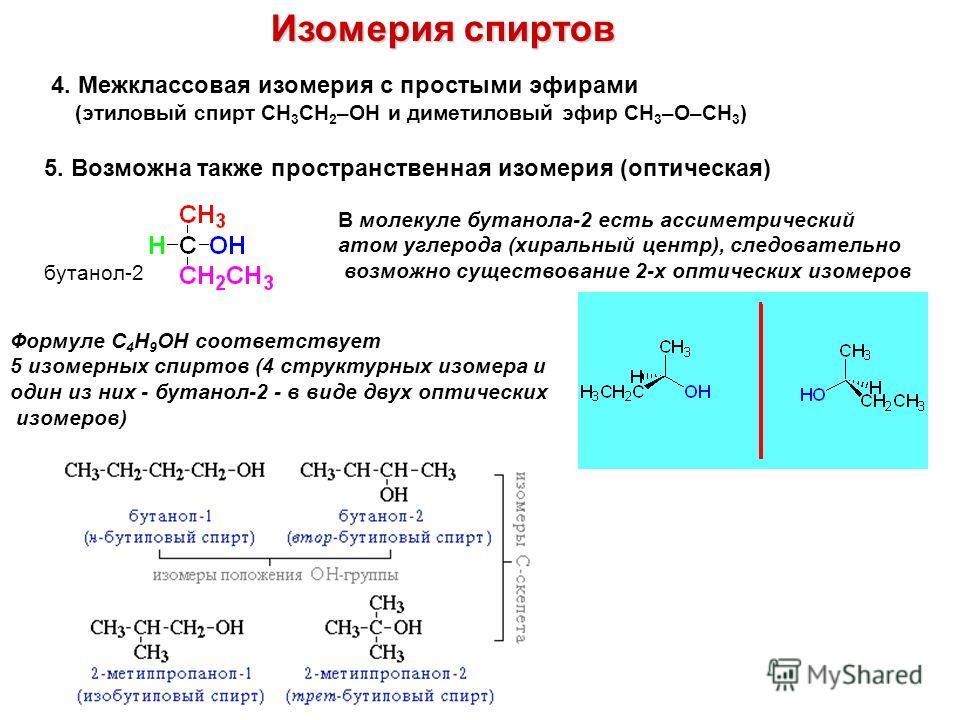 Все остальное внутреннее потребление составило менее 4 процентов (5 миллионов фунтов стерлингов). (См. Таблицу 1.) Наконец, OSHA также отмечает, что очень немногие комментарии, представленные в ответ на повторное открытие записи, могут быть дополнительным свидетельством снижения использования и воздействия четырех гликолевых эфиров:
Все остальное внутреннее потребление составило менее 4 процентов (5 миллионов фунтов стерлингов). (См. Таблицу 1.) Наконец, OSHA также отмечает, что очень немногие комментарии, представленные в ответ на повторное открытие записи, могут быть дополнительным свидетельством снижения использования и воздействия четырех гликолевых эфиров:
Таблица 1. Потребление эфиров этиленгликоля, 1999 г. (в миллионах фунтов)
| Ацетат производство | Другие США Потребление | Экспорт | Всего | |
| 2-EE 2-EEA 2-ME 2-MEA Всего для всех гликолевых эфиров | 52 0 0 0 | 1 1 3 0 | 0 71 0 0 | 53 72 3 0 |
| 52 (40,6%) | 5 (3,9%) | 71 (55,5%) | 128 (100%) |
Источник: Исх.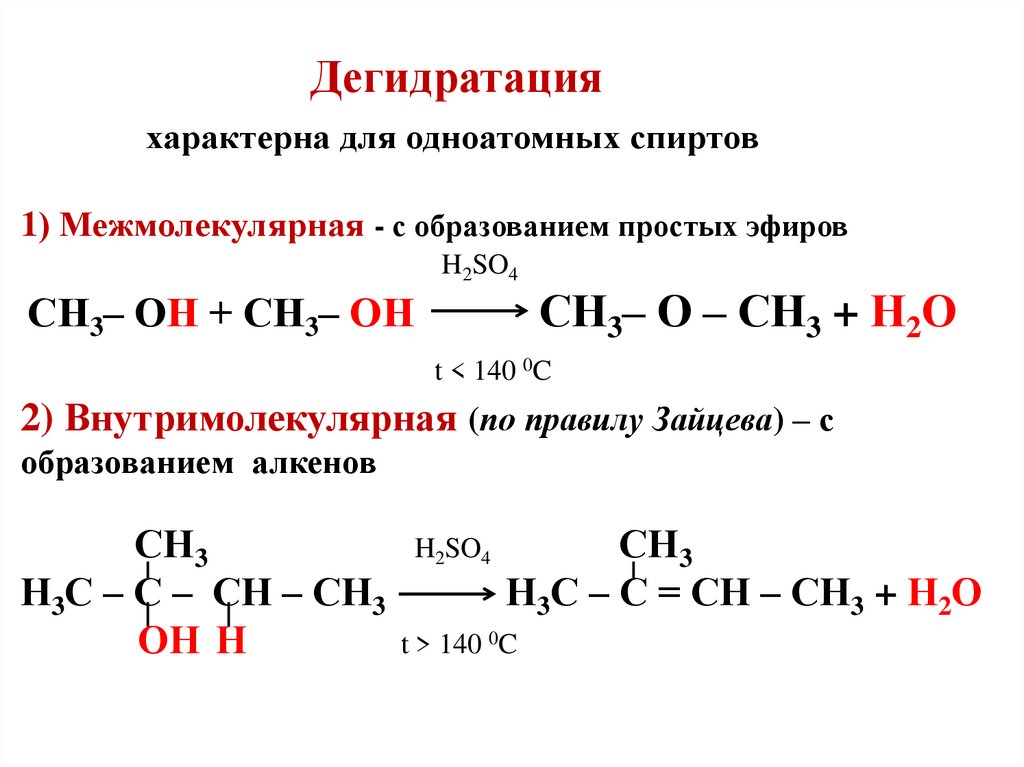 64-1-1 (цитируется SRI, Справочник по экономике химии (сентябрь 2000 г.)).
64-1-1 (цитируется SRI, Справочник по экономике химии (сентябрь 2000 г.)).
В настоящее время в Соединенных Штатах остается только один производитель этих гликолевых эфиров, Equistar Chemicals (Exs. 64-1; 64-1-1), чье производство практически ограничено закрытыми системами, поэтому у сотрудников мало возможностей для воздействия . По данным ACC, Equistar экспортирует большую часть производимых ею гликолевых эфиров (Пример 64-1). Chemical Economics Handbook подтверждает это, сообщая, что четыре эфира гликоля больше не продаются в Соединенных Штатах (CEH 663.5000R-S). (Управление по охране труда США отмечает, что компания Eastman Chemical Company также производит небольшое количество 2-ЭЭ в закрытой системе, но только для внутреннего использования в качестве промежуточного продукта при производстве другого продукта (Пример 64-1).
До 2001 г. Dow Chemical Company и Union Carbide, крупнейший производитель этих гликолевых эфиров, производили почти 60 процентов этих гликолевых эфиров (CEH 663.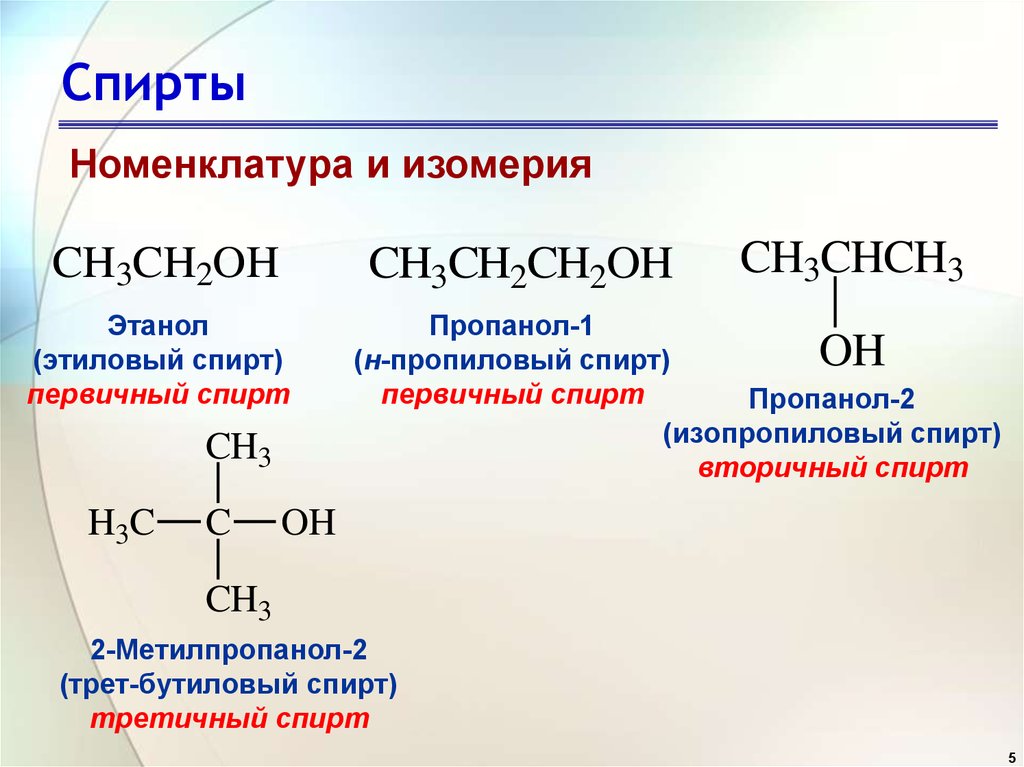 5000Q).В 2001 г. Dow приобрела Union Carbide (Exs. 64-1; 64-1). В прошлом году компания Dow прекратила производство этих гликолевых эфиров, вместо этого перейдя на производство менее токсичных бутилгликолевых эфиров серии Е ( напр. , EB) (Exs. 64-1; 64-1-1. CEH 663.5000Q).
5000Q).В 2001 г. Dow приобрела Union Carbide (Exs. 64-1; 64-1). В прошлом году компания Dow прекратила производство этих гликолевых эфиров, вместо этого перейдя на производство менее токсичных бутилгликолевых эфиров серии Е ( напр. , EB) (Exs. 64-1; 64-1-1. CEH 663.5000Q).
III. Заменители
Потенциальное воздействие четырех эфиров гликоля в будущем незначительно или отсутствует, поскольку их использование в значительной степени заменено менее токсичными заменителями. Согласно ACC, имеется ряд заменителей, включая другие эфиры этиленгликоля, эфиры пропиленгликоля и другие типы растворителей (Пример 64-1). В Справочнике по экономике химических веществ сообщается, что использование четырех эфиров гликоля было заменено в основном бутилгликолевыми эфирами серии E (EB), эфирами гликоля серии P и этил-3-этоксипропионатом (EEP). Например, ацетат монобутилового эфира этиленгликоля, ацетат монобутилового эфира диэтиленгликоля и монометилацетат пропиленгликоля заменили использование 2-EEA (CEH 663. 5000O). К 1999, различные заменители составляли около 80 процентов всех гликолевых эфиров, потребляемых внутри страны (CEH 663.5000E-F). Из этих заменителей ЭБ в настоящее время является эфиром гликоля с наибольшим объемом (64 FR 42127, 3 августа 1999 г.), на его долю приходится 44 процента всех эфиров гликоля, потребляемых внутри страны (CEH 663.5000E).
5000O). К 1999, различные заменители составляли около 80 процентов всех гликолевых эфиров, потребляемых внутри страны (CEH 663.5000E-F). Из этих заменителей ЭБ в настоящее время является эфиром гликоля с наибольшим объемом (64 FR 42127, 3 августа 1999 г.), на его долю приходится 44 процента всех эфиров гликоля, потребляемых внутри страны (CEH 663.5000E).
Некоторые комментаторы выразили озабоченность по поводу потенциальной токсичности некоторых заменителей, особенно эфиров этиленгликоля с более длинной цепью, и призвали OSHA обнародовать стандарты, касающиеся этих веществ (Примеры 64-2, 64-4, 64-5). Например, Департамент здравоохранения штата Калифорния заявил, что следующие эфиры гликоля оказывают неблагоприятное воздействие на репродуктивную функцию и развитие: диметиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля, диметиловый эфир триэтиленгликоля. , метиловый эфир пропиленгликоля-бета и ацетат метилового эфира пропиленгликоля-бета (пример 64-5).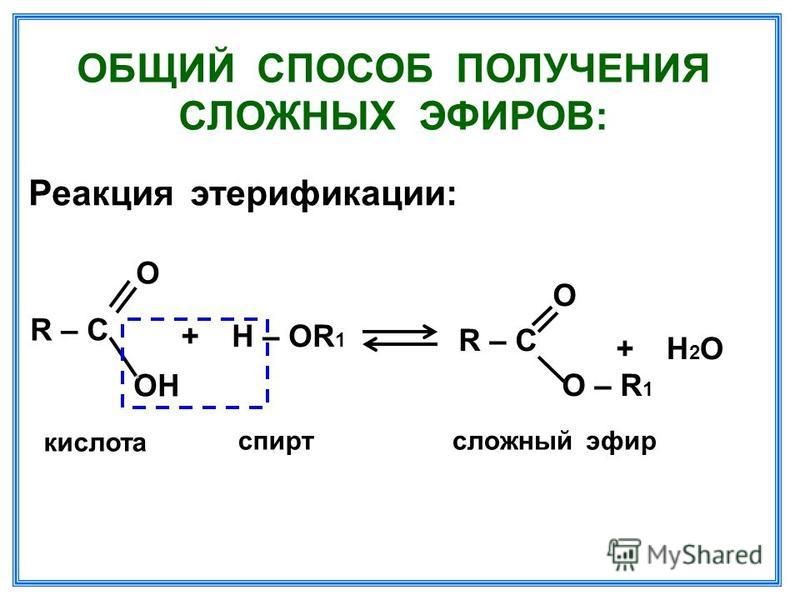 Однако OSHA получило мало информации о том, в какой степени эти вещества используются на рабочих местах и в какой степени сотрудники в настоящее время подвергаются их воздействию. Таким образом, OSHA не может определить на основе этой записи о нормотворчестве, нужно ли рассматривать эти заменители.
Однако OSHA получило мало информации о том, в какой степени эти вещества используются на рабочих местах и в какой степени сотрудники в настоящее время подвергаются их воздействию. Таким образом, OSHA не может определить на основе этой записи о нормотворчестве, нужно ли рассматривать эти заменители.
OSHA отмечает, что информация, предоставленная Агентству по охране окружающей среды, указывает на то, что некоторые заменители не обладают уровнем токсичности четырех эфиров гликолей (65 FR 47342, 2 августа 2000 г.; 64 FR 42125, 3 августа 1999 г.). См. также протокол Агентства по охране окружающей среды № A-99-24). Основываясь на такой информации, EPA в настоящее время рассматривает возможность исключения EB из списка опасных загрязнителей воздуха, установленного Законом о чистом воздухе. EB является наиболее распространенным из заменителей, на его долю приходится 44 процента всего эфира гликоля, потребляемого внутри страны.
В заключение, учитывая очень ограниченное производство, использование и воздействие этих гликолевых эфиров, а также отсутствие потенциального воздействия на рабочем месте в будущем из-за доступности и растущего использования менее токсичных заменителей, OSHA отзывает предложенный стандарт.
