Содержание
Спирты, подготовка к ЕГЭ по химии
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH.
Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы
OH — глицерины) и т.д.
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т. д.
д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором
щелочи образуются спирты.
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.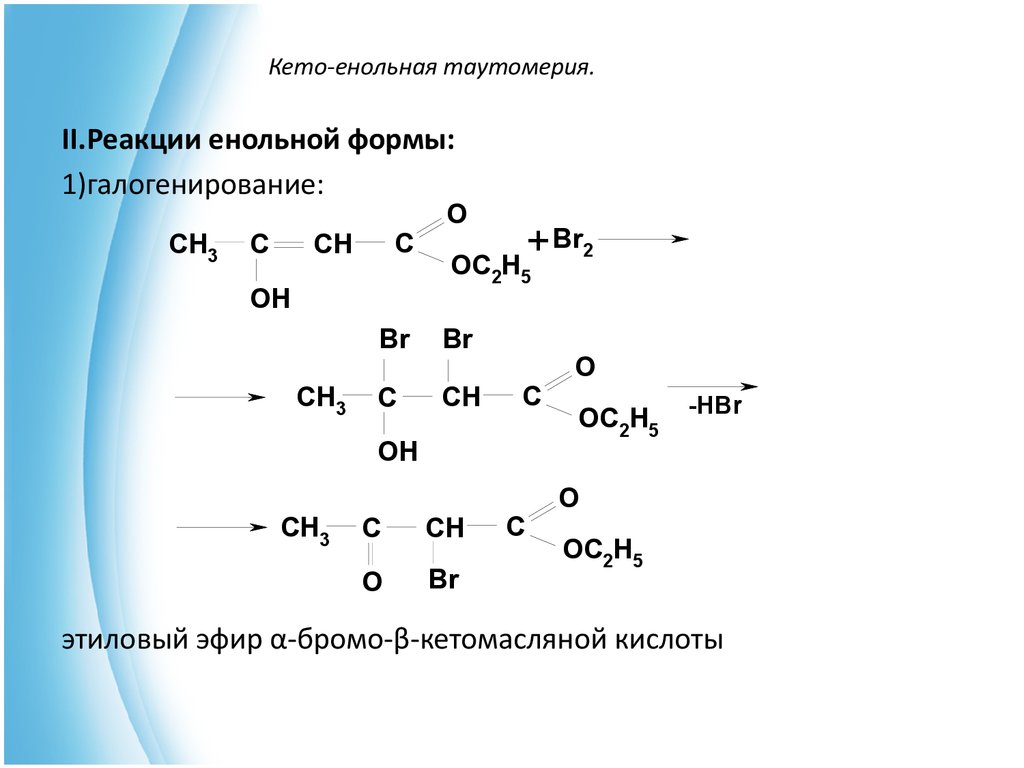
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие
от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).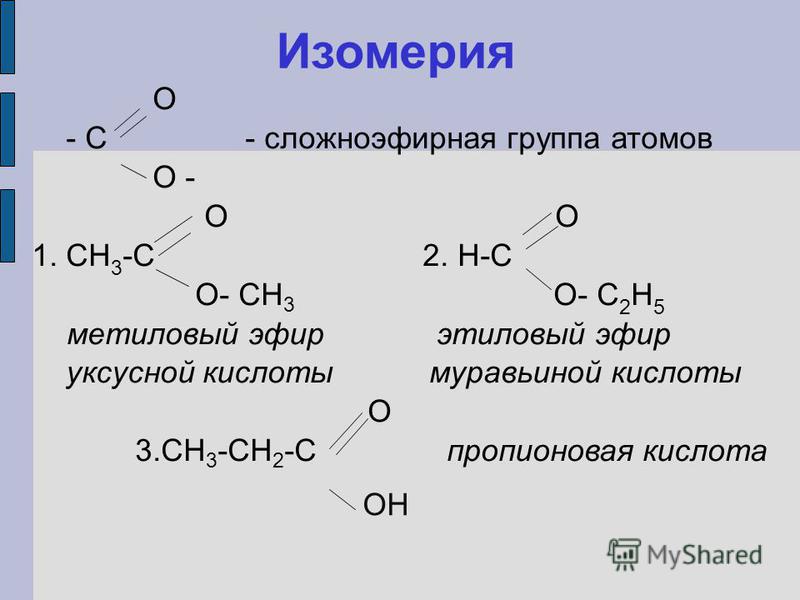
Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Температуры кипения некоторых спиртов и изомерных им простых эфиров
Спирт | Формула | Т |
Метанол | СН3ОН | 64,5 |
Этанол | СН3СН2ОН | 78 |
Диметиловый | CH3OCH3 | -24. |
Пропанол-1 | СН3СН2СН2ОН | 97 |
Метилэтиловый | СН3СН2ОCH3 | 7.9 |
Бутанол-1 | CH3(CH2)3OH | 117 |
Диэтиловый | СН3СН2ОCH2CH3 | 34.6 |
Кислотно-основные свойства спиртов
в
водном растворе кислотность спиртов
изменяется следующим образом:
H2O
> СН3ОН
> СН3СН2ОН
> (СН3)2СНОН
> (СН3)3СОН
Формально, такой
последовательности изменения кислотности
спиртов можно было бы ожидать на основании
увеличения индукционного эффекта
радикалов в этом ряду, что, в свою очередь,
должно приводить к увеличению электронной
плотности на атоме кислорода спирта.
Вследстсвие этого долж-но наблюдаться
уменьшение кислотности спиртов. Однако
более вероятным представляется
образование менее прочной водородной
связи в этом направ-лении, вследствие
увеличения пространственных препятствий
по мере увеличения объёма углеводородного
радикала в ряду:
CH3
<
C2H5
< (CH3)2CH
< (CH3)3C
Образование
водородной связи всегда предшествует
переносу протона в гидроксилсодержащих
растворителях. В Таблице 2 приведены
данные о кислотности простейших спиртов,
которые подтверждают это положение.
Таблица
2
Кислотность спиртов
RОН
рKa.
(СН3)3СОН
18,0
(СН3)2СНОН
17,1
СН3СН2ОН
15,9
СН3ОН
15,5
НОН
15,7
Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
Для
количественного превращения спирта в
алкоголят требуется использова-ние
гораздо более сильных оснований, таких
как гидриды или амиды щелоч-ных или
щелочноземельных металлов или реактивов
Гриньяра.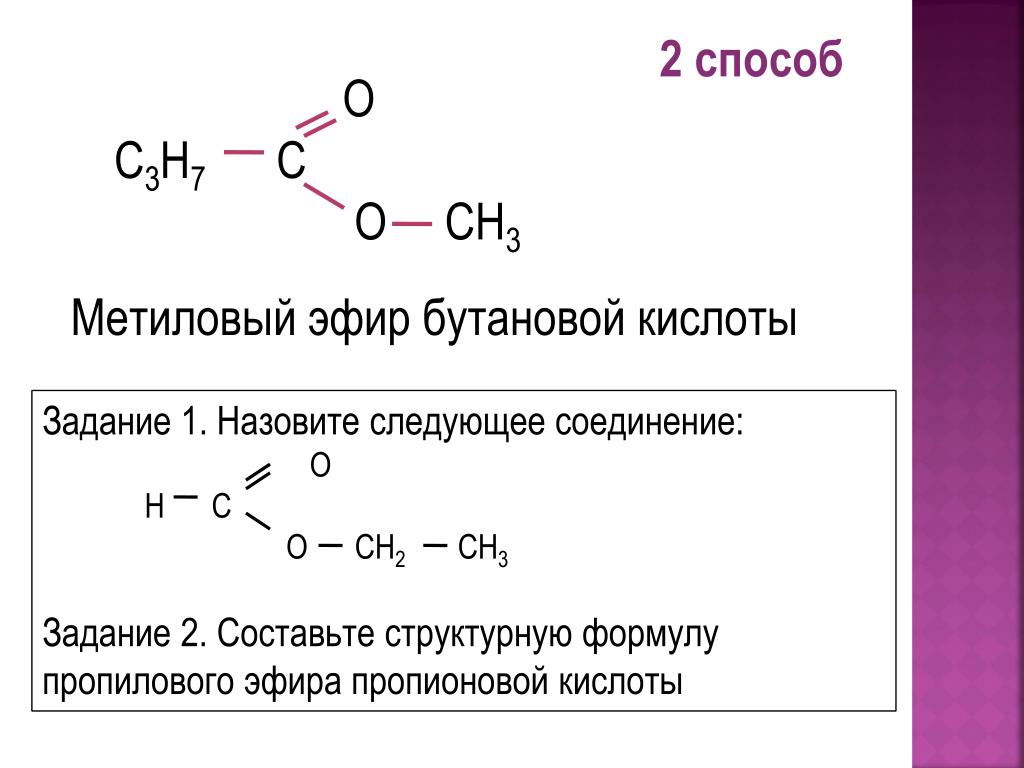
По
отношению к сильным минеральным кислотам
спирты проявляют свойства оснований и
образуют соли алкоксония:
основание кислота
кислота’ основание’
Эта
реакция является первой стадией в
реакциях спиртов, протекащих в кислой
среде, т.е., при замещении гидроксильной
группы на галоген, дегидратации спиртов
и образовании простых эфиров.
Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
Известно
много способов замены гидроксильной
группы спирта на галоген. Эти методы
замещения гидроксила на галоген основаны
на реакции спиртов с галогеноводородами,
а также с галогенидами фосфора и
оксогалогенидами фосфора и серы.
Получение алкилгалогенидов из спирта и галогеноводородных кислот
ROH
+ HHal →
RHal + Н2O
Реакционная
способность галогеноводородов уменьшается
в ряду HI
> HBr
> HC1
>> HF.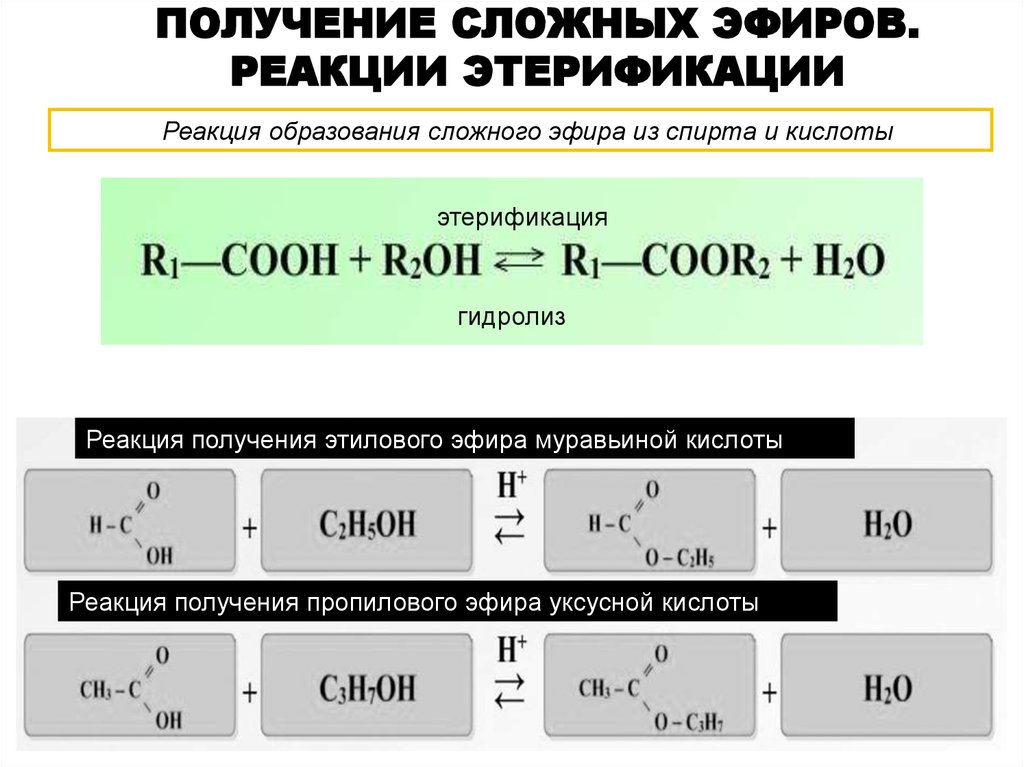
Скорость реакции замещения возрастает
в ряду первич-ный > вторичный >
третичный спирт. Для получения третичных
алкилгало-генидов обычно достаточно
обработать третичный спирт концентрирован-ным
водным раствором соляной, бромистоводородной
или йодистоводород-ной кислоты при
комнатной температуре. Для получения
первичных и вторичных алкилбромидов и
алкилйодидов обычно требуется нагревание
смеси спирта с концентрированной
бромистоводородной или йодисто-водородной
кислотой. Вместо концентрированных
водных растворов НВr
и HI
можно использовать бромиды и йодиды
натрия или калия и концентрированную
серную или фосфорную кислоту. Выходы
алкилгалогенидов по этому методу обычно
составляют 75—90%. Отдельные примеры
приведены ниже.
Первой стадией
реакции является образование из спирта
иона алкоксония
Следующей
стадией для первичных спиртов и некоторых
вторичных является SN2
реакция замещения воды в катионе
алкоксония на галоген:
для
получения алкилхлоридов при взаимодействии
первичных спиртов с соляной кислотой
используют электрофильный катализатор
— безводный хлорид цинка. Смесь соляной
Смесь соляной
кислоты и хлорида цинка носит название
реактива Лукаса. В отсутствии катализатора
реакция протекает с гораздо меньшей
скоростью.
Третичные
спирты и некоторые вторичные взаимодействуют
с гало-геноводородом по механизму SNl
с образованием в качестве интермедиата
карбокатиона, который далее с анионом
галогена образут конечный продукт.
Спирты в эфиры с помощью кислотного катализа – Master Organic Chemistry
Как получить эфиры из спиртов и кислот
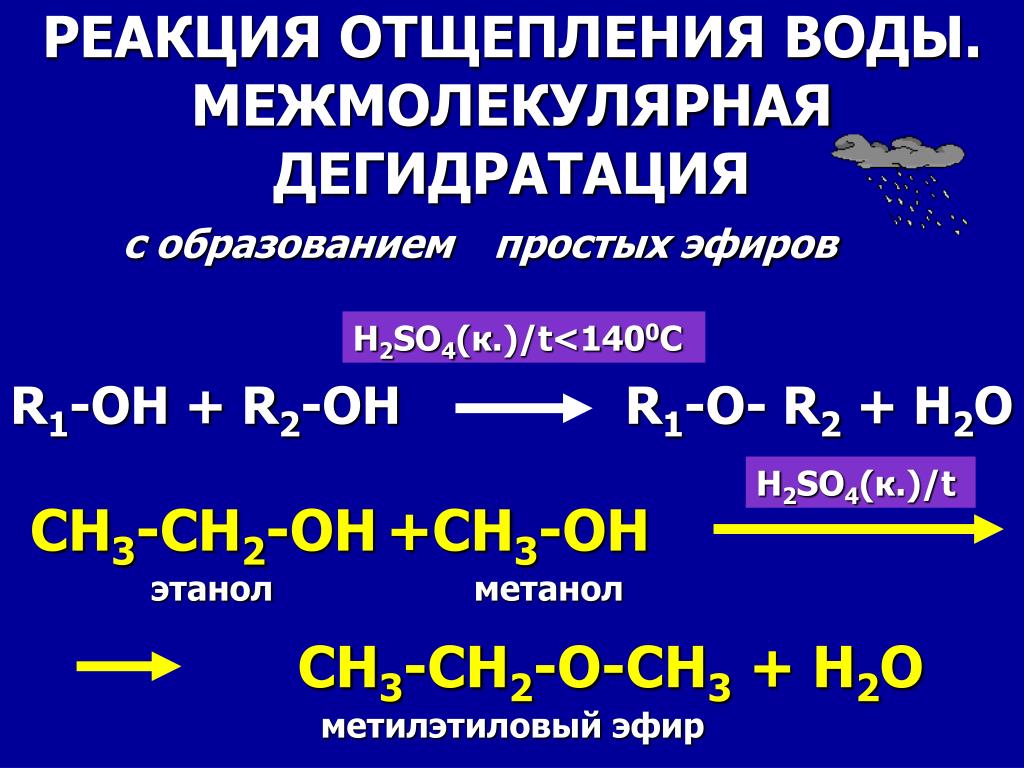
- Симметричные эфиры можно получить путем катализируемой кислотой дегидратации первичных спиртов.
- Классическим примером является нагревание этанола при 130-140 °C с получением диэтилового эфира.
- Реакция протекает через протонирование гидроксильной группы с образованием сопряженной кислоты с последующей реакцией SN2 с получением симметричного эфира.
- Этот процесс лучше всего подходит для получения симметричных эфиров первичных спиртов.

Table of Contents
- Synthesis of Symmetrical Ethers Via Acid-Catalyzed Dehydration of Alcohols
- The Mechanism: Acid-Catalyzed Dehydration of Alcohols
- Summary: Symmetrical Ether Synthesis via Alcohol Dehydration
- Notes
- (Advanced ) Ссылки и дополнительная литература
1. Синтез симметричных эфиров посредством кислотно-катализируемой дегидратации спиртов
Последний пост Я немного забежал вперед. Я был в восторге от изучения реакций эфиров и забыл, что есть еще один метод синтеза эфира, который мы не рассмотрели. На самом деле это не , а в целом, поэтому вы, вероятно, можете пропустить его. Но для полноты вот это.
Помните, мы говорили, что спиртам часто нужен «пинок под зад», чтобы участвовать в реакциях? То есть мы либо добавляем кислоту к протонируем их (образуя их сопряженную кислоту, которая имеет лучшую уходящую группу), либо добавляем основание к депротонируют их (образуя их сопряженное основание, которое является лучшим нуклеофилом).
Сегодняшний пост — прекрасный тому пример. Вот резюме.
Вот в чем дело. Если мы возьмем простой спирт — прекрасным примером является этанол — и нагреем его в присутствии сильной кислоты, может образоваться эфир .
Как это работает?
2. Механизм: синтез симметричных эфиров посредством кислотно-катализируемой дегидратации спиртов
Существует три ключевых этапа.
Прежде всего, один эквивалент спирта протонируется до его сопряженной кислоты – которая имеет хорошую уходящую группу , OH 2 (вода, слабое основание). ( Помните, что сопряженная кислота является лучшей уходящей группой — см. Что делает хорошую уходящую группу ).
Далее, другой эквивалент спирта теперь может осуществлять нуклеофильную атаку на углерод (S N 2) , что приводит к замещению ОН 2 (вода) и образование новой связи С-О. Это реакция S N 2. (См. Механизм SN2 )
Это реакция S N 2. (См. Механизм SN2 )
Заключительный этап — это депротонирование продукта другим эквивалентом растворителя (или другим слабым основанием), в результате чего получается наш эфирный продукт.
Вот схема механизма:
3. Резюме: образование симметричных эфиров из спиртов
Итак, насколько важен этот процесс на самом деле?
В промышленности это очень важный процесс синтеза диэтилового эфира, который является товарным химическим веществом и полезным растворителем для органической химии. Этанол дешевый. Серная кислота дешевая. Нагрейте, перегоните, и Боб станет вашим дядей. Ежегодно с помощью этого процесса производится более 10 миллионов тонн материала.
Практически — и я говорю это тебе, студент-химик — с синтетической точки зрения — это не очень общий синтез эфиров.
Прежде всего, он ограничен симметричными эфирами. Если мы попытаемся получить несимметричные эфиры, используя этот процесс, мы получим смеси, которые нужно будет разделить, что даст нам низкий выход каждого отдельного компонента.
Если мы попытаемся получить несимметричные эфиры, используя этот процесс, мы получим смеси, которые нужно будет разделить, что даст нам низкий выход каждого отдельного компонента.
Во-вторых, температура должна быть тщательно оптимизирована, потому что возможно множество побочных реакций. Например, оптимальная температура для образования диэтилового эфира составляет около 130-140°С. Как только температура достигает 150°С и выше, начинает конкурировать отщепление, приводя к образованию газообразного этилена.
[И это для первичных спиртов, которые не очень легко образуют карбокатионы. Как только вы попадаете в категорию использования этого процесса для вторичных и третичных спиртов, карбокатионам становится намного легче образовываться, и элиминация становится еще более значительным разрушительным путем.]
Вы должны знать, какой правильный ответ на вопрос ниже. И уметь рисовать механизм. Вот и все.
Кроме того, если вы не Sigma-Aldrich и не планируете производить несколько метрических тонн эфира, вы можете с комфортом исключить этот метод синтеза эфира из своего синтетического набора инструментов. Синтез эфира Вильямсона также справится с этой задачей, и его также можно использовать для создания несимметричных эфиров.
Синтез эфира Вильямсона также справится с этой задачей, и его также можно использовать для создания несимметричных эфиров.
Хорошо. Наконец, в следующем посте мы напишем все о различных реакциях эфиров. Мы изучили пять (5) — считайте их — способы создания эфира, и теперь, когда мы вооружены всеми этими знаниями, мы выйдем и поговорим обо всех разных вещах, которые мы можем сделать!
Следующий пост – Расщепление эфиров кислотой
Примечания
Примечание 1. Этот синтез эфиров настолько практически прост, что его можно использовать в обучающих видеороликах. Не делайте этого, если вы не знаете, что делаете — эфир чрезвычайно легко воспламеняется.
(продвинутые) Ссылки и дальнейшее чтение
- Катализаторы для формирования диэтилового эфира
ИНДАТОРЫ : Ченг Чжанг, Виктор Дж. Джонсон
ПРЕДУПРЕЖДЕНИЕ : CELANESE International Corp.
Дата публикации: , 18, 9014 3
15015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015 Паб. №: US 20140275636A1
№: US 20140275636A1
В нем описан промышленный процесс синтеза диэтилового эфира, который осуществляется с использованием гетерогенного катализатора. - Одностадийный синтез диизопропилового эфира – альтернативного средства, повышающего октановое число, для неэтилированного бензина
Фрэнк П. Хиз, Марк Э. Драй, Клаус П. Мёллер
Катализ сегодня 1999 , 49 (1-3), 327-335
DOI: 10.1016/S0920-58663
DOI: 10.1016/S0920-5861 (
DOI: 10.1016/S0920-5861 (
DOI: 10.1016/S0920-586993
DOI: 10.1016/S0920-586993
DOI: 10.1016/S0920-586
DOI: 10.1016. 98)00440-4
В этой статье показано, что механизм образования симметричных эфиров из вторичных спиртов (например, изопропанола) является более сложным, поскольку бимолекулярная дегидратация может конкурировать с другими путями (например, S N 1 или отщепление-присоединение). Диизопропиловый эфир иногда используется в качестве растворителя, но требует еще большей осторожности при обращении и хранении по сравнению с другими эфирами, так как он еще более склонен к образованию взрывоопасных перекисей.
Диизопропиловый эфир иногда используется в качестве растворителя, но требует еще большей осторожности при обращении и хранении по сравнению с другими эфирами, так как он еще более склонен к образованию взрывоопасных перекисей. - Способ получения диизопропилового эфира
Изобретатель: Hanbury John Woods
Правопреемник: Gulf Oil Canada Limited
Дата публикации: 16, 1977
Pub. №: US 4,042,633
Патент на промышленный способ получения диизопропилового эфира из изопропанола. Это также делается с помощью гетерогенного катализатора (в данном случае монтмориллонитовой глины). - Реакции фенолов и спиртов над торием: механизм образования эфира
Karuppannasamy, K. Narayanan, C. N. Pillai
J. Catalysis 1980 , 66 (2), 281-289
DOI: 10.1016/0021-9517(80)-9
Under В форсированных условиях фенол может дегидратироваться до дифенилового эфира, но это происходит по необычному механизму.
14.8: Эфиры — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16048
- Анонимный
- LibreTexts
Цели обучения
- Описать структурные различия между спиртом и эфиром, которые влияют на физические характеристики и реакционную способность каждого из них.
- Назовите простые эфиры.
- Опишите структуру и применение некоторых эфиров.
С общей формулой ROR’ простой эфир можно рассматривать как производное воды, в котором оба атома водорода заменены алкильными или арильными группами. Его также можно считать производным спирта (ROH), в котором атом водорода группы ОН заменен второй алкильной или арильной группой:
\[\ mathrm{HOH\underset{H\:atomics}{\xrightarrow{replace\: Both}}ROR’\underset{of\: OH\: group}{\xleftarrow{replace\: H\: атом} }ROH} \номер\]
Простые эфиры имеют простые общие названия, образованные от названий групп, присоединенных к атому кислорода, за которыми следует общее название эфир .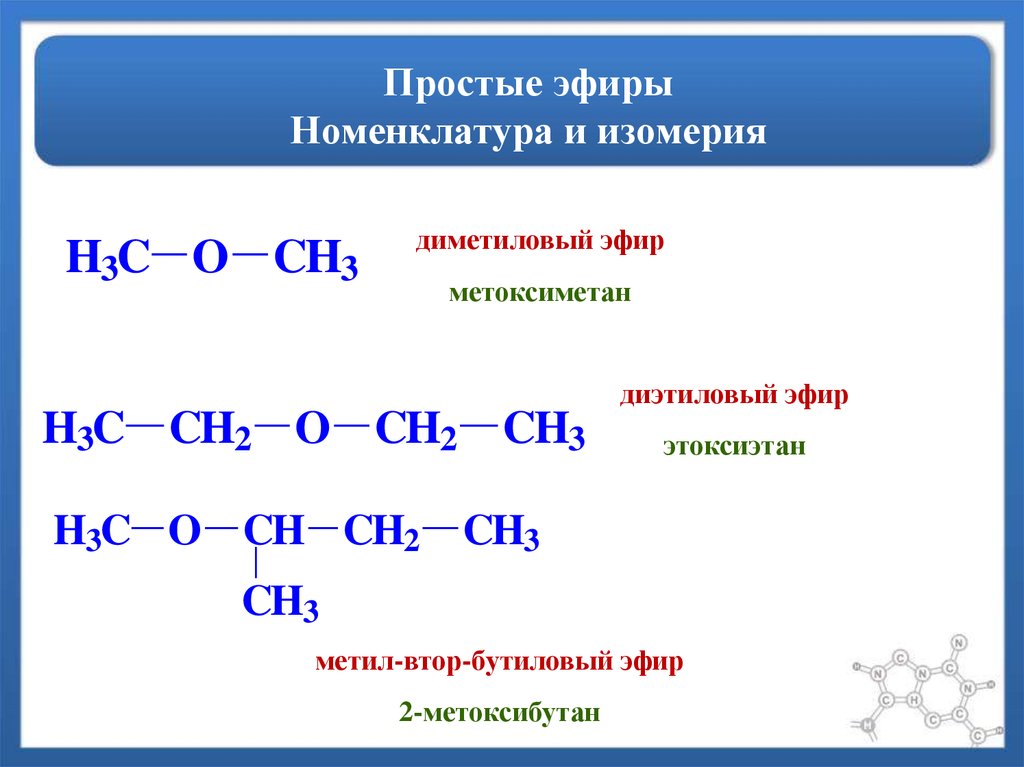 Например, CH 3 –O–CH 2 CH 2 CH 3 представляет собой метилпропиловый эфир. Если обе группы совпадают, перед названием группы должен стоять префикс di -, как в случае диметилового эфира (CH 3 –O–CH 3 ) и диэтилового эфира CH 3 CH 2 – О–СН 2 СН 3 .
Например, CH 3 –O–CH 2 CH 2 CH 3 представляет собой метилпропиловый эфир. Если обе группы совпадают, перед названием группы должен стоять префикс di -, как в случае диметилового эфира (CH 3 –O–CH 3 ) и диэтилового эфира CH 3 CH 2 – О–СН 2 СН 3 .
Молекулы эфира не имеют атома водорода при атоме кислорода (то есть группы ОН). Следовательно, межмолекулярная водородная связь между молекулами эфира отсутствует, и поэтому эфиры имеют довольно низкие температуры кипения для данной молярной массы. Действительно, температуры кипения простых эфиров примерно такие же, как у алканов сравнимой молекулярной массы, и значительно ниже, чем у соответствующих спиртов (таблица \(\PageIndex{1}\)).
| Краткая структурная формула | Имя | Молярная масса | Температура кипения (°С) | Межмолекулярная водородная связь в чистой жидкости? |
|---|---|---|---|---|
| CH 3 CH 2 CH 3 | пропан | 44 | –42 | нет |
| СН 3 ОСН 3 | диметиловый эфир | 46 | –25 | нет |
| CH 3 CH 2 OH | спирт этиловый | 46 | 78 | да |
| CH 3 CH 2 CH 2 CH 2 CH 3 | пентан | 72 | 36 | нет |
| CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир | 74 | 35 | нет |
| CH 3 CH 2 CH 2 CH 2 OH | бутиловый спирт | 74 | 117 | да |
Однако молекулы эфира содержат атом кислорода и образуют водородные связи с молекулами воды.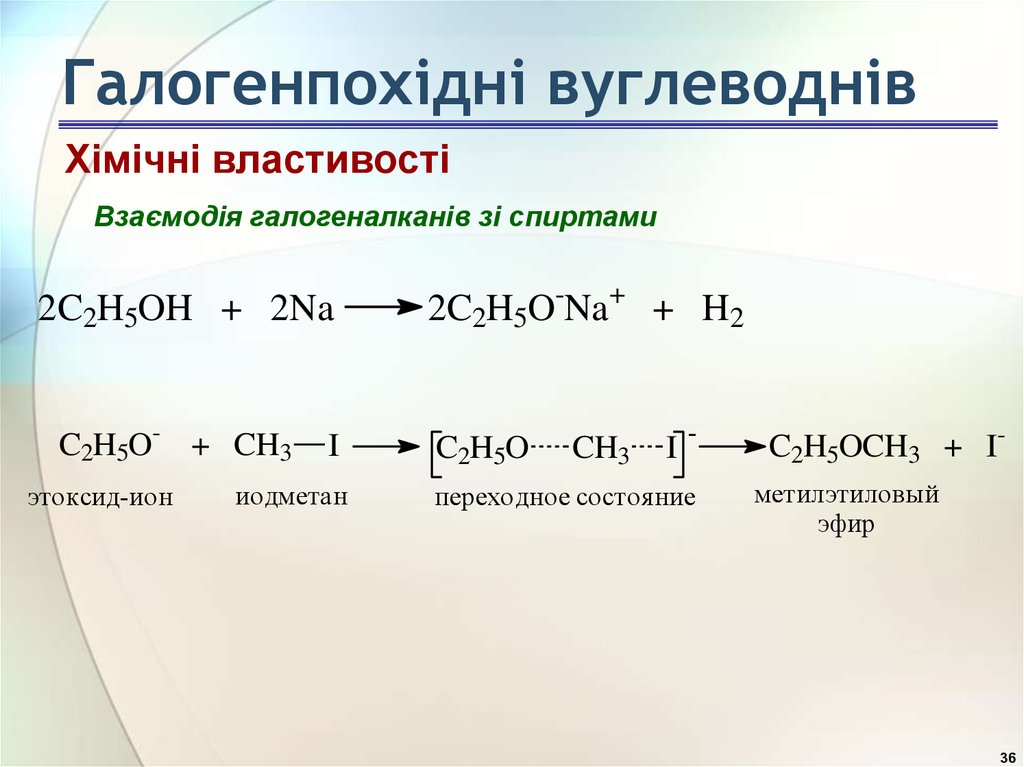 Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) мало растворимы в воде (8 г/100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) мало растворимы в воде (8 г/100 мл воды).
Пример \(\PageIndex{1}\)
Каково общее название каждого эфира?
- CH 3 CH 2 CH 2 OCH 2 CH 2 CH 3
Решение
- Углеродные группы по обе стороны от атома кислорода представляют собой пропильные группы (CH 3 CH 2 CH 2 ), поэтому соединение представляет собой дипропиловый эфир.
- Трехуглеродная группа присоединена к среднему атому углерода, поэтому это изопропильная группа. Одноуглеродная группа представляет собой метильную группу.
 Соединение представляет собой изопропилметиловый эфир.
Соединение представляет собой изопропилметиловый эфир.
Упражнение \(\PageIndex{1}\)
Каково общее название каждого эфира?
- CH 3 CH 2 CH 2 CH 2 OCH 2 CH 2 CH 2 900 90 8 CH 3
Для вашего здоровья: эфиры в качестве общих анестетиков
Общий анестетик воздействует на мозг, вызывая потерю сознания и общую нечувствительность к ощущениям или боли. Диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) был первым общим анестетиком, который использовался.
Диэтиловый эфир относительно безопасен, поскольку существует довольно большой разрыв между дозой, вызывающей эффективный уровень анестезии, и летальной дозой. Однако, поскольку он легко воспламеняется и имеет дополнительный недостаток, вызывающий тошноту, его заменили более новыми ингаляционными анестетиками, включая фторсодержащие соединения галотан, энфлуран и изофлуран. К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины, работающие в операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.
К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины, работающие в операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.
Чтобы дать эфирам общие названия, просто назовите группы, присоединенные к атому кислорода, а затем общее название эфир . Если обе группы одинаковые, перед названием группы должен стоять префикс di -. Молекулы эфира не имеют группы ОН и, следовательно, не имеют межмолекулярных водородных связей. Следовательно, эфиры имеют довольно низкие температуры кипения для данной молярной массы. Молекулы эфира имеют атом кислорода и могут образовывать водородные связи с молекулами воды. Молекула эфира имеет примерно такую же растворимость в воде, как изомерный ей спирт.
Эта страница под названием 14.8: Ethers распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.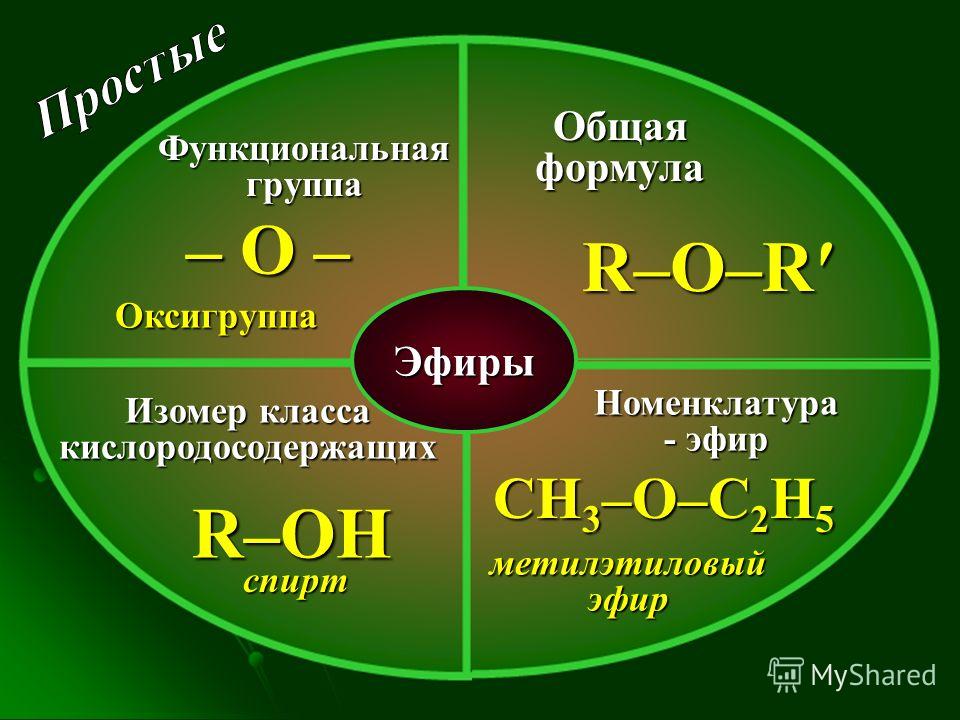

 9
9
 №: US 20140275636A1
№: US 20140275636A1 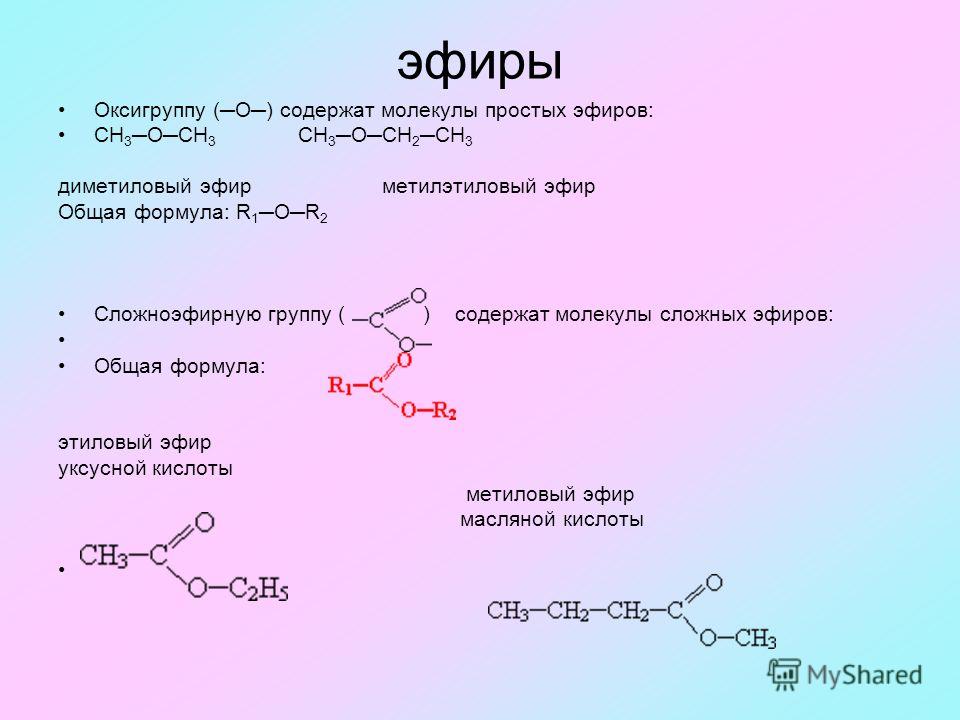 Диизопропиловый эфир иногда используется в качестве растворителя, но требует еще большей осторожности при обращении и хранении по сравнению с другими эфирами, так как он еще более склонен к образованию взрывоопасных перекисей.
Диизопропиловый эфир иногда используется в качестве растворителя, но требует еще большей осторожности при обращении и хранении по сравнению с другими эфирами, так как он еще более склонен к образованию взрывоопасных перекисей.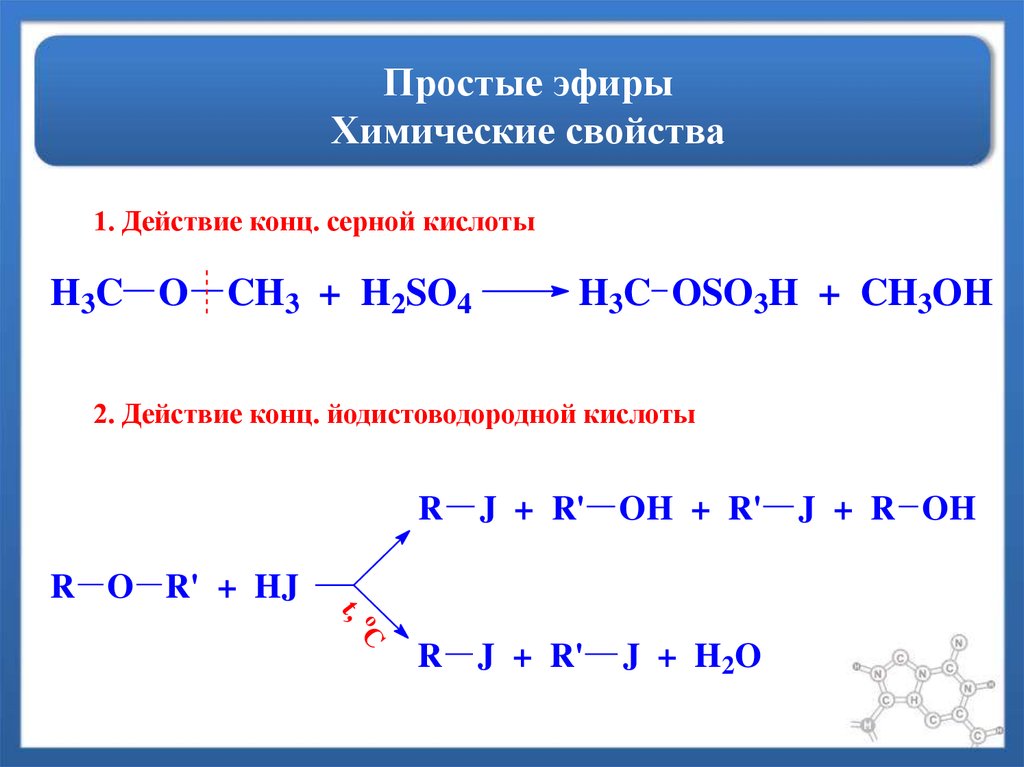
 Соединение представляет собой изопропилметиловый эфир.
Соединение представляет собой изопропилметиловый эфир.