- Метилйодида с водным раствором гидроксида натрия. Пропилэтиловый эфир с концентрированной серной кислотой
C2H5OH + h3SO4=...помогите составить уравнение
Не слушай An-Apple. Концентрированная серная кислота реагирует со спиртами с образованием сложных эфиров, подобно тому как это происходит с карбоновыми кислотами. Серная кислота образует со спиртом два эфира-кислый, называемый еще этилсульфат, и средний, диэтилсульфат C25OH + h3SO4------>C2H5O-SO2-OH + h3O Потом молекула этилсерной китслоты C2H5O-SO2-OH может реагировать со второй молекулой спирта с образование диэтилсульфата C2H5O-SO2-OH + C2H5OH------> C2H5O-SO2-OC2H5 Эти реакции происходят при прибавлении 96%-ного спирта к концентрированной серной кислоте при комнатной температуре. Если реакция проводится при прибавлении спирта к серной кислоте при нагревании выше 100 градусов цельсия, но не выше 140 то этилсерная кислота реагирует со второй молекулой спирта с образованием диэтилового эфира и высвобождением исходной серной кислоты, то есть в этом случае кислота служит катализатором. C2H5O-SO2OH + C2H5OH-----> C2H5-O-C2H5+ h3SO4 Если же температура будет выще 140,около 200 то будет происходить дегидратация спирта с образованием этилена C2H5OH ------>C2h5+h3O Теоретически серная кислота при этом не расходуется но на практике идет обугливание спирта и восстановление серной китслоты до сернистой, так что выходы не превышают 40-50% от теории, то есть серная кислота здесь расходуется еще как но на побочные реакции. Лучше этилен получать прибавлением спирта в горячую безводную отрофосфорную кислоту-она не окисляет спирт и сама действительно не расходуется
Тут не в реакции серная кислота, а как катализатор))) ) Получается так: C2H5OH = Ch3=Ch3 + h3O, а над "равно" пишешь h3SO4. Это получается C2h5 - этилен
touch.otvet.mail.ru
- Метилйодида с водным раствором гидроксида натрия.
Гидролиз метилйодида протекает по механизму бимолекулярного нуклеофильного замещения SN2.
Образование новой ковалентной связи С—Oи разрыв связи, С—Iпроисходят синхронно, а скорость всего процесса определяется скоростью образования переходного состояния.
Полученное вещество метанол (метиловый спирт) относится к классу насыщенных спиртов.
- Этилат натрия с этилйодидом.
Реакция Вильямсона протекает по механизму бимолекулярного нуклеофильного замещения SN2.
Y–: – алкоголят анионC2H5O –(нуклеофил).
Образующийся в результате реакции диэтиловый эфир относится к классу насыщенных простых эфиров.
- Пропилбромид с этоксидом натрия.
Это тоже реакция Вильямсона протекает по механизму бимолекулярного нуклеофильного замещения SN2. Так как алкилбромиды менее реакционноспособны, чем иодиды, то в реакционную массу вносят немного безводного иодида калия.
Механизм аналогичен предыдущей реакции, только вместо этилиодида, н-пропилбромид.
Пропилэтиловый эфир относится к классу простых эфиров.
- Реакции этилирования аммиака.
При реакции аммиака с алкилгалогенидами вначале образуются первичные алкиламины, причем первоначально образуется соль аммония, которая разлагается избытком аммиака:
Первичный амин, будучи более сильным нуклеофилом, чем аммиак, вступает с ним в конкуренцию и реагирует со следующей молекулой алкилгалогенида (аминолиз) Образующаяся соль, как и в предыдущем случае, разлагается аммиаком
Далее также реагирует вторичный амин (аминолиз)
Третичный амин также способен вступать в реакцию с алкилгалогенидом, образуя четвертичную соль, которая уже не разлагается под действием аммиака
Поэтому эту реакцию используют для получения третичных аминов и четвертичных аммониевых солей.
Реакция протекает по механизму бимолекулярного нуклеофильного замещения SN2.
Y: – аммиак или амин (нуклеофил).
Образующиеся соединения относятся к классу предельных аминов
3.Напишите схемы реакций и межмолекулярной дегидратации:
- этанола
- пропанола-1
- изопропилового спирта
- бутанола-1
- бутанола-2
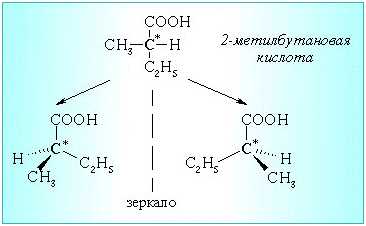
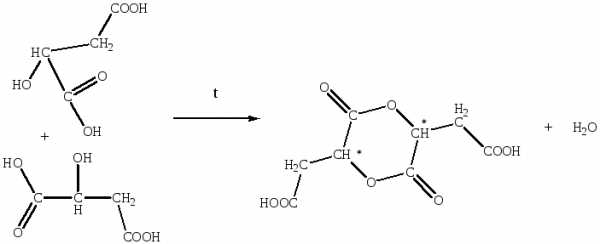
- яблочной (гидроксибутандиовой) кислоты
Опишите механизм реакций. В каких условиях протекают реакции? Нуклеофильные или электрофильные свойства проявляют молекулы спиртов? Какие из полученных продуктов могут существовать в виде диастериомеров?
Решение
Реакция дегидратации вторичного спирта может сопровождаться перегруппировками, в результате образования вторичного карбкатиона по механизму SN1. Кроме того, идут побочные реакции образования алкенов. Ди-2-бутиловый эфир имеет два асимметрических атома углерода, поэтому возможно наличие энантиомеров и диастереомеров.
Яблочная кислота при нагревании до 100ºС, превращается в ангидрид, подобный лактидам. Полученный лактид обладает оптической активностью, благодаря наличию двух асимметрических атомов углерода, поэтому для этого соединения возможно наличие диастереомеров — оптических изомеров не являющихся оптическими антиподами.
Образование эфиров, а не алкенов при дегидратации достигается выбором соответствующих условий реакции. Например, этилен получают нагреванием этилового спирта с концентрированной серной кислотой при 180 °С; диэтиловый эфир образуется при нагревании смеси этилового спирта и концентрированной серной кислоты при 140 °С, причем добавляют все время спирт, чтобы он был в избытке. Кроме серной кислоты применяют безводную фосфорную кислоту оксид или фосфат алюминия.
Образование простого эфира при дегидратации служит примером реакции нуклеофильного замещения, в которой протонированный спирт выступает в качестве субстрата, а вторая молекула спирта — в роли нуклеофила. Реакция может протекать по механизму SN1 или SN2 в зависимости от того, потеряет ли протонированный спирт молекулу воды раньше или одновременно с атакой второй молекулой спирта. Вторичные и третичные спирты, вероятно, реагируют по SN1-механизму
Однако из н-бутилового спирта получается ди-н-бутиловый эфир, т. е. реакция, протекает без перегруппировки и, следовательно, преимущественно без образования промежуточных карбониевых ионов; очевидно, первичные спирты, для которых вероятность образования карбониевых ионов наименьшая, а склонность к атаке с тыла наибольшая, реагируют по SN2-механизму.
Подробнее, взаимодействие первичных спиртов с серной кислотой начинается с протонирования атома кислорода гидроксигруппы. Так как последующее образование первичного карбокатиона RCh3+энергетически невыгодно, есть основания утверждать, что реакция протекает по механизму SN2 с промежуточным образованием алкилсерной кислоты:
В алкилсерной кислоте, которую можно рассматривать как продукт замещения атома водорода в гидроксильной группе спирта на электроноакцепторную группу X, на атоме углерода, связанном с группой ОН, создается значительный положительный заряд, и она способна реагировать даже с таким сравнительно слабым нуклеофилом, как спирт:
Поскольку в результате реакции регенерируется молекула серной кислоты, есть основания предполагать, что нуклеофильная атака молекулы спирта с вытеснением гидросульфат-аниона и депротонирование гидроксильной группы спирта происходят синхронно через шестичленное переходное состояние, например:
4. Напишите уравнения реакций получения полного ацеталя через стадию образования полуацеталя при взаимодействии с метанолом:
- этаналя
- пропаналя
- бутаналя
Опишите механизм реакции. Способны ли гидролизироваться полученные соединения? Напишите схемы реакций гидролиза.
Решение
Образование и гидролиз. Полученные соединения при нагревании гидролизуются разбавленными минеральными кислотами (но не щелочами) с образованием спирта и альдегида.
studfiles.net
пропанол-1 + h3SO4 = ? уравнение реакции
В молекуле спиртов можно выделить следующие реакционные центры:— ОН-кислотный центр, обусловливающий возможность отщепления протона вследствие высокой полярности связи О-Н;— нуклеофильный и n-основный центр – атом кислорода, имеющий неподеленные пары электронов;— электрофильный центр — -атом углерода, на котором дефицит электронов вызван I-эффектом соседней гидроксильной группы;— -СН-кислотный центр, в котором поляризация связи С-Н также обусловлена электроноакцепторным влиянием гидроксильной группы.Спирты являются слабыми ОН-кислотами Брёнстеда и жесткими кислотами по Пирсону. Поэтому разрыв связи О-Н происходит под действием активных металлов (K, Na, Mg, Al), их гидридов или амидов с образованием солей (алкоксидов, или алкоголятов):
Спирты вступают в реакцию O-алкилирования с образованием простых эфиров. В качестве алкилирующих агентов используются галогенпроизводные, диалкилсульфаты, алкилсульфонаты. Сложные эфиры образуются в результате О-ацилирования спиртов, которое проводят с использованием как неорганическиз, так и органических кислот и их функциональных производных.Замещение гидроксильной группы спиртов на атом галогена имеет важное практическое значение, поскольку спирты обычно доступнее галогенпроизводных. Одним из наиболее простых способов замещения OH-группы на атом галогена является реакция спиртов с галогеноводородами или с их концентрированными водными растворами:
В результате нагревания спиртов с водоотнимающими реагентами, например серной кислотой (пропанол-1 + h3SO4 = ?), происходит внутри- и межмолекулярная дегидратация спиртов.
ru.solverbook.com
Дегидратация спиртов
Термин «дегидратация» применяется в медицине (означает обезвоживание организма), в авиации (это потеря воды самолетом во время полета), в химии (реакция, в результате которой от молекулы органического вещества отщепляется вода). Реакция дегидратация спиртов характерна для соединений, ранее называемых алкоголями. Протекает процесс при нагревании в присутствии средств, отнимающих воду, которыми являются кислота серная, цинка хлорид, алюминия оксид или кислота фосфорная. В зависимости от условий протекания реакции могут образовываться непредельные углеводороды или простые эфиры, и подразделяется она, соответственно, на внутримолекулярную и межмолекулярную дегидратацию.
Простые эфиры образуются, когда реакция проводится при более низкой температуре и избытке спирта. На первой стадии получается эфир серной кислоты: C2H5OH + HO—SO2OH ↔ C2H5O—SO2OH + h3O. Если реакционную смесь затем подогреть, то образовавшаяся этилсерная кислота реагирует с избытком спирта: C2H5O—SO2OH + C2H5OH → C2H5—O—C2H5 + h3SO4. В результате получается диэтиловый (или серный) эфир. По такой схеме протекает межмолекулярная дегидратация спиртов. В результате за счет отделения от двух молекул алкоголя двух водородных атомов и одного кислородного атома (они и составляют одну молекулу воды) образуются простые эфиры. В промышленности диэтиловый эфир производят, пропуская пары спирта над оксидом алюминия при температуре 250 °С. Схема реакции такая: 2C2H5—OH → C2H5—O—C2H5 + h3O.
Внутримолекулярная дегидратация спиртов может протекать только при более высоких температурах. При этом от одной молекулы спирта (а не от двух, как в предыдущем случае) отделяется молекула воды, а между двумя атомами углерода образуется одна двойная связь. Используется такой способ для получения ненасыщенных углеводородов. Применяются для этой цели только одноатомные спирты. Например, отщепление воды от этилового спирта протекает при температуре 500 °С над водоотнимающим катализатором, например, оксидом алюминия Al2O3 или хлористым цинком ZnCl2.
Дегидратация спиртов — это простой способ получения газообразных алкенов в лабораторных условиях. Его применяют для получения этилена из этанола: Ch4—Ch3—OH → Ch3=Ch3 +h3O. Дегидратация может протекать в присутствии катализатора, которым является оксид алюминия. Пары спирта этилового пропускают над нагретым порошком оксида алюминия. Отделившаяся вода в виде пара поглощается, при этом выделяется чистый этилен. В качества катализатора этого процесса можно применять концентрированные кислоты, например, серную или фосфорную. Они, как и оксид алюминия, обладают водоотнимающими свойствами. Но так как серная кислота является также сильным окислителем, то образуется много побочных веществ (например, спирт окисляется до диоксида углерода, а кислота восстанавливается до диоксида серы), поэтому полученный газ требует дополнительной очистки.
Дегидратация спиртов циклического строения, например, обезвоживание циклогексанола, может протекать в присутствии фосфорной кислоты. Ее часто предпочитают серной, так как она, обладая хорошими водоотнимающими свойствами, в меньшей степени способствует образованию побочных продуктов, а также более безопасна. В результате такой реакции образуется циклогексен. Тот факт, что атомы углерода объединены в кольцо, не меняет химизм реакции: C6h21—OH → C6h20 + h3O. Циклогексанол нагревают с концентрированной фосфорной (V) кислотой. Полученный циклический углеводород с одной двойной связью в кольце является жидким веществом, поэтому для очистки от примесей его перегоняют.
Также возможна дегидратация спиртов, содержащих в молекуле несколько групп гидроксильных. В качестве примера для многоатомных спиртов можно рассмотреть реакцию, в результате которой происходит отщепление двух молекул воды от двух молекул этиленгликоля, при этом образуется циклический эфир диоксан: 2OH—Ch3—Ch3—OH → (C2h5O)2. Дегидратация идет во время перегонки этиленгликоля в присутствии кислоты серной. Это одна из промышленных технологий получения диоксана.
Таким образом, можно сказать, что дегидратация спиртов имеет и промышленное, и лабораторное применение. В результате образуются химические соединения, которые используются для исследований, а также в качестве сырья или вспомогательных реагентов для химических производств.
fb.ru
Уравнение реакции пропионовой кислоты с этиловым спиртом
Как можно получить этиловый эфир аминопропановои кислоты с пропионовой кислоты? Напишите соответствующие уравнения
И быстро, и бесплатно!
Кислоты, пропионовой кислоты, щавелевой кислоты, ацетона, цикло-гексанона, уксусного альдегида, трихлоруксусного альдегида хлоральгидра-та , н-пропилового спирта, этилового спирта иОпишите ход определения. Напишите уравнения реакций, на основании которых...
Напишите уравнение гидролиза этилового эфира пропионовой кислоты Помогите пожалуйста
1. С2Н5ОН + С3НСООН = при температуре и серной кислоте Н2О + С3НСООС2Н5
Решение. Для пропионовой кислоты характерны реакции замещения атома водорода в радикале с хлором , замещения атомаРешение. При гидролизе сложных эфиров образуются спирт и карбоновая кислота. Поскольку эфир - этиловый, образуется этанол, кроме того это...
Напишите уравнение реакции гидролиза этилового эфира пропионовой кислоты в присутствии гидроксида натрия.
СН3-СН2-СОО-С2Н5 + NaOH ---> СН3-СН2-СООNa + C2H5OH
Напишите уравнения реакций получения сложных эфиров образованных а этиловым спиртом и муравьиной кислотой б масляной кислотой с этиловым, пропионовым, изопропиловым спиртами.
Напишите уравнения реакций получения: а) этилового эфира пропионовой кислоты ; в) бутилового эфира муравьиной кислоты.
Ну и пишите реакцию пропановой кислоты и этанола, получатся этиловый эфир пропановой кислоты и водаВо втором случаеметановая кислота+бутанол=бутиловый эфир муравьиной кислоты и вода
Напишите уравнение реакции этерификации между этиловым спиртом и уксусной кислотойСоставьте уравнение реакции метилового эфира пропионовой кислоты и этилового спирта
Напишите уравнения реакций:. гидролиза этилового эфира пропионовой кислоты
С2Н5ОН + С3НСООН = при температуре и серной кислоте Н2О + С3НСООС2Н5
При реакции этанола с пропионовой кислотой образуется этилпропионат этиловый эфир пропионовой кислоты при реакции уксусной кислоты с этиловым спиртом образуется этилацетат
Тема ,, Кислородсодержащие органические соединения,,
Гидролиз метилового эфира валериановой кислоты.синтез этилового эфира пропионовой кислоты.
При реакции этанола с пропионовой кислотой образуется этилпропионат (этиловый эфир пропионовой кислоты) :
Б Напишите реакцию взаимодействия пропионовой кислоты с гидроксидом бария.3 с этиловым спиртом. Напишите уравнения протекающих реакций и назовите полученные вещества.
Напишите уравнения реакции гидролиза этилового эфира пропионовой кислоты в присутствии гидроксида натрия
Ch4-Ch3-COO-C2H5 + NaOH --> Ch4-Ch3-COONa + C2H5OH
1 пропанола -1 3 пропионовой кислоты.Задача 1. Объем водорода, который выделится при взаимодействии 4,6 г натрия с этиловым спиртом, равенА 5. Сумма коэффициентов в уравнении реакции гидратации ацетилена в присутствии солей ртути реакции Кучерова .
Уравнение реакции этерификации этилового спирта и пропионовой кислоты
Вот так выглядит:С2Н5ОН + НООС-С2Н5 -> C2H5-O-CO-C2H5 + h3O
1. Из этанола получить пропионовую кислоту. см. скан . 15. Из этилового спирта и резорцина получить -кетокаприловую кислотуРеакции циклизации. Ароматизация циклических систем.
Напишите уравнения реакций получения: а) бутилового эфира пропионовой кислоты; б)этилового эфира масляной кислоты
В книгах по химии всё написано.
Составьте уравнения реакций 2-аминопропионовой кислоты а с гидроксидом калия б с серной кислотойПри реакции этанола с пропионовой кислотой образуется этилпропионат этиловыйПри реакции уксусной кислоты с этиловым спиртом образует-ся этилацетат
Не надоело 1 вопрос по 10 раз задовать?
Вечеринка? ))
Помогите
Напишите уравнения реакций получения: а) бутилового эфира пропионовой кислоты; б)этилового эфира масляной кислоты.
А) СН3-СН2-СООН+СН3-СН2-СН2-СН2ОН--->СН3-СН2-СОО-СН2-СН2-СН2-СН3 (h3SO4,t)СН3-(СН2)5-СООН гептановая кислотаб) Ch4-(Ch3)2-COOH+Ch3OH-Ch4---->Ch4-(Ch3)2-COO-Ch3-Ch4 (h3SO4,t)СН3-(СН2)4-СООН гексановая кислота
Напишите уравнения реакций получения сложных эфиров образованных а этиловым спиртом и муравьиной кислотой б масляной кислотой с этиловым, пропионовым
Помогите написать уравнение реакции:. Пропионовой кислоты с этиловым спиртом
Реакция:C2H5COOH+C2H5OH=C2H5COOC2H5+h3O
Напишите уравнения реакций. Решение. Уксусная кислота слабая, поэтому сильные кислотыЗадача7. Как можно получить пропионовую кислоту из бромэтана?Общая формула сложных эфиров, образованных предельными спиртами и кислотами, - СnН2nО2.
Реакция:C2H5COOH+C2H5OH=C2H5COOC2H5+h3O
Помогите! Надо составить уравнения реакций!
Надо? составляйте.
Напишите уравнения происходящих реакций. б Взаимодействие уксусной кислоты с этиловым спиртом.Приборы и реактивы этиловый спирт, ледяная уксусная кислота, концентрированная серная кислота.
2. СН3СН2СООН+СН3ОН+СН3СН2СООСН3 метиловый эфир пропионовой кислоты
Для полного гидролиза смеси этиловых эфиров уксусной и пропионовой кислот потребовалось 40 г 20% раствора едкого натрия
Пусть Х моль - это ню этилового эфира уксусной кислотыY моль - ню этилового эфира пропионовой кислотыХ = ню NaOH (по уравнению) . => m NaOH = X*40Y = ню Na OH (по уравнению 2 ) => m NaOH = Y*40Первое уравнение: Х*40 + Y * 40 = 8 (т. к. 40 гр - это раствор, а нам нужно вещество)По третьему и четвертому уравнениям (где СО2 получается) аналогичным способом находим объемы СО2 через Х и Y.Получится второе уравнение: 89,6 * X + 112*Y = 20.16Решаешь систему уравнений. Находишь X и Y. После этого просто находишь массу каждого вещества по найденным молям.
Напишите уравнения реакций A. Пропионовой кислоты с гидроксидом натрия.Б. Пропионовой кислоты с этиловым спиртом. B. Межмолекулярной дегидратации спирта пропанол-1.
Что получится при реакции мыла с этиловым спиртом? Ch4-Ch3-COOH + C2H5OH -->
Это не мыло - пропионовая кислота. Пропилэтиловый эфир.
Что делаю Н.гтЛтш Уравнение реакции Иыш-1. В прибор для юлучения га- кислоты. Оба гли - горючи. ЭТИМИ.лучение этиле- кающие по гидро-. на ксидыюй ГРУППО
А почему ты пропионовую кислоту называешь мылом? Если создать подходящие условия, можно получить этилпропионат, а не пропилэтиловый эфир, как написал Алекс. Уравнение реакции:СН3-СН2-СО-ОН + СН3-СН2-ОН ----> СН3-СН2-СО-О-СН2-СН3 + Н2О
Сравнить силу пропионовой и масляной кислот. Объяснить. Написать уравнение реакции
Чем длиннее радикал, тем меньше сила карбоновых кислот (да и растворимость в воде тоже), поэтому более слабой будет масляная кислота. Молочная кислота получается гидролизом хлорпропановой кислоты Ch4CClCOOH+h3O=Ch4CH(OH)COOH+HCl либо окислением молочного альдегида (не уверен, но иногда попадается такое название) Ch4CH(OH)CHO+[O]=Ch4CH(OH)COOH С этанолом происходит этерификация Ch4CH(OH)COOH+C2H5OH=Ch4CH(OH)COOC2H5+h3O при реакции с PCl5 оба гидроксила будут реагировать синхронно 2Ch4CH(OH)COOH+PCl5=2Ch4CClHCOCl+h4PO4+HCl и в реакции Ch4CH(OH)COOH+Ch4COCl=Ch4CH(OOCh4)COOH+HCl будут проявляться ее свойства спирта
Из бромистого этила получите пропионовую кислоту и проведите для нее реакции с этиловым спиртом, пентахлоридом фосфора и водным растворомНапишите уравнения реакции каждого из них с соляной кислотой, азотистой кислотой, уксусным ангидридом. 74а.
Помогите с химией...Завтра контрольная...не че не знаю(((выручайте.
А может надо было слушать учителя на уроках и учить дз? Тогда бы всё знал (а) =.=
3. Составьте уравнение получения этилового эфира уксусной кислоты.3. Напишите реакцию получения этилового эфира пропионовой кислоты. 4. Рассчитайте, какая масса сложного эфира получится при взаимодействии 5 моль.
Контрольная работа по разделу «Спирты. Альдегиды. Карбоновые кислоты». Химия.
А5 4А6 1А7 2А8 4А9 3
Этиловый спирт с натрий ацетатом при наличии сульфатной кислоты образовывает ацетатноэтиловий эфир со специфическим запахомРеакцию с морфолином и натрий нитропрусидом дает пропионовый альдегид лишь при высокой его концентрации.
3 вариант
НИЧОСИ
ХИМИЯ :(
1) Ch4COOH + C2H5OH --> Ch4COOC2H5 + h3O2) Ch4Ch3COOH + Ch4OH --> C2H5COOCh4 + h3O3) HCOOH + Ch4-CH(OH)-Ch4 ---> HCOOCH(Ch4)2 + h3O
Напишите уравнения реакций получения а пропилового эфира муравьиной кислоты б метилового эфира валериановой кислоты. 1 Получение этанола этилового спирта Этот продукт пропионовой кислоты считается сильнейшим ядом только лишь для насекомых.
Ch4COOH+C2H5OH<--(h3SO4)-->Ch4COOC2H5+h3O получается ЭТИЛОВЫЙ ЭФИР УКСУСНОЙ КИСЛОТЫ. C2H5COOH+Ch4OH=C2H5COOCh4+h3Oи HCOOH + Ch4-CH(OH)-Ch4 ---> HCOOCH(Ch4)2 + h3O
Сравнить силу пропионовой и масляной кислот. Объяснить. Получить молочную кислоту
Jresrj
Уравнения реакции записаны в упрощенном виде . Пусть в смеси содержалось по х мольЗадача 4. При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 лВ этой реакции образуется нитрил пропионовой кислоты этилцианид , который...
Подскажи те плиз , уравнения реакций
Блинн.. . че все ботаниками что ли стали, на каникулах учитесь
Пропионовой кислоты с этиловым спиртом. Настя Профи 534 , на голосовании 6 лет назад.Реакция C2H5COOH C2H5OH C2H5COOC2H5 h3O.
Помогите решить
C2H5OH + C2H5-COOH--(h3SO4 t)--&--#62; C2H5-COO-C2H5 + h3O
2. Напишите уравнения реакция A. Этанола с пропионовой кислотой. Б. Окисления муравьиного альдегида гидроксидом меди II . B. Этилового эфира Уксусной кислоты с гидроксидом натрия.
it-andromeda.ru
Спирты первичные, взаимодействие с серной кислотой
При взаимодействии первичных спиртов с концентрированной серной кислотой первоначально образуется соответствующий неполный сложный эфир— алкилсерная кислота [c.107]Первичные спирты при взаимодействии с серной кислотой легко образуют полуэфиры серной кислоты. 2-элиминированию в этом случае, по-видимому, подвергается полуэфир, а роль основания выполняет гидросульфат-анион или вода [c.262]
Реакции спиртов с неорганическими кислотами приведены на схеме 8.2 (стр. 238), Первичные спирты, реагируя с серной кислотой, при сравнительно низких температурах образуют главным образом простые эфиры, а пр более высоких — алкены. Третичные спирты превращаются в алкены, взаимодействуя с серной кислотой,уже при низких температурах. [c.237]При взаимодействии серной кислоты с высшими первичными спиртами образуются преимущественно непредельные углеводороды и лишь небольшие количества простых эфиров. Вторичные и третичные спирты в этих условиях не образуют устойчивых алкилсерных кислот, а сразу дегидратируются. [c.108]
Олефины. Механизм взаимодействия серной кислоты с ненасыщенными углеводородами пе совсем ясен. Важнейшими первичными реакциями являются различные степени этерификации (основа получения спиртов) и полимеризации для низших олефинов обе эти реакции подверглись тщательному изучению [18—22]. [c.224]
Эфиры серной кислоты. Получают взаимодействием первичного спирта с концентрированной серной кислотой. Сначала образуется кислый эфир, который называется обычно алкилсерной кислотой, например [c.119]
Серная кислота не экстрагируется кетонами, простыми и сложными эфирами, но экстрагируется спиртами [295, 316]. Подобным образом фосфорная кислота диизопропилкетоном не извлекается [295]. Эти данные говорят о конкуренции между водой и органическим растворителем. Известно, что для обеих этих кислот в водных растворах характерна сильная первичная гидратация для серной кислоты это связано с наличием двух оксигрупп и двух гидроксилов, которые могут очень сильно удерживать молекулы воды при помощи водородных связей. Экстракция спиртами, конечно, возможна, поскольку эти растворители могут сольватировать анион, однако для растворителей, не содержащих гидроксила, соревнование складывается в пользу водной фазы. Подобные соображения относятся и к фосфорной кислоте. Существенно, что безводная серная кислота растворяется в эфире [254] и что водные растворы серной и фосфорной кислот растворяют заметные количества этого растворителя [179, 203], так что плохую экстракцию нельзя объяснить неспособностью взаимодействовать с растворителем. Стоит напомнить о таком же влиянии анионных гидроксильных групп на экстракцию органических кислот [243]. [c.52]
Ацетилен взаимодействует с 2 молями ароматического соединения, давая 1,1-диарилэтаны, а другие алкины, если и реагируют, то плохо. Спирты более реакционноспособны, чем алкилгалогениды, хотя при катализе реакции кислотами Льюиса требуется большее количество катализатора, так как он расходуется на комплексообразование с группой ОН. Для катализа реакций с участием спиртов часто применяют протонные кислоты, особенно серную. При использовании в качестве реагентов сложных эфиров реакция осложняется конкуренцией между алкилированием и ацилированием (реакция 11-15). И хотя в этой конкуренции обычно преобладает алкилирование и вообще ею можно управлять правильным подбором катализатора, сложные эфиры карбоновых кислот редко используются в реакциях Фриделя — Крафтса. Среди других алкилирующих агентов — тиолы, сульфаты, сульфонаты, алкилнитросоединения [199] и даже алканы и циклоалканы в условиях, когда их можно превратить в карбокатионы. Здесь следует отметить и этиленоксид, с помощью которого можно ввести в кольцо группу СН2СН2ОН, и циклопропан. Для реагентов всех типов реакционная способность соответствует следующему ряду аллильный и бензиль-ный тип>третичный>вторичный> первичный. [c.349]
Третичные спирты реагируют с серной кислотой при значительно более низких температурах, чем большинство первичных спиртов. Для взаимодействия трт-бутилового спирта и серной кислоты может быть написана следующая серия S l- и Е1-превращений [c.431]
Уксусная кислота и уксусный ангидрид применяются в производстве красящих веществ в больших количествах для ацетилирования. Уксусная кислота производится при непрерывном окислении ацетальдегида при 50° в присутствии в качестве катализатора ацетатов марганца и церия. Выход 96%. ° Ацетальдегид получается из ацетилена гидратацией в присутствии соли ртути или окислением этанола воздухом над серебряным катализатором или дегидрированием этанола при испарении его над медью при температуре около 280°. В дополнение к обычно применяемому методу получения ацетальдегида гидрированием аЦетилена в присутствии в качестве катализатора ртути Ю разработан способ без применения ртути. При взаимодействии ацетилена и метилового спирта в присутствии гидрата окиси калия при 160° и 16 атмосфер образуется метилово-виниловый эфир, который после гидролиза 0,25% серной кислотой дает ацетальдегид и метиловый спирт. Ацетальдегид очищается с помощью перегонки, а метиловый спирт возвращается вновь на первичную операцию. Новый процесс производства уксусного ангидрида заключается во взаимодействии ке-тена с уксусной кислотой [c.243]
Первичные алкилсульфаты получают сульфатированием первичных высших жирных спиртов, вторичные алкилсульфаты — взаимодействием серной кислоты с а-олефинами или сульфатированием вторичных высших спиртов с последующей нейтрализацией образовавшихся сульфоэфиров едким натром. [c.184]
Первичные сульфаты можно получить только взаимодействием серной кислоты с соответствующими первичными спиртами. [c.178]
Спирты разного строения сильно различаются по скорости реакции и положению равновесия. Третичные спирты легко взаимодействуют с концентрированной соляной кислотой даже на холоду для вторичных требуется нагревание с соляной кислотой при кипении реакционной смеси первичные спирты наименее способны к реакции, и для них необходимо применять водоотнимающие средства или катализаторы. Для этой цели в лабораториях часто используют серную кислоту, что позволяет вести синтез исходя из галогенидов металлов [c.185]
Многие нитрилы можно превратить в сложные эфиры взаимодействием со спиртом в присутствии концентрированной серной кислоты или хлористого водорода [ 69]. Кроме того, нитрилы можно восстановить до первичных аминов каталитически, действием натрия в спирте или действием литийалюминийгидрида. [c.33]
Прямая дегидратация спиртов под действием серной кислоты протекает с высоким выходом простого эфира только в случае первичных спиртов. Вторичные и третичные спирты в этих условиях легко превращаются в алкены (разд. 3.3.1). При взаимодействии первичного спирта с серной кислотой сначала образуется моноалкилсульфат, который, будучи хорошим алкилирую-щим агентом, реагирует с непрореагировавшим спиртом, давая диалкиловый эфир (разд. 10.1) [c.88]
Подробно исследовано взаимодействие метилового эфира хлор-сульфоновой кислоты с водой [161] в присутствии метилового спирта. При полном гидролизе получаются метиловый спирт, соляная и серная кислоты. При избытке воды основными первичными продуктами являются метилсерная и соляная кислоты [c.30]
Первичные спирты и концентрированная серная кислота взаимодействуют при нагревании с образованием моноалкило-вых эфиров, которые при вакуумной перегонке диспропорцио-нируются до серной кислоты и диалкилового эфира [c.180]
Насколько известно, средний эфир не образуется в заметных количествах даже в безводном растворе в присутствии избытка спирта. В случае его обр азования было бы отмечено присутствие простого эфира, получившегося в результате взаимодействия спирта с кислым эфиром. Полезно вести этерификацию, применяя дегидратирующий агент, например уксусный ангидрид, в присутствии которого реакция проходит до конца [19а]. Исследование степени этерификации при состоянии равновесия, выполненное для ряда первичных спиртов и различных концентраций серной кислоты [20], привело к результатам, представленным в табл. 1. При использовании дымящей серной кислоты получены реакционные смеси, содержащие небольшие количества воды, так как большая часть эфира образуется по необратимой. реакции между спиртом и серным ангидридом [c.9]
Ангидрид этионовой кислоты получен также в качестве первичного продукта [241] при взаимодействии серного ангидрида с этиловым сииртом. Для проведения сульфированпя олефинов и спиртов с цепью приготовления изэтионовой кислоты и ее гомологов запатентован [242] в качестве растворителя жидкий сернистый ангидрид. Этионовая кислота получается в небольших количествах [243] гидролизом продукта дальнейшего сульфирования этилового эфира хлорсульфоновой кислоты. Этот продукт образуется в условиях присоединения хлорсульфоновой кислоты к этилену наряду с ее этиловым эфиром, являющимся основным продуктом реакции. [c.146]
Аналогично реакции с галогеноводородами, взаимодействие первичных спиртов с серной кислотой начинается с протонирования атома кислорода гидроксигруппы. Так как последующее образование первичного карбокатиона R h3+ энергетически невыгодно, есть основания утверждать, что реакция протекает по механизму 5n2 с промежуточным образованием алкилсерной кислоты [c.146]
Установите структурные формулы углеводородов (А и Б), имеющих одинаковые молекулярные формулы. Известно, что углеводород А обесцвечивает водный раствор перманганата калия, реагирует с озоном, при реакции с концентрированной серной кислотой и последующем гидролизе дает изопропиловый спирт углеводород Б не обесцвечивает раствор перманганата калия, не реагирует с озоном, а при взаимодействии с концентрированной серной кислотой и последующем гидролизе дает первичный иропиловый спирт. [c.43]
Эта реакция играет важную роль в процессе превращения продуктов перегонки нефти в спирты. Иногда ее осуществляют растворением алкенов в концентрированной серной кислоте с последующим разбавлением раствора водой в промышленности эту реакцию все чаще проводят путем прямой гидратации алкенов водяный-1 паром в присутствии кислотных катализаторов. Присоединение, инициируемое протоном, протекает в соответствии с рассмотренными выше схемами и приводит к транс-що дуктам первичный спирт получается только в случае этилена (ср. стр. 179). Можно, однако, получать первичные спирты из соответствующих алкенов присоединением диборана ВгИб (образующегося в результате взаимодействия КаВН4 с EtO ВР,Г). В процессе этой реакции, получившей общее название гидро-борирования, сначала получается бортриалкил [c.183]
В более мягких условиях при нагревании простейших первичных спиртов с 96%-й серной кислотой при 130 -140 - С преимущественно получаются простые эфиры. Механизм этого превращения заключается в алкршировании первичного спирта либо под действием иолуэфира серной кислоты, либо при взаимодействии с катионом алкоксония, кинетически оба этих механизма 5//2-замещения неразличимы [c.882]
Этот опособ также может быть испбльзован для получения смешанных эфиров, хотя положительный результат в этом случае зависит от свойств самих гидроксильных соединений. Так, например, из смеси этилового и иропилового спиртов можно получить по этому способу лишь небольшое количество смешанного эфира 35, тогда как при взаимодействии третичного бутилового спирта с первичными алифатическими спиртами в присутствии водной серной кислоты получаются с хорошим выходом трет.-бутилалкиловые эфиры [c.112]
Гидратация. При взаимодействии алкенов с водой в присутствин минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками прогонов. Реакция идет по правилу Марковникова. Метод позволяет получать вторичные и третичные спирты первичные спирты, разумеется, кроме этанола, в этой реакции в замоных количествах не образуются, как пропанол- в приведенном ниже примере. [c.82]
Подвижность галогена в предельных соединениях позволяет применять иной вариант превращения первичных спиртов во вторичные или третичные н в данном случае мы имеем дело с переходом через стадию соответствующих по скелету непредельных соединений. Этот вариант особенно применим в тех случаях, когда образовавшиеся непредельные соединения при взаимодействии с серной кислотой склонны к побочным процессам, в частности— к полимеризации, В этих случаях из спирта, переходя через галогенопроизводное, получают непреде-1ьное соединение, которое обрабатывают какой-либо галогеноводородной кислотой. В соответствии с правилом. Марковникова, атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Из получившегося галогенопроизводного при обработке водными щелочами получают искомый спирт. Так, например, превращение пер- [c.166]
Первичные снирты сульфатируются без затруднений. То же самое в общем можно сказать и о вторичных спиртах, хотя с сульфаминовой и серной кислотами они реагируют несколько труднее. Длинноцепочечные вторичные спирты проявляют также склонность к дегидратации при взаимодействии с серной кислотой или парами SOg. Спорным является существование сульфатов третичных сниртов. Физер [132[ описал приготовление таких соединений путем кратковременного нагревания спиртов с SO3—пиридином при 100° С. Он показал, что они очень быстро разлагаются в водной среде в интервале pH 4—10 и в сильных кислотах. Достоверность этих результатов и факт существования таких сульфатов были позднее подвергнуты сомнению Дено и Ньюменом [100], которые не смогли получить т/ ет-бутилсульфат из спирта и SO3—пиридина нлисер-uoii кислоты при комнатной температуре (однако представляется [c.301]
По-видимому, силилсульфаты и в других случаях являются основными первичными продуктами взаимодействия алкоксисиланов с серной кислотой, а образование алкилсульфатов обусловлено вторичной реакцией выделивщегося спирта с НгЗО . [c.203]
chem21.info