Готовимся к углубленному изучению химии. Структурная формула метиловый эфир этановой кислоты
|
Биотопливо. Биодизель Biodiesel.Biotoplivo. LTD BioSam. Биодизель. биотопливо. Изготовление оборудования. Видеокурс по изготовлению биодизеля. biosam.ru рапсовое масло, животные жиры, метиловый эфир, этиловый эфир, метиловый спирт Google PageRank: 0 из 10 Яндекс ТИЦ: 10 |
Рейтинг: 24.9 |
|
|
Схема ацп структурная Структурная схема АЦП с динамической Рис. 2.2.Структурная схема АЦП с динамической К входу АЦП приложено аналоговое напряжение. Компаратор «проверяет» величину напряжения, поступающего от ЦАП. alkora.ru Google PageRank: 0 из 10 Яндекс ТИЦ: 0 |
Рейтинг: 16.0 |
|
|
Онлайн Гран-При Формулы 1 Формула 1 онлайн ! Сайт где есть всё , от гонок до новостей о Формуле 1 . Мир Формулы 1 , это Формула 1 онлайн . grand-prixf1.ru формула 1, формула сочи, формула 1 сочи 2016, формула 1 2016, формула 1 новости Google PageRank: 0 из 10 Яндекс ТИЦ: 10 |
Рейтинг: 15.2 |
|
|
Структура и свойства затвердевшего цемента - Структурная вязкость Структурная вязкость, Взаимодействие цемента с водой, Теория твердения портландцемента, Основные понятия о МВВ str-inf.ru Google PageRank: 0 из 10 Яндекс ТИЦ: 0 |
Рейтинг: 14.5 |
|
|
Добро пожаловать на главную страницу Эфир НН Беспроводной интернет efirnn.ru эфир нн, эфир нн Google PageRank: 0 из 10 Яндекс ТИЦ: 0 |
Рейтинг: 14.4 |
|
|
ООО "Химтранзит". Производство анаэробных герметиков "Фиксатор" hzt52.ru эфир, метакриловой, кислоты Рейтинг Alexa: #9,392,863 Google PageRank: 0 из 10 Яндекс ТИЦ: 10 |
Рейтинг: 14.0 |
|
|
Формула 1 онлайн, Самые свежие новости формулы 1. Самые свежие новости формулы, Формула 1, Формула 1 - новости чемпионата 2016, эксклюзивные интервью, календарь F1, личный зачет команд Гран При Формулы 1. formula1.su формула 1, формула 1, формула 1 2016, история формулы 1, формула 1 сочи Рейтинг Alexa: #3,619,527 Google PageRank: 0 из 10 Яндекс ТИЦ: 20 |
Рейтинг: 13.8 |
|
rankw.ru
Готовимся к углубленному изучению химии : 10.4 Карбоновые кислоты
10.4. Карбоновые кислоты Карбоновые кислоты – это кислородсодержащие органически вещества, молекулы которых содержат одну или несколько карбоксильных групп (-СOOH), соединённых с углеродным радикалом или водородным атомом. Карбоксильная группа содержит две функциональные группы – карбонил >С=О и гидроксил -OH, непосредственно связанные друг с другом: Классификация А) По числу карбоксильных групп в молекуле| 1) Одноосновные | Метановая, муравьиная кислота Этановая, уксусная кислота |
| 2) Двухосновные | Щавелевая кислота |
| 3) Многоосновные |
| 1) Предельные (насыщенные) | Метановая, муравьиная кислота Этановая, уксусная кислота |
| 2) Непредельные | Акриловая кислота Кротоновая кислота СН3–СН=СН–СООН Олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН Линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН Линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН |
| 3) Ароматические | С6Н5СООН – бензойная кислота НООС–С6Н4–СООН Пара-терефталевая кислота |
 Б) Цис- транс – изомерия для непредельных кислот Номенклатура карбоновых кислот Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота. Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной углеродной цепью (Ch4)2CH-Ch3-COOH называется 3-метилбутановая кислота. Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения. Некоторые одноосновные кислоты
Б) Цис- транс – изомерия для непредельных кислот Номенклатура карбоновых кислот Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота. Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной углеродной цепью (Ch4)2CH-Ch3-COOH называется 3-метилбутановая кислота. Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения. Некоторые одноосновные кислоты | Название кислоты R-COOH | Название остатка RCOO- | ||
| систематическое | |||
| гексадекановая | пальмитиновая | ||
| октадекановая | |||
| бензолкарбоновая | |||
 Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, Ch4COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17h45COOK – стеарат калия и т.п. I. Общие с другими кислотами 1. Диссоциация: R-COOH ↔ RCOO- + H+ -Сила кислот уменьшается в ряду: H-COOH > Ch4-COOH > Ch4-Ch3-COOH 2. Взаимодействие с активными металлами: 2R-COOH + 2Na → 2R-COONa + h3↑ 3. Взаимодействие с основными оксидами и основаниями: 2R-COOH + CaO → (R-COO)2Ca + h3O R-COOH + NaOH → R-COONa + h3O 4. Взаимодействие с солями слабых кислот: R-COOH + NaHCO3 → R-COONa + h3O + CO2↑ Соли карбоновых кислот разлагаются сильными минеральными кислотами: R-COONa + HСl → NaCl + R-COOH -В водных растворах гидролизуются: R-COONa + h3O ↔ R-COOH + NaOH 5. Образование сложных эфиров со спиртами: II. Специфические свойства 1. Образование функциональных производных R-CO-X (свойства гидроксильной группы) Получение хлорангидридов: R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl 2. Образование амидов Ch4COOH + Nh4→Ch4COONh5 t˚C→ Ch4CONh3 + h3O Вместо карбоновых кислот чаще используют их галогенангидриды: Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами): Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп - пептидных связей. 3. Реакции замещения с галогенами (свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ): 4. Особенности муравьиной кислоты H-COOH: · Даёт реакцию «Серебряного зеркала»: H-COOH + 2[Ag(Nh4)2]OH → 2Ag↓ + (Nh5)2CO3 + 2Nh4 + h3O · Окисление хлором: H-COOH + Cl2 → CO2 + 2HCl · Вступает в реакцию с гидроксидом меди(II): H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3h3O · Разлагается при нагревании: HCOOH t,h3SO4→ CO↑ + h3O 5. Реакции декарбоксилирования солей карбоновых кислот (получение алканов): R-COONa + NaOH t → Na2CO3 + R-H (алкан) 6. Окисление в атмосфере кислорода: R-COOH + O2 → CO2 + h3O Получение карбоновых кислот I. В промышленности 1. Выделяют из природных продуктов (жиров, восков, эфирных и растительных масел) 2. Окисление алканов: 2Ch5 + + 3O2 t,kat → 2HCOOH + 2h3O метан муравьиная кислота 2Ch4-Ch3-Ch3-Ch4 + 5O2 t,kat,p → 4Ch4COOH + 2h3O н-бутан уксусная кислота 3. Окисление алкенов: Ch3=Ch3 + O2 t,kat → Ch4COOH этилен Сh4-CH=Ch3 + 4[O] t,kat → Ch4COOH + HCOOH (уксусная кислота+муравьиная кислота) 4. Окисление гомологов бензола (получение бензойной кислоты): C6H5-Cnh3n+1 + 3n[O] KMnO4,H+→ C6H5-COOH + (n-1)CO2 + nh3O 5C6H5-Ch4 + 6KMnO4 + 9h3SO4 → 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14h3O толуол бензойная кислота 5. Получение муравьиной кислоты: 1 стадия: CO + NaOH t,p → HCOONa (формиат натрия – соль) 2 стадия: HCOONa + h3SO4 → HCOOH + NaHSO4 6. Получение уксусной кислоты: Ch4OH + CO t,p → Ch4COOH II. В лаборатории 1. Гидролиз сложных эфиров: 2. Из солей карбоновых кислот: R-COONa + HCl → R-COOH + NaCl 3. Растворением ангидридов карбоновых кислот в воде: (R-CO)2O + h3O → 2 R-COOH 4. Щелочной гидролиз галоген производных карбоновых кислот: III. Общие способы получения карбоновых кислот 1. Окисление альдегидов: Например, реакция «Серебряного зеркала» или окисление гидроксидом меди (II) – качественные реакции альдегидов 2. Окисление спиртов: R-Ch3-OH + 2[O] t,kat → R-COOH + h3O 3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода. 4. Из цианидов (нитрилов) – способ позволяет наращивать углеродную цепь: Сh4-Br + Na-C≡N → Ch4-CN + NaBr Ch4-CN - метилцианид ( нитрил уксусной кислоты) Сh4-CN + 2h3O t → Ch4COONh5 ацетат аммония Ch4COONh5 + HCl → Ch4COOH + Nh5Cl 5. Использование реактива Гриньяра R-MgBr + CO2 → R-COO-MgBr h3O → R-COOH + Mg(OH)Br ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя. Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество. Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов. Щавелевая кислота – в металлургической промышленности (удаление окалины). Стеариновая C17h45COOH и пальмитиновая кислота C15h41COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке. Олеиновая кислота C17h43COOH – флотореагент и собиратель при обогащении руд цветных металлов. Отдельные представители одноосновных предельных карбоновых кислот Муравьиная кислота впервые была выделена в XVII веке из красных лесных муравьев. Содержится также в соке жгучей крапивы. Безводная муравьиная кислота – бесцветная жидкость с острым запахом и жгучим вкусом, вызывающая ожоги на коже. Применяется в текстильной промышленности в качестве протравы при крашении тканей, для дубления кож, а также для различных синтезов. Уксусная кислота широко распространена в природе – содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в зеленых листьях). Образуется при брожении, гниении, скисании вина, пива, содержится в кислом молоке и сыре. Температура плавления безводной уксусной кислоты + 16,5°C, кристаллы ее прозрачны как лед, поэтому ее называют ледяной уксусной кислотой. Впервые получена в конце XVIII века русским ученым Т. Е. Ловицем. Натуральный уксус содержит около 5% уксусной кислоты. Из него приготовляют уксусную эссенцию, используемую в пищевой промышленности для консервирования овощей, грибов, рыбы. Уксусная кислота широко используется в химической промышленности для различных синтезов. Представители ароматических и непредельных карбоновых кислот Бензойная кислота C6H5COOH - наиболее важный представитель ароматических кислот. Распространена в природе в растительном мире: в бальзамах, ладане, эфирных маслах. В животных организмах она содержится в продуктах распада белковых веществ. Это кристаллическое вещество, температура плавления 122°C, легко возгоняется. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире. Ненасыщенные непредельные кислоты с одной двойной связью в молекуле имеют общую формулу Cnh3n-1COOH. Высокомолекулярные непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая распространенная из них – олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН или C17h43COOH. Она представляет собой бесцветную жидкость, затвердевающую на холоде.Особенно важны полиненасыщенные кислоты с несколькими двойными связями:линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17h41COOH с двумя двойными связями, линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН илиC17h39COOH с тремя двойными связями и арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др.Линолевая кислота C17h41COOH и линоленовая кислота C17h39COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой. Сорбиновая (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют. Простейшая непредельная кислота, акриловая СН2=СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон. Называя вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновой СН3–СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium, из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты –метакриловая кислота СН2=С(СН3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло. Непредельные карбоновые кислоты способны к реакциям присоединения: СН2=СН-СООН + Н2 → СН3-СН2-СООН СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН СН2=СН-СООН + HCl → СН2Сl-СН2-СООН СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН Две последние реакции протекают против правила Марковникова. Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации. 1. Каким образом можно осуществить реакции: ацетат натрия → уксусная кислота → хлоруксусная кислота? Напишите уравнения реакций. Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ее солей: Ch4COONa + HCl = СН3СООН + NaCl. Уксусная кислота на свету реагирует с хлором: СН3СООН + Сl2 = СН2СlСООН + HCl↑. ________________________________________________________________ 2. Как можно получить пропионовую кислоту из бромэтана? СН3СН2Br → СН3СН2СООН. В молекуле пропионовой кислоты содержится три атома углерода, а в молекуле бромэтана — два. Дополнительный атом углерода можно ввести в состав молекулы, используя реакцию замещения с цианидом калия: Ch4Ch3Br + KCN → Ch4Ch3CN + КBr. В этой реакции образуется нитрил пропионовой кислоты (этилцианид), который гидролизуется при нагревании с образованием пропионата аммония: Ch4Ch3CN + 2Н2О → СН3СН2СООМН4. Подкисление раствора пропионата аммония дает пропионовую кислоту: Ch4Ch3COONh5 + HCl → СН3СН2СООН + Nh5Cl. Другой способ решения этой задачи связан с использованием магнийорганических соединений и может быть проиллюстрирован схемой: Мg СО2. Н2О С2Н5Br → С2Н5МgBr → С2Н5СООМgBr → С2Н5СООН ________________________________________________________________ 3. Напишите схему превращений, с помощью которой из 3,3,3-трихлорпропена можно получить 3-гидроксипропановую кислоту. Укажите условия проведения реакций. Хлороводород присоединяется к 3,3,3-трихлорпропену против правила Марковникова за счет -/-эффекта группы ССl3: ССl3-СН=СН2 + HCl →ССl3-СН2-СН2Сl. Гидролиз образующегося тетрахлорпроизводного водным раствором КОН дает (после подкисления) гидроксикислоту: CCl3Ch3Ch3Cl + 4KOH → НООС-СН2-СН2ОН + 4KCl + Н2О ________________________________________________________________ 4. Уксусную кислоту массой 5,40 г поместили в сосуд объемом 4,50 л и нагрели до температуры 200 °С. Давление паров при этом составило 43,7 кПа. Определите число молекул димера уксусной кислоты в газовой фазе. В парах уксусная кислота находится частично в виде димеров, а частично в виде отдельных молекул: х моль х/2 моль2СН3СООН → (СН3СООН)2 Исходное количество уксусной кислоты: v(Ch4COOH) = m/ M = 5,4 / 60 = 0,09 моль. Пусть в реакцию димеризации вступило х моль СН3СООН, тогда образовалось х/2 моль димера (СН3СООН)2 и осталось (0,09 — х) моль СН3СООН. Общее количество веществ в газовой фазе равно: v = PV / (RT) = 43,7 * 4,50 / (8,31 * 473) = 0,05 = х/2 + (0,09 – х), откуда х = 0,08 моль. Число молекул димера уксусной кислоты в газовой фазе равно: N[(СН3СООН)2] = v * NA = 0,08 / 2 * 6,02*1023 = 2,408*1022. Ответ. 2,408*1022 молекул (СН3СООН)2. ________________________________________________________________ 5. Напишите уравнения реакций, соответствующие следующей схеме: 1) Этанол окисляется до ацетата натрия хроматом натрия в щелочном растворе: ЗС2Н5ОН + 4Na2CrO4 + 7NaOH + 4h3O = 3Ch4COONa + 4Na3[Cr(OH)6]. 2) Этилацетат гидролизуется под действием щелочей: СН3СООС2Н5 + NaOH = Ch4COONa + С2Н5ОН. 3) Этанол окисляется до уксусной кислоты дихроматом калия в кислом растворе: 5С2Н5ОН + 4KMnO4 + 6h3SO4 = 5СН3СООН + 2K2SO4 +4MnSO4 + 11h3O. 4) Этилацетат можно получить из ацетата натрия действием этилиодида: Ch4COONa + C2H5I = СН3СООС2Н5 + Nal. 5) Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ацетатов: Ch4COONa + HCl = СН3СООН + NaCl 6) Сложный эфир образуется при нагревании уксусной кислоты с этанолом в присутствии серной кислоты:
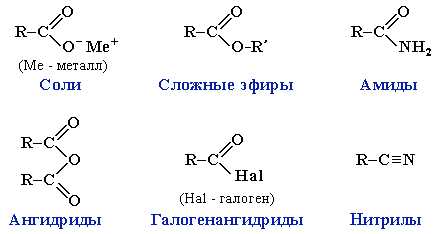
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, Ch4COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17h45COOK – стеарат калия и т.п. I. Общие с другими кислотами 1. Диссоциация: R-COOH ↔ RCOO- + H+ -Сила кислот уменьшается в ряду: H-COOH > Ch4-COOH > Ch4-Ch3-COOH 2. Взаимодействие с активными металлами: 2R-COOH + 2Na → 2R-COONa + h3↑ 3. Взаимодействие с основными оксидами и основаниями: 2R-COOH + CaO → (R-COO)2Ca + h3O R-COOH + NaOH → R-COONa + h3O 4. Взаимодействие с солями слабых кислот: R-COOH + NaHCO3 → R-COONa + h3O + CO2↑ Соли карбоновых кислот разлагаются сильными минеральными кислотами: R-COONa + HСl → NaCl + R-COOH -В водных растворах гидролизуются: R-COONa + h3O ↔ R-COOH + NaOH 5. Образование сложных эфиров со спиртами: II. Специфические свойства 1. Образование функциональных производных R-CO-X (свойства гидроксильной группы) Получение хлорангидридов: R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl 2. Образование амидов Ch4COOH + Nh4→Ch4COONh5 t˚C→ Ch4CONh3 + h3O Вместо карбоновых кислот чаще используют их галогенангидриды: Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами): Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп - пептидных связей. 3. Реакции замещения с галогенами (свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ): 4. Особенности муравьиной кислоты H-COOH: · Даёт реакцию «Серебряного зеркала»: H-COOH + 2[Ag(Nh4)2]OH → 2Ag↓ + (Nh5)2CO3 + 2Nh4 + h3O · Окисление хлором: H-COOH + Cl2 → CO2 + 2HCl · Вступает в реакцию с гидроксидом меди(II): H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3h3O · Разлагается при нагревании: HCOOH t,h3SO4→ CO↑ + h3O 5. Реакции декарбоксилирования солей карбоновых кислот (получение алканов): R-COONa + NaOH t → Na2CO3 + R-H (алкан) 6. Окисление в атмосфере кислорода: R-COOH + O2 → CO2 + h3O Получение карбоновых кислот I. В промышленности 1. Выделяют из природных продуктов (жиров, восков, эфирных и растительных масел) 2. Окисление алканов: 2Ch5 + + 3O2 t,kat → 2HCOOH + 2h3O метан муравьиная кислота 2Ch4-Ch3-Ch3-Ch4 + 5O2 t,kat,p → 4Ch4COOH + 2h3O н-бутан уксусная кислота 3. Окисление алкенов: Ch3=Ch3 + O2 t,kat → Ch4COOH этилен Сh4-CH=Ch3 + 4[O] t,kat → Ch4COOH + HCOOH (уксусная кислота+муравьиная кислота) 4. Окисление гомологов бензола (получение бензойной кислоты): C6H5-Cnh3n+1 + 3n[O] KMnO4,H+→ C6H5-COOH + (n-1)CO2 + nh3O 5C6H5-Ch4 + 6KMnO4 + 9h3SO4 → 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14h3O толуол бензойная кислота 5. Получение муравьиной кислоты: 1 стадия: CO + NaOH t,p → HCOONa (формиат натрия – соль) 2 стадия: HCOONa + h3SO4 → HCOOH + NaHSO4 6. Получение уксусной кислоты: Ch4OH + CO t,p → Ch4COOH II. В лаборатории 1. Гидролиз сложных эфиров: 2. Из солей карбоновых кислот: R-COONa + HCl → R-COOH + NaCl 3. Растворением ангидридов карбоновых кислот в воде: (R-CO)2O + h3O → 2 R-COOH 4. Щелочной гидролиз галоген производных карбоновых кислот: III. Общие способы получения карбоновых кислот 1. Окисление альдегидов: Например, реакция «Серебряного зеркала» или окисление гидроксидом меди (II) – качественные реакции альдегидов 2. Окисление спиртов: R-Ch3-OH + 2[O] t,kat → R-COOH + h3O 3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода. 4. Из цианидов (нитрилов) – способ позволяет наращивать углеродную цепь: Сh4-Br + Na-C≡N → Ch4-CN + NaBr Ch4-CN - метилцианид ( нитрил уксусной кислоты) Сh4-CN + 2h3O t → Ch4COONh5 ацетат аммония Ch4COONh5 + HCl → Ch4COOH + Nh5Cl 5. Использование реактива Гриньяра R-MgBr + CO2 → R-COO-MgBr h3O → R-COOH + Mg(OH)Br ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя. Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество. Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов. Щавелевая кислота – в металлургической промышленности (удаление окалины). Стеариновая C17h45COOH и пальмитиновая кислота C15h41COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке. Олеиновая кислота C17h43COOH – флотореагент и собиратель при обогащении руд цветных металлов. Отдельные представители одноосновных предельных карбоновых кислот Муравьиная кислота впервые была выделена в XVII веке из красных лесных муравьев. Содержится также в соке жгучей крапивы. Безводная муравьиная кислота – бесцветная жидкость с острым запахом и жгучим вкусом, вызывающая ожоги на коже. Применяется в текстильной промышленности в качестве протравы при крашении тканей, для дубления кож, а также для различных синтезов. Уксусная кислота широко распространена в природе – содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в зеленых листьях). Образуется при брожении, гниении, скисании вина, пива, содержится в кислом молоке и сыре. Температура плавления безводной уксусной кислоты + 16,5°C, кристаллы ее прозрачны как лед, поэтому ее называют ледяной уксусной кислотой. Впервые получена в конце XVIII века русским ученым Т. Е. Ловицем. Натуральный уксус содержит около 5% уксусной кислоты. Из него приготовляют уксусную эссенцию, используемую в пищевой промышленности для консервирования овощей, грибов, рыбы. Уксусная кислота широко используется в химической промышленности для различных синтезов. Представители ароматических и непредельных карбоновых кислот Бензойная кислота C6H5COOH - наиболее важный представитель ароматических кислот. Распространена в природе в растительном мире: в бальзамах, ладане, эфирных маслах. В животных организмах она содержится в продуктах распада белковых веществ. Это кристаллическое вещество, температура плавления 122°C, легко возгоняется. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире. Ненасыщенные непредельные кислоты с одной двойной связью в молекуле имеют общую формулу Cnh3n-1COOH. Высокомолекулярные непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая распространенная из них – олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН или C17h43COOH. Она представляет собой бесцветную жидкость, затвердевающую на холоде.Особенно важны полиненасыщенные кислоты с несколькими двойными связями:линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17h41COOH с двумя двойными связями, линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН илиC17h39COOH с тремя двойными связями и арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др.Линолевая кислота C17h41COOH и линоленовая кислота C17h39COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой. Сорбиновая (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют. Простейшая непредельная кислота, акриловая СН2=СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон. Называя вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновой СН3–СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium, из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты –метакриловая кислота СН2=С(СН3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло. Непредельные карбоновые кислоты способны к реакциям присоединения: СН2=СН-СООН + Н2 → СН3-СН2-СООН СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН СН2=СН-СООН + HCl → СН2Сl-СН2-СООН СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН Две последние реакции протекают против правила Марковникова. Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации. 1. Каким образом можно осуществить реакции: ацетат натрия → уксусная кислота → хлоруксусная кислота? Напишите уравнения реакций. Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ее солей: Ch4COONa + HCl = СН3СООН + NaCl. Уксусная кислота на свету реагирует с хлором: СН3СООН + Сl2 = СН2СlСООН + HCl↑. ________________________________________________________________ 2. Как можно получить пропионовую кислоту из бромэтана? СН3СН2Br → СН3СН2СООН. В молекуле пропионовой кислоты содержится три атома углерода, а в молекуле бромэтана — два. Дополнительный атом углерода можно ввести в состав молекулы, используя реакцию замещения с цианидом калия: Ch4Ch3Br + KCN → Ch4Ch3CN + КBr. В этой реакции образуется нитрил пропионовой кислоты (этилцианид), который гидролизуется при нагревании с образованием пропионата аммония: Ch4Ch3CN + 2Н2О → СН3СН2СООМН4. Подкисление раствора пропионата аммония дает пропионовую кислоту: Ch4Ch3COONh5 + HCl → СН3СН2СООН + Nh5Cl. Другой способ решения этой задачи связан с использованием магнийорганических соединений и может быть проиллюстрирован схемой: Мg СО2. Н2О С2Н5Br → С2Н5МgBr → С2Н5СООМgBr → С2Н5СООН ________________________________________________________________ 3. Напишите схему превращений, с помощью которой из 3,3,3-трихлорпропена можно получить 3-гидроксипропановую кислоту. Укажите условия проведения реакций. Хлороводород присоединяется к 3,3,3-трихлорпропену против правила Марковникова за счет -/-эффекта группы ССl3: ССl3-СН=СН2 + HCl →ССl3-СН2-СН2Сl. Гидролиз образующегося тетрахлорпроизводного водным раствором КОН дает (после подкисления) гидроксикислоту: CCl3Ch3Ch3Cl + 4KOH → НООС-СН2-СН2ОН + 4KCl + Н2О ________________________________________________________________ 4. Уксусную кислоту массой 5,40 г поместили в сосуд объемом 4,50 л и нагрели до температуры 200 °С. Давление паров при этом составило 43,7 кПа. Определите число молекул димера уксусной кислоты в газовой фазе. В парах уксусная кислота находится частично в виде димеров, а частично в виде отдельных молекул: х моль х/2 моль2СН3СООН → (СН3СООН)2 Исходное количество уксусной кислоты: v(Ch4COOH) = m/ M = 5,4 / 60 = 0,09 моль. Пусть в реакцию димеризации вступило х моль СН3СООН, тогда образовалось х/2 моль димера (СН3СООН)2 и осталось (0,09 — х) моль СН3СООН. Общее количество веществ в газовой фазе равно: v = PV / (RT) = 43,7 * 4,50 / (8,31 * 473) = 0,05 = х/2 + (0,09 – х), откуда х = 0,08 моль. Число молекул димера уксусной кислоты в газовой фазе равно: N[(СН3СООН)2] = v * NA = 0,08 / 2 * 6,02*1023 = 2,408*1022. Ответ. 2,408*1022 молекул (СН3СООН)2. ________________________________________________________________ 5. Напишите уравнения реакций, соответствующие следующей схеме: 1) Этанол окисляется до ацетата натрия хроматом натрия в щелочном растворе: ЗС2Н5ОН + 4Na2CrO4 + 7NaOH + 4h3O = 3Ch4COONa + 4Na3[Cr(OH)6]. 2) Этилацетат гидролизуется под действием щелочей: СН3СООС2Н5 + NaOH = Ch4COONa + С2Н5ОН. 3) Этанол окисляется до уксусной кислоты дихроматом калия в кислом растворе: 5С2Н5ОН + 4KMnO4 + 6h3SO4 = 5СН3СООН + 2K2SO4 +4MnSO4 + 11h3O. 4) Этилацетат можно получить из ацетата натрия действием этилиодида: Ch4COONa + C2H5I = СН3СООС2Н5 + Nal. 5) Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ацетатов: Ch4COONa + HCl = СН3СООН + NaCl 6) Сложный эфир образуется при нагревании уксусной кислоты с этанолом в присутствии серной кислоты: | СН3СООН + С2Н5ОН | ⇌СН3СООС2Н5 + Н2О |
6.
________________________________________________________________7.

______________________________________________________________
himiy88.blogspot.com
Изомерия. Физические свойства - HimHelp.ru
Изомерия/>. У карбоновых кислот возможны следующие виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
2. Изомерия положения кратной связи, например:
СН2=СН—СН2—СООН СН3—СН=СН—СООНБутен-3-овая кислота Бутен-2-овая кислота(винилуксусная кислота) (кретоновая кислота)
3. Цис-транс- изомерия, например:
цис -бутен-2-овая транс-бутен-2-оваякислота кислота
4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—СН2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СН3) и этиловый эфир уксусной кислоты (СН3—СО—О—СН2—СН3).
5. У гетерофункциональных кислот имеется изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты:
СН3—СН2—СНСl—СООН СН3—СНСl—СН2—СООН2-хлорбутановая кислота 3-хлорбутановая кислота
СН2Сl—СН2—СН2—СООН
4-хлорбутановая кислота
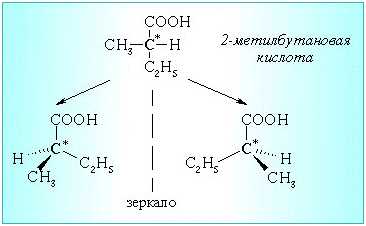
Для гетерофункциональных кислот возможна также оптическая изомерия.
Физические свойства/>. Насыщенные алифатические монокар-боновые кислоты образуют гомологический ряд, который характеризуется общей формулой Cnh3n+1 COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный "уксусный" запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название "ледяная" уксусная кислота. Средние представители этого гомологического ряда — вязкие, "маслообразные" жидкости; начиная с С10 — твердые вещества.
Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
Физические свойства карбоновых кислот
| Название кислоты | Химическая формула | tпл | tкип | ЧслоДвойныхСвязей |
| Муравьиная(метановая) | HCOOH | 8 | 101 | 0 |
| Уксусная(этановая) | Ch4COOH | 17 | 118 | 0 |
| Пропионовая(пропановая) | Ch4Ch3COOH | -22 | 141 | 0 |
| Акриловая(пропеновая) | Ch3=CH-COOH | 12 | 141 | 1 |
| Капроновая(гексановая) | Ch4(Ch3)4COOH | -2 | 205 | 0 |
| Пальмитиновая(гексадециловая) | C15h41COOH | 64 | 215 | 0 |
| Стеариновая(октадециловая) | C17h45COOH | 70 | 232 | 0 |
| Олеиновая (цис-октадецен-9-овая) | C17h43COOH | 14 | 228 | 1 |
| Линолевая(октадекадиен-9,12-овая) | C17h41COOH | -5 | 230 | 2 |
| Линоленовая (октадекатриен-9,12,15-овая) | C17h39COOH | -11 | 230 | 3 |
| Бензойная(бензолкарбоновая) | C6H5COOH | 122 | 249 | 0 |
| Щавелевая(этандиовая) | HOOC—COOH | 190 | 0 |
При одной и той же длине углеводородного радикала температуры плавления (и кипения) зависят от наличия кратных связей — с ростом их числа соответствующие температуры уменьшаются.
Ненасыщенные кислоты при комнатной температуре являются, как правило, жидкостями.
Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.
www.himhelp.ru















