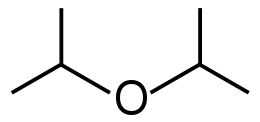
Молекулярное строение имеет... Какое вещество имеет молекулярное строение. Молекулярное строение эфира
Тема №5 «Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки»
Оглавление
- Молекулярное и немолекулярное строение веществ
- Твердые вещества: аморфные и кристаллические
- Атомные кристаллические решетки
- Молекулярные кристаллические решетки
- Металлические кристаллические решетки
- Шпаргалки
- Задания для самопроверки

Молекулярное и немолекулярное строение веществ. Строение вещества

В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения. Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
 Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl—, так и сложные SO42- , OH—. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Cl—, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Кристаллическая решетка — а) и аморфная решетка — б).
 Кристаллическая решетка — а) и аморфная решетка — б).
Кристаллическая решетка — а) и аморфная решетка — б).Атомные кристаллические решетки
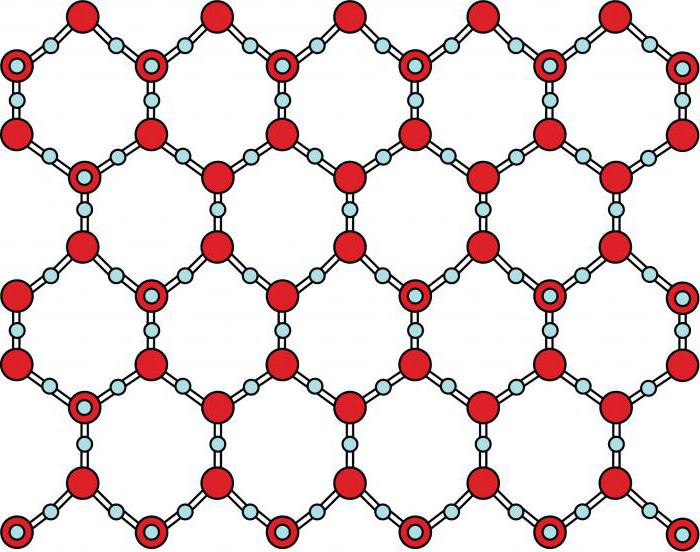
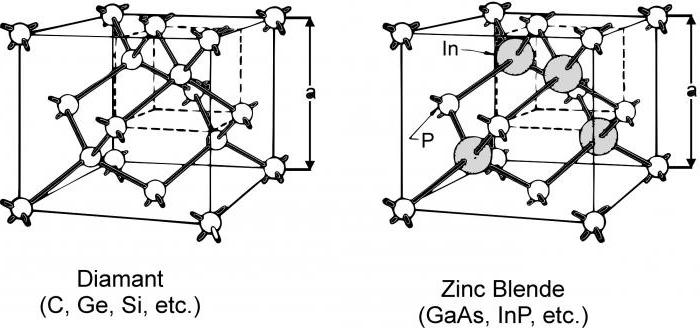
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода. Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
 Атомная решетка алмаза
Атомная решетка алмаза Атомная решетка графита
Атомная решетка графита
Молекулярные кристаллические решетки
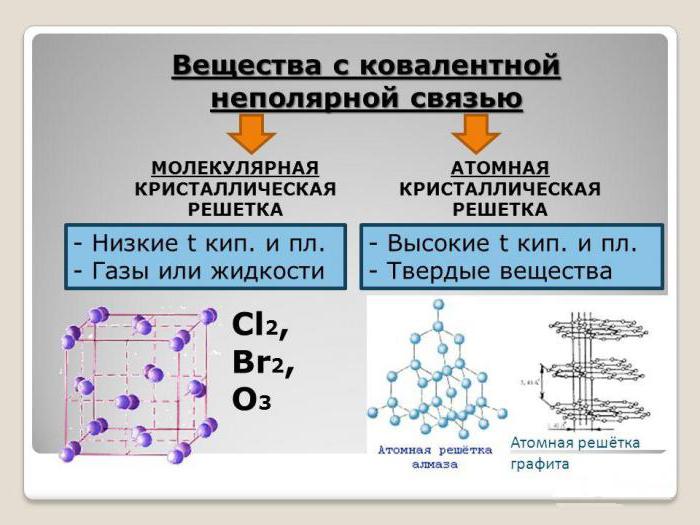
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl, h3O), и неполярными (N2, O2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
 Молекулярная кристаллическая решетка(углекислый газ)
Молекулярная кристаллическая решетка(углекислый газ)
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
 Металлическая кристаллическая решетка
Металлическая кристаллическая решетка Шпаргалки
Шпаргалки


 Взаимосвязь между типом кристаллической решетки и типом связи в веществе
Взаимосвязь между типом кристаллической решетки и типом связи в веществе

www.chem-mind.com
Молекулярное строение имеет... Какое вещество имеет молекулярное строение
Как известно, химия изучает строение и свойства веществ, а также их взаимные превращения. Важное место в характеристике химических соединений занимает вопрос о том, из каких именно частиц они состоят. Это могут быть атомы, ионы или молекулы. В твердых телах они входят в узлы кристаллических решеток. Молекулярное строение имеет сравнительно небольшое количество соединений, находящихся в твердом, жидком и газообразном состоянии.
В нашей статье мы приведем примеры веществ, для которых характерны молекулярные кристаллические решетки, а также рассмотрим несколько видов межмолекулярного взаимодействия, характерных для твердых тел, жидкостей и газов.
Почему нужно знать строение химических соединений
В каждой отрасли человеческого знания можно выделить группу фундаментальных законов, на которых основывается дальнейшее развитие науки. В химии – это теория М.В. Ломоносова и Дж. Дальтона, объясняющая атомно-молекулярное строение вещества. Как установили ученые, зная внутреннюю структуру, можно спрогнозировать как физические, так и химические свойства соединения. Всё огромное количество искусственно синтезированных человеком органических веществ (пластмассы, лекарственные препараты, пестициды и т.д.) имеют заранее предусмотренные характеристики и свойства, наиболее ценные для его промышленных и хозяйственно-бытовых нужд.

Знания об особенностях строения и свойств соединений востребованы при проведении контрольных срезов, тестов и экзаменов в курсе химии. Например, в предлагаемом перечне веществ найти правильные варианты ответов: какое вещество имеет молекулярное строение?
Правильным ответом будет: цинк имеет молекулярное строение, а также нафталин.
Силы межмолекулярного взаимодействия
Экспериментально установлено, что молекулярное строение характерно для веществ с низкими температурами плавления и малой твердостью. Чем же можно объяснить непрочность кристаллических решеток этих соединений? Как оказалось, все зависит от силы совместного влияния частиц, находящихся в их узлах. Она имеет электрическую природу и называется межмолекулярным взаимодействием или ван-дер-ваальсовыми силами, в основе которых лежит влияние друг на друга противоположно заряженных молекул – диполей. Оказалось, что существует несколько механизмов их образования, зависящих от природы самого вещества.
Кислоты как соединения молекулярного состава
Растворы большинства кислот, как органических, так и неорганических, содержат полярные частицы, которые ориентируются друг относительно друга противоположно заряженными полюсами. Например, в растворе хлоридной кислоты HCI присутствуют диполи, между которыми возникает ориентационные взаимодействия. С повышением температуры у молекул соляной, бромоводородной (HBr) и других галогенсодержащих кислот наблюдается уменьшение ориентационного эффекта, так как тепловое движение частиц мешает их взаимному притяжению. Кроме выше перечисленных веществ, молекулярное строение имеет сахароза, нафталин, этанол и другие органические соединения.
Как возникают индуцированные заряженные частицы
Ранее мы рассмотрели один из механизмов действия сил Ван-дер-Ваальса, называемый ориентационным взаимодействием. Кроме органических веществ и галогенсодержащих кислот, молекулярное строение имеет оксид водорода – вода. У веществ, состоящих из неполярных, но склонных к образованию диполей, молекул, таких как углекислый газ CO2, можно наблюдать возникновение наведенных заряженных частиц – диполей. Их важнейшее свойство – это способность притягиваться друг к другу, благодаря появлению сил электростатического притяжения.
Молекулярное строение газа
В предыдущем подзаголовке мы упомянули такое соединение, как диоксид углерода. Каждый его атом создает вокруг себя электрическое поле, которое наводит поляризацию на атом рядом расположенной молекулы углекислого газа. Она видоизменяется в диполь, который, в свою очередь, становится способной к поляризации других частиц CO2. В итоге молекулы притягиваются друг к другу. Индукционное взаимодействие можно наблюдать и у веществ, состоящих из полярных частиц, правда, в этом случае оно значительно слабее, чем ориентационные ван-дер-ваальсовые силы.

Дисперсионное взаимодействие
Как сами атомы, так и частицы, входящие в их состав (ядра, электроны), способны к непрерывному вращательному и колебательному движению. Оно приводит к появлению диполей. Согласно исследованиям квантовой механики, возникновение мгновенных двузарядных частиц происходит и в твердых телах, и в жидкостях синхронно, таким образом, что концы молекул, расположенных рядом, оказываются с противоположными полюсами. Это приводит к их электростатическому притяжению, получившему название дисперсионного взаимодействия. Оно свойственно всем веществам, кроме тех, которые находятся в газообразном состоянии, и чьи молекулы одноатомны. Однако, ван-дер-ваальсовые силы могут возникать, например, при переходе инертных газов (гелия, неона) в жидкую фазу при низких температурах. Таким образом, молекулярное строение тел или жидкостей обуславливает их способность к формированию различных видов межмолекулярного взаимодействия: ориентационного, индуцированного или дисперсионного.
Что такое сублимация
Молекулярное строение твердого тела, например, кристаллов йода, обуславливает такое интересное физическое явление, как возгонка – улетучивание молекул I2 в виде фиолетовых паров. Оно происходит с поверхности вещества, находящегося в твердой фазе, минуя жидкое состояние.
Этот визуально эффектный опыт часто проводят в школьных кабинетах химии, чтобы проиллюстрировать особенности строения молекулярных кристаллических решеток и связанных с ними свойств соединений. Обычно это невысокая твердость, низкие температуры плавления и кипения, плохая тепло- и электропроводность, летучесть.
Практическое использование знаний о строении веществ
Как мы убедились, между типом кристаллической решетки, строением и свойствами соединения можно установить определенную корреляцию. Поэтому, если известны характеристики вещества, то достаточно легко спрогнозировать особенности его строения и состава частиц: атомов, молекул или ионов. Полученная информация также может пригодиться, если в заданиях по химии нужно из определенной группы соединений правильно выбрать вещества, имеющие молекулярное строение, исключив те, у которых присутствуют атомные или ионные типы решеток.
Подводя итог, можно сделать следующий вывод: молекулярное строение имеет твердое тело, и его пространственное строение кристаллических решеток, а особенности расположения поляризованных частиц в жидкостях и газах полностью отвечают за его физические и химические свойства. В теоретическом плане свойства соединений, содержащих диполи, зависят от величины сил межмолекулярного взаимодействия. Чем выше полярность молекул и меньше радиус атомов, входящих в их состав, тем сильнее ориентационные силы, возникающие между ними. Наоборот, чем больше атомы, составляющие молекулу, тем выше ее дипольный момент, а, значит, более значительны дисперсионные силы. Таким образом, молекулярное строение твердого тела влияет еще и на силы взаимодействия между его частицами – диполями.
fb.ru
Молекула этилового спирта строение - Справочник химика 21
В молекуле этилового спирта один атом водорода связан с углеродом через кислород (полярная ковалентная связь), а поэтому этот атом водорода более подвижен, чем атомы водорода, связанные с углеродом. В молекуле диметилового эфира все атомы водорода одинаково связаны с атомами углерода (ковалентная связь). Разным строением молекулы объясняется различное отношение этих веш,еств к металлическому натрию. Этиловый спирт взаимодействует с натрием по уравнению [c.273] На примере свойств и строения этилового спирта объясните взаимное влияние атомов в молекулах органических веществ. [c.89]Таким образом, существуют два вещества — этиловый спирт и диметиловый эфир — с одинаковой молекулярной формулой СгНвО, но с различными свойствами. Как же объяснить существование этих двух соединений Ответ строение их молекул различно. Этиловому спирту можно приписать формулу I, а диметиловому эфиру — формулу П. Как будет показано ниже, различие в физических и химических свойствах этих двух соединений легко объяснить исходя из различного строения их молекул. [c.36]
Электронная схема строения молекулы этилового спирта [c.149]
Элементарный анализ и определение молекулярного веса этилового спирта дают простейшую формулу СзН О. Формулу строения этилового спирта можно вывести только на основании дальнейших опытов, например, изучая действие металлического натрия на спирт. Мы видели, что при этом выделяется водород. С помощью анализа можно было бы убедиться, что, сколько бы мы ни прибавляли натрия, на 1 грамм-молекулу спирта выделяется только 1 грамм-атом водорода. Значит, из 6 атомов водорода, находящихся в молекуле этилового спирта, только один какой-то атом занимает, по-видимому, особое положение, почему он и способен замещаться натрием [c.69]
Строени,е молекулы этилового спирта. Неограниченная растворимость этилового спирта в воде объясняется особенностью строе- [c.270]
ОБЩАЯ ХАРАКТЕРИСТИКА И СТРОЕНИЕ МОЛЕКУЛЫ ЭТИЛОВОГО СПИРТА [c.5]
Эта теория объяснила многообразие органических веществ. А. М. Бутлеров показал, что внутренняя структура молекул познаваема, доступна для сознательного воспроизведения. Изучая химические превращения, на основе теории А. М. Бутлерова можно установить строение молекул эта теория указала химические методы исследования строения вещества. Например, для молекулы этилового спирта СгНбО с учетом валентности элементов можно предположить два варианта структуры [c.57]
Видно, что изомеры действительно отличаются порядком хим 1-ческой связи атомов если в молекуле диметилового эфира оба углеродных атома непосредственно не связаны друг с другом — их разделяет кислород, то в молекуле этилового спирта имеется цепь из двух атомов углерода. Диметиловый эфир и этиловый спирт имеют неодинаковое химическое строение, поэтому различны и их свойства. [c.221]
Укажите сходство и различие в строении молекул этилового спирта и втиленгликоля. Какой характерной реакцией можно отличить многоатомные спирты от одноатомных [c.89]
Результат исследования регистрируется в виде кривой поглощения (рис. 94), которая выражает зависимость поглощения излучения от напряженности магнитного поля. Спиновые переходы ядра зависят от состояния электронной оболочки атома. Поэтому разные молекулы и разные атомные группировки в них поглощают при разной напряженности магнитного поля. Анализ формы и положения пиков на кривой поглощения позволяет делать заключение о структуре соединений. Так, анализ кривой поглощения этилового спирта показывает, что пики (рис. 94) отвечают спиновым переходам протонов соответственно атомных группировок СНз, СНг и ОН. Таким путем подтверждается строение молекулы С2Н5ОН. [c.147]
Решение. 1. Метод Бромли. Молекула этилового спирта имеет нелинейное строение, поэтому следует применить уравнение (IX. 16). Для определения полярного параметра а, необходимо знать плотность жидкости при нормальной температуре кипения. Приближенное значение рь, полученное по методу Шредера (раздел II. 18), составляет 0,73 г/см . Из уравнения (IX. 14) получаем [c.504]
О том, что строение молекулы органического вещества можно определить, изучив свойства этого вещества. Для этого прежде всего рассмотрим взаимодействие этилового спирта с различными веществами. [c.21]
Укажите особенности строения молекул этилового спирта и бромэтана. [c.32]
Этиловый спирт — соединение химически более простое, однако его спектр ПМР сложнее (рис. 32), чем спектр ПМР диацетонового спирта, У этилового спирта проявляется взаимодействие протонов, стоящих у соседних атомов углерода. В результате вместо одиночных линий возникают группы их (расщепление линий в результате спин-спинового взаимодействия). Внимательный анализ характера расщепления дает дополнительные данные о структуре молекулы. Таким образом, в спектрах ЯМР используются два вида ин( юрма-ции химический сдвиг (положение сигнала) и константы спин-спинового расщепления. Очень ценную информацию спектры ЯМР дают не только о строении, но и о конформации органических соединений, о динамических процессах, об энергиях молекул и их отдельных конформаций, об электроотрицательностях групп о яа- [c.360]
Установление структурной формулы. Теперь, познакомившись с характером связи между атомами в органических сое.амне-ниях, перейдем к определению строения их молекул. Прежде всего. необходимо знать общую молекулярную формулу органического вещества, которая, как мы уже говорили, легко определяется по данным качественного и количественного анализа этого вещества и его молекулярному весу. Возьмем, например, этиловый спирт. Его суммарная формула СгНбО. Какова будет его структурная формула [c.20]
Неодинаковое строение молекул приводит к различным свойствам именно различие в свойствах свидетельствует о том, что имеются различные соединения. В некоторых случаях различие в строении, а следовательно, и в свойствах настолько велико, что изомеры относятся к разным классам органических соединений, как, например, этиловый спирт и диметиловый эфир. В других случаях различие строения настолько незначительно, что [c.36]
Отметим, что требования к гетерогенному катализатору не ограничиваются лишь подходящей энергией адсорбции, большую роль играет пространственное расположение адсорбированных молекул и электронное строение поверхностного слоя катализатора. Действительно, в некоторых случаях разные катализаторы приводят к выделению разных продуктов из одних и тех же исходных веществ. Выше уже упоминались различные варианты разложения этилового спирта на разных катализаторах. [c.160]
В радикало-функциональных названиях последняя часть указывает функцию, а другие — в радикальной форме — особенности строения молекулы. В табл. 5 приведены наиболее часто встречающиеся классы соединений в порядке падения их старшинства (на случай, если в соединении имеется более одной функциональной группы). Примерами могут служить названия этиловый спирт, этилхлорид, фенилазид и диметилсульфоксид. [c.369]
Нетрудно заметить, что диэтиловый и метилпропиловый эфиры имеют одинаковый состав С4Н10О и являются изомерами, различие которых состоит в том, что в их молекулах радикалы, соединенные с кислородом, отличаются по составу. Эфирам присуща и обычная изомерия строения радикалов так, изомером метилпропилового эфира является метилизопропиловый эфир СН3—О—СН(СНз)2-Следует отметить, что простые эфиры изомерны одноатомным спиртам. Например, один и тот же состав СаНвО имеют диметиловый эфир СНз—О—СНз и этиловый спирт СН3—СНа—ОН. А составу С4Н10О отвечают не только диэтиловый, метилпропиловый и метилизопропиловый эфиры, но и четыре бутиловых спирта состава С4НдОН (см. табл. 9). [c.127]
Цеолит СаА адсорбирует углеводороды и спирты только нормального строения (независимо от длины цепи), в связи с чем широко используется в процессах разделения многокомпонентных органических веществ на молекулярно-ситовой основе. Кроме того, цеолитом СаА поглощаются метил- и этилмеркаптаны, органические соединения с числом атомов углерода в молекуле, равным двум, (этиловый спирт, этиламин, диборан и др.). Среди цеолитов общего назначения тип СаА отличается повышенной стойкостью в слабокислой среде и, поэтому его используют в процессах сероочистки и декарбонизации газов. [c.367]
Свойства. Строение кристаллической решетки соответствует аддукту Tll-Ia, однако в растворе метилового спирта образуются молекулы TII3. Черные ромбические кристаллы, изоморфные Rbl-b. Не растворяются в воде, но прн взаимодействии с водой, этиловым спиртом, эфиром, I4 или раствором KI теряют молекулу Ь с образованием ТП. [c.953]
Состав большинства неорганических веществ однозначно характеризует их молекулярное строение Н2304 — это всегда серная кислота ЫазР04 — это всегда фосфат натрия КА1 (504)2 —это всегда алюмокалиевые квасцы и т. д. В органической химии широко распространено явление изомерии— существуют разные вещества, имеющие одинаковый состав молекул. Эмпирические, суммарные формулы становятся поэтому для органических соединений неоднозначными простая формула С2Н6О отвечает как этиловому спирту, так и диметиловому эфиру более сложные эмпирические формулы могут соответствовать десяткам, сотням и даже тысячам различных веществ. С созданием бутлеровской теории химического строения стало ясно, что изомеры отличаются друг от друга порядком химической связи атомов — химическим строением. Определение химического строения, установление структурной формулы стало (и остается до сих пор) главной задачей при исследовании органических веществ. [c.84]
Свойства веществ зависят не только от качественного и количественного состава их молекул, но и от их химического строения. Например, формуле СзН О соответствуют два вещества димстиловый эфир — СН3-О-СН3 и этиловый спирт — СН3СН2ОН. Первое вещество — газ, не реагирует с натрием, второе — нащ-кость, под действием натрия выделяет водород. [c.60]
А. М. 15утлеров показал, что свойства веществ зависят от химического строения молекул. Таким образом, теория А. М. Бутлерова объясняет явление изомерин различным расположением атомов в молекулах. В примере с веществами состава СгНоО различие их свойств обусловлено тем, что этиловый спирт и диметиловый [c.295]
Моносахариды классифицируют по числу атомов углерода в их молекуле. В состав моносахаридов входят триозы (Сз), тетрозы (С4), пентозы (Сз), гексозы (Сб) и т.д. Из моносахаридов наибольший интерес представляют гексозы, так как часть из них в процессе взаимодействия с ферментами дрожжей превращается в этиловый спирт и углекислый газ. Гексозы являются бесцветными кристаллическими веществами, хорошо растворяются в воде и имеют сладкий вкус. Наиболее распространенными представителями гексоз являются глюкоза и фруктоза, имеющие одинаковый химический состав и обозначение С6Н12О6, но разное строение молекул. Смесь равных частей глюкозы и фруктозы называется инвертным сахаром. [c.31]
Зависимость параметра вращательной диффузии зонда 5 от концентрации растворителей является сложной и определяется строением их молекул. Так, изопропиловый и этиловый спирты, имеющие выраженное бифильное строение, вызывают резкое увеличение вращательной подвижности зонда 5 в мембране с увеличением их концентрации, т.е. увеличение текучести липидов липосом под действием этих спиртов. Увеличение в молекулах растворителей количества ОН групп и уменьщение гидрофобной части резко меняют характер их воздействия на липидный бислой липосом. Так пропиленгликоль и глицерин снижают вращательную подвижность зонда 5. [c.568]
chem21.info
Молекулярное и немолекулярное строение | Дистанционные уроки
16-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А6 ЕГЭ по химии —
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.

Темы, которые нужно знать:
Давайте определим свойства веществ молекулярного строения и немолекулярного.
| Вещества молекулярного строения | Вещества немолекулярного строения |
|
|
Типы кристаллических решеток
- Ионная кристаллическая решетка — характерна для соединений с ионной связью, в узлах решетки находятся, соответственно, ионы. Связи очень прочные, поэтому и температуры плавления высокие. Ее образуют неорганические соли, основания, основные оксиды, органические соли.

- Атомная кристаллическая решетка — связь — ковалентная, очень прочная. Примером может служить алмаз — вещество, имеющее максимальный показатель твердости, очень низкая растворимость, малореакционноспособны.Характерна для B, Si, Ge, силициды (Si4- ), карбиды и нитриды бора, SiO2

- Молекулярная кристаллическая решетка — состоит из молекул, которые удерживаются между собой межмолекулярными связями, поэтому они непрочные — низкие температуры плавления, неэлектропроводны. Молекулярную кристаллическую решетку имеют все твердые вещества с полярной или неполярной ковалентной связью: J2, S2, твердый CO2 («сухой лед»), твердые органические вещества (кроме солей) и т.д.

- Металлическая кристаллическая решетка — в узлах содержит атомы и ионы металлов. Очень прочная металлическая связь со всеми характерными свойствами: делокализованное электронное облако, электро- и теплопроводность, металлический блеск, пластичность, ковкость.
Получается, что металлическая и атомарная кристаллические решетки схожи, но есть основное отличие — вещества с металлической решеткой проводят электрический ток и пластичны.
Для определения типа кристаллической решетки необходимо сначала определить — имеет вещество молекулярное или немолекулярное строение, затем уже определить вид химической связи и по нему уже выбирать вариант решетки.
Еще на эту тему:
Обсуждение: "Молекулярное и немолекулярное строение"
(Правила комментирования)distant-lessons.ru
Молекулярное строение веществ - Наука и образование
Одним из основных вопросов, которые рассматриваются в науках о природе, является вопрос о том, из чего и как построены предметы изучения: геология изучает состав и строение нашей планеты, биология изучает строение животных и растительных организмов и т. д.
В химии изучаются вещества. Поэтому для химика важно знать, как построено вещество.Прежде всего, нужно выяснить, состоит ли вещество из отдельных частичек, находящихся на некотором расстоянии друг от друга, или имеет сплошное, непрерывное строение.
При рассматривании капли чистой воды даже в самый сильный микроскоп нельзя обнаружить в ней каких-либо частичек, отделённых друг от друга промежутками. То же можно сказать о ртути и о других веществах. Но можно ли отрицать существование частиц только потому, что их не видно? Ведь очень долго не могли видеть микробов, которые существовали, существуют и теперь хорошо изучены.
Если некоторые вопросы в науке о природе нельзя решить непосредственными наблюдениями, то принято делать предположения, которые затем проверяются.
Научные предположения называются гипотезами.
Если с помощью гипотезы можно объяснить или предвидеть изучаемые явления, то такая гипотеза признаётся правильной и после многократной проверки становится теорией.
Много лет назад в науке было сделано предположение о том, что всякое вещество состоит из отдельных частиц, находящихся друг от друга на некотором расстоянии.Самые маленькие частицы вещества называются молекулами, а гипотеза о молекулярном строении вещества — молекулярной гипотезой.
С помощью этой гипотезы очень хорошо объясняются многие физические явления: сжатие и расширение тел, диффузия (проникновение одних веществ в другие), переход из одного физического состояния в другое.
При сжатии происходит уменьшение, а при расширении — увеличение межмолекулярных промежутков. Особенно сильно уменьшаются межмолекулярные промежутки при сжатии газов.
Интересным и очень важным является вопрос: находятся ли молекулы в покое или в движении? Ответить на этот вопрос поможет следующий опыт.
Маленький тигелёк, в котором находятся несколько капель тяжёлой красно-бурой, легко испаряющейся жидкости — брома, помещают на стеклянную пластинку, покрытую сверху стеклянной банкой, перевёрнутой вверх дном.
Несмотря на то, что пары брома тяжелее воздуха более чем в пять раз, они всё же подымаются вверх, заполняют весь сосуд и перемешиваются с воздухом.
Пары брома, находящиеся в банке, защищены от какого-либо действия на них извне, тем не менее, они распространились по всему объёму банки. Следовательно, молекулы брома обладают собственным движением. Такое движение молекул происходит во всех газах.
Тогда ли в газах происходит самопроизвольное движение молекул?
В 1827 году английский ботаник Броун, рассматривая в микроскоп пыльцу растений, помещённую в каплю воды, заметил, что некоторые крупинки пыльцы колеблются, передвигаются в разных направлениях. Это явление получило название броуновского движения. Объясняется оно тем, что молекулы воды находятся в непрерывном и беспорядочном движении и неравномерно ударяют крупинки пыльцы с разных сторон. Под воздействием этих ударов крупинки пыльцы беспорядочно передвигаются в разные стороны.
Самопроизвольное движение молекул является свойством всех газов и жидкостей. Благодаря этому движению происходит диффузия не только в газах, но и в жидкостях. В этом можно убедиться и на следующем опыте.
В стеклянную трубку с краном наливают небольшое количество чистой воды, а в воронку — раствор марганцевокислого калия. Затем осторожно открывают кран так, чтобы раствор марганцевокислого калия, более тяжёлый, чем рода, медленно входил в трубку и поднимал находящийся в ней слой воды.
Когда фиолетовый раствор поднимется примерно на высоты трубки, закрывают кран. Между бесцветной водой и фиолетовым раствором марганцевокислого калия заметна довольно резкая граница, которая по истечении нескольких дней становится размытой. Объясняется это тем, что частицы марганцевокислого калия постепенно проникают (диффундируют) в верхние слои воды, а вода диффундирует в раствор марганцевокислого калия.
Возможна ли диффузия в твёрдых телах? Следующий опыт даёт положительный ответ на поставленный вопрос. Так, если прижать одну к другой две хорошо пришлифованные пластинки различных металлов и сильно нагреть их, не доводя до плавления, то можно обнаружить проникновение частиц одного металла в другой.
Следовательно, самопроизвольное движение молекул происходит во всех веществах в любых состояниях: в газообразном, жидком и твёрдом.
scibio.ru
Строение веществ » HimEge.ru
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения.
Это вещества, состоящие из молекул. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (С, Si, Li, Na, К, Си, Fe, W), среди них есть металлы и неметаллы.
Немолекулярное строение веществ
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K2S04), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, КОН). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Твердые вещества: кристаллические и аморфные
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Сl—, так и сложные S042-, ОН—. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Сl—, образующих решетку в форме куба.

Ионная кристаллическая решетка поваренной соли
Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.

Атомная кристаллическая решетка алмаза
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы.

Молекулярная кристаллическая решетка йода
Химические связи в этих молекулах могут быть и полярными (НСl, Н2O), и неполярными (N2, О2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки.

Металлическая кристаллическая решетка
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
himege.ru
Строение веществ - Наука и образование
Скорость движения газовых молекул можно измерить на опыте.
Один из таких опытов заключается в следующем. В сильно откачанном сосуде находится платиновая посеребрённая проволока РР, которая окружена двумя цилиндрами А и В так, что является их общей осью, вокруг которой цилиндры могут вращаться.
Во внутреннем цилиндре А параллельно проволоке прорезана узкая щель S. Платиновую проволоку накаливают электрическим током до температуры, при которой серебро начинает плавиться и испаряться. При этом некоторые молекулы серебра пролетают через щель и отлагаются на внешнем цилиндре в виде серебряной полоски L, которая представляет собой чёткое изображение щели.
Затем оба цилиндра приводятся во вращение в направлении, указанном стрелкой. После остановки цилиндров оказывается, что серебряная полоска L, отложившаяся на внешнем цилиндре В во время его движения, сместилась в сторону, противоположную вращению прибора, в положение L1.
Это смещение объясняется тем, что пока молекулы серебра пробегали расстояние от щели S до внешнего цилиндра, произошло смещение цилиндра на расстояние LL1.
Чем больше скорость вращения цилиндров, тем большее получается смещение. Зная расстояние, на которое смещается полоска серебра, и скорость вращения цилиндров, можно определить скорость движения молекул.
Подробнее...
Как и все тела, частицы окружающего нас воздуха притягиваются к Земле. Но почему же тогда они все не упадут на поверхность Земли? Чем объяснить наличие у Земли атмосферы?
Только непрерывным движением молекул можно объяснить тот факт, что, несмотря на свой вес, газы, составляющие атмосферу, не находятся на поверхности Земли, а распределяются с всё уменьшающейся плотностью в весьма толстом слое, достигающем тысячи километров. Такое распределение газа в атмосфере происходит под влиянием, с одной стороны, силы тяготения, притягивающей молекулы к Земле, с другой стороны, движения молекул воздуха, разбрасывающего молекулы по всем направлениям.
Следы земной атмосферы обнаружены с помощью искусственных спутников Земли на расстоянии 1500 км и более от её поверхности.
Подробнее...
scibio.ru