Справочник химика 21. Вода сложный эфир
Растворимость воды в сложных эфирах и гидролиз сложных эфиров
Растворимость воды в сложных эфирах и гидролиз сложных эфиров
10.10.2012
Растворимость воды в сложных эфирах при 28С в большинстве случаев не превышает 0,05%, у отдельных эфиров - 0,1%; исключение составляют эфиры триэтилен- и полиэтиленгликолей и 2-этилгексановой кислоты, которые растворяют 0,2-1,3% воды. Следует полагать, что при содержании в эфире воды не более 0,1% скорость гидролиза эфира будет протекать весьма медленно.
Экспериментальные определения степени гидролиза большей части эфиров двухосновных кислот показывают, что их гидролиз в течение 24 час. не превышает 0,02-0,03%, кроме ди-2-этилгексилового эфира глутаровой кислоты и ди-2-(бутоксиэтокси) этилового эфира адипиновой кислоты, а также триэтиленгликольди-2-этилгексаноата, глубина гидролиза которых составляет соответственно 0,1, 0,2% в достаточно широком интервале рН (от 3,0 до 9,6).
Сложные эфиры, синтезированные из неполных эфиров многоатомных спиртов вместо спиртов того же молекулярного веса или путем взаимодействия полиэтиленгликолей с разветвленными одноосновными карбоновыми кислотами, должны обладать большей растворимостью воды, и потому можно предположить, что скорость гидролиза этих эфиров также должна быть больше.
Стойкость сложных эфиров к гидролитическому расщеплению, как правило, больше у эфиров, имеющих одну или несколько коротких боковых цепей в основной цепи молекулы. Эффект боковых цепей тем больше, чем ближе они расположены к эфирной связи. Желательно иметь боковые цепи в В-положении по отношению к спиртовому или кислотному остатку. Такое строение молекулы эфира как бы создает пространственные затруднения для гидролиза эфирной связи. Однако очень большое экранирование этой связи имеет и серьезный недостаток - при синтезе выходы эфиров такого строения должны быть невысоки соответственно степени экранирования.
Сложные эфиры, а также и приготовленные на их основе смазочные жидкости значительно менее вспениваются (при прохождении газов через слой жидкости), чем нефтяные масла, и их цена значительно менее устойчива.
Чистые эфиры не образуют с водой стойкой эмульсии, и эфир полностью отделяется от воды в течение 10 мин. или даже быстрее, скорость деэмульсации тем больше, чем меньше плотность эфира. Добавка к эфирам 0.2% 4-изобутил-2-фенилфенола не изменяет заметно скорости деэмульсации эфиров. При добавке к эфирам антикоррозийных присадок стойкость образующихся эмульсий этих эфиров с водой заметно увеличивается, меньше при добавках солей двухвалентных металлов арилстеариновых кислот, больше - при добавках нефтяных сульфонатов.
necton-sea.ru
Растворимость - сложный эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Растворимость - сложный эфир
Cтраница 1
Растворимость сложного эфира в воде заметно ниже, чем растворимость исходной кислоты и спирта вследствие исчезновения свободных гидроксильных групп. Высаливание - добавление какой-либо соли в раствор - еще более снижает растворимость сложного эфира в воде ( ср. [1]
Растворимость сложного эфира в воде заметно ниже, чем растворимость исходной кислоты и спирта, вследствие исчезновения свободных гидроксиль-ных групп. Высаливание-добавление какой-либо соли в раствор-еще более снижает растворимость сложного эфира в воде ( ср. [2]
В литературе, посвященной растворимости сложных эфиров целлюлозы, неоднократно высказывалось мнение об однозначной зависимости между полярностью растворителя и его растворяющем действии на эфир целлюлозы. Однако ряд фактов указывает на несоответствие некоторых систем этой зависимости. [4]
Если водный слой недостаточно хорошо отделяется от эфирного, следует добавить 5 г поваренной соли и тщательно перемешать. Этот процесс высаливания снижает растворимость сложного эфира в воде. [5]
Гидролизуется сложный эфир только одного энантиомера. Смесь легко разделяется, так как растворимость сложного эфира значительно отличается от растворимости аминокислоты. [6]
Растворимость сложного эфира в воде заметно ниже, чем растворимость исходной кислоты и спирта, вследствие исчезновения свободных гидроксиль-ных групп. Высаливание-добавление какой-либо соли в раствор-еще более снижает растворимость сложного эфира в воде ( ср. [7]
Фильтрат переносят в реакционную колбу и при перемешивании ( для предотвращения толчков при кипении) отгоняют большую часть этанола. К остатку добавляют водный раствор бромида натрия для уменьшения растворимости сложного эфира и повышения плотности водного слоя, чтобы слой, содержащий сложный эфир, находился сверху. [8]
Растворимость сложного эфира в воде заметно ниже, чем растворимость исходной кислоты и спирта вследствие исчезновения свободных гидроксильных групп. Высаливание - добавление какой-либо соли в раствор - еще более снижает растворимость сложного эфира в воде ( ср. [9]
Существование оптимума содержания воды и растворенного масла в кислотной фазе [29] легко может быть связано с ионизацией сложного эфира. Если концентрация кислоты чрезмерно понижается, то ионизация недостаточна. Если содержание масла слишком низко, то растворимость сложного эфира также понижается. При слишком малом содержании воды может понижаться ионизация самой кислоты, что выражается в меньшей способности ее присоединяться к олефину. [10]
Остаток переносят из колбы в делительную воронку, промывают 50 - 60 мл воды и нижний водяной слой отделяют. Оставшийся в делительной воронке эфирный слой встряхивают последовательно с 50 мл воды 20 - 25 мл разбавленного раствора кислого углекислого натрия до нейтральной реакции и вновь с 25 мл воды. Отделив от воды эфир, высушивают его безводным сернокислым натрием или хлористым кальцием. Если водяной слой недостаточно хорошо отделяется от эфирного, следует добавить 5 г поваренной соли и тщательно перемешать. Этот процесс высаливания снижает растворимость сложного эфира в воде. Затем в приборе 2 отгоняют две фракции: 1) до ПО С, состоящую главным образом из остатка бензола; 2) 136 - 142 С. [11]
После окончания реакции, которая длится 3 - 4 ч, бензольный раствор, собравшийся в насадке, сливают обратно в колбу, собирают прибор 2 и отгоняют бензол от реакционной смеси при 80 - 81 С. Остаток переносят из колбы в делительную воронку, промывают 50 - бО мл воды и нижний водяной слой отделяют. Оставшийся в делительной воронке эфирный слой встряхивают последовательно с 50 мл воды, 20 - 25 мл разбавленного раствора кислого углекислого натрия до нейтральной реакции и вновь с 25 мл воды. Отделив от воды эфир, высушивают его безводным сернокислым натрием или хлористым кальцием. Если водяной слой недостаточно хорошо отделяется от эфирного, следует добавить 5 г поваренной соли и тщательно перемешать. Этот процесс высаливания снижает растворимость сложного эфира в воде. Затем в приборе 2 отгоняют две фракции: 1) до 110 С, состоящую главным образом из остатка бензола; 2) 136 - 142 С. Если температурный интервал второй фракции будет больше, то эту фракцию подвергают вторичной перегонке, собирая уксусноизоамиловый эфир при 138 - 142 С. [12]
После окончания реакции, которая длится 3 - 4 ч, бензольный раствор, собравшийся в насадке, сливают обратно в колбу, со1 бирают прибор 2 и отгоняют бензол от реакционной смеси при 80 - 81 С. Остаток переносят из колбы в делительную воронку, промывают 50 - 60 мл воды и нижний водяной слой отделяют. Оставшийся в делительной воронке эфирный слой встряхивают последовательно с 50 мл воды, 20 - 25 мл разбавленного раствора кислого углекислого натрия до нейтральной реакции и вновь с 25 мл воды. Отделив от воды эфир, высушивают его безводным сернокислым натрием или хлористым кальцием. Если водяной слой недостаточно хорошо отделяется от эфирного, следует добавить 5 г поваренной соли и тщательно перемешать. Этот процесс высаливания снижает растворимость сложного эфира в воде. Затем в приборе 2 отгоняют две фракции: 1) до 110 С, состоящую главным образом из остатка бензола; 2) 136 - 142 С. Если температурный интервал второй фракции будет больше, то эту фракцию подвергают вторичной перегонке, собирая уксусноизоамиловый эфир при 138 - 142 С. [13]
После окончания реакции, которая длится 3 - 4 ч, бензольный раствор, собравшийся в насадке, сливают обратно в колбу, собирают прибор 2 и отгоняют бензол от реакционной смеси при 80 - 81 С. Остаток переносят из колбы в делительную воронку, промывают 50 - 60 мл воды и нижний водяной слой отделяют. Оставшийся в делительной воронке эфирный слой встряхивают последовательно с 50 мл воды, 20 - 25 мл разбавленного раствора кислого углекислого натрия до нейтральной реакции и вновь с 25 мл воды. Отделив от воды эфир, высушивают его безводным сернокислым натрием или хлористым кальцием. Если водяной слой недостаточно хорошо отделяется от эфирного, следует добавить 5 г поваренной соли и тщательно перемешать. Этот процесс высаливания снижает растворимость сложного эфира в воде. Затем в приборе 2 отгоняют две фракции: 1) до 110 С, состоящую главным образом из остатка бензола; 2) 136 - 142 С. Если температурный интервал второй фракции будет больше, то эту фракцию подвергают вторичной перегонке, собирая уксусноизоамиловый эфир при 138 - 142 С. [14]
После окончания реакции, которая длится 3 - 4 ч, бензольный раствор, собравшийся в насадке, сливают обратно в колбу, собирают прибор 2 и отгоняют бензол от реакционной смеси при 80 - 81 С. Остаток переносят из колбы в делительную воронку, промывают 50 - - 60 мл воды и нижний водяной слой отделяют. Оставшийся в делительной воронке эфирный слой встряхивают последовательно с 50 мл воды, 20 - 25 мл разбавленного раствора кислого углекислого натрия до нейтральной реакции и вновь с 25 мл воды. Отделив от воды эфир, высушивают его безводным сернокислым натрием или хлористым кальцием. Если водяной слой недостаточно хорошо отделяется от эфирного, следует добавить 5 г поваренной соли и тщательно перемешать. Этот процесс высаливания снижает растворимость сложного эфира в воде. Затем в приборе 2 отгоняют две фракции: 1) до 110 С, состоящую главным образом из остатка бензола; 2) 136 - 142 С. Если температурный интервал второй фракции будет больше, то эту фракцию подвергают вторичной перегонке, собирая уксусноизоамиловый эфир при 138 - 142 С. [15]
Страницы: 1
www.ngpedia.ru
Сложные эфиры. Жиры

Разделы: Химия
Цели:
- Систематизировать знания о сложных эфирах, их строении, нахождении в природе и свойствах.
- Сформировать представление о жирах, их составе, свойствах и применении.
Задачи:
- Образовательные: познакомить учащихся с жирами, их строением и классификацией; изучить получение и химические свойства жиров;познакомить с функциями жиров в организме человека; познакомить с применением сложных эфиров и жиров.
- Развивающие: развить умения применять ИКТ;продолжить развитие умений анализировать; развивать логическое мышление, практические умения и умения прогнозировать.
- Воспитательные: создание эффекта необычности для мотивации обучения;воспитание бережного отношения к природе.
Тип урока: урок изучения и первичного закрепления новых знаний.
ИКТ применяются для наглядности объяснения нового материала, урок сопровождается демонстрационными опытами.
Оборудование: компьютер, мультимедийный проектор, экран, химические реактивы и лабораторное оборудование.
Презентация.
Сложные эфиры. Жиры. (Слайд 1)
Наш урок мы посвятим очень важной теме: “Сложные эфиры. Жиры”, которые имеет большое практическое значение в нашей жизни. Сложные эфиры образуются при взаимодействии карбоновых кислот со спиртами (реакция этерификации) (слайд 2). Запишем ее в общем виде:
Эта реакция обратима. Реакция сложных эфиров с водой (гидролиз сложного эфира) обратна реакции этерификации. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ – спирта и кислоты. Химическое равновесие можно сместить в сторону образования сложного эфира с помощью водоотнимающих средств, например конц. серной кислоты, а в сторону гидролиза сложного эфира – в присутствии щелочи (слайд 3).
Составьте уравнения двух реакций этерификации, с помощью которых можно получить этиловый эфир муравьиной кислоты и пропиловый эфир уксусной кислоты.
Сложные эфиры широко распространены в природе, простейшие из них – бесцветные легкокипящие жидкости с фруктовым запахом; а высшие сложные эфиры – воскообразные вещества (пчелиный воск) (слайд 4). Плотность сложных эфиров меньше плотности воды, поэтому они практически в ней не растворяются. Сложные эфиры являются хорошими растворителями органических веществ, поэтому их применяют как растворители лаков и красок, также в пищевой промышленности как ароматизаторы изделий (слайд 5).
Важнейшими представителями сложных эфиров являются жиры (слайд 6).
При нагревании жиров с водой в щелочной среде французский ученый Э. Шеврель установил, что жиры расщепляются и образуются глицерин и различные карбоновые кислоты. Французский ученый М.Бертло в 1854 г. осуществил обратный процесс: при нагревании глицерина с высшими карбоновыми кислотами он получил жиры и воду (слайд 7).
На основании этих экспериментов сделали вывод, что жиры – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот, общая формула которых изображена на слайде 6.
Жиры имеют сложное строение – это подтверждает модель молекулы тристеарата. По физическим свойствам жиры – твердые вещества (слайд 8) или вязкие жидкости (слайд 9). Рассмотрим растворимость жиров (опыт) нальем в пробирки различные растворители (воду, этанол, бензол, бензил) и добавим в каждую пробирку растительное масло, и встряхнем. Жиры в воде не растворяются, но растворяются в органических растворителях (бензиле, бензоле, гексане...). Поэтому их можно извлечь экстракцией из измельченных семян растений или из животных продуктов этими растворителями при нагревании. Рассмотрим классификацию жиров (слайд 10).
Жиры являются важнейшими продуктами питания.
Выясним строение жидких жиров. Прильем к растительному маслу раствор бромной воды – она обесцветится. Значит, жидкие жиры содержат остатки непредельных карбоновых кислот. Для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Назовите их. Наиболее важная реакция присоединения, имеющая практическое значение – это гидрирование жидких жиров (слайд №11). Эта реакция лежит в основе получения маргарина (твердого жира) из растительного масла.
Все жиры, как и другие сложные эфиры, подвергаются гидролизу (слайд 12).
Гидролиз жиров протекает и в нашем организме: когда в органы пищеварения поступают жиры, то под влиянием ферментов они гидролизуются с образованием глицерина и карбоновых кислот. Продукты гидролиза всасываются ворсинками кишечника, а затем синтезируется жир, но уже свойственный данному организму. В дальнейшем они гидролизуются и постепенно окисляются до углекислого газа и воды. При окислении жиров в организме выделяется большое количество энергии. Для людей, занятых тяжелым физическим трудом, затраченную энергию проще всего компенсировать жирной пищей. Жиры поставляют в ткани организма жирорастворимые витамины и другие биологические активные вещества.
Гидролиз сложных эфиров – обратимая реакция. Для смещения равновесия в сторону продуктов реакции его проводят в щелочной среде (в присутствии щелочей или карбонатов щелочных металлов, например, карбоната натрия).
Гидролиз жиров в щелочной среде называют омылением жиров, т.к. образуются соли карбоновых кислот, которые называют мылами (слайд 13).
Мыла – натриевые или калиевые соли высших карбоновых кислот. Натриевые соли высших карбоновых кислот имеют твердое агрегатное состояние, а калиевые – жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты.
Если мы используем для мытья и стирки жесткую воду, а такая вода содержит ионы Са 2+ и Mg2+,то мыло теряет свою моющую способность.
Как вы думаете почему?
Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде. Запишем уравнение реакции:
2С17Н35СООNa + СаСI2 = (C17 h45COO)2Ca ↓ + 2NaCI
Почему после мытья волос твердым мылом в жесткой воде нужно прополоскать их раствором уксуса?
Чтобы удалить нерастворимые соли кальция и жирных кислот.
Как используя мыльный раствор отличить родниковую воду от снеговой? (В родниковой выпадет осадок).
Знаете ли вы?
Какую роль играет жир в горбе верблюда? (Источник воды).
Какие масла влияют на содержание холестерина в крови? (Животные).
Жиры имеют большое практическое значение и выполняют в нашем организме несколько функций: (слайд 14) Приложение
- Энергетическая (при полном расщеплении 1 г жира до СО2 и Н2О освобождается 38,9 кДж энергии).
- Структурная (жиры – важный компонент каждой клетки).
- Защитная (жиры накапливаются в подкожных тканях и тканях, окружающих внутренние органы).
- Жиры обладают низкой теплопроводностью и предохраняют организм от переохлаждения. Поэтому северяне, употребляют много животных жиров.
xn--i1abbnckbmcl9fb.xn--p1ai
Персональный сайт - Каталог статей
При взаимодействии карбоновых кислот со спиртами(реакция этерификации) образуются сложные эфиры: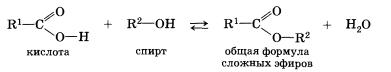
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ —спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции эте-рификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Сложные эфиры в природе и технике
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности (схема 10). Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней.
Схема 10. Применение сложных эфиров
Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов.
Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов называют во скажи. Так, пчелиный воск состоит, главным образом, из эфира пальмитиновой кислоты и мирицилового спирта С15Н31СООС31Н63, кашалотовый воск — спермацет — сложный эфир той же пальмитиновой кислоты и цетилового спирта С15Н31СООС16Н33.
Важнейшими представителями сложных эфиров являются жиры.
Жиры — природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Состав и строение жиров могут быть отражены общей формулой: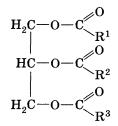
Большинство жиров образовано тремя карбоновыми кислотами — олеиновой, пальмитиновой и стеариновой. Очевидно, две из них — предельные (насыщенные), а олеиновая кислота содержит двойную связь между атомами углерода в молекуле. Таким образом, в состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют маслами. В основном это жиры растительного происхождения — льняное, конопляное, подсолнечное и другие масла. Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях — твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например бараний жир. Известны исключения и из этого правила. Так, пальмовое масло — твердый в обычных условиях жир.
Состав жиров определяет их физические и химические свойства. Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция — гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно (подумайте, почему условно) этот процесс можно описать уравнением реакции:
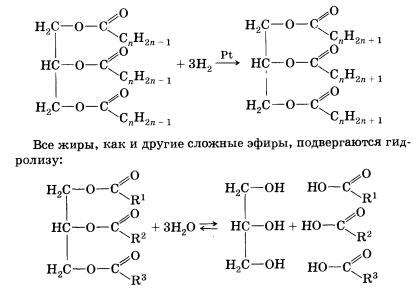
Напомним, что гидролиз сложных эфиров — обратимая реакция. Для смещения равновесия в сторону образования продуктов гидролиза его проводят в щелочной среде (в присутствии щелочей или карбонатов щелочных металлов, например кальцинированной соды). В этих условиях гидролиз жиров протекает необратимо и приводит в результате к образованию не карбоновых кислот, а их солей, которые называются мылами. Поэтому гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла — натриевые или калиевые соли высших карбоновых кислот.
himi4ok.ucoz.ru
Растворители сложные эфиры кислот - Справочник химика 21
Этим методом пользуются и при получении сложных эфиров кислот, карбоксильная группа которых находится при третичном углеродном атоме. Вместо серебряных солей используют более дешевые натриевые или калиевые соли. Реакцию можно проводить в растворителях (бензоле, толуоле, эфире, хлороформе, уксусной кислоте) или без растворителей, непосредственно действуя избытком галогеналкила на соответствующую соль. [c.170] Физические свойства. Сложные эфиры могут быть как жидкими, так и твердыми веществами в зависимости от молекулярной массы образующих их кислоты и спирта. Сложные эфиры низших и средних гомологов — летучие жидкости с характерным, часто приятным запахом. Многие из них являются носителями запаха различных плодов, овощей и фруктов. Сложные эфиры труднее растворимы в воде, чем образующие их спирты и кислоты. Так, этиловый спирт и уксусная кислота смешиваются с водой во всех отношениях, тогда как уксусноэтиловый эфир трудно растворим в воде. В органических растворителях сложные эфиры растворяются хорошо. [c.180]Аналогичные примеры найдены для реакций гидролиза сложных эфиров кислотами и основаниями, активированные комплексы в которых сильно полярны за счет ионизации карбонильных групп во второй главе обсуждаются именно такие механизмы реакции. За счет ориентации растворителя активированными комплексами энтропия активации в таких реакциях очень мала. И реакция ускоряется с повышением диэлектрической проницаемости растворителя. [c.238]
Физические свойства. Сложные эфиры, образованные низшими представителями кислот и спиртов, представляют собой жидкости. Они обладают приятным запахом, напоминающим фруктовый. В воде с южные эфиры растворяются очень мало. В органических растворителях сложные эфиры растворяются легко. [c.387]
Камфара растворима во многих органических растворителях (спирте, углеводородах, простых и сложных эфирах, кислотах) и сама является растворителем. В воде она растворяется незначительно 1 кг в 1300 л воды. В холодной воде растворяется лучше, чем в горячей. Кусочек камфары, брошенный в воду, приходит в быстрое вращательное движение. [c.300]
Синтез уксусной кислоты. Уксусная кислота СНзСООН (т. кип. 118°С, т. пл. 16,6 °С) полностью смешивается с водой и многими органическими растворителями. Она является важнейшей из алифатических кислот и широко применяется в пищевых целях, в качестве растворителя, промежуточного продукта для синтеза монохлоруксусной кислоты, растворителей — сложных эфиров уксусной кислоты (этилацетат, бутилацетат и др.), мономеров (винилацетат) и других ценных веществ. [c.392]
В то время как автомобильный транспорт загрязняет воздух почти исключительно углеводородами, промышленные предприятия выбрасывают в атмосферу органические соединения самых различных классов. Особенно широкий ассортимент загрязнителей выделяют предприятия химической и нефтехимической промышленности, в выбросах которых часто присутствуют компоненты исходного сырья, промежуточные и конечные продукты синтеза. Например, в газовых выбросах заводов жирозаменителей и синтетических моющих средств содержатся парафиновые углеводороды, подвергаемые окислению, а также промежуточные и побочные продукты — альдегиды, кетоны, эфиры, карбоновые кислоты. Заводы синтетического каучука загрязняют воздух мономерами (стирол, бутадиен, изопрен, хлоропрен, акрилонитрил и другие) и растворителями. Предприятия лесохимической промышленности выделяют уксусный и пропионо-вый альдегиды, ацетон, спирты i—С4, сложные эфиры, кислоты С2—Сб и терпеновые углеводороды. Целлюлозно-бумажные комбинаты выбрасывают большие количества газообразных одорантов, таких, как метилсульфид, диметилсульфид, диметил-дисульфид, а также формальдегид, метанол, фенол и терпены. [c.13]
При вулканизации происходит изменение макромолекулярного строения, однако для каучука можно осуществить реакции, известные из химии олефинов, при которых структура полимера не меняется или изменяется лишь незначительно. К этим реакциям относятся все реакции присоединения по двойной связи (гидрирование и особенно хлорирование). Хлоркаучук, твердый при комнатной температуре, приобретает пластические свойства (но не каучукоподобную эластичность) при повышенной температуре (начиная с 80°). Он используется как пластмасса, в частности, для создания лаковых покрытий, устойчивых к действию кислот, хлора, алифатических углеводородов. Хлоркаучуковые покрытия неустойчивы к действию ароматических растворителей, сложных эфиров и кетонов. При хлорировании снижается вязкость каучука в растворе. Причина этого явления пока не установлена. Штаудингер предполагает, что при хлорировании происходит циклизация. При действии на каучук газообразного хлористого водорода происходит гидрохлорирование. Гидрохлорид каучука по свойствам напоминает гуттаперчу. Переход в область каучукоподобной эластичности для него осуществляется при температуре П5°. [c.115]
Как правило, эластичные ППУ обладают хорошей стойкостью к действию воды, водных растворов и растворителей. Вода и водные растворы не влияют на стабильность размеров пенопласта, тогда как углеводородные растворители и льняное масло (в меньшей степени), ароматические и хлорсодержащие растворители, сложные эфиры, кетоны и спирты (в большей степени) вызывают набухание пенопласта. Химическая стойкость эластичного ППУ на основе сложного олигоэфира адипиновой кислоты с р = 32 кг/м , выраженная в процентах линейного удлинения, равна 11% для толуола, 9,5% для тетрахлорметана и 5,6% для тетрахлорэтилена. После высушивания пенопласт восстанавливает свои первоначальные размеры. [c.101]
Поливинилхлорид водостоек, обладает стойкостью к минеральным маслам, кислотам, щелочам и повышенной прочностью так как содержание хлора в нем достигает 56%, то он огнестоек. ПВХ растворяется в хлорсодержащих растворителях, сложных эфирах и кетонах. [c.162]
Направление научных исследований пищевые жиры и масла, красители для пищевой промышленности пеногасители технические жиры, косметические и фармацевтические продукты аппретуры для волокон пластификаторы, катализаторы, мыла и растворители сложные эфиры жирных кислот, этоксилаты, сульфонаты, амиды разработка специальных составов для обработки котельной воды и химических препаратов для очистки воздуха на судах, в автомобилях и самолетах. [c.68]
Особое положение занимают головные погоны в области получения сложных эфиров, применяющиеся как мягчители и растворители. Сложные эфиры этих кислот с гликолем, глицерином, триметилолэтаном или триметилолпропаном, пентаэритритом, гексантриолом и т. п. являются полезными мягчителями для различных высокополимерных веществ [98]. [c.473]
По стойкости к полярным растворителям — сложным эфирам, кетонам, тетратидрофурану, окислителям, основаниям, хлорсуль-фоновой кислоте и фтористому водороду резины на основе пер-фторированных каучуков типа СКФ-460 и ЕСД-006 значительно превосходят другие резины, в том числе и резины на основе сополимеров винилиденфторида. Вулканизаты на основе перфторалкилентриазиновых эластомеров совершенно не стойки к щелочам и аминам. [c.520]
Практика эксплуатации установок окисления ацетальдегида в надуксусную кислоту показала надежность принятых мер безопас ности, что открывает возможности для дальнейшего развития эко номичн1з1х методов синтеза на основе этого окислительного агента Синтез уксусной кислоты. Уксусная кислота СНз—СООН (т кип. 1П°С, т. пл. 16,6°С) полностью смешивается с водой и мне гими 011ганическими растворителями. Она является важнейшей из алифат11ческих кислот и широко применяется в пищевых целях, в качестве растворителя, промежуточного продукта для синтеза мо-нохлоруксусной кислоты, растворителей — сложных эфиров уксусной кислоты (этилацетат, бутилацетат и др.), мономеров (винилацетат) и других ценных веществ. [c.405]
Действием 84% гидразингидрата в спирте на сложный эфир триазинкарбоновой кислоты выделяют гидразиды соответствующих кислот. При наличии в положении 3 или 5 триазинового кольца меркапто- или метилмеркаптогрупп происходит одновременно замещение их на гидразин [806, 808]. Гидразиды кислот получают и циклизацией гидразингидрата с замещенным амидом а-кетокислоты. Амиды кислот выделяются при действии на сложные эфиры кислот аммиаком или замещенными аминами в спиртовой среде. Обычно используют раствор аммиака в метаноле или этаноле при длительном стоянии в обычных условиях, иногда при нагревании. Можно получать амиды и при обработке эфира триазинкарбоновой кислоты раствором аммиака в ацетоне или уксусной кислоте. В случае применения аминов в качестве растворителя можно использовать сухой бензол или проводить реакцию в присутствии метилата натрия в мета- [c.199]
В настоящее время наиболее распространены из полимеризационных пленкообразователей производные поливинила. Поливинилхлорид водостоек, обладает стойкостью к маслам, кислотам, щелочам и повы-иенной прочностью, растворяется в хлорсодержащих растворителях, сложных эфирах и кетонах. К недостаткам поливинилхлорида относят низкую термо- и светостойкость, невысокую адгезию к металлу. [c.16]
Омыление щелочью наиболее часто применяется для количественного определения содержания большинства сложных эфиров, в том числе и жиров, а также продуктов этерификации фенолов. Наибольшее влияние на реакцию омыления оказывают следующие факторы достаточная концентрация ионов гидроксила в растворе, хорошая растворимость анализируемого вещества во взятом растворителе и высокая температура реакции омыления. Сравнительно легко растворимые в воде сложные эфиры (как, например, этил-формиат, метилформиат, этилацетат и др.) могут быть омылены водными растворами щелочей. Сложные эфиры, плохо растворимые в воде, омыляют в спиртовой среде. Для этого пользуются спиртовыми растворами едкого кали или едкого натра. Можно прямо растворить сложный эфир в этиловом спирте, а затем прилить определенное количество водного раствора титрованной щелочи и омылить эфир. Спиртовые растворы едкого кали более предпочтительны вследствие хорошей растворимости едкого кали в спирте, особенно при получении его концентрированных растворов. Скорость омыления сложных эфиров различна. Она зависит от природы входящих в состав сложного эфира кислоты и спирта. В одних случаях реакция омыления протекает быстро даже при обычной комнатной температуре, в других [c.249]
Ход определения. К сухому остатку, полученному после разделения органических веществ (см. разд. 9.2), прибавляют 5 мл 207о-ного раствора едкого натра и после растворения кислот количественно переносят полученный раствор в колбу вместимостью 50 мл, приливают 3 мл диметилсульфата, закрывают пробкой и перемешивают смесь 2—3 мин. Затем колбу присоединяют к обратному холодильнику, нагревают на водяной бане 10—15 мнн, охлаждают, отъединяют холодильник и переносят содержимое колбы в делительную воронку вместимостью 100 мл. Образовавшиеся сложные эфиры кислот извлекают экстракцией гексаном (3 раза по 10 мл), экстракты объединяют, высушивают, прибавляя прокаленный сульфат натрия, переносят в предварительно взвешенный бюкс и испаряют растворитель под вентилятором до объема около 0,5 мл, после чего бюкс снова взвешивают. По разности масс и плотности гексана рассчитывают объем полученного раствора метиловых эфиров кислот в гексане. [c.296]
Определение с дитиолом. Дитиол (толуол-3,4-дитиол 4-метил-1,2-димеркаптобепзол) образует с молибденом (VI) соединение темно-зеленого цвета, малорастворимое в кислотах. Соединение это растворяется во многих органических растворителях сложных эфирах, углеводородах, бензоле, четыреххлористом углероде и др. [c.896]
Б.П1.6.8. Олефины и ненасыщенные соединения. Ионы серебра образуют координационные комплексы с олефинами и более устойчивые комплексы с диенами-1,2. Известно, что порошкообразный нитрат серебра использовался в качестве неподвижной фазы в газовой хроматографии олефинов. На макросетчатой катионообменной смоле, содержащей ионы серебра, разделяли цис- и транс-тошеры диенов в растворе метилового спирта [122]. Вымывали этим же растворителем. Сложные эфиры ненасыщенных олеиновой и линолевой кислот удалось разделить подобным же образом на содержащей серебро катионообменной смоле, вымывая смесью вода — метиловый спирт или раствором бутена в метиловом спирте [123]. [c.230]
Растворимость в спиртах уменьшается с увеличением молекулярного веса спирта. Первичные спирты оказываются лучшими растворителями в сравнении со вторичными спиртами. С накоплением гидроксильных групп в спиртах ухудшается растворимость гексахл0рщ1кл0гексана. Эфиры (в особенности сложные эфиры) в сравнении со спиртами оказываются лучшими растворителями. Сложные эфиры одной и той же кислоты растворяют гексахлорциклогексан тем хуже, чем больше молекулярный вес эфира. [c.23]
Оксиэтиламиды двухосновных кислот (малеиновой, фумаровой, адипиновой, себациновой, янтарной, фталевой, терефталевой) растворимы в воде и низших спиртах, нерастворимы в диэтиловом эфире, кетонах, алифатических и ароматических углеводородах, хлорсодержащих растворителях, сложных эфирах мало растворимы в диоксане. [c.188]
Разработанные методы индивидуализации входящих в состав горного воска химических соединений, основанные на применении различных растворителей, дробной кристаллизации и разделительной адсорбционной хроматографии, позволили выделить из него высокомолекулярные жирные кислоты от С21 до С31, сложные эфиры кислот и спиртов. Знание химического состава дало возможность установить новые области применения горного воска точное литье по выплавляемым моделям, производство пластмасс на основе фенолальдегидных пресспорошков, в которых горным воском заменяют стеарин и стеарат кальция. Пребладание соединений с длинной углеродной цепочкой обусловливает получение на основе горного воска модельных составов для точного литья с достаточно высокой температурой плавления, т. е. более устойчивых к деформациям в производствен- [c.130]
Отрицательной стороной способа окисления жпдкпх парафинов является повышенный выход низкомолекулярных кислот, которые в настояш,ее время еще недостаточно исиользуются. Сложные эфиры низкомолекулярных кислот, полученные прп их этерпфи-кации одноатомными и двухатомными спиртами, могут найти квалифицированное применеппе. Например, сложные эфиры кислот Сх — Се могут быть псиользованы для экстракции фенолов и других органических соединенпй из подсмольных вод, различных растворителей в лакокрасочной промышленности и др. Эфиры кислот С, — С9 должны получить широкое иримененпе в качестве пластификаторов. [c.68]
Трипропионат крахмала растворим в аро.матических углеводородах, хлорсодержащих растворителях, сложных эфирах, низших кетонах, уксусной и пропионовой кислотах. Он может быть пластифицирован трикрезилфосфатом, диметил-, дибутил-или диэтоксиэтилфталатами. Трипропионат крахмала с 35% пластификатора вполне пригоден для пропитки тканей. [c.82]
Если диацетоновый спирт восстанавливать, например, гидрированием в жидкой фазе при 70—80°С и 35 атм в присутствии никеля Ренея, он превращается в 2-метил-2,4-пентандиол [7] (т. кип. 196°С). Последний применяется как растворитель. Сложные эфиры метилпентандиола могут служить пластификаторами. Жидкофазная дегидратация этого диола при 120° С в присутствии соляной кислоты или иода приводит к образованию смеси [c.300]
В современной литературе проблеме устойчивости виниловых волокон к действию растворителей посвящено очень мало экспериментальных работ, причем в этих работах вопрос рассматривается лишь с качественной точки зрения. Виниловые волокна, однако, более подвержены действию органических растворителей, чем натуральные, и лучшие из них скорее можно сравнить в этом отношении с найлоном и териленом, чем с хлопком или шерстью. Можно сказать, что волокна из поливинилхлорида имеют наиболее низкую устойчивость к действию растворителей они растворяются или набухают при действии таких реагентов, как кетоны, целый ряд хлорированных растворителей, сложные эфиры, бензол, толуол, нитросоединения, тетрагидрофуран и диметилформамид [79]. Они вполне устойчивы к действию спиртов, алифатических углеводородов, аминов и органических кислот. Волокна из поливинилхлорида подвержены также действию, особенно при повышенной температуре, больпюго числа высококипящих жидкостей, применяемых в качестве пластификаторов для эластомеров [80]. [c.450]
Большие количества хлористого этила потребляют также в производстве этилцеллюлозы, которая в противоположность метилцеллюлозе образует растворимые в органических растворителях водостойкие пленки. Поэтому этилцеллюлозу широко применяют в лакокрасочной промышленности. Алкалицеллюлозу обрабатывают хлористым этилом в облицованном никелем автоклаве с мешалкой при температуре около 205°. В зависимости от режима процесса достигается различная глубина этилирования. После удаления спирта, эфира и непрореагиро-вавшего хлористого этила сырой продукт промывают водой и сушат. Этилцеллюлоза растворима в смесях хлороформа со спиртом, в ледяной уксусной кислоте, амилацетате, нитрометане и т. д. [186]. Этилцеллюлоза (более стойка, чем сложные эфиры целлюлозы, не гидролизуется, поэтому значительно устойчивее к действию кислот и щелочей. Обычно получаемая на промышленных установках этилцеллюлоза содержит [c.214]
Эти амиловые спирты, выпускаемые под фирменным названием пентазолы , содержат около 60% первичных и до 40% вторичных спиртов. Содержание первичных спиртов весьма ценно, так как именно они в виде ацетатов представляют исключительно важный растворитель для лакокрасочной промышленности их сложные эфиры винокаменной или фталевой кислоты являются важными мягчителями или (пластификаторами. Если бы гидролиз всех хлоридов амила протекал одинаково, то содержание первичного спирта должно было составлять лишь около-33%. Однако вследствие того, что первичные хлориды практически полностью превращаются в соответствующие спирты, в то время как вторичные и особенно третичные хлориды превращаются главным образом в олефины и, таким образом, в образовании спирта почти не участвуют, содержание первичных спиртов в гидролизате неизбежно увеличивается. Это совершенно ясно из всего сказанного выше. В олефины превращается около 50% не первично замещенных хлористых амилов, что соответствует приблизительно /з общего количества хлоридов. [c.220]
Наиболее важная проводимая в промышленном масштабе реакция низкомолекулярных нитропарафинов состоит в соединении их с альдегидами и кетонами, особенно с формальдегидом для получения нитроспиртов. Нитроспирты могут быть восстановлены в аминоспирты или же путем получения сложных эфиров с органическими или неорганическими кислотами превращепы в ценные конечные продукты, имеюшие значение как растворители, мягчители или взрывчатые вешества. [c.321]
Полученные таким путем сложные эфиры ошиовой кислоты совершенно нерастворимы во всех обычных растворителях, кроме третичных оснований, особенно пиридина, растворов, в которых они выделяются в виде слабоокрашешшх кристаллических продуктов с двумя молекулами кристаллизационного пиридина. Такие соединения могут рассматриваться как координационные комплексы, предположительно имеющие структуру [c.367]
chem21.info



















