Способ получения хлоргидрата метилового эфира глицина. Метиловый эфир аминоуксусной кислоты
Свойства аминокислот: химические и физические
Cвойства аминокислот можно разделить на две группы: химические и физические.
Химические свойства аминокислот
В зависимости от соединений, аминокислоты могут проявлять различные свойства.
Взаимодействие аминокислот:
Аминокислоты как амфотерные соединения образуют соли и с кислотами, и со щелочами.
Как карбоновые кислоты аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
Взаимодействие и свойства аминокислот с основаниями:Образуются соли:
Nh3-Ch3-COOH + NaOH Nh3-Ch3-COONa + h3O
Натриевая соль + 2-аминоуксусной кислоты Натриевая соль аминоуксусной кислоты (глицина) + вода
Взаимодействие со спиртами:
Аминокислоты могут реагировать со спиртами при наличии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Nh3-Ch3-COOH + Ch4OH Nh3-Ch3-COOCh4 + h3O.
Метиловый эфир / 2-аминоуксусной кислоты /
Взаимодействие с аммиаком:
Образуются амиды:
Nh3-CH(R)-COOH + H-Nh3 = Nh3-CH(R)-CONh3 + h3O
Амид
Взаимодействие аминокислот с сильными кислотами:
Получаем соли:
HOOC-Ch3-Nh3 + HCl → [HOOC-Ch3-Nh4]Cl (или HOOC-Ch3-Nh3*HCl↑)
Таковы основные химические свойства аминокислот.
Физические свойства аминокислот
Перечислим физические свойства аминокислот:
- Бесцветные
- Имеют кристаллическую форму
- Большинство аминокислот со сладким привкусом, но в зависимости от радикала (R) могут быть горькими или безвкусными
- Хорошо растворяются в воде, но плохо растворяются во многих органических растворителях
- Аминокислоты имеют свойство оптической активности
- Плавятся с разложением при температуре выше 200°C
- Нелетучие
- Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
uchilegko.info
Аминокислоты: свойства и получение
Рассмотрим физические свойства аминокислот. Аминокислоты – это бесцветные кристаллические вещества; имеют высокие температуры плавления, они хорошо растворимы в воде, но малорастворимы в органических растворителях. Аминокислоты бывают сладковатыми, горьковатыми и безвкусными. Аминокислоты хорошо кристаллизуются и имеют высокую плотность.
Получают α-аминокислоты из α-галогензамещённых карбоновых кислот при взаимодействии с аммиаком. Причём эту реакцию проводят в две стадии. Сначала получают α-галогензамещённую карбоновую кислоту, а на второй стадии при взаимодействии с аммиаком галоген замещается на аминогруппу.
Второй способ получения аминокислот – это гидролиз полипептидов – белков. При этом получается смесь аминокислот. Например, при гидролизе глицил-аланина образуются аминокислоты глицин и аланин.
Ароматические аминокислоты получают при восстановлении нитропроизводных ароматических кислот по реакции Зинина. Так, при восстановлении 4-нитробензойной кислоты получается 4-аминобензойная кислота.
Аминокислоты можно получить и микробиологическим синтезом. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α-аминокислоты.
Так как аминокислоты – это бифункциональные соединения, у которых есть карбоксильная и аминогруппы, то для них характерны кислотно-основные свойства. Карбоксильная группа обуславливает кислотные свойства, а аминогруппа – основные. То есть аминокислоты обладают амфотерными свойствами.
Для аминокислот характерна внутримолекулярная нейтрализация, при этом образуется биполярный, цвиттер-ион.
Аминокислоты электропроводны за счёт образования внутренних солей, при котором происходит перенос протона от карбоксильной группы к аминогруппе.
Рассмотрим химические свойства аминокислот по карбоксильной группе. Аминокислоты будут реагировать со щелочами. Так, в реакции глицина с гидроксидом натрия образуется натриевая соль 2-аминоуксусной кислоты и вода.
h3N – Ch3 – COOH + NaOH → h3N – Ch3 – COONa + h3O
Аминокислоты реагируют со спиртами, при этом образуются сложные эфиры, которые представляют собой летучие вещества. Так, в реакции глицина с метанолом в присутствии газоообразного хлороводорода образуется сложный эфир – метиловый эфир 2-аминоуксусной кислоты.
В реакции аминокислот с аммиаком образуются амиды.
Nh3 – CH(R) – COOH + H – Nh3 → Nh3 – CH(R) – CONh3 + h3O
Рассмотрим химические свойства аминокислот по аминогруппе.
Аминокислоты реагируют с минеральными кислотами. Так, в реакции глицина с соляной кислотой образуется соль аминоуксусной кислоты.
h3N – Ch3 – COOH + HCl → [h4N+ – Ch3 – COOH]Cl-
Аминокислоты реагируют с азотистой кислотой подобно аминам, при этом образуется гидроксокислота.
Nh3 – CH(R) – COOH + HNO2 → HO – CH(R) – COOH + N2↑ + h3O
Для аминокислот характерны реакции поликонденсации с образованием полипептидов – белков. Так, при взаимодействии двух α-аминокислот образуется дипептид. Например, в реакции глицина и аланина образуется глицил-аланин, который является дипептидом. В результате взаимодействия образуется пептидная группа или амидная группа.
Для аминокислот характерны реакции разложения. Так, при разложении глицина образуются метиламин и углекислый газ.
Nh3 – Ch3 – COOH → Nh3 – Ch4 + CO2↑
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам – продукт для получения капрона.
С ионами тяжёлых металлов α-аминокислоты образуют комплексные соли. Например, соли меди двухвалентной имеют голубую окраску и используются для обнаружения α-аминокислот.
Большинство аминокислот являются биологически активными веществами. Так, трипептид глутатион является гормоном, который отвечает за детоксикацию чужеродных соединений в организме человека, а гормон окситоцин – нонапептид, вызывает сокращение мышц.
Таким образом, аминокислоты – это органические соединения, которые содержат карбоксильную группу с кислотными свойствами и аминогруппу с основными свойствами. Аминокислоты взаимодействуют как с кислотами, так и с основаниями, являясь амфотерными веществами. Аминокислоты реагируют друг с другом, образуя пептиды с различным числом остатков аминокислот. Аминокислоты и их производные имеют важное биологическое значение для жизнедеятельности человека.
videouroki.net
Способ получения хлоргидрата метилового эфира глицина
Изобретение касается эфиров аминокислот , в частности получения хлоргидрата метилового эфира глицина - полупродукта для синтеза инсектицидов. Цель - удешевление процесса и целевого продукта. Синтез ведут этерификацией глицина метанолом при кипячении в присутствии катализатора - продукта реакции эквимолярных количеств хлористого сульфурила и РС1з при кипячении. В этом случае достигаются выход целевого продукта до 99% и его удешевление за счет использования более доступного катализатора. fe
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (si)s С 07 С 229/08
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
»» $ОL,Ц, ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ. СВИДЕТЕЛЬСТВУ (21) 4729899/04 (22) 14.08,89 (46) 23.05.92. Бюл. ¹ 19 (71) Рубежанский филиал Научно-исследовательского института органических полупродуктов и красителей (72) Г.Н.Ворожцов, Ф.Х.Бикулов, Л.В,Галич, В.И,Коваленко, Э.И.Мостославская, Т.fl.Островка, P.Ï,Ñàâÿê, В.И,Тихонов,,Г.А.Югай и Е.А.Шапиро (53) 547.466,07 (088.8) (56) Annalen, Bol. 640, с, 138.
Теренин А .Н. Фотоника молекул красителей и родственных органических соединений, Л,: Наука, 1967, с. 275-278.
Патент НРБ ¹ 36837, кл, С 07 С 101/18, опублик. 1985.
Изобретение относится к получению хлоргидратов аминокислот, конкретно к способу получения хлоргидрата метилового эфира глицина — полупродукта для получения инсектицидного препарата перметрина, предназначенного для борьбы с вредителями сельскохозяйственных культур, эктопаразитами скота, бытовыми насекомыми, а также насекомыми переносчиками инфекционных заболева ний.
Известен способ получения хлоргидрата метилового эфира глицина по реакции
Фишера, состоящий в том, что суспензию глицина в избытке метанола кипятят с обратным холодильником в присутствии сухого хлористого водорода. Процесс состоит из двух реакций; быстрого и необратимого присоединения хлористого водорода к глицину с образованием хлоргидрата глицина Ы«, 1735275 А1 (54) СПОСОБ ПОЛУ4ЕНИЯ ХЛОРГИДРАТА
МЕТИЛОВОГО ЭФИРА ГЛИЦИНА (57) Изобретение касается эфиров аминокислот, в частности получения хлоргидрата метилового эфира глицина — полупродукта для синтеза инсектицидов. Цель — удешевление процесса и целевого продукта, Синтез ведут этерификацией глицина метанолом при кипячении в присутствии катализатора — продукта реакции эквимолярных количеств хлористого сульфурила и РС!з при кипячении. В этом случае достигаются выход целевого продукта до 99 и его удешевление за счет использования более доступного катализатора. и медленной и обратимой этерификации образовавшегося хлоргидрата глицина метиловым спиртом с выделением воды.
Продолжительность процесса до 40 ч. Выход продукта составляет 88-92;ь.
Известен способ, согласно которому взаимодействие глицина с метанолом в присутствии хлористого водорода проводят беэ внешнего нагрева. Выход хлоргидрата метилового эфира составляет 84ф„а с учетом использования маточника бт предыдущего синтеза общий выход по 10 опытам составляет 98,5 (.
Недостатками этих способов являются использование значительных количеств сухого хлористого водорода, что приводит к образованию больших количеств отходящих газов, содержащих метанол и соляную кислоту, а также большая. продолжительность процесса.
1735275
Использование в качестве катализатора этерификации хлористого тионила позволяет избежать этих недостатков. Известный метод основан на взаимодействии аминокислоты и метанола в присутствии хлористого тионила и диметилформамида.
К суспензии глицина в метаноле, содержащей диметилформамид, при 30 С придают хлористый тионил при интенсивном перемешивании. Смесь кипятят до полного растворения глицина, Выпавший после охлаждения осадок отделяют фильтрацией.
Выход продукта составляет 83,37,, общий выход продукта с использованием маточника после 10 опытов составляет 99,1 .
Недостатком этого метода является использование дорогостоящего и дефицитного хлористого тионила.
Цель изобретения — замена хлористого тионила на более доступное и дешевое сырье.
Поставленная цель достигается использованием в качестве катализатора продукта взаимодействия эквимолярных количеств хлористого сульфурила и треххлористого фосфора. Отклонение от эквимолярного соотношения хлористого сульфурила и треххлористого фосфора ведет к снижению выхода и ухудшению качества хлоргидрата метилового эфира глицина.
Наилучший результат достигается при использовании не менее 2 мас,ч, катализатора. на 1 мас.ч. глицина. Использование меньшего количества снижает выход и ухудшает качество продукта, использование большего количества ведет к перерасходу сырья и удорожанию продукта, Сущность предлагаемого метода заключается в следующем: хлористый сульфурил нагревают до 55-60 С и при интенсивном перемешивании придают треххлористый фосфор с такой скоростью, чтобы температура реакционной массы не опускалась ниже 55 С, По окончанию придачи массу кипятят 1 ч и охлаждают.
Полученную смесь придают к суспензии глицина в метаноле при 20-55 С в течение
20-40 мин, кипятят 5-60 мин (лучше 2030 мин), охлаждают до 0-5 С, фильтруют, сушат. В маточник добавляют метанол и проводят следующую операцию этерификации. Выход хлоргидрата метилового эфира глицина составляет 95-99, Т.пл. 1741760С, Пример 1. Получение катализатора этерификации.
55 треххлористого фосфора с такой скоростью, чтобы температура реакционной массы не опускалась ниже 55 С. Реакция идет с выделением тепла. По окончании придачи треххлористого фосфора массу нагревают до кипения, выдерживают 1 ч и охлаждают.
Полученную бесцветную жидкость используют в качестве катализатора при получении хлоргидрата метилового эфира глицина. В
ИК-спектре смеси появляется полоса поглощения при 1350 см, отсутствующая в ИК-1 спектрах исходных веществ.
Пример 2. Получение хлоргидрата метилового эфира глицина.
К суспензии 30 г (0,4 моль) глицина в
200 мл метанола при интенсивном перемешивании придают 62 r смеси, полученной в примере 1, при температуре 20-550С. По окончанию придачи реакционную массу кипятят 30 мин с обратным холодильником.
Охлаждают до 0-5 С, фильтруют, осадок промывают 50 мл метанола. Получают 47,7 г хлоргидрата метилового эфира глицина. Выход составляет 95, т. пл. 174-176 С. С учетом повторного использования маточника общий выход по 10 опытам составляет
99,5ф», Пример 3. Получение хлоргидрата метилового эфира глицина.
Аналогичен примеру 2, но катализатор этерификации придают в количестве 55,8 r.
Получают 41,5 г (81,6 ) продукта с т.пл. 170 172 С.
Пример 4. Получение хлоргидрата метилового эфира глицина.
Аналогичен примеру 2, но катализатор этерификации придают в количестве 74,4 г.
Получают 47,7 г (95ь) продукта с т,пл. 1721740 С.
Пример 5. Получение катализатора этерификации при избытке треххлористого фосфора.
Процесс ведут аналогично примеру 1, но для приготовления катализатора загружают 77,6 см (0,93 моль) хлористого сульфурила и 105,3 см (1,146 моль) треххлористого фосфора. Получают жидкость желтого цвета, которую используют s качестве катализатора.
Пример 6. Получение хлоргидрата метилового эфира глицина.
Процесс ведут аналогично примеру 2, но используют катализатор, полученный в примере 5.
Получают 38,2 r (76,7 ) продукта с т.пл, 169-112 С.
Пример 7. Получение хлоргидрата метилового эфира глицина.
Процесс ведут аналогично примеру 4, но используют катализатор, полученный в примере 5.
1735275
Формула изобретения
Способ получения хлоргидрата метилового эфира глицина этерификацией глицина метанолом при кипячении в присутствии катализатора, отличающийся тем, что, с целью удешевления процесса и целевого продукта, в качестве катализатора используют продукт, полученный при кипячении эквимолярных количеств хлористого сульфурила и треххлористого фосфора.
Составитель Г. Югай
Редактор А. Козориз Техред M.Ìoðråíòàë Корректор М. Максимишинец
Заказ 1788 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР.
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", r. Ужгород, ул,Гагарина, 101
Получают 38,1 г (78,5 ) продукта с т,пл.
168-170 С.
Пример 8. Получение катализатора этерификации с избытком хлористого сульфурила. 5
Процесс ведут аналогично примеру 1, но для приготовления катализатора загружают 85,5 мл (0,93 моль) треххлористого фосфора и 95,6 мл (1,146 моль) хлористого сульфурила, Получают жидкость желтого 10 цвета, которую используют в качестве катализатора.
Пример 9. Получение хлоргидрата метилового глицина.
Процесс ведут аналогично примеру 2, 15 но используют катализатор, полученный в примере 8.
Получают 26 г (52) ) продукта с т,пл.
165-167 С.
Пример 10. Получение хлоргидрата 20 метилового эфира глицина, Процесс ведут аналогично примеру 4, но используют катализатор. полученный в примере 8.
Получают 26,8 r (53,5 ) продукта с т.пл. 25
166-168 С.
Пример 11. Получение хлоргидрата метилового эфира глицина с применением хлористого сульфурила в качестве катализатора. 30
Процесс ведут аналогично примеру 2, но в качестве катализатора используют
36,7 смз (0,439 моль) хлористого сульфурила.
Получают 12,5 г (24,9 ) продукта с т.пл.
165-167 С. . Пример 12, Получение хлоргидрата метилового эфира глицина с применением треххлористого фосфора в качестве катализатора.
Процесс ведут аналогично примеру 2, только в качестве катализатора используют
40,3 см (0,439 моль) треххлористого фосфора.
Получают 37,8 г (75,3 ) продукта с т.пл, 169-170 С.
Предлагаемый способ позволяет расширить сырьевую базу за счет использования более доступного и дешевого катализатора зтерификации..
www.findpatent.ru
ТФА-аминокислот эфиры метиловые - Справочник химика 21
Без катализаторов гидролиз многих эфиров протекает очень медленно, иногда в течение нескольких лет, хотя некоторые сложные эфиры, например метиловый и этиловый эфиры муравьиной кислоты, метиловый и этиловый эфиры щавелевой кислоты, эфиры а-окси- и низших а-аминокислот и др., гидролизуются очень быстро. Скорость реакции значительно увеличивается добавками [c.529]
Высокоэффективное разделение веществ достигается при использовании газовой подвижной фазы. ГЖХ — универсальный метод разделения смесей разнообразных веществ, испаряющихся без разложения. Для увеличения летучести многие природные Соединения превращают в производные а-аминокислоты в метиловые или этиловые эфиры (см. 11.1.4), моносахариды в их триметилсилиловые эфиры (см. 12.1.5) и др. [c.498]
Превращение аминокислот в метиловые эфиры не сколько удобнее. Реакцию проводят следующим образом. Смесь смешивают с метанолом, насыщенным хлористым водородом, и несколько часов нагревают с обратным холодильником. После разложения 2 н. раствором едкого натра сложные эфиры экстрагируют диэтиловым эфи ром. Раствор сложных эфиров в диэтиловом эфире можно хроматографировать. Для разделения сложных эфиров [c.150]
Образование эфиров. Метиловые и этиловые эфир]. аминокислот получают обработкой суспензии аминокислоты в абсолютном метиловом или этиловом спирте током сухого хлористого водорода [c.37]
Защита карбоксильной группы. Для защиты карбоксильной группы аминокислоты или пептида чаще всего используют сложные эфиры — метиловый, этиловый, бензиловый /г-нитробензиловый или амиды [c.99]
Одной из основных причин применения дериватизации в ГХ является перевод нелетучих соединений в более летучие. Особое место здесь занимают методы получения летучих производных аминокислот, которые в натуральном виде не только нелетучи, но и термически нестойки и поэтому их прямой анализ методом ГХ невозможен. В то же время актуальность задач качественного и количественного определения аминоки слот в биологии, биохимии, медицине и микробиологии стимулирует развитие методов получения и анализа летучих производных аминокислот. Использование метиловых эфиров N-тpифтopaцeтил-пpoизвoдныx [c.193]
В принципе вытеснительная хроматография приводит к физическому разделению исходной смеси на компоненты. Однако на практике при проведении разделения возникают трудности, обусловленные близостью зон и недостаточной резкостью их границ (см. рис. 66, о). Чтобы обеспечить количественное разделение, Тизелиус и Хагдал предложили способ вытесняющего носителя. Для достижения количественного разделения в систему вносят вещество (носитель), сорбируемость которого занимает промежуточное положение по отнощению к сорбируемости двух разделяемых компонентов. Носитель должен легко отделяться от компонентов анализируемой смеси. В качестве примера можно упомянуть алифатические спирты, используемые в качестве носителя при разделении аминокислот и метиловые эфиры, применяемые при разделении смеси жирных кислот [c.559]
Известно, что реакция трифторацетилирования протекает для аминокислот всех классов в мягких условиях с выходами, близкими к количественному [46]. Таким образом, если для превращения К-ацильных производных аминокислот в соответствующие летиловые эфиры применить мягкие метилирующие агенты, то, очевидно, весь процесс конверсии аминокислот в метиловые эфиры К-ТФА-производных будет происходить чрезвычайно гладко и легко воспроизводиться. Проведенные недавно исследования количественного получения эфиров жирных кислот с помощью различных метилирующих агентов [47] показали, что оптимальные результаты достигаются при применении диазометана. [c.265]
Нефкенс [1598, 1600а] использовал для защиты карбоксильной функции аминокислот модифицированный метиловый эфир, а именно фталимидометиловый эфир, который можно синтезировать взаимодействием N-хлорметилфталимида с соответствующей карбобензоксиаминокислотой с последующим каталитиче- [c.93]
Ацилирование химотрипсина метиловыми эфирами а - -ацилзаме-щенных-/,-аминокислот. Характеристикой собственной (внутренней) реакционной способности составного нуклеофила активного центра будем считать константу скорости для некоторой модельной реакции, в которой боковые группы субстрата не принимают участия в сорбции на белке. Для того чтобы найти эту величину, проанализируем, как влияет изменение структуры отдельных субстратных фрагментов на общую скорость образорания ацилфермента [c.158]
Рассматриваются различные методы анализа аминокислот. Разделялись метиловые эфиры и N-трифторацетилпроизводные аминокислот, НФ силиконовая высоковакуумная смазка с 10% капроната лит11Я, Изучено влияние добавок канронатов различных металлов на удерживаемые объемы, [c.133]
Анализ аминокислот крови при помощи газовой хроматографии. II. Применение в опытах с нагрузкой аминокислотами. (Анализ метиловых эфиров ДНФ-аминокислот НФ QF-1 на газхроме Р опыты с L-фенилалани-ном.) [c.188]
Этот синтез представляет собой первую часть реакции Соммлв (гл. 10 Альдегиды , разд. А.9). Если гидролиз комплекса, образуемого галогенпроизводным и гексаметилентетрамином, проводить в смеси этилового спирта и концентрированной соляной кислоты [73], реакция останавливается на стадии образования первичного амина. Этот метод. синтеза, таким образом, можно применять для получения первичных аминов вместо реакции Габриеля (разд. Б.2). Его с успехом применяют к первичным галогенпроизводным, и, поскольку иодиды реагируют лучше, чем хлориды или бромиды, при реакциях с последними добавляют иодистый натрий [74]. Этот метод с успехом использовался для получения простых алифатиче-ческих аминов [74], некоторых бензиламинов [75], а-аминокетонов [76], аминоалкинов [77], метиловых эфиров п-аминобензойной кислоты [78], а-аминоэфиров [791 и -аминокислот [80]. Выходы составляли 40—85%. [c.514]
Простейший дикетопиперазин — глицинангидрид был получен с 62/о-ным выходом простым нагреванием глицина в этиленгликоле при 174—176" С. Однако в большинстве случаев выходы 2,5-дикетошшерази-нов из свободных аминокислот неудовлетворительные, поэтому в основном исходят из их эфиров. Метиловый и этиловый эфиры глицина, например, спонтанно переходят в дикетопиперазин в водном растворе при 15—20° С. [c.45]
Один из основных методов получения К-карбоксиангидридов — это карбалкоксилъный метод метод Лейкса) Аминокислоту ацилируют метиловым эфиром хлоругольной кислоты в щелочной среде, затем обрабатывают тионилхлоридом и полученный хлорангидрид К-карбметокси-аминокислоты нагревают в вакууме при 60—70° С [c.115]
Превращение аминокислот в метиловые эфиры н сколько удобнее. Реакцию проводят следующим образо Смесь смешивают с метанолом, насыщенным хлористы водородом, и несколько часов нагревают с обратным х лодильником. После разложения 2 и. раствором едко1 натра сложные эфиры экстрагируют диэтиловым эф. ром. Раствор сложных эфиров в диэтиловом эфире можь хроматографировать. Для разделения сложных эфире [c.150]
К настоящему времени подобраны стационарные фазы, позволяющие разделять методом ГЖХ ГАС практически любого класса и решать самые сложные стрз ктурные проблемы, вплоть до установления оптической конфигурации молекул (например, аминокислот [164], изоирепоидных жирных кислот и их эфиров [269]. Получены необходимые для идентификации экспериментальные данные по параметрам удерживания характерных для нефтей летучих ГАС, в том числе тиолов [270], диалкилсульфидов [271], тиацикланов [272], аминов [273, 274], производных пиридина и хинолина [274—276], свободных жирных [277] и ароматических [278] кислот и их метиловых эфиров, фенолов [279, 280], кето-нов [281], спиртов [282] и т. д. Выведены корреляции между хроматографическим поведением и строением ГАС отдельных типов. Надежность идентификации чисто газохроматографическими средствами можно значительно повысить путем изучения так называемых спектров хроматографического удерживания [283]. На основе характеристик удерживания идентифицирован, например [c.34]
В общем случае это достигается этерификацией карбоксильной группы, подлежащей защите. Для получения метилового или этилового эфира обрабатывают аминокислоту метанолом или этанолом, насыщенным НС1 (этерификация по Фищеру). Однако обычно предпочитают эфиры, гидролиз которых легко провести в мягких условиях. Хотя эфиры омыляются основаниями гораздо легче, чем пептиды (поскольку алкоксиды — лучщие уходящие группы), используемые для этого щелочные условия нельзя применять для деблокирования полипептидов. Использование бензи-ловых эфиров позволяет удалять защитные группы при нейтральных условиях с помощью каталитического гидрирования. Бензи-ловые эфиры синтезируют из кислоты и бензилового спирта в присутствии кислоты или тиоиилхлорида (который переводит спирт в сульфохлорид, и уже последний замещается кислотой), [c.77]
Это позволило определить строение аминокислоты, из которой получен данный метилтиогидантоин. Новые сведения о порядке чередования аминокислотных остатков в коротких пептидах были получены па основанни исследоваиия масс-спектров этиловых эфиров ацетилпептидов, аминоспиртов и диаминоспиртов [208, 209]. В работе Н. К. Кочеткова и сотрудников масс-спектрометрический метод использовался для определения размера цикла в метиловых эфирах моносахаридов [210], установления конфигураций гликозидной связи в метилглюкозидах [211] и выяснения места свободного гидроксила в частично метилированных моносахаридах [212, 213]. [c.124]
Другой фермент — трипсин — эффективно катализирует гидролиз метиловых эфиров К-ацетилзамещенных -аминокислот типа НСН(МНС0СНз)С(0)0СНз также за счет сорбции гидрофобной субстратной группы Н на активном центре. Сравним кинетические харак- [c.44]
При изучении термодинамики гидролиза ацил-химотрип-синов, образующихся при реакции метиловых эфиров Н-ацетил-Ь-аминокислот с а-химотрипсином [9], были получены активационные параметры, приведенные в табл. 10. Найти изокинетическую температуру для реакции деацилирования фермента. [c.255]
С помощью линейных зависимостей типа Igk /Ks — n R можно описать реакционную способность метиловых эфиров также и других N-ацилзамещенных a-L-аминокислот (Val, Туг, Phe и др.), причем наклон сохраняет постоянное значение, равное примерно 0,6 [62]. Это означает, что гидрофобное взаимодействие с ферментом субстратного фрагмента R вносит аддитивный вклад в ускорение реакции, поскольку величина вклада не зависит от природы специфической боковой группы R в молекуле аминокислоты. [c.159]
Этерификация под действием СНзОН — НС1 Метиловые эфиры аминокислот Вайер, Рейтер и Борн (1957) Байер (1958) [c.270]
В итоге взаимосвязь структуры и реакционной способности метиловых эфиров N-ацилзамещенных a-L-аминокислот можно описать следующим общим уравнением [c.161]
Прямое кинетическое подтверждение образования промежуточных соединений и Х2 в катализе гидролиза эфиров N-aцилиpoвaнныx-L-аминокислот получено из анализа кинетики реакции на длинах волн поглощения промежуточных соединений ( 290 нм) [9]. Так, при смешивании раствора а-химртрипсина с метиловым эфиром Ы-ацетил-1-фенилаланина наблюдается быстрое (кинетически неразрешенное) спектральное изменение (по-видимому, образование первичного фермент-субстратного комплекса Х ), за которым следует медленная кинетика образования ацилфермента (рис. 64,а). В стационарной фазе реакции в условиях,, когда расходом субстрата можно пренебречь, концентрация ацилфермента сохраняется постоянной последующий расход субстрата приводит к- исчезновению в растворе промежуточных соединений (рис. 64,6) [9]. [c.198]
Полиаминокислоты. — Данный раздел посвящен главным образом синтетическим полипептидам, полученным полимеризацией производных отдельных аминокислот (гомополимеры) или в некоторых случаях двух или более компонентов. Эфиры глицина и аланина были полимеризованы, но в настоящее время предпочитают использовать в качестве мономеров N-кapбoк иaнгидpиды, известные также КЗ К ангидриды Лейяса IV. Лейхс (1906) лолучил соединения этого типа взаимодействием аминокислоты I с метиловым эфиром хлоругольной кислоты. При этом образуется Ы-карбметоксиаминокислота П, из которой после превращения в хлорангидрид III при перегонке в вакууме образуется Ы-карбоксиангидрид IV и элиминируется молекула хлористого метила [c.711]
Этот обмен происходит, и часто с хорошими выходами, в случае М-ациламинокислот и при получении виниловых эфиров различных алифатических и ароматических карбоновых кислот. N-Ациламино-кислоты, например фталоилглицин или тозилглицин, превращаются в метиловые или этиловые эфиры под действием алкилформиата или алкилацетата [126]. Обычно в качестве катализаторов используют 96%-ную серную кислоту или моногидрат я-толуолсульфокислоты. Неацилированные аминокислоты, за исключением фенилаланина, [c.298]
Ряд олигомеров а-аминокислот играет значительную роль в жизнедеятельности организма и некоторые из них применяют в медицинской практике. Так, метиловый эфир дипептида L-аспарагил-Ь-фенилаланина (аспартат, аспартам) используют при диабете как малокалорийный заменитель сахара (в 150 раз слаще глюкозы). Его производят синтетическим или микробиологическим путем конденсацией аспарагина и метилата фенилаланина [c.38]
chem21.info
Аминокислоты. Строение, получение, химические свойства
Сегодня урок по химии 48 — Аминокислоты. Строение, получение, химические свойства. Как изучить? Полезные советы и рекомендации — повторить уроки по химии 40 — карбоновые кислоты и 47 амины.
Аминокислоты – это производные углеводородов, содержащие аминогруппы (- Nh3) и карбоксильные группы (-СООН ). Общая формула:
( Nh3 )mR ( COOH )n, где m и n чаще всего равны 1 и 2.
В зависимости от взаимного положения групп различают α-, β- и γ-аминокислоты. Одновременное присутствие в молекуле аминокислоты кислотной и основной групп приводит к внутримолекулярной нейтрализации. Учитывая это, свободные аминокислоты правильнее представлять в виде внутренних солей типа:
h4N+ — Ch3 – СОО—
Это сказывается и на физических свойствах аминокислот: подобно обычным неорганическим солям, аминокислоты представляют собой кристаллические вещества, растворимые в воде и мало растворимые в органических растворителях. Они плавятся при высоких температурах и обычно при этом разлагаются. Переходить в парообразное состояние они не способны.
Значение α-аминокислот велико, так как они входят в состав белков, которые являются основой всех живых организмов.
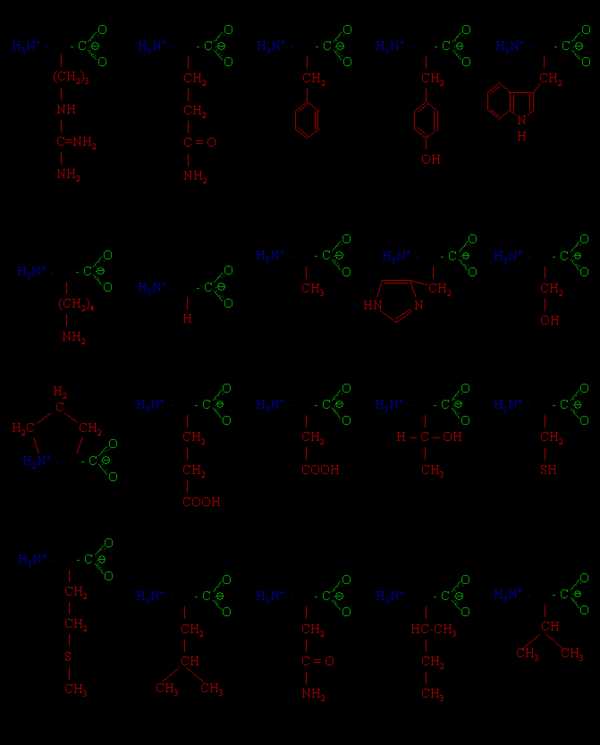
Приведем формулы и названия некоторых аминокислот, входящих в состав белков.
h3N – Ch3 – COOH – аминоэтановая кислота, аминоуксусная кислота, глицин.
Ch4 – CH(Nh3) – COOH – 2-аминопропановая кислота, α-аминопропионовая кислота, аланин
СН2(OH) – СН(Nh3) – СООН – 2-амино-3-гидроксипропановая кислота, α-амино-
β-гидроксипропионовая кислота, серин
СН2(SH) – СН(Nh3) – СООН – 2-амино-3-меркаптопропановая, α –амино-β-
меркаптопропионовая кислота, цистеин
СН3 – СН(Ch4) – СН(Nh3) – СООН – 2-амино-3-метилбутановая, α-амино-
β-изовалериановая кислота, валин
C6H5 – Ch3— CH(Nh3) – COOH – 2-аминo-3-фенилпропановая, α-амино-β-
фенилпропионовая кислота, фенилаланин
НО – С6Н4 – СН2 – СН(Nh3) – СООН – 2-амино-3-(п-гидроксифенил)-пропановая кислота, тирозин НООС – СН2 – СН(Nh3) – СООН – 2-аминобутандиовая , α-аминоянтарная, аспарагиновая кислота
HOOC – (Ch3)2 – CH(Nh3) – COOH – 2-аминопентандиовая, α-минопентандиовая,
СН2(Nh3) – (СН2)3 – СН(Nh3) –СООН – 2,6-диаминогексановая , α,ε – диамино-капроновая кислота, лизин
Способы получения аминокислот.
Гидролиз белковых веществ.
- Действием на галогенокислоты аммиака.
R–CH(Br)–COOH + 2Nh4→ R – CH(Nh4+Br—)–COONh5 → R–CH(Nh3 – COONh5
-HBr
Химические свойства аминокислот
Химические свойства аминокислот определяются содержащимися в них функциональными группами различной природы. Своеобразие аминокислот определяется, прежде всего, тем, что в них имеются две функции противоположного химического характера – аминогруппа со свойствами основания и карбоксильная группа со свойствами кислоты. Вследствие этого, аминокислоты являются амфотерными веществами.
- Взаимодействие с основаниями:
h3N – Ch3 – COOH + NaOH → h3N – Ch3 — COONa + h3O
- Взаимодействие с кислотами:
h3N – Ch3 – COOH + HCI → [h4N+ — Ch3 – COOH]CI—
- Образование внутренних солей – биполярных ионов:
h3N – Ch3 – COOH ⇄ h4N+ — Ch3 – COO—
- Взаимодействие с формальдегидом с образованием метиленаминокислот:
Ch4 – CH(Nh3) – COOH + CН2О → Ch4 – CH(N=Ch3) – COOH + h3O
5. Реакция со спиртами:
СН3 – СН(Nh3) – СООН + С2Н5ОН ↔ СН3 – СН(Nh3) – СООС2Н5 + Н2O
6. Взаимодействие с азотистой кислотой:
СН3 – СН(Nh3) – СООН + HONO → Ch4 – Ch3OH + N2↑ + h3O + CO2↑
7. Гомополиконденсация. Так из ε-аминокапроновой кислоты получают полимер – капрон:
nh3N – (Ch3)5 – COOH → [-HN – (Ch3)5 – CO- ]n + (n – 1)Н2О
8. Сополиконденсация различных аминокислот с образованием полипептидов:
R – CH(Nh3) – COOH + h3N – CH(R1) – COOH → R – CH (Nh3) – C(O) – N(H) –CH(R1) –COOH
-h3O
Образующееся вещество содержит пептидные (амидные) связи: — N(Н) – C(О) —
Это был урок по химии 48 — Аминокислоты. Строение, получение, химические свойства.
Расскажите об этой статье друзьям:
Friend me:
к нашему сайту.
sovety-tut.ru
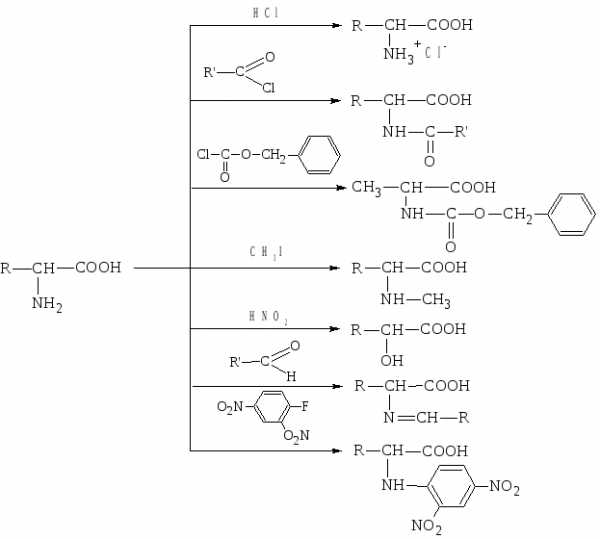
2. Алкилирование аминокислот.
Аминокислоты можно алкилировать по аминогруппе галоидными алкилами (обычно иодистыми алкилами). Например, алкилированием глицина можно получить метиламиноуксусную кислоту саркозин, которая в связанном виде содержится в некоторых белках.
При избытке иодистого метила образуется четвертичная аммонийная соль:
3. Действие азотистой кислоты (дезаминирование in vitro).
Реакция протекает так же, как и при взаимодействии с азотистой кислотой алифатических первичных аминов выделяется азот, а аминогруппа замещается на гидроксильную группу:
Таким образом можно установить структурное родство аминокислот с соответствующими оксикислотами. По объёму выделившегося азота определяют количество α-аминокислоты, вступившей в реакцию (метод Ван-Слайка).
4. Взаимодействие с альдегидами.
α-Аминокислоты, подобно первичным аминам, реагируют с альдегидами, образуя замещенные имины (основания Шиффа). Реакция протекает через стадию образования карбиноламинов.
При взаимодействии α-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины N-метилольные производные, свободная карбоксильная группа которых может быть оттитрована щелочью.
Формальдегид, взятый в избытке, способствует отщеплению протона от Nh4+ группы биполярного иона и легко соединяется со свободной (непротонированной) аминогруппой, образуя устойчивое метилольное производное.
Титрование аминокислоты в избытке формальдегида (формольное титрование) представляет собой аналитический метод (метод Серенсена), при помощи которого прослеживается, в частности, образование свободных аминокислот в процессе гидролиза белков.
5. Взаимодейстивие с динитрофторбензолом (днфб).
Важной реакцией α-аминогруппы является её реакция с 2,4-динитрофторбензолом (ДНФБ) в слабощелочном растворе, которую впервые использовал Фредерик Сенгер для количественного введения метки в аминогруппы аминокислот и пептидов. Эта реакция протекает по механизму нуклеофильного замещения.
Продукт реакции окрашен в интенсивно желтый цвет. Эта реакция представляет исключительную ценность для идентификации N-концевых аминокислот полипептидных цепей.
Все вышеперечисленные реакции аминогруппы аминокислот можно представить следующей схемой:
Реакции функциональных групп, содержащихся в радикалах аминокислот
Аминокислоты вступают также в реакции, типичные для функциональных групп, присутствующих в их радикалах. Например для SH-групп цистеина, гидроксильной группы тирозина и треонина, гуанидиновой группы аргинина.
1. Реакции сульфгидрильной (тиоловой) группы.
Для сульфгидрильной группы характерна исключительно высокая реакционная способность. Например, при действии на цистеин незначительных концентраций ионов некоторых тяжелых металлов образуются меркаптиды.
В щелочных растворах цистеин легко теряет атом серы. Так, при нагревании цистеина с ацетатом свинца в щелочном растворе образуется черный осадок сульфида свинца. Эта реакция применяется для обнаружения сульфгидрильной группы в пептидах и белках.
Тиоловая группа цистеина легко подвергается окислению с образованием дисульфида. Этот процесс можно отразить следующей схемой:
Дисульфидные связи, присоединяя два атома водорода, переходят в сульфгидрильные (тиоловые) группы:
Рассмотрим этот процесс на примере превращения цистеина в цистин:
В цистине при действии восстановителей дисульфидная связь разрывается и образуется две молекулы цистеина:
Дисульфидная связь может также подвергаться окислению под действием таких жестких окислителей, как например над-
муравьиная кислота ( ). В результате образуется цистеиновая кислота:
studfiles.net
Аминоуксусная кислота- ее неизмеримая важность для организма.
Единственная в своем роде аминокислота, которая не имеет оптических изомеров - это аминоуксусная кислота (или аминоэтановая), в народе также известная, как глицин. В некоторых источниках ее можно встретить под названием параоксифениламиноуксусная кислота - всем известное вещество, служащее для проявки фотографий. Она относится к группе простейших алифатических аминокислот, имеет следующую химическую формулу: Nh3-Ch3-COOH.
Влияние данной кислоты на организм.
Не секрет, что аминоуксусная кислота содержится во многих белках и биологически активных соединениях. Благодаря ей происходит процесс синтеза профиринов и пуриновых соединений. Кроме того, рассматриваемое вещество- это нейромедиаторная аминокислота. Рецепторы к глицину, расположенные в районах головного и спинного мозга, тормозят воздействие на нейроны, повышают выделение ГАМК, а также уменьшают так называемые выделения из нейронов, которые способствуют возбуждению аминокислот, к числу которых можно отнести глутаминовую кислоту.
Химические свойства
Важно знать, что у такого вещества, как аминоуксусная кислота, химические свойства следующие: глинергическое, ГАМК-ергическое действие, кроме того, выражены антиоксидантные и антитоксические свойства. А главное, глицин способен регулировать глутаматные рецепторы. Применяют данную кислоту для уменьшения вегето-сосудистых и общемозговых расстройств, она заметно уменьшает токсическое действие алкоголя. Наблюдается заметное снижение психоэмоционального напряжения и агрессивности, что в свою очередь приводит к повышению социальной адаптации. Кроме этого, улучшается настроение и нормализуется сон, повышается умственная работоспособность.
Фармакологический анализ
Что касается фармакологического действия, то аминоуксусная кислота способна с легкостью проникать в большое количество жидкостей и тканей, например, в головной мозг. Данное вещество метаболизируется до соединения воды и углекислого газа, которое не накапливается в тканях.
При каких сигналах организма следует употреблять данное вещество?
При часто наблюдающихся стрессовых ситуациях, сниженной работоспособности, при девиантных формах поведения, различных заболеваниях нервной системы рекомендуется применять данное лекарственное средство. Глицин борется с неврозами и вегето-сосудистой дистонией, а также полезен после черепно-мозговых травм и ишемического инсульта.
Применение спортсменами глицина
В спортивный рацион аминоэтановая кислота включается в виде пищевой добавки Е640.
Список полезных свойств, которыми обладает, аминоуксусная кислота – полипептид, неиссякаем. Так, она замедляет процесс дегенерации мышечной ткани, в связи с тем, что эта кислота является источником креатина. Без нее не обойтись при синтезе нуклеиновых и желчных кислот.
Данное вещество вошло в состав целого ряда антацидных препаратов, которые применяются при желудочно-кишечных заболеваниях. Ко всему прочему, эта кислота применяется тогда, когда необходимо восстановить поврежденные ткани.
Нельзя не сказать о важности глицина для центральной нервной системы и предстательной железы. Благодаря тому, что он является тормозным нейромедиатором, предотвращаются эпилептические судороги.
Аминоуксусная кислота нашла также свое применение в лечении маниакально-депрессивного психоза. Справляется она довольно эффективно и с таким недугом, как гиперактивность.
Известен тот факт, что при избытке данного вещества человек часто испытывает чувство усталости, однако его применение в разумных количествах способно решить эту проблему, подарив организму огромный запас энергии. Следует помнить, что во всем нужно знать меру.
fb.ru