Гомологический ряд. Гомологический ряд простых эфиров
Гомологический ряд
Ch5 - метан C2H6 - этан C3H8 - пропан C4h20 - бутан C5h22 - пентан C6h24 - гексан C7h26 - гептан C8h28 - октан C9h30 - нонан C10h32 - декан ...
Гомологический ряд характеризуется общей формулой, по которой можно определить формулу любого вещества данного ряда. Для предельных углеводородов - эта формула
Cnh3n+2
C увеличением молекулярной массы вещества (увеличивается количество атомов углерода и водорода в молекуле) происходит увеличение температуры кипения этого вещества. Поэтому следует отметить, что вещества с Ch5 по C4h20 - газы, с C5h22 по C15h42 - жидкости, далее - это твёрдые вещества!
7.5 Какие органические соединения называются изомерами, какие разновидности структурной и пространственной изомерии существуют.
Изомерия — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Структурная изомерия — результат различий в химическом строени.
Изомерия углеродной цепи (углеродного скелета)[
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутан иметилциклопропан (III и IV).
Валентная изомерия
Валентная — особый вид структурной изомерии, при которой изомеры можно перевести друг в друга лишь за счёт перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы (межклассовая изомерия)[
Различается характером функциональной группы; например, этанол (Ch4—Ch3—OH) и диметиловый эфир (Ch4—O—Ch4).
Изомерия положения[
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Метамерия
Метамерия — вид структурной изомерии, для которого характерно различное распределение углеродных атомов между несколькими углеводородными радикалами, разделенными в молекуле гетероатомом. Метамерия известна в рядах алифатических простых эфиров, сложных эфиров, тиоспиртов и аминов. В настоящее время термин используется редко.
На данный вид изомерии ещё указывал А. М. Бутлеров, называя его «изомерия нецельных структур».
Пример: Ch4Ch3OCh3Ch4 — диэтиловый эфир и Ch4OCh3Ch3Ch4 — метилпропиловый эфир
5. Пространственная изомерия
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4
Рис. 4. Положение атомов хлора вокруг одинарной связи
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах – по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя. Рис. 5.
Рис. 5. Цис- и транс- изомеры
studfiles.net
фенолы амины
Фенолы
Органические соединения, содержащие гидроксил, связанный непосредственно с атомом углерода ароматического ядра, называются фенолами.
Сам фенол (оксибензол) и его метильные гомологи (о-, м- и n-крезолы) в значительных количествах содержатся в каменноугольной смоле и добываются из нее:
1. Свойства фенолов
Для фенола характерны ярко выраженные кислотные свойства. Это объясняется тем, что свободная электронная пара атома кислорода в феноле оттянута к ядру (+М-эффект):
В отличие от алифатических спиртов фенол при действии щелочей дает соли — феноляты:
+М-Эффект гидроксильной группы приводит к значительному повышению электронной плотности в орто- и пара-положениях, что значительно облегчает реакции электрофильного замещения:
Фенолы легко окисляются с образованием сложных продуктов уплотнения молекул.
В целом гидроксильная группа фенолов значительно менее подвижна, чем гидроксил спиртов. Получение эфиров даже с хлорангидридами карбоновых кислот несколько затруднено, с кислотами реакция вообще не идет.
Введение электроноакцепторных заместителей в ядро сильно увеличивает кислотность гидроксила. Так, для тринитрофенола (пикриновая кислота) рК = 1,5, следовательно, он по силе приближается к соляной кислоте:
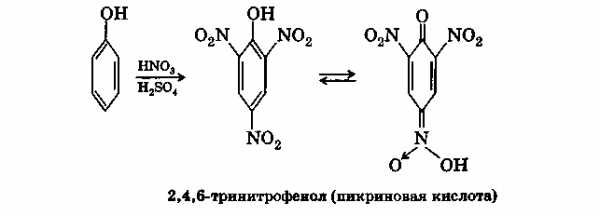
Пикриновая кислота дает хорошо кристаллизующиеся соли с большинством органических оснований и применяется для их идентификации. Как и все полинитросоединения, она сильно взрывчата, особенно ее соли с тяжелыми металлами.
Активность фенолов в реакциях электрофильного замещения настолько велика, что даже альдегиды в кислых растворах реагируют с фенолом. На этой реакции основано получение фенолоформальдегидных (бакелитовых) смол — дешевых и широко применяющихся полимеров:
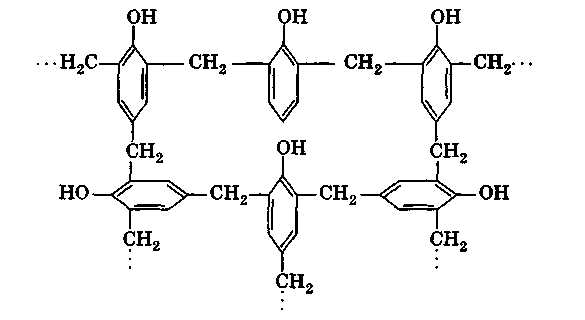
При дальнейшем действии формальдегида цепи растут, и в результате реакции поликонденсации образуется фенолоформальдегидная смола сетчатой структуры, фрагмент которой приведен ниже:
Сам фенол является важным техническим полупродуктом. Он используется в производстве пластических масс, пикриновой кислоты, салициловых препаратов, красителей, инсектицидов и др.
Все фенолы обладают сильным бактерицидным действием. Даже в очень слабых растворах. Поэтому фенол и крезолы применяются в медицине и ветеринарии в качестве дезинфицирующих средств. В чистом состоянии и в концентрированных растворах они вызывают труднозаживающие ожоги кожи. Очень часто применяется для дезинфекции лизол — мыльный раствор смеси о-, м- и n-крезолов, выделяемой из каменноугольной смолы и из продуктов сухой перегонки дерева и торфа.
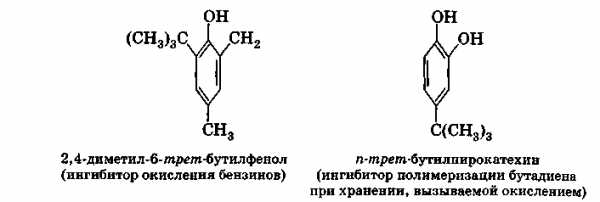
Прекрасным консервантом являются эфиры n-оксибензойной кислоты. По действию на стафилококки они в 100 раз сильнее фенола, но значительно менее токсичны для теплокровных. трет-Бутилгидрохинон широко применяется как антиоксидант низкокачественных жиров, идущих на корм бройлерам.
Двухатомные фенолы. Простейшие двухатомные фенолы называются диоксибензолами С6Н4(ОН)2:
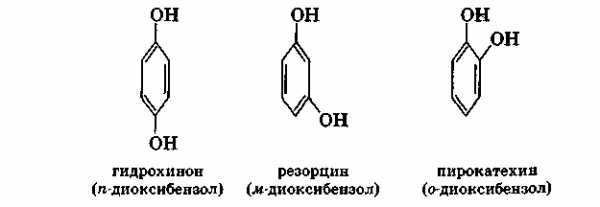
Двухатомные фенолы дают все характерные для фенолов реакции, причем в этих реакциях могут участвовать как одна, так и обе гидроксильные группы.
С увеличением числа гидроксильных групп молекула становится все менее устойчивой к действию окислителей.
Так, гидрохинон при действии окислителей легко превращается в бензохинон через промежуточную стадию образования хингидрона (молекулярного соединения, образованного молекулами хинона и гидрохинона):
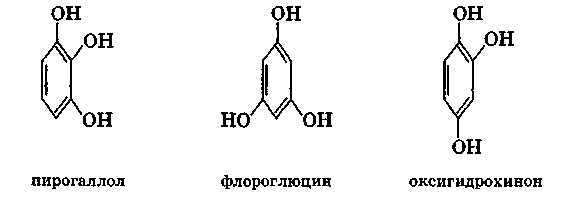
Трехатомные фенолы. Из трехатомных фенолов широко известны пирогаллол (1,2,3-триоксибензол) и флороглюцин (1,3,5-триоксибензол). Пирогаллол настолько легко окисляется, что его щелочные растворы применяются в газовом анализе для поглощения кислорода.
Фенолы нафталинового ряда. Они называются нафтолами:
Ядро n-нафтохинона является основой витаминов группы К.
Ароматические спирты. Если гидроксильная группаудалена от ароматического ядра, то соединение относят к подклассу ароматических спиртов.
Гидролизом хлористого бензила может быть получен бензил овый спирт:
Для него характерны как обычные реакции спиртового (но не фенольного) гидроксила, так и реакции ароматического ядра (группа СН2ОН является заместителем первого рода).
Является основным компонентом природного розового масла и широко используется в парфюмерии.
Простые эфиры
Эфиры представляют собой продукты замещения атома водорода гидроксильной группы спиртов или фенолов на какой-либо радикал:
В зависимости от характера радикала R´ различают три типа эфиров:
1) простые эфиры, R´ — углеводородный радикал;
2) сложные эфиры неорганических кислот, R´ — остаток неорганической кислородсодержащей кислоты: азотной (—NO2), азотистой (—N0), серной (—S03Н) и т. п.;
3) сложные эфиры карбоновых кислот, R´ — остаток карбоновой кислоты — ацил, например СН3СО—, С2Н5СО— и т. д/
1. Номенклатура и изомерия простых эфиров
Согласно номенклатуре ИЮПАК, простые эфиры называют двумя способами, прибавляя к названию старшего (наиболее длинного) углеводородного радикала в качестве префикса название алкоксигруппы (R—О—) или для эфиров фенолов — арилоксигруппы (Аг—О—), например:
Простые эфиры называют также, используя название радикалов и слово эфир:
Физические свойства простых эфиров
Температура кипения простых эфиров значительно ниже, чем соответствующих спиртов, несмотря на то, что эфиры содержат большее число атомов углерода. Это объясняется тем, что из-за отсутствия подвижного атома водорода они не образуют водородных связей. Низшие члены гомологического ряда хорошо растворимы в воде [диметиловый эфир и тетрагидрофуран смешиваются с ней, диэтиловый эфир умеренно растворим в воде (6%)].
Химические свойства простых эфиров
Реакционная способность эфиров невелика. Они не изменяются при нагревании с водой, щелочами и разбавленными кислотами. В отличие от спиртов, при взаимодействии с металлическим натрием в обычных условиях они не выделяют водород. Только концентрированная йодоводородная кислота разлагает эфиры:
При хранении, особенно на свету, простые эфиры медленно окисляются кислородом воздуха, образуя крайне взрывчатые гидроперекиси, что может послужить причиной серьезного несчастного случая при перегонке эфиров:
Своеобразно отношение простых эфиров к концентрированным протонным кислотам: эфиры растворяются в них с выделением теплоты. При этом образуются непрочные соединения солеобразного характера — оксониевые соединения.
Образование оксониевых соединений можно представить следующим образом. У эфирного атома кислорода имеется пара неподеленных электронов: протон кислоты образует связь с этой парой, в результате чего получается непрочный положительно заряженный ион оксония:
Оксониевая соль находится в равновесии с системой, состоящей из молекул эфира и кислоты, связанных водородной связью. Этим можно объяснить малую электрическую проводимость оксониевых солей.
Простые эфиры фенолов
Простые эфиры фенолов
Простые эфиры фенолов, как и простые эфиры спиртов, мало реакционноспособные соединения, но разрыв связи С—О в них происходит все же несколько легче. Отщепление алкильной группы можно осуществить действием А1С13 или концентрированной НВг, расщепление проходит всегда с образованием фенола и алкилгалогенида:
Классификация, номенклатура, изомерия аминов
Аминами называются производные углеводородов, образованные замещением в последних атомов водорода на группы —NН2, —NHR' или — NR'R":
В зависимости от числа атомов водорода у атома азота, замещенных радикалами, амины называются первичными, вторичными или третичными. При этом не имеет значения, какие радикалы (первичные, вторичные или третичные) являются заместителями.
Группа —NН2, входящая в состав первичных аминов, называется аминогруппой. Группа >NН во вторичных аминах называется иминогруппой.
Номенклатура аминов:
1. Названия аминов обычно производят от названий входящих в них радикалов с присоединением окончания –амин: метиламин СН3— NН2, диметиламин (СН3)2—NН, триметил-амин (СН3)3N, пропиламин СН3СН2СН2 NН2 и т. д.
2. В более сложных случаях аминогруппу рассматривают как функциональную группу и ее название амино- ставят перед названием основной цепи (ИЮПАК):
Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние члены ряда аминов — жидкости, высшие — твердые тела. С увеличением молекулярной массы аминов увеличивается их плотность, повышается температура кипения и уменьшается растворимость в воде. Высшие амины в воде нерастворимы. Низшие амины имеют неприятный запах, несколько напоминающий запах аммиака. Высшие амины или не имеют запаха, или обладают очень слабым запахом.
Молекулы аминов ассоциированы в результате образования водородных связей, но меньше, чем это наблюдается у спиртов:
У третичного триэтиламина, неспособного к ассоциации, температура кипения значительно ниже (90 °С), чем у изомерного первичного гексиламина (133 °С). Пространственная модель аминогруппы представляет собой уплощенную пирамиду, в которой легко происходит инверсия (выворачивание), именно поэтому у простейших аминов отсутствует оптическая изомерия:
При протонизации и образовании солей строение молекулы амина становится близким к тетраэдрическому.
Солеобразование. Амины с кислотами дают соли, которые под действием сильного основания вновь дают свободные амины:
Аналогично строению молекулы хлорида аммония можно представить и строение солей аминов:
Амины дают соли даже со слабой угольной кислотой:
Присоединение алкилгалогенидов к третичным аминам идет по той же схеме:
Как и аммиак, амины обладают основными свойствами что объясняется связыванием протонов в слабо диссоциирующий катион замещенного аммония:
При растворении амина в воде часть протонов воды расходуется на образование катиона; таким образом, в растворе появляется избыток гидроксид-ионов, и он имеет щелочные свойства, достаточные для окрашивания растворов лакмуса в синий цвет и фенолфталеина в малиновый. Основность аминов предельного ряда колеблется в очень небольших пределах и близка к основности аммиака.
Эффект метильных групп несколько повышает основность метил- и диметиламина. В случае триметиламина метильные группы уже затрудняют сольватацию образующегося катиона и уменьшают его стабилизацию, а следовательно, и основность.
Соли аминов следует рассматривать как комплексные соединения. Центральным атомом в них является атом азота, координационное число которого равно четырем. Атомы водорода или алкилы связаны с атомом азота и расположены во внутренней сфере; кислотный остаток расположен во внешней сфере.
Ацилирование аминов. При действии на первичные и вторичные амины некоторых производных органических кислот (галогенангидридов, ангидридов и др.) образуются амиды:
Третичные амины в эту реакцию не вступают.
Действие на амины азотистой кислоты. Эта реакция имеет важное аналитическое значение, так как позволяет различать первичные, вторичные и третичные амины неароматического характера.
При действии азотистой кислоты на первичные амины (кроме ароматических аминов) выделяется свободный азот и образуется чаще всего спирт:
Вторичные амины с азотистой кислотой дают нитрозоамины — желтоватые жидкости, мало растворимые в воде:
При обработке крепкой соляной кислотой нитрозоамины снова дают исходные амины:
Третичные амины устойчивы к действию разбавленной азотистой кислоты на холоду (образуют соли азотистой кислоты), в более жестких условиях один из радикалов отщепляется и образуется нитрозоамин.
Диамины
Диамины играют важную роль в биологических процессах. Как правило, они легко растворимы в воде, обладают характерным запахом, имеют сильно щелочную реакцию, взаимодействуют с С02 воздуха. Диамины образуют устойчивые соли с двумя эквивалентами кислоты.
Этилендиамин (1,2-этандиамин) h3NCh3СН2NН2. Он является простейшим диамином; может быть получен действием аммиака на этиленбромид:
Тетраметилендиамин (1,4-бутандиамин), или путресцин, NН2СН2СН2СН2СН2Nh3 и пентаметилендиамин (1,5-пентандиамин) NН2СН2СН2СН2СН2СН2NН2, или кадаверин. Они были открыты в продуктах разложения белковых веществ; образуются при декарбоксилировании диаминокислот и названы птомаинами (от греч. — труп), их считали ранее «трупными ядами». В настоящее время выяснено, что ядовитость гниющих белков вызвана не птомаинами, а присутствием других веществ.
Путресцин и кадаверин образуются в результате жизнедеятельности многих микроорганизмов (например, возбудителей столбняка и холеры) и грибков; они встречаются в сыре, спорынье, мухоморе, пивных дрожжах.
Некоторые диамины применяются в качестве сырья для получения полиамидных волокон и пластмасс. Так, из гекса-метилендиамина NН2СН2СН2СН2СН2СН2СН2NН2 получено весьма ценное синтетическое волокно — найлон (США) или анид (Россия).
Аминоспирты
Аминоспирты — соединения со смешанными функциями, в молекуле которых содержатся амино- и оксигруппы.
Аминоэтанол (этаноламин) НО—СН2СН2—Nh3, или коламин.
Этаноламин — густая маслянистая жидкость, смешивается с водой во всех отношениях, обладает сильными щелочными свойствами. Hаряду с моноэтаноламином получаются также диэтаноламин и триэтаноламин:
Этаноламины широко применяются в технике в качестве эмульгаторов и других поверхностно-активных веществ, а также в различных процессах газоочистки, в том числе для извлечения оксида углерода (IV) из топочных газов при производстве сухого льда (твердой двуокиси углерода).
Холин. Он представляет собой четырехзамещенное аммониевое основание. В нем с атомом азота связаны три метильные и одна окси-этильная группа:
Холин входит в состав лецитинов — жироподобных веществ, весьма распространенных в животных и растительных организмах, и может быть выделен из них. Холин представляет собой кристаллическую, весьма гигроскопичную, легко расплывающуюся на воздухе массу. Он обладает сильными щелочными свойствами и с кислотами легко образует соли.
При ацилировании холина уксусным ангидридом образуется холинацетат, называемый также ацетилхолином:
Ацетилхолин играет крайне важную биохимическую роль, так как является медиатором (посредником), передающим возбуждение от нервных рецепторов к мышцам.
7
studfiles.net
| misle.ru | страница 1Вопросы к промежуточной аттестации по учебной дисциплине «Органическая химия» для специальности 060301 Фармация Общие понятия. Углеводороды.
Смотрите также: Гомологический рядУчебной дисциплине «Органическая химия» для специальности 060301 Фармация42.96kb. 1 стр. ОртоэфирыПрограмма комплексного вступительного испытания в магистратуру направление подготовки 04. 04. 01 Химия Магистерская программа «органическая химия»419.71kb. 2 стр. Скелетная формула органических соединенийУчебно-методический комплекс. Рабочая программа для студентов очной формы обучения по направлению 020100947.65kb. 4 стр. Высокомолекулярные соединенияРабочая программа для студентов очной формы обучения по направлению 020100. 62 «Химия», профили подготовки: «Неорганическая химия и химия координационных соединений»419kb. 1 стр. Октетная теорияПамятка для студентов групп пкм по изучению дисциплины "Органическая химия" (2 семестр)122.34kb. 1 стр. Перегруппировка БекманаМодуль IX. «Особенности строения и реакционной способности монокарбонильных соединений. Проблемы и методы синтеза»108.7kb. 1 стр. АнтиинтеллектуализмРабочая программа учебной дисциплины философия Для специальности: 080507. 65 «Менеджмент организации»87.81kb. 1 стр. Обсерватория Вюрцбургского университетаЛекция по дисциплине «Проблемы афазии» для специальности331.11kb. 1 стр. Нижняя конечностьМетодические рекомендации для обучающихся № к внеаудиторной (самостоятельной) работе по дисциплине «Детская хирургия» для специальности101.64kb. 1 стр. Теорема Пуанкаре - ВольтеррыРабочая программа по дисциплине Математическое моделирование в радиофизике (наименование дисциплины) для специальности176.83kb. 1 стр. Химия твёрдого телаТребования к кандидатам в соответствии с квалификационными характеристиками, утвержденными постановлением Президиума ран от 25. 03. 2008 г. №196. Конкурс состоится 26 сентября 2014 года в 10: 00 в конференц-зале Института27.91kb. 1 стр. Гробница АтреяУчебно-методический комплекс по дисциплине "Культурология" для специальности 030501. 65 «Юриспруденция» Красноярск: Издательство кф урао, 2013. 23 с205.74kb. 1 стр. |
misle.ru