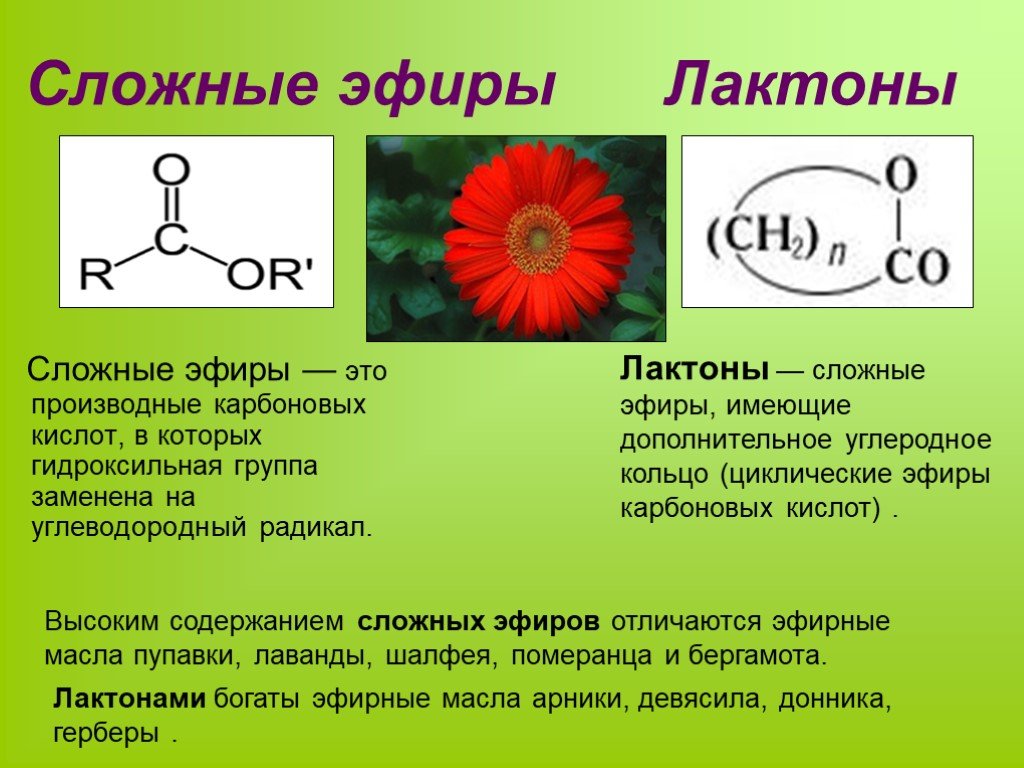
Содержание
10 класс. Химия. Жиры. Строение, химические свойства, функции в организме. Примеры задач по химии сложных эфиров и жиров — Примеры задач по химии сложных эфиров и жиров
Комментарии преподавателя
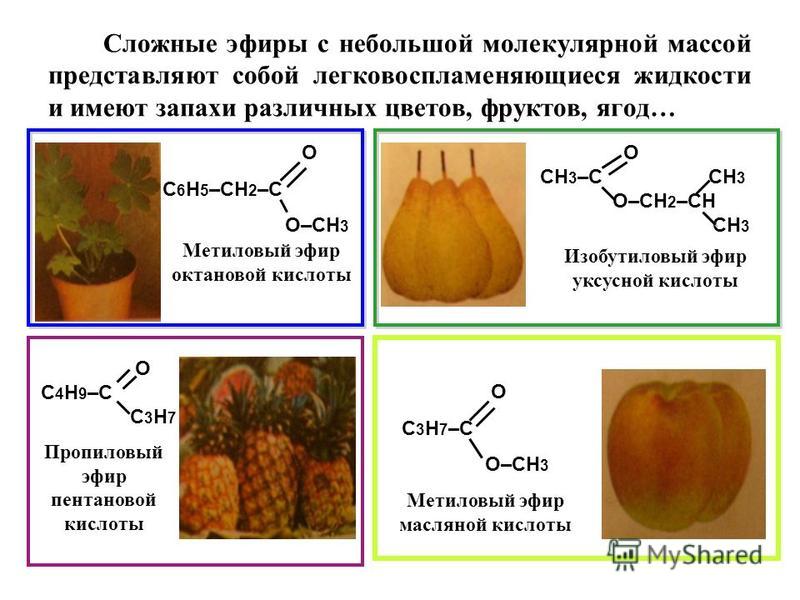
Задача 1
Условие задачи.
Какие исходные кислоты и спирты необходимо взять для синтеза сложных эфиров этилбензоата (с запахом мяты) и бензилацетата (с запахом жасмина)?
Решение
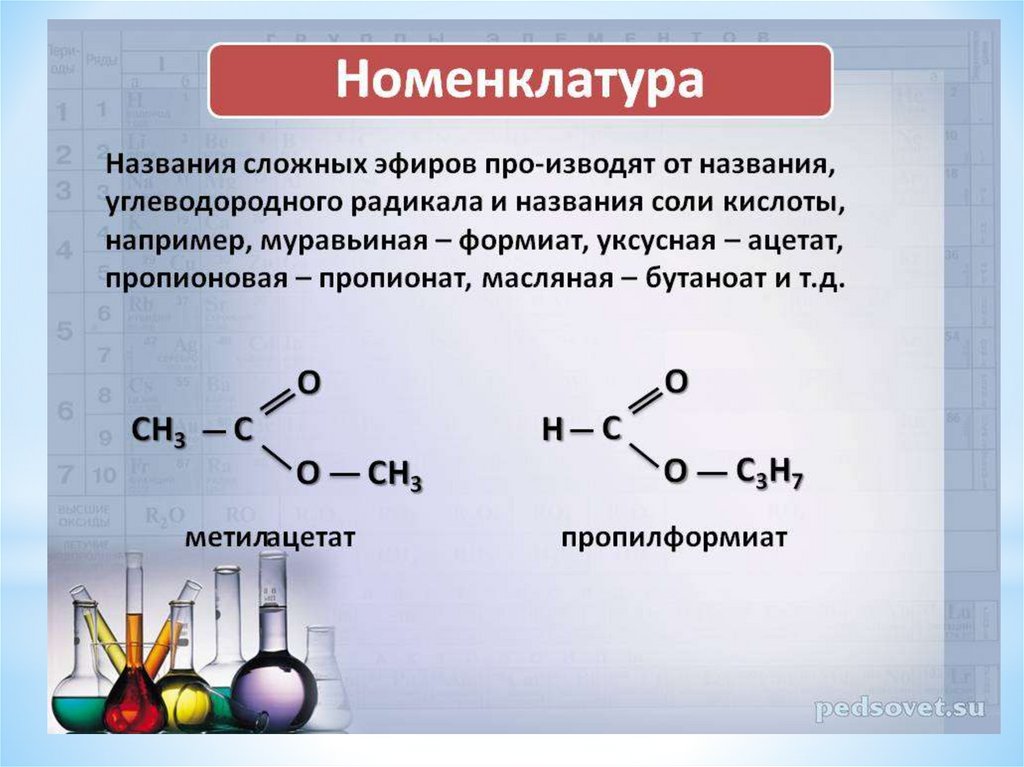
1. Вспомните, как образуется название сложного эфира.
Ответ: сначала указывают название радикала – остатка от спирта, а затем название кислотного остатка.
2. Определим исходные вещества для синтеза этилбензоата и бензилацетата.
«Этил» – остаток этилового спирта, «бензоат» – остаток бензойной кислоты. Следовательно, этилбензоат образуется из бензойной кислоты и этилового спирта. «Бензил» – остаток бензилового спирта, «ацетат» – остаток уксусной кислоты.
Формулы сложных эфиров представлены на рисунке 1.
Рис. 1. Формулы и исходные вещества для синтеза этилбензоата и бензилацетата
Приведенные сложные эфиры между собой являются изомерами, их состав соответствует формуле С9Н10О2 (Рис. 2).
Рис. 2. Изомерные сложные эфиры
Задача 2
Условие задачи
При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если: а)серебряная соль кислоты А содержит 59,66 % серебра, б) спирт Б не окисляется дихроматом калия.
Решение
1. Предположим, что кислота, образующая сложный эфир, одноосновна. Но если задача не будет решена таким образом, то придется рассматривать случаи двух-, трехосновной кислот и так далее.
2. Запишем формулу серебряной соли и рассчитаем молярную массу углеводородного радикала R в кислоте.
RCOOAg – формула серебряной соли кислоты А.
Зная молярные массы серебра, углерода и кислорода, выразим молярную массу RCOOAg:
Известно, что серебро составляет 59,66 % от массы всей соли. Составим пропорцию:
Составим пропорцию:
59,66 % – 108 г/моль
100 % – (M(R) + 152) г/моль
Произведем соответствующие вычисления и найдем молярную массу R:
Такая молярная масса соответствует радикалу этилу – С2Н5. Следовательно, кислота, образующая сложный эфир, – пропановая. Тогда, общая формула эфира – С2Н5СООR.
Зная молярную массу эфира С2Н5СООR, можно найти молярную массу радикала R:
Молярной массе 57 г/моль соответствуют 4 изомерных радикала (Рис. 3).
Рис. 3. Изомеры состава -С4Н9
В условии задачи сказано, что спирт Б не окисляется дихроматом калия, следовательно, этот спирт является третичным.
Таким образом, исходный сложный эфир образован пропановой кислотой и третбутиловым спиртом:
Задача 3
Условие задачи
Растительное масло массой 17,56 г нагрели с 3,36 г гидроксида калия до полного исчезновения масляного слоя. При действии избытка бромной воды на полученный после гидролиза раствор образуется только одно тетрабромпроизводное.
Установите возможную формулу жира.
Решение
Запишем в общем виде уравнение гидролиза жира:
На 1 моль жира при гидролизе приходится 3 моль гидроксида калия.
Найдем количество вещества гидроксида калия и жира (количество жира втрое меньше):
Зная количество и массу жира, можно найти его молярную массу:
На три углеводородных радикала R кислот приходится 705 г/моль:
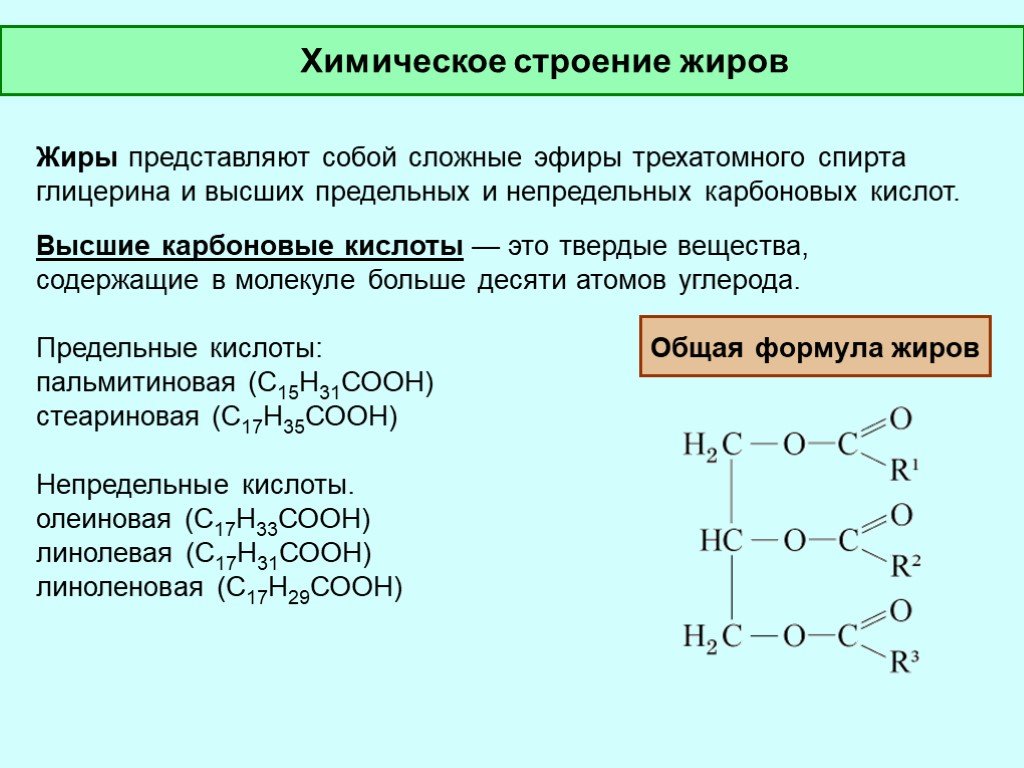
Зная, что тетрабромпроизводное получено только одно, можно сделать вывод, что все кислотные остатки одинаковы и содержат по 2 двойные связи. Тогда получаем, что в каждом радикале содержится 17 атомов углерода, это радикал линолевой кислоты:
Возможная формула жира представлена на рисунке 4.
Рис. 4. Формула жира
Источники
http://www.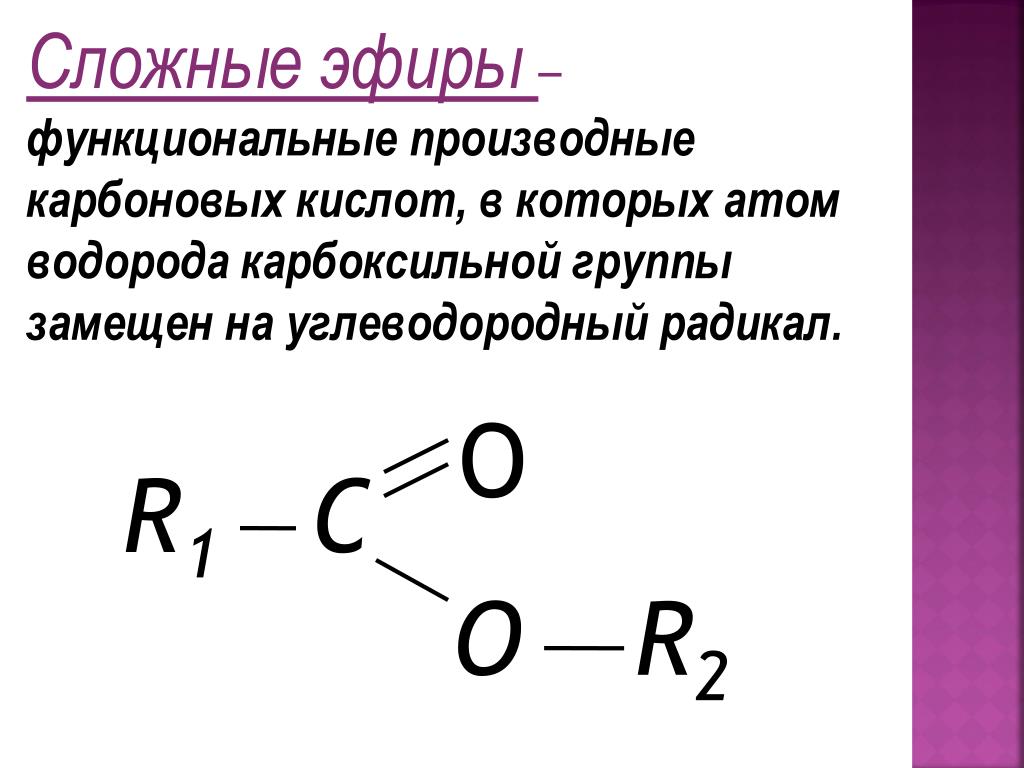 youtube.com/watch?v=YIjmD7bjGoc
youtube.com/watch?v=YIjmD7bjGoc
источник конспекта — http://www.youtube.com/watch?v=UeImnRPGZqg
Получение сложных эфиров и эфирных масел
Актуальность Сложные эфиры и эфирные масла широко используются в практической деятельности человека, но получение их — процесс дорогостоящий. Поэтому зная способы их получения, свойства, биологическое воздействие, можно найти более дешевые способы получения эфиров, находить новые сферы их применения.
Цель: Поиск дешевых методов получения сложных эфиров, выделения эфирных масел из растений и химических реактивов.
Гипотеза: Возможно, полученные в школьной лаборатории и в домашних условиях сложные эфиры и эфирные масла можно использовать для создания духов и в качестве лекарственных средств.
Новизна: Изготовление модели установки для выделения эфирных масел в домашних условиях, поиск дешевых методов получения эфирных масел.
Объект исследования: сложные эфиры и эфирные масла.
Методы исследования. При проведении исследовательской работы использовались: поисково-аналитический метод и известные методы органического синтеза сложных эфиров-этерификация, методы экстракции эфирных масел из растительного сырья, моделирование. Ароматическая композиция создавалась с использованием полученных сложных эфиров и эфирных масел
Результаты
-
Изучены методы получения сложных эфиров: в промышленности [8], в лаборатории [6], [4], извлечением из растений [1], [2], [3], [5], [9].
Получение эфиров в промышленных масштабах мы изучали во время экскурсии в Амзинский лесокомбинат (рис.1).
Рис. 1. Цех по производству этилацетата
Рис.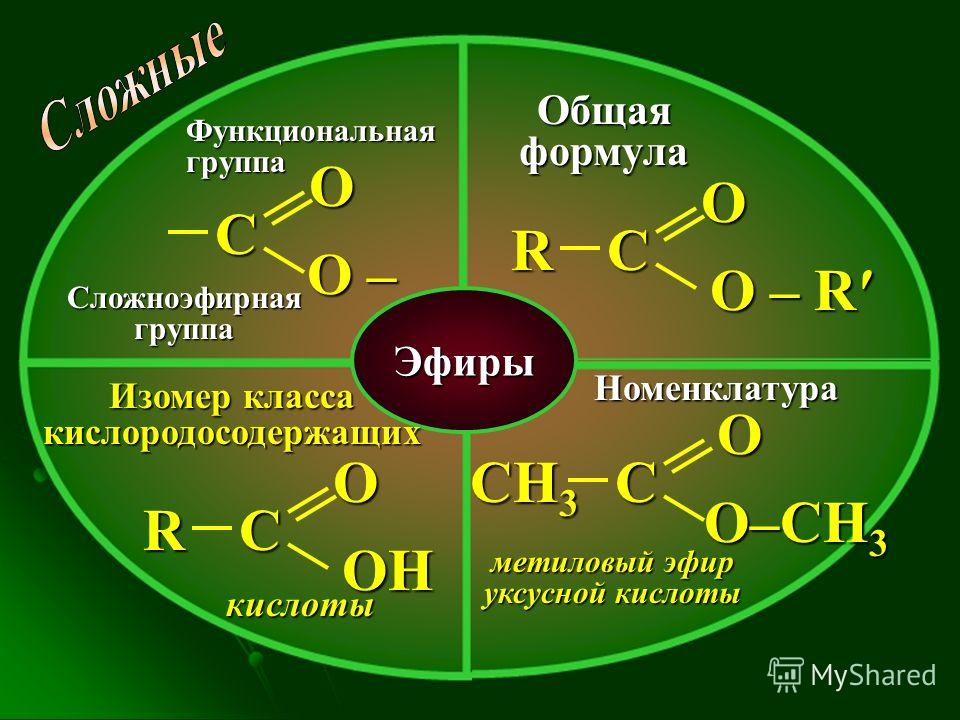 2. Схема установки получения этилацетата
2. Схема установки получения этилацетата
Получение эфира в промышленности очень сложный процесс. Мы выяснили, что химическая реакция происходит в реакторе (куб-этерефикатор), обогреваемом через змеевики. Реакционная смесь (СН3СООН, С2Н5ОН, катализатор серная кислота(конц.) перед попаданием в куб разогревается, только затем поступает в него. Куб нагревает смесь с помощью змеевика (нагревание происходит паром), образуется дистиллят — пары реакционной смеси. Дистиллят охлаждается и поступает во флорентину, где он расслаивается на эфир-сырец и водно-эфирно-спиртовый слой, идущий на регенерацию.
Этилацетат-сырец проходит несколько стадий очисток: промывка, нейтрализация раствором соды, сушка. Сухой эфир направляют на ректификацию. После ректификации эфир охлаждается и поступает в цистерны (баки) — готовый товарный продукт, содержание в нем эфира должно быть не менее 90–97 % и должна отсутствовать вода [8].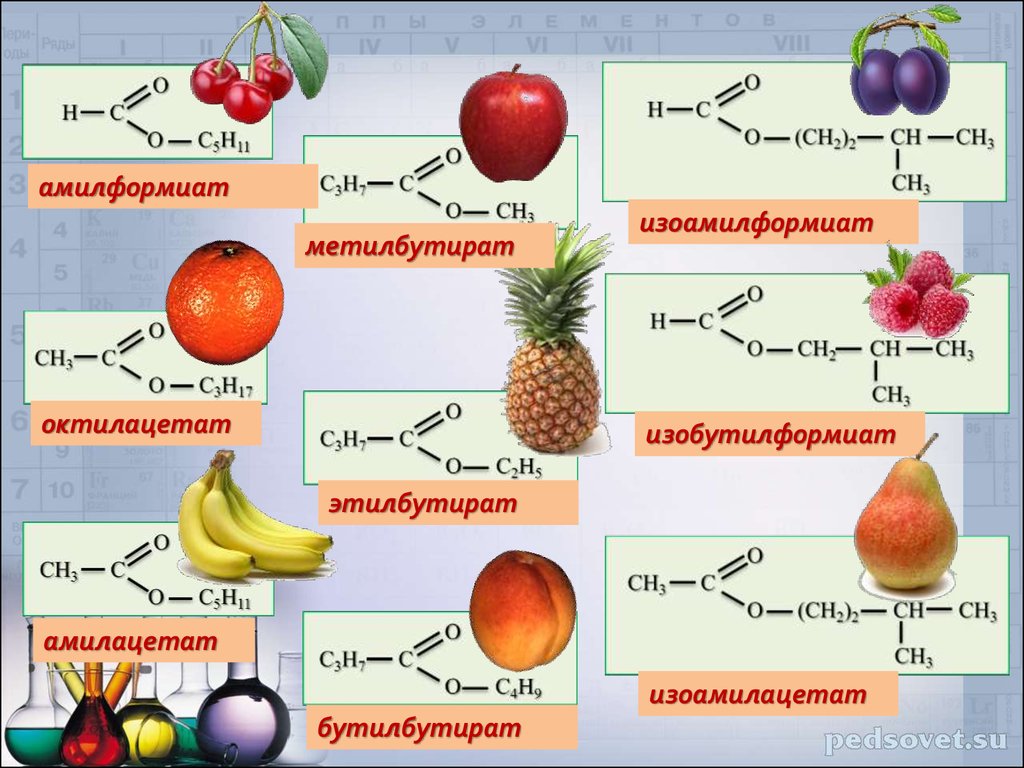
-
Получены методом этерификации [6], [4] 5 сложных эфиров уксусной кислоты: этилацетат, изоамилацетат, изобутилацетат, метилацетат, бутилацетат.
Рис. 3. Синтез сложных эфиров методом этерификации
Рис. 4. Синтезированные сложные эфиры
Таблица 1
Синтезированные сложные эфиры
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
Выделены эфирные масла из различных частей растений методом перегонки с водяным паром [6], экстракции спиртом [7], [9], [11], [19], и получены настоянные масла [12], [13], [14], [15], [16], [18].
Подобрали растительное сырье со специфическими запахами и возможно, по литературным данным, содержащие эфирные масла [17].
Собрали прибор. В 1-ю колбу наливали воду и кипелки для равномерного нагревания смеси, во 2-ю растительное сырье и воду. Полученный эфир пропускается через холодильник и собирается в капельной воронке. В результате, методом перегонки с водяным паром получены эфирные масла: мяты перечной, корицы, тмина, ванилина.
Рис. 5. Выделение эфирных масел методом перегонки с водяным паром
Рис. 6. Полученные эфиры
6. Полученные эфиры
Экстракционные методы рекомендуют применять в тех случаях, когда извлекаемые душистые вещества термически малостойкие и не выдерживают даже температур перегонки с водяным паром [11]. Взяли фрукты, обладающие специфическими ароматами: лимон, апельсин, мандарин, банан, киви. Отделили кожуру фруктов, залили спиртом, выстояли в холодильнике в течении 2-х недель, затем отфильтровали полученные вытяжки.
Таблица 2
Свойства спиртовых вытяжек
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Собранное растительное сырье: трава чистотела, зверобоя, корни одуванчика, листья подорожника, хвоя пихты, цветы ромашки, плоды облепихи, также измельчались при помощи ножниц и заливались спиртом [10]. Настаивали в холодильнике в течении 2-х недель. Затем все отфильтровывали через слой марли.
Таблица 3
Свойства спиртовых вытяжек лекарственных растений
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Спиртовые вытяжки все имеют приятный внешний вид, без налетов. Однако т. к. настойка одуванчика имеет неприятный запах, его в качестве компонента для добавления к ароматической композиции использовать нельзя.
Однако т. к. настойка одуванчика имеет неприятный запах, его в качестве компонента для добавления к ароматической композиции использовать нельзя.
Настоянные масла отличаются от эфирных масел и по качеству, и по методу получения. Этот метод использовался в течение сотен лет, еще задолго до того, как были изобретены методы извлечения эфирных масел из растений. В странах Востока и Средиземноморья горшки просто оставляли на солнце до завершения процесса, но в странах с более прохладным климатом понадобится источник тепла. Иногда флягу с маслом ставят в поддон с водой и нагревают ее, но в этом случае масло получается не такое хорошее, как при медленном настаивании [15]. Приготовили настоянные масла из плодов облепихи, цветов ромашки, листьев подорожника, хвои пихты, корня репейника, травы чистотела, зверобоя.
Рис. 7. Извлечение эфиров из растений экстракционным методом
Рис.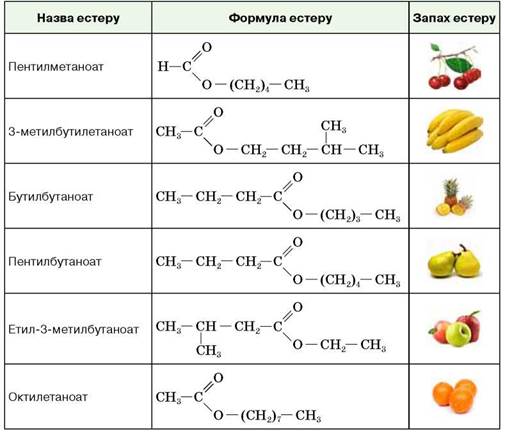 8. Полученные вытяжки
8. Полученные вытяжки
-
Изготовлена установка для выделения эфирных масел в домашних условиях.
Модель установки для получения эфира в домашних условиях была создана на основе прибора для выделения эфирных масел. Получали эфир на обычной газовой плите, нагревая баночки с веществами на водяной бане, в качестве холодильника использовали кастрюлю со снегом. Выделили около 4 мл эфира из гвоздики
Рис. 9. Извлечение эфирных масел в домашних условиях
Рис. 10. Выделенный эфир из корицы
-
Созданы 4 ароматические композиции с применением полученных эфиров.
На основе полученных вытяжек из растительного сырья и синтезированных сложных эфиров, путем различных комбинаций, создали ароматические композиции ([12].
Рис. 11. Получение ароматических композиций
Рис. 12. Полученные ароматические композиции
-
Изучены физико-химические свойства некоторых сложных эфиров. -
Выявлено, что эфирное масло пихты обладает антимикробным действием, этилацетат губительно воздействует на биологические объекты.
Заключение: Рассмотренные методы извлечения эфирных масел просты и не требуют дорогостоящего оборудования. Любому человеку, имеющему доступ к свежим растениям или цветам, можно приготовить их даже в домашних условиях. Выделенные композиции из растительных вытяжек безопасны для организма человека.
Полученные композиции из синтетических эфиров требуют продолжения исследований медицинского характера.
Направление использования результатов проекта: Полученные вытяжки из лекарственных растений могут быть использованы в качестве медицинских препаратов для
наружного использования, в качестве косметических средств, ароматические композиции — для изготовления мыла, духов, ароматизации воздуха в помещении.
Литература:
-
Войткевич С. А. 865 душистых веществ для парфюмерии и бытовой химии. М.: Пищ. Пром-сть, 1994. -
Войткевич С. А. Эфирные масла для парфюмерии и ароматерапии. М.: Пищ. Промыш., 2001. -
Войткевич С. А., Хейфич Л. А. От древних благовоний до современной парфюмерии и косметики. М.: Пищ. Пром-сть, 1997. -
Голодников Г. В. Практические работы по органическому синтезу. Л.: ЛГУ, 1966г. 373
В. Практические работы по органическому синтезу. Л.: ЛГУ, 1966г. 373
-
Г. М. Свиридоновы «Растения и здоровье лечебные и пищевые свойства», М. Профиздат, 1992г-272с.
6. Гроссе Э., Вайсмантель X. Химия для любознательных. Основы химии и занимательные опыты
-
Е. В. Кучеров, Д. Н. Лазарева «Целебные растения и их применение». Уфа.1993.288с. -
Л. В. Гордон, С. О. Скворцов, В. И. Лисов «Технология и оборудование лесохимических производств» М. «Лесная промышленность», 1988г. -
Попов А. В. «Лесные целебные растения», М. «Экология»,1992г.160с -
Солдатенков А. Т., Колядина Н. М., Ле Туан Ань и др. Основы органической химии душистых веществ для прикладной эстетики и ароматерапии.
-
Энциклопедия ароматов Автор: Захаренкова В. И. Издательство: Природа и человек 2000г., с.304 -
alhimik.ru› Душистые эфиры
13. Как приготовить репейное масло в домашних условиях | Аптека… aptekapodnogami.ru›)
14. Масла, настоянные в домашних условиях. Приготовление. Применение | Форум izbushka.com› Масла
-
Настоянные ароматические масла в домашних условиях http://medpravila. info/topics/42994293104/Nastoyan…ie-masla-v-domashnih-usloviyah
16. Приготовление эфирных масел inflora.ru›
17. www.narmed.ru Характеристика различных эфирных масел Ароматерапия… nedug.ru› Библиотека
18. Приготовление эфирных масел в домашних условиях.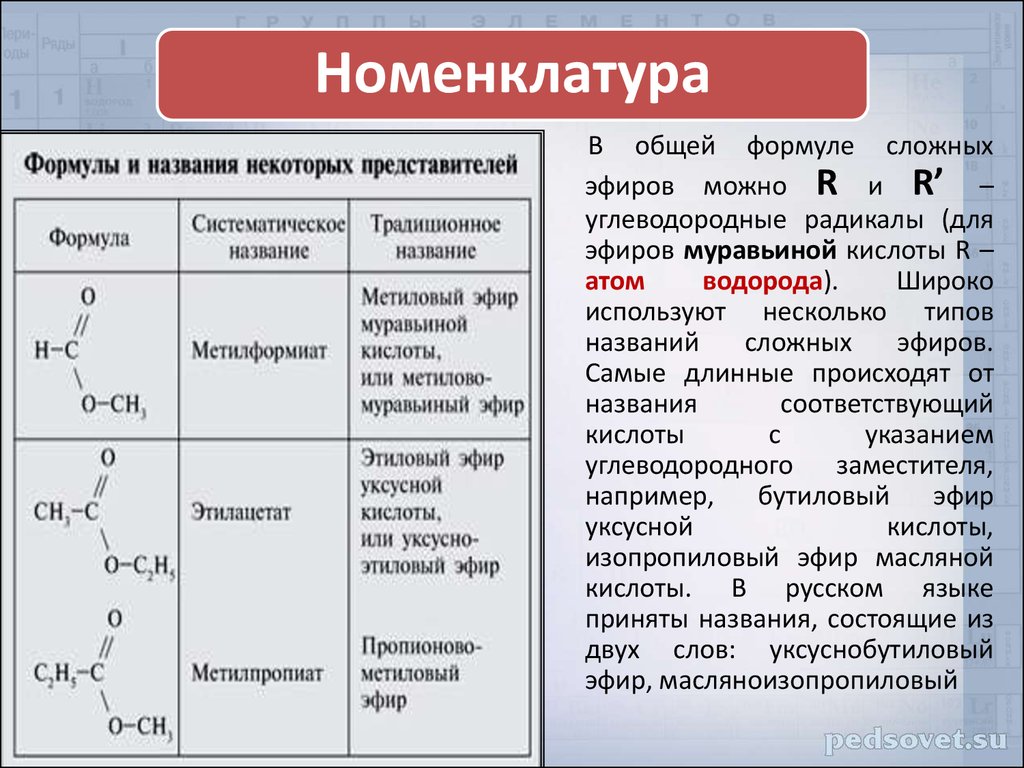 Обсуждение… liveinternet.ru›Записи›post269698784
Обсуждение… liveinternet.ru›Записи›post269698784
-
Травень В. Ф. Органическая химия: В 2т. М.: ИКЦ «Академкнига», 2004. project.1september.ru›works.
Физические и химические свойства эфиров
Органические химические вещества, такие как спирт, фенол и эфир, широко используются как в быту, так и в промышленности. Духи, дезинфицирующие средства и топливо — все это примеры этих товаров, которые по-разному используются в нашей повседневной жизни.
Что такое эфиры?
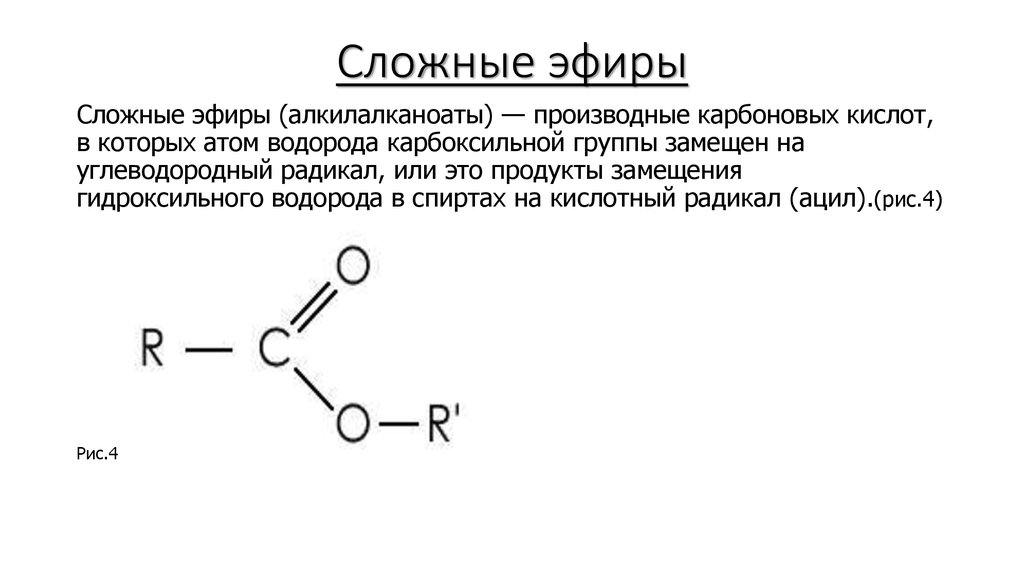
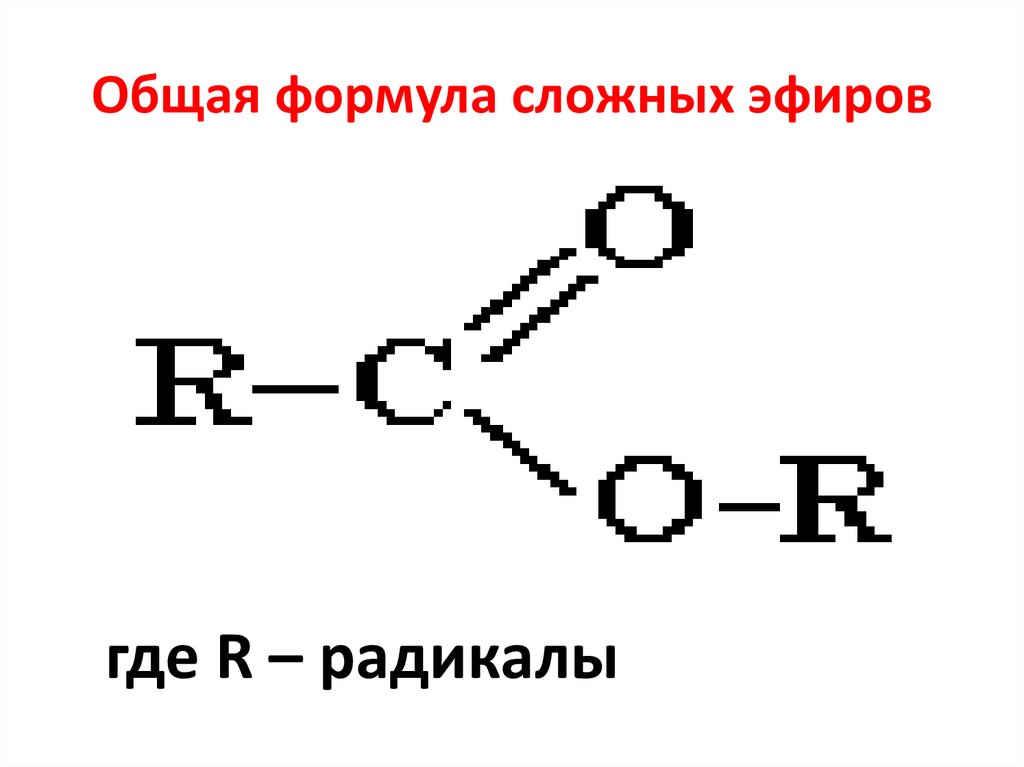
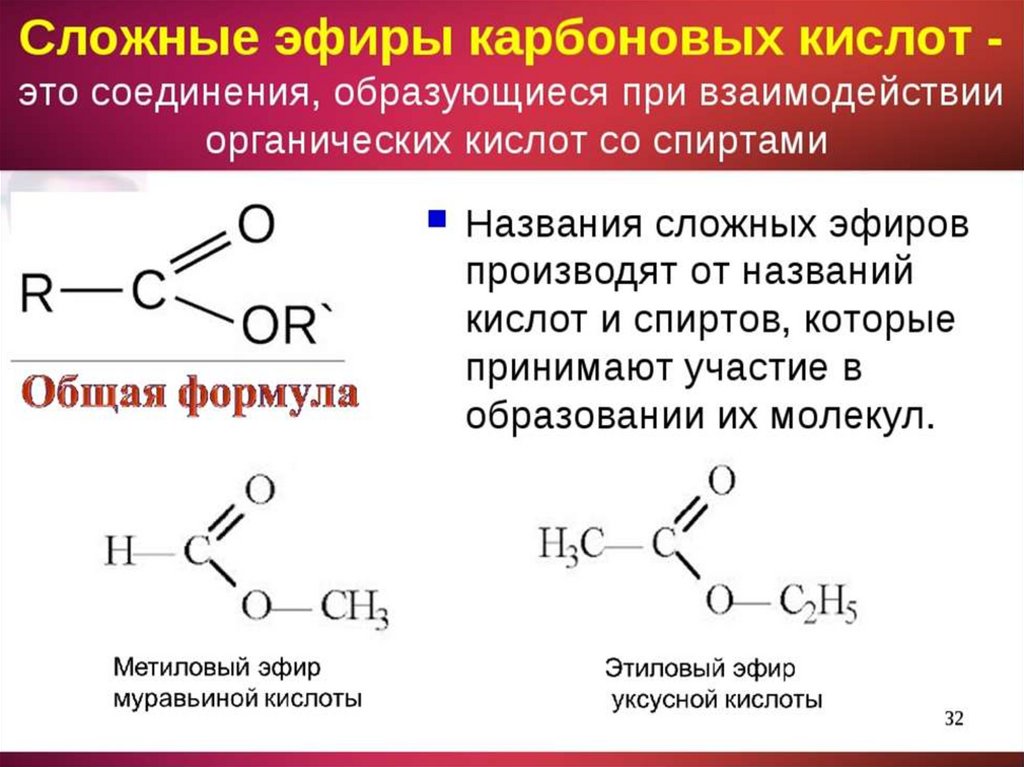
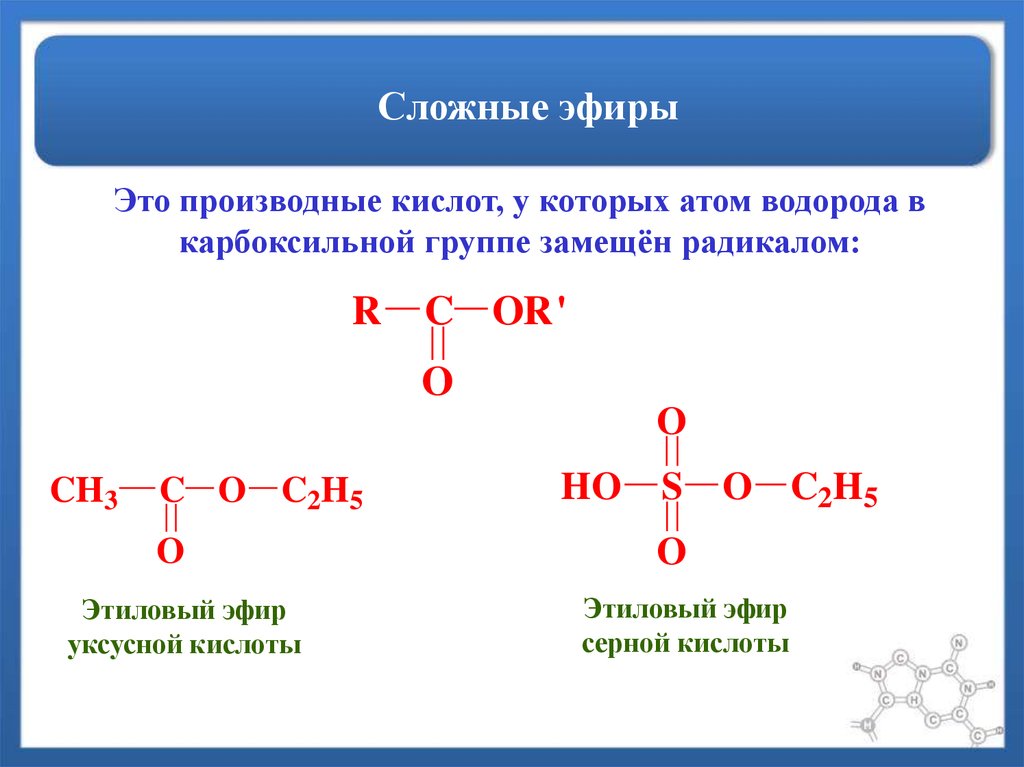
Эфиры представляют собой форму органической молекулы, в которой один атом кислорода соединяет две углеводородные группы (алкильные или арильные). Он представлен с помощью формулы R-O-R’.
В формуле R’ углеводородная группа может быть такой же или отличной от R.
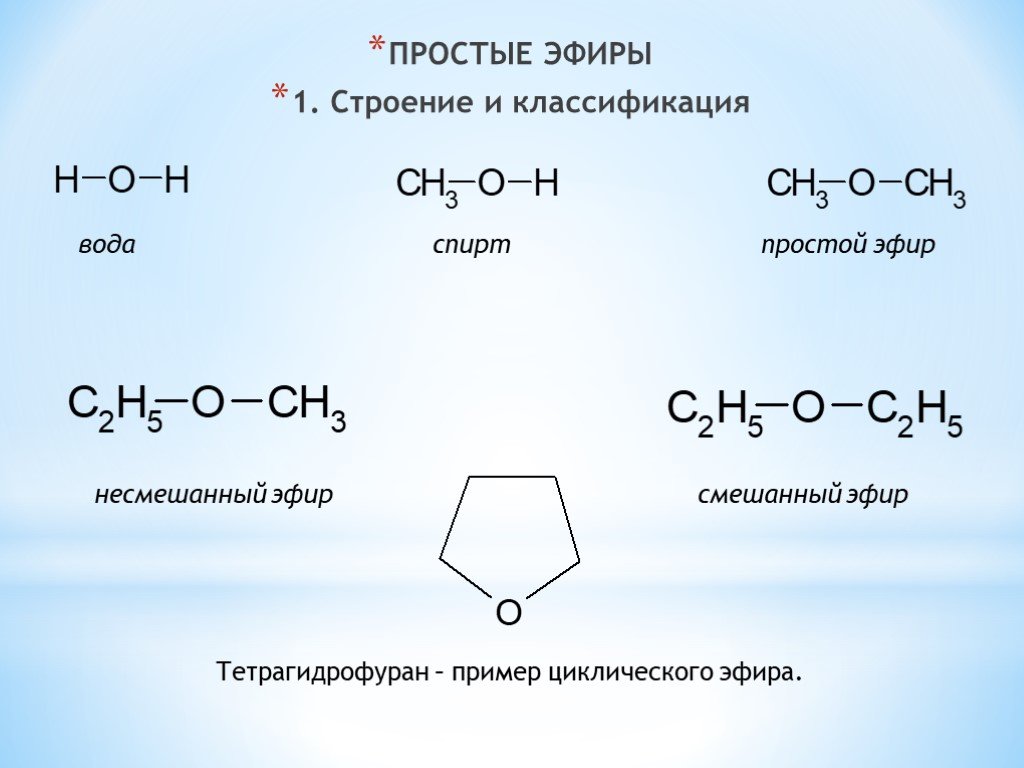
Простые эфиры образуются при замене атома водорода гидроксильной группы в спиртах на алкильную или арильную группу.
Например-
Кислород и углерод в связи C-O-C гибридизованы sp 3 .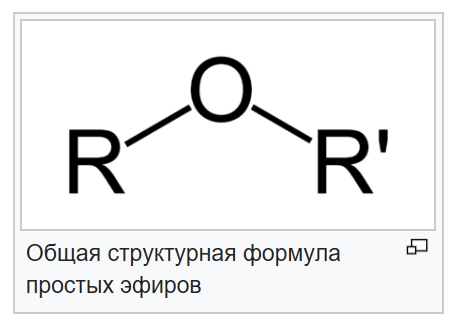 Отталкивание двух неподеленных пар (lp) на атоме кислорода вызывает искривленную форму. Наличие объемных групп на обоих концах атома кислорода, а также отталкивание bp-bp, приводящее к валентному углу CO около 111,7, создают стерический барьер.
Отталкивание двух неподеленных пар (lp) на атоме кислорода вызывает искривленную форму. Наличие объемных групп на обоих концах атома кислорода, а также отталкивание bp-bp, приводящее к валентному углу CO около 111,7, создают стерический барьер.
Классификация простых эфиров
Простые эфиры делятся на два типа в зависимости от групп у R и R’:
- Простые эфиры или симметричные эфиры: Эти простые эфиры имеют одинаковую алкильную группу на обоих концах атома кислорода . Например,
- Смешанные эфиры или асимметричные эфиры: Эти эфиры состоят из разных алкильных групп на обоих концах атома кислорода. Например,
Этиловый метиловый эфир
Метилфениловый эфир
Физические свойства простых эфиров
Физические характеристики простых эфиров следующие:
- Физическое состояние: Другие ингредиенты представляют собой летучие жидкости без запаха метоксиметана, а метоксиметан представляет собой летучие жидкости без запаха.
 . К низшим гомологам относятся бесцветные, приятно пахнущие летучие жидкости с характерным запахом эфира.
. К низшим гомологам относятся бесцветные, приятно пахнущие летучие жидкости с характерным запахом эфира. - Полярная природа эфира: Эфиры имеют полярный характер. Причиной этого является разница в электроотрицательности между атомами кислорода и углерода. Атом кислорода подталкивает общую пару электронов ближе к себе из-за разницы в электроотрицательности, что приводит к частичному отрицательному заряду атома кислорода и частичному положительному заряду атома углерода. Две полярные связи С—О в эфире наклонены друг к другу под углом 111,7°. В результате два диполя не компенсируются, что приводит к чистому дипольному моменту. т. е. в эфире дипольный момент (μ) ≠ 0. Эфиры более полярны, чем алкены, но не так полярны, как спирты, сложные эфиры или амиды с аналогичной структурой.
- Водородная связь эфира: Атом водорода не связан напрямую с атомом кислорода в эфирах. В результате эфиры не содержат водородных связей между молекулами. С другой стороны, простые эфиры используются только для принятия водородных связей.
 Водородная связь с молекулами воды возможна, потому что атомы кислорода имеют две неподеленные пары электронов.
Водородная связь с молекулами воды возможна, потому что атомы кислорода имеют две неподеленные пары электронов.
По сравнению с линейными алифатическими эфирами циклические эфиры, такие как тетрагидрофуран и 1,4-диоксан, смешиваются с водой из-за более открытого атома кислорода для образования водородной связи.
- Температура кипения эфира: Поскольку эфиры не образуют внутримолекулярных водородных связей, их температура кипения ниже, чем у изомерных спиртов, но ближе к температуре кипения алканов той же массы. Хотя оба вещества имеют одинаковую химическую формулу C 2 H 6 O, температура кипения метоксиметана (CH 3 OCH 3 ) ниже, чем у этанола (CH 3 CH 2 OH). ).
- Растворимость эфира: Эфиры, содержащие до трех атомов углерода, смешиваются с водой. Это связано с тем, что меньшие эфиры легче образуют водородные связи с молекулами воды.
 Эфиры состоят из двух типов молекул: неполярной гидрофобной углеводородной цепи и полярного гидрофильного кислородного конца. Растворимость эфира в воде уменьшается по мере увеличения размера алкильной группы. Это связано с неполярной природой углеводородного компонента, препятствующего образованию водородных связей с полярными молекулами воды. Органические растворители, такие как спирты, бензол и ацетон, относительно растворимы в эфирах. Диэтиловый эфир и н-бутиловый спирт, например, растворимы в воде в одинаковой степени. Потому что эфир образует водородную связь с водой так же, как это делает спирт.
Эфиры состоят из двух типов молекул: неполярной гидрофобной углеводородной цепи и полярного гидрофильного кислородного конца. Растворимость эфира в воде уменьшается по мере увеличения размера алкильной группы. Это связано с неполярной природой углеводородного компонента, препятствующего образованию водородных связей с полярными молекулами воды. Органические растворители, такие как спирты, бензол и ацетон, относительно растворимы в эфирах. Диэтиловый эфир и н-бутиловый спирт, например, растворимы в воде в одинаковой степени. Потому что эфир образует водородную связь с водой так же, как это делает спирт. - Кислотность: Вода, эфиры и спирты имеют одинаковые кислородные связи. Поскольку кислород более электроотрицателен, чем углерод, альфа-альфа атомов водорода по сравнению с эфирами в простых углеводородах более кислая. Они гораздо менее кислые, чем альфа-карбонильные группы водорода (например, в кетонах или альдегидах).
- Эфиры легче воды.
Химические свойства эфиров
- Эфиры представляют собой бесцветные, приятно пахнущие, чрезвычайно летучие и горючие жидкости.
 Эфиры плохо растворимы в воде из-за Н-связей и гидрофобных алкильных или арильных групп.
Эфиры плохо растворимы в воде из-за Н-связей и гидрофобных алкильных или арильных групп. - Внутри себя простые эфиры не имеют водородных связей. В результате их температуры кипения значительно ниже, чем температуры кипения эквивалентных спиртов.
- Пары диэтилового эфира используются в качестве анестетика, поскольку при вдыхании они вызывают потерю сознания.
- Поскольку валентный угол C–O–C простых эфиров составляет около 110 ∘ , дипольные моменты двух связей C–O не компенсируются. В результате эфиры полярны, но их полярность слабая (для диэтилового эфира =1,18D).
- Реакционная способность простых эфиров ниже, чем у сложных функциональных групп. На них не действуют активные металлы, сильные основания, восстановители и окислители. Наличие алкильной группы, неподеленной пары электронов у атома кислорода и разрыв связи С-О придают простым эфирам их химические характеристики.
Реакции, обусловленные алкильной группой
- Горение: Эфиры чрезвычайно горючи, и при контакте с воздухом они образуют углекислый газ и воду.

C 2 H 5 OC 2 H 5 + 6O 2 → 4CO 2 + 5H 2 O 9003 + 5H 2 O 9003 + 5H 2 O 9003
- + 5H 2 O 9003 + 5H 2 O 9003 + 5H 2 O
- + 5H 2 O OF + 5H 2 O . процесс замещения хлором или бромом в отсутствие солнечного света, приводящий к а-галогенированным эфирам.
Все атомы водорода в эфирах замещаются в присутствии солнечного света.
Реакция на эфирный кислород
- Образование перекиси: Когда эфир вступает в контакт с атмосферным кислородом в присутствии солнечного света, он взаимодействует с кислородом с образованием перекиси эфира из-за присутствия неподеленной пары электронов в эфирном кислороде.
 При нагревании перекись эфира очень нестабильна и сильно взрывается, вызывая серьезные аварии. В результате кипячение пробы эфира, выдержанной длительное время, опасно.
При нагревании перекись эфира очень нестабильна и сильно взрывается, вызывая серьезные аварии. В результате кипячение пробы эфира, выдержанной длительное время, опасно.
- Образование солей оксония: Поскольку простые эфиры могут действовать как слабые основания Льюиса, они могут образовывать соли оксония при растворении в холодных сильных минеральных кислотах, таких как соляная или серная кислота.
Реакции в ароматических эфирах
- Галогенирование: В бензольном кольце фенилалкиловые эфиры подвергаются нормальному галогенированию. Даже в отсутствие катализатора бромида железа (III) анизол проводит бромирование бромом в этановой кислоте. Метоксигруппа активирует бензольное кольцо, что приводит к этой реакции. Пара-изомер получается в качестве основного продукта 90% времени.
- Реакция Фриделя-Крафтса: Процесс Фриделя-Крафтса включает добавление алкильных и ацильных групп в орто- и пара-положениях в анизоле посредством реакций с алкилгалогенидом и ацилгалогенидом в присутствии безводного хлорида алюминия (a кислота Льюиса) в качестве катализатора.

- Нитрование: Орто- и пара-нитроанизолы образуются при взаимодействии анизола с сильными серной и азотной кислотами.
Использование эфиров
- Эфир является растворителем для растворения масла, смолы, бензина, камеди и других материалов.
- Благодаря своей практически инертной природе и высокой растворяющей способности они также используются в качестве реакционных сред для ряда процедур, таких как синтез реактива Гриньяра, реакция Вюрца и т.д.
- Также действует как местный анестетик.
- Также используется для поддержания прохлады.
Примеры вопросов
Вопрос 1: Какова классификация эфира?
Ответ:
Эфиры делятся на две категории в зависимости от наличия углеводородной (арильной или алкильной) цепи на обоих концах атома кислорода: простые или симметричные эфиры и смешанные или асимметричные эфиры.
- Простые или симметричные эфиры образуются, когда углеводородная (арильная или алкильная) цепь, присутствующая на обоих концах атома кислорода, одинакова. СН 3 ОЧ 3 является примером.
- Смешанные или асимметричные эфиры образуются, когда углеводородная (арильная или алкильная) цепь, присутствующая на обоих концах атома кислорода, различна. -CH 3 OC 2 H 5 пример.
Вопрос 2. Почему эфиры растворимы в воде?
Ответ:
Две алкильные группы (R–O–R′) присоединены к концам атома кислорода в эфирах. Из-за своей высокой электроотрицательности кислород ведет себя как акцептор водородной связи и растворяется в воде так же, как спирты.
Вопрос 3: Как превратить спирт в эфир?
Ответ:
Производство эфиров обусловлено катализируемой кислотой дегидратацией первичных спиртов.
Реакция конденсации происходит, когда две молекулы первичного спирта объединяются, образуя одну большую, при этом освобождая крошечную молекулу воды.
Вопрос 4: Почему эфир хранится в бутылке с железной проволокой?
Ответ:
Под воздействием солнечного света эфир сильно реагирует с кислородом окружающей среды, образуя пероксид, который взрывается при нагревании, что приводит к серьезной аварии.
Когда эфир держат в бутылке с железной проволокой, кислород вступает в реакцию с железом с образованием оксида железа, который предотвращает превращение эфира в пероксид. В результате эфир хранится в контейнере с железной проволокой внутри.
Вопрос 5: Для чего используется диэтиловый эфир?
Ответ:
- В нем большей частью растворены масла, жиры, камеди, смолы, полимеры и другие подобные соединения.
- Выполняет функцию хладагента.
- Используется в качестве общего анестетика в хирургии.
- Под торговой маркой Natalite сочетается со спиртом и используется в качестве альтернативы топливу.
Вопрос 6: Каковы физические свойства эфиров?
Ответ:
- В молекуле эфира есть чистый дипольный момент. Это связано с полярностью связи C-O.
- Эфир имеет температуру кипения, аналогичную температуре кипения алканов.
- Эфир смешивается с водой так же, как спирт.
- В воде молекулы эфира смешиваются.
Вопрос 7: Что такое реакция Фриделя-Крафтса?
Ответ:
Процедура Фриделя-Крафтса включает реакцию алкилгалогенида и ацилгалогенида в присутствии безводного хлорида алюминия (кислоты Льюиса) с присоединением алкильных и ацильных групп в орто- и пара-положениях анизола.
Диэтиловый эфир – определение, структура, свойства и применение
Диэтиловый эфир органического соединения состоит из двух атомов углерода, соединенных атомом кислорода (C-O-C).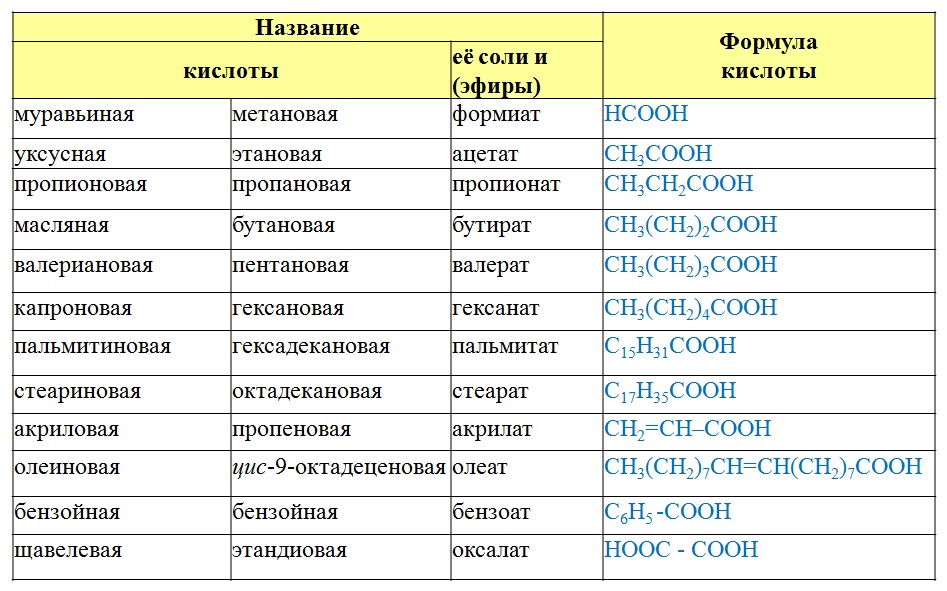 Это бесцветная, легко воспламеняющаяся, легколетучая жидкость с эфирным запахом (сладкий запах). Молекулярная формула диэтилового эфира: $C{{H}_{3}}C{{H}_{2}}OC{{H}_{2}}C{{H}_{3}}$ и название диэтилового эфира ИЮПАК — этоксиэтан.
Это бесцветная, легко воспламеняющаяся, легколетучая жидкость с эфирным запахом (сладкий запах). Молекулярная формула диэтилового эфира: $C{{H}_{3}}C{{H}_{2}}OC{{H}_{2}}C{{H}_{3}}$ и название диэтилового эфира ИЮПАК — этоксиэтан.
Валериус Кордус синтезировал диэтиловый эфир в 1540 году и дал ему название «сладкое масло купороса» (oleum dulce vitrioli), отражающее тот факт, что его получают путем перегонки смеси этанола и серной кислоты. Август Зигмунд Фробениус назвал это вещество «эфиром» в 1729 году. Он часто используется в качестве жидкости для запуска двигателя и в качестве растворителя в лабораториях. До того, как были созданы негорючие лекарства , такие как галотан, он использовался в качестве общего анестетика. В прошлом из него делали опьяняющие рекреационные наркотики.
Структура диэтилового эфира
Диэтиловый эфир , обычно называемый этиловым эфиром, представляет собой химическую молекулу класса эфира с формулой ${{({{C}_{2}}{{H}_{ 5}})}_{2}}O$.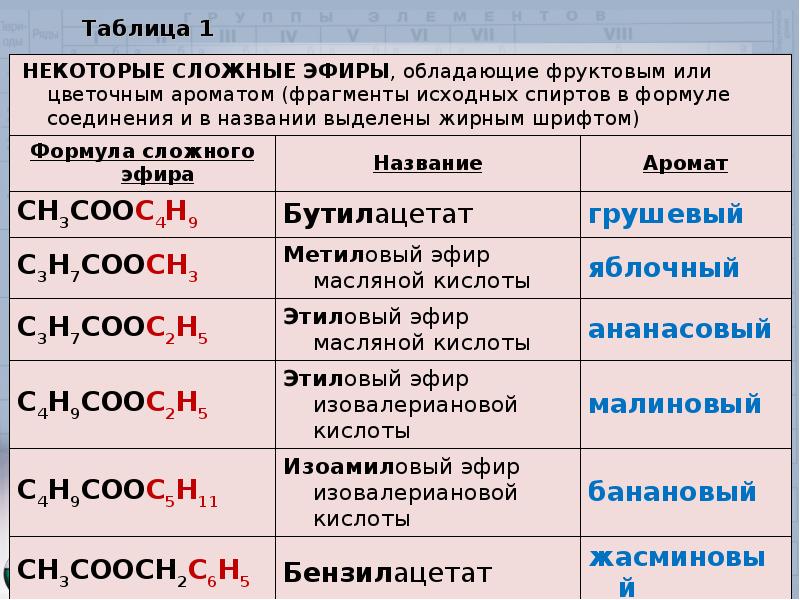 Р-О-Р. Он используется для обозначения диэтилового эфира. Здесь R обозначает алкильную группу (${{C}_{2}}{{H}_{5}}$), а O обозначает атом кислорода.
Р-О-Р. Он используется для обозначения диэтилового эфира. Здесь R обозначает алкильную группу (${{C}_{2}}{{H}_{5}}$), а O обозначает атом кислорода.
Структура диэтилового эфира
Физические свойства диэтилового эфира
Диэтиловый эфир представляет собой бесцветную жидкость с молекулярной массой 74,123 г/моль. 93$, жидкость.
Давление пара составляет 440 мм рт. ст. при 20 °C (58,66 кПа при 20 °C).
Химические свойства диэтилового эфира
${{C}_{2}}{{H}_{5}}O{{C}_{2}}{{H}_{5}} \,+\,6{{O}_{2}}\,\к \,4C{{O}_{2\,}}+\,5{{H}_{2}}O$
${{C}_{2}}{{H}_{5}}O{{C}_{2}}{{H}_{5}}\,+\,C{{l} _{2}}\,\к \,{{C}_{2}}{{H}_{4}}(Cl)O{{C}_{2}}{{H}_{4} }(Cl)$
Получение диэтилового эфира
Диэтиловый эфир получают нагреванием сухого оксида серебра с этилйодидом.

Синтез Вильямсона: Этот процесс включает нагревание этоксида натрия или калия с хлор-, бром- или йодэтаном. Диэтиловый эфир и иодид натрия являются продуктами этой реакции.
${{C}_{2}}{{H}_{5}}ONa\,+\,{{C}_{2}}{{H}_{5}}I\ ,\to \,{{C}_{2}}{{H}_{5}}O{{C}_{2}}{{H}_{5}}\,+\,NaI$
${{C}_{2}}{{H}_{5}}OH\,\xrightarrow[250]{A{{l}_{2}}{{O}_{3}} }\,{{C}_{2}}{{H}_{5}}O{{C}_{2}}{{H}_{5}}\,+\,{{H}_ {2}}
900 000 000 000 $
${{C}_{2}}{{H}_{5}}OH\,+\,{{H}_{2}}S{{O}_{4}}\,+\ ,{{C}_{2}}{{H}_{5}}HS{{O}_{4}}\,+\,{{H}_{2}}O$
${{ C}_{2}}{{H}_{5}}HS{{O}_{4}}\,+\,{{C}_{2}}{{H}_{5}}OH \,\к \,{{C}_{2}}{{H}_{5}}O{{C}_{2}}{{H}_{5}}\,+\,{{ H}_{2}}S{{O}_{4}}$
Опасность диэтилового эфира для здоровья
Легко воспламеняющаяся жидкость и пар, а также может образовывать взрывоопасные перекиси.

Очень вреден при проглатывании, вызывает сонливость, головокружение и может вызвать рвоту.
Продолжительное воздействие эфира может привести к сухости или растрескиванию кожи, а также может нарушить нормальное функционирование почек.
Использование диэтилового эфира
Благодаря высокой летучести и низкой температуре воспламенения диэтиловый эфир с высоким цетановым числом 85–96 используется в качестве пусковой жидкости в сочетании с нефтяными дистиллятами для бензина и дизельного топлива. двигатели.
Химия:
Типичным апротонным растворителем, используемым в лабораториях, является диэтиловый эфир.
Растворяется в воде со скоростью 1,5 г/100 г (1,0 г/100 мл) и имеет низкую растворимость в воде (6,05 г/100 мл при 25 °С). Это делает его идеальным для использования в качестве неполярного растворителя в жидкостно-жидкостной экстракции, наряду с его высокой летучестью.
Это делает его идеальным для использования в качестве неполярного растворителя в жидкостно-жидкостной экстракции, наряду с его высокой летучестью.
В дополнение к другим реакциям, в которых используются металлоорганические реагенты, в реакции Гриньяра они используются в качестве типичного растворителя.Анестезия:
Из-за лучшего терапевтического индекса эфира или большего разрыва между эффективной дозой и потенциально токсичной дозой диэтиловый эфир обычно заменил использование хлороформа в качестве общего анестетика.
Важные вопросы
1. Назовите несколько физических свойств диэтилового эфира.
Ответ: Диэтиловый эфир представляет собой органическое соединение, представляющее собой бесцветную легковоспламеняющуюся и легколетучую жидкость с эфирным запахом с температурой плавления и кипения -116,3 °C и 34,6 °C соответственно.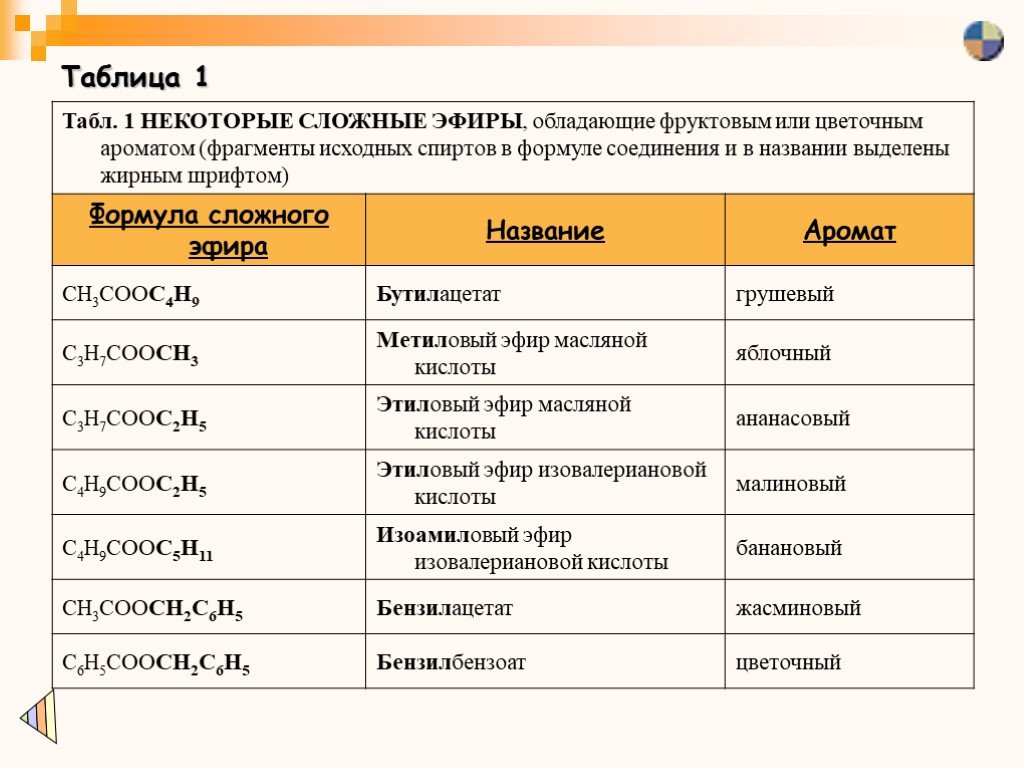
2. Укажите способ получения диэтилового эфира.
Ответ: Диэтиловый эфир можно получить перегонкой высококонцентрированного этилового спирта с серной кислотой при температуре около 140 градусов Цельсия.
Резюме
Этиловый эфир, обычно называемый диэтиловым эфиром, является популярным анестетиком, принадлежащим к большому классу химических соединений, известных как эфиры. Молекулярная формула и название диэтилового эфира по классификации ИЮПАК: $C{{H}_{3}}C{{H}_{2}}OC{{H}_{2}}C{{H}_{3 }}$ и этоксиэтан соответственно. Это бесцветная, легковоспламеняющаяся и легколетучая жидкость с эфирным запахом, температура плавления и кипения которой составляет -116,3 °C и 34,6 °C соответственно. Он обычно используется в качестве лабораторного растворителя, топлива и анестетика.
Практические вопросы
1. Какой из этих терминов не является синонимом диэтилового эфира?
этил эфир
Этоксиэтан
Этоксиметан
Эфир
2.

 Хранится долго, до года, не теряя свой аромат.
Хранится долго, до года, не теряя свой аромат.
 Неустойчив при хранении. В холодильнике через месяц появляется неприятный запах.
Неустойчив при хранении. В холодильнике через месяц появляется неприятный запах.
 В. Практические работы по органическому синтезу. Л.: ЛГУ, 1966г. 373
В. Практические работы по органическому синтезу. Л.: ЛГУ, 1966г. 373
 . К низшим гомологам относятся бесцветные, приятно пахнущие летучие жидкости с характерным запахом эфира.
. К низшим гомологам относятся бесцветные, приятно пахнущие летучие жидкости с характерным запахом эфира. Водородная связь с молекулами воды возможна, потому что атомы кислорода имеют две неподеленные пары электронов.
Водородная связь с молекулами воды возможна, потому что атомы кислорода имеют две неподеленные пары электронов.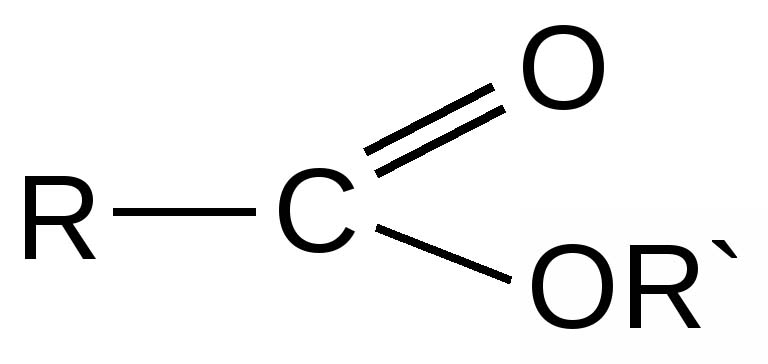 Эфиры состоят из двух типов молекул: неполярной гидрофобной углеводородной цепи и полярного гидрофильного кислородного конца. Растворимость эфира в воде уменьшается по мере увеличения размера алкильной группы. Это связано с неполярной природой углеводородного компонента, препятствующего образованию водородных связей с полярными молекулами воды. Органические растворители, такие как спирты, бензол и ацетон, относительно растворимы в эфирах. Диэтиловый эфир и н-бутиловый спирт, например, растворимы в воде в одинаковой степени. Потому что эфир образует водородную связь с водой так же, как это делает спирт.
Эфиры состоят из двух типов молекул: неполярной гидрофобной углеводородной цепи и полярного гидрофильного кислородного конца. Растворимость эфира в воде уменьшается по мере увеличения размера алкильной группы. Это связано с неполярной природой углеводородного компонента, препятствующего образованию водородных связей с полярными молекулами воды. Органические растворители, такие как спирты, бензол и ацетон, относительно растворимы в эфирах. Диэтиловый эфир и н-бутиловый спирт, например, растворимы в воде в одинаковой степени. Потому что эфир образует водородную связь с водой так же, как это делает спирт. Эфиры плохо растворимы в воде из-за Н-связей и гидрофобных алкильных или арильных групп.
Эфиры плохо растворимы в воде из-за Н-связей и гидрофобных алкильных или арильных групп.
 При нагревании перекись эфира очень нестабильна и сильно взрывается, вызывая серьезные аварии. В результате кипячение пробы эфира, выдержанной длительное время, опасно.
При нагревании перекись эфира очень нестабильна и сильно взрывается, вызывая серьезные аварии. В результате кипячение пробы эфира, выдержанной длительное время, опасно.
 Реакция конденсации происходит, когда две молекулы первичного спирта объединяются, образуя одну большую, при этом освобождая крошечную молекулу воды.
Реакция конденсации происходит, когда две молекулы первичного спирта объединяются, образуя одну большую, при этом освобождая крошечную молекулу воды.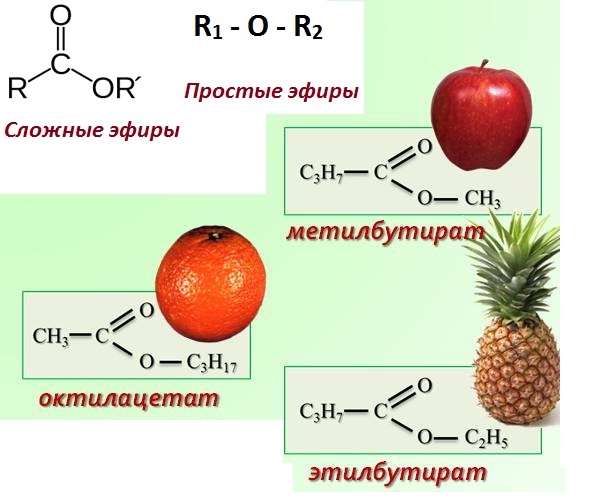

 Это делает его идеальным для использования в качестве неполярного растворителя в жидкостно-жидкостной экстракции, наряду с его высокой летучестью.
Это делает его идеальным для использования в качестве неполярного растворителя в жидкостно-жидкостной экстракции, наряду с его высокой летучестью.