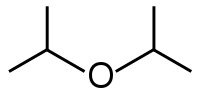
Пластификатор дибутилфталат (ДБФ). Формула дибутиловый эфир
Исследования закрепления органических соединений (октан, октанол-1, дибутиловый эфир) на поверхности золота.
3.1. Октан: молекулярная формула – С8Н18, структурная формула - СН3-(СН2)6-СН3, дипольный момент μ=0. Бесцветная жидкость со слабым запахом, температура плавления – 56,795° С, температура кипения – 125,665° С, он легче воды и в ней не растворяется. Октан является типичным насыщенным углеводородом с открытой углеродной цепью, в которой все атомы углерода соединены друг с другом простыми G-связями и находятся в состоянии sp3 гибридизации, углы между связями 109,5°.
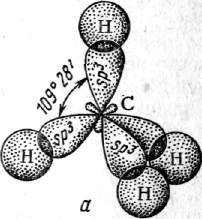
Рис. 6. sp3-гибридизация метана
Химические свойства:
В октане все атомы связаны между собой прочной ковалентной связью. Поэтому при обычных условиях октан, как и все алканы, проявляет чрезвычайно высокую химическую инертность: не вступает в реакции присоединения, не взаимодействует с кислотами и щелочами, сильными окислителями, активными металлами. Основные химические превращения октана будут происходить только при сообщении ему достаточно высокой энергии за счет нагревания, ультрафиолетового облучения и в присутствии катализатора.
1.Радикальное нитрование (реакция Коновалова):
СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН3 + НNО3 =t СН3-СН2-СН2-СН2-СН2-СН-СН3 + Н2О
Октан 2-нитрооктан NО22. Крекинг – радикальный разрыв связей С – С. Протекает при нагревании и в присутствии катализаторов:
С8Н18 = С4Н10 + С4Н8
Бутан Бутилен
3. Окисление. При поджигании на воздухе октан будет гореть с выделением большого количества тепла:
2C8h28 + 25О2 = 16СО2 + 18Н2О
4. Сульфохлорирование – промышленный способ получения сульфокислот:
5. Каталитический риформинг – включает сложные процессы, такме как изомеризация, циклизация, дегидрирование, ароматизация алканов, которые приводят к перестройке углеродного скелета:
СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН3 → СН3-СН2-СН2-СН2-СН2-СН-СН3 2-метилгептан
н-октан
СН3
Данная реакция протекает в присутствии катализатора Al2O3 при температуре 100° С
3.2. Октанол-1(октиловый спирт): молекулярная формула – С8Н17ОН, структурная формула – СН3-(СН2)6-СН2-ОН. Бесцветная жидкость с ароматным запахом. Температура кипения – 195,2° С, температура плавления – 16,3 С, температурные пределы воспламенения 74- 142°С. Октанол-1 является предельным одноатомным спиртом. Атомы углерода находятся в состоянии sp3 гибридизации.

Рис. 7. Модели молекулы этилового спирта
Химические свойства: октанол-1 – это химически активное соединение, вступающее в реакции с разрывом связи R – O – H или R – OH. Разрыв происходит по ионному механизму с образованием органических катионов и анионов.
1. Реакции с щелочными металлами:
2С8Н17-ОН + 2Na = 2C8h27-ONa + h3;
2. Горение:
C8h27OH + 12О2 = 8СО2 + 9Н2О
3. Галогенирование:
C8h27OH + HBr = C8h27Br + h3O
4. Дегидратация (потеря воды):
C8h27OH → С4Н8=С4Н8 + Н2О с присутствием катализатора h3SO4; t0
Октанол-1 можно использовать в качестве пенообразователя или гетерополярного собирателя. Главным структурным элементом определяющим адсорбционные свойства у октилового спирта является функциональная группа –ОН. В этой молекуле наиболее электроотрицателен атом кислорода, поэтому связь О–Н сильно поляризована. Пара электронов смещается к кислороду, который несет частично отрицательный заряд δ- (рис4). В то же время в радикалах электронных пар связи С–Н частично смещены атомы углерода и под их влиянием смещается пара электронов. Это, в свою очередь, несколько уменьшает поляризацию связей ОН.
3.3 Дибутиловый эфир (С4Н9 – О – С4Н9) - простой эфир. Простые эфиры – это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных через атом кислорода: R’– О – R’’, где R’ и R’’ – радикалы, которые могут быть различными и одинаковыми.
Название простых эфиров обычно связано с названием углеродных радикалов, соединенных с кислородом.
Дибутиловый эфир подвижная, крайне огнеопасная бесцветная жидкость с сильным характерным запахом. Температура кипения – 141,97°С, температура плавления – 95,37° С. В воде при температуре 17° С растворяется менее 0,01 %
Химические свойства: Простые эфиры – довольно инертные вещества. В отличие от сложных эфиров они не гидролизуются. На холоде простые эфиры не взаимодействуют с металлическим натрием и большинством разбавленных кислот. Однако концентрированные кислоты (Н2SO4;НI) даже на холоде разлагают эти эфиры, а металлический натрий при нагревании их расширяет:
С4Н9 – О – С4Н9 + Н2SO4 = С4Н9О – SO2 – OС4Н9 + h3O (1. с. 199-202)
Дибутилсульфат
С4Н9 – О – С4Н9 + НI = С4Н9ОН + С4Н9I
С4Н9 – О – С4Н9 + 2Na =t С4Н9ОNa + С4Н9Na
бутилнатрий
Простые эфиры в природе не встречаются, их получают синтетическим путем. Дегидратация спиртов под влиянием минеральных кислот:
Н2SO4
С4Н9ОН + С4Н9ОН С4Н9 – О – С4Н9 - Дибутиловый эфир
– Н2О
Очень ограничено применяют как растворитель, используют также в синтезе гриньяра. Преимущества дибутилового эфира по сравнению с диэтиловым эфиром является меньшая летучесть. При длительном хранении образуют перекиси, в связи, с чем перед применением берут пробу на содержание этих примесей, которые вследствие устраняются встряхиванием с растворами солей двухвалентного железа или с раствором сульфата натрия.
По классификации А. В. Киселева дибутиловый эфир относится к группе В адсорбата.
Дибутиловый эфир можно является также, как и октанол-1 очень эффективным пенообразователем. Главным структурным элементом определяющим адсорбционные свойства у дибутилового эфира является функциональная группа – О –. В этой молекуле наиболее электроотрицателен атом кислорода, поэтому связь –О– с углеводородными радикалами сильно поляризована. Пара электронов смещается к кислороду, который несет частично отрицательный заряд δ- (рис4). В то же время в радикалах электронных пар связи С–Н частично смещены атомы углерода и под их влиянием смещается пара электронов в связи С - О.
ЗАКЛЮЧЕНИЕ
В данной курсовой работе было подробно рассмотрено золото, а также флотационные реагенты, применяемые в процессе флотационного извлечения этого благородного металла. Было установлено, что из всех известных реагентов-собирателей, наиболее распостранены для флотации золота – ксантогенаты и дитиофосфаты, а среди пенообразователей – сосновое масло, Т-66, Т-80, ОПСБ.
Без понимания адсорбционных свойств невозможен правильный и грамотный подбор реагентов. В процессе изучения адсорбционных способностей поверхности золота – выяснили, что адсорбция реагентов происходит путем химической адсорбции.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Гумилевский С.А., Киршов В.М. Кристаллография и минералогия. Москва: «Высшая школа», 1972.
2. Виноградов А.Н. Металлы и минералы. Ростов-на-Дону: «Феникс», 2004.
3. Паддефет Р. Химия золота. Москва: «Мир», 1982.
4. Соболевский В.И. Благородные металлы. Золото. Москва: «Знание», 1970.
5. Хан. Г.А., Габриелова Л.И. Флотационные реагенты и их применение. Москва: «Недра», 1986.
6. Гольман А.М., Дмитриева И.Л. Флотационные реагенты. Москва: «Наука», 1986.
7. Дуденков С.В., Шафеев Э.Ш. Флотореагентщик. Москва: «Недра», 1968.
8. Полькин С.И. Обогащение руд и россыпей редких и благородных металлов. Москва: «Недра», 1987.
9. Абрамов А.А. Переработка, обогащение и комплексное использование полезных ископаемых. Т2. Москва: МГГУ, 2004.
10. Бочаров В.А., Игнаткина В.А. Технология обогащения полезных ископаемых. Т1, Т2. Москва: «Руда и металлы», 2007.
11. Горлова О.Е., Фадеева Н. В. Химия флотореагентов. Магнитогорск: МГТУ им. Г. И. Носова, 2007.
infopedia.su
Дибутиловый эфир | ЗАО Химсервис
Описание
Дибутиловый эфир (бутиловый эфир) - это бесцветная жидкость, обладающая специфическим запахом. В воде практически нерастворим, но хорошо растворяется во всех органических растворителях.
Применение
Применяют бутиловый эфир в комплексе кремний-фторорганических производств в качестве сырья. Применяется также как растворитель для органических синтезов.
Техника безопасности
Дибутиловый эфир относится к четвертому классу опасности для человека; он способен раздражать слизистые оболочки глаз, верхних дыхательных путей; сильно раздражает кожу, через которую способен проникать в организм; оказывает наркотическое воздействие на человека.
Взрывоопасные перекисные соединения дибутиловый эфир образует при хранении на свету; по этой причине недопустима перегонка дибутилового эфира досуха, так как при этом концентрируются перекисные соединения и появляется опасность взрыва.
Дибутиловый эфир - легковоспламеняющаяся жидкость, температура вспышки которой составляет 25 градусов, а температура самовоспламенения - 160. загорание эфира ликвидируется пеной или тонкораспыленной водой.
Анализы выполняются в вытяжном шкафу при работающей вентиляции; все помещения, в которых проходят работы с бутиловым эфиром, должны оборудоваться приточно-вытяжной вентиляцией, функционирующей непрерывно. Местные отсосы устанавливаются в местах повышенного выделения эфира в воздух.
При работе с веществом применяются индивидуальные средства защиты, например, противогаз (марка А и БКФ), герметично закрытые очки (тип Г), резиновые перчатки, непромокаемый фартук, спецодежда, нарукавники, резиновые сапоги, головной убор.
Если имеет место отравление парами эфира, пострадавшего нужно вывести на свежий воздух, согреть тело грелками, напоить крепким чаем либо кофе. При потере сознания чередуют ингаляции кислорода и карбогена. Немедленное обильное промывание водой рекомендуется при поражении бутиловым эфиром глаз или при его попадании на кожу.
При попадании на одежду ее следует немедленно снять и смыть эфир с тела мыльной водой, а одежду, предварительно замочив в мыльной воде, выстирать.
Место случайного розлива эфира засыпается опилками, которые затем собираются в специальную тару и отправляются на уничтожение; место розлива обрабатывается большим количеством воды.
Транспортировка
Транспортируется автомобильным, морским и железнодорожным транспортом в крытом и открытом транспорте. Масса (брутто) ящика не должна превышать 8 кг.
Условия и гарантийный срок хранения
При хранении продукта не допускают попадания прямых солнечных лучей; хранят бутиловый эфир в крытых складских помещениях, предназначенных для огнеопасных веществ. Гарантийный срок хранения дибутилового эфира составляет 4 месяца с момента изготовления.
chem-service.com
Пластификатор дибутилфталат (ДБФ)
Дибутилфталат (ДБФ) представляет собой дибутиловый эфир фталевой кислоты. Это вещество производят согласно требованиями ГОСТ 8728-88 «Пластификаторы. Технические условия». ДБФ может маркироваться на иностранном сырье как DBP. Формула этого вещества - C16h32O4.
Физические характеристики и свойства ДБФ
ДБФ пластификатор имеет маслянистую и жидкую консистенцию. Цвет этого вещества отличается легким желтым оттенком. Его практически невозможно растворить водой, но он прекрасно растворяется с помощью этанола, бензина, различных спиртов или ацетона.
Также хорошую среду для полного растворения обеспечивают органические растворители. Температура кипения ДБФ составляет 340 °С. Это вещество не имеет сильной вязкости.
Пластификаторы по своей природе:
- • совместимы с полимерами,
- • имеют низкую степень летучести,
- • не имеют характерного запаха,
- • химически инертные вещества,
- • нетоксичные.

Вся группа пластификаторов во всем мире разделяется на:
- • фталаты бутилового спирта, ДБФ,
- • фталаты октилового спирта, ДОФ,
- • фталаты спирта С9 и С10 и др. эфиры.
Основные сферы применения
Пластификатор ДБФ дибутилфталат находит свое применение в сфере производства пластмасс. Его используют в процессе изготовления:
- • лакокрасочной продукции,
- • поливинилхлорида,
- • эфиров целлюлозы,
- • полиакрилатов,
- • полиуритановых герметиков,
- • нитрильного каучука,
- • искусственных пленочных материалов (различного полиэтилена),
- • линолеума,
- • поливинилацетатных соединений,
- • кабельного пластиката,
- • искусственной смолы,
- • резины,
- • «холодного» фарфора.
Добавление дибутилфтала обусловлено тем, что он увеличивает износостойкость материала, предотвращает появление трещин, улучшает внешний вид изделия, придает блеск, увеличивает прочность.
Сорта ДБФ
Из-за такого разнообразного круга применений, это вещество разделяют на три сорта:
- • высший,
- • первый,
- • второй.
Высший сорт ДБФ используют для производства материалов из поливинилхлорида. Сорт данного пластификатора считается одним из самых востребованных, так как его добавляют в продукцию, которая должна иметь высокую стойкость к свету. Его добавляют в состав неокрашенных пластиков.
Первый сорт применяют для полимерной продукции, которая подвергается покраске в светлые тона. Это вещество можно увидеть в составе искусственной кожи, лакокрасочной продукции.

Второй сорт предназначен для полимеров, которые подвергаются окрашиванию в темные тона.
Основная функция этого пластификатора – это добавить готовой продукции большей эластичности. Дибутилфталат применяют для приготовления смол. Готовая продукция, имеющая в своем составе этот компонент, сохраняет изначальную форму, но в тоже время, она может быть гибкой и эластичной. На таком материале не появляются сколы или трещины.
Также отдельного внимания требует ДБФ, когда его вводят в состав эпоксидной смолы. Содержание дибутилфталата не должно превышать 10% от общей массы с эпоксидной смолой. При добавлении ДБФ снижается уровень вязкости смолы, поэтому в качестве наполнителя еще используют вещества, в состав которых, входит каолин, мел или белая сажа.
Значительное добавление пластификатора в состав сырья увеличивает в несколько раз пластичность и упругость готового изделия. Также пластификаторы уместно добавлять в изделия, которые подвергаются частым перепадам температур.
Для большего соединения ДБФ и смолы используют повышение температуры. Такую смесь начинают подогревать до температуры 50–60°С. Только в таком состоянии, пластификатор и смола легко смогут перемешаться. Повышенная температура позволит пластификатору однородно распределиться по всему объему.
Особенности транспортировки и хранения
Согласно стандарту пластификатор ДБФ можно перевозить всеми возможными видами крытого транспорта. Его необходимо ранить в сухих вентилируемых помещениях, где попадание солнечных лучей будет полностью исключено. Для безопасного хранения дибутилфталата в помещении не должна быть повышенная влажность.

Хранить ДБФ пластификатор можно только 6 месяцев, если он разлит в металлическую тару, и1 год, если он перелитый в стеклянную тару.
По стандарту фасовка ДБФ может происходить по: 18 кг и 210 кг. Упаковывают готовый пластификатор в:
- • металлические бочки,
- • полиэтиленовые бочки и канистры,
- • еврокубы.
Производители и стоимость ДБФ
Цена на дибутилфталат значительно отличается из-за сорта, но средняя стоимость этого вещества на розничном рынке составляет 125-220 рублей за 1 кг. Оптовые цены варьируются в приделах 110-115 рублей за 1 кг.
Главными производителями ДБФ в Российской Федерации считаются:
- • ООО ВитаХим,
- • ООО УралХимПласт,
- • ООО ХимПлюс,
- • ООО ВитаРеактив,
- • ООО КурскХим Пром,
- • ЗАО Вектон,
- • ООО Бенефит-Трейд.
Наибольшее количество пластификаторов на данный момент выпускают: Россия, Китай, Япония, Индия, страны Ближнего Востока, США и страны Европы. Последнее время сохраняется тенденция наращивания производства пластификаторов в Китае. И это не случайно, так как эта страна является первой в мире по потреблению пластика. 25% всех полимерных материалов направлено в Китай.
Производство пластификаторов стало одной из самых перспективных сфер деятельности и в Соединенных Штатах Америки. В этой стране потребность в материалах с пластификаторами составляет 15% от мирового объема. Третье место в этом рейтинге занимают страны Европы и Азии.
promplace.ru
Алкилирование спиртов и аминов
Понятие процесса алкилирования. Типы реакций алкилирования: по атому углерода, кислорода, азота.
Алкилирование алкенов алканами и алкенами. Условия протекания и механизмы этих реакций.
Алкилирование ароматических углеводородов. Алкилирующие агенты, катализаторы, условия проведения. Алкилирование аренов как процесс электрофильного замещения. Механизм реакции.
Алкилирование спиртов как процесс нуклеофильного замещения по атому кислорода. Механизм кислотной межмолекулярной дегидратации спиртов. Влияние условий процесса и строения спирта на выход простого эфира.
Алкилирование аммиака и аминов как процесс нуклеофильного замещения по атому азота. Алкилирующие агенты. Условия получения первичных, вторичных и третичных аминов. Основность аминов; факторы, влияющие на эту характеристику. Соли аминов и четвертичных аммониевых оснований.
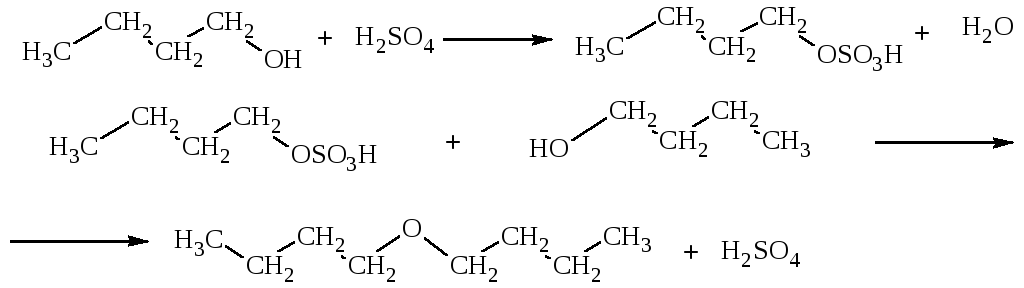
Синтез дибутилового эфира
Уравнения основных реакций:
Реактивы
| н-Бутиловый спирт | 50 г |
Посуда и приборы
| Круглодонная колба | 1 шт. |
| Водоотделитель (ловушка Дина-Старка) | 1 шт. |
| Обратный холодильник с водяным охлаждением | 1 шт. |
| Делительная воронка | 1 шт. |
| Круглодонная колба | 1 шт. |
| Холодильник Либиха с водяным охлаждением | 1 шт. |
| Аллонж | 1 шт. |
| Колба-приемник | 1 шт. |
| Термометр | 1 шт. |
| Электроплитка | 1 шт. |
Выполнение синтеза
В реакционную колбу (рис. В.6) помещают 50 г н-бутилового спирта и 7 см3концентрированной серной кислоты (катализатор). Смесь тщательно перемешивают. Затем колбу присоединяют к водоотделителю и обратному холодильнику, нагревают на воздушной бане (электроплитка) до тех пор, пока в водоотделителе не соберется расчетный объем воды. Реакционную массу переносят в большую колбу, прибавляют 100 см3воды и перегоняют, затем отделяют в делительной воронке от воды (эфир находится в верхнем слое!). Промывают 30 см3насыщенного раствора хлорида кальция для отделения непрореагировавшего спирта (с первичными спиртами хлористый кальций дает кристаллическое молекулярное соединение СаСl2 2С2Н5ОН, которое нерастворимо в простых эфирах), затем еще раз 30 см3воды, отделяют. Высушивают безводным хлористым кальцием и перегоняют (но не досуха, так как эфиры образуют взрывчатые пероксиды!), собирая фракцию с Ткип= 141-144С.
Выход дибутилового эфира 25 г.
Дибутиловый эфир - бесцветная подвижная жидкость, нерастворимая в воде со слабым сладковатым запахом; Ткип= 142,4оС.
Диизоамиловый эфир получают по той же методике из изоамилового спирта, собирая при перегонке фракцию 165-172 оС. Выход 55% от теоретического, Ткип= 172оС.
Техника безопасности.Все простые эфиры при хранении на воздухе быстро накапливают нелетучие пероксиды в результате самоокисления. В ходе перегонки пероксиды концентрируются и в конце ее может произойти сильный взрыв. Поэтому перегонку никогда не ведут «досуха», а долго стоявшие на свету и воздухе простые эфиры необходимо проверять на наличие свободных пероксидов раствором иодида калия (выделение свободного иода вследствие окисленияKIпероксидами).
studfiles.net
50 См3 95% этилового спирта,
51,2 Г бромистого калия,
57,1 См3 98% серной кислоты.
Из уравнения реакции следует, что из 0,43 моль бромида калия (продукт, взятый в недостатке) получается 0,43 моль бромистого этила. Поэтому теоретический выход бромистого этила:
0,43109 = 46,9 г
Ожидаемый выход бромистого этила можно рассчитать по пропорции, учитывая, что по этой методике (стр.18) из 30 г бромистого калия образуется 22 г бромистого этила:
30 22
51,2 Х
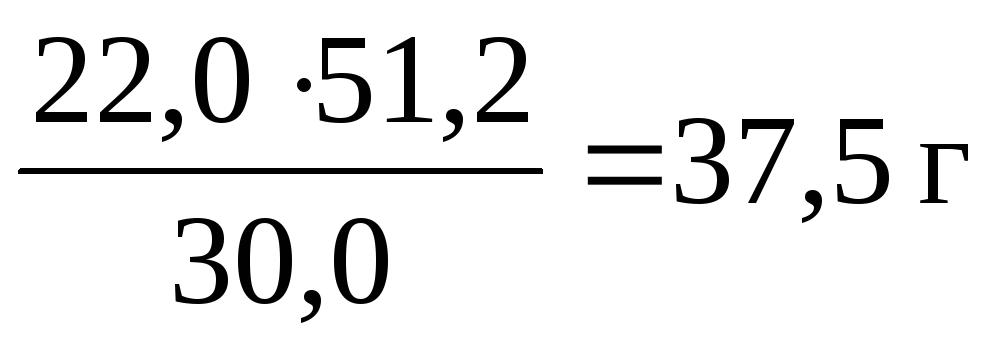
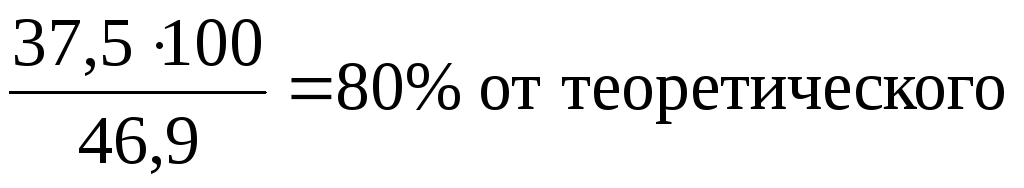
Обратный расчет.
Задание:получить 40 г бромистого этила.
В соответствии с методикой синтез, приводимой на стр.16, аналогично тому, как это делалось в прямом расчете (см. выше), находится мольное соотношение реагирующих веществ.
Мольное соотношение реагентов:
С2Н5ОН :KBr: Н2SО4 = 0,48 : 0,25 : 0,61.
Далее делим все три числа на 0,25 – число молей бромида калия, который в недостатке и получаем новое мольное соотношение: 1,92 : 1,00 : 2,36.
По методике 22 г бромистого этила получают, исходя из 30 г бромистого калия, 40 г – х
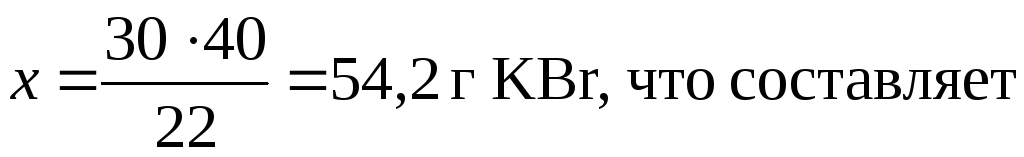
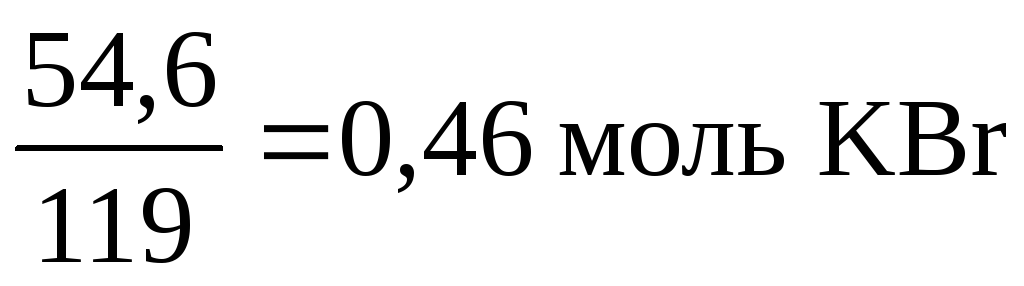
где: 119 - мольная масса бромистого калия.
Если ожидаемый выход по методике указывается в процентах от теоретического (в данной методике выход бромистого этила составляет 80% от теоретического), то находится теоретический выход целевого продукта в граммах:
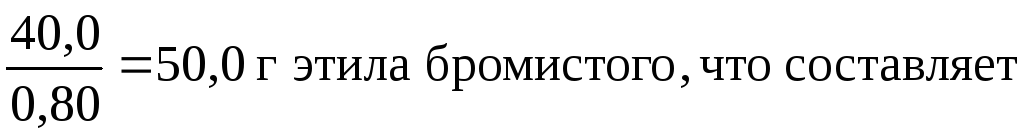
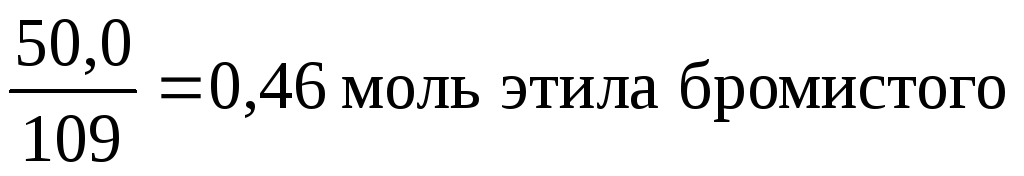
где: 109 - мольная масса бромистого этила, г/моль.
Число моль исходного продукта, который берется в недостатке, в данном случае это бромистый калий, также равно 0,46 моль, что составляет 0,46 119 = 54,6 г КВr.
Используя мольное соотношение реагентов, находим количество этилового спирта и серной кислоты.
Число моль этилового спирта.
0,46 1,92 = 0,88 моль, что составляет 0,88 46 = 40,5 г 100 % спирта,
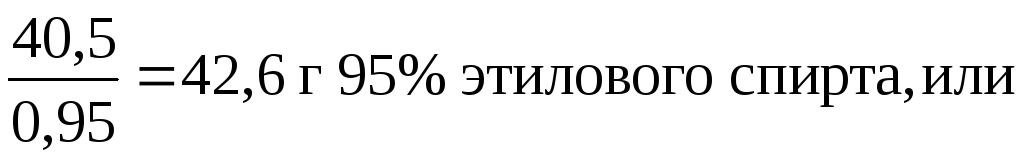
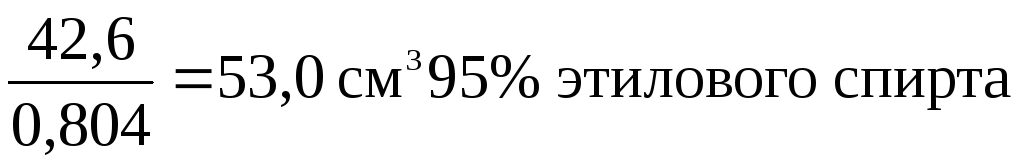
где 46 г – молярная масса, 0,804 – относительная плотность этилового спирта.
Число моль серной кислоты.
0,46 2,36 = 1,09 моль, что составляет 1,09 98 = 106,4 г 100%-ной серной кислоты или
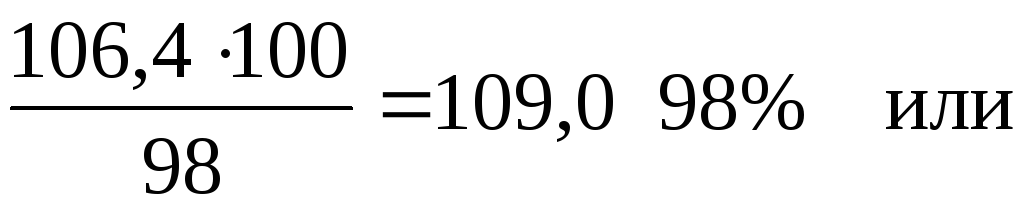
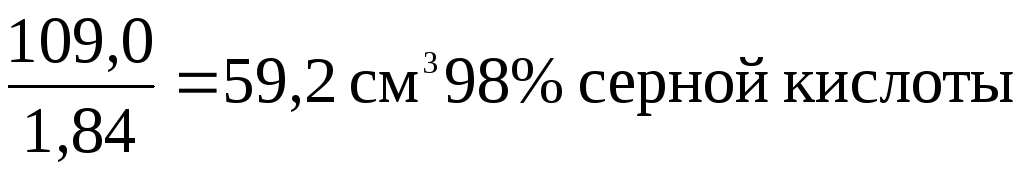
где 98 г - молярная масса, а 1,84 - относительная плотность 98% кислоты.
Таким образом, для получения 40 г бромистого этила необходимо в синтез ввести:
53,0 См 3 95%-ного этилового спирта,
54,6 Г бромистого калия,
59,2 См 3 98%-ной серной кислоты.
Выделение и очистка целевого продукта. Контроль чистоты
В результате экспериментального проведения реакций обычно получается смесь, в состав которой помимо основного вещества могут входить растворители и некоторые количества исходных реагентов и продуктов промежуточных и побочных реакций. Поэтому очередной операцией в синтезе является выделение и очистка целевого соединения. Методы ее осуществления зависят от физических и химических свойств разделяемых веществ. В стандартных синтезах очистка обычно описывается в прописях. Очень часто для разделения органических веществ используются химические методы, которые в результате селективного проведения реакций с отдельными компонентами смеси дают возможность перевести их в соединения, легко удаляемые из реакционной массы. Примером может служить извлечение из органических смесей малорастворимых в воде кислот и оснований с переводом их в водорастворимые соли. Вещества, находящиеся в осадке, обычно отделяют от маточного раствора фильтрованием или центрифугированием. Смеси твердых веществ разделяются кристаллизацией или возгонкой. Различные виды перегонок (простая перегонка, перегонка в вакууме, перегонка с водяным паром, экстрактивная и азеотропная перегонки, ректификация и др.) дают возможность разделять смеси жидких, а иногда и твердых веществ. Различия в растворимости органических соединений используются при выделении и очистке их экстрагированием. Иногда для получения чистых веществ применяют хроматографию (тонкослойную, бумажную, колоночную) и некоторые другие физико-химические методы.
Для удаления остатков воды, которая часто используется как растворитель в синтезе и при разделении и очистке веществ, твердые вещества сушат на воздухе или под вакуумом, в сушильных шкафах при повышенной температуре, в эксикаторах с поглощающими влагу веществами. Широко распространены методы сушки жидкостей при помощи осушающих веществ, связывающих воду. Сушка газов проводится вымораживанием влаги или пропусканием их через слой осушающего агента.
Наиболее простым и удобным способом контроля наличия примесей в полученном соединении является сопоставление его физических констант (температур кипения и плавления, показателя преломления и др.) с их справочными значениями. В случае отсутствия справочных данных о чистоте продукта можно судить по достижению неизменных значений физических констант в процессе многократно повторяемых циклов очистки. Чистота вещества проверяется также спектральными и хроматографическими методами, с помощью химического анализа. При проведении органических синтезов часто бывает достаточным достижение 97-99% чистоты целевого продукта.
studfiles.net
ДБС - дибутилсебацинат
ГОСТ 8728-88 с изм. 1
Уважаемые потребители пластификатора Дибутилсебацинат (ДБС) ГОСТ 8728-88.
Информируем Вас, что ЗАО «Современные химические технологии» с февраля 2012 года серийно производит платификатор Дибутилсебацинат (ДБС) наряду с уже производимыми Диоктилсебацинатом (ДОС) и Диоктиладипинатом (ДОА). В настоящее время Вы можете его приобрести у нас!
Мы приложим все усилия, чтобы сделать Вам предложение, от которого Вы не сможете отказаться.
Спасибо Вам за уделённое нам внимание!
Синонимы
Дибутиловый эфир себациновой кислоты; дибутиловый эфир 1,8-октандикарбоновой кислоты; ДБС.
CAS - номер 109-43-3
Формула: C18h44O4
мол. м. 314,46
Описание
ДБС — сложноэфирный высокоэффективный пластификатор для поливинилхлорида и его сополимеров, поливинилбутираля, простых и сложных эфиров целлюлозы, полистирола, полиакрилатов, каучуков.
Основные характеристики ДБС по ГОСТ
| Внешний вид | Прозрачная жидкость без механических примесей | Соответствует | ГОСТ 8728-88 |
| Цветность по платинокобальтовой шкале, ед. Хазена, не более | 50 | 30 | ГОСТ 18522-73 ГОСТ 8728-88 |
| Плотность при 20°С, г/см3 | 0,934 - 0,938 | 0,936 | ГОСТ 18329-73 |
| Кислотное число, мг КОН/г, не более | 0,04 | 0,03 | ГОСТ 8728-88 |
| Число омыления, мг КОН | 354-359 | 355 | ГОСТ 8728-88 |
| Температура вспышки, °С, не ниже | 183 | 185 | ГОСТ 4333-87 ГОСТ 8728-88 |
ДБС, выпускаемый по ГОСТ 8728-88, представляет собой мало летучую высококипящую жидкость, практически не растворимую в воде, при обычных условиях устойчивую к гидролизу и к воздействию кислорода воздуха. Предельно допустимая концентрация паров пластификатора ДБС в воздухе рабочей зоны производственных помещений составляет 10 мг/м3.
Другие физико-химические показатели
| Температура кипения, °С при давлении Па (мм.рт.ст.): | |
| 1×105 (760) | 345 - 349 |
| Температура застывания, °С | -12 |
| Показатель преломления при 20°С | 1,4410 - 1,4450 |
| Динамическая вязкость при 20°С, 10-3 Па*с: | 7 - 11 |
| Массовая доля летучих веществ при 100°С за 6 ч, % | 0,1 |
| Массовая доля влаги, % | 0,1 |
| Растворимость в воде, % при 20°С | 0,03 |
Применение
ДБС - наиболее используемый пластификатор в производстве упаковочных пленок, резинотехнических изделий. Применяется при изготовлении стекловолокна, пленочных материалов, прокладок для холодильников.
Требование безопасности
Дибутилсебацинат (ДБС) включен в список безопасных веществ, разрешенных к применению при контакте с пищевыми продуктами.
Хранение
ДБС хранят в таре изготовителя или в герметично закрытых алюминиевых емкостях, а также в емкостях из нержавеющей стали. При хранении и транспортировке необходимо принять меры, обеспечивающие защиту от попадания влаги и воздействия прямых солнечных лучей.
Транспортировка
Согласно ГОСТ 19433-88 "Грузы опасные. Классификация и маркировка" ДБС относится к классу 9, подкласс 9.2 (Грузы, обладающие видами опасности, проявление которых предоставляет опасность только при их транспортировании навалом водным транспортом), группа 3.
Специальная маркировка для подкласса 9.2 не требуется.
Согласно "Правил перевозки опасных грузов автомобильным транспортом" (утвержденных Минтрансом РФ 20.06.95г., согласованных с МВД, МЧС, Госстандартом и Минприроды РФ и зарегистрированных в Министерстве юстиции РФ), ДБС относится к классу 9, подкласс 2 – вещества с относительной низкой опасностью при транспортировании.
Для транспортировки не требуется специальное переоборудование подвижного состава автомобильного транспорта, информирование об опасности, и достаточно обычной лицензии на перевозку грузов.
Гарантия производителя
Гарантийный срок хранения пластификатора — 1 год со дня изготовления.
Изготовитель гарантирует соответствие пластификатора требованиям ГОСТ 8728-88 при соблюдении условий транспортировки и хранения.
Поделиться
rpch.ru