Эфир жидкость или газ
Как называется жидкость или в-во при вдохе испарений которого человек теряет сознание?
Эфир. Или хлороформ. Когда-то использовались для анестезии. Есть ещё закись азота - веселящий газ. Но, это уже газ а не жидкость. Кажется, его использовали в фильме "Крах инженера Гарина". Ну, а тряпочка в эфире - вспоминается "Операция «Ы» и другие приключения Шурика " . "А Вы не подскажите, сколько сейчас градусов ниже нуля? " :)
ты решил кого-то усыпить?))
Второй раз объясняю -ЭТО ТОЛЬКО В КИНО БЫВАЕТ! мгновенно и без вреда здоровью .А ты со своими экспериментами попадаешь под статью " УМЫШЛЕННОЕ причинение вреда здоровью" .потому что планируешь "мероприятие" ...
В старину во всех аптеках свободно продавался "эфир для наркоза"... Вот им и усыпляли и животных и людей.. . Теперь он используется только наукой для усыпления мышей и прочей "мелкой живности" и в аптеках его нет...
touch.otvet.mail.ru
Облако- тело, вещество, жидкость, или газ?
Облако - это тело. Имеет достаточно четкие границы. Смотрите определение тела: <a rel="nofollow" href="http://dic.academic.ru/searchall.php?SWord=тело&from=ru&to=xx&submitFormSearch=Найти&stype=0" target="_blank">http://dic.academic.ru/searchall.php?SWord=тело&from=ru&to=xx&submitFormSearch=Найти&stype=0</a>
естественно вещество в виде газа
Скорее тело. Облако это взвесь капелек воды в воздухе.
облако - это облако, а состоит из взвеси мелких капель жидкости.
Туман это. Дисперсная система - капли жидкости в газовой смеси.
нет это не тело, это место, объем пространства с температурой ниже точки росы. при входе в него невидимого водяного пара, он конденсируется и превращается в видимый туман, в котором капельки воды удерживаются от падения восходящими потоками воздуха. при обратном выходе из него видимого тумана, он испаряется и превращается в невидимый водяной пар.
Это тело, все подробности: <a rel="nofollow" href="http://moodle.nci.kz/Books025/OKR3K/м1п2/тело.html" target="_blank">http://moodle.nci.kz/Books025/OKR3K/м1п2/тело.html</a>
touch.otvet.mail.ru
Ответы@Mail.Ru: Сжиженный газ - это все-таки жидкость или газ?
Сжиженный газ представляет собой криогенную жидкость различных газов, преимущественно метана, сохраняющуюся при сверхнизких температурах. <br>Так, в России под термином сжиженный газ часто понимается газ, находящийся под давлением при нормальной температуре. <br><br>
пока жидкий - это жидкость.<br>а если замерзнет так ващще кристалл!
У любого вечества 4 агрегатных состояния кристаллическое, жидкое, газообразное и плазма....так что сжиженный газ это жидкое состояние вещества :-)
Газ, по своему состояни., так же как, например вода может стать паром, то есть атомарной.
Старшина - первогодкам: - Для связи в бою на танках имеется рация.<br>- А рация на микросхемах или на транзисторах?<br>- Для тупых повторяю: рация на танке.<br><br>Ответ: - это сжиженый газ :)
смотря в каком дисперсионном сосоянии он находится, но вообще это газ
Вообще-то постановка вопроса не верна.<br> Как уже отмечалось by Artemka345, какждое вещество в зависимости от условий может находится в одном из 4-х агрегатных состояний. <br>В связи с этим корректно говорить, например, "азот в жидкой фазе" или "жидкий азот". При этом не существенно каким образом вещество переведено в данную фазу. Привычное разделение веществ на твёрды, жидкие и газообразные связяно с тем в какой фазе они находятся при "нормальных условиях" (10^5Па, 20С).
то, что газ называют газом - ни о чем не говорит. просто при нашей обычной температуре такие вещества, как водород, кислород, азот находятся в газообразном состоянии. поэтому их называют газами. вообще-то это просто ВЕЩЕСТВА. сжиженный кислород - это жидкость. сжиженный водород - это тоже жидкость. вода - это тоже по сути сжиженный газ. так как при температуре больше 100 градусов и атмосферном давлении h3O - это газ. и при температуре минус 200 градусов азот можно переливать из банки в банку и плескаться им друг в друга.
Физическое состояние вещества зависит от температуры. и давления. Сжиженный газ -это обычно фракция пропан- бутан или природный газ, то есть почти чистый метан. При обычном диапазоне температур эти вещества могут находится в жидком состоянии при высоком давлении, так что в обычном понятии все-таки это -жидкость
touch.otvet.mail.ru
Что является причиной возникновения выталкивающей силы. Какие силы действуют на тело,находящееся в жидкости или газе?
Закон Архимеда. Природа выталкивающей силы Существование гидростатического давления приводит к тому, что на любое тело, находящееся в жидкости или газе, действует выталкивающая сила. Впервые значение этой силы в жидкостях определил на опыте Архимед. Закон Архимеда формулируется так: на тело, погруженное в жидкость или газ, действует выталкивающая сила, равная весу того количества жидкости или газа, которое вытеснено погруженной частью тела. (Необходимо помнить, что закон Архимеда справедлив только при наличии тяжести. В условиях невесомости он не выполняется. ) На использовании действия архимедовой силы в газах основано воздухоплавание - полеты дирижаблей, аэростатов и т. п. <a rel="nofollow" href="http://www.edu.yar.ru/russian/projects/socnav/prep/phis001/liq/liquid25.html" target="_blank">http://www.edu.yar.ru/russian/projects/socnav/prep/phis001/liq/liquid25.html</a>
Выталкивающая сила зависит от плотности газа/жидкости, от массы тела Силы действующие на тело, находящееся в жидкости или газе - архимедова сила, сила тяжести.
touch.otvet.mail.ru
Kvant. Газ-жидкость — PhysBook
Кикоин А.К. Газ превращается в жидкость (Из истории физики) //Квант. — 1984. — № 11. — С. 25-27.
По специальной договоренности с редколлегией и редакцией журнала "Квант"
Долгое время единственным известным науке газом был атмосферный воздух, который к тому же считался чем-то вроде элемента, составной части всего существующего. И лишь во второй половине XVIII века усилиями многих химиков было установлено, что существуют и другие газы, что сам воздух — это смесь различных по своей природе и свойствам газов. Впрочем слово «газ» тогда не было в употреблении. То, что мы теперь называем газом, тогда называлось «воздухом». Водород — это горючий воздух, кислород — огненный воздух, азот — удушливый воздух, аммиак — щелочной воздух и т. д.
Но в конце XVIII века химики, и прежде всего французский химик Антуан Лавуазье, сумели разобраться в новом своем газовом «хозяйстве». Лавуазье дал всем 20 известным в то время газам имена. Он же предложил слово «газ» в качестве общего наименования всего этого класса веществ. Лавуазье впервые ввел и представление об агрегатных состояниях вещества.
Как превратить газ в жидкость?
О возможности превращения газа в жидкость Лавуазье высказал такую идею: «... Если бы мы могли поместить Землю в некую весьма холодную область, например в атмосферу Юпитера или Сатурна, то... воздух, или по крайней мере некоторые его компоненты, перестал бы быть невидимым и превратился в жидкость. Превращение такого рода открыло бы возможность получения новых жидкостей, о которых мы до сих пор не имеем никакого понятия».
Это было догадкой выдающегося химика, догадкой пророческой. Но нашлась и другая возможность.
Вместо охлаждения — сжатие
В 1792 году нидерландский физик Ван Марум пытался выяснить, справедлив ли закон Бойля — Мариотта («Физика 9», с. 45) для аммиака (ведь и Бойль и Мариотт открыли этот закон, исследуя воздух!). Для этого Ван Марум сжимал аммиак в цилиндре и измерял его давление, которое при этом, естественно, росло. Но неожиданно при давлении около 7 атмосфер (1 атм ≈ 105 Па) давление газа перестало расти, несмотря на то, что объем его продолжал уменьшаться. При этом в сосуде появился жидкий аммиак.
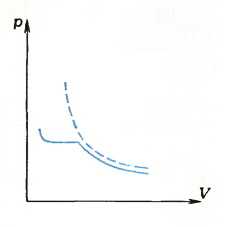
Рис. 1
На рисунке 1 сплошной линией показана полученная Ван Марумом зависимость давления газа от объема. Штриховой линией показана зависимость р от V, соответствующая закону Бойля — Мариотта; так вел бы себя воздух. Различие между воздухом и аммиаком разительное. Уже при сравнительно малом давлении в сосуде с аммиаком появляется жидкость и, конечно, насыщенный пар над ней.
Следовательно, насыщенный пар можно получить не только испаряя жидкость в закрытом сосуде («Физика 9», с. 79), но и сжимая газ, конечно, тоже в закрытом сосуде. Опыт Ван Марума показывал как будто бы, что для сжижения газа охлаждение не обязательно, его можно заменить сжатием, повышением давления.
Изобретатель сирены нагревает жидкость

Рис. 2
В 1822 году французский физик Каньяр де Латур, известный как изобретатель сирены и автор многочисленных исследований колебаний струны, опубликовал статью, в которой описал опыты с нагреванием жидкостей (спирта, эфира, воды) сначала в запаянном стальном сосуде (сделанном из пушечного ствола), а затем в запаянных толстостенных стеклянных трубках (в стальном сосуде ничего не видно!). Он заметил, что с повышением температуры уровень жидкости в сосуде сначала слегка понижается (жидкость испаряется), а затем повышается (жидкость при нагревании расширяется), при некоторой же температуре граница между жидкостью и паром над ней внезапно исчезает (рис. 2). Отсюда Каньяр де Латур сделал вывод, что при температуре выше той, при которой изчезает граница, вещество в жидком состоянии не может существовать — возможно только газообразное состояние.
Чтобы снова получить жидкость, вещество нужно охладить. Каньяр де Латур и в самом деле для многих веществ наблюдал восстановление границы жидкость — пар при охлаждении трубки. Только для воды он не смог увидеть исчезновение границы — еще до этого лопались трубки.
За дело берется Фарадей
Одним из немногих, кто понял работу Каньяра де Латура как указание на то, что для сжижения газа требуется не только сжатие его, но и охлаждение, был английский физик Майкл Фарадей. Уже в 1823 году он сумел превратить в жидкость хлор. Через 20 лет, в 1844 году, он снова вернулся к работе по сжижению газов. Действуя и охлаждением и повышением давления, Фарадей сумел сжижить сероводород, двуокись углерода, серный ангидрид. Правда некоторые газы, такие, как кислород, азот, водород, упорно не поддавались сжижению. Некоторые исследователи, считавшие, что для сжижения газа достаточно одного давления, подвергали эти газы действию все более высоких давлений. Но тщетно — даже казавшееся в то время чудовищным давление в 3000 атмосфер не принесло успеха. За этими газами прочно укрепилась «репутация» несжижаемых, и их стали называть «постоянными» газами.
Охлаждение обязательно
Однако все больше ученых склонялись к мысли, что для каждого вещества существует такая температура, выше которой оно может находиться только в газообразном состоянии. Так думал Фарадей. К такой же мысли в 1860 году пришел Д. И. Менделеев, который назвал эту температуру абсолютной точкой кипения.
Окончательную ясность в этот вопрос внес английский физик Томас Эндрюс. В 1869 году он опубликовал результаты своих многолетних опытов. Как и Ван Марум, Эндрюс изучал поведение газа при уменьшении его объема и увеличении давления. Но если Ван Марум провел опыт только при комнатной температуре, то Эндрюс проводил опыты при самых разных температурах.
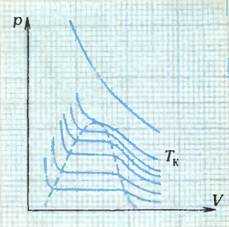
Рис. 3
На рисунке 3 сплошными линиями показаны кривые, полученные Эндрюсом. Он тоже наблюдал появление жидкости при давлениях, которым соответствуют горизонтальные участки кривых. Но с увеличением температуры эти давления постепенно повышались, а ширина горизонтальных участков становилась все меньше, пока при некоторой температуре, обозначенной на рисунке 3 через Tк, горизонтальный участок на кривой не исчезал совсем. При этом исчезала и граница между жидкостью и паром — то, что наблюдал еще Каньяр де Латур.
Выше этой температуры, названной Эндрюсом критической температурой, вещество жидким быть не может. Жидкость и насыщенный пар над ней могут наблюдаться лишь в той области давлений и объемов, которая на рисунке 3 ограничена штриховой линией. Если же температура газа выше Tк, то для его сжижения обязательно охлаждение.
После работы Эндрюса стало ясно, что и «постоянные» газы вовсе не постоянны. Просто их критические температуры много ниже комнатных. С этого времени борьба за сжижение «постоянных» газов превратилась в борьбу за получение низких температур. Потребовалось еще 40 лет, прежде чем удалось сжижить все без исключения газы. Так в 1877 году были сжижены азот (Tк = 126,3 К) и кислород (Tк = 154,8 К). В 1898 году был получен жидкий водород (Tк = 33,2 К). Еще через 10 лет, в 1908 году, был превращен в жидкость последний газ — гелий (Tк = 5,2 К). Этим было положено начало развитию одной из важнейших областей физической науки — физики низких температур.
Таким образом, для веществ, обычно известных нам как газообразные, комнатная температура выше их критической температуры. Поэтому они и газообразны. Наоборот, для веществ, которые мы привыкли считать жидкими, комнатная температура ниже их критических температур. У воды, например, критическая температура равна 647,3 К (374,3 °С). Поэтому на Земле вода жидкая. На Венере, планете горячей (температура на поверхности Венеры около 480 °С), рек и морей, похожих на земные, быть не может, даже если бы там и существовало вещество, молекулы которого имели бы состав Н2О.
www.physbook.ru
какие из тел твердые тела жидкости или газы обладают наименьшей теплопроводностью ? почему?
Газы, т. к. их плотность самая меньшая. Малекулы находятся дальше друг от друга, реже соприкасаются. Из-за этого процесс термонасыщения происходит медленнее, и теплопроводность падает...
газы, из-за плотности
Наименее плотные, ибо теплопроводность - это способность молекул, атомов в-ва передавать друг другу энергию (колебания)
Чем меньше плотность, тем меньше теплопроводность! У газов - наименьшая, а у металлов наибольшая. Но у металлов оне еще зависит от особенностей кристаллич. решетки и подвижностиэлектронов.
Газы однозначно, расстояние между молекулами больше.
Газы. Количество вещества (и масса) в единице объёма мала.
А вот неоднозначно. Теплопроводность газов РАЗНАЯ, и зависит от массы факторов. Даже для одного и того же газа она зависит ещё и от давления. Причём в некотором диапазоне давлений чем оно выше (то есть больше плотность газа и меньше длина свободного проблега молекул) , тем теплопроводность МЕНЬШЕ. Что, замечу, идёт вразрез с большинством заявлений. В некоторых установках для теплоотвода вообще используется ВОДОРОД именно из-за своей ВЫСОКОЙ теплопроводности и теплоёмкости. Так что я б сказал, что теплопроодность минимальна у жидкостей, потому что у них меньше длина свободного пробега молекул. Но в любом случае резкой границы нет, она размыта. Запросто можно создать условия, когда теплопроводность газа будет ещё ниже, чем у любой наперёд взятой жидкости, равно как и наборот.
touch.otvet.mail.ru
Скажите что такое газ? А то мне задали написать в тетрадь о газе
Газ (газообразное состояние) (от греч. χάος — хаос) — агрегатное состояние вещества, характеризующееся очень слабыми связями между составляющими его частицами, (молекулами, атомами или ионами) , а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда) . Некоторые частные случаи * Идеальный газ — газ, в котором взаимодействие между молекулами сводится к парным столкновениям, причём время межмолекулярного столкновения много меньше среднего времени между столкновениями. Идеальный газ является простейшим модельным объектом молекулярной физики. * Реальный газ — газ, в котором учитывается взаимодействие между молекулами. Уравнение состояния реального газа часто строится методами теории возмущений, при этом отличие от уравнения состояния идеального газа описывается набором вириальных коэффициентов. * Газ ван-дер-Ваальса — частный случай реального газа с достаточно простым модельным уравнением состояния. Важнейшим свойством газа ван-дер-Ваальса является существование в такой простой модели фазового перехода газ-жидкость. * Частично или полностью ионизованный газ называется плазмой. Также газом часто кратко называют природный газ. Этимология Слово «газ» (голл. gas) было придумано в начале XVII века голландским естествоиспытателем Я. Б. ван Гельмонтом (Jean Baptiste van Helmont), для обозначения полученного им «мёртвого воздуха» (углекислого газа) . Согласно, Я. И. Перельману, Гельмонт писал: «Такой пар я назвал газ, потому что он почти не отличается от хаоса древних» . Согласно В. Вундту, звуковой строй этого слова целиком определяется смысловыми отголосками тех терминов и выражений, которые для учёного сознания того времени обозначали родственные идеи и образы. По мнению Вундта, прежде всего Гельмонт думал, что открытый им газ напоминает первобытный хаос. Кроме того, на Гельмонта действовало представление слова blas (ср. немецкое blasen), которое он употреблял для обозначения холодного воздуха, исходящего из звёзд. Наконец, сюда же примешивалась мысль о слове Geist, соответствующем латинскому spiritus, так как газ, под которым Гельмонт подразумевал, главным образом, углекислоту, по латыни передавался через spiritus silvestris («лесной дух») . Некоторые подозревают воздействие немецкого gasen — «кипеть» . В России для обозначения газов М. В. Ломоносов употреблял термин «упругие жидкости» , но он не прижился. Электрический ток в газах Газ в ионизированном состоянии способен проводить электрический ток. Основных способа ионизации газа два: термическая ионизация и ионизация электрическим ударом. Кроме того, существует так называемый самостоятельный электрический разряд (пример - Молния).
Газ-это агрегатное состояние вещества, расстояние между молекулами которого очень велико, притяжение между молекулами мало, расстояние между молекулами во много раз больше самих молекул, занимает любой предоставленный объем. =)
Газ (газообразное состояние) (от нидерл. gas, восходит к др. -греч. χάος) — одно из четырёх агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Так же термин «газ» можно определить как вещество, температура которого равна или превышает критическую точку, при такой температуре сжатие газа не приводит к образованию жидкости. В этом и заключается отличие газа от пара. При повышении давления насыщенный пар частично превращается в жидкость, газ нет. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма [1] и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда).
Газ-это агрегатное состояние вещества, расстояние между молекулами которого очень велико, притяжение между молекулами мало, расстояние между молекулами во много раз больше самих молекул, занимает любой предоставленный объем.;)
мне надо знать что такое нефть . Цвет блеск твердость плавает в воде пропускает воду притягивается к магниту .
touch.otvet.mail.ru














