Содержание
Диэтиловый эфир — щавелевая кислота
Cтраница 3
Иногда образуется эмульсия, которая долго не расслаивается и затрудняет отделение слоя диэтилового эфира щавелевой кислоты. Соединенные эфирные вытяжки промывают водой и сушат хлористым кальцием. Затем, отогнав диэтиловый эфир на водяной бане, перегоняют диэти-ловый эфир щавелевой кислоты.
[31]
Иногда образуется эмульсия, которая долго не расслаивается и затрудняет отделение слоя диэтилового эфира щавелевой кислоты. Соединенные эфирные вытяжки промывают водой и сушат хлористым кальцием. Затем, отогнав диэтиловый эфир на водяной бане, перегоняют диэтиловый эфир щавелевой кислоты.
[32]
Смесь 200 г пятихлористого фосфора с 142 г ( 1 моль) диэтилового эфира щавелевой кислоты нагревают в течение 10 час. Дихлор-атоксиуксусный эфир, перегоняющийся без разложения под уменьшенным давлением, снова несколько раз перегоняют с колонкой под обычным давлением с небольшим количеством металлической платины до достижения постоянной температуры кипения. Данные о температуре кипения хлораНгидрида моноэтилоксалата несколько расходятся. В нашей лаборатории обычно температура кипения была несколько ниже. При получении через моноэтиловый эфир щавелевой кислоты получают самое большее 36 % от теории. Та к как приготовление моноэфира затруднительно и цены на пятихлористый фосфор и80С12 также довольно высоки, описанный способ во всяком случае кажется заслуживающим предпочтения.
Данные о температуре кипения хлораНгидрида моноэтилоксалата несколько расходятся. В нашей лаборатории обычно температура кипения была несколько ниже. При получении через моноэтиловый эфир щавелевой кислоты получают самое большее 36 % от теории. Та к как приготовление моноэфира затруднительно и цены на пятихлористый фосфор и80С12 также довольно высоки, описанный способ во всяком случае кажется заслуживающим предпочтения.
[33]
Иногда образуется эмульсия, которая долго не расслаивается и затрудняет отделение слоя диэтилового эфира щавелевой кислоты. Соединенные эфирные вытяжки промывают водой и сушат хлористым кальцием. Затем, отогнав диэтиловый эфир на водяной бане, перегоняют диэти-ловый эфир щавелевой кислоты.
[34]
Иногда образуется эмульсия, которая долго не расслаивается и затрудняет отделение слоя диэтилового эфира щавелевой кислоты. Соединенные эфирные вытяжки промывают водой и сушат хлоридом кальция. Затем, отогнав диэтиловый эфир на водяной бане, перегоняют диэтиловый эфир щавелевой кислоты.
[35]
Иногда образуется эмульсия, которая долго не расслаивается и затрудняет отделение слоя диэтилового эфира щавелевой кислоты. Соединенные эфирные вытяжки промывают водой и сушат хлористым кальцием. Затем, отогнав диэтиловый эфир на водяной бане, перегоняют диэтиловый эфир щавелевой кислоты.
[36]
Иногда образуется эмульсия, которая долго не расслаивается и затрудняет отделение слоя диэтилового эфира щавелевой кислоты. Соединенные эфирные вытяжки промывают водой и сушат хлористым кальцием. Затем, отогнав диэтиловый эфир на водяной бане, перегоняют диэти-ловый эфир щавелевой кислоты.
[37]
Оксамид, или полный амид щавелевой кислоты, ШМОС-CONh3 легко образуется при действии аммиака на диэтиловый эфир щавелевой кислоты.
[38]
Оксамид, или полный амид щавелевой кислоты, h3NOC — CONh3 легко образуется при действии аммиака аа диэтиловый эфир щавелевой кислоты.
[39]
Оксамид, или полный амид щавелевой кислоты, HjNOC — CONh3 легко образуется при действии аммиака на диэтиловый эфир щавелевой кислоты.
[40]
В качестве таких ацилирующих агентов часто применяются этиловый эфир муравьиной кислоты, этиловый эфир бензойной кислоты, диэтиловый эфир щавелевой кислоты.
[41]
В связи с этим нами были проведены исследования по разработке методов синтеза производных 1 2 4-триазиндиона — 5 6 на основе доступного сырья — диэтилового эфира щавелевой кислоты ( диэтилоксалата) с азотсодержащими соединениями, определению их химических и биологических свойств.
[42]
К хорошо охлаждаемому спиртовому раствору этилата натрия, полученному растворением 23 г натрия в 550 см3 абсолютного спирта, прибавляют смесь 58 г ацетона и 146 г диэтилового эфира щавелевой кислоты. Вскоре начинает выделяться натриевая соль, которую через 24 часа отфильтровывают. Затем натриевую соль смешивают с ледяной водой и разлагают прибавлением небольшого избытка разбавленной серной кислоты. Продукт извлекают эфиром и эфирную вытяжку высушивают.
[43]
К хорошо охлаждаемому спиртовому раствору этилата натрия, полученному растворением 23 г натрия в 550 см3 абсолютного спирта, прибавляют смесь 58 г ацетона и 146 г диэтилового эфира щавелевой кислоты.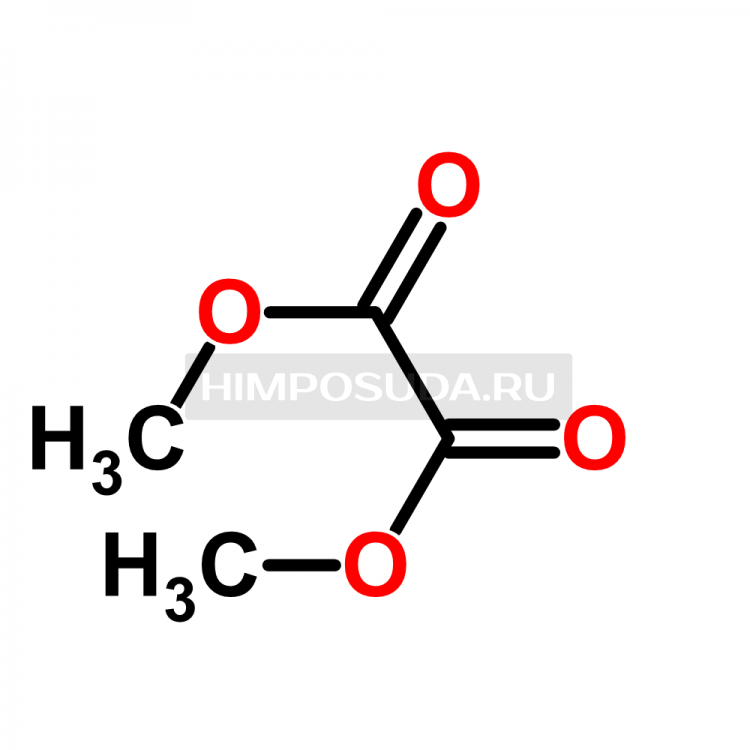 Вскоре начинает выделяться натриевая соль, которую через 24 часа отфильтровывают. Затем натриевую соль смешивают с ледяной водой и разлагают прибавлением небольшого избытка разбавленной серной кислоты. Продукт извлекают эфиром и эфирную вытяжку высушивают. Остаток посл § отгонки эфира перегоняют в вакууме, причем получают чистый этиловый эфир ацетилпиро.
Вскоре начинает выделяться натриевая соль, которую через 24 часа отфильтровывают. Затем натриевую соль смешивают с ледяной водой и разлагают прибавлением небольшого избытка разбавленной серной кислоты. Продукт извлекают эфиром и эфирную вытяжку высушивают. Остаток посл § отгонки эфира перегоняют в вакууме, причем получают чистый этиловый эфир ацетилпиро.
[44]
Когда весь металлический натрий растворится, раствор охлаждают до 25 — 30 и при перемешивании мешалкой из капельной воронки в реакционную колбу вводят непрерывной струей 49 9 г диэтилового эфира щавелевой кислоты, после чего немедленно приливают 56 s этилового эфира фенилук-сусиой кислоты. Реакционная масса постепенно загустевает и через 15 — 20 мин.
[45]
Страницы:
1
2
3
4
Фуллерен увеличил каталитическую активность меди в реакции гидрирования
Химики из Китая смогли в разы увеличить каталитическую активность меди в реакции получения этиленгликоля. Они модифицировали медный катализатор фуллереном, который умеет принимать и отдавать электронную плотность. Благодаря этому стабильность и активность медного катализатора увеличилась, пишут ученые в Science.
Они модифицировали медный катализатор фуллереном, который умеет принимать и отдавать электронную плотность. Благодаря этому стабильность и активность медного катализатора увеличилась, пишут ученые в Science.
Химическая промышленность производит 42 миллиона тонн этиленгликоля в год. Его используют в качестве растворителя, компонента охлаждающих жидкостей для автомобилей и для синтеза полиэтилентерефталата (PET). Большую часть этиленгликоля получают окислением и последующим гидратированием этилена. Но это можно делать и по-другому. Например, гидрировать метиловый эфир щавелевой кислоты (диметилоксалат), который химики умеют получать из синтез-газа.
Гидрирование диметилоксалата проводят с помощью медного катализатора, нанесенного на диоксид кремния. При этом для успешного синтеза необходимо поддерживать давление водорода в 20–30 атмосфер, иначе реакция не идет. Таким методом удается провести гидрирование с максимальным выходом всего в 10 процентов из-за быстрого разрушения катализатора. Поэтому химики пытаются найти более стабильные каталитические системы для синтеза этиленгликоля.
Поэтому химики пытаются найти более стабильные каталитические системы для синтеза этиленгликоля.
Юань Ючжу (Yuan Youzhu) и его коллеги из Сямэньского университета попробовали увеличить активность уже известного катализатора на основе меди для получения этиленгликоля. Они предположили, что медный катализатор будет разрушаться медленнее в присутствии вещества, способного принимать на себя электронную плотность и в нужный момент отдавать ее обратно. В качестве такого вещества химики решили использовать фуллерен. Он состоит из шарообразных молекул по 60 атомов углерода в каждой.
Сначала авторы приготовили образцы катализатора. Они смешали нитрат меди (II) с фуллереном (10 массовых процентов) в 28-процентном растворе аммиака в воде, а затем прилили к смеси суспензию диоксида кремния. После этого смесь гомогенизировали с помощью ультразвука и 8 часов нагревали — сначала в масляной бане, а потом на воздухе при 350 градусах Цельсия. В результате получился катализатор, который химики охарактеризовали с помощью электронной микроскопии и твердотельной ЯМР-спектроскопии.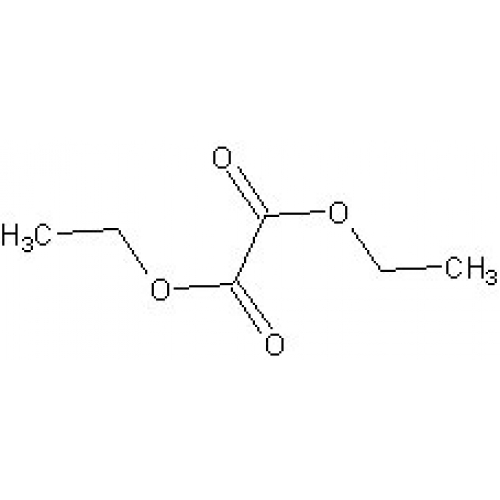 Катализатор состоял из наночастиц меди размером в 3 нанометра, на поверхности которых адсорбировались молекулы фуллерена.
Катализатор состоял из наночастиц меди размером в 3 нанометра, на поверхности которых адсорбировались молекулы фуллерена.
Чтобы протестировать свой катализатор, химики провели реакцию гидрирования диметилоксалата. Сначала они смешали их катализатор с диметилоксалатом и нагрели при давлении водорода в 30 атмосфер. К удивлению химиков, им удалось получить почти количественный выход продукта — 96,2 процента. Более того, когда химики снизили давление водорода до атмосферного, выход повысился до 98 процентов.
Далее химики провели такой же синтез с килограммовой загрузкой исходного диметилоксалата. Давления водорода в три атмосферы хватило, чтобы выход продукта достиг 98 процентов. Кроме того, даже после 1000 часов реакции, катализатор сохранил свою первоначальную активность.
Чтобы исследовать роль фуллерена в катализе, химики провели эксперименты по циклической вольтамперометрии. Она позволяет детектировать процессы окисления и восстановления, то есть переноса электронов от атомов и обратно. В эксперименте с медным катализатором без фуллерена на вольтамперограмме химики обнаружили четыре пика. Они соответствовали четырем переносам электронов от атомов меди и обратно. Но в присутствии фуллерена часть пиков исчезла. Из этого следовало, что молекулы фуллерена выступали буфером электронов: они принимали на себя электронную плотность при окислении меди, и отдавали ее при восстановлении. При этом ток не достигал электродов, и поэтому не возникло пиков на вольтамперограмме. Так, химики сделали вывод, что фуллерен стабилизировал катализатор, периодически принимая на себя лишнюю электронную плотность.
В эксперименте с медным катализатором без фуллерена на вольтамперограмме химики обнаружили четыре пика. Они соответствовали четырем переносам электронов от атомов меди и обратно. Но в присутствии фуллерена часть пиков исчезла. Из этого следовало, что молекулы фуллерена выступали буфером электронов: они принимали на себя электронную плотность при окислении меди, и отдавали ее при восстановлении. При этом ток не достигал электродов, и поэтому не возникло пиков на вольтамперограмме. Так, химики сделали вывод, что фуллерен стабилизировал катализатор, периодически принимая на себя лишнюю электронную плотность.
В результате китайским химикам удалось довести выход синтеза этиленгликоля из диметилоксалата до 98 процентов при атмосферном давлении водорода. Также они смогли разобраться в неожиданном эффекте от добавки фуллерена в катализатор. Авторы считают, что благодаря этому открытию синтез этиленгликоля и другие реакции восстановления можно будет проводить эффективнее и дешевле.
Металлические катализаторы часто теряют активность, когда окисляются кислородом воздуха. Но в случае меди этот процесс можно предотвратить. Ранее мы рассказывали, как химики приготовили устойчивые к окислению медные пленки.
Но в случае меди этот процесс можно предотвратить. Ранее мы рассказывали, как химики приготовили устойчивые к окислению медные пленки.
Михаил Бойм
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
свойства диэтилового эфира щавелевой кислоты
свойства диэтилового эфира щавелевой кислоты — SpringerMaterials
Вы превысили максимально допустимое количество слов в поисковом запросе (30). Уточните запрос и повторите попытку.
Профиль вещества
-
Молекулярная формула:
С 6 Н 10 О 4
-
Элементная система:
С-Н-О
-
КАС-РН:
95-92-1
-
ИнЧИ:
InChI=1S/C6h20O4/c1-3-9-5(7)6(8)10-4-2/h4-4h3,1-2h4
-
Ключ ИнЧИ:
WYACBZDAHNBPPB-UHFFFAOYSA-N
Просмотр трехмерной интерактивной структуры
Исследуйте это вещество
Просмотреть все 16 документов
Свойства, появляющиеся с
диэтиловый эфир щавелевой кислоты
точка кипения
химический сдвиг
плотность
диамагнитная восприимчивость
диэлектрическая постоянная
тепло сублимации
форма линии
магнитная восприимчивость
оптический коэффициент
показатель преломления
звукопоглощение
распространение звука
скорость звука
поверхностное натяжение
коэффициент теплового расширения
точка кипения
химический сдвиг
плотность
диамагнитная восприимчивость
диэлектрическая постоянная
тепло сублимации
форма линии
магнитная восприимчивость
оптический коэффициент
показатель преломления
звукопоглощение
распространение звука
скорость звука
поверхностное натяжение
коэффициент теплового расширения
давление газа
вязкость
Химические свойства + синтез
-
Молекулярный вес:
146.
 1426
1426 -
Расчетный журнал P:
0,262
-
Вращающиеся облигации:
7
-
Н акцепторы:
2
-
H Доноры:
0
-
Реакции с этим веществом в качестве реагента:
1314
-
Реакции, в которых это вещество является продуктом:
18
-
Журнальные статьи, содержащие это вещество:
395
-
Патенты, содержащие это вещество:
128
-
Другие публикации, содержащие это вещество:
17
-
Поставщики:
ABCR, ASDI, Acros, Alfa Aesar, ChemPacific, ChemiK, Enamine, Oakwood, RareChem, Sigma-Aldrich, VWR
Данные SPRESIweb
3D интерактивная структура
smsid_mpvudcbtkxwunyaq
Щавелевая кислота, 2-этилгексилоктиловый эфир
Кат. № № | OT56860000 |
| CAS. № | NA |
| Молекулярная формула | C 18 H 34 O 4 |
| Molecular Weight | 314.46 g/mol |
| Synonyms | 2-ethylhexyl octyl oxalate |
| Chemical Name | Oxalic acid, 2- ethylhexyl octyl сложный эфир |
| Категория | Исследовательские химикаты |
| Статус товара на складе | В наличии |
Вышеупомянутый продукт
НЕТ В НАЛИЧИИ! Вы хотите получать уведомления, когда
доступный?
Запросить предложение
Купить 2-этилгексилоктиловый эфир щавелевой кислоты от Simson Pharma Limited по лучшей конкурентоспособной цене.

 1426
1426