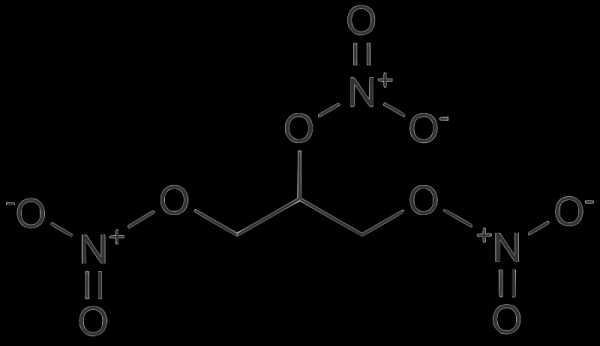
Синтез изобутилового эфира уксусной кислоты реакцией этерификации (стр. 3 из 6). Эфир изобутиловый уксусной кислоты
Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
Практическое применение
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии h3SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Способ 2. Получение на катионитовых катализаторах
н-Бутил- и изобутилацетат очень широко используются в качестве растворителей и в ряде синтезов. Как известно, синтез сложных эфиров проводится в присутствии минеральных кислот в качестве катализаторов, используемых только однократно, что приводит к большому расходу воды при промывании.
При применении катионитов этот недостаток исключается; кроме того, в меньшей степени идут побочные процессы, в частности, образование непредельных соединений.
Схема синтеза
Характеристика основного сырья
Бутиловый спирт, ч., ГОСТ 6006—51 или 5980—51. Изобутиловый спирт, ч., ГОСТ 6016—51. Уксусная кислота, ч, ГОСТ 61—51. Катионит КУ-2, ГОСТ 5696—51.
Условия получения
Синтез веществ проводят в трехгорлой колбе с механической мешалкой, термометром и обратным холодильником с водоотделительной насадкой. Нагревание производят на глицериновой или масляной бане, температуру которой поддерживают контактным термометром.
В колбу загружают 17 г катионита в Н-форме (см. примечание 1), 74,86 г (1,01 М) н- или изобутилового спирта, 60,06 г (1 М) уксусной кислоты и нагревают. По достижении 98° начищает выделяться вода (воду, собравшуюся во флорентине, сливают с таким расчетом, чтобы к концу синтеза она оставалась заполненной водой почти полностью). Перед завершением реакции температура повышается для н-бутилацетата ~ до 115°, для изобутилацетата —110°. Реакцию ведут до выделения примерно 98—99% воды (17,7—17,8 мл) так как кроме реакции этерификации три накоплении эфира, идет дегидратация сложного эфира с образованием непредельных соединений и кислоты. Синтез веществ с н-бутиловым спиртом заканчивается за 45—50 минут, а с изобутиловым спиртом за 60—62 минуты (см. примечание 2). Затем реакционную смесь охлаждают, отделяют катализат от катионита декантацией, пропускают через колонку с анионитом АВ—17 или АВ—16 в ОН-форме, либо нейтрализуют 18—20%-ным раствором соды до слабощелочной реакции и промывкой водой до нейтральной реакции. Далее катализат подвергают разгонке на ректификационной колонке с эффективностью 10 теоретических тарелок.
Первую фракцию н-бутилацетата собирают до 122° с выходом 8,9—9 г, она состоит примерно из 51—52% спирта и 48—49% бутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 122 —127°/745 мм. Его выход составляет 106,8—106,9 г (или 92% от теоретического по кислоте) с содержанием бутилацетата не менее 99% и кислотностью не более 0,05%.
Первую фракцию изобутилацетата собирают до 110° с выходом 6,5—8 г, она состоит также примерно из 51—52% спирта и 48—49% изобутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 110—1157745 мм. Его выход составляет 108—110,3 г (или 93—95% от теоретического по кислоте) с содержанием изобутилацетата не менее 99,0% и кислотностью не более 0,05%.
Первые фракции с учетом содержания спирта и эфира снова используются в синтезе или повторной разгонке, последнее менее желательно.
Примечания:
1. При расчете количество катионита лучше выражать не в процентах по отношению к спирту или кислоте, а в граммах на грамм-моль гидроксильных или карбоксильных групп. Эти данные для сравнения более реальны и не меняются в зависимости от колебания молекулярного веса кислоты или спирта. В данном случае необходимо 17 г катиоинита КУ-2 на 1 грамм-моль гндроксильных (17 г) или карбоксильных (45 г) групп. Если синтез вести с избытком 0,25 М спирта, то достаточно уже 10 г катионита и реакция заканчивается примерно в два раза быстрее. Следует также отметить, что первые два-три синтеза протекают несколько дольше.
2. Необходимо заметить, что скорость образования эфиров из спиртов изостроения заметно медленнее, то есть продолжительность реакции зависит от прямой и обратной скорости диффузии внутри зерна ионообменной смолы реагирующих веществ и образовавшихся продуктов. Это наблюдалось также на примере образования н-амил- и изоамилацетата, н-бутил- и изобутил-, н-амил- и изоамилсалицилатов.
Способ 3. На ионообменных катализаторах
Существующий метод получения эфиров уксусной кислоты основан на действии уксусного ангидрида или уксусной кислоты на соответствующие спирты в присутствии серной кислоты. Возможность побочных процессов, трудность очистки от не вступившего в реакцию спирта являются недостатками метода гомогенного кислотного катализа.
В последнее время разработан метод получения некоторых эфиров уксусной кислоты этерификацией уксусной кислоты соответствующими спиртами в присутствии ионообменной смолы КУ-2.
Использование ионитов как катализаторов реакции этерификации позволяет применить эквивалентные количества реагирующих веществ, что значительно облегчает очистку готового продукта.
Схема синтеза
Характеристика основного сырья
Уксусная кислота, техн., ГОСТ 7077—54, изобутиловый спирт техн., ТУ МХП 1704—47, ионообменная смола КУ-2, ВТУ ГХПК М-661—55, используется без предварительной обработки.
Условия получения
В круглодонную колбу емкостью 1 л, снабженную мешалкой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°.
Выход чистого продукта составляет 470 г или 67,5% от теоретического; 1,390; - 0,8710. По литературным данным, —1,39066; —0,8712.
3. Литературный поиск. Сольволиз
Сольволитические методы составляют самую большую группу методов синтеза сложных эфиров, поскольку все производные кислот так или иначе способны к взаимопревращениям. По уменьшению относительной реакционной способности эти производные располагаются в следующий ряд: хлорангидрид > ангидрид кислоты > > сложный эфир > амид, нитрил > соль. Можно ожидать, что сложные эфиры, находящиеся в середине этого ряда, легко будут образовываться из хлорангидридов или ангидридов кислот, существовать в равновесии с другими эфирами (в условиях кислотного катализа) и с несколько большим трудом образовываться из амидов и солей. Получение эфиров из солей облегчается, если при этом происходит выделение или осаждение нерастворимой неорганической соли. Короче говоря, сложные эфиры могут быть получены из кислот (реакция этерификации), а также из соединений пяти других приведенных выше типов. Кроме того, для синтеза сложных эфиров можно применять и другие исходные вещества, например кетены — соединения, родственные ангидридам, и 1,1,1-тригалоген-замещенные или а-дигалогензамещенные простые эфиры, имеющие ту же степень окисления, что и сложные эфиры. Единственным в своем роде методом получения является рассмотренный пример пиролиза медных солей, при котором происходит необычная ориентация.
Из карбоновых кислот (реакция этерификации)
RCOOH + R'OH = RCOOR' + Н2О
продолжениеСинтез изобутилового эфира уксусной кислоты реакцией этерификации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
“СИНТЕЗ ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ”
Курсовая работа
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
1. Введение
1.1.Общие сведения
1.2.Практическое применение
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Способ 2. Получение на катионитовых катализаторах
Способ 3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1.Из карбоновых кислот (реакция этерификации)
3.2.Из хлорангидридов кислот
3.3.Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5.Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6.Из нитрилов
3.7.Из сложных эфиров и спиртов (реакция переэтерификации)
3.8.Из лактонов и спиртов (реакция переэтерификации)
3.9.Из сложных эфиров и кислот (реакция переэтерификации)
3.10.Из солей при взаимодействии с алкилгалогенидами
3.11.Из солей и кислот и других алкилирующих агентов
3.12.Из медных солей
3.13.Из тетраалкиламмоиевых солей
3.14.Из амидов
3.15.Из тригалогензамещенных
3.16.Из дигалогензамещенных простых эфиров
3.17.Из карбоновых кислот и дивинилртути
3.18.Механизм реакции этерификации
4.Выводы
Список литературы
1. Введение
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии h3 SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
Способ 1 . Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Способ 2. Получение на катионитовых катализаторах
н-Бутил- и изобутилацетат очень широко используются в качестве растворителей и в ряде синтезов. Как известно, синтез сложных эфиров проводится в присутствии минеральных кислот в качестве катализаторов, используемых только однократно, что приводит к большому расходу воды при промывании.
При применении катионитов этот недостаток исключается; кроме того, в меньшей степени идут побочные процессы, в частности, образование непредельных соединений.
Схема синтеза
Характеристика основного сырья
Бутиловый спирт, ч., ГОСТ 6006—51 или 5980—51. Изобутиловый спирт, ч., ГОСТ 6016—51. Уксусная кислота, ч, ГОСТ 61—51. Катионит КУ-2, ГОСТ 5696—51.
Условия получения
Синтез веществ проводят в трехгорлой колбе с механической мешалкой, термометром и обратным холодильником с водоотделительной насадкой. Нагревание производят на глицериновой или масляной бане, температуру которой поддерживают контактным термометром.
В колбу загружают 17 г катионита в Н-форме (см. примечание 1), 74,86 г (1,01 М) н - или изобутилового спирта, 60,06 г (1 М) уксусной кислоты и нагревают. По достижении 98° начищает выделяться вода (воду, собравшуюся во флорентине, сливают с таким расчетом, чтобы к концу синтеза она оставалась заполненной водой почти полностью). Перед завершением реакции температура повышается для н-бутилацетата ~ до 115°, для изобутилацетата —110°. Реакцию ведут до выделения примерно 98—99% воды (17,7—17,8 мл) так как кроме реакции этерификации три накоплении эфира, идет дегидратация сложного эфира с образованием непредельных соединений и кислоты. Синтез веществ с н-бутиловым спиртом заканчивается за 45—50 минут, а с изобутиловым спиртом за 60—62 минуты (см. примечание 2). Затем реакционную смесь охлаждают, отделяют катализат от катионита декантацией, пропускают через колонку с анионитом АВ—17 или АВ—16 в ОН -форме, либо нейтрализуют 18—20%-ным раствором соды до слабощелочной реакции и промывкой водой до нейтральной реакции. Далее катализат подвергают разгонке на ректификационной колонке с эффективностью 10 теоретических тарелок.
Первую фракцию н-бутилацетата собирают до 122° с выходом 8,9—9 г, она состоит примерно из 51—52% спирта и 48—49% бутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 122 —127°/745 мм. Его выход составляет 106,8—106,9 г (или 92% от теоретического по кислоте) с содержанием бутилацетата не менее 99% и кислотностью не более 0,05%.
Первую фракцию изобутилацетата собирают до 110° с выходом 6,5—8 г, она состоит также примерно из 51—52% спирта и 48—49% изобутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 110—1157745 мм. Его выход составляет 108—110,3 г (или 93—95% от теоретического по кислоте) с содержанием изобутилацетата не менее 99,0% и кислотностью не более 0,05%.
Первые фракции с учетом содержания спирта и эфира снова используются в синтезе или повторной разгонке, последнее менее желательно.
Примечания:
1. При расчете количество катионита лучше выражать не в процентах по отношению к спирту или кислоте, а в граммах на грамм-моль гидроксильных или карбоксильных групп. Эти данные для сравнения более реальны и не меняются в зависимости от колебания молекулярного веса кислоты или спирта. В данном случае необходимо 17 г катиоинита КУ-2 на 1 грамм-моль гндроксильных (17 г) или карбоксильных (45 г) групп. Если синтез вести с избытком 0,25 М спирта, то достаточно уже 10 г катионита и реакция заканчивается примерно в два раза быстрее. Следует также отметить, что первые два-три синтеза протекают несколько дольше.
2. Необходимо заметить, что скорость образования эфиров из спиртов изостроения заметно медленнее, то есть продолжительность реакции зависит от прямой и обратной скорости диффузии внутри зерна ионообменной смолы реагирующих веществ и образовавшихся продуктов. Это наблюдалось также на примере образования н-амил- и изоамилацетата, н-бутил- и изобутил-, н-амил- и изоамилсалицилатов.
Способ 3. На ионообменных катализаторах
Существующий метод получения эфиров уксусной кислоты основан на действии уксусного ангидрида или уксусной кислоты на соответствующие спирты в присутствии серной кислоты. Возможность побочных процессов, трудность очистки от не вступившего в реакцию спирта являются недостатками метода гомогенного кислотного катализа.
В последнее время разработан метод получения некоторых эфиров уксусной кислоты этерификацией уксусной кислоты соответствующими спиртами в присутствии ионообменной смолы КУ-2.
Использование ионитов как катализаторов реакции этерификации позволяет применить эквивалентные количества реагирующих веществ, что значительно облегчает очистку готового продукта.
Схема синтеза
Характеристика основного сырья
Уксусная кислота, техн., ГОСТ 7077—54, изобутиловый спирт техн., ТУ МХП 1704—47, ионообменная смола КУ-2, ВТУ ГХПК М-661—55, используется без предварительной обработки.
Условия получения
В круглодонную колбу емкостью 1 л, снабженную мешалкой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°.
mirznanii.com
Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
“СИНТЕЗ ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ”
Курсовая работа
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
1. Введение
1.1. Общие сведения
1.2. Практическое применение
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Способ 2. Получение на катионитовых катализаторах
Способ 3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1. Из карбоновых кислот (реакция этерификации)
3.2. Из хлорангидридов кислот
3.3. Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5. Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6. Из нитрилов
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)
3.8. Из лактонов и спиртов (реакция переэтерификации)
3.9. Из сложных эфиров и кислот (реакция переэтерификации)
3.10. Из солей при взаимодействии с алкилгалогенидами
3.11. Из солей и кислот и других алкилирующих агентов
3.12. Из медных солей
3.13. Из тетраалкиламмоиевых солей
3.14. Из амидов
3.15. Из тригалогензамещенных
3.16. Из дигалогензамещенных простых эфиров
3.17. Из карбоновых кислот и дивинилртути
3.18. Механизм реакции этерификации
4.Выводы
Список литературы
1. Введение
1.1. Общие сведения
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
1.2. Практическое применение
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии h3SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
2. Синтезы изобутилацетатаСпособ 1. Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Способ 2. Получение на катионитовых катализаторах
н-Бутил- и изобутилацетат очень широко используются в качестве растворителей и в ряде синтезов. Как известно, синтез сложных эфиров проводится в присутствии минеральных кислот в качестве катализаторов, используемых только однократно, что приводит к большому расходу воды при промывании.
При применении катионитов этот недостаток исключается; кроме того, в меньшей степени идут побочные процессы, в частности, образование непредельных соединений.
Схема синтеза
Характеристика основного сырья
Бутиловый спирт, ч., ГОСТ 6006—51 или 5980—51. Изобутиловый спирт, ч., ГОСТ 6016—51. Уксусная кислота, ч, ГОСТ 61—51. Катионит КУ-2, ГОСТ 5696—51.
Условия получения
Синтез веществ проводят в трехгорлой колбе с механической мешалкой, термометром и обратным холодильником с водоотделительной насадкой. Нагревание производят на глицериновой или масляной бане, температуру которой поддерживают контактным термометром.
В колбу загружают 17 г катионита в Н-форме (см. примечание 1), 74,86 г (1,01 М) н- или изобутилового спирта, 60,06 г (1 М) уксусной кислоты и нагревают. По достижении 98° начищает выделяться вода (воду, собравшуюся во флорентине, сливают с таким расчетом, чтобы к концу синтеза она оставалась заполненной водой почти полностью). Перед завершением реакции температура повышается для н-бутилацетата ~ до 115°, для изобутилацетата —110°. Реакцию ведут до выделения примерно 98—99% воды (17,7—17,8 мл) так как кроме реакции этерификации три накоплении эфира, идет дегидратация сложного эфира с образованием непредельных соединений и кислоты. Синтез веществ с н-бутиловым спиртом заканчивается за 45—50 минут, а с изобутиловым спиртом за 60—62 минуты (см. примечание 2). Затем реакционную смесь охлаждают, отделяют катализат от катионита декантацией, пропускают через колонку с анионитом АВ—17 или АВ—16 в ОН-форме, либо нейтрализуют 18—20%-ным раствором соды до слабощелочной реакции и промывкой водой до нейтральной реакции. Далее катализат подвергают разгонке на ректификационной колонке с эффективностью 10 теоретических тарелок.
Первую фракцию н-бутилацетата собирают до 122° с выходом 8,9—9 г, она состоит примерно из 51—52% спирта и 48—49% бутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 122 —127°/745 мм. Его выход составляет 106,8—106,9 г (или 92% от теоретического по кислоте) с содержанием бутилацетата не менее 99% и кислотностью не более 0,05%.
Первую фракцию изобутилацетата собирают до 110° с выходом 6,5—8 г, она состоит также примерно из 51—52% спирта и 48—49% изобутилацетата. Вторую фракцию, представляющую собой эфир, собирают при 110—1157745 мм. Его выход составляет 108—110,3 г (или 93—95% от теоретического по кислоте) с содержанием изобутилацетата не менее 99,0% и кислотностью не более 0,05%.
Первые фракции с учетом содержания спирта и эфира снова используются в синтезе или повторной разгонке, последнее менее желательно.
Примечания:
1. При расчете количество катионита лучше выражать не в процентах по отношению к спирту или кислоте, а в граммах на грамм-моль гидроксильных или карбоксильных групп. Эти данные для сравнения более реальны и не меняются в зависимости от колебания молекулярного веса кислоты или спирта. В данном случае необходимо 17 г катиоинита КУ-2 на 1 грамм-моль гндроксильных (17 г) или карбоксильных (45 г) групп. Если синтез вести с избытком 0,25 М спирта, то достаточно уже 10 г катионита и реакция заканчивается примерно в два раза быстрее. Следует также отметить, что первые два-три синтеза протекают несколько дольше.
2. Необходимо заметить, что скорость образования эфиров из спиртов изостроения заметно медленнее, то есть продолжительность реакции зависит от прямой и обратной скорости диффузии внутри зерна ионообменной смолы реагирующих веществ и образовавшихся продуктов. Это наблюдалось также на примере образования н-амил- и изоамилацетата, н-бутил- и изобутил-, н-амил- и изоамилсалицилатов.
Способ 3. На ионообменных катализаторах
Существующий метод получения эфиров уксусной кислоты основан на действии уксусного ангидрида или уксусной кислоты на соответствующие спирты в присутствии серной кислоты. Возможность побочных процессов, трудность очистки от не вступившего в реакцию спирта являются недостатками метода гомогенного кислотного катализа.
В последнее время разработан метод получения некоторых эфиров уксусной кислоты этерификацией уксусной кислоты соответствующими спиртами в присутствии ионообменной смолы КУ-2.
Использование ионитов как катализаторов реакции этерификации позволяет применить эквивалентные количества реагирующих веществ, что значительно облегчает очистку готового продукта.
Схема синтеза
Характеристика основного сырья
Уксусная кислота, техн., ГОСТ 7077—54, изобутиловый спирт техн., ТУ МХП 1704—47, ионообменная смола КУ-2, ВТУ ГХПК М-661—55, используется без предварительной обработки.
Условия получения
В круглодонную колбу емкостью 1 л, снабженную мешалкой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°.
Выход чистого продукта составляет 470 г или 67,5% от теоретического; ~ 1,390; - 0,8710. По литературным данным, —1,39066; —0,8712.
3. Литературный поиск. СольволизСольволитические методы составляют самую большую группу методов синтеза сложных эфиров, поскольку все производные кислот так или иначе способны к взаимопревращениям. По уменьшению относительной реакционной способности эти производные располагаются в следующий ряд: хлорангидрид > ангидрид кислоты > > сложный эфир > амид, нитрил > соль. Можно ожидать, что сложные эфиры, находящиеся в середине этого ряда, легко будут образовываться из хлорангидридов или ангидридов кислот, существовать в равновесии с другими эфирами (в условиях кислотного катализа) и с несколько большим трудом образовываться из амидов и солей. Получение эфиров из солей облегчается, если при этом происходит выделение или осаждение нерастворимой неорганической соли. Короче говоря, сложные эфиры могут быть получены из кислот (реакция этерификации), а также из соединений пяти других приведенных выше типов. Кроме того, для синтеза сложных эфиров можно применять и другие исходные вещества, например кетены — соединения, родственные ангидридам, и 1,1,1-тригалоген-замещенные или а-дигалогензамещенные простые эфиры, имеющие ту же степень окисления, что и сложные эфиры. Единственным в своем роде методом получения является рассмотренный пример пиролиза медных солей, при котором происходит необычная ориентация.
3.1. Из карбоновых кислот (реакция этерификации)
RCOOH + R'OH= RCOOR' + Н2О
Реакция этерификации — один из самых обычных методов, применяемых для синтеза сложных эфиров, поскольку часто и необходимая кислота, и спирт имеются в готовом виде. Наилучшие результаты этот метод дает в случае первичных спиртов, менее удовлетворительные — для вторичных и еще менее удовлетворительные — в случае третичных спиртов. Для быстрейшего достижения равновесия применяют такие катализаторы, как серная кислота, хлористый водород, арилсульфокислота или эфират трехфтористого бора, хотя некоторые эфиры бензилового спирта и муравьиной кислоты можно получить в отсутствие катализатора. Если спирт или кислота изменяются под действием кислот, следует предпочесть эфират трехфтористого бора. Для этерификации ароматических, кислот лучше брать 2 экв трехфтористого бора. Если при проведении реакции нежелательно присутствие кислоты в реакционной среде, в качестве катализатора можно использовать сильнокислые ионообменные смолы. Скорость образования эфира зависит or площади поверхности ионообменной смолы, а в случае кислот высокого молекулярного веса площадь поверхности может быть еще больше ограничена плохой диффузией кислоты внутрь смолы. Ниже приведен пример этерификации при помощи кислой ионообменной смолы фурилового спирта, который при наличии кислоты в реакционной среде полимеризуется (пример а).
Недавно для получения метилового эфира пеларгоновой кислоты из этой кислоты, спирта и серной кислоты были использованы молекулярные сита Линде ЗА в виде таблеток; выход эфира составил 96%.
Для того чтобы максимально сместить равновесие в сторону образования сложного эфира, одно из исходных веществ (обычно спирт применяют в избытке или один из получающихся продуктов (воду) удаляют азеотропной перегонкой, а растворитель (бензол или толуол) возвращают в реакционную смесь при помощи ловушки Дина— Старка. Другими методами удаления воды могут служить следующие: азеотропная перегонка в аппарате Сокслета, в патрон которого помещают осушитель, например сульфат магния, или химический способ, заключающийся в реакции с диметилацеталем ацетона, приводящей к образованию ацетона и метилового спирта. Азеотропная перегонка при помощи аппарата Дина — Старка — лучший метод получения сложных эфиров, особенно эфиров высококипящих спиртов. Применение метилового спирта при этом представляет трудности вследствие его летучести. В этом случае используют специальную барботажную колонну для удаления; промежуточных фракций, содержащих воду. Однако в тех случаях, когда большие количества серной кислоты не оказывают влияния на карбоновую кислоту, из которой получают эфир, эту кислоту, метиловый спирт и серную кислоту просто можно кипятить с обратным холодильником, а образующийся метиловый эфир экстрагировать толуолом по методу Клостергарда, предназначенному для получения этиловых эфиров, таких, как триэтиловый эфир лимонной кислоты. Разработан простой полумикрометод, похожий на приведенный выше, при котором метиловые эфиры образуются и разделяются так же эффективно, как и при реакции кислоты с диазометаном. Наконец, удобным методом получения метиловых эфиров алифатических и ароматических кислот, дающим выходы 87—98%, является кипячение соответствующей кислоты (1 моль), метилового спирта (3 моля) и серной кислоты в этилен или метиленхлориде в течение 6—15 ч. Этот метод не требует сложного оборудования, как метод Вайсбергераи Киблера, и более удобен для получения эфиров в больших масштабах, чем метод Бейкера.
Схема реакции этерификации следующая:
Электрофильная атака протона кислоты приводит к образованию иона карбония (I), который подвергается нуклеофильной атаке спиртом, давая соединение II; при перегруппировке и выделении молекулы воды и протона из него получается сложный эфир (III). Несомненно, что аллиловый и бензиловый спирты, а также третичные спирты склонны реагировать по карбоний-ионному механизму. В связи с существованием такой тенденции третичные спирты превращаются в основном в олефины, а не в сложные эфиры, а для получения сложных эфиров третичных алкилов необходимо искать другие пути синтеза, как показано в следующих параграфах.
Существенную роль в реакции этерификации играют стерические эффекты, поскольку атом углерода карбонильной группы кислоты в переходном комплексе II переходит из плоской тригональной структуры в тетраэдрическую структуру (3-тибридизация). Для определения влияния стерических эффектов на скорость этерификации алифатических кислот полезно «правило шести» Ньюмена, но лучшим способом оценки стерических факторов является изучение моделей. При применении обычных методов этерификации влияние оказывают также заместители, находящиеся в орто-положении ароматических кислот. В случае о,о-ди-алкилзамещенных можно проводить этерификацию, приливая раствор кислоты в 100%-ной серной кислоте к спирту. Успех этой реакции, по-видимому, зависит от образования плоского иона кар бония (обычная протонированнаякарбоксильная группав этом случае не может стать копланарной с кольцом), который реагирует со спиртом, давая сложный эфир. Выходы при применении этого метода бывают от удовлетворительных до хороших.
Этиловые эфиры могут быть получены (с выходами 84—94%) при нагревании соответствующей кислоты с избытком ортомуравьиного эфира вплоть до образования однородного раствора. В двух случаях добавляют толуолсульфокислоту или диметилформамид. Пространственно затрудненные кислоты, например 2,4,6-тринитро-и 2,4,6-триметилбензойные кислоты, этерифицируются с умеренными выходами.
Недавно опубликован новый метод этерификации пространственно затрудненных кислот. В этом случае реакция между спиртом и кислотой катализируется ангидридом трифторуксусной кислоты. Отличные выходы обычно получают с пространственно затрудненными кислотами, такими, как антрацен-9-карбоновая и 2,4,6-три-метилбензойная, и простыми или пространственно затрудненными спиртами или фенолами. Если и фенол, и кислота пространственно затруднены и возможен другой путь протекания реакции, например ацилирование атома углерода фенола, этерификация может не пойти. Согласно предполагаемому механизму, реакция идет по двум направлениям, которые оба включают образование протонированного ангидрида
Этот последний может реагировать непосредственно со спиртом, образуя сложныйэфир (V)
или в образовании эфира V может участвовать ион ацилия (VI)
Аналогичным методом является реакция раствора кислоты в 20 частях пиридина с 2 экв бензол- или толуолсульфохлорида, приводящая к образованию ангидрида кислоты. К этому раствору на холоду добавляют 1 экв спирта (или фенола) и смесь разбавляют ледяной водой. Этот метод рекомендуется для получения трет-алкильных сложных эфиров и сложных эфиров третичных ацетиленовых спиртов. Для этерификации кислот в мягких условиях пригоден диэтилацеталь диметилформамида. Так, например, при реакции бензойной кислоты и 2 экв формамида в бензоле при 80 °С в течение 1 ч выход сложного эфира превышает 90%.
Сложные эфиры аминокислот можно с успехом получать при взаимодействии аминокислот со спиртом в присутствии хлористого тионила в качестве катализатора, а в некоторых случаях при взаимодействии с а-толуолсульфокислотой и большим избытком диметилсульфита
Стероидные спирты часто лучше ацетилируются уксусной кислотой и уксусным ангидридом в присутствии следов хлорной кислоты.
Ариловые сложные эфиры можно получать взаимодействием кислоты с фенолом в присутствии хлорокиси фосфора или полифесфорной.
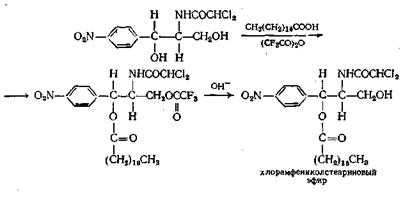
Если в молекуле имеется как первичная, так и вторичная спиртовая группа, как, например, в антибиотике хлорамфениколе (синтомицин), частичная этерификация обычно приводит к образованию первичных моноэфиров. Эфир со вторичной спиртовой группой получают, проводя реакцию по остроумной схеме, приведенной ниже:
Диэфиры из кетонов или альдегидов и кислот можно получать, вероятно, через ангидрид кислоты (пример г) и из эфира.
3.2. Из хлорангидридов кислот
Этот метод синтеза находит широкое применение, поскольку эта реакция необратима в отличие от реакции этерификации. Выделяющийся при реакции хлористый водород можно уводить из сферы реакции или поглощать его каким-нибудь основанием, например едким натром, диметиланилином или пиридином, или магнием. Иногда желательно применение алкоголята натрия. Диметиланилин и магний применяют для. получения эфиров третичных спиртов, имеющих тенденцию в отсутствие вещества, способного поглощать выделяющийся хлористый водород, образовывать галогенпроизводные. При этерификации фенолов часто применяют магний; эта реакция исследована количественно. Наиболее высокие выходы фениловых эфиров получают из таллиевых солей фенолов и хлорангидрида соответствующей кислоты.
Простейший метод — метод Шоттена — Баумана, состоящий во встряхивании хлорангидрида кислоты с водным раствором едкого натра, содержащим соответствующий спирт. Самые высокие выходы получаются тогда, когда хлорангидрид кислоты (и образующийся эфир) нерастворимы в воде, так что реакция протекает на границе раздела между органическим и водным слоем. Нерастворимость образующегося сложного эфира в водной фазе препятствует его омылению. По окончании реакции эфир получается свободным от хлорангидрида кислоты и хлористого водорода и его можно сразу экстрагировать и сушить. В довольно старом и незаслуженно забытом
Исследовании реакции Шоттена — Баумана было установлено, что (выходы сложных эфиров возрастают при понижении температуры Макции, при увеличении концентрации спирта (что можно осуществлять, добавляя щелочь постепенно) и при применении едкого кали, а не едкого натра. Кроме того, ангидрид уксусной кислоты дает более высокий выход эфира, чем хлорангидрид. Наиболее общим методом служит метод, в котором используют пиридин; если бы не неудобства, связанные с необходимостью избавляться от следов пиридина, который обычно отмывают разбавленной кислотой, вероятно, применяли бы только этот метод.
Эффективность реакции галогенангидридов кислот со спиртами может быть повышена проведением предварительной реакции галогенангидрида с кислотой Льюиса с целью получения соли ацилия. Простейшей такой солью является, по-видимому, метилоксокарбонийгексафторантимонат, который сам по себе или в нитрометане быстро реагирует со спиртами, образуя ацетаты с выходами от 62 до 87%.
Эта реакция, вероятно, происходит в результате нуклеофильной атаки спирта на атом углерода карбонила хлорангидрида кислоты.
Образующийся при этом комплекс быстро теряет хлористый водород, давая сложный эфир R'COOR.
В случае образования реакционноспособных и нестабильных бензилтозилатов желательно сначала получить соответствующий алкоголят с гидридом натрия, а затем обрабатывать его хлор ангидридом кислоты. Аналогичный метод, но без выделения алкоголята натрия, применялся для получения тозилата 2-нитро-3,4,5-триметок-сибензилового спирта, в котором гидроксил спирта прочно связан с нитрогруппой.)
Многие функциональные группы при этом методе синтеза не затрагиваются. В хлорангидридах кислот, содержащих двойные связи, ацетокси- , алкиламино- и 2-фуранакрилогруппы, эти группы не изменяются. Оксиэфиры можно получать из двухатомных спиртов и хлорангидридов кислот; аналогичным образом хлорзамещенные сложные эфиры можно получать из галогендоинов. При этом часто получают высокие выходы
3.3. Из ангидридов кислот
Или
Как и хлорангидриды кислот, ангидриды кислот широко применяют для получения сложных эфиров из соединений, содержащих оксигруппу. Эту реакцию проводят как в отсутствие катализаторов, так и с применением таких катализаторов, как серная кислота, хлористый цинк, хлорсульфокислота, хлористый ацетил, ацетат натрия. борная кислота, сульфат железа(Ш), метилат натрия и моногидрат я-толуолсульфокислоты. Ацетилирование многих фенолов можно осуществить в водном растворе щелочи, а циклические ангидриды можно полностью или частично этерифицировать. Механизм этой реакции такой же, как и при реакции с хлорангидридом кислоты, только при этом происходит отрыв аниона карбоксилата, а не галоген-аниона. Поскольку анион карбоксилата в растворе менее термодинамически стабилен, чём анион галогена, можно ожидать, что реакция ангидрида кислоты со спиртом будет несколько менее экзотермической, чем реакция соответствующего хлорангидрида. Вопреки тому, что написано в некоторых учебниках, третичные спирты можно этерифицировать ангидридами кислот при применении кислых катализаторов или трифенилметилнатрия.
Способные енолизоваться альдегиды можно превратить в енол-ацетаты нагреванием с уксусным ангидридом и ацетатом калия. Для трех ангидридов, для которых была проведена эта реакция, выходы составляли от 35 до 61%. Способные к енолизации кетоны реагируют не с такой легкостью, но, применяя уксусный ангидрид и л-толуолсульфокислоту, можно добиться успеха. Выходы для трех изученных кетонов составляли от 32 до 68%. Интересно отметить, что в условиях, применявшихся при реакции с кетонами, в реакцию вовлекались только метиленовые водородные атомы. При получении а-бром альдегидов и кетонов в качестве промежуточных соединений используют енолацетаты, как показано ниже:
Смешанные ангидриды, получающиеся из алкиловых эфиров хлормуравьиной кислоты, разлагаются при нагревании, образуя сложные эфиры по следующим схемам:
Ряд смешанных ангидридов из алифатических кислот разлагается с образованием сложных эфиров по пути А, а смешанные ангидриды ароматических кислот разлагаются по пути либо А, либо Б. При 250 °С происходит также реакция В. Трифторуксусная кислота и фениловый эфир хлормуравьиной кислоты при смешивании образуют фениловый эфир трифторуксусной кислоты с выходом 75—80%. Рассмотренные реакции декарбоксилирования, по-видимому, протекают через промежуточное циклическое состояние, причем происходит сдвиг электронов в цикле.
3.4. Из кетенов, ацетатов кетонов и изотианалей
Несмотря на то что эти реакции часто дают высокие выходы, этот метод синтеза не находит широкого распространения вследствие того, что химик обычно не имеет готового кетена, а его получение иногдабывает довольно сложным. Реакцию промотируют такие катализаторы, как серная кислота или толуолсульфокислота. Этот метод с успехом применяют при ацетилировании сложных эфиров молочной кислоты, а также при ацетилировании третичных спиртов и фенолов. Некоторые функциональные группы, например функциональные группы альдегидов и кетонов, подвержены атаке кетенами. В некоторых случаях эти карбонильные соединения превращаются в енолацетаты
Присоединение спирта к кетену, вероятно, идет как присоединение к карбонильным группам. Сначалаобразуется енол
таутомеризующийся затем собразованием сложного эфира
Поскольку кетены образуются в качестве промежуточных соединений при облучении большинства кетонов, кетоны представляют собой потенциальные источники получения сложных эфиров, если проводить их облучение в присутствии спиртов
Спирты присоединяются к дикетенам с образованием ацетоацетатов следующим образом:
Этот метод выгодно применять для получения ацетоацетатов с ненасыщенными группами R. Оказалось, что в этих случаях лучше всего в качестве катализатора использовать алкоголят натрия. Такие сложные эфиры можно также получать из хлорангидридов кислот через дикетен в одну стадию.
Ацетали кетенов также могут самопроизвольно превращаться в сложные эфиры с количественным выходом
Получение карбаматов из изоцианатов и спиртов напоминает образование сложных эфиров из кетенов
Эта реакция происходит самопроизвольно в отсутствие катализатора и дает высокие выходы карбаматов. Третичные спирты, однако, склонны к образованию олефинов. При получении фенилкарбаматов из изоцианатов и фенолов в качестве катализатора используют несколько капель триэтиламина или пиридина. Получение сложного эфира изоцианата представляет собой способ идентификации спиртов.
3.5. Диэфиры или α-замещенные эфиры из карбонильных соединений
или
Эти реакции присоединения применяют в ограниченных масштабах для синтеза а-галогензамещенных сложных эфиров или ацилалей. Сложные эфиры получают, смешивая компоненты либо сами по себе, либо в присутствии следов хлористого цинка, причем выходы составляют примерно 50%. Ацилали лучше всего получать действием уксусного ангидрида, если реакцию вести с добавлением небольших количеств эфирата трехфтористого бора, но с ангидридами пропионовой и и-масляной кислот наилучшие результаты достигаются при добавлении 10%-ного избытка катализатора сверх эквивалентного количества. При проведении реакции как с малым количеством катализатора, так и с избытком уксусный ангидрид и формальдегид образуют смеси, а с янтарным и пропионовым альдегидами реакция не идет. Выходы при этих реакциях присоединения составляют 60—80%. При реакциях присоединения ангидрида можно использовать кислоты, например серную кислоту, но выходы при этом обычно получаются более низкими, кроме тех случаев, когда добавляют ацетат натрия.
Выше уже приводились примеры получения изопропилиденмалоната и а-ацетокси-М-циклогексилизовалерамида.
3.6 Из нитрилов
Хотя от нитрилов можно перейти к сложным эфирам через амиды, обычный метод состоит в превращении их в иминоэфир, который можно выделять в качестве промежуточного соединения, а можно и не выделять. Для этой реакции применяют различные катализаторы, такие, как хлористый водород, бромистый и йодистый водород, серную кислоту и моногидраты бензол- и толуолсульфокислот. Следует отдать предпочтение аренсульфокислотам по сравнению с хлористым водородом или серной кислотой. С хлористым водородом получаются, более высокие выходы, чем с бромистым и йодистым водородом. Как показывает приведенное уравнение реакции, если исключить из участия в реакции воду, можно получить иминоэфиры. В некоторых случаях для реакции, ведущей к образованию иминоэфира, вода не нужна совсем, а иногда в отсутствие воды реакция не идет.
Этот метод синтеза находит широкое применение для получения полифункциональных соединений. Так, например, малоновые эфиры обычно синтезируют из эфиров а-цианкарбоновых кислот. Из циангидринов получают оксиэфиры, из кетоцианидов — кетоэфиры, а из аминоцианидов—аминоэфиры. Выходы при этом обычно бывают удовлетворительные.
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)
Переэтерификация представляет собой равновесную реакцию, которую можно сдвинуть в прямом направлении, применяя избыток одного из реагентов или, что предпочтительно, удаляя один из компонентов — RCOOR" или R'OH. Если температура кипения R'OH ниже, чем R"OH, можно проводить разделение, при помощи фракционирования: иногда для удаления получающихся продуктов пользуются образованием азеотропных смесей. Катализаторами такой реакции обмена служат кислоты, например серная или толуолсульфокислота, или основания, например алкоголяты алюминия. Как правило, превращение лучше протекает с первичными спиртами, причем наиболее реакционноспособен метиловый спирт, хотя в некоторых случаях с успехом можно применять вторичные спирты.
Этот метод синтеза пригоден для синтеза алкиловых эфиров высших жирных кислот из жиров, масел и восков. Путем такого обмена удобно получать и многие другие сложные эфиры, например эфиры акриловой и диэтиламино-а-фенилмасляной кислот. Наиболее важным эфиром енола, применяемым для получения сложных эфиров, является изопропенилацетат. Этот реагент легко доступен, и из него можно получать различные сложные эфиры с высоким выходом в результате обмена со спиртом в присутствии кислых катализаторов
Эта реакция может протекать с образованием кетена, из которого получают изопропенилацетат, но возможно также, что при реакии, катализируемой кислотой, образуется ион ацилия, атакующий спирт. Приведен пример образования сложного эфира, а также эфира енола.
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами. Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Бутиловый спирт, однако, обменивается очень медленно
3.8. Из лактонов и спиртов (реакция переэтерификации)
Этот метод синтеза находит лишь ограниченное применение при получении сложных эфиров. Бромистый водород в спиртовом растворе дает бромзамещенный сложный эфир, а хлористый водород приводит к образованию оксиэфира. Вместо галогеноводорода применяют и другие галогенпроизводные, например пятибромистый фосфор и тионилхлорид. Наиболее детально изучена, по-видимому, реакция пропиолактона. В этом случае при взаимодействии со спиртом в зависимости от природы катализатора образуются два продукта. С основаниями происходит расщепление по связи кислород—углерод карбонила, приводящее к образованию оксиэфиров
В отсутствие катализатора или с кислыми катализаторами происходит расщепление связи кислород — углерод метиленовой группы с образованием р-алкоксикислот
Механизм этого расщепления сходен с механизмом, предложенным для сложных эфиров, поскольку лактоны можно рассматривать как внутримолекулярные сложные эфиры. Выходы при этой реакции получаются удовлетворительные.
3.9. Из сложных эфиров и кислот (реакция переэтерификации)
Этот обмен происходит, и часто с хорошими выходами, в случае ациламинокислот и при получении виниловых эфиров различных алифатических и ароматических карбоновых кислот. N-Ациламинокислоты, например фталоилглицин или тозилглицин, превращаются в метиловые или этиловые эфиры под действием алкилформиата или алкилацетата. Обычно в качестве катализаторов используют 96% -ную серную кислоту или моногидрат толуолсульфокислоты. Неацилированные аминокислоты, за исключением фенилаланина нельзя превратить в сложные эфиры при помощи такого катализатора, как серная кислота.
«Винильный обмен» требует применения в качестве катализатора ртутной соли сильной кислоты. Температура при этой реакции должна поддерживаться в области 20—80 °С; более высокие температуры приводят к образованию диэфиров этилидена и ангидридов кислот. Этот метод синтеза позволяет получать более чистые мономеры, чем те, которые образуются в результате присоединения ацетилена к кислоте. Считают, что в этом случае соль ртути образует ацетиленовый комплекс (I)
реагирующий с кислотой с о
3-net.ru
Уксусная изобутиловый - Справочник химика 21
Изобутиловый эфир муравьиной кислоты (изобутилформиат). . Пропиловый эфир уксусной кислоты (пропилацетат). ...... [c.679]
Изобутиловый эфир уксусной кислоты. ............. [c.736]Амиловый эфир муравьиной кислоты (амилформиат) Бутиловый эфир уксусной кислоты (бутилацетат). . Изобутиловый эфир уксусной кислоты (изобутилацетат) грет-Бутиловый эфир уксусной кислоты (трет-бутил- [c.971]
Этилендиамин. . Амиловый спирт Изоамиловый спирт етор-Бутиловый спирт Циклогексанол Пентанон-3. . Ацетофенон. . Бензальдегид Бутиловый спирт Изобутиловый спирт Пропионовый ангидрид Изопропиловый спирт Циклогексанон. . . Пропионовый альдегид Метилэтилкетон. . . Пропиловый спирт Уксусный ангидрид. Аллиловый спирт. . [c.419]
ИЗОБУТИЛОВЫЙ ЭФИР УКСУСНОЙ кислоты [c.51]
СХЕМА СИНТЕЗА ИЗОБУТИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ [c.51]
В круглодонную колбу емкостью 1 л, снабженную мешал-кой с затвором, обратным холодильником и водоотделителем, загружают 360 г уксусной кислоты, 440 г изобутилового спирта и 44 г смолы КУ-2 с 20%-ным содержанием влаги. Содержимое колбы при энергичном перемешивании кипятят в течение 5—6 часов, до прекращения отделения воды (температура бани 110—120°). Затем реакционную массу охлаждают до комнатной температуры, фильтруют и фильтрат промывают сначала 250 мл воды, затем 250 мл 10%-ного раствора соды и вновь водой до нейтральной реакции промывных вод. Промытый эфир сушат хлористым кальцием. Выход технического продукта равен 550—570 г. Очистку изобутилацетата проводят перегонкой, собирая фракцию с температурой кипения 115—118°. [c.52]
В качестве подвижной фазы использованы также бутиловый, изобутиловый, амиловый и изоамиловый спирты и их растворы с кислотами. В бутиловом и амиловом спиртах эти ионы остаются па стартовой линии неподвижными. При добавлении концентрированного раствора HG1 резко увеличивается величина Rf для рения, молибдена и ванадия. Для перемещения вольфрама требуется больше 25 мл раствора соляной кислоты в 100 мл смеси. Разбавление подкисленных растворов водой не влияет на Rf ионов, но добавление уксусной кислоты способствует перемещению вольфрама при меньшем количестве соляной кнслоты [97]. [c.223]
Изобутиловый эфир уксусной кислоты [c.150]
Токсикология. Патти [1445] считает, что максимально допустимая концентрация изобутилового зфира уксусной кислоты в воздухе составляет 0,04%. [c.378]
К 1 мл анализируемого раствора прибавляют I мл 30%-ного раствора уксусной кислоты, 0,1—0,2 г цинковой пыли (для восстановления мешающих ионов) и фильтруют. К фильтрату прибавляют 4 мл концентрированного раствора гидроокиси аммония, 2 мл I Л/ раствора этилксантогената калия и мл изобутилового спирта и перемешивают, В присутствии кобальта появляется Темно-зеленое окрашивание спиртового слоя. Железо, медь, никель и большинство других катионов не мешают обнаружению кобальта. [c.53]
Процесс синтеза и переработки изобутилового масла получил широкое развитие в 40-х годах. Этот процесс служил основой при получении многих важнейших продуктов [2]. Спирты С4 и С5 служили растворителями в лакокрасочной промышленности, эфпры уксусной и пропионовой кислот и спиртов Се—С7 (ноли-сольваны) — в качестве селективных экстрагентов, нанример, [c.73]
Наблюдения за системой изобутиловый спирт—уксусная кислота—вода+ЫаОН показали, что активность достигает максимума при некоторой концентрации NaOH (около 1 н.). В этой же области Шервуд получил наибольшие коэффициенты массопередачи и наибольшие отклонения их от теоретически вычисленных, из чего следует вывод о связи между спонтанной турбулентностью и массопе-реносом. [c.61]
Капроновая кислота. . . Изокапроновая кислота Дпацетоиовый спирт. . . Изоамиловый эфир муравьиной кислоты ( 3 о а м л ф о р м I й т) Изобутиловый эфир уксусной кислоты (изобутилацетат). . . Пропиловый эфир пропионовой кис лоты (пропилпроппоиат). . Этиловый эфир масляной кислоты [c.637]
Этиловый эфир пропионовой к-ты Метиловый эфир изомасля-ыой к-ты Масляный альдегид Пропиловый эфир уксусной к-ты Диэтиловый эфир угольной к-ты Этилнитрат Метиламиловый эфир Амилнитрит 2-Метилгексан Пропиловый спирт Изобутиловый эфир муравьиной к-ты [c.822]
Алкилбензол, амилацетат, ангидрид уксусный, ацетилацетон, ацетил хлористый, винилацетат, ди-изопропиламии,изопрен, изопропиламин, метил метакрилат, моноизобу-тиламин, 1етилмвркап-тан, 2-метилтиофен, пропиламин спирты бутиловый третичный, изопропиловый, изобутиловый трифторэтилен, трихлорэтилен, хлористый изобутил, этиламин, этилендиамин [c.551]
Расположите в ряд по увеличению кислотности следующие соединения а) изобутиловый спирт, муравьиная кислота, уксусная кислота, щавелевая кислота, бгор-бутиловый спирт, трег-пентиловый спирт, бензиловый спирт [c.94]
Примеры систем различного типа а — бензол —вода, вода — хлорбензол, вода—ксилол б —вода—фурфурол в — вода—и-бу-типовый спирт, вода — изобутиловый спирт г — бтор-бутило-вый спирт — вода а — уксусная кислота — и-октан, этиловый спирт — вода, сероуглерод — ацетон е — и-гексан — бензол, н-гептан — бензол, метиловый спирт — вода ж — бензол—толуол, этан — бутан, циклогексан—н-октап з — ацетальдегид— фурфурол, ацетон—уксусная кислота, метилацетилкетон—про-нионовая кислота и — азотная кислота—вода, соляная кислота-вода, циклогексанол —фенол. [c.53]
Ангидриды кислот изомасляной Г7,111,477 и масляной 85,359. О Бутиловый, 0тор- и Г 5ег-бутиловый, изобутиловый эфиры ацето-уксусной кислоты 02,1,363. О 3-Гидрокси 5-метокси-З-метоксиме- [c.99]
Бромистый изобутил может быть получен из изобутилового спирта при действии брома и фосфора водного раствора бромистоводородной кислоты 2 и газообразного бромистого водорода из изобутилена и газообразного бромистого водорода или раствора бромистого водорода в ледяной уксусной кислоте изомеризацией бромистого ягршич.-бутила при 210—220° . Целый ряд бромидов, в том числе и бромистый изобутил, был получен действием трехбромистого фосфора на спирты Описанный метод является видоизменением метода, применявшегося для получения бромистого циклопентила [c.116]
Сивушное масло. К сивушному маслу относят летучие органические вещества, выделяющиеся из бражки в процессе ее перегонки и имеющие температуры кипения более высокие, чем у этилового спирта. Многие из них имеют маслянистую консистенцию, ограниченно растворимы в воде. Поэтому они придают водно-спиртовому раствору мутный (сивый) оттенок. Независимо от сырья, идущего на приготовление сусла, количественно в сивупшом масле преобладают изоамиловый, изобутиловый и Н-пропиловый спирты. Остальные компоненты сивушного масла — уксусная и другие карбоновые кислоты, фурфурол и сложные эфиры присутствуют в существенно меньших количествах. Спирты, являющиеся основными компонентами сивушного масла, образуются из сахаров и аминокислот в процессе брожения и в силу этого в зрелой бражке из любого сырья присутствуют всегда. [c.136]
В трехгорлую колбу, снабженную термометром, обратным холодильником и мешалкой, помещают 72 г (0,52 М) монобромуксусной кислоты, нейтрализуют ее 20°/о-ным раствором едкого натра до pH 7, нагревают до 90° и добавляют при перемешивании 16 г (0,03 М) a,a a"-тpиaминдибeпзилднфeнил-метана. Затем раствор нагревают до кипения (110° в колбе) и при энергичном размешивании прибавляют 20%-ный раствор едкого натра, поддерживая pH 8—10 по фенолфталеину. Конденсацию считают законченной, если щелочная реакция среды не изменяетсй в течение 30 минут после прибавления последнего количества щелочи. Реакция продолжается 5—6 часов. Затем реакционную массу фильтруют горячей, охлаждают и подкисляют 10%-ным раствором соляной кислоты до pH 2—3. Кислоту отфильтровывают и промывают водой до отрицательной реакции на ион хлора. После перекристаллизации из бутилового спирта в соотношении 1 8 получают 12 г комплексона ( 51% теории) с т. пл. 159—161°. а, а, а"-Три-аминдибензилдифенилметан- У, Л , Ы , К, К", М" -гекса-уксусная кислота представляет собой белый аморфный порошок с желтоватым оттенком хорошо растворим в щелочах, соляной кислоте, этиловом спирте, хуже — в бутиловом н изобутиловом нерастворим в хлороформе, ацетоне, воде. [c.74]
Изобутиловый эфир уксусной кислоты, изобутил-ацетат, jS-метилэтилэтаноат [c.12]
Определением скорости этерификацииодноосновных алифатических кислот можно установить, является ли данная кислота первичной, вторичной нлн третичной, т. е. с каким числом водородных атомов связан атом углерода, соседний с карбоксилом. Чтобы получать сравнимые между собой результаты, всегда следует вести этерификацию одним и тем же алкоголем. Обычно для этой цели применяют изобутиловый алкоголь. Вступление фенильных групп в уксусную кислоту очень сильно уменьшает скорость ее этерификации О влиянии строения на скорость этерификации ароматических кислот см. А, TV, 12. [c.361]
Получение изобутилового эфира уксусной кислоты К бромистому магний-этилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см эфира (ср. Б, II, 2) медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 лкш., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида н сноса кипятят несколько минут. Через 12 час. реакциопную массу выливают в лед, смесь ела о подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике "21 реакцию ведут в автоклаоах, а вместо бромистого Этила применяют хлористый метил, хлористый этил или хлористый бенлил. [c.474]
В отличие от эфиров ТФА-аминокислот ацетиламинокислоты, впервые изучавшиеся Янгсом [129] в виде н-бутиловых эфиров, менее летучи и, следовательно, имеют больший удерживаемый объем. По-видимому, полярные основные аминокислоты, такие, как Арг, а также Гис, Три и цистин, вряд ли можно подвергать газовой хроматографии. Их нет среди 35 аминокислот (в том числе 18 природных), разделенных с помощью ГХ в виде н-амиловых эфиров Джонсоном и др. [42]. Эти авторы разделяли также н-бутило-вые,. изобутиловые и изоамиловые эфиры, приготовленные аналогично ТФА-производным. Эти эфиры получали в виде бромгидра-тов, а затем прямо ацетилировали уксусным ангидридом. Известно, что при этом из оксиаминокислот образуются также N, 0-диацетиль-ные соединения, но пока нет никаких данных о том, как взаимодействует ангидрид с другими полифункциональными аминокислотами. По сравнению с соответствующими ТФА-производными 0-ацетил-соединения гораздо меньше подвержены гидролизу и, по-видимому, обладают более высокой термоустойчИвостью правда, соответствующих количественных измерений еще не проводили. В литературе описано разделение н-пропиловых эфиров ацетиламинокислот [29], но подробные методики не были опубликованы. [c.321]
Исследовалась массопередача уксусной кислоты в системах этиленгликоль — этилацетат, вода — изобутиловьп спирт и вода — этилацетат. Прп определенной величине возмущений наблюдались псевдостационарные полигональные конвективные ячейки. Этот тип межфазных явлений был назван микромасштабным межфазным движением в отличие от макромасштабного, под которым Беккер ы др. понимали движение, обусловленное потоками и геометрией межфазной новерхности. Средняя площадь ячейки возрастает во времени, причем ячейки большого размера растут за счет меньших. Для систем гликоль — ацетат и вода — изобутиловый эфир соотношение между средней площадью и временем было найдено линейным при массопередаче из гликоля или изобутилового спирта. Это означает, что линейный размер ячейки нропорционален корню квадратному из времени. Определяя глубину проникновения в случае молекулярной диффузии как было показано, что поря- [c.236]
chem21.info
Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Сложные эфиры аминокислот можно с успехом получать при взаимодействии аминокислот со спиртом в присутствии хлористого тионила в качестве катализатора, а в некоторых случаях при взаимодействии с а -толуолсульфокислотой и большим избытком диметилсульфита
Стероидные спирты часто лучше ацетилируются уксусной кислотой и уксусным ангидридом в присутствии следов хлорной кислоты.
Ариловые сложные эфиры можно получать взаимодействием кислоты с фенолом в присутствии хлорокиси фосфора или полифесфорной.
Если в молекуле имеется как первичная, так и вторичная спиртовая группа, как, например, в антибиотике хлорамфениколе (синтомицин), частичная этерификация обычно приводит к образованию первичных моноэфиров. Эфир со вторичной спиртовой группой получают, проводя реакцию по остроумной схеме, приведенной ниже:
Диэфиры из кетонов или альдегидов и кислот можно получать, вероятно, через ангидрид кислоты (пример г) и из эфира.
Этот метод синтеза находит широкое применение, поскольку эта реакция необратима в отличие от реакции этерификации. Выделяющийся при реакции хлористый водород можно уводить из сферы реакции или поглощать его каким-нибудь основанием, например едким натром, диметиланилином или пиридином, или магнием. Иногда желательно применение алкоголята натрия. Диметиланилин и магний применяют для. получения эфиров третичных спиртов, имеющих тенденцию в отсутствие вещества, способного поглощать выделяющийся хлористый водород, образовывать галогенпроизводные. При этерификации фенолов часто применяют магний; эта реакция исследована количественно. Наиболее высокие выходы фениловых эфиров получают из таллиевых солей фенолов и хлорангидрида соответствующей кислоты.
Простейший метод — метод Шоттена — Баумана, состоящий во встряхивании хлорангидрида кислоты с водным раствором едкого натра, содержащим соответствующий спирт. Самые высокие выходы получаются тогда, когда хлорангидрид кислоты (и образующийся эфир) нерастворимы в воде, так что реакция протекает на границе раздела между органическим и водным слоем. Нерастворимость образующегося сложного эфира в водной фазе препятствует его омылению. По окончании реакции эфир получается свободным от хлорангидрида кислоты и хлористого водорода и его можно сразу экстрагировать и сушить. В довольно старом и незаслуженно забытом
Исследовании реакции Шоттена — Баумана было установлено, что (выходы сложных эфиров возрастают при понижении температуры Макции, при увеличении концентрации спирта (что можно осуществлять, добавляя щелочь постепенно) и при применении едкого кали, а не едкого натра. Кроме того, ангидрид уксусной кислоты дает более высокий выход эфира, чем хлорангидрид. Наиболее общим методом служит метод, в котором используют пиридин; если бы не неудобства, связанные с необходимостью избавляться от следов пиридина, который обычно отмывают разбавленной кислотой, вероятно, применяли бы только этот метод.
Эффективность реакции галогенангидридов кислот со спиртами может быть повышена проведением предварительной реакции галогенангидрида с кислотой Льюиса с целью получения соли ацилия. Простейшей такой солью является, по-видимому, метилоксокарбонийгексафторантимонат, который сам по себе или в нитрометане быстро реагирует со спиртами, образуя ацетаты с выходами от 62 до 87%.
Эта реакция, вероятно, происходит в результате нуклеофильной атаки спирта на атом углерода карбонила хлорангидрида кислоты.
Образующийся при этом комплекс быстро теряет хлористый водород, давая сложный эфир R'COOR.
В случае образования реакционноспособных и нестабильных бензилтозилатов желательно сначала получить соответствующий алкоголят с гидридом натрия, а затем обрабатывать его хлор ангидридом кислоты. Аналогичный метод, но без выделения алкоголята натрия, применялся для получения тозилата 2-нитро-3,4,5-триметок-сибензилового спирта, в котором гидроксил спирта прочно связан с нитрогруппой.]
Многие функциональные группы при этом методе синтеза не затрагиваются. В хлорангидридах кислот, содержащих двойные связи, ацетокси- , алкиламино- и 2-фуранакрилогруппы, эти группы не изменяются. Оксиэфиры можно получать из двухатомных спиртов и хлорангидридов кислот; аналогичным образом хлорзамещенные сложные эфиры можно получать из галогендоинов. При этом часто получают высокие выходы
Или
Как и хлорангидриды кислот, ангидриды кислот широко применяют для получения сложных эфиров из соединений, содержащих оксигруппу. Эту реакцию проводят как в отсутствие катализаторов, так и с применением таких катализаторов, как серная кислота, хлористый цинк, хлорсульфокислота, хлористый ацетил, ацетат натрия. борная кислота, сульфат железа(Ш), метилат натрия и моногидрат я-толуолсульфокислоты. Ацетилирование многих фенолов можно осуществить в водном растворе щелочи, а циклические ангидриды можно полностью или частично этерифицировать. Механизм этой реакции такой же, как и при реакции с хлорангидридом кислоты, только при этом происходит отрыв аниона карбоксилата, а не галоген-аниона. Поскольку анион карбоксилата в растворе менее термодинамически стабилен, чём анион галогена, можно ожидать, что реакция ангидрида кислоты со спиртом будет несколько менее экзотермической, чем реакция соответствующего хлорангидрида. Вопреки тому, что написано в некоторых учебниках, третичные спирты можно этерифицировать ангидридами кислот при применении кислых катализаторов или трифенилметилнатрия.
Способные енолизоваться альдегиды можно превратить в енол-ацетаты нагреванием с уксусным ангидридом и ацетатом калия. Для трех ангидридов, для которых была проведена эта реакция, выходы составляли от 35 до 61%. Способные к енолизации кетоны реагируют не с такой легкостью, но, применяя уксусный ангидрид и л-толуолсульфокислоту, можно добиться успеха. Выходы для трех изученных кетонов составляли от 32 до 68%. Интересно отметить, что в условиях, применявшихся при реакции с кетонами, в реакцию вовлекались только метиленовые водородные атомы. При получении а -бром альдегидов и кетонов в качестве промежуточных соединений используют енолацетаты, как показано ниже:
Смешанные ангидриды, получающиеся из алкиловых эфиров хлормуравьиной кислоты, разлагаются при нагревании, образуя сложные эфиры по следующим схемам:
Ряд смешанных ангидридов из алифатических кислот разлагается с образованием сложных эфиров по пути А, а смешанные ангидриды ароматических кислот разлагаются по пути либо А, либо Б. При 250 °С происходит также реакция В . Трифторуксусная кислота и фениловый эфир хлормуравьиной кислоты при смешивании образуют фениловый эфир трифторуксусной кислоты с выходом 75—80%. Рассмотренные реакции декарбоксилирования, по-видимому, протекают через промежуточное циклическое состояние, причем происходит сдвиг электронов в цикле.
Несмотря на то что эти реакции часто дают высокие выходы, этот метод синтеза не находит широкого распространения вследствие того, что химик обычно не имеет готового кетена, а его получение иногдабывает довольно сложным. Реакцию промотируют такие катализаторы, как серная кислота или толуолсульфокислота. Этот метод с успехом применяют при ацетилировании сложных эфиров молочной кислоты, а также при ацетилировании третичных спиртов и фенолов. Некоторые функциональные группы, например функциональные группы альдегидов и кетонов, подвержены атаке кетенами. В некоторых случаях эти карбонильные соединения превращаются в енолацетаты
Присоединение спирта к кетену, вероятно, идет как присоединение к карбонильным группам. Сначалаобразуется енол
таутомеризующийся затем собразованием сложного эфира
Поскольку кетены образуются в качестве промежуточных соединений при облучении большинства кетонов, кетоны представляют собой потенциальные источники получения сложных эфиров, если проводить их облучение в присутствии спиртов
Спирты присоединяются к дикетенам с образованием ацетоацетатов следующим образом:
Этот метод выгодно применять для получения ацетоацетатов с ненасыщенными группами R. Оказалось, что в этих случаях лучше всего в качестве катализатора использовать алкоголят натрия. Такие сложные эфиры можно также получать из хлорангидридов кислот через дикетен в одну стадию.
mirznanii.com
Синтез изобутилового эфира уксусной кислоты., Химия
Пример готовой курсовой работы по предмету: Химия
Содержание
1. Введение
1.1. Общие сведения
1.2. Практическое применение
2. Синтезы изобутилацетата
Способ
1. Реакция этерификации
Способ
2. Получение на катионитовых катализаторах
Способ
3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1. Из карбоновых кислот (реакция этерификации)
3.2. Из хлорангидридов кислот
3.3. Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5. Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6. Из нитрилов
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)
3.8. Из лактонов и спиртов (реакция переэтерификации)
3.9. Из сложных эфиров и кислот (реакция переэтерификации)
3.10. Из солей при взаимодействии с алкилгалогенидами
3.11. Из солей и кислот и других алкилирующих агентов
3.12. Из медных солей
3.13. Из тетраалкиламмоиевых солей
3.14. Из амидов
3.15. Из тригалогензамещенных
3.16. Из дигалогензамещенных простых эфиров
3.17. Из карбоновых кислот и дивинилртути
3.18. Механизм реакции этерификации
4.Выводы
Список литературы
Выдержка из текста
1. Введение
1.1.Общие сведения
Изобутилацетат (изобутиловый эфир уксусной кислоты) бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде.
Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd 20 1.3901.
1.2.Практическое применение
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около
85. наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5−6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100−110°C в присутствии h3SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
Список использованной литературы
1.Терней А. Современная органическая химия: В 2 т. — М.: Мир, 1981. — Т.1 — 670 с; Т.2 — 615 с.
2.В. Ф. Травень. Органическая химия. Том 1. М.: Академкнига, 2004, — 708 с.
3.Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
4.Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
5.Голодников Г. В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
6.Дорофеенко Г. Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
7.Голодников Г. В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
8.Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
9.Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
10.Шабаров Ю.С. Органическая химия: В 2-х кн. — М.:Химия, 1994.- 848 с.
11.Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. М.: Высш. шк., 1973. — 623 с.
12.Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
13.Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.
referatbooks.ru
Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Ацетали кетенов также могут самопроизвольно превращаться в сложные эфиры с количественным выходом
Получение карбаматов из изоцианатов и спиртов напоминает образование сложных эфиров из кетенов
Эта реакция происходит самопроизвольно в отсутствие катализатора и дает высокие выходы карбаматов. Третичные спирты, однако, склонны к образованию олефинов. При получении фенилкарбаматов из изоцианатов и фенолов в качестве катализатора используют несколько капель триэтиламина или пиридина. Получение сложного эфира изоцианата представляет собой способ идентификации спиртов.
или
Эти реакции присоединения применяют в ограниченных масштабах для синтеза а -галогензамещенных сложных эфиров или ацилалей. Сложные эфиры получают, смешивая компоненты либо сами по себе, либо в присутствии следов хлористого цинка, причем выходы составляют примерно 50%. Ацилали лучше всего получать действием уксусного ангидрида, если реакцию вести с добавлением небольших количеств эфирата трехфтористого бора, но с ангидридами пропионовой и и-масляной кислот наилучшие результаты достигаются при добавлении 10%-ного избытка катализатора сверх эквивалентного количества. При проведении реакции как с малым количеством катализатора, так и с избытком уксусный ангидрид и формальдегид образуют смеси, а с янтарным и пропионовым альдегидами реакция не идет. Выходы при этих реакциях присоединения составляют 60—80%. При реакциях присоединения ангидрида можно использовать кислоты, например серную кислоту, но выходы при этом обычно получаются более низкими, кроме тех случаев, когда добавляют ацетат натрия.
Выше уже приводились примеры получения изопропилиденмалоната и а -ацетокси-М-циклогексилизовалерамида.
3 .6 Из нитрилов
Хотя от нитрилов можно перейти к сложным эфирам через амиды, обычный метод состоит в превращении их в иминоэфир, который можно выделять в качестве промежуточного соединения, а можно и не выделять. Для этой реакции применяют различные катализаторы, такие, как хлористый водород, бромистый и йодистый водород, серную кислоту и моногидраты бензол- и толуолсульфокислот. Следует отдать предпочтение аренсульфокислотам по сравнению с хлористым водородом или серной кислотой. С хлористым водородом получаются, более высокие выходы, чем с бромистым и йодистым водородом. Как показывает приведенное уравнение реакции, если исключить из участия в реакции воду, можно получить иминоэфиры. В некоторых случаях для реакции, ведущей к образованию иминоэфира, вода не нужна совсем, а иногда в отсутствие воды реакция не идет.
Этот метод синтеза находит широкое применение для получения полифункциональных соединений. Так, например, малоновые эфиры обычно синтезируют из эфиров а -цианкарбоновых кислот. Из циангидринов получают оксиэфиры, из кетоцианидов — кетоэфиры, а из аминоцианидов—аминоэфиры. Выходы при этом обычно бывают удовлетворительные.
Переэтерификация представляет собой равновесную реакцию, которую можно сдвинуть в прямом направлении, применяя избыток одного из реагентов или, что предпочтительно, удаляя один из компонентов — RCOOR" или R'OH. Если температура кипения R'OH ниже, чем R"OH, можно проводить разделение, при помощи фракционирования: иногда для удаления получающихся продуктов пользуются образованием азеотропных смесей. Катализаторами такой реакции обмена служат кислоты, например серная или толуолсульфокислота, или основания, например алкоголяты алюминия. Как правило, превращение лучше протекает с первичными спиртами, причем наиболее реакционноспособен метиловый спирт, хотя в некоторых случаях с успехом можно применять вторичные спирты.
Этот метод синтеза пригоден для синтеза алкиловых эфиров высших жирных кислот из жиров, масел и восков. Путем такого обмена удобно получать и многие другие сложные эфиры, например эфиры акриловой и диэтиламино-а -фенилмасляной кислот. Наиболее важным эфиром енола, применяемым для получения сложных эфиров, является изопропенилацетат. Этот реагент легко доступен, и из него можно получать различные сложные эфиры с высоким выходом в результате обмена со спиртом в присутствии кислых катализаторов
Эта реакция может протекать с образованием кетена, из которого получают изопропенилацетат, но возможно также, что при реакии, катализируемой кислотой, образуется ион ацилия, атакующий спирт. Приведен пример образования сложного эфира, а также эфира енола.
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами. Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Бутиловый спирт, однако, обменивается очень медленно
Этот метод синтеза находит лишь ограниченное применение при получении сложных эфиров. Бромистый водород в спиртовом растворе дает бромзамещенный сложный эфир, а хлористый водород приводит к образованию оксиэфира. Вместо галогеноводорода применяют и другие галогенпроизводные, например пятибромистый фосфор и тионилхлорид. Наиболее детально изучена, по-видимому, реакция пропиолактона. В этом случае при взаимодействии со спиртом в зависимости от природы катализатора образуются два продукта. С основаниями происходит расщепление по связи кислород—углерод карбонила, приводящее к образованию оксиэфиров
В отсутствие катализатора или с кислыми катализаторами происходит расщепление связи кислород — углерод метиленовой группы с образованием р-алкоксикислот
Механизм этого расщепления сходен с механизмом, предложенным для сложных эфиров, поскольку лактоны можно рассматривать как внутримолекулярные сложные эфиры. Выходы при этой реакции получаются удовлетворительные.
Этот обмен происходит, и часто с хорошими выходами, в случае ациламинокислот и при получении виниловых эфиров различных алифатических и ароматических карбоновых кислот. N-Ациламинокислоты, например фталоилглицин или тозилглицин, превращаются в метиловые или этиловые эфиры под действием алкилформиата или алкилацетата. Обычно в качестве катализаторов используют 96% -ную серную кислоту или моногидрат толуолсульфокислоты. Неацилированные аминокислоты, за исключением фенилаланина нельзя превратить в сложные эфиры при помощи такого катализатора, как серная кислота.
«Винильный обмен» требует применения в качестве катализатора ртутной соли сильной кислоты. Температура при этой реакции должна поддерживаться в области 20—80 °С; более высокие температуры приводят к образованию диэфиров этилидена и ангидридов кислот. Этот метод синтеза позволяет получать более чистые мономеры, чем те, которые образуются в результате присоединения ацетилена к кислоте. Считают, что в этом случае соль ртути образует ацетиленовый комплекс (I)
реагирующий с кислотой с образованием сложного эфира (II)
Эта реакция обмена дает высокие выходы с галогенпроизводными, способными к реакции замещения по механизму SN2 в апротонных растворителях. Хорошие выходы метиловых эфиров высокой степени чистоты получаются с йодистым метилом, бикарбонатом натрия и соответствующей кислотой при проведении реакции в диметилацетамиде при комнатной температуре. При реакции с другими алкилгалогенидами синтезирован ряд сложных эфиров. Можно использовать для этой реакции соль натрия или серебра с триэтиламином в качестве катализатораили саму свободную кислоту с триэтиламином. Фенациловые эфиры, получаемые этим методом, используют для характеристики карбоновых кислот.
При получении тритиловых эфиров следует предпочесть бромистый триэтил хлористому, поскольку он более реакционноспособен и менее гигроскопичен и его можно применять с безводной серебряной, натриевой или калиевой солью.
При реакции соли, уксуснокислого тетраэтиламмония, с оптически активным галогенпроизводным образуется сложный эфир с меньшей степенью рацемизации, чем при применении уксусной кислоты
Реакция медной соли кислоты с каким-либо арилгалогенидом в высококипящем растворителе — единственно пригодный способ получения ариловых эфиров из арилгалогенидов. В качестве промежуточного соединения образуется медьорганическое соединение
mirznanii.com