Большая Энциклопедия Нефти и Газа. Эфир газ или жидкость
Как определить по формуле -газ, жидкость или твердое вещество?
приблизительно .от вещества зависить . у обычных условиях если то например углеводороды с малям числом атомов газы и чем больше тем тяжелее . как эфир и бензин и мазут и гудрон
Формулы отображают только строение структурной единицы но никак не всего вещества в целом
Как уже было сказано, формула такой информации не несёт, поэтому путь хитрый: 1) Узнать по формуле, что за вещество. 2) Загуглить, при каких условиях вещество будет твёрдым, жидким и газообразным - это называется "фазовая диаграмма", для воды она такая: <a rel="nofollow" href="http://commons.wikimedia.org/w/index.php?title=File:Phase-diag_ru.svg&page=1&uselang=ru" target="_blank">http://commons.wikimedia.org/w/index.php?title=File:Phase-diag_ru.svg&page=1&uselang=ru</a> 2а) Заодно обратить внимание на то, в каком диапазоне условий вещество не распадается, иначе может выйти конфуз: при данных условиях вещество с данной формулой вполне может разрушаться, превращаясь в два газа и одну жидкость - что совершенно изменит ход дальнейших реакций. 3) Посмотреть внимательно условия задачи. Если там есть указания условий - найти их на диаграмме состояний - это даст ответ на вопрос о фазовом состоянии. Если же указания условий нет, то опыт проводится при "нормальных условиях", состояние вещества в нормальных условиях найти обычно несложно (достаточно посмотреть картинки с ним) . <a rel="nofollow" href="http://ru.wikipedia.org/wiki/Фазовая_диаграмма" target="_blank">http://ru.wikipedia.org/wiki/Фазовая_диаграмма</a> <a rel="nofollow" href="http://ru.wikipedia.org/wiki/Нормальные_условия" target="_blank">http://ru.wikipedia.org/wiki/Нормальные_условия</a>
touch.otvet.mail.ru
Взрывоопасность простых эфиров - Справочник химика 21
Простые эфиры и им подобные вещества при хранении, особенно на свету, способны окисляться кислородом воздуха с образованием чрезвычайно взрывоопасных пероксидов. При перегонке таких растворителей пероксиды концентрируются в перегонной колбе, в результате чего часто происходят взрывы. Перед работой с эфирами следует обязательно проверять, не присутствуют ли в них пероксиды. Для этого 2—3 мл эфира встряхивают в пробирке с равным объемом 2 1)-ного раствора иодида калия и несколькими каплями разбавленной серной или соляной кислоты. Бурое окрашивание (выделяется свободный иод) указывает на присутствие пероксидов. [c.59]
При хранении в диоксане (как и в других простых эфирах) образуются взрывоопасные пероксиды. [c.90]
К образованию перекисей склонны все простые эфиры, особенно циклические, такие, как диоксан и тетрагидрофуран. Перегонка больших количеств эфира производится в специально оборудованных лабораториях с принятием особых мер предосторожности. В силу своей дешевизны и способности растворять многие органические соединения этиловый эфир находит широкое применение в работе химических лабораторий. Необходимо помнить, что он имеет низкую температуру кипения (34,48°), образует с воздухом взрывоопасные смеси в пределах 1,85—36,5 об. %. При неаккуратном хранении на воздухе он окисляется с образованием перекисей, легко взрывающихся при сотрясении сосуда или при нагревании. Необходимо всегда помнить об особой огнеопасности эфира. Пары его в 2,5 раза тяжелее воздуха, имеют низкую температуру вспышки и достаточно очень небольшого источника для его воспламенения. [c.110]
Простые эфиры вступают в реакцию со свободными радикалами и по этой причине не могут служить хорошими растворителями при проведении реакций свободнорадикального характера. Потенциально простые эфиры представляют собой опасные химические вещества, поскольку в присутствии кислорода воздуха может происходить радикальноцепной процесс, приводящий к образованию перекисей — неустойчивых и взрывоопасных соединений. Такой процесс носит название автоокисления и происходит не только в случае простых эфиров, но также со многими альдегидами и углеводородами. В общем виде эта реакция может быть представлена приведенными ниже стадиями инициирования (1), развития цепи (2 и 3) и обрыва (4). [c.446]
В некоторых случаях взрывоопасные соединения могут получаться вследствие неправильного или небрежного ведения процесса. Так, непредельные углеводороды, спирты, простые эфиры способны под влиянием кислорода воздуха образовывать перекиси, взрывающиеся с большой силой. [c.11]
Напишите уравнение реакции окисления диэтилового эфира кислородом воздуха. Пероксидные соединения взрывоопасны, особенно при нагревании (перегонке). Поэтому перед употреблением простые эфиры проверяют на присутствие перекисей. Если перекиси обнаруживают, эфиры подвергают очистке. [c.85]
При проведении экстракции надо всегда помнить, что многие органические растворители ядовиты, особенно при вдыхании их паров в больших количествах. Поэтому необходимо следить, чтобы вентиляция в лаборатории была достаточной и работала исправно. Кроме того, большинство органических растворителей представляют собой легковоспламеняющиеся, огнеопасные жидкости. Некоторые растворители (простые эфиры и др.) могут содержать сильно взрывающиеся примеси, а пары растворителей с воздухом образуют взрывоопасные смеси. Поэтому при работе с растворителями всегда следует быть очень осторожным и предусмотрительным (см. Правила работы с легковоспламеняющимися веществами, с. 8). [c.39]
Большинство органических растворителей представляет собой легко воспламеняющиеся, огнеопасные жидкости. Некоторые растворители (простые эфиры и др.) могут содержать сильно взрывающиеся примеси, а пары растворителей с воздухом образуют взрывоопасные смеси. [c.54]
При приготовлении чистых безводных растворителей следует особо строго соблюдать меры предосторожности, так как большинство органических растворителей — горючие вещества, пары которых образуют с воздухом взрывоопасные смеси, а в некоторых из них (простые эфиры) при длительном хранении образуются взрывчатые перекисные соединения. Многие органические растворители весьма токсичны, как при вдыхании их паров, так и при действии их на кожу. [c.115]
Наиболее важные представители. Диэтиловый эфир этиловый эфир, просто эфир , серный эфир) — жидкость с характерным запахом, т. кип. 34,6 °С, т. пл. — 116,3°С, df 0,714. Легко воспламеняется, его пары в смеси с воздухом взрывоопасны, способен к аутоокислению. Требует тщательного хранения и осторожного обращения. Используется как растворитель многих органических веществ. Эфир обладает анестезирующим действием, применяется в медицине при хирургических операциях. [c.192]
Газообразные вещества и пары жидкостей могут образовывать с кислородом (воздухом) взрывоопасные смеси. Во многих случаях пределы взрывоопасных концентраций очень широки. Взрывоопасны термодинамически неустойчивые соединения, такие, как ацетилен (особенно при повышенных температурах й давлении) перекиси и гидроперекиси, являющиеся промежуточными и конечными продуктами производства ацетилениды меди и серебра. Особую опасность представляют взрывоопасные соединения, которые могут образоваться вследствие неправильного или небрежного ведения процесса. Так, непредельные углеводороды, спирты, простые эфиры способны под влиянием кислорода воздуха давать перекиси, взрывающиеся с большой силой. [c.8]
Гидропероксиды и пероксиды - весьма взрывоопасные вещества, особенно при нагревании (и даже встряхивании в колбе), при достаточно высоких концентрациях. В связи с этим органические вещества при перегонке нельзя выпаривать досуха, а простые эфиры поэтому хранят в темных бутылях (защита от УФ-облучения солнечных лучей) со щелочами или металлическим натрием. Пероксиды удаляют встряхиванием с солями двухвалентного железа (восстановители) или разлагают концентрированной серной кислотой. [c.288]
Работа с эфирами требует большой аккуратности и осторожности. Легколетучие простые эфиры (например, этиловый) образуют легковоспламеняющиеся и взрывоопасные смеси с воздухом в широких пределах. А горят эфиры страшно... [c.288]
Метан составляет 80—95% объема газов, выделяющихся из недр земли. Саратовский, ставропольский газ и другие природные источники газа приносят большую пользу народному хозяйству, а также способствуют оздоровлению быта. Метан скапливается также в рудничных и угольных шахтах и может служить нередко причиной страшных взрывов. Метан, как и все горючие газы (например водород) или пары (бензина, эфира), образует с воздухом взрывоопасные смеси. Взрыв может произойти, если содержание метана в воздухе достигает от 5 до 15% (объемных). Такие смеси могут взрывать просто от случайной искры. Это и служит причиной взрывов газа в шахтах или, при несоблюдении правил эксплуатации газовых приборов, в домашних условиях. [c.52]
В конвективных сушилках тепло, необходимое для процесса, доставляется газообразным сушильным агентом (нагретым воздухом, топочными газами или их смесью с воздухом) при непосредственном его соприкосновении с поверхностью материала. В случаях, когда не допускается соприкосновение высушиваемого материала с кислородом воздуха, или, если пары удаляемой влаги огнеопасны, сушильным агентом служат инертные газы (азот, СО2 и др.) или перегретый водяной пар. В простейшем виде сушильный процесс осуществляется т. обр., что сушильный агент, нагретый до темп-ры, предельно допускаемой высушиваемым материалом, однократно используется в сушильном аппарате. Этот процесс наз. основным. Для термолабильных материалов снижение темп-ры достигается устройством внутри сушильной камеры дополнительной поверхности нагрева или нагреванием воздуха по ходу процесса за счет тепла, полностью вносимого в сушильную камеру. Для С. материалов, требующих повышенной влажности сушильного агента и невысоких темп-р, применяются сушилки с возвратом (рециркуляцией) части отработавшего воздуха, а также сушилки с промежуточным подогревом воздуха между отдельными ступенями (зонами) и одновременной рециркуляцией. Для С. огне- и взрывоопасных материалов, или в случае, когда удаляемая жидкость является ценным продуктом (спирты, эфиры и др. растворители), применяются схемы с полной (замкнутой) циркуляцией инертных газов, включающие дополнительно конденсаторы-холодильники для конденсации и удаления из системы испаряющейся влаги, и одновременного осушения циркулирующих в системе газов. [c.567]
Отдельные представители. Наиболее важным представителем простых эфиров является диэтиловый эфир (этиловый) С2Н5—О— —С2Н5 — очень подвижная, крайне огнеопасная жидкость с сильным характерным запахом. Его пары в 2,5 раза тяжелее воздуха и образуют с ним взрывоопасные смеси. Кроме того, он легко образует с кислородом воздуха перекись, которая также крайне взрывоопасна. Для разложения этой перекиси достаточно взболтать эфир с раствором едкой щелочи или железного купороса. Этиловый эфир применяется в качестве растворителя, в производстве бездымного пороха, коллодия и искусственного щелка. Широко используется в медицине. [c.166]
Активность простых эфиров в реа кциях свободнорадикального замещения проявляется также в легкости их окисления кислородом воздуха на свету. При этом специального облучения не требуется. Продуктами окисления являются взрывоопасные гидройероксиды [c.206]
Учитывая взрывоопасность пероксидов и гидропероксидов, необходимо при работе с простыми эфирами всегда проверять их на наличие пероксидных соединений. Проба на наличие пероксидных соединений проводится с раствором К1. Если в эфире содержатся пе-роксидные соединения, то они окисляют К1 до свободного иода I,, окрашивающего раствор в буро-коричневый цвет. Образование небольших количеств иода можно легко обнаружить, добавляя в пробу раствор крахмального клейстера, который дает при взаимодействии с иодом синее окрашивание. Для разрушения пероксидных соединений эфир обрабатывают раствором щелочи или восстановителей — сульфита натрия Ка ЗО,, сульфата железа(П) Ре80 и др. [c.198]
Этоксиэтан (диэтиловый эфир, часто называемый просто эфиром) jHjO jHj — бесцветная летучая жидкость, легче воды. Плохо растворим в воде, смешивается во всех соотношениях со спиртом и бензолом. При работе с эфиром необходимо соблюдать особую осторожность. Эфир очень легко воспламеняется, поэтому работать с ним можно только при отсутствии поблизости источника открытого огня. Пары эфира тяжелее воздуха, что делает его возгорание особенно опасным. Необходимо также помнить, что эфир легко испаряется, а смеси паров эфира с воздухом взрывоопасны. Эфир окисляется с образованием взрывоопасных пероксидных соединений. [c.198]
Наиболее важным простым эфиром является диэтиловый (серный) эфир С2Н5—О—С2Н5. Это бесцветная жидкость с характерным эфирным запахом. Он кипит при 35,6°С. Серный эфир — очень легко испаряющееся летучее вещество, пары его в 2,5 раза тяжелее воздуха и чрезвычайно легко воспламеняются, смесь их с воздухом крайне взрывоопасна. Поэтому при работе с эфиром надо соблюдать большую осторожность и не допускать соприкосновения паров эфира с источниками нагревания, особенно с открытым пламенем горелки. [c.111]
Серьезным недостатком смесей диэтилового эфира с кислородом, служащих в качестве анестетика, является их способность к взрыву, и это послужило толчком к поиску новых менее взрывоопасных анестетиков. В результате были открыты новые анестетики, такие как 1,1-дифтор-2,2-дихлорэтилметиловый эфир (мето-ксифлуран) и 2,2,2-трифторэтилвиниловый эфир (флуроксен) [3]. В качестве анестетиков предлагались и другие фторированные простые эфиры [4], однако при их использовании существует возможность проявления мутагенного действия а-галогенэфиров [5]. [c.292]
В случае использования в качестве пропе плента простых эфиров вероятность образования в рабочих помещениях взрывоопасных паро-воздушных смесей выше, чем при применении парафиновых углеводородов. Самая низкая концентрация паров в воздухе, при которой происходит взрыв паро-воз-душной смеси от соприкосновения ее с источником воспламенения, у диэтилового эфира (1 объемн.%). Нижний предел взрываемости диметилового и метилэтилового эфира немного выше, чем у парафиновых углеводородов. Разница между нижним и верхним пределами взрываемости у эфиров гораздо выше, чем у парафиновых углеводородов (табл. 6.3). Поэтому чаще всего эфиры применяются в смесях с негорючими пропеллентами — фреонами, причем количество эфира не должно превышать предельно допустимой концентрации, при которой смесь в условиях производства становится огнеопасной [3—4]. [c.105]
Диэтилсвый эфир С2Н5—О—С2Н5. Его обычно называют серный эфир или просто эфир . Очень летучая, бесцветная жидкость с приятным запахом, кипящая при 34,6 °С его плотность 0,713 г/см . Эфир чрезвычайно легко воспламеняется своз-духом пары эфира образуют взрывоопасную смесь. [c.99]
В большинстве случаев в магнийорганическом синтезе используется в качестве растворителя диэтиловый эфир, отличающийся доступностью, дешевизной и низкой температурой кипения (облегчающей его отгонку от продукта реакции). Недостатками диэтилового эфира является его огне- и взрывоопасность. В тех случаях, когда требуется нагревание реакционной смеси до более высокой температуры, чем температура кипения диэтилового эфира, применяют другие простые эфиры (дибутиловый, диизоамиловый). В. В. Челинцев (1904 г.) предложил при получении магнийорганических соединений заменить эфир третичными аминами, например, диметиланилином образующиеся комплексы имеют азот в качестве комплексообразующего атома. К. А. Андрианов и Грибанова показали, что галогеналкилы (арилы) реагируют с магнием в присутствии небольших количеств этилового эфира ортокремневой кислоты 81(ОС2Н5)4, давая хорошие выходы [c.299]
МНОГОАТОМНЫЕ СПИРТЫ,"содержат в молекуле не менее трех ОН-групп у насыщ. атомов углерода. В зависимости от числа ОН-групп алиф. С. подразделяются на трехатомные (глицерины), четырехатомные (эритриты, или тет-риты), пятнатомные (пентиты), шестиатомные (гекснты) и т. п. Алициклич. М. с. наз. циклитами. М. с, обладают всеми св-вами одноатомных спиртов образуют, напр., простые и сложные эфиры, циклич, ацетали. При каталитич. гидрировании высших М. с. образуются низшие М. с. Нитраты М, с. взрывоопасны. М. с, широко распространены в природ (содержатся в водорослях, мн. растениях, плодах, грибах). См., напр., Глицерин, Пентазритрит, Ксилит, D-Сорбит, Маннит, Эритрит. [c.345]
Растворители. Наиболее распространенным растворителем для магнийорганических синтезов является абсолютный диэтиловый эфир. Общепризнано, что эфир не только растворитель, но и катализатор реакции. Однако это весьма огне- и взрывоопасное вещество, что затрудняет его применение, особенно в промышленности. В качестве растворителей для получения магнийорганических соединений применяются и другие простые алифатические эфиры (дибутиловый), жирноароматические (анизол), циклические (тетрагидрофуран) углеводороды, третичные амины, эфиры ортокремневой кислоты и др. Реакцию можно вести и вообще без растворителя. За исключением некоторых осо бых случаев, лучшим растворителем при проведении магнийор ганических синтезов является абсолютный диэтиловый эфир. [c.212]
При производстве химико-фармацевтических препаратов большей частью приходится пользоваться огнеопасным и взрывоопасным сырьем взрывоопасными газами (водород, аммиак, сероводород, кетен), легко воспламеняющимися жидкостями, являющимися компонентами реакций и средами для их проведения (бензол, толуол, спирты, эфиры простые и сложные, органические кислоты и др.), пирофорными твердыми веществами, применяемыми в качестве восстановителей (цинковая пыль) и катализаторов (скелетный никелевый катализатор), а также некоторыми огневзрывоопасньгми промежуточными продуктами (диазо- и нитрозосоединеиия). Эта особенность вызывает необходимость специального взрывобезопасного оформления технологических схем производства, применения взрывобезопасных электрооборудования, освещения и сетей, заземления всего оборудования, применения паро- и газотушения, изоляции опасных процессов, взрывобезопасного оформления вентиляционных устройств в соответствии с противопожарными нормами строительного проектирования промышленных предприятий. [c.22]
Из указанных в табл. 33 соединений фреон 12 — наиболее распространенный хладоагент. Это бесцветный, нерастворимый в воде и не горящий газ с эфирным запахом он хорошо смешивается с растворителями (бензол, лигроин, минеральное масло, тетрагидронафталин, толуол, ксилол, дигидронафталин, гентан), алкилгалогенидами (хлороформ, бромбензол, хлористый амил, бромхлорме-тая, бромоформ, четыреххлористый углерод, бромистый этил, хлористый метил), сложными (амилацетат, бутилаце-тат, дибутилфталат, атилацетат) и простыми (бутилбензи-ловый эфир, бутилкарбитол, бутилцеллозольв. диоксан-дифениловый эфир) эфирами и многими другими органическими веществами (уксусная кислота, ацетонитрил, диметиланилин, окись этилена, циклогексан, нитробензол, пиридин, сернистый ангидрид). Смеси фреона 12 с воздухом в любых соотношениях негорючи и невзрывоопасны, в то время как смеси хлористого этилена (4—14%-ные) или хлористого метила (9—15%-ные) с воздухом взрывоопасны. Даже аммиак (13—27%-ный) образует с воздухом взрывоопасные смеси. [c.176]
chem21.info
Кипения температура газов и летучих жидкостей
Обратим внимание на то, что испарение летучих жидкостей под различными особенно под малыми, давлениями дает легкое средство получения низких температур. Так, сжиженный углекислый газ под обыкновенным давлением уже прямо дает холод, достигающий — 80 , а при испарении, происходящем при разрежении (воздушным насосом) до 25 мм ( = 0,033 атм.), судя по вышеприведенным числам, температура падает до —115° (Дьюар). Даже испарение обычных, всюду находящихся жидкостей под малым давлением, легко достигаемым насосами, может доставить низкие температуры, которыми можно пользоваться для сжижения более летучих жидкостей. Вода, кипящая -в пустоте, при давлении менее 4,5 мм, замерзает, потому что при 0 упругость ее 4,5 мм. Продувая воздух (мелкими струями) чрез обыкновенный (серный) эфир, чрез жидкий сернистый углерод S-, хлористый метил С№С1 и т. п. легко летучие жидкости, можно иметь уже довольно низкие температуры. В прилагаемой таблице даны для некоторых газов 1) число атмосфер давления, необходимого для сжижения при температуре 15°, и 2) температура кипения жидкости при давлении 760 мм-. [c.424]
Главная задача автора настоящей книги заключается в рассмотрении различных видов хроматографии газов — группы физических методов разделения, вызвавших широкий интерес сразу же после их разработки. Хро.мато-графия газов используется главным образом в качестве аналитического метода для разделения, идентификации и количественного определения летучих соединений (газов и жидкостей) с температурами кипения примерно до 350 (или даже до 400°). [c.25]
Установив единство газов и паров, Менделеев идет дальше на основании открытой им температуры абсолютного кипения он устанавливает единство обоих агрегатных состояний — жидкого и газообразного, причем пар играет роль связующего звена между ними. Парообразное состояние в виде насыщенного пара, — пишет Менделеев, — представляет как бы переход от жидкого к газообразному, как коллоидальное, мягкое и порошкообразное состояния представляют переход от твердого состояния к жидкому. В этом отношении особенно поучительно то, что при известной температуре всякая летучая жидкость, несмотря на малый объем пространства, переходит вполне и вдруг в пар [c.178]
В гомологических рядах наблюдаются определенные общие закономерности. Например, низшие члены гомологических рядов при нормальных температурах — газы или летучие жидкости. При увеличении относительной молекулярной массы соединений повышаются температуры плавления и кипения (имеются некоторые исключения из этого правила, особенно для темлературы плавления). Повышение температур плавления и кипения в гомологическом ряду можно объяснить тем, что при увеличении молекул все с большей силой проявляются дисперсионные взаимодействия (разд. ЗЛ) и, чтобы преодолеть эти взаимодействия (для перехода из твердой фазы в жидкую или из жидкой —в газовую), требуется затрачивать все больше энергии. [c.117]
Низшие эфиры представляют собой нейтральные газы или летучие жидкости, имеюш,ие более низкие температуры кипения, чем изомерные спирты. Обладают ограниченной растворимостью в воде, но сами являются хорошими растворителями для большинства органических соединений. [c.89]
Если температура жидкости при стриппинге повышается вплоть до кипения, то отпадает необходимость в газе-экстрагенте, роль которого при кипячении способен выполнять водяной пар. К таким модификациям стриппинга относится сочетание дистилляции с парофазным анализом дистиллята [13]. Дистилляция как метод стриппинга оказалась эффективной в применении к анализу следов летучих полярных органических соединений— низкомолекулярных спиртов, кетонов и альдегидов, плохо поддающихся концентрированию путем жидкостной экстракции и сорбции из водных растворов. Методика анализа предназначаемых для повторного употребления очищенных сточных вод госпиталей [13] включает отгонку 100 мл воды с 20-сантиметровым елочным дефлегматором и отбор первых 1,5 мл дистиллята. 1 мл дистиллята помещается в стандартную скляночку на 15 мл, насыщается сульфатом натрия и подвергается парофазному анализу. Площадь пика простейших спиртов, кетонов и этилацетата пропорциональна их концентрации в исходном образце воды, причем коэффициенты пропорциональности устанавливаются анализом в тождественных условиях серии стандартных смесей [c.113]
Образование при растворении соединений определенного состава становится верным из явлений сильного уменьшения упругости или из повышения температуры кипения, происходящих при растворении в воде некоторых летучих жидкостей и газов. Для примера возьмем иодистый водород HJ, представляющий газ, сгущающийся в жидкость, кипящую лишь около —34°. Раствор его, содержащий на 100 ч., по весу, 57 /о иодистого водорода, отличается тем, что при нагревании из него иодистый водород улетучивается вместе с водою в том самом отношении, в каком находится в растворе, т.-е. такой раствор может. перегоняться. Такой раствор кипит выше, чем вода — при 127°. Правильнее сказать, это будет не температура кипения, а температура, при которой образовавшееся соединение разлагается, образуя пары продуктов диссоциации, которые при охлаждении опять соединяются. Если в воде растворено будет меньше иодистоводородного газа, чем указано выше, то при нагревании такого раствора сперва будет перегоняться вода и будет оставаться иодистоводородный раствор вышеприведенного состава, который под конец будет перегоняться [c.77]
Ректификационные колонны работают обычно при атмосферном или небольшом избыточном давлении. Ограниченное применение находят вакуумные колонны и колонны, работающие при повышенном давлении. Ректификацию под вакуумом применяют в том случае, когда хотят снизить температуру в колонне, что бывает необходимо при разделении компонентов с высокой температурой кипения или веществ, нестойких при высокой температуре. Ректификацию под повышенным давлением используют для разделения сжиженных газов и легко-летучих жидкостей. [c.162]
Физические свойства. Бесцветные, летучие жидкости, слегка раств. в воде, легче воды (кроме диоксана). Низшие гомологи имеют температуру кипения ниже, чем соответствующие спирты. Диметиловый и метилэтиловый эфиры при обыкновенной температуре — газы. С водой даже низшие П. Э. не смешиваются, но несколько в ней растворяются и сами ее несколько растворяют (см. табл. на стр. 250—251). [c.249]
Пример 1.3. В аппарате Мейера, показанном на рис. 1.8, летучая жидкость, вес которой известен, испаряется, после чего измеряют объем образовавшегося газа. Зная объем этого газа, можно рассчитать его молекулярный вес. Небольшое количество (0,1437 г) органической жидкости (температура кипения 72°С) вносят из стеклянной ампулы Б баню с кипящим растворителем (см. рис. 1.8). Жидкость превращается в пар, который вытесняет 22,9 см воздуха это определяют по смещению столбика ртути при температуре 25,0 °С и давлении 744 мм рт. ст. Чему равен мол. вес жидкости [c.35]
Для эффективной работы таких приборов необходимо, чтобы вакуумная линия имела достаточно большой диаметр (не менее 20 - 30 мм), а температура поверхности холодильника была бы на 60 - 100 °С ниже температуры поверхности испаряющейся жидкости. Перед введением жидкости в молекулярно-дистилляционный прибор из нее удаляют все растворенные газы. Простейшее устройство типа охлаждаемый палец (рис. 169, а) состоит из сосуда 3, в который наливают около 5 мл очищаемой смеси 6, и пробирки / с хладоагентом. Сосуд 3 подключают через кран 2 к вакуумной системе для предварительно-гр удаления растворенных газов и летучих растворителей. После этой операции в пробирку 1 вносят охлаждающую смесь (см. разд. 6.11) и нагревают сосуд 3 в жидкостной бане 5 (см. разд. 6.1). Температуру бани подбирают таким образом, чтобы молекулярная перегонка проходила достаточно быстро при сохранении необходимого перепада температур жидкость - холодильник без кипения и разложения перегоняемой жидкости. [c.319]
Если летучая жидкость находится в смеси своего пара с газом постоянной концентрации, а ее температура значительно ниже температуры кипения (24), равна температуре кипения (25), немного ниже температуры кипения (26), немного выше температуры кипения (27). [c.69]
Муравьиный альдегид - газ, низшие альдегиды и кетоны — летучие жидкости, плотность меньше единицы, обладают характерным запахом неспособны к образованию водородных связей, поэтому кипят при более низкой температуре, чем соответствующие спирты. Температура кипения кетонов несколько выше, чем у изомерных им альдегидов, хорошо растворяются в органических растюрителях, низшие - смешиваются с водой. [c.392]
Работа на колонке осуществляется следующим образом. Охлаждают конденсационную часть колонки охладительной смесью (сухой лед с бензином или ацетоном) до температуры на 10—15 град ниже температуры кипения наиболее летучего компонента смеси и присоединяют к нижней части колонки перегонную колбу с охлажденным веществом, подлежащим перегонке (не забыть бросить перед этим кипелки ). Затем, осторожно нагревая перегонную колбу водой, доводят находящуюся в ней жидкость до кипения. При этом через реометр 8 вытеснится находившийся в колонке воздух, после чего выделение газа из колонки должно временно прекратиться. Отбор продукта можно начать тогда, когда из колонки в перегонную колбу будет достаточно интенсивно стекать флегма и когда температура, показываемая термометром 7, перестанет изменяться. [c.55]
Уменьшение упругости пара растворов объясняет повышение температуры кипения от растворения твердого нелетучего тела в воде. Температура выделяющегося пара такая же, как и. раствора, а потому при этом водяной пар будет перегрет. Насыщенный раствор обыкновенной или поваренной соли кипит при 108°,4, раствор 335 ч. [калиевой] селитры в 100 ч. воды кипит при 115°,9 325 ч. хлористого кальция при 179°, если определять температуру кипения, погрузивши шарик термометра в самую жидкость. Это показывает опять ту связь, которая существует между растворенным телом и водою. Еще яснее эта связь в тех случаях (напр., при растворении азотной или муравьиной кислоты в воде), когда раствор кипит выше, чем вода и летучее тело, в ней растворенное. По этой причине растворы некоторых газов, напр., хлористого и иодистого водорода, кипят выше 100°. [c.74]
Альдегиды и кетоны по химическому характеру — вещества нейтральные. Первый представитель альдегидов — муравьиный альдегид (формальдегид)—газ, следующие за ним альдегиды, а также низшие кетоны — летучие, легко растворимые в воде жидкости с характерным запахом. С усложнением молекул растворимость альдегидов и кетонов в воде понижается, а температура кипения повышается. Высшие альдегиды и кетоны перегоняются без разложения только под вакуумом. [c.41]
При простой перегонке полного разделения удается достичь лишь в том случае, когда примесь совершенно нелетуча или разница в температурах кипения разделяемых компонентов достаточно велика (не менее 100 град). Для разделения компонентов смеси с меньшей разницей в температурах кипения применяют фракционную перегонку. Рекомбинацией фракций и повторной перегонкой можно увеличить эффективность разделения. Фракции отбирают по температуре кипения дистиллята, которая в течение процесса перегонки непрерывно повышается. Трудоемкую и занимающую много времени операцию систематической разгонки фракций можно сократить, применяя эффективную аппаратуру (колонку), в которой пары вещества частично конденсируются по пути от перегонной колбы до холодильника. При такой фракционной перегонке (ректификации) достигается эффективный контакт потока паров вещества с жидкостью, возвращающейся обратно в перегонную колбу, вследствие чего дистиллят к моменту равновесия в колонке оказывается значительно обогащенным наиболее летучим компонентом. Вещества, которые во время кипения при атмосферном давлении частично или полностью разлагаются, перегоняют при пониженном давлении (в вакууме.) Одним из вариантов перегонки в вакууме является молекулярная перегонка. Ее применяют для очистки или выделения веществ с очень низкой упругостью паров. Перегонку можно использовать также для очистки твердых веществ с низкой температурой плавления и сжиженных газов. [c.46]
КРЕМНЕВОДОРОДЫ (силаны) — соединения кремния с водородом. Предельные К-— силаны, аналоги предельных углеводородов, общей формулы 51лН2 21 предполагают, что существуют и непредельные К.— силены, аналоги этиленовых углеводородов, и силины — аналоги ацетиленовых углеводородов. К. отличаются неустойчивостью силано-вых цепей —31—31—. Плотность, температуры плавления и кипения К. выше, чем у соответствующих углеводородов. Низшие К.— газы с неприятным запахом высшие — летучие ядовитые жидкости с еще более неприятным запахом. Силаны растворяются в спирте, бензине, сероуглероде. Характерным свойством силанов является их чрезвычайно легкое окисление для некоторых силанов реакция окисления протекает с сильным взрывом. Если в закрытые сосуды с раствором силана в сероуглероде попадает воздух, происходит взрыв. Силаны — хорошие восстановители, быстро гидролизуются. Силаны получают разложением силицидов металлов кислотами или щелочами, восстановлением галогеносиланов гидридами или водородом и другими методами. [c.138]
Акролеин — жидкость с резким запахом, с низкой температурой кипения (52°С), поэтому легко превращается в газ, раздражающий слизистые оболочки глаз, гортани, пищевода. Едкость кухонного чада объясняется наличием акролеина в летучих продуктах жарения. Акролеин дает все химические реакции альдегидов и непредельных соединений, легко полимеризуется, применяется для производства некоторых полимерных материалов. [c.110]
В 1874 г. журнал Русского физико-химического общества сообщил о работах Мельсана, который установил, что древесный уголь поглощает равную ему массу хлора, причем в процессе поглощения температура в адсорбенте повышается на 30 °С. Была продемонстрирована также способность угля поглощать такие газы, как сероводород, двуокись серы, аммиак, бромистый водород, хлористый этил и синильная кислота. Мельсан отметил, что летучие жидкости (спирт), поглощенные углем, не выделяются из него при температурах их кипения. Таким образом, зародилась идея об удерживающей способности адсорбента в цикле адсорбция — десорбция. [c.15]
Гидриды. Соединения кремния с водородом (силаны) образуют гомологический ряд с общей формулой 81 Н2 + 2 подобно предельным углеводородам, но отличаются от них меньшей прочностью цепей из-за невысокой энергии связи 81—81 (см. с. 335). Максимальное значение п в общей формуле силанов равно 8. Электронные орбитали атома кремния в силанах находятся в состоянии вр -гибридизации, поэтому молекулы первого члена гомологического ряда — моносилана 81Н4 имеют форму тетраэдра. Температуры плавления и кипения в гомологическом ряду силанов увеличиваются быстрее, чем у углеводородов. При обычных условиях только моносилан и дисилан 812Нд — газы. Остальные силаны — летучие жидкости. Все силаны бесцветны, ядовиты, имеют неприятный запах. [c.363]
Термин "нервно-паралитические газы", строго говоря, не совсем верен, так как это жидкости с температурой кипения выше температуры кипения воды. Они, однако, достаточно летучи, чтобы представлять бльшую опасность для людей, находясь в пароной фазе. Именно поэтому и укоренилось название "нервно-паралитические газы". [c.398]
Когда температура достигает 105 °С, раствор профильтровывают горячи. и фильтрат концентрируют далее, не допуская кипения, до достижения температуры 110°С. Выдерживают при этой температуре 1/4 ч, а затем постепенно поднимают ее до 130 °С, опять-таки избегая кипения жидкости. Кислота при этом течет совершенно спокойно, не выделяет пузырьков газа и не пахнет фосфином, но слегка дымит, так как она несколько летуча. Прн осторожном нагревании можно повысить температуру до 138 С, не вызывая этим разложения. После примерно 10-минутного выдерживания при 130 °С прекращают нагревание, жидкость охлаждают и фильтруют ее в скляику с притертой пробкой. Склянку охлаждают на несколько градусов ниже нуля и, если кристаллизация не наступает, вызывают ее трением по диу стеклянной палочкой, а затем оставляют стоять. [c.582]
Имеется большое число жидкостей, которые можно использовать в качестве неподвижной фазы при температурах колонки приблизительно до 150°. В настоящее время существует заметная тенденция распространить газо-жидкостную хроматографию со всеми ее преимуществами до более высоких температур вплоть до 400°. Даже если допустить термическую устойчивость разделяемых веществ, это вызовет ряд специфических трудностей. Практически все обычные органические растворители становятся слишком летучими или неустойчивыми. Каталитическое действие носителя способствует нестабильности. Жидкостями, пригодными для температур выше 250°, являются некоторые силиконы, апьезоновая смазка и битумы. Избирательность полярных жидкостей по отношению к структурным типам при высоких температурах уменьшается. Наконец, в сложных смесях число компонентов с увеличением температуры кипения необычайно возрастает, и разделение на индивидуальные соединения становится практически невозможным. По этим двум причинам высокотемпературная газо-жидкостная хроматография, по-видимому, не найдет такого широкого применения в качестве независимого метода разделения, как низкотемпературная. Ее можно использовать скорее как метод, дающий фракции для анализа другими методами, такими, как масс-спектрометрия. [c.318]
Можно оценить также загрязнение продукта неподвижной фазой. Для этого необходимо знать летучесть неподвижной фа зы при рабочей температуре (имеется в виду суммарное содер жание летучих веществ, включая пары неподвижной фазы а также вещества, образующиеся при ее термической деструк ции или в результате взаимодействия с кислородом, присутст вующим в газе-носителе). Летучесть неподвижной фазы суще ственно ограничивает применение газожидкостной препаратив ной хроматографии для выделения высококипящих соединений Считается, что неподвижная жидкость должна кипеть при тем пературе по крайней мере на 200 °С выше температуры кипения самого тяжелого компонента разделяемой смеси. [c.250]
Температура кипения горючего также должна удовлетворять известным требованиям. Точка кипения не должна быть слишком высокой. Важно, чтобы в любое время года, даже зимой, жидкость в карбюраторе распределялась равномерно. Но точка кипения не должна быть ниже определенного предела. Горючее, кипящее при 25°, имело бы прекрасную стартовую готовность. Но в этом случае образовывалось бы так много легковзрывающихся газов, что курение в машине или даже рядом с ней могло бы стоить человеку жизни. К тому же летом чересчур возрастали бы потери на испарение. И наконец, легко летучее горючее образует в системе газовые пробки, которые мешают равномерному притоку топлива из бака в карбюратор. [c.79]
За скипидарным маслом гонится уже вещество, окрашенное в желтый цвет оно известно под именем керосина или, как говорят американцы, керосена иначе называют ее осветительной жидкостью. Это вещество есть тоже собрание продуктов, имеющих уд. вес 0.780—0.810—0.815 температура кипения =110—210—230°. Если керосин имеет много летучих продуктов, то считается опасным. Последнее узнается таким образом керосин нагревают до 50°, при этом газы от горящей спички не должны загораться. Керосин не должен также заключать много тяжелых продуктов, потому что в противном случае он нелегко поднимается по фитилю. [c.350]
chem21.info
Назовите силы действующие на тело погруженное в жидкость или газ
на тело, погружённое в жидкость (или газ) , действует выталкивающая сила, равная весу вытесненной этим телом жидкости (или газа) (называемая силой Архимеда)
сила притяжения
На тело, погруженное в жидкость или газ действует выталкивающая сила
Выталкивающая сила, сила притяжения, вязкость жидкости -газа ( иногда не учитывают )
На тело, погруженное в жидкость и остающееся в равновесии на плаву (возможно под поверхностью, как подводная лодка) действуют две силы: сила тяжести и равная ей выталкивающая сила (и равная весу жидкости, вытесненной погруженным объёмом тела) . На тело, погруженное в жидкость и тонущее действуют три силы: сила тяжести, неравная ей (меньше) выталкивающая сила (равная весу жидкости, вытесненной погруженным объёмом тела) , а также сила трения при движении, в значительной степени зависящая от скорости погружения и вязкости жидкости. На тело, погруженное в жидкость и лежащее плотно на дне, действуют три силы: сила тяжести, неравная ей выталкивающая сила, и сила реакции со стороны дна. В данном случае выталкивающая сила уменьшается на величину, равную весу жидкости, занимаемому той частью объёма тела, под которой нет воды. Если на плоское дно, например на мягкое глинистое дно, положить плоский предмет и придавить, чтобы плотно прилегал, а сверху налить воды, то выталкивающая сила будет полностью отсутствовать, несмотря на то что погруженный объём тела - есть. Оторвать предмет ото дна на большой глубине бывает невозможно, нужно поднять весь столб воды. Формулировка Архимеда не совсем универсальна, она не учитывает этот случай.
что такое ----------------------------------------------------------------
touch.otvet.mail.ru
Фрион это жидкость или газ?
газообразная жидкость
Когда я взломал холодильник, на меня полилась эта маслянистая гадость, от которой еще надо суметь отмыться.. . на тот момент это была жидкость, температура окружающей среды около 20-30 С.. . А так все зависит от условий: любой газ можно привести в жидкое и даже твердое состояние.. . И наверное большинство жидкостей и твердых тел можно перевести в газообразное состояние, если достаточно нагреть...
Если говорить научно, то фрEон представляет собой фторсодержащее производное от насыщенных углеводородов, которые сегодня так часто используются в качестве хладагентов в холодильном оборудовании. На сегодняшний день существует более сорока видов разных фреонов. Сами по себе фреоны – это бесцветные жидкости или газы, не имеющие запаха.
В холодильники заправляют фреон (газ) и специальное масло для смазки компрессора...
Фреон (хладагент) -международное название R(№ такой-то, например R-12(дифтордихлорметан), кстати в ряде стран запрещён, как озоноразрушающий и заменён на R-134а) У других фреонов названия ещё мудрёнее-поэтому и принята к лассификация на R+номер., например R22 применяется зачастую в кондиционерах ну и т. д. В холодильных машинах во время цикла, фреон может находиться в различных агрегатных состояниях-газ и жидкость (и промежут. состоянии в виде нассыщенного пара) На конденсаторе конденсируется, а на испарителе, соответственно, испаряется
Фреон сам по себе - газ. Но в баллонах он продается в жидком состоянии.
touch.otvet.mail.ru
Технология GTL (Gas to liquids)
Процесс Фишера-Тропша
Процесс Фишера-ТропшаПроцесс Фишера-Тропша был разработан в Германии в середине 20-х годов прошлого века. Он начинается с парциального (частичного) окисления метана (природного газа) в диоксид углерода, монооксид углерода, водород и воду. Кислород либо берется из воздуха (что делает газ менее насыщенным), либо подается из воздушного криогенного сепаратора (что увеличивает стоимость).
Соотношение монооксида углерода и водорода (1:2) регулируется реакцией с водяным газом, а избыток диоксида углерода удаляется с помощью водных растворов алканоаламина (или физическим растворением). После удаления воды остается синтез-газ (сингаз), который, химически реагируя в присутствии катализатора (железа или кобальта) превращается в жидкие углеводороды и другие побочные продукты.
Метанол в бензин (Methanol to gasoline process — MTG)
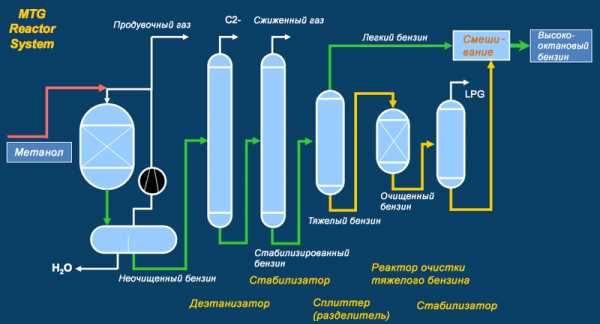 Конверсия метанола в бензин (MTG)
Конверсия метанола в бензин (MTG)В начале 70-х гг. ХХ века компания Mobil разработала альтернативную технологию конверсии природного газа в синтез-газ, а синтез-газа в метанол. Затем метанол полимеризуется в присутствии цеолитного катализатора с образованием алканов (насыщенных углеводородов).
Метанол производится из метана (природного газа) посредством трех реакций: парового риформинга, конверсии водяного газа и синтеза. Затем он преобразуется в бензин по оригинальной технологии Mobil. Вначале метанол обезвоживается с получением диметилэфира, который, в свою очередь, далее дегидратируется в присутствии оригинального цеолитного катализатора ZSM-5, разработанного Mobil. В результате получается бензин, в котором содержание углеводородов с пятью и более атомами углерода достигает 80% по весу. Для прекращения реакции ZSM-5 деактивируется коксованием с добавлением избытка углерода. В дальнейшем катализатор может быть вновь активирован путем выжигания кокса потоком горячего (500 °C) воздуха. Однако число циклов реактивации ограничено.
Синтез-газ в бензин плюс (Syngas to gasoline plus process — STG+)
Синтез-газ в бензин (STG+)Этот способ основан на технологии MTG. В ходе непрерывного циклового термохимического процесса полученный из природного газа синтез-газ преобразуется в высокооктановый синтетический бензин. Весь цикл состоит из четырех этапов. Каждый этап осуществляется в отдельном реакторе с неподвижным слоем катализатора, которые последовательно соединены между собой.
Синтез метанола. В первом реакторе сингаз, проходя через слой катализатора, преобразуется в метанол, который подается во второй реактор.
Синтез диметилэфира (ДМЭ). Здесь метанол также проходит через слой катализатора и подвергается дегидратации, в результате чего на выходе получают ДМЭ.
Синтез бензина. В третьем реакторе поступивший ДМЭ с помощью катализаторов преобразуют в углеводороды, включающие парафины (алканы), ароматические углеводороды, нафтены (циклоалканы) и небольшое количество олефинов (алкенов). Все они имеют от 6 до 10 атомов углерода в молекуле.
Очистка бензина. В четвертом реакторе продукты, поступившие из третьего реактора, подвергаются трансалкированию и гидрогенизации. Это уменьшает содержание дурола (тетраметилбензола)/изодурола и триметилбензола, которые имеют высокие точки. Поэтому их содержание в бензине должно быть сведено к минимуму. В результате полученный синтетический бензин имеет высокое октановое число и необходимые вязкостные свойства.
Сепаратор. Здесь смесь, поступившая из четвертого реактора, конденсируется. Несконденсированный газ и готовый бензин разделяются. Большая часть газа направляется обратно в первый реактор для переработки. Полученный синтетический бензин состоит из парафинов, ароматических углеводородов и нафтенов.
avtonov.info
Газ - жидкость - Большая Энциклопедия Нефти и Газа, статья, страница 1
Газ - жидкость
Cтраница 1
От газов жидкости отличаются малой сжимаемостью. Сжимаемость - это свойство тел изменять свой объем под воздействием внешних сил. Для того чтобы объем жидкости заметно изменился, действующие на нее внешние силы должны быть в тысячи раз больше тех, с которыми приходится обычно иметь дело. Поэтому жидкости считают практически несжимаемыми. [1]
Адсорбция-способность газов жидкостей и растворенных тел концентрироваться на поверхности твердых тел - выражена у инертных газов также слабо. Правда, с понижением температуры она возрастает, тем не менее и при 100 ниже нуля гелий и неон не очень склонны адсорбироваться. [2]
В газах жидкости растворяются в зависимости от температуры, общего давления системы и характера газа растворителя. В метане вода растворяется заметно хуже, чем нефтяные УВ. УВ в составе газов и чем больше доля относительно легких УВ в составе жидкостей. Повышение температуры и давления способствует переходу в газовую фазу более тяжелых компонентов нефтей. В пластовых газах нефтегазоносных бассейнов может быть растворено до 600 г / м3 конденсата. [3]
Диспергированные в газах жидкости имеют, как отмечалось, очень большие поверхности контакта фаз. Поэтому жидкие струи используют при газовой абсорбции, деаэрации и десорбции небольших количеств газов, которые слабо растворяются в жидкости. Однако Симпсон [ 190а ] показал, что большая часть массообмена происходит на поверхности плоской струи жидкости вблизи распылительного сопла. Перед распадом с образованием капель эта струя становится исключительно тонкой, растягиваясь в радиальном направлении. [4]
В отличие от газов жидкости имеют более сложное внутреннее строение. [5]
В отличие от газов жидкости имеют во много раз меньшие значения коэффициента температуропроводности. Поэтому при турбулентном течении жидкости по трубопроводу влияние нестационарной теплопроводности на теплообмен существенно. [6]
В отличие от газов жидкости имеют во много раз меньшие значения коэффициентов температуропроводности. Поэтому при турбулентном течении жидкости в каналах влияние нестационарной теплопроводности на теплообмен существенно. [7]
В отличие от газов жидкости обладают весьма слабой способностью аккумулировать энергию. [8]
При образовании из газов жидкости или твердого тела атомы сближаются, внешние орбитали атомов обобществляются, образуя разрешенные энергетические зоны. Электроны перераспределяются по обобществленным орбиталям таким образом, чтобы иметь минимальную энергию. Если энергии внешних атомных орбиталей сближающихся атомов сильно различались, то перераспределение электронов между обобщественными ор-биталями приведет к тому, что электронная плотность будет максимальна вблизи атомов, имевших низко расположенные неполностью заполненные атомные орбитали. В результате образуются ионные кристаллы, состоящие из положительно и отрицательно заряженных ионов. Например, так происходит при образовании щелочно-галоидных кристаллов. Хорошим акцептором электронов является также атом кислорода, более слабым - серы. В общем случае донорная или акцепторная способность атомов характеризуется электроотрицательностью по Полингу [12] и определяется радиусом атомов, зарядом ядер, межэлектронным отталкиванием и запретом Паули. [9]
В отличие от газов жидкости характеризуются определенным объемом, но, как и газы, не имеют своей постоянной надмолекулярной структуры и формы. В жидком состоянии молекулы находятся на близком расстоянии, при котором силы взаимодействия и притяжения молекул друг к другу значительно больше, чем в газообразном. Этим обусловлено наличие сил поверхностного натяжения жидкостей в пограничном слое с газами. Силы молекулярного давления ( избыточного) измеряются в 1000 - г - Ю 000 am, что и определяет малую сжимаемость жидкостей. [10]
В отличие от газов жидкости обладают поверхностью раздела и, следовательно, поверхностной энергией. [11]
По сравнению с газами жидкости обладают значительно боль шей плотностью и меньшим мольным объемом. Так, 1 моль воды при 100 С занимает объем - 18 мл, в то время как объем пара в этих условиях равен 30600 мл. Мольный объем многих жидкостей является аддитивной величиной - он приблизительно равен сумме атомных объемов групп, входящих в молекулу жидкости. Относительное изменение объема жидкости при изменении давления ( сжимаемость) очень незначительно. Так, для уменьшения объема воды на 1 % требуется давление 200 атм. [12]
На границе с газом жидкости образуют свободную поверхность. Наблюдения показывают, что со стороны молекул поверхностного слоя жидкости на каждый элемент длины произвольной линии, расположенной в этом слое, действует сила, перпендикулярная этому элементу длины и направленная по касательной к поверхности жидкости. Эту силу называют силой поверхностного натяжения. [13]
При наличии в струе газа жидкости в коэффициенты для расчета газа по штуцеру необходимо ввести поправки, которые находятся экспериментально путем сравнения дебитов, получаемых по измерителю расхода и штуцеру. [14]
В отличие от воздуха и газов жидкости практически несжимаемы. Давление через жидкость передается так же жестко, как через рычаги и шатуны. А это позволяет осуществлять передачу громадных усилий. Например, ноги шагающего экскаватора приводятся в движение гидравлическим механизмом, многотонные прессы, ковочные манипуляторы, мощные домкраты, молоты огромной силы используют гидравлику. Короче говоря, там, где нужно осуществить передачу больших сил, очень часто выручает гидравлика. [15]
Страницы: 1 2 3 4
www.ngpedia.ru