10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля. Эбуллиоскопическая константа диэтилового эфира
Эбулиоскопические константы некоторых растворителей
| Растворитель |
| Е | Растворитель |
| Е |
| Анилин | 184,4 | 3,69 | Уксусная кислота | 118,4 | 3,10 |
| Ацетон | 56 | 1,50 | | 181,2 | 3,60 |
| Бензол | 80,2 | 2,57 | Хлороформ | 61,2 | 3,88 |
| Вода | 100 | 0,516 | Четырёххлористый углерод | 76,7 | 5,30 |
| Метилацетат | 57,0 | 2,06 | Этилацетат | 77,2 | 2,79 |
| Метиловый спирт | 64,7 | 0,84 | Пиридин | 115,4 | 2,69 |
| Нитробензол | 210,9 | 5,27 | Этиловый спирт | 78,3 | 1,11 |
| Сероуглерод | 46,3 | 2,29 | Этиловый эфир | 34,5 | 2,00 |
| Серы двуокись | -10 | 1,45 |
Таблица 3
Криоскопические константы некоторых растворителей
| Растворитель |
| К | Растворитель |
| К |
| Анилин | -6,0 | 5,87 | Нитробензол | 5,7 | 6,9 |
| Бензол | 5,5 | 5,1 | Пиридин | -42,0 | 4,97 |
| Вода | 0,0 | 1,86 | Серная кислота | 10,5 | 6,17 |
| 1,4-Диоксан | 12,0 | 4,7 | п-Тодуидин | 43,0 | 5,2 |
| Камфора | 178,4 | 39,7 | Уксусная кислота | 16,65 | 3,9 |
| п-Ксилол | | 4,3 | Фенол | 41,0 | 7,3 |
| Муравьиная кислота | 8,4 | 2,77 | Четырёххлористый углерод | -23,0 | 2,98 |
| Нафталин | 80,1 | 6,9 | Циклогексан | 6,5 | 20,2 |
Таблица 4
Константы диссоциации слабых кислот и оснований при 25ºС
| Кислота | Ка |
| Фтористоводородная HF | 6,7∙10-4 |
| Хлорноватистая HClO | 1,0∙10-8 |
| Бромноватистая HBrO | 2,0∙10-9 |
| Сероводородная h3S | 1,1∙10-7 1,0∙10-14 |
| Сернистая h3SO3 | 1,7∙10-2 1,0∙10-7 |
| Азотистая HNO2 | 5,0∙10-4 |
| Фосфорная h4PO4 | 1,1∙10-2 2,0∙10-7 3,6∙10-13 |
| Циановодородная HCN | 4,0∙10-10 |
| Угольная h3CO3 | 4,4∙10-7 5,6∙10-11 |
| Уксусная Ch4COOH | 1,8∙10-5 |
| Муравьиная HCOOH | 1,77∙10-4 |
| Бензойная C6H5COOH | 6,3∙10-5 |
| Фенол C6H5OH | 1,0∙10-10 |
| Основания | Kb |
| Анилин C6H5Nh3 | 3,8∙10-10 |
| Гидроксид аммония Nh5OH | 1,8∙10-5 |
| Гидразин N2h5∙h3O | 1,7∙10-6 |
| Пиридин C6H5N | 1,7∙10-9 |
| Метиламин Ch4Nh3 | 6,7∙10-4 |
| Этиламин C2H5Nh3 | 4,38∙10-4 |
| Диметиламин (Ch4)2NH | 5,2∙10-4 |
| Триметиламин (Ch4)3N | 5,4∙10-5 |
Таблица 5
Предельные подвижности ионов (См∙см∙моль-1) при 25ºС
| Катион |
| Анион |
|
| Н+ | 349,8 | OH- | 198,0 |
| К+ | 73,5 | I- | 76,8 |
| Na+ | 50,1 | Br- | 78,4 |
| Li+ | 38,7 | Cl- | 76,3 |
| Ag+ | 61,9 | NO | 71,4 |
| Ba2+ | 127,2 | Ch4COO- | 40,9 |
| Ca2+ | 119,0 | SO | 160,0 |
| Mg2+ | 106,1 | [Fe(CN)6]3- | 297,0 |
| Al3+ | 189,0 | [Fe(CN)6]4- | 444,0 |
| Fe3+ | 204,0 |
Таблица 6
Стандартные электродные потенциалы при Т=298 К
| Электрод | Электродная реакция | Е0, В |
| Li+/Li | Li+ + e ↔ Li | -3,045 |
| Rb+/Rb | Rb+ + e ↔ Rb | -2,925 |
| K+/K | K+ + e ↔ K | -2,925 |
| Cs+/Cs | Cs+ + e ↔ Cs | -2,923 |
| Ba2+/Ba | Ba2+ + 2e ↔ Ba | -2,906 |
| Ca2+/Ca | Ca2+ + 2e ↔ Ca | -2,866 |
| Na+/Na | Na+ + e ↔ Na | -2,714 |
| La3+/La | La3+ + 3e ↔ La | -2,522 |
| Mg2+/Mg | | -2,363 |
| Be2+/Be | Be2+ + 2e ↔ Be | -1,847 |
| Al3+/Al | Al3+ + 3e ↔ Al | -1,662 |
| Ti2+/Ti | Ti2+ + 2e ↔ Ti | -1,628 |
| V2+/V | V2+ + 2e ↔ V | -1,186 |
| Mn2+/Mn | Mn2+ + 2e ↔ Mn | -1,180 |
| Sm3+/Sm2+ | Sm3+ + e ↔ Sm2+ | -1,150 |
| Cr2+/Cr | Cr2+ + 2e ↔ Cr | -0,913 |
| Zn2+/Zn | Zn2+ + 2e ↔ Zn | -0,763 |
| Cr3+/Cr | Cr3+ + 3e ↔Cr | -0,744 |
| In3+/In2+ | In3+ + e ↔ In2+ | -0,450 |
| Fe2+/Fe | Fe2+ + 2e ↔ Fe | -0,440 |
| Cr3+/Cr2+ | Cr3+ + e ↔ Cr2+ | -0,408 |
| Cd2+/Cd | Cd2+ + 2e ↔ Cd | -0,403 |
| Ti3+/Ti2+ | Ti3+ + e ↔ Ti2+ | -0,368 |
| Co2+/Co | Co2+ + 2e ↔Co | -0,277 |
| V3+/V2+ | V3+ + e ↔ V2+ | -0,256 |
| Ni2+/Ni | Ni2++ 2е ↔Ni | -0,250 |
| Sn2+/Sn | Sn2++ 2е ↔Sn | -0,136 |
| Pb2+/Pb | Pb2++ 2е ↔Pb | -0,126 |
| Fe3+/Fe | Fe3++ 3е ↔Fe | -0,036 |
| H+/h3 | H++ е ↔ ½h3 | 0,000 |
| Sn4+/Sn2+ | Sn4++ 2е ↔Sn2+ | +0,150 |
| Cu2+/Cu+ | Cu2++ е ↔Cu+ | +0,153 |
| SO | SO | +0,303 |
| Cu2+/Cu | Cu2++ 2е ↔Cu | +0,337 |
| O2/OH- | ½ O2+ Н2О + 2е↔OH- | +0,401 |
| Cu+/Cu | Cu++ е ↔Cu | +0,521 |
| I2/I- | I2+ 2е ↔I- | +0,536 |
| Fe3+/Fe2+ | Fe3++ е ↔Fe2+ | +0,771 |
| Ag+/Ag | Ag++ е ↔Ag | +0,799 |
| Hg2+/Hg | Hg2++ 2е ↔Hg | +0,854 |
| +0,940 | ||
| Pd2+/Pd | Pd2++ 2е ↔Pd | +0,987 |
| Br2/Br- | ½ Br2+ е ↔Br- | +1,065 |
| +1,190 | ||
| Pt2+/Pt | Pt2++ 2е ↔Pt | +1,200 |
| Ti3+/Ti+ | Ti3++ 2е ↔Ti+ | +1,250 |
|
|
| +1,330 |
| Cl2/Cl- | ½ Cl2+ е ↔Cl- | +1,359 |
| PbO2/Pb2+ | PbO2 + 14Н+ + 2е ↔ Pb2+ + 2Н2О | +1,455 |
| Au3+/Au | Au3+ + 3е ↔ Au | +1,498 |
| MnO | MnO | +1,510 |
| HClO2/HClO | HClO2+ 2Н++ 2е ↔HClO+ 2Н2О | +1,640 |
| PbO2/PbSO4 | PbO2+ 4Н++SO | +1,685 |
| h3O2/h3O | h3O2+ 2Н++ 2е ↔ 2h3O | +1,776 |
| Co3+/Co2+ | Co3++ е ↔Co2+ | +1,810 |
| S2O/SO | S2O | +2,010 |
| h3/H- | ½ h3+ е ↔H- | +2,200 |
| F2/F- | ½ F2+ е ↔F- | +2,866 |
studfiles.net
Эбулиоскопические константы
| Растворитель | Е | tкип |
| Анилин | 3,22 | 184,4 |
| Ацетон | 1,48 | 56,0 |
| Ацетонитрил | 1,30 | 81,6 |
| Бензол | 2,57 | 80,2 |
| Бензонитрил | 3,87 | 191 |
| Бромбензол | 6,26 | 156,2 |
| 2-бутанол | 2,28 | 79,6 |
| Вода | 0,516 | 100 |
| Декалин | 5,76 | 191,7 |
| Диоксан | 3,27 | 100,3 |
| Дихлорметан | 2,6 | 40-41 |
| Дихлорэтилен | 3,44 | 60 |
| Диэтиловый эфир | 2,16 | 35,6 |
| Иодметан | 4,19 | 42,5 |
| Иодэтан | 5,16 | 72,4 |
| Кислота масляная | 3,94 | 163,2 |
| Растворитель | Е | tкип |
| Кислота муравьиная | 2,4 | 100,8 |
| Кислота пропионовая | 3,51 | 139,6 |
| Кислота уксусная | 3,07 | 118,5 |
| Камфора | 6,09 | 204 |
| Метилацетат | 2,06 | 56,5 |
| Метилпропилкетон | 3,14 | 102 |
| Метилэтилкетон | 2,28 | 80 |
| Нафталин | 5,8 | 218 |
| Нитробензол | 5,27 | 210,9 |
| Нитрометан | 1,86 | 102 |
| Нитроэтан | 2,60 | 114,8 |
| Н-Октан | 5,71 | 125,7 |
| Пиридин | 2,687 | 115,8 |
| Пропионитрил | 1,87 | 98 |
| Сероуглерод | 2,29 | 46,3 |
| Серы двуокись | 1,45 | -10 |
| Спирт амиловый | 2,58 | 131,5 |
| Спирт бутиловый | 1,94 | 104,6 |
| Спирт метиловый | 0,84 | 64,7 |
| Спирт пропиловый | 1,73 | 97,3 |
| Спирт этиловый | 1,2 | 78,4 |
| Тетралин | 5,58 | 207,3 |
| Тетрахлорэтилен | 5,5 | 121,9 |
| П-Толуидин | 4,14 | 200,3 |
| Толуол | 3,29 | 110,6 |
| Трихлорэтилен | 4,43 | 87,5 |
| Кусусный ангидрид | 3,53 | 140,0 |
| Фенол | 3,60 | 182,1 |
| Хлорбензол | 4,15 | 132,1 |
| Хлороформ | 3,88 | 61,2 |
| Хлорэтан | 1,95 | 12,2 |
| Циклогексан | 2,75 | 81,5 |
| Четыреххлористый углерод | 5,3 | 76,7 |
| Этилацетат | 2,79 | 75,5 |
| Этилен бромистый | 6,43 | 78,3 |
Константы диссоциации кислот и оснований в водных растворах.
В таблицах приводятся как термодинамические константы диссоциации, вычисленные с учетом коэффициентов активности, так и концентрационные («кажущиеся») константы диссоциации.
Данные, относящиеся к разным ступеням диссоциации отмечены римскими цифрами. Если дается только одно значение константы, то оно относится к первой ступени диссоциации. Для угольной кислоты и гидроксида аммония приводятся «истинные» константы диссоциации, учитывающие, что не весь растворенный СО2 и NН3 находятся в растворе в виде Н2СО3 и Nh5ОН.
Для кислот даны константы кислотности и показатели кислотности рКа=-lgКа. Для неорганических оснований приведены константы основности и показатели основности рКb=-lgКb.Для органических оснований даны константы основности и показатели констант кислотности сопряженных с данными основаниями кислот:
рКа=рКω-рКb, где Кω-ионное произведение воды, а рКω=-lgКω.
Константы диссоциации некоторых органических и неорганических оснований
| Название | Формула | Кb | рКb |
| Анилин | С6Н5NН2 Н2О | 4,2 10-10 | 9,38 |
| Гидразин | N2h5 h3O | 1,2 106 | 5,9 |
| Гидроксид алюминия | А1(ОН)3 | (III) 1,38 10-9 | 8,86 |
| Гидроксид аммония (истинная) | Nh5ОН | 6,3 10-5 | 4,2 |
| Гидроксид аммония(кажущаяся) | Nh5ОН | 1,77 10-5 | 4,75 |
| Гидроксид бария | Ва(ОН)2 | 2,3 10-1 | 0,64 |
| Гидроксид ванадия | V(OH)3 | (III) 8,3 10-12 | 11,08 |
| Гидроксид галлия | Ga(OH)3 | (II) 1,6 10-11 | 10,8 |
| (III) 4 10-12 | 11,4 | ||
| Гидроксид железа (II) | Fe(OH)2 | (II)1,3 10-4 | 3,89 |
| Гидроксид железа (III) | Fe(OH)3 | (II) 1,82 10-11 | 10,74 |
| (III) 1,35 10-12 | 11,87 | ||
| Гидроксид кадмия | Cd(OH)2 | (II) 5 10-3 | 2,3 |
| Название | Формула | Кb | рКb |
| Гидроксид кальция | Са(ОН)2 | I) 4,5 10-2 | 1,3 |
| II) 4 10-3 | 2,4 | ||
| Гидроксид лантана | La(OH)3 | (III) 5,2 10-4 | 3,3 |
| Гидроксид лития | LiOH | 6,75 10-1 | 0,17 |
| Гидроксид магния | Mg(OH)2 | (II) 2,5 10-3 | 2,6 |
| Гидроксид марганца (II) | Mn(OH)2 | (II) 5 10-4 | 3,3 |
| Гидроксид меди(II) | Cu(OH)2 | (II) 3,4 10-7 | 6,74 |
| Гидроксид натрия | NaOH | 5,9 | -0,77 |
| Гидроксид никеля | Ni(OH)2 | (II) 2,5 10-5 | 4,6 |
| Гидроксид свинца | Pb(OH)2 | I)9,6 10-4 | 3,02 |
| II) 3,0 10-8 | 7,52 | ||
| Гидроксид серебра | AgOH | 5 10-3 | 2,3 |
| Гидроксид скандия | Sc(OH)3 | (III) 7,6 10-10 | 9,12 |
| Гидроксид стронция | Sr(OH)2 | (II) 1,5 10-1 | 0,82 |
| Гидроксид таллия | Т1(ОН) | >10-1 | <1 |
| Гидроксид тория | Th(OH)4 | (IV) 2 10-10 | 9,7 |
| Гидроксид хрома(III) | Cr(OH)3 | (III) 1,02 10-10 | 9,99 |
| Гидроксид цинка | Zn(OH)2 | (II) 4 10-5 | 4,4 |
| Гидроксиламин | Nh3OH h3O | 9,33 10-9 | 8,03 |
| Гуанидин | (Н2N)2CNH h3O | 3 10-1 | 0,52 |
| Диметиламин | (СН3)2NH h3O | 1,1 10-3 | 2,97 |
| Дифениламин | (С6Н5)2NH h3O | 7,1 10-14 | 13,15 |
| Диэтиламин | (С2Н5)2NH h3O | 9,6 10-4 | 3,02 |
| Метиламин | Nh3Ch4 h3O | 4,2 10-4 | 3,77 |
| Мочевина | СО(Nh3)2 h3O | 1,5 10-14 | 13,82 |
| α-Нафтиламин | С10Н7Nh3 h3O | 8,4 10-11 | 10,08 |
| β-Нафтиламин | С10Н7Nh3 h3O | 1,3 10-10 | 9,89 |
| 8 Оксихинолин | С9Н7ON Н2О | 1 10-9 | 8,99 |
| Пиридин | С5Н5N h3O | 1,5 10-9 | 8,82 |
| Тиомочевина | СS(Nh3)2 h3O | 1,35 10-13 | 11,87 |
| Триметиламин | (Ch4)3N h3O | 8,1 10-5 | 4,09 |
| Уротропин | (СН2)6N4 h3O | 1,4 10-9 | 8,87 |
| Фенилгидразин | С6H5NHNh3 h3O | 1,6 10-9 | 8,8 |
| Хинолин | С9Н7N h3O | 6,3 10-10 | 9,2 |
| Этиламин | Сh4Ch3Nh3 h3O | 4,7 10-4 | 3,33 |
| Название | Формула | Кb | рКb |
| Этилендиамин | (h3NCh3)2 h3O | (I)9,1 10-5 | 4,04 |
| (II)1,5 10-7 | 6,82 |
studfiles.net
10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
Пример 1. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,10С. Температура кипения чистого бензола
80,20С, температура замерзания –5,40С.
Решение: По закону Рауля:
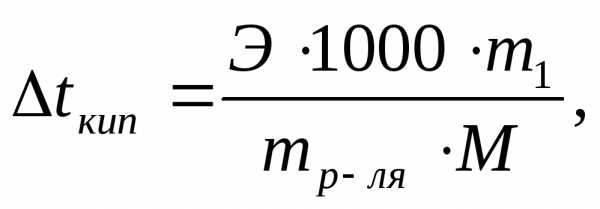
где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Ккр и Э– соответственно криоскопическая и эбулиоскопическая константы растворителя; m1- масса растворенного вещества, г; mр-ля- масса растворителя, г; М- молекулярная масса растворенного вещества; M (С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:
Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
Температура замерзания раствора: tзам= 5,4 – 4,14 =1,260C.
Пример 2. Раствор камфоры массой 0,522 г в 17 г эфира кипит при температуре на 0,4610С выше, чем чистый эфир. Эбулиоскопическая константа эфира 2,160С. Определите молекулярную массу камфоры.
Решение: Молекулярную массу камфоры определяем, пользуясь соотношением
M=
Молекулярная масса камфоры равна 155,14.
1 Вычислить повышение температуры кипения раствора, содержащего 0,488 г бензойной кислоты С7Н6О2 в 50,0 г хлороформа Ехлороформа=3, 88 град. Ответ: 0,31 град.
2 Вычислить температуру кипения раствора, содержащего 0,5 моль растворенного вещества в 1000 г ацетона. Eацетона=1,5 град; температура кипения ацетона 56,0 град. Ответ: 56,75 град.
3 Вычислить температуру кипения раствора анилина в этиловом эфире, содержащего 12 г анилина С6Н5Nh3 в 200 г раствора. Еэфира=2,12 град; температура кипения эфира 35,6 град. Ответ: 370С.
4 В каком количестве сероуглерода нужно растворить 0,1 моль вещества, чтобы раствор кипел при 470С? Температура кипения сероуглерода 46,30С; ЕCS2 =2,29 град. Ответ: 327 г.
5 Температура кипения эфира 35,60С, Еэфира=2,12 град. Вычислить молекулярную массу бензойной кислоты, если 10%-ный раствор ее в эфире кипит при 37,530С. Ответ: 122.
6 Раствор, содержащий 4,6 г глицерина С3Н5(ОН)3 в 200 г ацетона, кипит при 56,730С. Чистый ацетон закипает при 56,30C. Вычислить эбулиоскопическую константу ацетона. Ответ: 1,720.
7 Сколько граммов глюкозы С6Н12О6 растворено в 500 г воды, если раствор закипает при 100,2580С? Ответ: 45,35 г.
8 Сколько глицерина С3Н5(ОН)3 надо взять на 2 л воды, чтобы получить раствор с температурой кипения 106 °С? Ответ: 2,156 кг.
9 5 г некоторого вещества растворено в 200 г воды. Температура кипения раствора 100,4320С. Вычислить молекулярную массу растворенного вещества. Ответ: 29,6.
10 Температура кипения раствора 0,36 г фосфора в 60 г сероуглерода (Е=2,4 град) на 0,120С выше, чем у чистого растворителя. Чему равна молекулярная масса фосфора в растворе? Сколько атомов фосфора заключается в одной молекуле? Ответ: Р4.
11 Температура кипения раствора 12,8 г серы в 250 г бензола (Е=2,57град.) на 0,5140С выше, чем у чистого растворителя. Вывести молекулярную формулу серы в растворенном состоянии. Сколько атомов серы входит в состав одной молекулы этого вещества? Ответ: S8.
12 Определите температуру кипения 10%-ного водного раствора глюкозы С6Н12O6. Ответ: 100,320C.
13 Определите температуру кипения раствора 1 г нафталина С10Н8 в 20г эфира, если температура кипения эфира равна 35,60С, а Е=2,160С. Ответ:36,440С.
14 Раствор, состоящий из 9,2 г иода и 100 г метилового спирта, закипает при 65,00С. Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта 64,70С, а E=0,840. Ответ: I2.
15 Вычислить температуру кипения раствора, содержащего 100 г сахара С12Н22О11 в 750 г воды. Ответ: 100,20С.
16 Вычислить процентное содержание сахара С12Н22O11 в растворе, температура кипения которого 100,130С. Ответ: 7,88%.
17 В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,1040С? Ответ:1250 г.
18 Какая часть моля сахара C12h32O11приходится на 1 моль воды в растворе, температура кипения которого 100,0390С? Ответ: 1,35∙10-3 моль.
19 В скольких молях воды следует растворить 0,02 моля некоторого неэлектролита для получения раствора с температурой кипения 100,0260С? Ответ: 22,2 моль.
20 Температура кипения ацетона 56,10С, а Е=1,730. Вычислить температуру кипения 8%-ного раствора глицерина С3Н803 в ацетоне. Ответ:57,730С.
21 Температура кипения эфира 34,50С, а Е=2,160. Вычислить молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор этой кислоты в эфире кипит при 35,530С. Ответ: 122.
22 Температура кипения разбавленного раствора сахара C12h32O11 100,0650С. Вычислить осмотическое давление раствора при 00С. Плотность раствора принять равной единице. Ответ: 271,5 кПа.
23 Раствор 55,4 г неэлектролита в 2,5 л воды кипит при 100,160С. Чему равна молекулярная масса неэлектролита? Ответ: 72,0.
24 Повышение температуры кипения раствора 0,94 г фенола С6Н5ОН в 50 г этилового спирта (Е=1,16 град) 0,2320С. Найти молекулярную массу фенола. Ответ: 94.
25 Раствор 15г хлороформа в 400г диэтилового эфира (Е=2,02 град) кипит при температуре, превышающей температуру кипения растворителя на 0,635 °C. Вычислите молекулярную массу хлороформа. Ответ: 119,3.
26 При какой температуре должен кипеть раствор, содержащий 0,062моль неэлектролита в 200 мл воды? Ответ: 100,160С.
27 Раствор, содержащий 2,3 г С3Н8О3 в 100г ацетона (Ткип.=56,30С), кипит при 56,730С. Найдите Е для ацетона. Ответ: 1,720С.
28 Сколько граммов сахара С12h32O11 надо растворить в 100 г воды, чтобы а) повысить температуру кипения на 1 градус? б) Понизить температуру замерзания на 1 град? Ответ: а) 65,8 г; б) 18,4 г.
29 При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2O температура кипения повысилась на 0,453 градуса. Определить молекулярную массу растворенного вещества. Ответ: 145.
30 Температура кипения водного раствора сахара C12h32O11 равна 101,40С. Вычислить моляльность раствора. При какой температуре замерзает этот раствор? Ответ: 2 моль/кг; -3,720С.
31 Вычислить понижение температуры замерзания раствора, содержащего 0,2 моль растворенного вещества в 750 г бензола (К=5,12 град). Ответ: 1,365 град.
32 Температура замерзания уксусной кислоты 16,650С, а К=3,9 град. Вычислить температуру замерзания раствора, содержащего 0,1 моль растворенного вещества в 150 г уксусной кислоты. Ответ: 14,050С.
33 Вычислить температуру замерзания 10%-ного водного раствора глюкозы С6Н12О6. Ответ: -1,0480С.
34 Температура замерзания бензола 5,50С. Криоскопическая константа 5,12 град. Сколько молей растворенного вещества содержится в 125 г бензола, если раствор замерзает при 4,990С? Ответ: 0,012 моль.
35 Сколько глицерина С3Н8О3 нужно растворить в 200 г воды, чтобы раствор замерзал при -10С? Ответ: 9,9 г.
36 Водный раствор сахара замерзает при -1,050С. Сколько процентов сахара содержит этот раствор, если молекулярная масса сахара 342? Ответ:16,2%
37 Раствор, содержащий 1,74 г растворенного вещества в 45,0 г воды, замерзает при -1,20С. Вычислить молекулярную массу растворенного вещества. Ответ: 60.
38 Антифризы – жидкости с пониженной температурой замерзания, применяемые в системах охлаждения двигателей. Вычислить количество этиленгликоля С2Н4(ОН)2 которое необходимо прибавить к 1 кг воды для приготовления антифриза с температурой замерзания -150С. Ответ: 500 г.
39 При растворении 0,502 г ацетона (СН3)2 CO в 100 г уксусной кислоты температура замерзания понижается на 0,3390C. Вычислить криоскопическую константу уксусной кислоты. Ответ: 3,92 град.
40 Сколько граммов нафталина С10Н8 содержится в 3 кг бензола, если раствор замерзает при 4,550С? Т.зам. бензола 5,50С, а К=5,1 град. Ответ:71,5г.
41 В 250 г воды растворено 1,6 г некоторого неэлектролита. Температура замерзания раствора -0,20С. Вычислить молекулярную массу неэлектролита. Ответ: 59,5.
42 Раствор, содержащий 6 г мочевины в 50 г воды, замерзает при -3,720С. Вычислить молекулярную массу мочевины. Ответ: 60.
43 Для приготовления охлаждающей жидкости на 20 л воды взято 6 л глицерина С3Н8О3. Чему равна температура замерзания приготовленной смеси? Плотность глицерина равна 1,26 г/мл. Ответ: -7,560С.
44 Формалин, уксусная кислота и глюкоза имеют одинаковый элементарный состав: С – 39,97%; Н – 6,73% и О – 53,30%. Приготовлены три раствора: по 1,5 г каждого из перечисленных веществ на 25 г воды. Температура замерзания растворов равны: первого – 3,72 °C, второго -1,860С и третьего – 0,620С, Вывести молекулярные формулы указанных веществ. Ответ: Формалин СН2O; уксусная кислота СН3СOOН; глюкоза С6Н12O6.
45 Раствор 1,05 г неэлектролита в 30 г воды замерзает при -0,70С. Вычислите молекулярную массу неэлектролита. Ответ: 92,5.
46 Какова температура замерзания раствора неэлектролита, содержащего 2,02∙1023 молекул в литре воды? Ответ: -0,620С.
47 Определите формулу вещества, содержащего 39,34% углерода, 8,20% водорода и 52,46% серы, если раствор 0,2 г этого вещества в 26 г бензола замерзает при температуре на 0,3180С ниже, чем чистый бензол. Oтвет: C4h20S2.
48 Понижение температуры замерзания раствора 0,052 г камфоры в 26г бензола равно 0,0670C. Рассчитайте молекулярную массу камфоры. Ответ:152,2.
49 Для приготовления охлаждающей жидкости на 30 л воды взято 9 л глицерина С3Н8О3. Чему равна температура замерзания приготовленного раствора? Плотность глицерина равна 1,261 г/мл. Ответ: 7,60С.
50 При какой температуре будет замерзать 25%-ный раствор этилового спирта С2Н5ОН в воде? Ответ: -13,40С.
51 При какой температуре будет замерзать раствор, содержащий в 4 л воды 500 г этиленгликоля С2Н4(ОН)2? Ответ: -3,730C.
52 Сколько граммов нафталина С10Н8 находится в 8 кг бензола, если этот раствор замерзает при 3,4 50С? Температура замерзания чистого бензола 5,400С. Ответ: 392 г.
53 Вычислить процентное содержание сахара С12Н22О11 в водном растворе, температура замерзания которого -0,410С. Ответ: 7%.
54 Вычислить температуру замерзания водного раствора мочевины СО(Nh3)2 , в котором на 100 молей воды приходится 1 моль растворенного вещества. Ответ: -1,0330С.
55 Раствор сахара С12h32O11 оказывает при 270C осмотическое давление, равное 156 кПа. Принимая плотность раствора равной единице, вычислить температуру его замерзания. Ответ: -0,1190С.
56 В каком количестве воды следует растворить 0,5 кг глицерина С3H8O3 для получения раствора с температурой замерзания – 30С? Ответ:3,37кг.
57 При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,240C. Вычислить молекулярную массу растворенного вещества. Ответ: 60.
58 Водный раствор глицерина замерзает при температуре -2,790С. Вычислить число молей глицерина, приходящихся на каждые 100 молей воды, и давление пара раствора при 200С. Давление пара воды при 200С равно 2,34 кПа. Ответ: 2,7 моля.
59 Раствор сахара в воде показывает повышение температуры кипения на 0,312 °С. Вычислить величину понижения температуры замерзания этого раствора. Ответ: 1,116 °С.
60 Давление пара водного раствора глицерина составляет 98% от давления пара воды при той же температуре. Вычислить процентное содержание глицерина в растворе и температуру кристаллизации раствора. Ответ: 9,44%; -2,10С.
studfiles.net
10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
Пример 1. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,10С. Температура кипения чистого бензола
80,20С, температура замерзания –5,40С.
Решение: По закону Рауля:
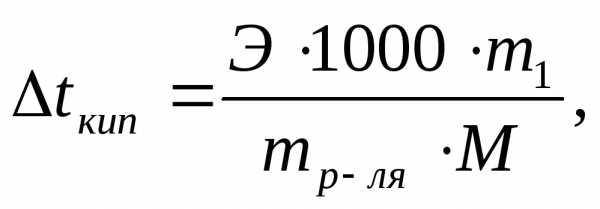
где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Ккр и Э– соответственно криоскопическая и эбулиоскопическая константы растворителя; m1- масса растворенного вещества, г; mр-ля- масса растворителя, г; М- молекулярная масса растворенного вещества; M (С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:
Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
Температура замерзания раствора: tзам= 5,4 – 4,14 =1,260C.
Пример 2. Раствор камфоры массой 0,522 г в 17 г эфира кипит при температуре на 0,4610С выше, чем чистый эфир. Эбулиоскопическая константа эфира 2,160С. Определите молекулярную массу камфоры.
Решение: Молекулярную массу камфоры определяем, пользуясь соотношением
M=
Молекулярная масса камфоры равна 155,14.
1 Вычислить повышение температуры кипения раствора, содержащего 0,488 г бензойной кислоты С7Н6О2 в 50,0 г хлороформа Ехлороформа=3, 88 град. Ответ: 0,31 град.
2 Вычислить температуру кипения раствора, содержащего 0,5 моль растворенного вещества в 1000 г ацетона. Eацетона=1,5 град; температура кипения ацетона 56,0 град. Ответ: 56,75 град.
3 Вычислить температуру кипения раствора анилина в этиловом эфире, содержащего 12 г анилина С6Н5Nh3 в 200 г раствора. Еэфира=2,12 град; температура кипения эфира 35,6 град. Ответ: 370С.
4 В каком количестве сероуглерода нужно растворить 0,1 моль вещества, чтобы раствор кипел при 470С? Температура кипения сероуглерода 46,30С; ЕCS2 =2,29 град. Ответ: 327 г.
5 Температура кипения эфира 35,60С, Еэфира=2,12 град. Вычислить молекулярную массу бензойной кислоты, если 10%-ный раствор ее в эфире кипит при 37,530С. Ответ: 122.
6 Раствор, содержащий 4,6 г глицерина С3Н5(ОН)3 в 200 г ацетона, кипит при 56,730С. Чистый ацетон закипает при 56,30C. Вычислить эбулиоскопическую константу ацетона. Ответ: 1,720.
7 Сколько граммов глюкозы С6Н12О6 растворено в 500 г воды, если раствор закипает при 100,2580С? Ответ: 45,35 г.
8 Сколько глицерина С3Н5(ОН)3 надо взять на 2 л воды, чтобы получить раствор с температурой кипения 106 °С? Ответ: 2,156 кг.
9 5 г некоторого вещества растворено в 200 г воды. Температура кипения раствора 100,4320С. Вычислить молекулярную массу растворенного вещества. Ответ: 29,6.
10 Температура кипения раствора 0,36 г фосфора в 60 г сероуглерода (Е=2,4 град) на 0,120С выше, чем у чистого растворителя. Чему равна молекулярная масса фосфора в растворе? Сколько атомов фосфора заключается в одной молекуле? Ответ: Р4.
11 Температура кипения раствора 12,8 г серы в 250 г бензола (Е=2,57град.) на 0,5140С выше, чем у чистого растворителя. Вывести молекулярную формулу серы в растворенном состоянии. Сколько атомов серы входит в состав одной молекулы этого вещества? Ответ: S8.
12 Определите температуру кипения 10%-ного водного раствора глюкозы С6Н12O6. Ответ: 100,320C.
13 Определите температуру кипения раствора 1 г нафталина С10Н8 в 20г эфира, если температура кипения эфира равна 35,60С, а Е=2,160С. Ответ:36,440С.
14 Раствор, состоящий из 9,2 г иода и 100 г метилового спирта, закипает при 65,00С. Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта 64,70С, а E=0,840. Ответ: I2.
15 Вычислить температуру кипения раствора, содержащего 100 г сахара С12Н22О11 в 750 г воды. Ответ: 100,20С.
16 Вычислить процентное содержание сахара С12Н22O11 в растворе, температура кипения которого 100,130С. Ответ: 7,88%.
17 В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,1040С? Ответ:1250 г.
18 Какая часть моля сахара C12h32O11приходится на 1 моль воды в растворе, температура кипения которого 100,0390С? Ответ: 1,35∙10-3 моль.
19 В скольких молях воды следует растворить 0,02 моля некоторого неэлектролита для получения раствора с температурой кипения 100,0260С? Ответ: 22,2 моль.
20 Температура кипения ацетона 56,10С, а Е=1,730. Вычислить температуру кипения 8%-ного раствора глицерина С3Н803 в ацетоне. Ответ:57,730С.
21 Температура кипения эфира 34,50С, а Е=2,160. Вычислить молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор этой кислоты в эфире кипит при 35,530С. Ответ: 122.
22 Температура кипения разбавленного раствора сахара C12h32O11 100,0650С. Вычислить осмотическое давление раствора при 00С. Плотность раствора принять равной единице. Ответ: 271,5 кПа.
23 Раствор 55,4 г неэлектролита в 2,5 л воды кипит при 100,160С. Чему равна молекулярная масса неэлектролита? Ответ: 72,0.
24 Повышение температуры кипения раствора 0,94 г фенола С6Н5ОН в 50 г этилового спирта (Е=1,16 град) 0,2320С. Найти молекулярную массу фенола. Ответ: 94.
25 Раствор 15г хлороформа в 400г диэтилового эфира (Е=2,02 град) кипит при температуре, превышающей температуру кипения растворителя на 0,635 °C. Вычислите молекулярную массу хлороформа. Ответ: 119,3.
26 При какой температуре должен кипеть раствор, содержащий 0,062моль неэлектролита в 200 мл воды? Ответ: 100,160С.
27 Раствор, содержащий 2,3 г С3Н8О3 в 100г ацетона (Ткип.=56,30С), кипит при 56,730С. Найдите Е для ацетона. Ответ: 1,720С.
28 Сколько граммов сахара С12h32O11 надо растворить в 100 г воды, чтобы а) повысить температуру кипения на 1 градус? б) Понизить температуру замерзания на 1 град? Ответ: а) 65,8 г; б) 18,4 г.
29 При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2O температура кипения повысилась на 0,453 градуса. Определить молекулярную массу растворенного вещества. Ответ: 145.
30 Температура кипения водного раствора сахара C12h32O11 равна 101,40С. Вычислить моляльность раствора. При какой температуре замерзает этот раствор? Ответ: 2 моль/кг; -3,720С.
31 Вычислить понижение температуры замерзания раствора, содержащего 0,2 моль растворенного вещества в 750 г бензола (К=5,12 град). Ответ: 1,365 град.
32 Температура замерзания уксусной кислоты 16,650С, а К=3,9 град. Вычислить температуру замерзания раствора, содержащего 0,1 моль растворенного вещества в 150 г уксусной кислоты. Ответ: 14,050С.
33 Вычислить температуру замерзания 10%-ного водного раствора глюкозы С6Н12О6. Ответ: -1,0480С.
34 Температура замерзания бензола 5,50С. Криоскопическая константа 5,12 град. Сколько молей растворенного вещества содержится в 125 г бензола, если раствор замерзает при 4,990С? Ответ: 0,012 моль.
35 Сколько глицерина С3Н8О3 нужно растворить в 200 г воды, чтобы раствор замерзал при -10С? Ответ: 9,9 г.
36 Водный раствор сахара замерзает при -1,050С. Сколько процентов сахара содержит этот раствор, если молекулярная масса сахара 342? Ответ:16,2%
37 Раствор, содержащий 1,74 г растворенного вещества в 45,0 г воды, замерзает при -1,20С. Вычислить молекулярную массу растворенного вещества. Ответ: 60.
38 Антифризы – жидкости с пониженной температурой замерзания, применяемые в системах охлаждения двигателей. Вычислить количество этиленгликоля С2Н4(ОН)2 которое необходимо прибавить к 1 кг воды для приготовления антифриза с температурой замерзания -150С. Ответ: 500 г.
39 При растворении 0,502 г ацетона (СН3)2 CO в 100 г уксусной кислоты температура замерзания понижается на 0,3390C. Вычислить криоскопическую константу уксусной кислоты. Ответ: 3,92 град.
40 Сколько граммов нафталина С10Н8 содержится в 3 кг бензола, если раствор замерзает при 4,550С? Т.зам. бензола 5,50С, а К=5,1 град. Ответ:71,5г.
41 В 250 г воды растворено 1,6 г некоторого неэлектролита. Температура замерзания раствора -0,20С. Вычислить молекулярную массу неэлектролита. Ответ: 59,5.
42 Раствор, содержащий 6 г мочевины в 50 г воды, замерзает при -3,720С. Вычислить молекулярную массу мочевины. Ответ: 60.
43 Для приготовления охлаждающей жидкости на 20 л воды взято 6 л глицерина С3Н8О3. Чему равна температура замерзания приготовленной смеси? Плотность глицерина равна 1,26 г/мл. Ответ: -7,560С.
44 Формалин, уксусная кислота и глюкоза имеют одинаковый элементарный состав: С – 39,97%; Н – 6,73% и О – 53,30%. Приготовлены три раствора: по 1,5 г каждого из перечисленных веществ на 25 г воды. Температура замерзания растворов равны: первого – 3,72 °C, второго -1,860С и третьего – 0,620С, Вывести молекулярные формулы указанных веществ. Ответ: Формалин СН2O; уксусная кислота СН3СOOН; глюкоза С6Н12O6.
45 Раствор 1,05 г неэлектролита в 30 г воды замерзает при -0,70С. Вычислите молекулярную массу неэлектролита. Ответ: 92,5.
46 Какова температура замерзания раствора неэлектролита, содержащего 2,02∙1023 молекул в литре воды? Ответ: -0,620С.
47 Определите формулу вещества, содержащего 39,34% углерода, 8,20% водорода и 52,46% серы, если раствор 0,2 г этого вещества в 26 г бензола замерзает при температуре на 0,3180С ниже, чем чистый бензол. Oтвет: C4h20S2.
48 Понижение температуры замерзания раствора 0,052 г камфоры в 26г бензола равно 0,0670C. Рассчитайте молекулярную массу камфоры. Ответ:152,2.
49 Для приготовления охлаждающей жидкости на 30 л воды взято 9 л глицерина С3Н8О3. Чему равна температура замерзания приготовленного раствора? Плотность глицерина равна 1,261 г/мл. Ответ: 7,60С.
50 При какой температуре будет замерзать 25%-ный раствор этилового спирта С2Н5ОН в воде? Ответ: -13,40С.
51 При какой температуре будет замерзать раствор, содержащий в 4 л воды 500 г этиленгликоля С2Н4(ОН)2? Ответ: -3,730C.
52 Сколько граммов нафталина С10Н8 находится в 8 кг бензола, если этот раствор замерзает при 3,4 50С? Температура замерзания чистого бензола 5,400С. Ответ: 392 г.
53 Вычислить процентное содержание сахара С12Н22О11 в водном растворе, температура замерзания которого -0,410С. Ответ: 7%.
54 Вычислить температуру замерзания водного раствора мочевины СО(Nh3)2 , в котором на 100 молей воды приходится 1 моль растворенного вещества. Ответ: -1,0330С.
55 Раствор сахара С12h32O11 оказывает при 270C осмотическое давление, равное 156 кПа. Принимая плотность раствора равной единице, вычислить температуру его замерзания. Ответ: -0,1190С.
56 В каком количестве воды следует растворить 0,5 кг глицерина С3H8O3 для получения раствора с температурой замерзания – 30С? Ответ:3,37кг.
57 При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,240C. Вычислить молекулярную массу растворенного вещества. Ответ: 60.
58 Водный раствор глицерина замерзает при температуре -2,790С. Вычислить число молей глицерина, приходящихся на каждые 100 молей воды, и давление пара раствора при 200С. Давление пара воды при 200С равно 2,34 кПа. Ответ: 2,7 моля.
59 Раствор сахара в воде показывает повышение температуры кипения на 0,312 °С. Вычислить величину понижения температуры замерзания этого раствора. Ответ: 1,116 °С.
60 Давление пара водного раствора глицерина составляет 98% от давления пара воды при той же температуре. Вычислить процентное содержание глицерина в растворе и температуру кристаллизации раствора. Ответ: 9,44%; -2,10С.
studfiles.net
Эбуллиоскопическая и криоскопическая константы
| Растворитель | К | Е |
| Вода | 1,86 | 0,52 |
| Бензол | 5,10 | 2,57 |
| Этиловый эфир | 2,12 | — |
| Фенол | 7,3 | 3,60 |
| Ацетон | — | 1,80 |
| Уксусная кислота | 3,9 | 3,1 |
| ССl4 | 2,98 | 5,3 |
Методы криоскопии и эбуллиоскопии позволяют определить молекулярную массу не диссоциирующих при растворении веществ (обычно органических) по понижению температуры замерзания и повышению температуры кипения растворов известной концентрации.
Закон Рауля и следствие в полной мере приложимы для описания свойств идеальных растворов. Очевидно, что понятие идеального раствора не определяется его концентрацией, достаточно лишь отсутствие взаимодействия компонентов. Однако на практике встречаются очень мало систем, которые в широком интервале концентраций удовлетворяют условию идеальности. В то же время существует категория растворов, для которых законы идеальных растворов могут быть использованы с достаточной точностью. Это так называемые разбавленные растворы, в которых концентрация растворенного вещества мала, вследствие чего можно пренебречь взаимодействием растворенных частиц. Термодинамика не устанавливает количественного критерия разбавленного раствора. Единственным критерием является применимость в данном интервале концентраций законов идеальных растворов.
Все приведенные закономерности относятся к бесконечно разбавленным идеальным растворам. Применение их к реальным растворам ограничено тем в большей степени, чем выше концентрация раствора.
Растворы электролитов и их свойства
В 1887 г. Вант-Гофф установил, что определенное экспериментально осмотическое давление в растворах электролитов превышает вычисленное практически. Подобные отклонения измеренных величин от вычисленных наблюдаются также для температуры кипения и замерзания растворов электролитов. Не зная, как можно объяснить эти отклонения, но стремясь приспособить уравнения, описывающие свойства растворов неэлектролитов, к растворам электролитов, Вант-Гофф ввел поправочный множитель i, названный изотоническим коэффициентом. Подставляя коэффициент i в уравнения для расчетов он получил соотношения, пригодные для описания свойств разбавленных растворов всех веществ, в том числе и для растворов электролитов
(Р0 - Р)/Р0 = iХА; t = iКст,; Росм = iсRТ
Коэффициент i, физический смысл которого Вант-Гофф не выяснил, зависит от природы раствора и его концентрации, но для одного и того же раствора значение i одинаково во всех трех приведенных уравнениях. Аррениус установил, что коэффициент i растет при разбавлении раствора.
Взаимодействие с растворителем растворенного вещества может вызвать распад последнего на ионы. Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссоциацией или ионизацией веществ в растворах.
Возможность и степень распада растворенного вещества на ионы определяется природой растворенного вещества и растворителя. Электролитической диссоциации подвергаются ионные соединения и молекулярные соединения с полярным типом связи в полярных растворителях. Вода является сильнейшим полярным растворителем.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая. Один из них – это диссоциация растворяющихся солей, то есть кристаллов с ионной структурой, второй - диссоциация при растворении кислот, то есть веществ состоящих из полярных молекул.
Когда кристалл соли, например хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам – положительными.
Схема растворения соли
Но если ионы притягивают к себе молекулы воды, то и последние с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
Иначе протекает диссоциация полярных молекул.
Схема диссоциации полярных молекул в растворе
Молекулы воды, притнувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов – поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды, приводит, в конечном счете, к распаду полярной молекулы на ионы. Как и в случае растворенного ионного кристалла, эти ионы гидратируются. При этом ион водорода (Н+) (т.е. протон) оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
Н2О + НСl = h4O+ + Cl-
Диссоциацию молекул кислоты можно объяснить образованием дополнительной ковалентной связи (донорно-акцепторной). При этом общую связывающую электронную пару представляют не оба атома, а только один из них.
Диссоциации веществ как ионного, так и молекулярного строения способствует полярность молекул растворителя. Поэтому не только вода, но и другие жидкости, состоящие из полярных молекул (муравьиная кислота, этиловый спирт, аммиак и др.), также являются ионизирующими растворителями, а соли, кислоты и основания, растворенные в этих жидкостях, диссоциируют на ионы.
Вещества, распадающиеся в растворах или расплавах на положительно заряженные (катионы) и отрицательно заряженные (анионы) ионы, называются электролитами. Растворы электролитов способны проводить электрический ток. Электролитами являются кислоты, щелочи, большинство солей.
Отмеченные выше отклонения свойств растворов, определенных экспериментально, от вычисленных нельзя объяснить иным, кроме как увеличением числа частиц растворенного вещества, то есть диссоциацией молекул электролита в растворе на более мелкие частицы. Аррениус пришел к следующему выводу: диссоциация молекул растворенных электролитов на ионы происходит не под действием электрического тока, а уже в процессе растворения, независимо от того, пропускают через раствор электрический ток или нет (электролитическая диссоциация). В результате этого процесса в растворе увеличивается число частиц, поэтому коэффициент i принимает значения больше единицы.
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием степени электролитической диссоциации (). Степень электролитической диссоциации равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества:
= Nu/No
где Nu - число молекул распавшихся на ионы; No - общее число молекул растворенного вещества. Степень электролитической диссоциации зависит от:
природы растворенного вещества и растворителя;
температуры;
концентрации.
Роль растворителя в процессе электролитической диссоциации велика. Чем больше диэлектрическая проницаемость растворителя, тем больше его ионизирующее действие. Растворитель уменьшает силу взаимодействия частиц в полярной молекуле или силу взаимодействия ионов в кристалле. Она связана с i соотношением
= (i-1)/(n-1).
По степени диссоциации электролиты разделяются на сильные, слабые и средние. Принято считать сильными электролитами те, для которых > 30%, слабыми - если < 3% и средние - если 3%< < 30%. К сильным электролитам относятся почти все соли, многие неорганические кислоты (НNOз, Н2SО4, НС1О4, НС1, НВr, HI и др.) и гидроксиды щелочных ( = 90%) и щелочно - земельных металлов ( ≈ 60%). Электролитами средней силы являются некоторые органические и неорганические кислоты (Н2С2О4, НСООН, Н2SО3, Н3РO4 и др.), к слабым электролитам - кислоты Н2S, НСN, Н2SiOз, НзВОз, гидроксиды многих d-элементов (Сu(ОН)2, Сr(ОН)3 и др.), а также некоторые соли (НgС12, СdСl2, Fе(SСN)3) ( ≈ 2%).
Для описания реальных свойств растворов сильных электролитов, на которые значительное влияние оказывает электростатическое взаимодействие между ионами, усиливающееся с увеличением концентрации раствора, вводится понятие эффективной (кажущейся) концентрации, или активности а. Это понятие ввел Льюис в 1907 г. Активность (а) связана с истинной концентрацией растворенного вещества (с) соотношением:
a = f∙c, (1.12)
где f - коэффициент активности. Величина f рассматривается как кажущаяся степень диссоциации сильных электролитов. Она отражает все имеющие место в данной системе взаимодействия силовых полей. Чем слабее межионное взаимодействие в растворе, тем ближе значение f к единице. В сильно разбавленных растворах f = 1, а = с. Активность выражается в тех же единицах, что и концентрация, поскольку коэффициент активности -величина безразмерная.
studfiles.net
Константа эбулиоскопическая - Справочник химика 21
| Таблица VII-1. Значение эбулиоскопической константы для различных |  |
Температура кипения ацетона 56,1°С, а его эбулиоскопическая константа равна 1,73°. Вычислить температуру кипения 8%-ного раствора глицерина СзНбОз в ацетоне. [c.100]
Эбулиоскопические Е и криоскопические / константы некоторых растворителей (град моль) [c.154]
Зная эбулиоскопическую и криоскопическую константы растворителя, можно вычислить температуры кипения и кристаллизации растворов, еслн известны их концентрации. [c.98]
Эбулиоскопические константы некоторых растворителей (Ск температура кипения) [c.418]
Раствор, состоящий из 4,6 г С8Н (ОН)8 и 200 г ацетона, кипит при 56,73 . Чистый ацетон закипает при 56,3 С. Вычислить эбулиоскопическую константу ацетона. [c.83]
Найти молекулярную массу растворенного вещества эбулиоско-пическим или криоскопичес нм методом — это значит найти такое количество его (в граммах), которое, будучи растворено в 1000 г растворителя, повысит температуру кипения раствора на величину, равную эбулиоскопической константе растворителя, или соответственно понизит температуру кристаллизации раствора на величину, равную криоскопической константе растворителя. [c.99]
Коэффициент 0,52 для водных растворов неэлектролитов является константой, называемой эбулиоскопической постоянной-, ее обозначают буквой Е. Для воды = 0,52, и она не зависит от природы растворенного вещества. [c.113]
Коллигативные свойства можно использовать для определения молекулярной массы вещества. Например, если, зная массу т растворенного вещества, определить температуру замерзания (кипения) раствора, то. найдя понижение, повышение) температуры замерзания (кипения) раствора, можно вычислить число молей п раств оренного вещества, а затем и саму молекулярную массу вещества М = т1п. Таким образом можно определить степень диссоциации или ассоциации вещества в растворе. В этом случае следует умножить правую часть уравнений (355) и (356) на введенный Вант-Гоффом в соответствии с уравнением (322) коэффициент . Понижение температуры замерзания раствора повареной соли примерно в два раза больше, чем для раствора сахарозы той же моляльной концентрации. На практике чаще используют криоскопический метод, так как он более прост в экспериментальном исполнении, а кроме того, как правило, криоскопическая константа для одного и того же растворителя больше, чем эбулиоскопическая. Для растворителя камфары, например, =40 К-кг/моль. [c.281]
Температура кипгния эфира 34,6°, а его эбулиоскопическая константа равна 2,16°. Вычислить молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор этой кислоты в эфире кипит при 35,53°С. [c.100]
Л э(к) — эбулиоскопическая (криоскопическая) константа растворителя, К-моль [c.4]
Температура кипения бензола 353,36 К. Его молярная теплота испарения при температуре кипения 30 795 Дж/моль. Определите эбулиоскопическую константу бензола. [c.202]
Эбулиоскопнческие константы - эбулиоскопическая константа (молярное повышение точки кипения раствора) [c.556]
Моляльная константа повышения температуры кипения растворителя В, называемая также эбулиоскопической констанюй, зависит только от свойств растворителя-его нормальной температуры кипения, моле- [c.141]
Коллигативные свойства растворов. Понижение давления пара, повышение температуры кипения, понижение температуры замерзания и осмотриеское давление. Моляльные константы повышения точки кипения (эбулиоскопическая константа) и понижения точки замерзания (криоскопическая константа). Определение молекулярного веса растворенного вешества. [c.119]
Решение. Значение эбулиоскопической константы бензола АГэ = 2,61 рассчитано исходя из того, что в формуле (1.9) рбр = 1000 г, а величина g численно равна концентрации, выраженной в г/1000 г растворителя. Поэтому [c.23]
Водный раствор замерзает при 271,5 К. Определите его температуру кипения и давление при 299 К. Криоскопическая константа воды 1,86° эбулиоскопическая константа воды 0,516° давление пара воды при 298 К равно 3168 Па. [c.204]
Растворы закипают при температуре, превышающей температуру кипения чистых растворителей, и кристаллизуются при температуре, лежащей ниже температуры кристаллизации чистых растворителей. Если приготовить раствор из 1000 г растворителя и 1 моля неэлектролита , то такой раствор покажет одинаковое для любого неэлектролита повышение температуры кипения по сравнению с температурой кипения чистого растворителя. Это повышение температуры кипения называется молекулярным повышением температуры кипения растворителя или его эбули-оскопической константой. Эбулиоскопическая константа воды, обозначаемая символом Е ип. равна 0,52° это значит, что растворы, содержащие по 1 молю неэлектролита на 1000 г воды, будут кипеть при 100,52° С. [c.109]
Коэффициенты пропорциональности называются соответственно эбулиоскопической Е и криоскопической К константами. [c.242]
Раствор 28,5 г СиНааОц в 250 г воды кипит при 100,172 С. Вычислить эбулиоскопическую константу воды. [c.83]
Значение К , пересчитанное на 1000 г растворителя, получило название эбулиоскопической константы, величина которой определяется только химической природой выбранного растворителя (Приложение 4). [c.22]
Константу Ез называют молярным повышением точки кипения или эбулиоскопической константой. Есл,и продолжить кривую давления пара над раствором до пересечения с кривой равновесия между твердой фазой растворителя и паром (с кривой сублимации), то получится тройная точка раствора. Кривая сублимации для раствора со впада.ет с кривой сублимации для растворителя, так как с полным правом можно принять, что при постепенном охлаждении раствора прежде всего переходит в твердое состояние растворитель. [c.279]
Давление водяного пара над раствором, содержащим 0,673 моль-кг- Mg lz, при 100° С равно 9,81 кПа. Определить температуру кипения этого раствора, если эбулиоскопическая константа воды равна 0,51. [c.16]
Температура кипения чистогоСЗг319,2 К- Раствор, содержащий 0,217-10 кг серы в 1,918 10 кг С5а, кипит при 319,304 К. Эбулиоскопическая константа сероуглерода 2,37°. Определите число атомов, которое содержится в молекуле серы, растворенной в сероуглероде, если атомная масса серы 32. [c.202]
Чистая вода кипит при 373,2 К и атмосферном давлении. Определите температуру кипения раствора, содержащего 3,291 10 кг хлорида кальция в 0,1 кг воды. Кажущаяся степень диссоциации a lj в указанном растворе 68 %. Эбулиоскопическая константа для воды 0,516°. [c.203]
Коэффициенты пропорциональности Е и К называются соответственно эбулиоскопической и криоскопической постоянной. Для определения этих постоянных использовать тот же прием, который позволяет выяснить физический смысл константы уравнения (2.54), здесь не представляется возможным. Действительно, хотя математически Е - и ДГоп при /п = 1, однако при моляльности т ] раствор столь далек от большого разбавления (в одномоляльном растворе 342 г тростникового сахара приходится на 1 л воды ), что соотношения (2.57) и [c.259]
Величина К равна 1,84 для воды и 40 для камфоры. Отметим, что криоскопические константы значительно превышают эбули-оскопические. Поэтому криоскопический метод чаше используют для определения молекулярных масс, чем эбулиоскопический. [c.203]
Казалось бы, эбулиоскопическую константу можно определить как повышение температуры кипения одномоляльного раствора. Действительно, для одномоляльного раствора = АГкип-Однако экспериментально путем измерения температуры кипения одномоляльного раствора величину Е определять нельзя, так как одномоляльные растворы — это не разбавленные растворы, а концентрированные (одномоляльный раствор сахарозы содержит 342 г его в 1000 г воды). [c.114]
Водный раствор Nh5 I, концентрация которого 0,100 моль-кг-, замерзает при —0,344°С. Найти температуру кипения раствора, если криоскопическая и эбулиоскопическая константы HjO равны 1,86 и 0,51 соответственно. [c.16]
chem21.info
3) Температуры кипения и кристаллизации
Понижение давление пара приводит к тому, что растворы кипят и замерзают при температурах, отличающихся от соответствующих температур чистого растворителя. Известно, что жидкость кипит или кристаллизуется, когда давление её насыщенного пара становится равным внешнему давлению или давлению насыщенного пара над твердой фазой, в которую она переходит.
Раствор (вследствие уменьшения давления пара) труднее достигает температуры кипения или кристаллизации. Температурный интервал, в котором раствор существует в жидкой фазе, шире, чем у чистого растворителя.
Растворы кипят при более высокой и замерзают при более низкой температурах, чем чистые растворители. Эту закономерность заметил Рауль: повышение температуры кипения или уменьшение температуры кристаллизации раствора прямопропорционально моляльной концентрации растворенного вещества.
tкип = Е Сm (7),
где Е - эбуллиоскопическая константа
Е = RТ1 кип2/1000 Н1кип. (8)
Сm – моляльная концентрация растворенного
вещества (моль/кг)
Сm = mраств. вещества 1000/ М раств . вещества m расвторителя. (9)
t крист. = К Сm (10),
где К – криоскопическая константа;
К = RТ1 крист2/1000 Н1 крист (11)
Сm – моляльная концентрация растворенного
вещества (моль/кг)
Видно, что tкип и tкрист. зависят только от числа молей растворенного вещества. Каждый моль содержит 6 1023 молекул, следовательно температуры кипения и кристаллизации зависят только от числа частиц растворенного вещества.
Второй закон Рауля: Повышение температуры кипения и понижение температуры замерзания раствора пропорциональны числу частиц растворенного вещества и не зависят от его природы.
Эбуллиоскопическая и криоскопическая константы для каждого растворителя индивидуальны и являются справочными данными:
| Растворитель | К | Е |
| Вода | 1,86 | 0,52 |
| Бензол | 5,1 | 2,57 |
| Этиловый спирт | - | 1,16 |
| Диэтиловый эфир | 1,73 | 2,02 |
Зная К или Е растворителя можно высчитать t кип и t крист, моляльную концентрацию раствора, массу растворенного вещества, его молярную массу, массу растворителя.
Пример 3: Вычислить температуру кипения и температуру кристаллизации 4,6%-ного раствора глицерина в воде, молекулярная масса глицерина равна 92 г/моль.
Решение:
tкип = Е Сm =Е mраств. вещества 1000/ М раств. вещества mрастворителя
1)Раствор содержит 4,6 г глицерина в 95,4 г воды
2)tкип = 0,52 4,6 1000/92 95,4=0,270С
3)tкрист. = К Сm =К mраств. вещ. 1000/ М раств. вещ. mрастворителя
tкрист. = 1,86 4,6 1000/92 95,4 = 0,9750С.
4)t кип р-ра = t кип р-ля + tкип = 100 + 0,27 = 100,270С
5)t крист. р-ра = t крист. р-ля + tкрист=0-0,975 = -0,9750С
ОТВЕТ: tкип = 100,270С, t крист. = -0,9750С.
Рассмотренные выше свойства зависят от молекулярной массы растворенного вещества, и поэтому используются в лабораторной практике для определения молекулярной массы растворенного вещества. Это криоскопический и эбуллиоскопический методы. Наиболее удобен криоскопический метод. Согласно этого метода:
М = К m2 1000/ tкрист m1 (12),
где М –молярная масса растворенного вещества, (г/моль)
К – криоскопическая константа растворителя,
m1 – масса растворителя,(г)
m2 – масса растворенного вещества, (г)
tкрист – изменение температуры кристаллизации
раствора (0С).
Пример 4: Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36, 860С, тогда как чистый эфир кипит при 35,6 0С. Определите молекулярную массу растворенного вещества.
Решение:
1) t кип = tкип р-ра - t кип р-ля = 36,86 – 35,6 =1,260С.
Используя формулу (12) найдем молярную массу растворенного вещества: М =2,02 8 1000/1,26 100 = 128,2 г/моль.
studfiles.net

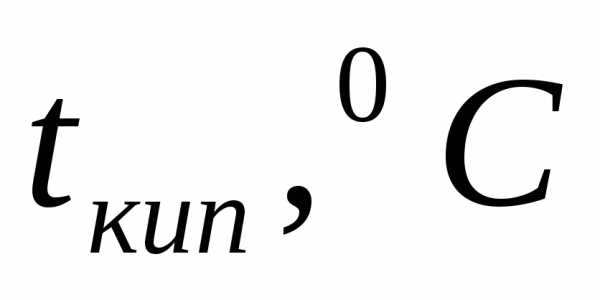
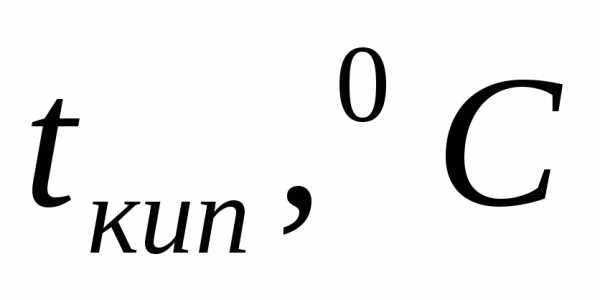
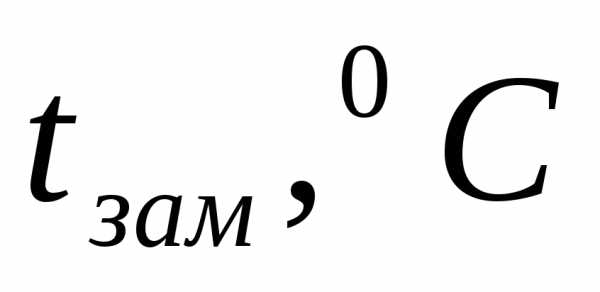
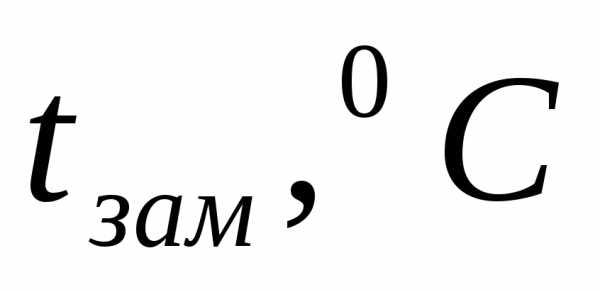
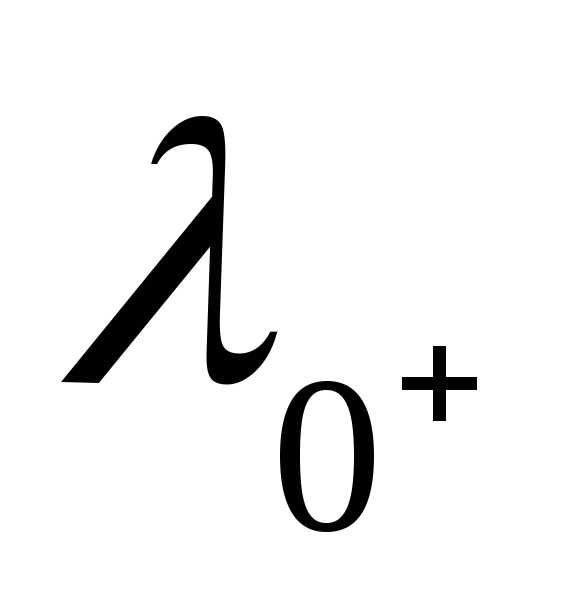
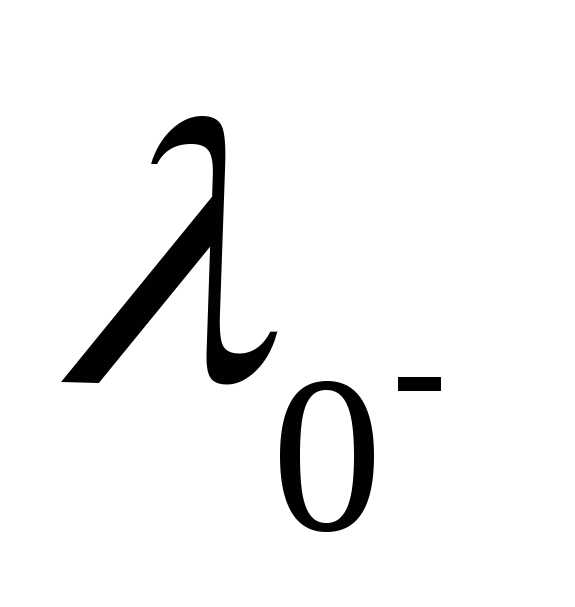
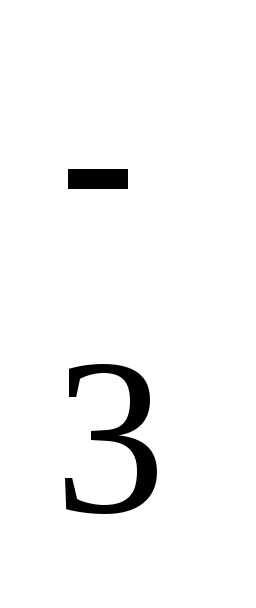
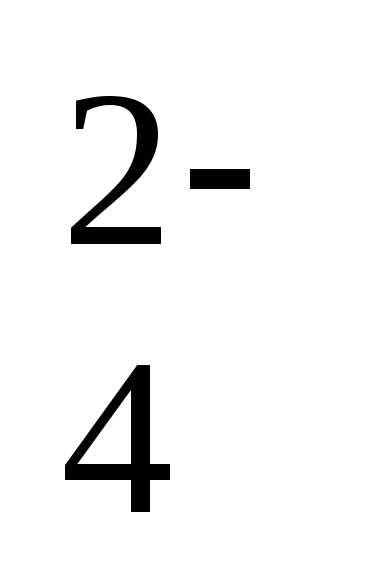
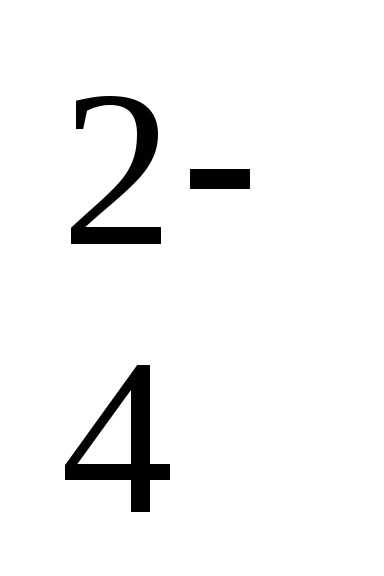 /h3S
/h3S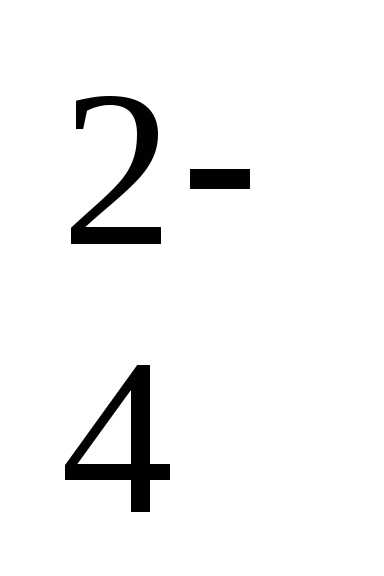
 Cr2O
Cr2O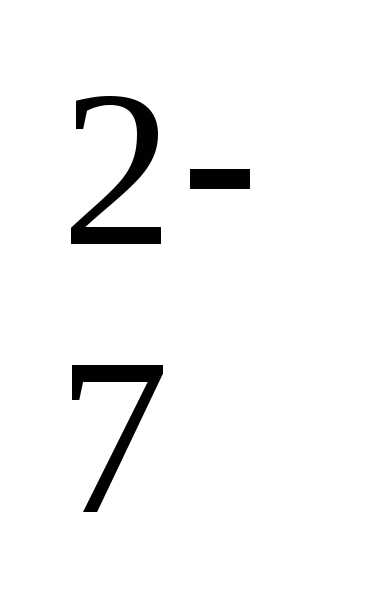 /Cr3+
/Cr3+ Cr2O
Cr2O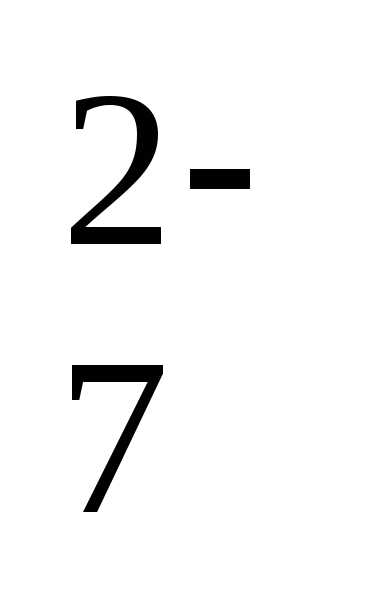 + 14Н++ 6е ↔Cr3++ 7Н2О
+ 14Н++ 6е ↔Cr3++ 7Н2О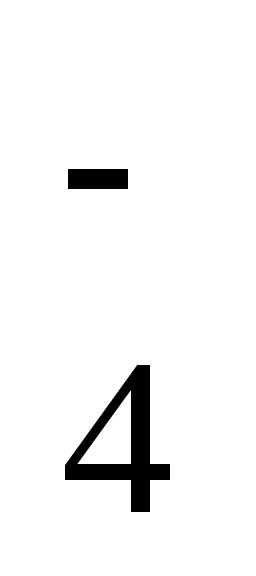 /Mn2+
/Mn2+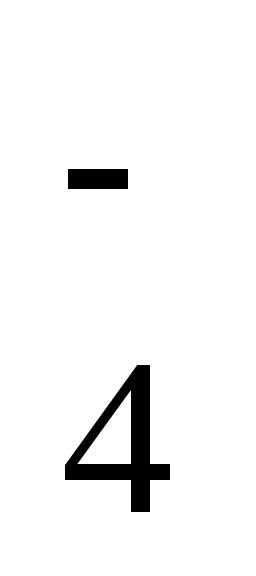 + 8Н++ 5е ↔Mn2++ 4Н2О
+ 8Н++ 5е ↔Mn2++ 4Н2О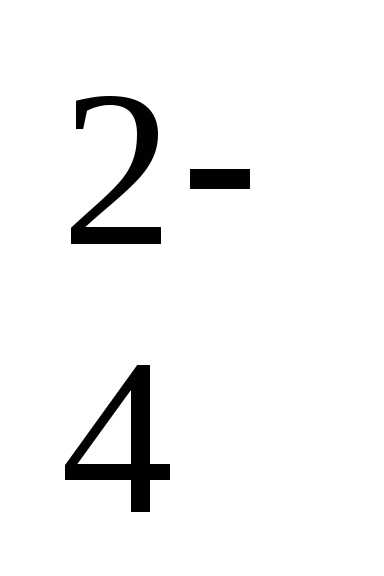 +2е ↔PbSO4+ 2Н2О
+2е ↔PbSO4+ 2Н2О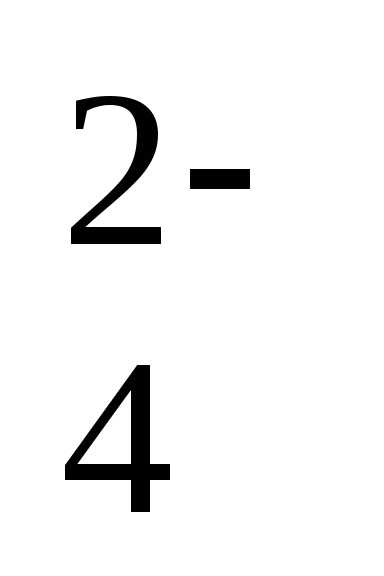
 + 2е ↔ 2SO
+ 2е ↔ 2SO