Содержание
Диметиловый эфир. Мини-справочник по химическим веществам (3340 веществ)
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Синонимы:
метиловый эфир
Внешний вид:
бесцветн. газ
Брутто-формула (система Хилла): C
2H6O
Формула в виде текста: Ch4OCh4
Молекулярная масса (в а.е.м.): 46,07
Температура плавления (в °C): -138,5
Температура кипения (в °C): -23,65
Растворимость (в г/100 г или характеристика):
ацетон: растворим
бензол: мало растворим
вода: растворим
диэтиловый эфир: растворим
хлороформ: растворим
этанол: растворим
Способы получения:
1. Получают из метанола действием серной или фосфорной кислот.
Получают из метанола действием серной или фосфорной кислот.
Плотность:
2,091 (20°C, г/см3)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-185,3 (г)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-114,2 (г)
Стандартная энтропия образования S (298 К, Дж/моль·K):
266,6 (г)
Стандартная мольная теплоемкость C
p (298 К, Дж/моль·K):
65,94 (г)
Температура самовоспламенения на воздухе (°C):
350
Теплота сгорания Q
p(кДж/моль):
1454,3
Критическая температура (в °C):
126,9
Критическое давление (в МПа):
5,3
Дополнительная информация:
Устойчив к щелочным металлам и щелочам, расщепляется иодоводородом до метилиодида и метанола. Дает продукты присоединения с сильными безводными кислотами и галогеноводородами, называемые вторичные оксониевые соли. При реакции с галогеналкилами в присутствии сильных кислот Льюиса образуются третичные оксониевые соли, являющиеся сильными алкилирующими агентами, разлагаемыми водой.
Дает продукты присоединения с сильными безводными кислотами и галогеноводородами, называемые вторичные оксониевые соли. При реакции с галогеналкилами в присутствии сильных кислот Льюиса образуются третичные оксониевые соли, являющиеся сильными алкилирующими агентами, разлагаемыми водой.
- Каррер П. «Курс органической химии» 2-е изд., под ред. Колосова М.Н., Л.:ГНТИХЛ, 1962 стр. 150-152
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 144
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- ДИМЕТИЛОВЫЙ ЭФИР — химическая энциклопедия
2.2.3.Простые эфиры.
Простые эфиры
можно рассматривать как производные
спиртов или фенолов, в которых атом
водорода замещен на какой-либо
углеводородный радикал:
R-O — R R-O — C6H5
Согласно номенклатуре
ИЮПАК простые эфиры называют, прибавляя
к названию главной цепи в качестве
префикса название алкокси-группы (R-O )
или для эфиров фенолов — арилоксигруппы
(Ar-O-), например:
CH3—
CH2
— O- CH2-CH2—
CH3
C6H5
-O — C6H13
этоксипропан
феноксигептан
Простые эфиры
называют так же, используя названия
радикалов с добавлением окончания —
овый эфир, например:
CH3-CH2-O-
CH2CH3
CH3—
O- CH=CH2
диэтиловый эфир
метилвиниловый эфир
Получение простых
эфиров.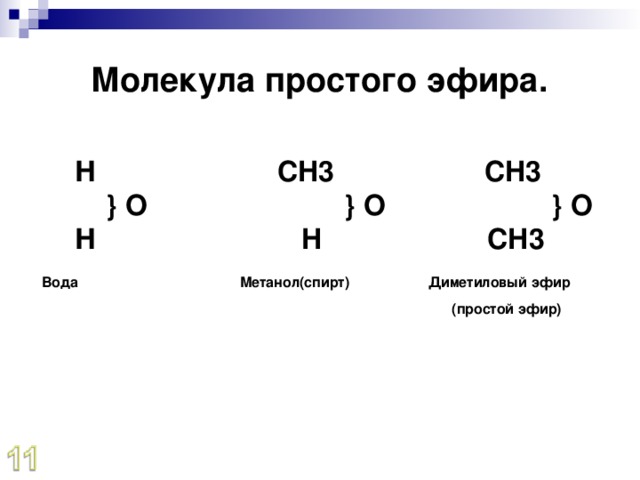
Общим способом
получения простых эфиров является
действие алкоксидов или феноксидов на
алкилгалогениды:
RO-Na
+ R — I R-O- R + NaI
С6Н5—
ОNa
+ R- Br C6H5OR
+ NaBr
Простые эфиры
спиртов можно получать дегидратацией
двух молекул спирта в присутствии
кислоты. Этим методом получают лишь
симметричные эфиры:
кислота
2
R-OH R-O-R + H2O
Образование эфира
в результате межмолекулярной дегидратации
служит примером нуклеофильной атаки
на протонированный по гидроксилу спирт
другой молекулой спирта:
Физические
свойства простых эфиров.
Простые эфиры –
жидкости с низкими температурами
кипения. Объясняется это тем, что простые
эфиры не образуют водородных связей из
— за отсутствия подвижного атома водорода.
Так, этиловый спирт кипит при 780С,
а диэтиловый эфир с большей молекулярной
массой — 360
С. Большинство простых эфиров не
смешиваются с водой, хорошо растворяют
многие органические вещества и поэтому
часто используются как растворители,
но они весьма огнеопасны.
Химические
свойства.
Простые эфиры
–значительно более инертные соединения,
чем спирты, где химическая активность
обусловлена наличием гидроксильной
группы. Простые эфиры устойчивы к
действию щелочных металлов и щелочей,
однако эфиры являются слабыми основаниями:
в сильнокислой среде за счет протонирования
атома кислорода превращаются в нестойкие
оксониевые соединения, легко гидролизующиеся
при действии избытка воды:
гидрохлорид
диэтилоксония
Наиболее важной
реакцией простых эфиров является их
расщепление под действием иодистоводородной
или бромистоводородной кислоты при
нагревании.
Приведенное выше расщепление диметилового эфира представляет собой sn2 реакцию. Однако другие простые эфиры могут расщепляться и по механизму sn1. I
П
ри
хранении, особенно на свету, простые
эфиры медленно окисляются кислородом
воздуха, образуя крайне взрывчатые
гидропероксиды, поэтому работа с простыми
эфирами требует крайней осторожности.
2.2.4. α — Оксиды
-Оксиды (эпоксиды)
являются так же простыми эфирами,
например:
Этиленоксид
Циклогексеноксид
- Оксиды — это
особого рода эфиры, так как валентные
углы в их молекулах искажены и атомы не
могут быть расположены так, чтобы
обеспечить максимальное перекрывание
орбиталей, следствием чего является их
высокая реакционная способность.
α-Оксиды очень легко вступают в реакции,
катализируемые как кислотой, так и
основанием. Важная особенность
эпоксисоединений — образование соединений,
содержащих две функциональные группы.
Так, при взаимодействии с водой образуются
1,2-диолы (гликоли) – (1), с аминами —
аминоспирты(2), cо спиртами — алкоксиспирты(3)
и т.д.
Н
апример:
Считается, что
введение гидроксильной группы во многие
природные соединения происходит через
стадию
— эпоксида — промежуточного соединения,
образующегося при действии кислорода
на двойную углерод — углеродную связь
в присутствии соответствующего фермента
(оксигеназы).
Из соединений,
относящихся к простым эфирам, большой
интерес представляют так называемые
“краун” эфиры. Свое название они
получили в соответствии с особенностями
их пространственного строения. Это
макроциклические структуры, в состав
которых входят атомы кислорода. При их
названии вначале указывается общее
число атомов в цикле, а затем — число
атомов кислорода в нем. Например:
18-краун-6
Уникальное свойство
краун-эфиров состоит в способности
образовывать комплексы с солями щелочных
металлов. Эти комплексы получаются за
Эти комплексы получаются за
счет электростатического взаимодействия
соответствующего катиона и отрицательных
концов С-О — диполей циклического эфира.
Краун – эфиры — перспективные
комплексообразователи, c помощью них
можно моделировать транспорт ионов
через клеточные мембраны. Примером
может служить 18-краун-6, образующий
прочный комплекс с ионом калия:
2.2.5.Двухатомные
спирты, или гликоли.
Если в углеводороде
заместить два атома водорода у разных
атомов углерода на гидроксильные группы,
то образуются двухатомные спирты, или
гликоли. Если две или три гидроксильные
группы содержатся у одного атома
углерода, то такие соединения нестабильны:
они легко теряют воду и превращаются в
карбонильные соединения (1) или кислоты
(2):
(1)
(2)
Физические
свойства гликолей.
Увеличение числа
гидроксильных групп в диолах приводит
к тому, что увеличивается число
межмолекулярных водородных связей
между молекулами спирта, вследствие
чего температуры кипения диолов еще
выше, чем у спиртов Так, этандиол-1,2(
этиленгликоль) кипит при температуре
1980С
(этанол имеет температуру кипения 780С).
Химические
свойства гликолей.
Гликоли — это
спирты, и большая часть химических
свойств гликолей является химическими
свойствами спиртов, которые были уже
обсуждены. Отметим лишь некоторые
отличия. По сравнению с одноатомными
спиртами гликоли обладают большей
кислотностью (для этиленгликоля рН
=14,7), поэтому водород в гликолях более
подвижен, чем в спиртах. Так, качественной
реакцией на диолы является образование
окрашенных хелатных соединений с
гидроксидами тяжелых металлов:
cинее
окрашивание
Г
ликоли
дают все реакции, характерные для
одноатомных спиртов, с той лишь разницей,
что реакция может затрагивать либо
одну, либо две гидроксильные группы,
давая два ряда производных: моно — и
дизамещенные производные гликолей.
Например, при взаимодействии со спиртом
получаются
монометиловый
эфир диметиловый эфир
этиленгликоля
этиленгликоля
(метилцеллозольв)
(моноглим)
Эти и этиловые
эфиры широко используются как растворители.
Весьма специфической
реакцией на гликоли является реакция
окисления иодной кислотой. В этом случае
происходит разрыв углерод-углеродной
связи с образованием по месту разрыва
карбонильной группы:
Это реакция
аналитическая и играет большую роль в
определении структур сахаров.
Диметиловый эфир | 115-10-6
Химические свойства
Диметиловый эфир представляет собой сжиженный газ и существует в виде жидкости при комнатной температуре, когда содержится под собственным давлением паров, или в виде газа при воздействии на него комнатной температуры и давления.
Это прозрачная бесцветная жидкость практически без запаха. В высоких концентрациях газ имеет слабый эфироподобный запах.
Использование
Метиловый эфир используется в качестве пропеллента для аэрозолей и в холодильных установках.
Использование
Аэрозольный пропеллент; альтернативное дизельное топливо; химический промежуточный продукт.
Использование
Диметиловый эфир используется в качестве растворителя в аэрозольных препаратах.
Методы производства
Диметиловый эфир получают реакцией битуминозных или бурых углей с водяным паром в присутствии тонкоизмельченного никелевого катализатора. В результате этой реакции образуется формальдегид, который затем восстанавливается до метанола и диметилового эфира. Диметиловый эфир также можно получить дегидратацией метанола.
Определение
ЧЭБИ: эфир, в котором атом кислорода связан с двумя метильными группами.
Общее описание
Диметиловый эфир — бесцветный газ со слабым эфирным запахом. Диметиловый эфир транспортируют в виде сжиженного газа под давлением паров. Контакт с жидкостью может вызвать обморожение. Диметиловый эфир легко воспламеняется. Его пары тяжелее воздуха. Любая утечка может быть как жидкостью, так и паром. Диметиловый эфир может вызвать удушье при вытеснении воздуха. При длительном воздействии огня или сильного нагрева контейнеры могут сильно разорваться и взорваться.
Диметиловый эфир легко воспламеняется. Его пары тяжелее воздуха. Любая утечка может быть как жидкостью, так и паром. Диметиловый эфир может вызвать удушье при вытеснении воздуха. При длительном воздействии огня или сильного нагрева контейнеры могут сильно разорваться и взорваться.
Реакции воздуха и воды
Легко воспламеняется. При стоянии и воздействии воздуха (кислорода) склонность к образованию взрывоопасных перекисей. При нагревании (перегонке) эфиров, содержащих пероксиды, они могут детонировать [Льюис, 3-е изд., 1993, с. 854].
Профиль реактивности
Диметиловый эфир — бесцветный легковоспламеняющийся газ (т.кип. -24°С), слаботоксичный. Очень опасная опасность пожара и взрыва при воздействии пламени, искр, тепла или сильных окислителей. Бурная реакция с гидридом алюминия, алюмогидридом лития. При стоянии и воздействии воздуха (кислорода) склонность к образованию взрывоопасных перекисей. При нагревании (перегонке) эфиров, содержащих пероксиды, они могут детонировать [Льюис, 3-е изд., 19].93, с. 854].
При нагревании (перегонке) эфиров, содержащих пероксиды, они могут детонировать [Льюис, 3-е изд., 19].93, с. 854].
Опасность для здоровья
Метиловый эфир обладает низкой ингаляционной токсичностью у крыс. Caprino и Togna (1975) сообщили о 30-минутном значении LC50, равном 396 ppm для крыс. В смертельных дозах вызывал седативный эффект, постепенное угнетение двигательной активности, выпадение зрительного рефлекса, гипопноэ, кому и гибель мышей. Воздействие 40% смеси метилового эфира с воздухом вызывало у кроликов вначале незначительное учащение сердцебиения, а затем снижение артериального давления. Смерть наступила через 45 минут. Выявлено снижение артериального и венозного парциального давления кислорода при одновременном повышении венозного давления СО2 и рН крови.0005 Реузель и др. (1981) сообщили, что субхроническое вдыхание метилового эфира у крыс не вызывало значительных побочных эффектов. Не наблюдалось заметного влияния на массу органов и тела и никаких изменений, связанных с лечением.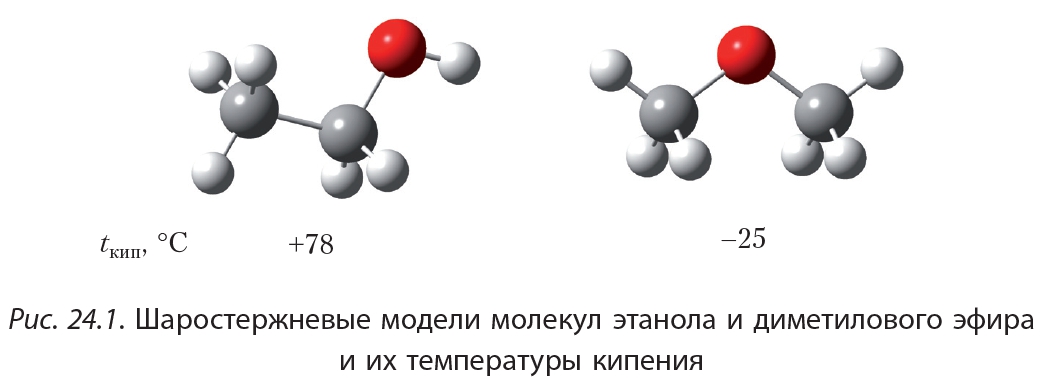 У человека вредное воздействие на здоровье от вдыхания этого соединения должно быть минимальным. Однако вдыхание чрезмерных количеств может вызвать интоксикацию и потерю сознания.
У человека вредное воздействие на здоровье от вдыхания этого соединения должно быть минимальным. Однако вдыхание чрезмерных количеств может вызвать интоксикацию и потерю сознания.
Пожарная опасность
Поведение при пожаре: Контейнеры могут взорваться. Пары тяжелее воздуха и могут перемещаться на большие расстояния к источнику воспламенения и вспыхивать обратно.
Химическая реактивность
Реакция с водой Нет реакции; Реактивность с обычными материалами: Нет реакции; Стабильность при транспортировке: стабильно; Нейтрализующие агенты для кислот и едких веществ: Не применимо; Полимеризация: Не относится; Ингибитор полимеризации: Не применимо.
Фармацевтические приложения
Диметиловый эфир может использоваться в качестве пропеллента для аэрозолей для местного применения в сочетании с углеводородами и другими пропеллентами. Как правило, его нельзя использовать отдельно в качестве топлива из-за высокого давления паров. Диметиловый эфир является хорошим растворителем и обладает уникальным свойством высокой растворимости в воде по сравнению с другими пропеллентами. Он часто используется с водными аэрозолями. При использовании диметилового эфира в качестве пропеллента образуется грубая влажная струя.
Как правило, его нельзя использовать отдельно в качестве топлива из-за высокого давления паров. Диметиловый эфир является хорошим растворителем и обладает уникальным свойством высокой растворимости в воде по сравнению с другими пропеллентами. Он часто используется с водными аэрозолями. При использовании диметилового эфира в качестве пропеллента образуется грубая влажная струя.
Диметиловый эфир также используется в качестве пропеллента в косметике, такой как лаки для волос, и в других аэрозольных продуктах, таких как освежители воздуха и спреи от мух.
В качестве хладагента дополнительно используется диметиловый эфир.
Безопасность
Диметиловый эфир может использоваться в качестве пропеллента и растворителя в фармацевтических аэрозолях для местного применения и обычно считается практически нетоксичным и не вызывающим раздражения материалом при использовании в таких применениях. Однако вдыхание высоких концентраций паров диметилового эфира вредно.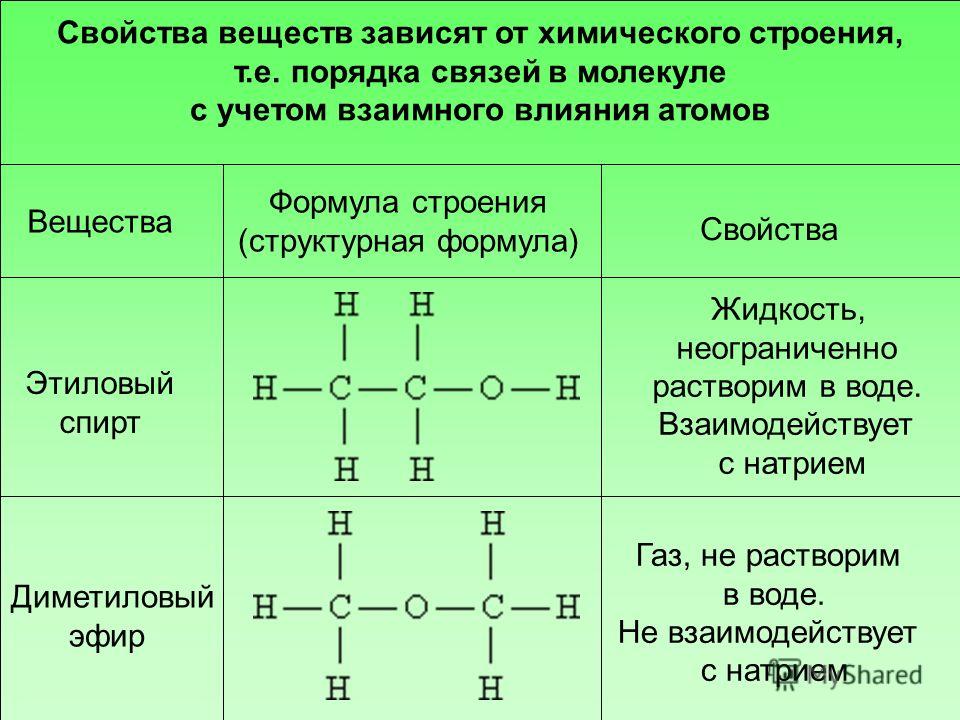 Кроме того, контакт кожи с жидким диметиловым эфиром может привести к обморожению кожи и сильному обморожению.
Кроме того, контакт кожи с жидким диметиловым эфиром может привести к обморожению кожи и сильному обморожению.
При использовании в составах для местного применения диметиловый эфир может оказывать охлаждающее действие на кожу, хотя при использовании по назначению пропеллент быстро испаряется и не вызывает раздражения.
LD50 (мышь, вдыхание): 386000 частей на миллион/30 мин
LD50 (крыса, вдыхание): 308 г/м3
Канцерогенность
Пожизненное исследование на крысах не
вызвать рак или явные, статистически значимые признаки
хроническая токсичность при 25 000 частей на миллион диметилового эфира.
Экологическая судьба
Ожидается, что
ДМЭ выброшен в атмосферу.
почти полностью находится в паровой фазе, так как давление пара
4450 мм рт.ст. при 25 ℃. Подвержен фотоокислению через
парофазная реакция с фотохимически полученным гидроксилом
радикалы.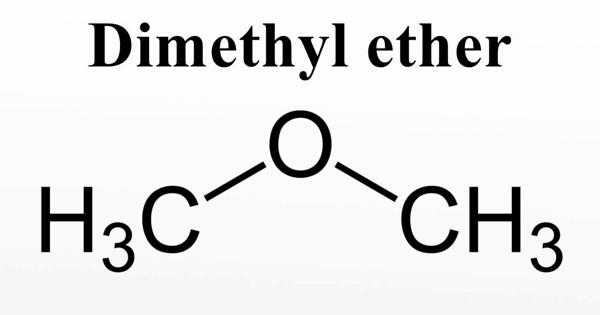 Был рассчитан период полураспада в атмосфере 5,4 дня.
Был рассчитан период полураспада в атмосфере 5,4 дня.
Он также будет проявлять очень высокую подвижность в почве и, следовательно, может
вымывание в грунтовые воды. Если ДМЭ попадет в воду, он не
ожидается либо значительное поглощение осадками, либо взвешенными
твердые частицы, биоконцентраты в водных организмах или
непосредственно фотолизовать. Нет данных о биодеградации
ДМЭ в окружающей среде были обнаружены, но многие эфиры
Известно, что они устойчивы к биоразложению. ДМЭ не будет
ожидается биоконцентрация в водных организмах.
хранилище
Сжиженный газ стабилен при использовании в качестве топлива. Однако длительное воздействие воздуха может привести к медленному образованию взрывоопасных перекисей.
Растворы жидкого диметилового эфира не следует концентрировать ни перегонкой, ни выпариванием. Диметиловый эфир следует хранить в плотно закрытых металлических баллонах в сухом прохладном месте.
Методы очистки
Сухой метиловый эфир пропусканием над оксидом алюминия и затем BaO или над Cah3 с последующей фракционной перегонкой при низких температурах. Его растворимость составляет 37 мл на мл воды при 18°, и он хорошо растворим
Его растворимость составляет 37 мл на мл воды при 18°, и он хорошо растворим
.
Оценка токсичности
Более высокие концентрации ДМЭ действуют на центральную нервную
системы (ЦНС) для создания наркоза. Эффекты быстро
обратимый, что согласуется с очень быстрой биоэлиминацией
молекулы. В прошлом DME был
рассматривается для использования в качестве анестезирующего средства для человека. Следует отметить
что это химическое вещество может вызвать сердечную сенсибилизацию, подобную
эффекты адреналина.
Несовместимость
Диметиловый эфир является агрессивным растворителем и может воздействовать на прокладочные материалы, используемые в аэрозольной упаковке. Окислители, уксусную кислоту, органические кислоты и ангидриды нельзя использовать с диметиловым эфиром.
Регуляторный статус
Включен в базу данных неактивных ингредиентов FDA (аэрозоли для местного применения).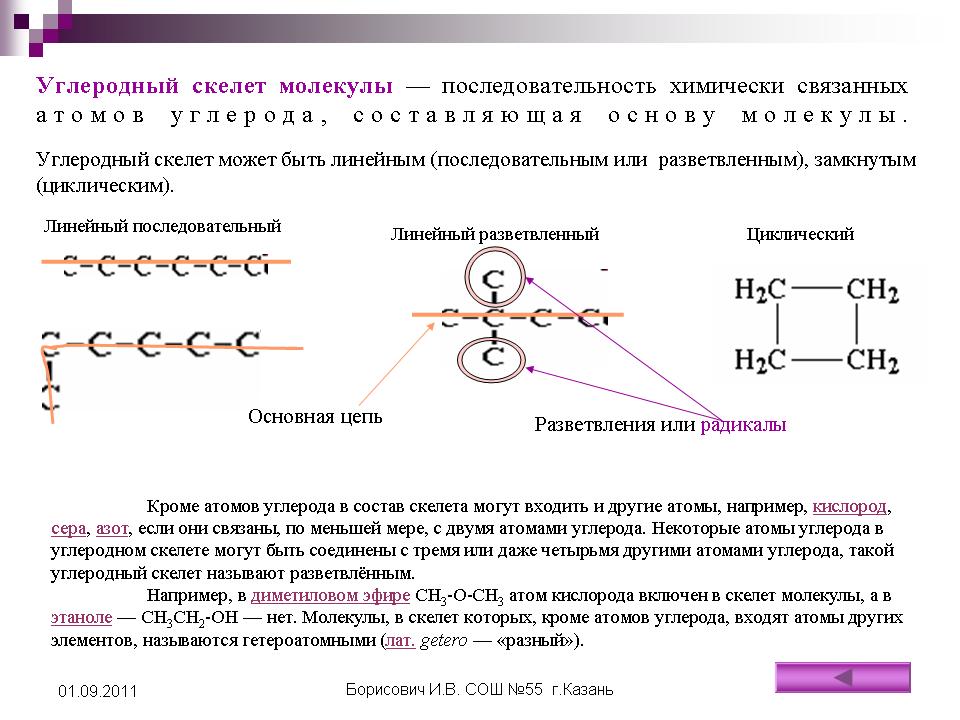 Входит в состав непарентеральных препаратов, лицензированных в Великобритании. Включен в Канадский список допустимых немедицинских ингредиентов.
Входит в состав непарентеральных препаратов, лицензированных в Великобритании. Включен в Канадский список допустимых немедицинских ингредиентов.
ДИМЕТИЛОВЫЙ ЭФИР
Подробности
| Стереохимия | АХИРАЛ |
| Молекулярная формула | С2Н6О |
| Молекулярный вес | 46.0685 |
| Оптическая активность | НИКТО |
| Определенные стереоцентры | 0 / 0 |
| Центры E/Z | 0 |
| Плата | 0 |
ШОУ УЛЫБКИ / ИнЧИ
Поиск структуры
УЛЫБКИ
ИнЧИ
InChIKey=LCGLNKUTAGEVQW-UHFFFAOYSA-N
ИнЧИ=1S/C2H6O/c1-3-2/h2-2h4
СКРЫТЬ УЛЫБКИ / ИнЧИ
Описание
Источники: https://www.ncbi.nlm.nih.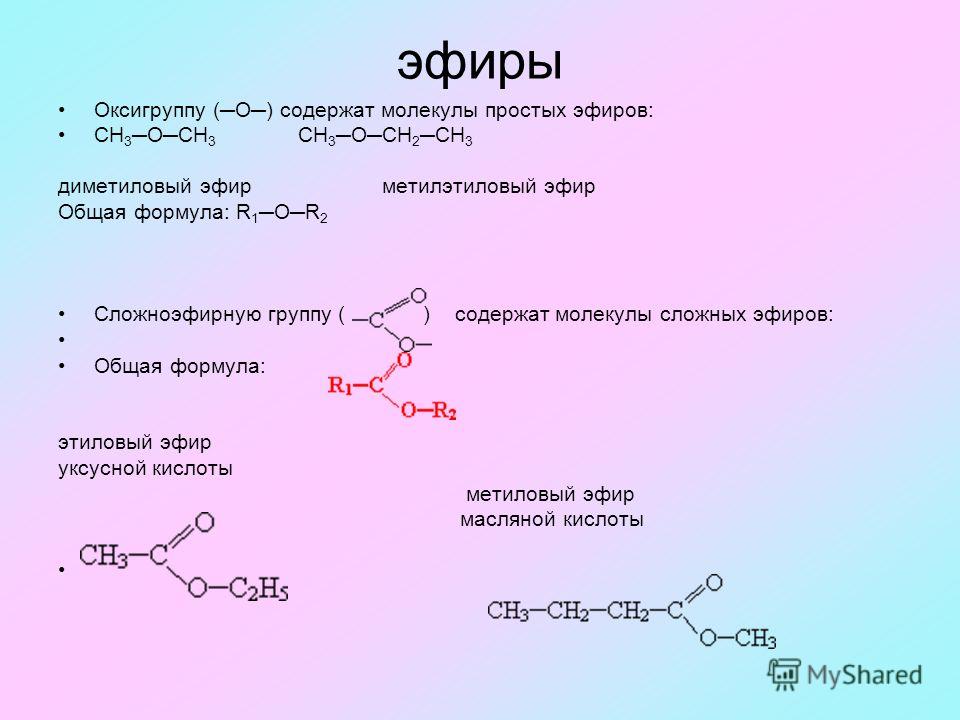 gov/pubmed/8963007 | https://www.pharmacytimes.com/publications/issue/2006/2006-07/2006-07-5674
gov/pubmed/8963007 | https://www.pharmacytimes.com/publications/issue/2006/2006-07/2006-07-5674
Диметиловый эфир в сочетании с пропаном разрешен к применению в домашних условиях для криотерапии бородавок. Тем не менее, этот холодный спрей следует использовать очень осторожно, чтобы не повредить незатронутые участки кожи.
Год утверждения
1993
136 Условия
Условия
| Условие | Модальность | Цели | Высшая фаза | Продукт |
|---|
WARTS | Первичный | Утверждено 8043 | Неизвестно Разрешенное использованиеНеизвестно |
ПабМед
пабмед
| Название | Дата | PubMed |
|---|---|---|
Производство микотоксинов Alternaria Alternaria alternata, выделенных из поврежденной погодными условиями пшеницы.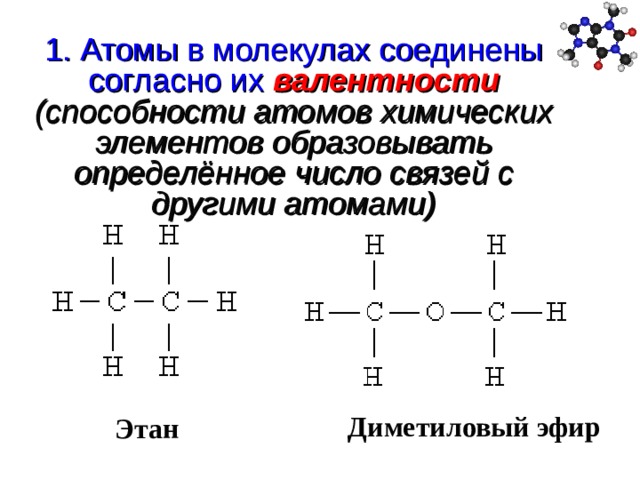 | 2001 Апрель | 11307900 |
| Структурные эффекты на фрагментацию метоксизамещенных катион-радикалов 1-арилалканола в водном растворе, вызванную ОН: роль кислородной кислотности. | 2001 1 апреля | 11330893 |
| Конформационный анализ индольных алкалоидов коринантеина и дигидрокоринантеина с помощью динамической спектроскопии ЯМР 1Н и вычислительных методов: стерические эффекты этиловой и винильной группы. | 2001 6 апреля | 11281758 |
| Липопротеины низкой плотности-антиоксиданты Saururus chinensis. | 2001 Декабрь | 11754613 |
| Потенциал артеметера для борьбы с шистосомозом. | 2001 Декабрь | 11730781 |
Природа неправильной водородной связи с синим сдвигом подтверждена экспериментально.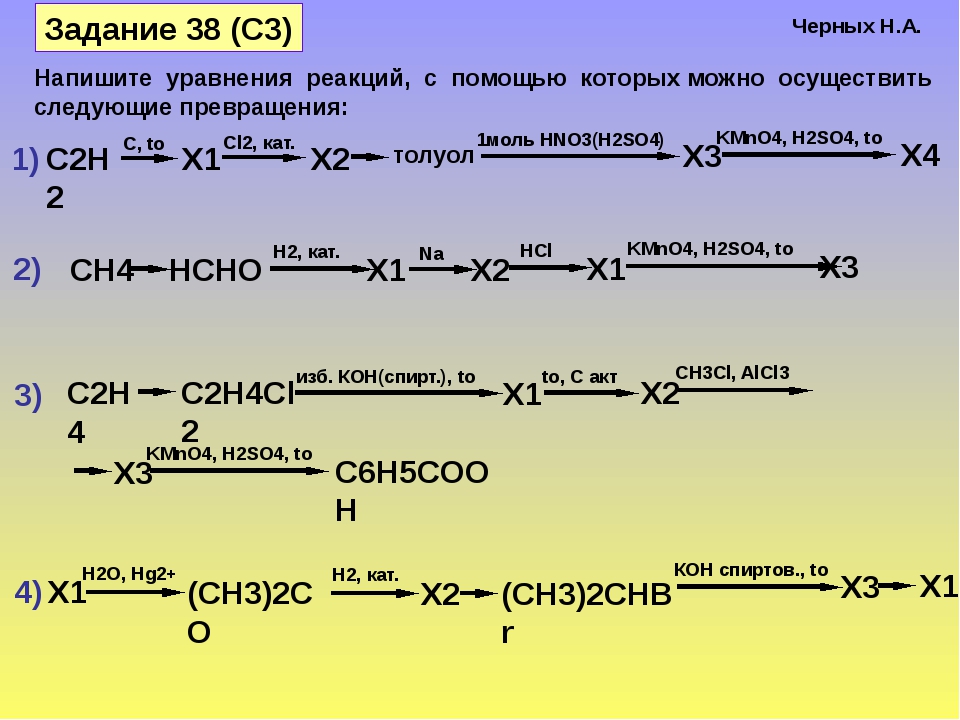 | 2001 12 декабря | 11734029 |
| Очистка, кристаллизация и предварительный рентгеноструктурный анализ глюкозо-1-фосфатазы Escherichia coli. | 2001 Февраль | 11173491 |
| Синтез, разложение и структурные исследования в газовой фазе и твердом состоянии N,N-диметиламинооксигермана. | 2001 12 февраля | 11225108 |
| Определение RS,E/Z-токотриенолов методом ВЭЖХ. | 2001 16 февраля | 11269521 |
| Выбросы полулетучих и твердых частиц при сжигании альтернативного дизельного топлива. | 2001 февраль-март | 11219694 |
| Формиаты низкотемпературного окисления диметилового эфира. | 2001 февраль-март | 11219683 |
Кристаллизация комплекса фактора элонгации дрожжей eEF1A-eEF1B альфа. | 2001 Январь | 11134944 |
| Оценка репродуктивной токсичности с использованием Xenopus laevis: борная кислота, кадмий и монометиловый эфир этиленгликоля. | 2001 январь-февраль | 11180279 |
| Оценка тетраглима для обогащения и анализа летучих органических соединений в воздухе. | 2001 13 июля | 11486865 |
| Репеллентная активность эстрогенных соединений в отношении зооспор фитопатогенного гриба Aphanomyces cochlioides. | 2001 март-апрель | 11371017 |
| Синтез и иммунологическая активность водорастворимых пролекарств талидомида. | 2001 Май | 11377186 |
Метод контроля аэрозольных глимов и его применение для измерения выбросов отработавших газов.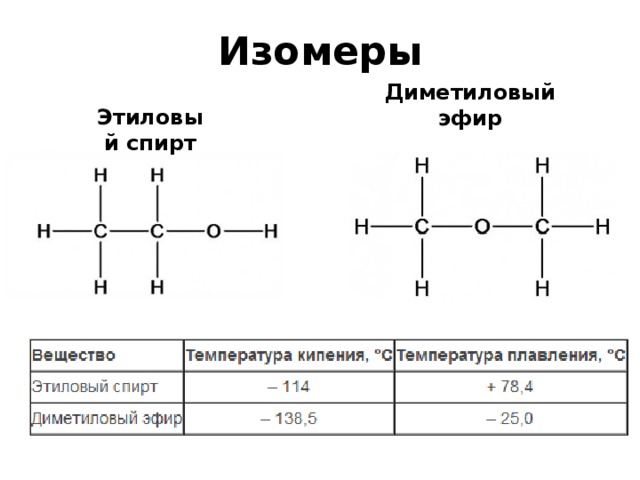 | 2001 ноябрь | 11695613 |
| Синтез конформационно замкнутых производных L-идуроновой кислоты: прямое свидетельство критической роли конформера 2S0 в виде косой лодочки в активации антитромбина гепарином. | 2001 19 ноября | 11763451 |
| Активность протеинкиназы играет центральную роль в апоптозе зародышевых клеток крыс, индуцированном метоксиуксусной кислотой. | 2001 ноябрь-декабрь | 11794376 |
| Хиральные протонодонорные реагенты: тетрахлорид олова — координированные оптически активные производные бинафтола. | 2002 | 12112869 |
| Влияние химических веществ, разрушающих эндокринную систему, на разрушение зародышевых пузырьков у Xenopus in vitro. | 2002 Август | 12173250 |
Воздействие на мать монометилового эфира диэтиленгликоля: возможная роль в этиологии ретрокавального мочеточника. | 2002 Август | 12149723 |
| Преимущества использования неизотермических биореакторов для ферментативного синтеза антибиотиков: пенициллин-G-ацилаза как модель фермента. | 2002 5 августа | 12115422 |
| Оценка двух путей биосинтеза дельта-аминолевулиновой кислоты у Euglena gracilis. | 2002 Январь | 11784323 |
| Ионная фотодиссоциация в арилаллилацетатах. | 2002 Июль | 12126304 |
| Молекулярные структуры взаимодействия катионов…пи(аренов) щелочных металлов с пи- и сигма-модальностями. | 17 июля 2002 г. | 12105914 |
Образование и разложение катионов N,N,N-триметиланилиния на цеолите H-Y исследовано in situ методом MAS ЯМР-спектроскопии с остановленным потоком.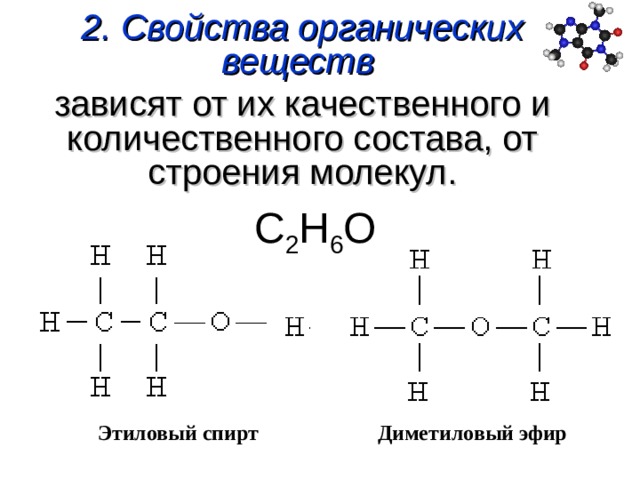 | 26 июня 2002 г. | 12071765 |
| Формальные синтезы гелианнуолов A и D, аллелохимические соединения Helianthus annus. | 21 марта 2002 г. | 12120159 |
| Участие апоптоза, опосредованного каспазой 3, в гемопоэтической цитотоксичности метаболитов монометилового эфира этиленгликоля. | 2002 Октябрь | 12502240 |
| Инженерия ферментативных реакций: влияние метанола на синтез антибиотиков, катализируемый иммобилизованной пенициллин-G-ацилазой, в изотермических и неизотермических условиях. | 2002 сентябрь-октябрь | 12363348 |
| Стимуляция продукции лигнинолитических ферментов Phanerochaete chrysosporium полиоксиалканами. | 2003 | 12588543 |
Двухуровневые исследования прямой динамики реакций диметилового эфира с атомом водорода и метильным радикалом. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
|
