Содержание
Циклический простой эфир — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
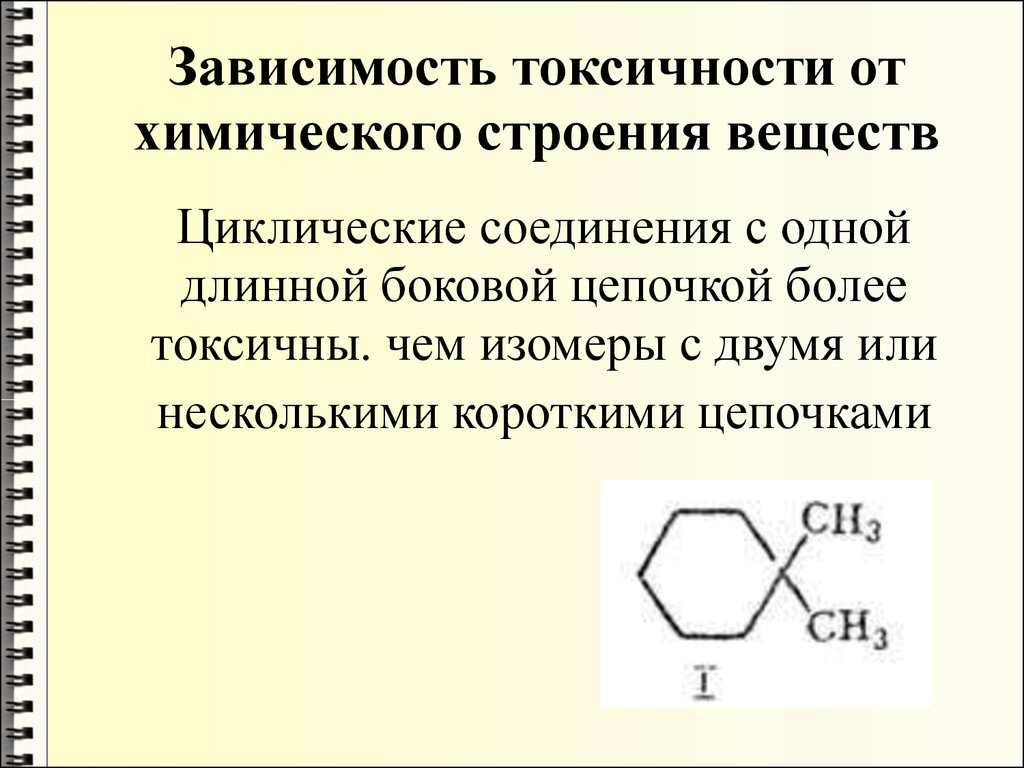
Циклические простые эфиры имеют интересную склонность к увеличению размеров кольца.
[1]
Циклические простые эфиры ( тетрагидрофуран, диоксан) смешиваются с водой.
[2]
Циклические простые эфиры с трехчленным ( а-оксидным) кольцом называют эпоксидами ( приставка epi обозначает соседнее положение), алкеноксидами.
[3]
Циклические простые эфиры несколько отличаются от эфиров с открытой цепью тем, что само кольцо может иметь собственные колебания, которые, хотя и не яв-пяются колебаниями С-О как таковыми, тем не менее достаточно характеристичны для идентификации кольца. Исследования в этом направлении проводились, например, в отношении эпоксигруппы, но для того, чтобы стала возможной достаточно надежная идентификация этих групп, требуется располагать значительным количеством дополнительных данных.
[4]
Циклические простые эфиры стали ценными промышленными продуктами, и их используют как промежуточные продукты синтеза и в качестве растворителей. Замыкание цикла осуществляют посредством реакций, аналогичных образованию ациклических простых эфирных связей.
[5]
Другие алифатические и циклические простые эфиры ( ди-н-пропиловый и диизопропиловый эфиры, N-метил-морфолин) применялись редко. Однако при его применении для разложения реакционной смеси можно пользоваться только щелочным гидролизом, так как при действии кислот метилаль быстро гидролизуется.
[6]
Такие ненасыщенные циклические простые эфиры, как 3 4-ди-гидро — 2Н — пиран и 2 3-дигидрофуран, представляют собой виниловые эфиры и характеризуются ожидаемой для них способностью подвергаться присоединениям под действием электрофильных инициаторов. Ди-гидро — 2Н — пиран находит широкое применение в качестве защитной группы в синтезе олигонуклеотидов, однако он обладает тем недостатком, что в случае хиральных спиртов образуются диасте-реомерные ацетали.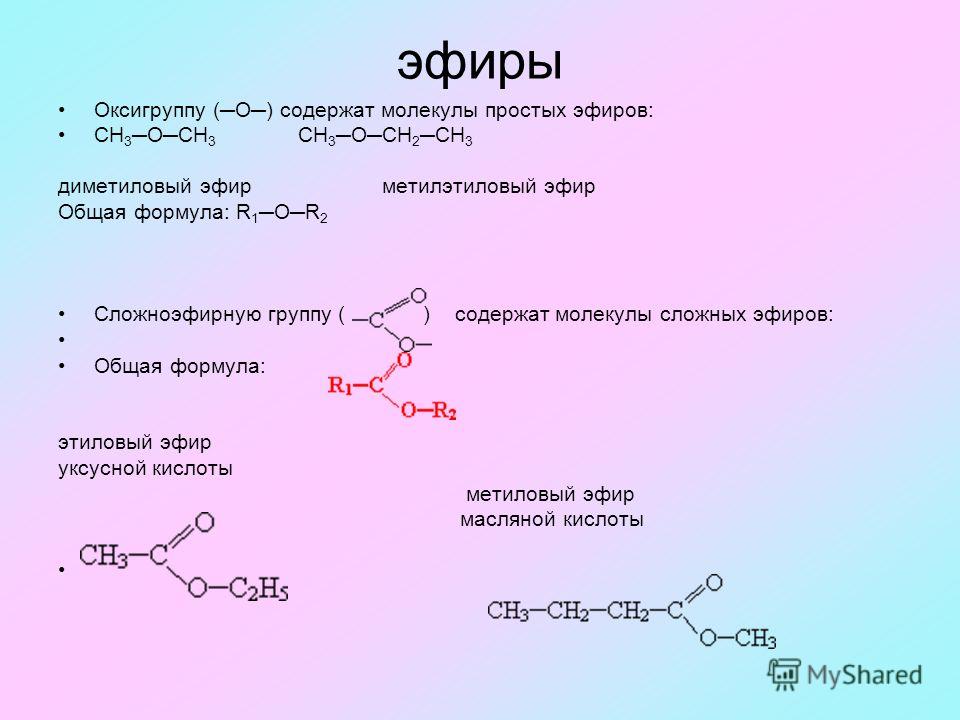 Этот недостаток может быть устранен [129] при использовании винилового эфира 4-метокси — 5 6-дигидро — 2Н — пи-рана; присоединение спирта к этому соединению не приводит к образованию нового хирального центра.
Этот недостаток может быть устранен [129] при использовании винилового эфира 4-метокси — 5 6-дигидро — 2Н — пи-рана; присоединение спирта к этому соединению не приводит к образованию нового хирального центра.
[7]
Из циклических простых эфиров получаются лактоны.
[8]
Получение циклических простых эфиров из спиртов обработкой иодпм и тс трнацетнтпм свирща при пблучении, обсуждавшееся выше в разд.
[9]
Эпоксидами называют циклические простые эфиры.
[10]
По поглощению циклические простые эфиры несколько отличаются от эфиров с открытой цепью, поскольку кольцо может иметь собственные колебания, которые, хотя и не являются колебаниями С-О как таковыми, тем не менее достаточно характеристичны для идентификации гетеро-цикла.
[11]
Дигидропиран как циклический простой эфир енола может присоединять спирты, давая ацетали ( ср.
[12]
Диоксан представляет собой циклический простой эфир и по химическим свойствам подобен алифатическим простым эфи-рам, он устойчив к действию кислот, щелочей, аммиака, металлического натрия.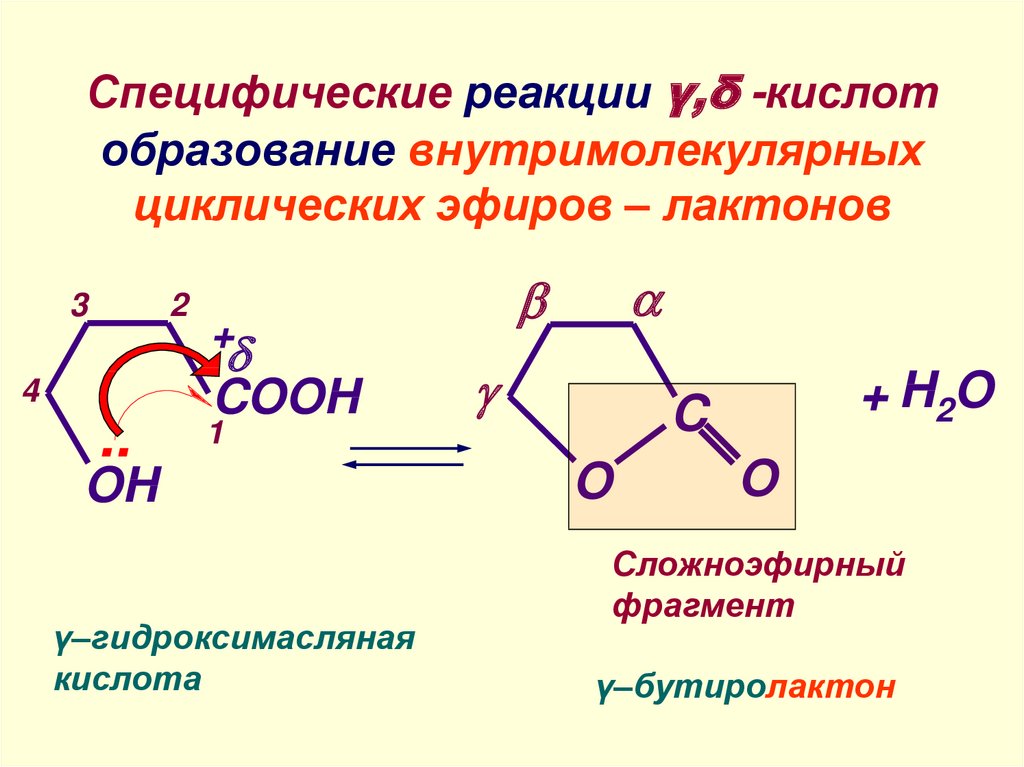
[13]
В число циклических простых эфиров не включены циклические аце-тали, которые рассматриваются в специальном разделе, хотя по некоторым свойствам соединения этих обоих классов близки.
[14]
Интересный пример образования циклического простого эфира был приведен [105] в связи с изучением стереохимии алкалоида ундулатина.
[15]
Страницы:
1
2
3
Лекция
Лекция
№30
ПРОСТЫЕ ЭФИРЫ
План
- Классификация
и номенклатура простых эфиров. - Способы
получения диалкиловых эфиров, их физические
и химические свойства. - Циклические
эфиры. - Оксираны
и краун – эфиры.
Простые эфиры можно рассматривать как производные спиртов, в
которых атом водорода гидроксильной группы замещен на углеводородный радикал.
По характеру атомов углерода, связанных с кислородным атомом, простые эфиры
можно подразделить на следующие типы:
1. Эфиры, содержащие связи С(sp3)¾O.
К ним относятся эфиры структуры ROR/и
циклические эфиры.
2. Эфиры содержащие связь С(sp2)¾O
К ним относятся
- алкилалкениловые
(виниловые) эфиры
- диалкениловые эфиры
- алкилариловые эфиры
- диариловые эфиры
3. Эфиры, содержащие связь С(sp)¾O
RCº
C-OR/
Диалкиловые эфиры
Диалкиловые
эфиры являются наиболее важными представителями класса простых эфиров. Их
эмпирическая формула СnH2n+ 2O или СnH2n+ 1OCmH2m + 1.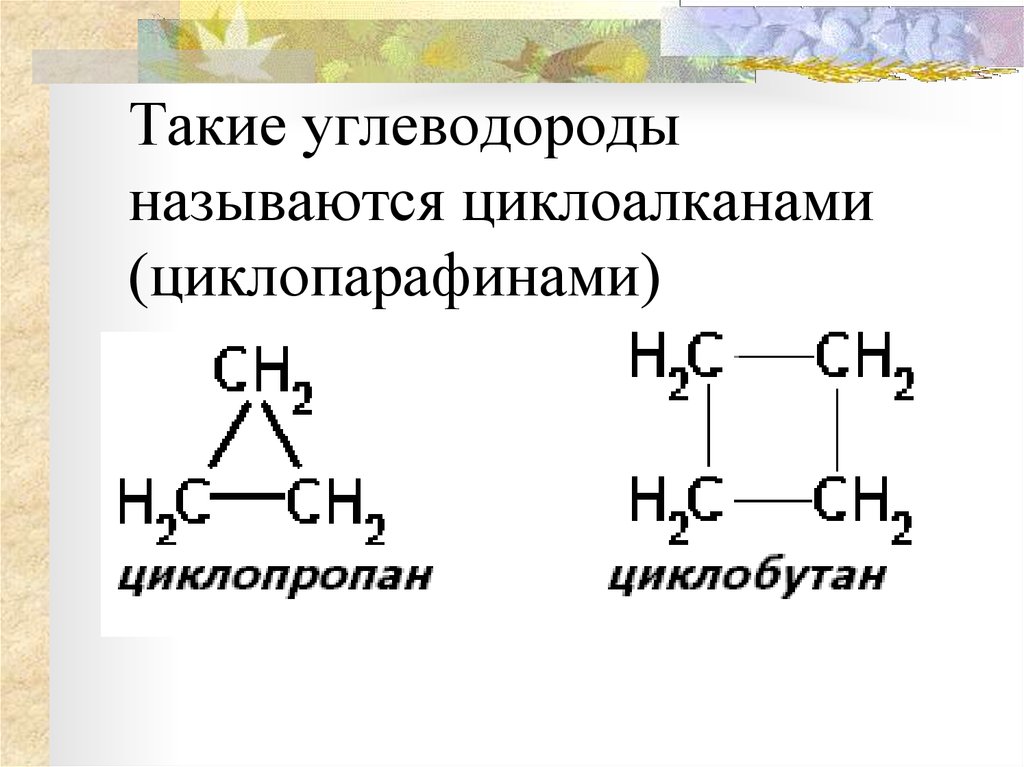
Изомерия и номенклатура
Наименование диалкиловых эфиров по рациональной номенклатуре образуют путем
перечисления заместителей и прибавления слова «эфир».
Номенклатура IUPAC рассматривает эфир как производное углеводорода,
замещенного на алкоксигруппу, причем в основе названия лежит наиболее длинная
углеводородная цепь.
Способы получения диалкиловых эфиров
- Синтез Вильямсона.
Можно видеть, что этот способ удобен для
получения несимметричных эфиров.
- Межмолекулярная дегидратация спиртов.
Реакция эффективна при получении симметричных
эфиров. Следует иметь в виду, что при повышении температуры будет
прогрессировать реакция нуклефильного отщепления, особенно если обьектом
дегидратации являются разветвленные спирты (вторичные и третичные)
- Алкилирование спиртов алкенами.

Функция кислоты – катализатора заключается в
генерировании карбкатионов, которые эффективно атакуются нуклеофилом – спиртом:
Эффективность реакции определяется стабильностью
карбкатиона, поэтому соблюдается следующий ряд реакционной способности алкенов.
- Алкоксимеркурирование алкенов.
или суммарно
Физические свойства и строение
Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира) со
своеобразным запахом и низкими температурами кипения, что свидетельствует о
слабом межмолекулярном взаимодействии. Это является показателем низкой
полярности диалкиловых эфиров и отсутствия (в отличие от спиртов) предпосылок
для образования водородных связей. В отличие от спиртов эфиры обладают более
сильными электронодонорными свойствами, о чем свидетельствует значение
потенциалов ионизации. Увеличение электронодонорных свойств обьясняется
Увеличение электронодонорных свойств обьясняется
положительным индуктивным эффектом алкильных групп. Валентный угол приближается
к тетраэдрическому и равен109–1120.
Химические свойства
- Основность
Основность простых эфиров проявляется в их
взаимодействии с кислотами Бренстеда и Льюиса. С Бренстедовскими кислотами
умеренной силы взаимодействие осуществляется посредством водородной связи.
В случае сильных Бренстедовских кислот происходит
протонирование эфиров и образование оксониевых кислот.
Простые эфиры – слабые основания и начинают
протонироваться в ощутимых количествах в растворе 30 — 40%-ной серной кислоты.
С кислотами Льюиса диалкиловые эфиры образуют
стабильные продукты присоединения – эфираты.
В этих соединениях образуется донорно–акцепторная
связь за счет неподеленной пары атома кислорода.
Способность простых эфиров сольватировать катионы
различных металлов имеет исключительное значение для получения
металоорганических соединений в растворах диалкиловых эфиров или
тетрагидрофурана.
- Реакции при a — углеродном атоме
диалкиловых эфиров.
Простые эфиры могут вступать в реакции
свободнорадикального хлорирования и автоокисления, причем обьектом этих реакций
является a — углеродный атом эфиров.
Основанием для такого направления является
стабильность a — алкилалкоксирадикалов,
обуслoвливающая энергетическую выгодность реакции
инициирования (в случае автоокисления) и развития цепей (в случае автоокисления
и хлорирования)
где Х. –
радикал цепи при хлорировании (Cl.) и
автоокислении
Образующиеся в результате автоокисления гидропероксиды
являются взрывчатыми веществами. Они могут образовываться в эфирах при хранении
Они могут образовываться в эфирах при хранении
в условиях доступа воздуха и в прозрачных бутылках. Поэтому эфиры после
длительного хранения перед употреблением подлежат обработке с целью разрушения
гидропероксидов.
- Реакции расщепления С ¾ О – связи
Эфиры
расщепляются под действием сильных кислот, например, иодоводородной,
бромоводородной, суперкислот:
При действии суперкислот на эфиры при низких температуах генерируются
карбкатионы, которые могут претерпевать различные перегруппировки и распад до
алкенов.
При
этом легче расщепляются простые эфиры, которые содержат разветвленные группы,
так как в результате протонирования образуются более устойчивые карбкатионы.
Алкилвиниловые эфиры.
Методы получения
- Винилирование спиртов
- Дегидрогалогенирование a — галогендиалкиловых
эфиров
Химические свойства алкилвиниловых эфиров
Основными
реакциями алкилвиниловых эфиров являются:
- Электрофильное присоединение
Можно показать, что порядок присоединения HНal и
других протонных кислот определяется стабильностью промежуточных карбкатионов.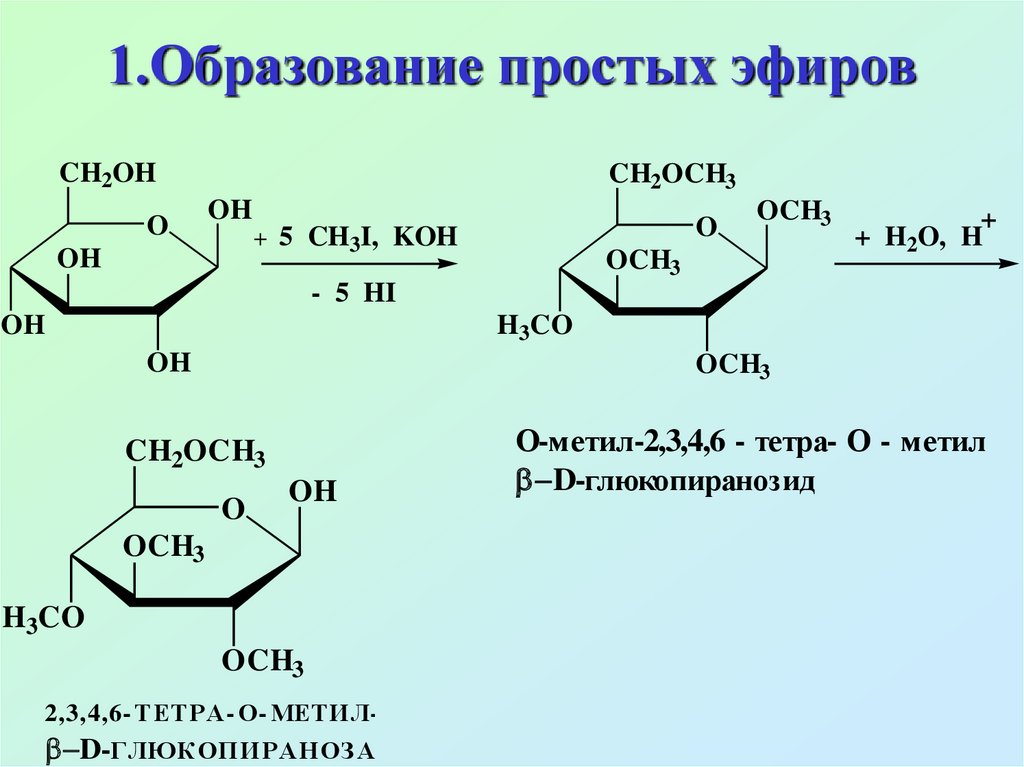
- Полимеризация
Эти реакции могут осуществляться по свободнорадикальному или
карбкатионному механизмам. В первом случае в качестве инициаторов используют
органические пероксиды или азобисизобутилонитрил, во втором — реакции
катализируются протонными кислотами, причем во избежание электрофильного
присоединения кислоты — катализатора НХ к двойной связи, кислоте должен
соответствовать слабый нуклефил Х.
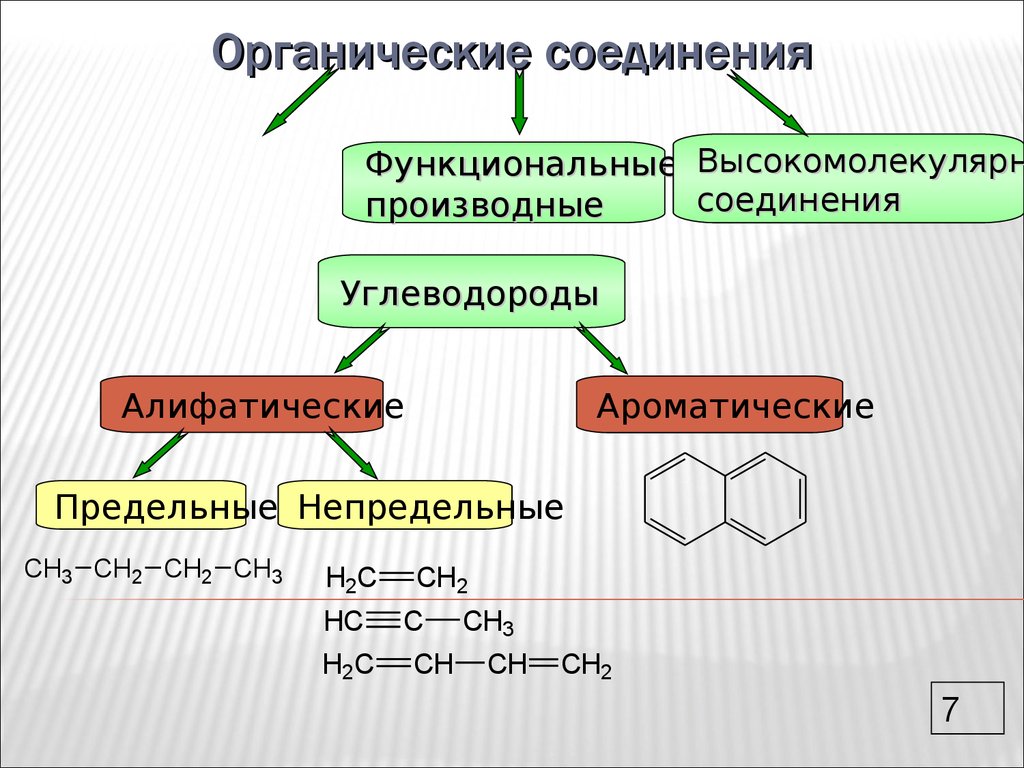
Циклические эфиры
Циклические
эфиры – производные алкандиолов, в которых эфирная связь образована
внутримолекулярно.
Циклические эфиры подразделяются на несколько групп в зависимости от
величины цикла и числа кислородных атомов в цикле. Их часто называют оксидами.
В этом плане различают:
Эпоксиды (оксираны)
Основу
названия этих соединений составляет наименование углеводорода, а на присутствие
кислородного мостика указывает приставка «эпокси».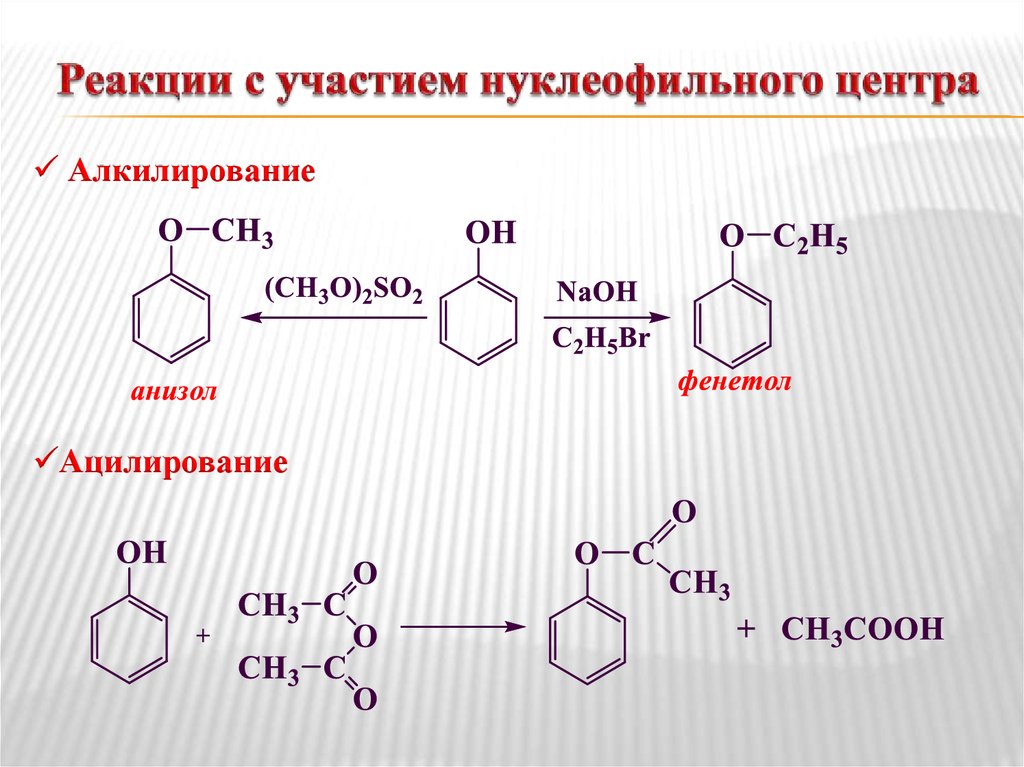 Для простейших
Для простейших
соединений сохраняется название этиленоксид и пропиленоксид. Используется также
номенклатура гетероциклических соединений «оксираны». Например,
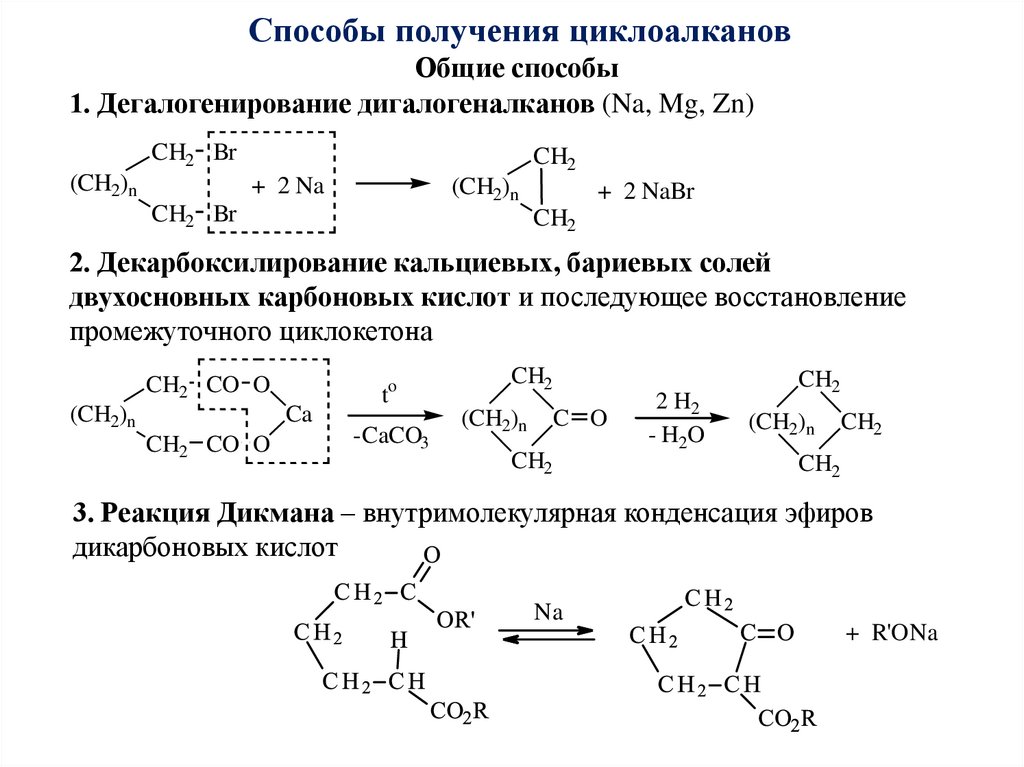
Методы получения
- Дегидрогалогенирование галогеналканолов
(галогенгидринов)
- Окисление (эпоксидирование) алкенов (реакция
Прилежаева)
В качестве катализаторов используют кислые соли вольфрамовой кислоты (Н2О2)
и соединений молибдена (ROOH). Реакцию можно осуществлять некаталитически, если
в качестве эпоксидирующего агента использовать органические надкислоты.
Первый член гомологического ряда этиленоксид, в промышленности получают
парофазным окислением кислородом или воздухом.
Химические свойства
Химическое поведение оксиранов определяется тремя факторами: поляризацией
связей С ¾ О с образованием
частичного положительного заряда на углероде оксидного цикла,
электронодонорными свойствами атома кислорода и напряженностью оксидного цикла.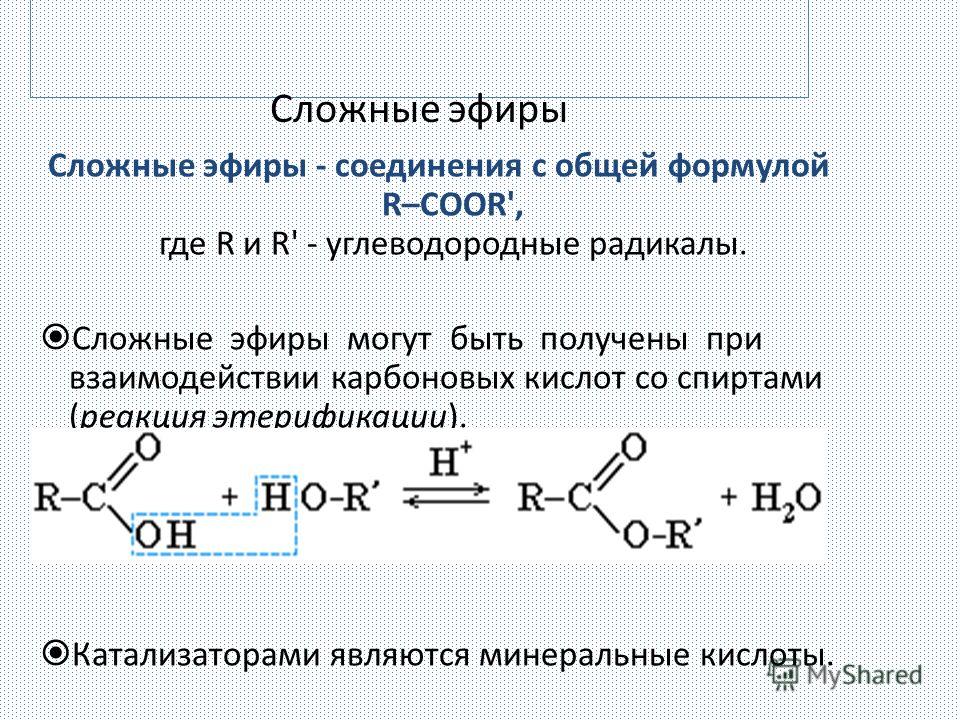
Поэтому наиболее характерными реакциями оксиранов являются реакции
нуклеофильного присоединения по положительно заряженному углероду цикла,
сопровождающиеся разрывом связи С¾
О цикла, облегчаемым протонированием кислородного атома под действием
протонодонорного агента.
Совместное действие этих факторов отчетливо проявляется в некаталитической
реакции этиленоксида с водой
или суммарно:
Эта реакция протекает медленно, поскольку вода является слабым
протонодонорным агентом. Для ускорения этой реакции необходимо использовать
высокую температуру и давление.
Другие более сильные нуклеофилы (NH3, RNH2, RMgX)
реагируют более легко.
Приведенные реакции имеют важное препаративное и промышленное значение.
Получаемый гидратацией этилена этиленгликоль являются антифризом и исходным
веществом для синтеза лавсана, этаноламины используются в качестве абсорбентов
для извлечения кислых примесей из газов. Оксиэтилирование реактивов Гриньяра –
Оксиэтилирование реактивов Гриньяра –
важный способ увеличения длины углеродной цепи органических соединений на два
углеродных атома.
Если в реакциях нуклеофильного замещения оксиранов участвуют нуклеофилы HNu,
обладающие слабой нуклефильной активностью и слабой кислотностью (h3O, h3S,
RSN), то для эффективного проведения этих реакций используют кислотный или
основной катализ. Например, кислотно–каталитическая реакция со спиртами связана
с эффективным протонированием оксирана, приводящим к увеличению положительного
заряда на его углеродных атомах и делающим атаку нуклеофила более эффективной:
Или суммарно
Образующиеся в этих реакциях целлозольвы и карбитолы – универсальные
растворители.
При основном катализе под действием основания продуцируется более
эффективный нуклеофил, например, в реакциях с ROH, RSH, h3S, HCN, эффективно атакующий углеродный атом
оксиранового цикла:
или суммарно:
Краун – эфиры
Краун-эфиры — макроциклические полиэфиры с четырьмя и более кислородными
атомами в цикле.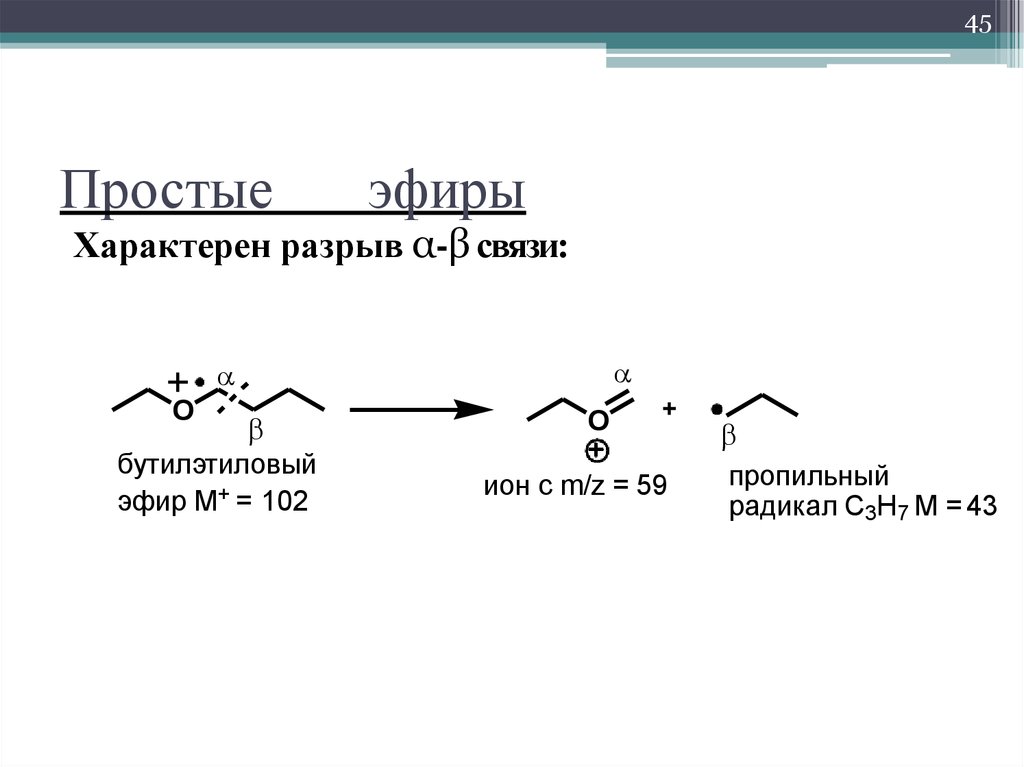 В большинстве случаев они являются производными этиленгликоля.
В большинстве случаев они являются производными этиленгликоля.
В названии соединений цифра в квадратных скобках указывает число атомов в
макроцикле, а вторая — число кислородных атомов.
Краун — эфиры получают по реакции Вильямсона из соответствующих гликолятов и
дигалогеналканов:
или галогенов b , b ’ – дигалогеналкиловых эфиров.
Самое важное свойство краун–эфиров – образование комплексов с катионами
металлов.
Ион металла находится в полости макроцикла и прочно удерживается благодаря
донорно–акцепторным связям кислород – металл, причем чем ближе ионный диаметр
металла к диаметру полости, тем устойчивее комплекс.
Краун – эфиры используют для улучшения растворимости неорганических солей в
органических растворителях, в качестве межфазных катализаторов, для
генерирования несольватированных анионов в неорганических растворителях.
Благодаря этому можно ускорить реакцию нуклеофильного замещения этими анионами.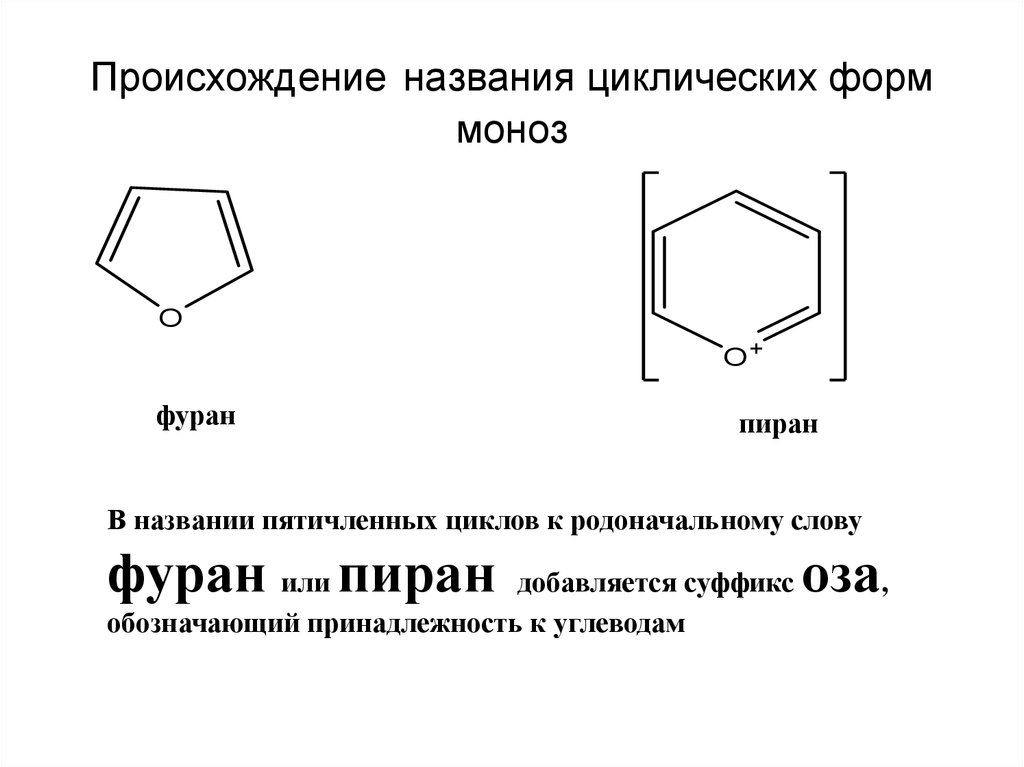
Соединения типа краун – эфиров играют большую роль в биологических системах –
они осуществляют транспорт ионов через биологические мембраны
Синтез циклического эфира
Портал органической химии
Реакции > Органический синтез Поиск
Категории: Синтез O -гетероциклов, Образование связи C-O,
Синтез циклических эфиров >
| Синтез | |||||
| Эпоксиды | Оксетаны | ||||
| Тетрагидро- фураны | Тетрагидро- пираны | Морфолины |
Последняя литература
Катализируемое платиной гидроалкоксилирование γ- и δ-гидроксиолефинов
допускали различные схемы замещения и ряд функциональных групп
включая пивалоатные и ацетатные эфиры, амиды, силиловые и бензиловые эфиры, и
боковые гидроксильные и олефиновые группы.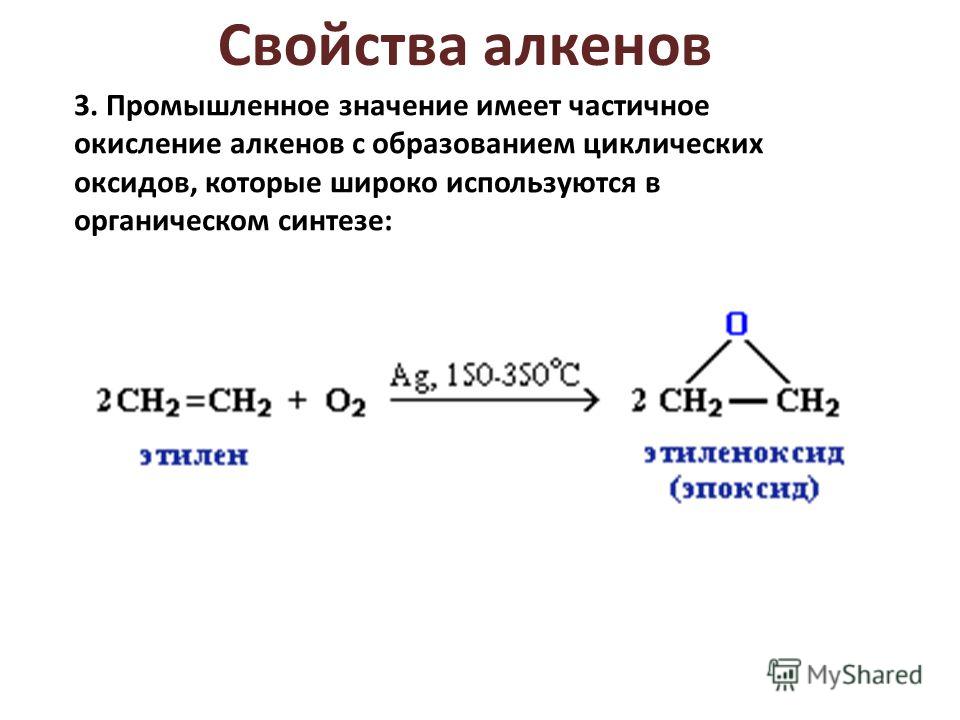
H. Qian, X. Han, R. A. Widenhoefer, J. Am. хим. соц. ,
2004 , 126 , 9536-9537.
Реакция третичных 1,4- и 1,5-диолов с аммиачной селитрой церия при комнатной
температура дает производные тетрагидрофурана и тетрагидропирана с высоким выходом
и стереоселективность. С использованием
Этот способ.
Э. Дж. Альварес-Мансанеда, Р. Чабуна, Э. Альварес, Э. Кабрера, Р.
Альварес-Мансанеда, А. Хайдур, Дж. М. Рамос, Синлетт , 2006 ,
1756-1758 гг.
Катализируемое Au(I) внутримолекулярное гидроаминирование N -алленила
карбаматы были эффективны для образования различных циклических аминов. γ-гидрокси
и δ-гидроксиаллены подверглись Au-катализируемому внутримолекулярному
гидроалкоксилирование с образованием соответствующих
кислородные гетероциклы с хорошим выходом. 2-Алленил индолы
подвергается катализируемому Au внутримолекулярному гидроарилированию с образованием 4-винилтетрагидрокарбазолов с хорошим выходом.
Z. Zhang, C. Liu, R. E. Kinder, X. Han, H. Qian, R. A. Widenhoefer, Дж. Ам. хим. соц. ,
Zhang, C. Liu, R. E. Kinder, X. Han, H. Qian, R. A. Widenhoefer, Дж. Ам. хим. соц. ,
2006 , 128 , 9066-9073.
Обработка 3-[(алкоксикарбонил)алкил]замещенных сопряженных циклоалкенонов
гидридом диизобутилалюминия при -78°С с последующим гашением кислотой
дает спироэфиры, тогда как соответствующие 3-(карбоксиалкил)замещенные
циклоалкеноны образуют спиролактоны при реакции с боргидридом натрия
при 30°С с последующим гашением кислотой.
М.-К. П. Йе, Ю.-К. Ли, Т.-К. Янг, Синтез , , 2006 , 3621-3624.
Комбинация активации Pd(II)/бис-сульфоксида C-H и сокатализа кислотой Льюиса
позволяет синтезировать хромановые, изохромановые и пирановые мотивы из широкого спектра
спиртов. Механистические исследования предполагают, что реакция протекает через начальный
За активацией CH следует новый путь функционализации внутренней сферы.
С. Э. Амманн, Г. Т. Райс, М. К. Уайт, Дж. Ам. хим. соц. , 2014 ,
136 , 10834-10837.
Нуклеофильное замещение алкилфторидов достигнуто во внутримолекулярных
реакции с О- и N-нуклеофилами. На реакцию влияет природа
нуклеофилов, размер образующегося кольца и комформационная
жесткость прекурсоров.
Л. Чжан, В. Чжан, Дж. Лю, Дж. Ху, J. Org. хим. , 2009 ,
74 , 2850-2853.
Высокореактивный и замкнутый имидодифосфоримидатный (IDPi) катализатор позволяет
прямой энантиоселективный синтез замещенных кислородных гетероциклов из лактола
ацетаты и енолсиланы. Различные хиральные кислородные гетероциклы, в том числе
тетрагидрофураны, тетрагидропираны, оксепаны, хроманы и дигидробензофураны,
были получены с превосходной энантиоселективностью.
С. Ли, П. С. Дж. Кайб, Б. Лист, Дж. Ам. хим. соц. , 2017 ,
139 , 2156-2159.
Бифункциональная аминобороновая кислота способствует внутримолекулярному аза- и окса-михаэлю
реакции α,β-ненасыщенных карбоновых кислот. Комбинация арилборона
кислота с хиральной аминотиомочевиной делает возможной энантиоселективную конверсию с получением
желаемые гетероциклы с высокими выходами и ее (до 96% ее).
Т. Адзума, А. Мурата, Ю. Кобаяши, Т. Инокума, Ю. Такемото, Орг. лат. ,
2014 ,
16 , 4256-4259.
Дегидратация 1,6-диолов обработкой BF 3 OEt 2 в
дихлорметан давал тетрагидробензоксепины с очень хорошими выходами, тогда как
1,7-диолы не подвергались дегидратации.
М. Юс, Т. Солер, Ф. Фубело, Тетраэдр , 2002 , 58 ,
7009-7016.
Эффективный и региоселективный Yb(OTf) 3 -промотированный
катализируемая палладием окислительная циклизация γ-гетероалкенил β-кетоамидов
был разработан. В простых аэробных условиях различные шести-, семи-,
и восьмичленное кольцо 9Были получены гетероциклы 0008 N — и O — с отличным выходом.
К.-Т. Йип, Дж.-Х. Ли, О.-Ю. Ли, Д. Ян, Org. лат. ,
2005 , 7 , 5717-5719.
| Диастереоселективное и энантиоселективное конструирование циклических эфиров Стереоконтролируемое конструирование циклических эфиров Энантиоселективное конструирование природных циклических эфиров |
Кислотное расщепление эфиров (SN2) – Магистр органической химии
dasdas
Описание: Когда простые эфиры обрабатывают сильной кислотой в присутствии нуклеофила, они могут быть расщеплены с образованием спиртов и алкилгалогенидов. Если эфир находится на первичном углероде, это может происходить по пути S N 2 .
Если эфир находится на первичном углероде, это может происходить по пути S N 2 .
Примечания: Обычными кислотами для этой цели являются HI и другие галогеноводороды, а также H 2 SO 4 в присутствии H 2 O.
В случае расщепления эфира является вторичным и имеет стереоцентр, будет инверсия конфигурации.
Примеры:
Примечания: Третий пример также может быть записан как «H 3 O+». Обратите внимание, что избыток HI будет превращать первичные спирты в алкилгалогениды через SN2, но не фенол (C 6 H 5 OH), поскольку sp 2 гибридизованные углероды не подвергаются реакциям S N 1 или S N 2 .
Механизм: Сильная кислота (HI) протонирует кислород эфира, что превращает его в более уходящую группу (Этап 1, стрелки A и B). Затем йодид-ион атакует углерод в S N 2 реакции (стадия 2, стрелки C и D) с получением спирта и йодистого метила.
Примечания: В тех случаях, когда расщепляемый эфир вторичен и имеет стереоцентр, будет инверсия конфигурации.
Другой пример : Открытие тетрагидрофурана (ТГФ) водной кислотой:
Проверь себя!
(дополнительно) Ссылки и дополнительная литература
Эфиры широко инертны во многих условиях и поэтому находят широкое применение в качестве растворителей (например, диэтиловый эфир, ТГФ (тетрагидрофуран), диоксан, глим и другие). Для расщепления эфира обычно требуется сильная кислота и тепло, которые являются вынужденными условиями. В качестве альтернативы можно использовать силановые реагенты, которые реагируют при комнатной температуре.
- НОВЫЙ МЕТОД ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ ИОДИДОВ
ГЕРМАН СТОУН и ГАРОЛЬД ШЕХТЕР
Журнал органической химии 1950 , 15 (3), 491-495
DOI: 10. 1021/jo01149a008
1021/jo01149a008
Вместо дорогого (и неудобного газа) HI можно использовать комбинацию фосфорной кислоты + KI для расщепления эфира, что приводит к образованию HI in situ. - 1,4-ДИИОДОБУТАН
Герман Стоун и Гарольд Шехтер
Орг. Синтез . 1950 , 30 , 33
DOI : 10.15227/orgsyn.030.0033
Эта процедура из Organic Syntheses , надежного источника независимо протестированных синтетических органических лабораторных процедур, демонстрирует расщепление ТГФ кипящей сильной кислотой. Ниже приведены различные статьи с использованием реагентов на основе силана для расщепления эфира. Покойный нобелевский лауреат профессор Джордж Ола проделал большую работу в этой области в середине своей карьеры. - Расщепление сложных и простых эфиров йодотриметилсиланом
Tse-Lok Ho Prof. Dr. George A. Olah
Анжю. хим. Междунар. Эд. 1976 , 15 (12), 774-775
DOI : 10,1002/ANIE.

 1021/jo01149a008
1021/jo01149a008