Органическая химия: Лабораторный практикум, страница 12. Диэтиловый эфир с концентрированной серной кислотой
Диэтиловый эфир из этилена - Справочник химика 21
Этилен получают термической переработкой погонов нефти, его мировое производство достигает нескольких десятков миллионов тонн. Этилен - бесцветный газ со слабым запахом, незначительно растворим в воде, умеренно - в этаноле, хорошо - в диэтиловом эфире. Этилен служит важнейшим сырьевым источником основного органического синтеза. Его применяют для производства этиленгликоля, этиленоксида, этанола, акрилонитрила, диок-сана, ацетальдегида, уксусной кислоты, стирола, пропионового альдегида, 1-пропанола, винилхлорида, винилацетата, дихлорэтана, полиэтилена. Т. самовоспл. 540 °С. Обладает слабым наркотическим действием. ПДК 50 мг/м . [c.294] Диэтиловый эфир Этилен Молекулярные сита 10Х и 5А импульсная микро-каталитическая установка, конверсия на 10Х 100% при 300° С и 90% при 250 С на 5А --5% при 300° С и --95% при 350° С [263] [c.494]Побочными продуктами прн получении бромистого этила являются диэтиловый эфир, этилен, двуокись углерода и сернистый ангидрид (см. опыты 41—43). [c.81]
Диэтиловый эфир этилен- — 1,0 Малоновый эфир 0,028 — [c.97]
Коксовый газ, бензин, этиловый спирт, диэтиловый эфир, этилен, пропан, пропилен, метиловый спирт [c.32]
Диэтиловый эфир этилен-гликоля Диэтиленгли-коль Моноэтиловый эфир диэти-ленгликоля [c.185]
Диэтилацеталь. ... Диэтиловый эфир этилен [c.371]
Треххлористый этилен. . . Хлороформ......... 5,8 12 Диэтиловый эфир. ... Ацетон. ...... 178 1 5 [c.158]
Аммиак ацетилен ацетон бензин Калоша бензол бутан бутилен бутиловый спирт водород дивинил дихлорэтан диэтиловый эфир изобутан изобутилен изопентан изопрен метан метанол моновинилацетилен окись углерода пентан пропан пропилен стирол толуол хлористый аллил хлористый бутил хлористый винил хлористый метил хлористый этил этан этилен этиловый спирт. [c.192]
Этилен, светильный газ Окись этилена Диэтиловый эфир - [c.139]
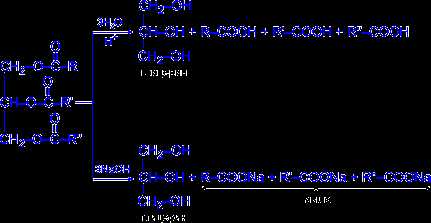
Из сложных эфиров гликолей и неорганических кислот (нитратов, сульфатов, боратов, карбонатов и др.) наиболее подробно описаны этилен и диэтиленгликольдинитраты. Они полностью смешиваются с диэтиловым эфиром, ацетоном, бензолом, метиловым спиртом, нитроглицерином, хлороформом и ограниченно с водой [30]. [c.299]
Эта азеотропная смесь кипит при температуре 78,15°, т. е. всего на 0,23° ниже, чем абсолютный спирт (т. кип. 78,38°). Выход этилового спирта, считая на этилен, составлял около 90%, причем в качестве побочного продукта получали 4—7% диэтилового эфира. Эфир можно возвращать в процесс, добавляя к свежему этилену, так как в условиях процесса он легко превращается в этилсерную кислоту. [c.145]
Этилен, бутилены, диэтиловый эфир и бутиловый спирт, количество которых достигает 15% прореагировавшего спирта, могут быть либо возвращены в процесс, либо использованы в других направлениях. Общий выход дивинила из этилового спирта равнялся 63% при степени превращения за один проход около 30—35%. [c.218]
Этилсерная кислота (при комнатной температуре), диэтиловый эфир (при 140 °С), этилен (при 180 °С). [c.165]
Этилен находится в больших количествах в коксовых газах и газах очистки нефтеперерабатывающих установок и выделяется оттуда путем низкотемпературной перегонки. Все увеличивающаяся потребность в этом исходном продукте тяжелого органического синтеза может быть, однако, удовлетворена лишь путем высокотемпературного пиролиза этана и других алканов при 800—900 °С. Подходящим методом получения этилена в лаборатории является дегидратация этанола под действием концентрированной серной кислоты. Первоначально при этом образуется этилсульфат, нагревание которого до 170°С дает этилен и серную кислоту. При 140 °С этилсульфат реагирует с избытком спирта с образованием диэтилового эфира, а при температурах ниже 140 образуется диэтилсульфат [c.235]
Действие катализаторов отличается специфичностью, а именно данный катализатор, как правило, может влиять только на одну из реакций, не оказывая воздействия на другие. Наиример, этиловый спирт при нагревании может превращаться в этилен, ацетальдегид, дивинил, диэтиловый эфир и другие вещества. Если в качестве катализатора использовать окись алюминия или окись тория, то весь спирт превращается в этилен при наличии же медного катализатора из него образуется ацеталь- [c.130]
Показано, что расщепление диэтилового эфира в присутствии литийорганического соединения приводит к образованию этилена и этилата лития, а расщепление ТГФ дает енолят ацетальдегида и этилен. Интенсивное изучение механизма разрыва связей простых эфиров показало, что он меняется в зависимости от природы реагирующих соединений и даже для одного и того же эфира возможна реализация альтернативных механизмов. Так, например, для расщепления диэтилового эфира под действием литийорганического соединения постулированы механизмы, включающие и даже а ф -элиминирование [c.255]
Образование эфиров, а не алкенов при дегидратации достигается выбором соответствующих условий реакции. Например, этилен получают нагреванием этилового спирта с концентрированной серной кислотой при 180 °С диэтиловый эфир образуется при нагревании смеси этилового спирта и концентрированной серной кислоты при 140 °С, причем добавляют все время спирт, чтобы он был в избытке. [c.535]
Образованием радикалов можно также объяснить происходящий на окиси алюминия обмен радиоактивной меткой (С-14) между диметиловым эфиром (а также метиловым спиртом), с одной стороны, и изопропиловым, бензиловым в октиловым спиртами, диэтиловым эфиром, ацетоном и этиленом, но не толуолом ил ацетонилацетоном, с другой сто-роны что может служить препаративным методом получения меченых соединений (Вассерберг, Леви и автор [249, 250]). [c.62]
Реакции мономолекулярного отщепления получают перевес над реакциями замещения при повышении температуры, поскольку скорость отщепления с температурой увеличивается больше, чем скорость замещения. Примером, иллюстрирующим это положение, является дегидратация этанола серной кислотой, которая при 130° приводит к образованию диэтилового эфира (реакция Зм1), а при повышении температуры до 180° дает в основном этилен (реакция Е1) [c.231]
Каждое из указанных на схеме направлений ускоряется специфическим катализатором. Дегидрирование этанола в ацетальдегид (I) протекает очень хорошо над медью при 200—250° активированные медные катализаторы превращают этанол в этилацетат (4) или ацетон (6). Этилен можно получить из этанола над А12О3 или ТЬО при 350—360° или с серной кислотой при 170—200° (2) диэтиловый эфир (3) с этими катализаторами—соответственно при 250 и 140. Превращение этанола в дивинил (5) имеет место над гпО СГзОд при 400—450°. Наконец, превращение этанола в диспирт —бутанол (7) происходит при действии металлического натрия или щелочных катализаторов. [c.28]
Эта реакция, сопровождаемая многими побочными реакциями, осуществляется при 370—380° С и давлении, близком к атмосферному, в контактной печи 3 (рис. 93). Печь имеет форму цилиндра высотой и диаметром до 6,5 м, выложена из огнеупорного кирпича с двойными стенками, внутри которой по окружности установлено 24 стальные реторты 4 прямоугольного сечения высотой 5 м, заполненные катализатором. Кольцевое пространство между двойными стенками представляет собой топку 5, в которой сгорает газообразное топливо. Реторты нагреваются за счет лучеиспускания раскаленной внутренней стенки. Топочные газы поступают во внутреннее пространство печи и далее в боров. Спирт-сырец синтетический, гидролизный или сульфитный С1мешивают с отходом производства — спиртом-регенератом. Полученная шихта (80-процентный спирт) испаряется в трубках спиртоиспарителя (на рис. 93 не указан), обогреваемых паром. Пары спирта, проходя через перегреватели 1 и 2, омываемые топочными газами, нагреваются до 380° С и поступают в контактную печь 3 и здесь распределяются по всем ретортам. Выходящий из реторт контактный газ собирается в кольцевом трубопроводе 6 и охлаждается до 180° С в котле-утилизаторе 7. Газ представляет собой смесь, содержащую более тридцати веществ помимо непрореагировавшего спирта и продуктов основной реакции — бутадиена, паров воды и водорода, — в ней содержатся в наибольшем количестве уксусный альдегид, диэтиловый эфир, этилен, пропилен и псевдобутилен (бутен-2). [c.264]
Из методов установления схемы превращений простейший — способ изолирования отдельных реакций. Он состоит в изучении продуктов превращения компонентов смеси в условиях реакции в отсутствие других веществ или в присутствии некоторых из них. Поясним это на примере реакции этанола с аммиаком, продуктами которой являются MOHO-, ди- и триэтиламины, диэтиловый эфир, этилен и вода. Из литературных данных известны следующие простые реакции образования перечисленных продуктов [c.60]
При выборе растворителя исходят из природы азеотропа, подлежащего расслаиванию. Растворитель, не должен, в свою очередь, давать азеотропы с разделяющим агентом или отогнанными углеводородами. Поэтому его температура кипения должна быть по крайней мере на 50° выше температуры кипения этих веществ. Если в качестве разделяющих агентов применяются амины, ацетон, метилэтилкетон, метилпропилкетон, диэтилкетон, диэтиловый эфир, диоксан, пиперидин и др., то растворителями могут являться этилен- и пропиленгликоль, глицерин, метилглицерин, моно-, ди- и триэтаноламин, пропанол-амин и др. В некоторых случаях для расслаивания азеотропов успешно могут применяться соли. [c.281]
Однако, несмотря на ишрокую известность и несомненную общность, эти реакции (за исключением присоединения брома) в своем классическом виде не вошли в арсенал методов современной органической химии по очень простой причине — им не хватало именно чистоты. Так, например, даже простейшая реа1 ция гидратации — присоединение воды к этилену в присутствии серной кислоты — приводит к образованию пе только этилового спирта, но и диэтилового эфира, этилсульфата и ряда других продуктов. [c.63]
При дегидратации этанола образуются этилен и диэтиловый эфир. Количество брома (М 160), которое прореагировало с этиленом, составляет 16 г (0,1 моля), что эквимолекулярно количеству этилена (0,1 моля, 22,4 л) и еоответственно этиловому спирту (0,1 моля, 4,6г), из которого получен этилен. Количество спирта, из которого образовался диэтиловый эфир, находим по разности 23 г — 4,6 г=18,4 г, что составляет 0,4 моля. Согласно уравнению (2), из 0,4 моля этилового спирта образуется 0,2 моля (14,8 г) диэтилового эфира С4Н10О, так как выход по условию задачи количественный. Следовательно, из спирта было получено 2,24 л этилена и 14,8 г диэтилового эфира. [c.203]
Соединение А, из которого получена н-масляная кислота, может быть н-бутиловым спиртом или -масляным альдегидом. Из этилового спирта в присутствии серной кислоты можно получить диэтиловый эфир (С2Н5ОС2Н5) или этилен. [c.211]
Аммиак, метан, уайт-спирит Ацетон, бензин, этан, пропан, бутан, ксилол, метиловый и этиловый спирты, бензол, толуол Этилен, светильный газ, коксовый газ, диэтиловый эфир Водород, водяной газ, ацетилен, сераводо1род, сероуглерод [c.86]
Другой путь — превращение хлорсоединения в хлорэфир — является проблемой химии эфиров. Если диэтиловый эфир получают дегидратацией этилового спирта, то можно ожидать, что хлорэтиловый эфир можно синтезировать дегидратацией хлорэтилового спирта. Мы уже знакомы с р-хлор-этиловым спиртом (этиленхлоргидрин), который легко получается при присоединении хлора к этилену в воде (разд. 6.14). Таким образом, приходим к следующему простому синтезу дивинилового эфира, исходя из этилена [c.539]
Диэтиловый эфир умеренно растворим в воде (6% при 20° С) и сам растворяет воду (- 1,2%) смешивается со спиртами, углеводородами и большинством органических растворителей не смешивается с этилен-гликолем и глицерином. Обладает значительной растворимостью в серной кислоте и в концентрпроваппой соляной. [c.121]
Согласно некоторым авторам, на AI2O3 первым продуктом дегидратации этилового спирта (наблюдаемым при более низких температурах) является диэтиловый эфир, который затем превращается в этилен (появляющийся при более высоких температурах). [c.43]
Данные о гидратации этплс на в присутствии Ь мол. % серной кислоты прп температурах 254° и давлениях от 82,6 до 264,2 атм получены в работе 160]. Однако анализ этих данных затруднителен, так как в условиях проводившихся опытов происходило образование жидкой (водной) фазы, содержавшей растпорепыып этилен и этиловый сппрт. Следует также упомянуть, что, по данным указанной работы, прп температуре выше 250° и давлении 200 атм происходила значительная полимеризация этилена, а при температурах ииже 220° отмечено образование диэтилового эфира. [c.42]
chem21.info
Органическая химия: Лабораторный практикум, страница 12
3Ch4Ch3OH + 2KMnO4 ® 3Ch4CHO + 2MnO2¯+ 2KOH +2h3O
Опыт № 20. Получение простого (диэтилового) эфира
Реактивы:
Этиловый спирт
Концентрированная серная кислота
Ход работы:
В пробирку наливают ~1 мл этилового спирта и ~1 мл концентрированной серной кислоты, добавляют кипятильные камешки. В пробирку вставляют пробку со стеклянной трубкой длиной 20-25 см (обратный воздушный холодильник) и очень осторожно нагревают на песчаной бане (до кипения!), затем дают остыть и по каплям очень осторожно прибавляют к смеси несколько капель спирта. Ощущается запах эфира. Реакция протекает в две стадии.
Первая стадия:
C2H5OH + HOSO2OH ® C2H5OSO2OH + h3O
этилсерная
кислота
Вторая стадия:
C2H5OH + HOSO2OC2H5 ® C2H5-O-C2H5 + h3SO4
Итоговое уравнение:
h3SO4
C2H5OH + HOC2H5 ® C2H5-O-C2H5 + h3O
Остывшую реакционную смесь выливают в пробирку с небольшим (~2-3 мл) количеством воды. Эфир легче воды и всплывает на ее поверхность.
Эфир легко воспламеняется, пары его очень летучи. Поэтому нельзя работать с эфиром вблизи открытого огня.
Опыт №21. Получение сложного (уксусно-этилового) эфира
Реактивы:
Ледяная уксусная кислота
Этиловый спирт
Концентрированная серная кислота
Насыщенный раствор хлорида натрия
Ход работы:
В пробирке смешивают ~2 мл ледяной уксусной кислоты, ~2 мл этилового спирта и ~0,5 мл концентрированной серной кислоты, Полученную смесь осторожно кипятят несколько минут в пламени спиртовки и после охлаждения выливают в пробирку с насыщенным раствором хлорида натрия. Образовавшийся уксусно-этиловый эфир (малорастворимый в воде) всплывает на поверхность, тогда как не вступившие в реакцию спирт и уксусная кислота переходят в водный нижний слой. Уксусно-этиловый эфир (этилацетат) имеет характерный фруктовый запах.
Опыт № 22. Получение фенолята натрия
Реактивы:
Фенол кристаллический
Вода
Раствор гидроксида натрия
Соляная кислота
Ход работы:
В пробирку помещают ~0,5 г кристаллов фенола (избегать попадания на руки!), приливают ~2 мл воды и встряхивают. К образовавшейся эмульсии прибавляют ~2-3 капли 10%-ного раствора гидроксида натрия и снова встряхивают. Раствор из мутного становится прозрачным, так как образовавшийся фенолят натрия в отличие от самого фенола хорошо растворим в воде:
C6H5OH + NaOH ® C6H5ONa + h3O
фенолят натрия
Фенол имеет слабокислые свойства, поэтому сильные кислоты вытесняют его из его солей. Для этого к раствору фенолята натрия приливают несколько капель соляной кислоты (на стенках пробирки появляются легкоплавкие кристаллы плохо растворимого в воде фенола).
vunivere.ru
С чем может реагировать этанол?
С Полипропилэтилмегасупербутанолом-2
ты случаем не бомбу собираешься делать, а?
ага, и с мозгами!
С мозгами! а еще с этанолом (!) - диметиловый эфир, с галогенводородами, с серной кислотой, с кислотами Льюиса, ацетальдегидом, да просто дофига с чем. См. хим. cв-ва спиртов в любом учебнике по органике.
С организмом. В учебнике по химии достаточно подробно описаны химические реакции одноатомных спиртов.
Они спирты обладают очень слабыми кислотными свойствами. Атом ОН может замещаться на металлы только щелочи металлов. С2Н5ОН +2Na= С 2Н 5ONa+H 2 Могут взаимодействовать с кислотами (HCl, HBr) Также дигидротация (отщепление воды) бывает: -Внутри молекулярно (пример писать не буду) -межмолекулярное (то есть вода отщепляется от 2 моль спирта)
С альдегидом. получается эфир сложный. Это именно из теста
При достаточном доступе воздуха горит (за счёт его кислорода) светлым голубоватым пламенем, образуя терминальные продукты окисления — диоксид углерода и воду: C2H5OH + 3O2 → 2CO2 + 3h3O Ещё энергичнее эта реакция протекает в атмосфере чистого кислорода. При определённых условиях (температура, давление, катализаторы) возможно и контролируемое окисление (как элементным кислородом, так и многими другими окислителями) до ацетальдегида, уксусной кислоты, щавелевой кислоты и некоторых других продуктов, например: 3C2H5OH + K2Cr2O7 + 4h3SO4 → 3Ch4CHO + K2SO4 + Cr2(SO4)3 + 7h3O Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами, а также магнием, алюминием и их гидридами, выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов: 2C2H5OH + 2К → 2С2Н5ОК + Н2. C2H5OH + NaH → C2H5ONa + h3 Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров: С2Н5OH + RCOOH ⇄ RCOOС2Н5 + h3O С2Н5OH + HNO2 ⇄ С2Н5ONO + h3O С галогеноводородами (HCl, HBr, HI) вступает в обратимые реакции нуклеофильного замещения: C2H5OH + HX ⇄ C2H5X + h3O Без катализаторов реакция с HCl идет относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса. Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например: 3C2H5OH + PCl3 → 3C2H5Cl + h4PO3 Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например: С2Н5OH + Сh3=CHCN → С2Н5OCh3Сh3CN, реагирует с альдегидами с образованием полуацеталей и ацеталей: RCHO + С2Н5OH → RCH(OH)OС2Н5 RCH(OH)OС2Н5 + С2Н5OH → RCH(OС2Н5)2 + h3O При умеренном (не выше 120 °C) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир: 2С2Н5OH ⇄ С2Н5-O-С2Н5 + h3O При более сильном нагревании с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия происходит более глубокая дегидратация. При этом образуется этилен: Ch4Ch3OH ⇄ Ch3=Ch3 + h3O При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удается реализовать одностадийный процесс получения окиси этилена: 2Ch4Ch3OH +O2 → 2C2h5O + 2h3O В присутствии катализатора, содержащего оксиды алюминия, кремния, цинка и магния, претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция Лебедева): 2C2H5OH → Ch3=CH-CH=Ch3 + h3O + h3 В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука. В слабощелочной среде образует иодоформ: C2H5OH + 4I2 + 6NaHCO3 → CHI3 + HCOONa + 5NaI + 5h3O + 6CO2 Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствии других веществ, дающих подобную реакцию.
touch.otvet.mail.ru
Этиловый спирт с концентрированной серной кислотой
Напишите уравнения реакции этилового спирта с серной кислотой,пожалуйста!!!
Na2B4O7+2h3SO4+12C2H5OH=4BC2H5O3+2NaHSO4+7h3O
Наиболее доступный и распространенный лабораторный способ получения этилена нагревание смеси этилового спирта с концентрированной серной кислотой.
Получение этилена из речного песка, этилового спирта и концентрированной серной кислоты
Этилен из речного песка - это круто!C2H5OH (t>150 град, h3SO4 конц) ---> h3O + Ch3=Ch3 (этилен)
Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этиленаОбугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием
Лопнула пробирка со смесью этилового спирта и концентрированной серной кислоты. Опишите ваши действия.
Звонить в полицию
Фейерверк в жидкости. В мерный цилиндр наливаем 50 мл этилового спирта. Через пипетку, которая опущена до дна цилиндра, вводим 40 мл концентрированной серной кислоты.
Крикнуть "Атас" и срочно бежать к ближайшему источнику воды (туалет) отмыватьсяпотом набрать воду и тащить отмывать ей недобежавшихну и потом вызывать спецов если надо. и бежать переодеваться
Возможно сделать холодный огонь из борной кислоты и этилового спирта
Возможно, но легче из сероуглерода
Например, при нагревании этилового спирта с серной кислотой в мягких условиях образуется диэтиловый эфирВзял 50 г растертого сахара и 25 мл концентрированной серной кислоты. Опыт прошел аналогично, но менее эффектно.
Ингредиенты:сухая борная кислота, чайная ложкаэтиловый спирт, чайная ложкаконцентрированная серная или соляная кислота, одна капляПриготовление:Все ингредиенты помещается в блюдце.Перемешивается и слегка подогревается на теплой (чтобы можно было держать руку) водяной бане.Выделяющийся эфир борной кислоты можно поджечь (не поднося спичку близко к блюдцу, чтобы не зажечь спирт) .Эфир борной кислоты горит очень объемным, слегка зеленоватым пламенем, которое не только не обжигает, но даже не греет ощутимо, в нем спокойно можно держать руку.После того, как эфир борной кислоты весь выгорит, может начать гореть спирт, а его пламя будет обжигать.http://otvet.mail.ru/question/19061828/ - уже спрашивали.www.kakprosto.ru/kak-47166-kak-sdelat-holodnyy-ogon
При взаимодействии этановой кислоты с 1-пропанолом в присутствии концентрированной серной кислоты образуются
Лопнула пробирка со смесью этилового спирта и концентрированной серной кислоты. Опишите ваши действия.
А-а-а-! мы все умрём!!!
Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из сильных кислот, в широком диапазоне температур 40 При помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры, ПАВ, ряд...
О-о-о неееет!!!
Массу этилена, полученного при нагревании200г этилового спирта, содержащего4% примесей сконцентрированной серной кислотой.
.
При взаимодействии этилового спирта с ледяной уксусной кислотой в присутствии концентрированной серной кислоты образуется уксусно-этиловый эфир, обладающий своеобразным запахом
При нагревании этилового и пропилового спиртов с концентрированной серной кислотой образуется смешанный этилпропиловый..
Диэтиловый и дипропиловый эфиры еще.
50%прополоскав ее этиловым спиртом с последующим продуванием грушей.Концентрированной серной кислотой можно сушить следующие оба газа. Хлористый водород и иодистый водород.
При нагревании 26,8 г смеси этилового спирта и уксусной кислоты с несколькими каплями концентрированной серной кислоты п
Почему благодатный огонь не обжигает?
Почему больные выздоравливают иногда, от икон или мощей святых ?
Серная кислота с этиловым спиртом образует в начале этилсульфат C2H5OH h3SO4 C2H5O-SO2-OH h3O Далее молекула этилсерной кислотыC2H5O-SO2-OC2H5 Эти реакции происходят при прибавлении 96%-ного спирта к концентрированной серной кислоте при...
Смещен в 4й мерности.
Эфирный потому что
В экстазе ощущения притупляются
Спецсостав горючей смеси.
А вы палец положите.
Этиловый спирт и концентрированная серная кислота при нагревании выше 140- 150 С дают преимущественно этилен, при температуре ниже 140 С дают диэтиловый эфир.
Более чем уверен что им отлично можно сжечь всё что нужно. просто сказка, так же как и про восставшего из мертвых зомби.
Http://www.kakprosto.ru/kak-47166-kak-sdelat-holodnyy-ogon
Откуда берется "благодатный огонь"...есть ли научное обьяснение этого явления? Спасибо
Научного объяснения нет
Этиловый спирт массой 50 г смешали с концентрированной серной кислотой и нагрели до 160 градусов. Собрали 89% этилена от теоретически возможного. Сколько литров этилена было собрано?
Нет. На то оно и есть - чудо.
Из благодатной зажигалки=))
Что-то химическое.
Да химичат что-то. Не верю я в эти сказки для дураков.
Научного нет, но то, что колонна храма треснула в месте, где вышел огонь, когда однажды нарушили ход события появления огня - это факт, колонна треснутая есть, летописи есть.... http://guide-israel.ru/attractions/23881-rassechyonnaya-kolonna/
Наиболее доступный и распространенный лабораторный способ получения этилена - нагревание смеси этилового спирта с концентрированной серной кислотой. Однако первоначально взаимодействие спирта с кислотой приводит к образованию сложного эфира...
Какие вещ-ва могут образоваться при нагревании метилового и этилового спиртов с концентрированной серной кислотой:...
Может точно образоваться а, б, в, а вот "г" образуется при более высокой температуре
Для получения этилена в пробирку поместите 1,5 мл этилового спирта, затем осторожно прилейте 4 мл концентрированной серной кислоты и добавьте в смесь немного прокаленного песка.
Этиловый спирт + концентрированная серная кислота + прокаленный песок
Не пей
При нагревании 23 г зтанола с концентрированной серной кислотой образовалось два органических соединения.Т.е. фактически при нагревании смеси этилового спирта и серной кислоты происходит разложение этилсульфата?
Вы что, в Алхимию играете?
Какой газ выделяется ри нагревании смеси этилового спирта и серной кислоты(концентрированной)
Газ в реакции этерификации не выделяется, а парит скорее всего серная кислота
Написать уравнение реакции получения этилена из этилового спирта с помощью концентрированной серной кислоты.При смешивании концентрированной серной кислоты со спиртом идет реакция образования сложного эфира c.288 .
Есть мнение что полетит диэтиловыйэфир
Какую роль играет концентрируемая серная кислота при получении этилена из этилового спирта
Осушитель
Реакция образования изоамилового эфира при нагревании изоамилового спирта с концентрированной серной кислотой идет аналогично описанной выше реакции получения этилового эфира.
Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой?
CH₃-CH₂-OH ---> C₂H₄↑ + H₂O (H₂SO₄конц., t)при нагревании этилового спирта с конц. серной кислотой выделяется после процесса дегидратации газ этилен (этен).2) При пропускании этого газа через бромную воду, происходит ее обесцвечивание.C₂H₄ + Br₂--> C₂H₄Br₂ (1,2-дибромэтан)3) этилен горит светящимся пламенем из-за повышенного числа атомов углерода и наличия двойной связи. метан имеет меньшее содержание углерода, но горит с большим количеством теплоты, (мало света).4) этилен в отличие от предельных углеводородов практически не вступает в реакцию замещения, а наоборот для него характерны реакции присоединения.
Этерификацией спиртов концентрированной азотной кислотой получают органические нитраты 22 Серная кислота способна давать при взаимодействии со спиртами при низких Беспалов П. Окисление этилового спирта оксидом меди II . Органическая химия.
Где в Новочеркасске купить: 1)сухую борную кислоту, 2)этиловый спирт, 3) концентрированную серную или соляную кислоту!!!
Химик- самоучка...
Этиловый спирт выпускается промышленностью двух типов, пищевой и технический. Пищевой этиловый спирт ректификат, этанол, винныйЧистота спирта.В основу метода положена реакция посторонних органических примесей в спирте с концентрированной серной кислотой.
Холодное пламя
[ссылка заблокирована по решению администрации проекта] плюс убрать
Фактически при нагревании смеси этилового спирта и серной кислоты. Наиболее доступный и распространенный лабораторный способ получения этилена - нагревание смеси этилового спирта с концентрированной серной кислотой.
Какой эфир поучается при нагревании этанола и этилового спирта в присутствии концентрированной серной кислоты?...
Этанол и этиловый спирт это одно и то же вещество, просто разные названия, а при нагревании с серной кислотой получится этилсульфат
Смешайте этиловый спирт и концентрированную серную кислоту. Произойдет реакция с образованием кислого этилового эфира. Нагрейте смесь, при нагревании произойдет процесс дегидратации спирта с выделением этилена.
Уважаемые атеисты...
Если руку сбоку держать, а не сверху, то вроде жечь не будет.
Для первичных спиртов, вероятно, реализуется иной, Е2 механизм дегидратации в концентрированной серной кислоте, они дегидратируются в гораздо более жестких условиях.
Могу, самое первое это сухая борная кислота, этиловый спирт, концентрированная серная или соляная кислота. Здесь идет реакция окисления, которая вызывает свечение
Посмотри о фосфинах и бороэтилатах.)) )Или "холодный огонь" набери, там даже способы получения есть в домашних условиях. )
Асбестом оборачиваемся и не палит и не жжёт.
Http://ru.wikipedia.org/wiki/Холодный_огоньhttp://www.chemport.ru/forum/viewtopic.php?f=4&t=82849
Ну с минутами они конечно преувеличили.Этим огнем водят быстро по лицу и ли водят над ним руками.Но над ним не возможно продержать руку хотя бы 15-20 сек и не ощутить при этом боли.
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой реакция дегидратации спирта . Смесь готовят из одной части спирта и трех частей серной кислоты.
У тебя склероз? Вчера я уже приводил тебе:http://rutube.ru/tracks/735555.html?v=9dbc2624197baaa9effa44cc0ee0c58cА почему вопрос только к атеистам? Ты типа признаешь, что верующие - тупые неучи и в школу не ходили?
Обыкновенная школьная программа по химии и физике, но прошлого столетия!
В азербайджане есть горы горящие, там выходит газ какой то и от соприкосновения с воздухом возгорается, но Ахура Мазде поклоняются только возле этих гор, и почему то из этого сенсацию не делают
Это все фигня! скорее всего секрет в фитиле (!) свечей, который и дают в течение первых секунда холодный эффект огня. Фитиля чем-то пропитывают при изготовлении - вот и весь секрет...
Настоящий благодатный огонь воспламеняется от коллективной молитвы и некоторых магических действий, которые известны только православным иерархам. Он представдяет собой относительно холодную плазму и не обжигает, до тех пор пока не загорится свеча.Искуственно можно самовоспламенить пирофорные соединения. Подробнее узнать можно в сети, рецептов много, в том числе и о фторорганике.
5.3 Определение концентрации этилового спирта. Концентрацию спирта определяют по ГОСТ 3639.Метод основан на реакции посторонних органических примесей в спирте с концентрированной серной кислотой.
Если помолиться с верой, то огонь не обжигает. Проверено!
Тринитротолуол+специальный запал=NO PROBLEM
Это холодный термоядерный синтез, происходящий при комнатной температуре с излучением квантов электромагнитного поля и инфракрасного излучения.
И странно это.Почему тогда тот храм столько раз горел?!
Как получить из этилового спирта этилен
Инструкция1Этиловый спирт представляет собой бесцветную жидкость с характерным запахом алкоголя. Именно этанол используют для получения этилена. Этот опыт считается доступным и достаточно безопасным даже для школьного курса химии. Этилен - это газообразное вещество, которое визуально обнаружить не представляется возможным. Однако его наличие доказывают качественные реакции на непредельные углеводороды.2Для проведения эксперимента возьмите пробирку с пробкой и газоотводной трубкой. Закрепите приспособление для получения этилена в лабораторный штатив. Налейте в пробирку 2-3 мл этилового спирта . Очень осторожно добавьте туда же концентрированную серную кислоту, которую нужно взять в количестве, в 2 раза превышающем объем спирта (то есть 6-9 мл) .3Так как необходимо будет нагревание, то в полученную смесь обязательно добавьте немного чистого (предварительно прокаленного и очищенного от примесей) песка. Он будет предохранять смесь от выбрасывания из емкости. Закройте пробкой пробирку и начинайте ее нагревать. Концентрированная серная кислота обладает водоотнимающим свойством, что позволяет ей «забирать» воду. В результате произойдет реакция дегидратации, то есть отщепления воды. В итоге образуется газообразное вещество – этилен .4Так как его увидеть невозможно, то для подтверждения реакции проведите опыт. Для этого пропустите поток этилена через бромную воду, имеющую бурую окраску. Произойдет обесцвечивание бромной воды, что свидетельствует о том, что произошла реакция галогенирования (в частности бромирование) этилена. Эта реакция является качественной на непредельные углеводороды, а именно на этилен .5Так как бромная вода - очень ядовитое соединение, то его можно заменить перманганатом калия (обыкновенная марганцовка) . Приготовьте разбавленный раствор марганцовокислого калия, подкислите его серной кислотой и пропустите через него этилен . Произойдет обесцвечивание раствора, что также свидетельствует о присутствии этилена, который образовался в первом опыте.
Получить оксид марганца VII Mn2O7 можно действием концентрированной серной кислоты на перманганат калия. Этанол этиловый спирт, метилкарбино л, ви нный спирт или алкого ль, часто в просторечии просто спирт одноатомный спирт с формулой C2H5OH...
Какую роль играет концентрируемая серная кислота при получении этилена из этилового спирта.... ..
tax-auditor.ru