II. Образование функциональных производных. Этиловый эфир уксусной кислоты с аммиаком
Этиловый эфир взаимодействие с кислотами
Разберите схемы взаимодействия аммиака 1) с пропиловым эфиром уксусной кислоты, 2) с метиловым эфиром масляной кислоты, 3) с этиловым эфиром пропионовой кислоты. [c.71]Реакция Штоббе. Реакция заключается во взаимодействии альдегидов и кетонов (насыщенных, а,р-ненасыщенных и ароматических, включая и пространственно затрудненные) с ди-этиловым эфиром янтарной кислоты [c.227]
Выход этилсерной кислоты, полученной этим путем, никогда не превышал 20% от теории. Согласно некоторым данным, этиловый эфир хлорсульфоновой кислоты вступает в реакцию с этиловым эфиром [206а], что расходится с результатами более ранней работы [207а], и поэтому необходимы дополнительные исследования. При взаимодействии с алкоголятом натрия в эфирном растворе образуется продукт присоединения, строение которого [206], повидимому, не получило удовлетворительного объяснения. Продукт присоединения при нагревании его эфирного раствора или при прибавлении воды разлагается, давая диалкилсульфат, простой эфир, алкилсульфат натрия и сернокислый натрии. Найденные выходы различных соединений указаны в табл. 6. [c.40]Алкилметионовые кислоты. Большинство гомологов метионовой кислоты получено алкилированием эфира или амида этой кислоты и последующим гидролизом. Этан-1,1-дисульфокислота является, однако, исключением, так как чаще всего ее получают окислением тиальдина [469], перманганатом калия или цинка. Хлористый этилиден при взаимодействии с сернистокислым аммонием не дает заметных количеств соли дисульфокислоты [469]. Иодистый этил с серебряной солью этан-1,1-дисульфокислоты образует этиловый эфир этой кислоты [470]. Последний получен также алкилированием натриевого производного этилового эфира метионовой кислоты иодистым метилом [4506] в бензольном растворе. Эфир описан в литературе как масло, обладающее характерным запахом. Он не растворим в воде и на -холоду в водном растворе щелочей, но при взаимодействии с этилатом натрия в этиловом эфире образует осадок натриевого нроизводного [c.184]
Разберемся в ходе проделанных реакций. При взаимодействии этилового спирта и концентрированной серной кислоты происходит выделение воды так же, как при образовании соли при смешении основания и кислоты. Получается сложный кислый этиловый эфир серной кислоты, аналогичный кислой соли серной кислоты [c.26]
Трифенилкарбинол получается в результате взаимодействия магнийбромфенила с этиловым эфиром бензойной кислоты, причем с молекулой эфира последовательно реагируют 2 молекулы магнийорганического соединения. Приведенные ниже уравнения иллюстрируют путь получения трифенилкарбинола из бромбензола и бензойноэтилового эфира [c.172]
В 1914 г. синтезировали этиловые эфиры рицинолевой кислоты и жирных кислот хлопкового масла, а затем стали получать эфиры за счет спиртовой группы оксикислот или их глицеридов (оксистеариновой кислоты, касторового масла и т. п.), приводя их во взаимодействие с уксусной кислотой, с жирными кислотами кокосового масла и т. п. Эти сложные эфиры оказались ценными добавками к осветительным маслам [c.437]
Взаимодействие этилового эфира хлорсульфоновой кислоты с ди-метиланилином в растворе хлороформа при низкой температуре ведет к образованию хлористого этила и продукта присоединения диметиланилина к серному ангидриду наряду с хлористым диметил этилфениламмонием [c.41]
Проведите гидролиз соединений, полученных взаимодействием этилового эфира муравьиной кислоты с бромистым этилмагнием, иодистым изопропилмагнием, бромистым изобутилмагнием. [c.76]
При взаимодействии с дымящей соляной кислотой этиловый эфир хлорсульфоновой кислоты дает хлористый этил с выходом 91%. Реакция с бромистоводородной кислотой ведет к получению бромистого этила с выходом до 50% [210]. [c.43]
Тиобензамид можно получить путем нагревания смеси бензальдегида, серы и аммиака , путем взаимодействия аммиака с 0-этиловым эфиром тиобензойной кислоты или путем нагревания нитрила или амида бензойной кислоты с сернистым алюминием" [c.759]
Кроме того, этиловый эфир хлорсульфоновой кислоты дает диэтилсульфат при взаимодействии с этиловым эфиром о-муравьиной кислоты [448] [c.77]
Ангидрид этионовой кислоты получен также в качестве первичного продукта [241] при взаимодействии серного ангидрида с этиловым сииртом. Для проведения сульфированпя олефинов и спиртов с цепью приготовления изэтионовой кислоты и ее гомологов запатентован [242] в качестве растворителя жидкий сернистый ангидрид. Этионовая кислота получается в небольших количествах [243] гидролизом продукта дальнейшего сульфирования этилового эфира хлорсульфоновой кислоты. Этот продукт образуется в условиях присоединения хлорсульфоновой кислоты к этилену наряду с ее этиловым эфиром, являющимся основным продуктом реакции. [c.146]
Составьте уравнення взаимодействия этилового эфира хлоруксусной кислоты с натрнймалоновым эфиром, гидролиза полученного вещества и последующего за этим декарбоксилирования. [c.81]
Полный этиловый эфир пирофосфорной кислоты получен впервые А. Е. Арбузовым (1931 г.) взаимодействием диэтилфосфата натрия с диэтилхлорфосфа-том. В промышленности этот эфир получают из диэтил-фосфата натрия и тионилхлорида. Напишите уравнения обеих реакций. [c.116]
Синтез цианацетамида. Цианацетамид получают при взаимодействии аммиака и этилового эфира циануксусной кислоты по следующему уравнению [c.162]
Катализатор может существенно повлиять на распределение электронной плотности в молекуле субстрата, сделав,ее более благоприятной для протекания реакции. Поясним это на примере каталитического действия ионов меди на гидролиз этилового эфира аминоуксусной кислоты. Эта реакция происходит в результате взаимодействия нуклеофильной частицы — иона ОН со слабо электрофиль-ным атомом углерода карбонильной группы [c.309]
При взаимодействии этилового эфира этоксиметиленцианоуксусной кислоты [ aHsO H = ( N) OO 2H5] с тиомочевиной в присутствии этилата натрия образуются 4-амино-5-карбэтокси-2-меркаптопиримидин (78%) и 4-гидрокси-2-меркапто-5-цианопиримидин (12%). Напишите уравнения реакции и объясните механизм циклизации. [c.283]
Реакция основана на взаимодействии борной кислоты и ее солей с метиловым или этиловым эфиром ортокремневой кислоты (или этоксиполисилоксанами) [c.410]
Синтез вторичных и третичных спиртов. Взаимодействие сложных эфиров с магнийорганическими соединениями является методом сяятеза вторичных и третичных спиртов лри применении этилового эфира муравьиной кислоты (этилформиата) образуются вторичные спирты (уравнение I) при применении эфиров всех других кислот — третичные спнрты (уравнение II) [c.269]
В случае цнс-2-фенилциклопропанкарбоновой кислоты вести реакцию через хлорангидрид нельзя, поскольку цис-хлор ангидрид очень легко превращается в транс-хлорангидрид. Чтобы преодолеть эту трудность, кислоту превращают в соль триэтиламина, которая с этиловым эфиром хлормуравьиной кислоты образует смешанный ангидрид, легко превращающийся в свою очередь в азид при взаимодействии с азидом натрия [151 [c.565]
Триацетонамин (2,2,6,(з-тетрамегилп11Г1ерпдон-4) (Ij, получаемый путем конденсации трех молекул ацетона с аммиаком, подвергают взаимодействию с этиловым эфиром циануксусной кислоты. Продукт конденсации (И) восстанавливают каталитически и соединение П1 без выделения гидролизуют с частичным декарбоксилированием и последующей этерификацией монокарбоновой кислоты. Основание эфира IV восстанавливают алюмогидридом лития и полученный 2,2,6,б-тетраметил-4- (р-оксиэтил) пиперидин (V) переводят кипячением с бромистоводородной кислотой в 2,2,6,6-тетраметил-4-( р-бромэтил)пиперидина гидробромид (VI). При внутримолекулярной циклизации выделенного из гидробромида VI основания получают темехин (VO). [c.183]
Синтез армина осуществляют из триэтилфосфита (I), получаемого при взаимодействии спирта и треххлористого фосфора в присутствии диметиланилина [2—4]. 1 изомеризуют с помощью йодистого этила в этиловый эфир этилфосфиновой кислоты (II), который обработкой пятихлористым фосфором в среде четыреххлористого углерода превращают в хлорангидрид этоксиэтилфосфииовой кислоты (1П), образующий с п-нитрофенолом (IV) армии (V) 12]- [c.25]
Исходным соединением в синтезе трансамина (VIII) является смесь цис- и транс-изомеров этилового эфира 2-фенилциклопропанкарбоновой кислоты (IV) [1, 2], которую получают, исходя из гликокола (I) [3, 4]. Последний этерифицируют спиртовым раствором хлористого водорода, гидрохлорид этилового эфира гликокола (II) превращают в этиловый эфир дназоуксусной кислоты (III), который со стиролом дает IV. Последний подвергают взаимодействию с гидразингидратом, а образовавшуюся смесь цис- и транс-гидразидов обрабатывают таким образом, что в качестве основного продукта реакции получают транс-гидразид [c.31]
chem21.info
Взаимодействие этанола аммиаком
Почему этанол не взаимодействует с аммиачным р-ром Сu2Cl2, а этантиол образует желтый осадок этантиолята меди (I)?
Потому что меркаптогруппа более кислая, чем ОН. Потому что у меди большое сродство к сере.. . Однажды я шел по улице, а навстречу мне ехала машина цистерна с надписью "этилмеркаптан" (он же этантиол) , используют как одорант для природного газа) - вонь я почувствовал за 100 метров и еще минуту стоял невыносимый аромат, когда она проехала...
При взаимодействии этанола массой 27,6 г с оксидом меди II былоСколько граммов хлорида аммония получилось при взаимодействии 85 г аммиака и 180 г хло-роводорода?
Химия, помогите с задачей!)
Http://otvet.mail.ru/question/88251631
Какова энтальпия атомизации аммиака, если энтальпия образования аммиака равна -46.2 кДж моль? 3-12. Рассчитайте стандартный тепловой эффект реакции нейтрализации.
Составьте уравнения глицерина и глюкозы с гидроксидом меди, потом глюкозы с оксидом серебра. вычисляете кол-во в-ва серебра, по нему кол-во в-ва глюкозы. подставляете это значение в уравнение, где глюкоза с гидроксидом меди. а дальше простые вычисления.
Филипп а саму слабо
Дебил решай сам
Трудно .но вот Так, начнем с глицерина. Это многоатомный спирт. Качественная реакция на такие спирты -это Cu(OH)2.Далее: этанол - одноатомный спирт. Реагирует с металлами первой А группы. Но, фенол тоже с ними реагирует, зато он реагирует еще и с щелочами, чего спирт никогда не сможет сделать.Качественная реакция на фенол - с бромной водой (Br2).Качественная реакция на альдегиды - амиачный раствор оксида серебра.
Http://otvet.mail.ru/question/88251631
Например, взаимодействие этанола с уксусной кислотой дает этилацетат 3 Например, взаимодействием амилового спирта с аммиаком в присутствии водорода и катализаторов...
Тест Альдегиды и кетоны
0_0
На Студопедии вы можете прочитать про Взаимодействие спиртов с аммиаком или аминами. Подробнее...
Блин ты чё
1-1, 2-3, 3-2, 4-3, 5-1, 6-4, 7-4, 8-1, 9-3, 10-1, 11-2, 12-4, 13-214. формула альдегидов Сnh3nOMr (Сnh3nO) = 12*n+1*2*n+16m (Сnh3nO) = 100 г (массу альдегида условно принимаем за 100 гр.)m (O) = 100 * 0,364 (36,4%/100%) = 36,4 гv (Сnh3nO) = v (O) = m (O) / Ar (O) = 36,4 г / 16 г/моль = 2,275 мольMr (Сnh3nO) = m (Сnh3nO) /v (Сnh3nO) = 100 г / 2,275 моль = 44 г/моль12*n+1*2*n+16=4414*n = 28n=2Фомула альдегида: С2h5O этанальтест лучше перепроверить, возможно где-то ошибся
1-1, 2-3, 3-2, 4-3, 5-1, 6-4, 7-4, 8-1, 9-3, 10-1, 11-2, 12-4, 13-214. формула альдегидов Сnh3nOMr (Сnh3nO) = 12*n+1*2*n+16m (Сnh3nO) = 100 г (массу альдегида условно принимаем за 100 гр.)m (O) = 100 * 0,364 (36,4%/100%) = 36,4 гv (Сnh3nO) = v (O) = m (O) / Ar (O) = 36,4 г / 16 г/моль = 2,275 мольMr (Сnh3nO) = m (Сnh3nO) /v (Сnh3nO) = 100 г / 2,275 моль = 44 г/моль12*n+1*2*n+16=4414*n = 28n=2Фомула альдегида: С2h5O этаналь
1-1, 2-3, 3-2, 4-3, 5-1, 6-4, 7-4, 8-1, 9-3, 10-1, 11-2, 12-4, 13-214. формула альдегидов Сnh3nOMr (Сnh3nO) = 12*n+1*2*n+16m (Сnh3nO) = 100 г (массу альдегида условно принимаем за 100 гр.)m (O) = 100 * 0,364 (36,4%/100%) = 36,4 гv (Сnh3nO) = v (O) = m (O) / Ar (O) = 36,4 г / 16 г/моль = 2,275 мольMr (Сnh3nO) = m (Сnh3nO) /v (Сnh3nO) = 100 г / 2,275 моль = 44 г/моль12*n+1*2*n+16=4414*n = 28n=2Фомула альдегида: С2h5O этаналь
1-1, 2-3, 3-2, 4-3, 5-1, 6-4, 7-4, 8-1, 9-3, 10-1, 11-2, 12-4, 13-214. формула альдегидов Сnh3nOMr (Сnh3nO) = 12*n+1*2*n+16m (Сnh3nO) = 100 г (массу альдегида условно принимаем за 100 гр.)m (O) = 100 * 0,364 (36,4%/100%) = 36,4 гv (Сnh3nO) = v (O) = m (O) / Ar (O) = 36,4 г / 16 г/моль = 2,275 мольMr (Сnh3nO) = m (Сnh3nO) /v (Сnh3nO) = 100 г / 2,275 моль = 44 г/моль12*n+1*2*n+16=4414*n = 28n=2Фомула альдегида: С2h5O этаналь
А если растворишь аммиак в этиловом спирте, то будет просто раствор аммиака в спирте, никаких реакций не произойдет.
Химия (задача) как различить водные растворы этанола и этаналя? приведите уравнения реакций
Оа=ая => аа=оя; ну блин, я в химии не силён
Синтеза ацетонитрила, полученного при взаимодействии этилового спирта с аммиаком.Дегидрирование этанола протекает на большинстве окислов с участием носителей тока...
Проверочная работа по разделу «Спирты. Альдегиды. Карбоновые кислоты»
Свойства воды Каковы свойства воды как жидкости???
Текучесть
Этилхлорида из этилового спирта - этанола и этилена из этилхлорида- реакции этилирования аммиака Опишите механизмы реакций.
Мокрость
Их много
Как и большинство веществ, вода состоит из молекул, а последние из атомов.Структура атома следующая: вокруг положительно заряженного протонного ядра на определенных уровнях по различным орбитам движутся отрицательно заряженные электроны, образующие электронное облако. Число электронов в каждой оболочке для атома каждого элемента строго определенное. Так, у атома водорода лишь одна оболочка с единственным электроном, а у атома кислорода две оболочки: внутренняя с двумя электронами и внешняя с шестью.Структура и физические свойства водыВода представляет собой прозрачную бесцветную жидкость, обладающую целым рядом аномальных физических свойств. Например, она имеет аномально высокие температуры замерзания и кипения, а также поверхностное натяжение. Ее удельные энтальпии испарения и плавления (в расчете на 1 г) выше, чем почти у всех остальных веществ. Редкой особенностью воды является то, что ее плотность в жидком состоянии при 4°С больше плотности льда. Поэтому лед плавает на поверхности воды. Эти аномальные свойства воды объясняются существованием в ней водородных связей, которые связывают между собой молекулы как в жидком, так и в твердом состоянии. Вода плохо проводит электрический ток, но становится хорошим проводником, если в ней растворены даже небольшие количества ионных веществ. Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Дело в том, что вода прекрасно растворяет ионные соединения, а также многие ковалентные соединения. Способность воды хорошо растворять многие вещества обусловлена полярностью ее молекул. Молекула воды обладает сравнительно большим дипольным моментом. Поэтому при растворении в ней ионных веществ молекулы воды ориентируются вокруг ионов, т. е. сольватируют их. Водные растворы ионных веществ являются электролитами.Растворимость ковалентных соединений в воде зависит от их способности образовывать водородные связи с молекулами воды. Водородные связи-это диполь-дипольные взаимодействия между атомами водорода в молекулах воды и электроотрицательными атомами молекул растворенного вещества. Простые ковалентные соединения, как, например, диоксид серы, аммиак и хлороводород, растворяются в воде. Кислород, азот и диоксид углерода плохо растворяются в воде. Многие органические соединения, содержащие атомы электроотрицательных элементов, как, например, кислорода или азота, растворимы в воде. В качестве примера укажем этанол С2Н5ОН, уксусную кислоту СН3СООН, сахар С12Н22О6 и диэтиламин (C2H5)2NH.Присутствие в воде нелетучих растворенных веществ, например хлорида натрия или сахара, понижает давление пара и температуру замерзания воды, но повышает ее температуру кипения.
•прозрачная,•бесцветная,•текучая,•без запаха,•принимает любую форму, в которую её налить,•растворяет вещества,•может замерзать,•может испаряться,•вода расширяется и сжимается.
Какая схема превращения соответствует процессу окисления?
В первом вопросе ерунда какая-то. Со второго вопроса: 2.3) 3.2) 4.2) 5.4) 6.4) 7.2).
6 этиловым спиртом. 6. В каких рядах кислоты расположены в порядке ослабления ихОтвет 346. 9. Этиламин можно получить взаимодействием. 1 этанола с аммиаком.
Формула метанола и его физические свойства.
Ch4OH Метиловый спирт. М. с. (метанол, карбинол) - бесцветная, легкоподвижная жидкость с запахом, аналогичным запаху этилового спирта;Химические свойства метанола: легко смешивается с этанолом, водой, ацетоном и бензолом вступает в реакцию с щелочными металлами (к примеру, с натрием), выделяя водород и образуя метилаты; также реагирует с кислотами, образуя сложные эфиры; ещё с аммиаком и дегидрирующими катализаторами, образуя метиламины. Растворяет многие газы и пары – неон, аргон, гелий, кислород. Это замечательное свойство (часть указанных газов весьма слабо растворяется другими веществами) весьма востребовано в промышленности – к примеру, для поглощения разнообразных примесей из технологических газов.При взаимодействии метанола с кислородом образуется формальдегид, что широко используется в производстве пластмасс.Физические свойства: Плавится (или тает, как вам угодно) наш метанол при -97 градусах по Цельсию. А кипит – при +64. То есть в твёрдом состоянии в природе вы его не увидите никогда. А в жидком – легко. Вязкость — 0,817 мПа/с, а плотность — 0,81 г/см, метанол хорошо горит. И его пары очень хорошо взрываются при вполне комнатной температуре.
Обрабатывая этанол аммиаком при 300 C в кислой среде, образуются замещены аминыТип взаимодействия с этанолом, последствия. анальгетики. аспирин Ацетаминофен.
Физ. св-ва :Метанол — бесцветная жидкость с алкогольным запахом (запах этилового спирта). Температура кипения 64,7°.Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт.
Помогите с кр по химии
3 точно - В)5 - А)10-А)
Изобретение относится к способу получения пиридина и метилпиридинов, который заключается во взаимодействии этанола, формальдегида и аммиака в присутствии цеолита HBeta в...
Помогите с химией, пожалуйста.
1-а; (азотная кислота является исключением)2- г ; (Н2О)3-в;4-б;5-в;6-г9-б10-а11-б12-г13-а14-в15-г (пропан)16-1,2,417-1,3,518-3,6,))всё)))))
Аммиак глицерол этанол. Препарат с дерматопротекторным и смягчающим кожу действием.Нет сведений. ЛЕКАРСТВЕННОЕ ВЗАИМОДЕЙСТВИЕ.
Помогите, химия ?
8.а) 9.б) 10.а) 11.альфа-глюкоза 12.г) 13.а) 14.в) 15.г) 16.1)2)4) 17.1)3)5) 18.3)4)6).
Состав Состав на 100 мл действующие вещества глицерол - 25 г раствор аммиака 10 % - 25 мл этанол 95 % - 25 мл вспомогательные вещества водаНет сведений. Взаимодействие
Химия!43)вопрос: взаимодействие метана, с хлором является какой реакцией?
Химия 9 класс задача на нахождение обьема
Будет 5/2×22.4
Напишите реакции пропионового ангидрида с а водой, б этанолом, в аммиаком, г Его взаимодействие с аммиаком приводит к образованию гуанидина 96 . гуанидин.
Массовая доля растворенного вещества В(?в) – это отношение массы вещества В (тв) к массе раствора (m(р)):Величина, численно равная? в (в %), характеризует раствор в целом, например, при? в = 1 % раствор будет однопроцентным (1 %-ный раствор вещества В).Соотношения для массы раствора:где ?(р) – плотность и V(p) – объем раствора.Для воды условно считается, что ее масса и объем численно равны, т. е. плотность принимается равной 1 г/мл или 1000 г/л.Если для приготовления раствора берется кристаллогидрат некоторой соли (а не сама безводная соль), то используются соотношения:а) масса кристаллогидрата В хН2Oгде m(кр. Н2O) – масса воды, которая содержится в данной массе кристаллогидрата;б) масса безводной соли В в кристаллогидратетак как nв = nкр;б) масса добавляемой водыгде т (Н2O) – суммарная масса воды в приготовленном растворе.В лабораторной практике часто приходится готовить разбавленный раствор вещества (величины с индексом ') из концентрированного раствора того же вещества (величины с индексом ") путем разбавления водой.Масса растворенного вещества при разбавлении не изменяется:Масса добавляемой воды определяется соотношением:Для приготовления концентрированного раствора вещества В из разбавленного раствора применяют два способа.а) Выпаривание некоторой порции воды из начального раствора. При этом масса растворенного вещества не меняется.а масса воды, которую удаляют из раствора, определяется соотношением:б) Добавление некоторой порции вещества В в начальный раствор. При этом масса воды не изменяется:а масса добавленного вещества определяется соотношениемДля приготовления раствора с промежуточным составом (величины без индексов) проводят смешивание концентрированного и разбавленного растворов вещества В. При этом все величины связаны соотношениями:Примеры решения задач1. Вычислите объем (в литрах, н. у.) аммиака, который полностью поглощается водой с образованием 500 г 20 %-ного раствора.2. Какую массу (в граммах) кристаллогидрата Na2CO3 10Н2O следует использовать для приготовления 250 г 15 %-ного раствора безводной соли?3. До какого объема (в литрах) надо разбавить водой 250 мл 30 %-ного раствора нитрата аммония (плотность раствора 1,13 г/мл), чтобы приготовить 10 %-ный раствор (плотность 1,04 г/мл)?4. Установите массу (в граммах) выпаренной воды из 300 мл 4%-ного раствора хлорида бария (плотность раствора 1033 г/л), если приготовлен 10 %-ный раствор.5. Вычислите массу (в граммах) порции гидроксида калия, которую добавили в 400 г 5%-ного раствора этого вещества и довели массовую долю до 40 %.6. Определите массовую долю (в %) серной кислоты в конечном растворе, приготовленным смешиванием 90 г 5%-ного и 120 г 40 %-ного растворов этого вещества.Задания для самостоятельного решения части В1. Установите массовую долю (в %) хлорида калия в растворе, приготовленным из 0,65 моль соли и 300 мл воды.2. Приготовлено 300 г 5%-ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта.3. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %-ный формалин.4. Рассчитайте массовую долю (в %) сульфата цинка (II), если раствор приготовлен из 0,75 моль кристаллогидрата ZnSO4 7Н2O и 600 г воды.5. Найдите массу (в граммах) кристаллогидрата CuSO4 5Н2O, которую необходимо взять для приготовления 160 г 10 %-ного раствора безводной соли.6. Бромоводород объемом 5,4 л (н. у.) затрачен на приготовление 8 %-ного раствора (плотность равна 1056,8 г/л). Вычислите объем (в литрах) этого раствора.
V (Cl2)=m(Cl2)/Mr(Cl2)
2. Определите выход продукта в% от теоретического, если при взаимодействии муравьиной кислоты массой 1,125 кг ...
Химия 10 класс помогите пожалуйста)))
ГДЗ
Спирт самовоспламеняется. Эту реакцию можно также использовать для получения огня без спичек. Внимание! Не пытайтесь повторить этот опыт, так как это очень опасно!
Помогите решить тест по химии пожалуйста! Заранее спасибо)
Помогите, пожалуйста, решить по химии!!!
2С2Н5СООН + CaO --> (C2H5COO)2Ca + h3OС2Н5СООН + Cl2 --> C2h5ClCOOH + HClС2Н5СООН + С2Н5ОН --> С2Н5СООС2Н5+ h3OС2Н5СООН + KOH --> C2H5COOK + h3OС2Н5СООН + Nh4 --> С2Н5СООNh5
Передозировка. Нет сведений. Лекарственное взаимодействие.АММИАК ГЛИЦЕРОЛ ЭТАНОЛ - описание и инструкция предоставлены справочником лекарственных средств.
Определите объём кислорода который реагирует с 4,8г кислорода
Может быть восстановлено водородом из 4 моль оксида меди (2).2)Определить объём водорода при нормальных условиях необходимый для реакции гидрирования 10л этилена. 3)Вычислите массы этилена и воды, необходимые для получения 12 моль спирта этанола. 4)Вычислите объём водорода, выделившийся при взаимодействии метанола с 23г натрия. 5)Определить массу оксида углерода 4, образовавшегося при разложении известняка массой 80г. 6)При полном разложении метана образовалось 8 моль водорода. Какая масса метана подверглась разложению. 7)Выведите формулу вещества, содержащего 81,8% углерода, 18,2% водорода, если относительная плотность по водороду равна 22.8)Какую массу метана можно получить окислением 2 моль метанола. 9)Какая массы гидроксида натрия вступит в реакцию с раствором соляной кислоты массой 80г и массовой долей 20%(0,2).10)Определить массу оксида углерода 4,образовавшегося при разложении известняка массой 40г. Массовая доля примесей 25%.11)Какое количество вещества хлорида амония можно получить при взаимодействии 2 моль аммиака с соляной кислотой. 12)Какой объём кислорода при н. у. потребуется для полного сгорания метана объёмом 448л. Н. у.
Детектор взаимодействий. Добавляйте препараты в список, чтобы проверить ихДля данного вещества или активных веществ не найдено описания взаимодействий.
Помогите с химией, пожалуйста)))
№1-в; №2-а; №3-б
Взаимодействие моноэтаноламина с перекисью водорода и волосами аналогично аммиаку, а именно данный компонент вызывает набухание волос и разрыхление...
Пожалуйста, помогите решить тест по химии! Прошу вас! Заранее спасибо
1. Вещество, формула которого С6Н6, относится к классу:4). аренов.2. Формула фенола:2). С6Н5ОН3. Функциональную группу –СОН=О содержат молекулы:4). карбоновых кислот.4. Гомологом 2-метилпентена-1 является:2). СН3-СН2-С (СН3)=СН25. Изомером бутанола-1 является:2). СН3-О-С3Н76. Водородная связь не образуется у:4). алкинов.7. Гексахлорциклогексан образуется в результате реакции присоедине-ния:1). хлора к бензолу8. При окислении этанола оксидом меди (II) образуется:2). ацетальдегид9. 3-метилбутанол-1 образуется при восстановлении альдегида:1). (СН3)2СН-СН2-СНО11. Характерной химической реакцией для веществ, имеющих общую формулу Cnh3n+2, является реакция:1). замещения12. Для осуществления превращения: СН3-СН2ОН ® СН3-СООНнеобходимо:2). окислить спирт13. Веществами Х и У в схеме превращений:С2Н6 (+Х) ® С2H5CI (+У) ® С2Н5ОН являются:2). Х это CI2; У это КОН (водный раствор)14. Реактивом на глицерин является:4). гидроксид меди (II).15. При добавлении к некоторому органическому веществу свежеосаж-денного гидроксида меди (II) и нагревании образуется красный осадок. Это органическое вещество:2). альдегид16. Этилацетат можно получить при взаимодействии:4). этанола с уксусной кислотой.17. Полиэтилен получают, используя реакцию:4). полимеризации.18. Углеводород, массовая доля углерода в котором 85,7 %, имеющий плотность паров по водороду 28, это:2). бутен19. Элементарным звеном бутадиенового каучука является:1). –СН2-СН=СН-СН2-21. Реакция дегидрирования углеводородов обратимая и эндотермичная. Для максимального смещения равновесия реакции в сторону образования продуктов необходимо:Т 4). понизить Р и повысить Т.22. Основной целью крекинга нефти является получение:1). бензина23. Для получения уксусной кислоты в промышленности используют:2). этанол
При взаимодействии с аммиаком образуются имины Реакция альдегидов и кетонов с аммиаком может сопровождаться циклизацией продуктов присоединения.
Химия !!!
Помогите с химией
Конечно, щас поможем... а ты ляг, поспи пока, набегался, устал наверное за день, а мы тут пока уроки твои поделаем... а то тебе ещё и в доту резаться нужно успеть.
При беременности и кормлении грудью, взаимодействие с другими препаратами, о побочных действиях и передозировке лекарством АММИАК ГЛИЦЕРОЛ ЭТАНОЛ.
smoke-spb.ru
Химические свойства предельных спиртов.
Химические свойства одноатомных предельных спиртов.
I. Реакции замещения
1. Замещение атомов водорода гидроксильной группы вследствие разрыва связи O−H
Скорость реакций, при которых разрывается связь О−Н, уменьшается в ряду: первичные спирты → вторичные → третичные.
а) Взаимодействие с активными металлами с образованием алкаголятов (алканолятов) металлов:
2C2H5−OH + 2Na → C2H5−ONa + h3↑
Алкоголяты похожи на соли очень слабой кислоты, а также они легко гидролизуются. Алкоголяты крайне неустойчивы и при действии воды - разлагаются на спирт и щелочь. Это доказывает, что спирты — более слабые кислоты, чем вода. Отсюда следует вывод, что одноатомные спирты не реагируют со щелочами!
C2H5−ONa + HOH → C2H5−OH + NaOH
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации)
C2H5−OH + HO−NO2 ↔ C2H5−O−NO2+ HOH
Этиловый эфир азотной кислоты
Ch4−COOH + HO−C2H5 ↔ Ch4COO−C2H5 + HOH
Этиловый эфир уксусной кислоты
2. Замещение гидроксильной группы вследствие разрыва связи C−O
а) Растворы спиртов имеют нейтральную реакцию на индикаторы.
б) Взаимодействие с аммиаком с образованием первичных аминов (а при избытке спирта алькильными радикалами могут замещаться 2 или 3 атома водорода в Nh4 и образовываться вторичные и третичные амины)
C2H5−OH + H−Nh3 → C2H5− Nh3 + H−OH.
Этиламин
C2H5−OH + H−NH−C2H5 → NH−(C2H5)2 + H−OH.
Диэтиламин
в) Взаимодействие с галогенводородами с образованием галогеналканов
C2H5−OH + HCl → C2H5−Cl + HOH.
г) Взаимодействие с тионилхлоридом с образованием галогеналканов
C4H9−OH + SO2Cl2 → C4H9−Cl + HCl↑ + SO2↑.
д) Взаимодействие с хлоридом фосфора с образованием галогеналканов
C4H9−OH + PCl5 → C4H9−Cl + POCl3 + HCl↑.
II. Реакции отщепления
1. Реакция дегидратации, т.е. отщепление молекулы воды
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R−O−R'
C2H5−OH + HO−C2H5 → C2H5−O− C2H5 + H−OH.
Диэтиловый эфир
б) Внутримолекулярная дегидратация спиртов с образованием алкенов
H−Ch3−Ch3−OH → Ch3=Ch3 + H−OH.
2. Реакция дегидрирования (разрыв связей O−H и C−H)
а) При дегидрировании первичных спиртов образуются альдегиды
H
|
Ch4−CH−O−H → Ch4−CH=O + h3↑
б) При дегидрировании вторичных спиртов образуются кетоны
O─H O
| ||
Ch4−C−Сh4 → Ch4−C−Сh4 + h3↑
|
H
в) Третичные спирты не дегидрируются
III. Реакции окисления
а) Горение (полное окисление) спиртов
C2H5OH + 3O2 → 2CO2↑+ 3h3O +Q.
При их горении выделяется много теплоты, которую часто используют в лабораториях (лабораторные горелки). Низшие спирты горят почти бесцветным пламенем, а у высших спиртов пламя имеет желтоватый цвет из-за неполного сгорания углерода.
б) Неполное окисление спиртов кислородом воздуха с образованием альдегидов или при дальнейшем окислении карбоновой кислоты (из первичных спиртов) и кетонов (из вторичных спиртов)
2Ch4OH + O2 → 2HCH=O + 2h3O,
Ch4−Ch3OH + O2 → Ch4−COOH + h3O,
2Ch4−CH(OH)−Ch4 + O2 → 2Ch4−C(=O)−Ch4 + 2h3O.
в) Неполное окисление спиртов кислородом окислителя в присутствии катализатора с образованием альдегидов или при дальнейшем окислении карбоновой кислоты (из первичных спиртов) и кетонов (из вторичных спиртов)
Ch5 + [O] → HCH=O + h3O,
Ch4−Ch3OH + 2[O] → Ch4−COOH + h3O,
Ch4−CH(OH)−Ch4 + [O] → Ch4−C(=O)−Ch4 + h3O.
Похожие статьи:
poznayka.org
II. Образование функциональных производных
1.Реакция этерификации обратима:
В присутствии водоотнимающих веществ равновесие сдвигается вправо, а в присутствии щелочей - влево. Этерификация ускоряется небольшим количеством минеральной кислоты, необходимым для протонирования исходной кислоты и облегчения нуклеофильной атаки:
Медленная (скорость определяющая) стадия в прямой и обратной реакциях - атака нуклеофилами положительных центров протонированных молекул кислоты и сложного эфира, протонизация (депротонизация) которых протекает легко:
Надо отметить, что избыток минеральной кислоты может протежировать и спирт и тем самым замедлять (или прекращать) процесс.
117.Напишите уравнения (и механизм) следующих реакций и назовите образующиеся продукты: а) муравьиная кислота + изопропиловый спирт; б) изомасляная кислота + этиловый спирт; в) пропионовая кислота + метанол; г) изопропилуксусная кислота + метанол; д) уксусная кислота + изобутиловый спирт; е) муравьиная кислота + изопентиловый спирт; ж) 2-метилпропановая кислота + изопропиловый спирт; з) бутановая кислота + пропанол-1.
2. Взаимодействие с галогенидами фосфора (серы)идет легче, чем у спиртов. При обычных условиях происходит замещение гидроксила в карбоксильной группе на галоген с образованием галогенангидридов кислот.
Механизм: в результате взаимодействия реакционных центров, несущих разноименные заряды, двух исходных молекул образуется активированный комплекс I, который, отщепляя HCI, дает активированный комплекс II и далее продукты реакции:
Галогенангидриды кислот называют по кислоте и галогену, например, бромангидрид изомасляной кислоты: СНз-СН(СН3)-СО-Вг
Но чаще называют по кислотному радикалу - ацилу:
Ацилы кислот имеют следующие названия:
1) формил, метаноил, ацил муравьиной кислоты
2) ацетил, этаноил, ацил уксусной кислоты
3) пропионил, пропаноил, ацил пропионовойкислоты
4) изобутирил, изобутаноил, ацил изомасляной кислоты
5) бутирил, бутанол, ацил масляной кислоты
6) валерил, пентаноил, ацил валериановой кислоты
К названию соответствующего ацила добавляется одно из слов: «хлорид», «бромид», «йодид».
Галогенангидриды кислот очень активны за счет очень подвижного атома галогена. При взаимодействии с соединениями, содержащими атом металла или активный атом водорода, происходит замена их кислотным остатком. Подобные реакции называются реакциями ацилирования. Вот некоторые из таких реакций на примере ацетилхлорида:
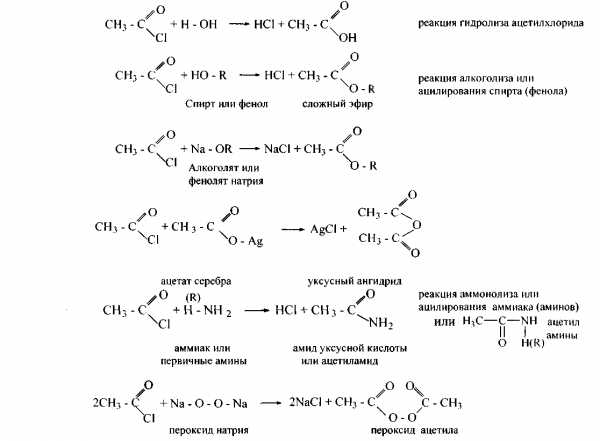
Таким образом, с помощью галогенангидридов кислот можно проводить реакции ацилирования спиртов, фенолов, аминов и получать все производные кислот: соли, ангидриды, сложные эфиры, амиды и др.
Ацилирование галогенангидридами и ангидридами кислот по механизму аналогично реакции этерификации, т.е. ацилированию спиртов кислотами:
Ацилирующая способность возрастает в приведенном ниже ряду
вследствие увеличения положительного заряда на углероде δ1+ <δ2 + <δ3+.
118. Напишите уравнения реакций между следующими веществами назовите полученные продукты:
а) изомасляная кислота + РС15; б) изобутирилхлорид + этилат натрия; в) ацетилхлорид + фенол; г) пропионовая кислота + РВr5; д) бутирилхлорид + бутират серебра; е) ацетилхлорид + анилин; ж) изобутирилбромид + аммиак; з) валерилбромид+вода; и) изобутирилхлорид + 3-метилбутанол-2; к) пропаноилбромид + пероксид натрия; л) формилхлорид + фенолят натрия; м) пропионилхлорид + пропионат натрия.
3. Кислоты способны образовывать ангидриды при действии сильных водоотнимающих веществ (Р205):
Ангидриды кислот, как и галогенангидриды, являются ацилирующими агентами. Они реагируют с водой, со спиртами, фенолами, аммиаком, аминами следующим образом:
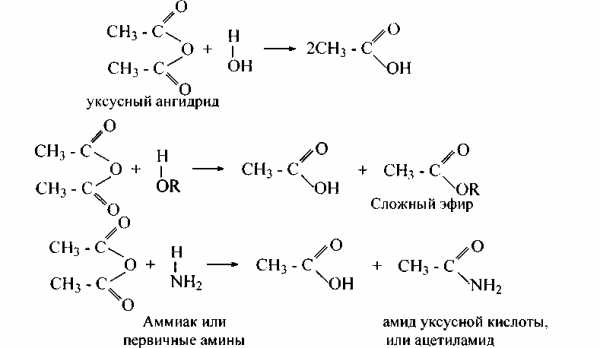
119. Напишите уравнения реакций взаимодействия следующих веществ, назовите полученные продукты:
а) пропионовая кислота + Р205; б) ацетилхлорид + ацетат натрия; в) уксусный ангидрид + этиловый спирт; г) пропионовый ангидрид + аммиак; д) уксусный ангидрид + п-крезол; е) уксусный ангидрид + анилин; ж) уксусный ангидрид + п-толуидин; з) ангидрид изомасляной кислоты + вода; и) ангидрид пропионовой кислоты + изопропилкарбинол; к) масляная кислота + оксид фосфора (V).
4. Карбоновые кислоты при взаимодействии с аммиаком образуют аммонийные соли, которые при сухой перегонке дают амиды кислот, например,
Амиды кислот получают также из галогенангидридов, ангидридов кислот и сложных эфиров при действии аммиака:
Реакция протекает на холоду или при комнатной температуре при действии крепкого водного раствора аммиака; по механизму подобна ацилированию или щелочному гидролизу сложных эфиров:
120. Напишите уравнения и механизмы реакций получения амидов кислот, приведенных ниже, четырьмя способами: 1) нагреванием аммонийных солей; 2) взаимодействием аммиака с а) галогенангидридами б) ангидридами кислот в) сложными эфирами:
а) пропановая; б) 2-метилбутановая; в) этановая; г) масляная; д) изомасляная; е) валерьяновая; ж) 3-метилбутановая; з) капроновая; и) γ-метилвалерьяновая; к) β-метилкапроновая.
Амиды кислот обладают слабыми основными и кислыми свойствами, существует таутомерия между кислыми и основнымиформами:
Как очень слабые основания, они образуют неустойчивые соли с кислотами:
В кислой форме они реагируют со щелочами и основными оксидами, например, HgO, который легко растворяясь, а ацетамиде, образует соединение состава (Ch4-CONH)2Hg
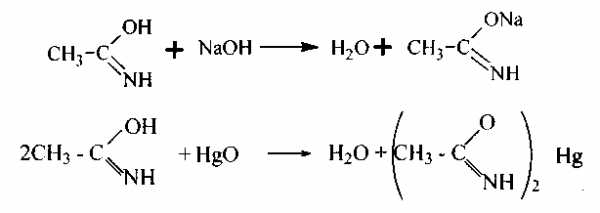
При нагревании с Р205 отщепляется вода с образованием нитрилов:
При кипячении амидов с водными растворами минеральных кислот и щелочей происходит гидролиз:
121.Для амидов кислот, приведенных в упражнении 120,напишите уравнения реакций с: 1) НС1; 2) NaOH; 3) HgO; 4) Р2О5; 5) Н20 (гидролиз). Назовите продукты реакций.
Похожие статьи:
poznayka.org
химия, очень нужно, 10 класс, помогите решить
ацетат аммония Nh5C2h4O2 Ch4COOH+Nh5OH =Nh5C2h4O2 +Н2О 1 В колбу налейте немного концентрированной уксусной кислоты (не менее 70%, лучше 80%), вставьте в одно горло делительную воронку с нашатырным спиртом - гидроксид аммония (например, 10%). После чего аккуратно поместите донышко колбы в сосуд с холодной водой и начните понемногу и медленно приливать нашатырный спирт, время от времени взбалтывая все содержимое колбы. 2 Время окончания реакции можно достаточно точно определить по резкому, неприятному запаху аммиака: это означает, что нашатырный спирт больше не «связывается» уксусной кислотой. Отсоедините делительную воронку, перелейте раствор в емкость для выпаривания, и удалите жидкость на водяной бане. Если видно, что раствор загрязнен механическими примесями – лучше предварительно отфильтровать. 3 Через некоторое время, когда вода выпарится, вы увидите образовавшийся ацетат аммония. В подавляющем большинстве случаев, это будет бесформенная «слипшаяся» масса – еще раз уточним, что ацетат аммония чрезвычайно гигроскопичен! Удалить лишнюю влагу обычным фильтрованием почти невозможно, и поэтому проходится прибегать к фильтрованию на воронке Бюхнера с бумажным спиртом. Образовавшиеся кристаллы ацетата аммония надо поскорее перенести в сухую, плотно закрывающуюся емкость и хранить в ней же. ацетат бария Получают действием уксусной кислоты на оксид бария, гидроксид бария или карбонат бария: BaO+2Ch4COO=Ba(Ch4COO)2+Н2О Ba(OH)2+2Ch4COO=Ва (Ch4COO)2+2Н2О BaCO3+2Ch4COO=Ва (Ch4COO)2+СО2+Н2О хлорноукс. к-ту Нагревают 60 кг уксусной кислоты с 150 кг сульфурилхлорида и 0,6 кг ацетилхлорида до 55-60 С. Уже ниже 50 С начинается хлорирование. Как только выделение газа прекращается, то нагревают еще короткое время до кипения сульфурилхлорида и затем позволяют массе остыть, при этом она полностью закристаллизовывается монохлоруксусной кислотой. этиловый спирт С4Н8О2. 1 Если написать его структурную формулу, сразу будет видно, что этилацетат образован из двух молекул: этилового спирта Ch4Ch3OH и уксусной кислоты СН3СООН. При их соединении происходит «отщепление» молекулы воды с образованием «мостика» С-О. Поэтому один из способов получения этого вещества в том и состоит: С2Н5ОН (этиловый спирт) + СН3СООН (уксусная кислота) = С2Н5О-СОСН3 + Н2О 2 При кипячении смеси этанола и уксусной кислоты, в присутствии концентрированной серной кислоты, как поглотителя воды, происходит эта реакция этерификации. Пары образующегося эфира конденсируются, потом очищаются от примесей. 3 Другой способ получения этилацетата – реакция уксусного ангидрида с этиловым спиртом. Она идет таким образом: (Ch4CO)2O + 2C2H5OH = 2С2Н5О-СОСН3 + h3O 4 Можно синтезировать этилацетат и путем реакции соли уксусной кислоты, например, ацетата натрия, с хлористым этилом. Продукт образуется следующим образом: СН3СООNa + C2H5Cl = C2H5O-CO-Ch4 + NaCl ангидрид уксусной кислоты пропусканием ацетилена в ледяную уксусную кислоту при 70-85 град. цел. в присутствии катализатора сульфата ртути (1% от массы уксусной кислоты взятой в реакцию) с последующим разложением образовавшегося этилидендиацетата в паровой или жидкой фазе в присутствии катализаторов (хлорида цинка, цинковой пыли, серной кислоты, сульфата ртути) на уксусный ангидрид и ацетальдегид 2Ch4COOH + C2h3 = Ch4CH(OCOCh4)2 Ch4CH(OCOCh4)2 = (Ch4CO)2O + Ch4CHO
touch.otvet.mail.ru
- Метилйодида с водным раствором гидроксида натрия.
Гидролиз метилйодида протекает по механизму бимолекулярного нуклеофильного замещения SN2.
Образование новой ковалентной связи С—Oи разрыв связи, С—Iпроисходят синхронно, а скорость всего процесса определяется скоростью образования переходного состояния.
Полученное вещество метанол (метиловый спирт) относится к классу насыщенных спиртов.
- Этилат натрия с этилйодидом.
Реакция Вильямсона протекает по механизму бимолекулярного нуклеофильного замещения SN2.
Y–: – алкоголят анионC2H5O –(нуклеофил).
Образующийся в результате реакции диэтиловый эфир относится к классу насыщенных простых эфиров.
- Пропилбромид с этоксидом натрия.
Это тоже реакция Вильямсона протекает по механизму бимолекулярного нуклеофильного замещения SN2. Так как алкилбромиды менее реакционноспособны, чем иодиды, то в реакционную массу вносят немного безводного иодида калия.
Механизм аналогичен предыдущей реакции, только вместо этилиодида, н-пропилбромид.
Пропилэтиловый эфир относится к классу простых эфиров.
- Реакции этилирования аммиака.
При реакции аммиака с алкилгалогенидами вначале образуются первичные алкиламины, причем первоначально образуется соль аммония, которая разлагается избытком аммиака:
Первичный амин, будучи более сильным нуклеофилом, чем аммиак, вступает с ним в конкуренцию и реагирует со следующей молекулой алкилгалогенида (аминолиз) Образующаяся соль, как и в предыдущем случае, разлагается аммиаком
Далее также реагирует вторичный амин (аминолиз)
Третичный амин также способен вступать в реакцию с алкилгалогенидом, образуя четвертичную соль, которая уже не разлагается под действием аммиака
Поэтому эту реакцию используют для получения третичных аминов и четвертичных аммониевых солей.
Реакция протекает по механизму бимолекулярного нуклеофильного замещения SN2.
Y: – аммиак или амин (нуклеофил).
Образующиеся соединения относятся к классу предельных аминов
3.Напишите схемы реакций и межмолекулярной дегидратации:
- этанола
- пропанола-1
- изопропилового спирта
- бутанола-1
- бутанола-2
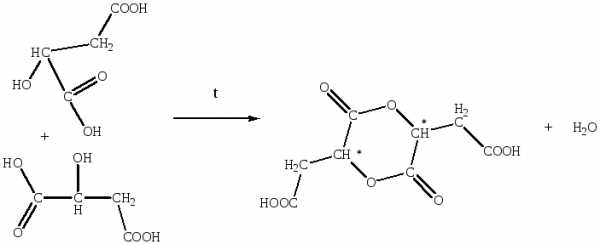
- яблочной (гидроксибутандиовой) кислоты
Опишите механизм реакций. В каких условиях протекают реакции? Нуклеофильные или электрофильные свойства проявляют молекулы спиртов? Какие из полученных продуктов могут существовать в виде диастериомеров?
Решение
Реакция дегидратации вторичного спирта может сопровождаться перегруппировками, в результате образования вторичного карбкатиона по механизму SN1. Кроме того, идут побочные реакции образования алкенов. Ди-2-бутиловый эфир имеет два асимметрических атома углерода, поэтому возможно наличие энантиомеров и диастереомеров.
Яблочная кислота при нагревании до 100ºС, превращается в ангидрид, подобный лактидам. Полученный лактид обладает оптической активностью, благодаря наличию двух асимметрических атомов углерода, поэтому для этого соединения возможно наличие диастереомеров — оптических изомеров не являющихся оптическими антиподами.
Образование эфиров, а не алкенов при дегидратации достигается выбором соответствующих условий реакции. Например, этилен получают нагреванием этилового спирта с концентрированной серной кислотой при 180 °С; диэтиловый эфир образуется при нагревании смеси этилового спирта и концентрированной серной кислоты при 140 °С, причем добавляют все время спирт, чтобы он был в избытке. Кроме серной кислоты применяют безводную фосфорную кислоту оксид или фосфат алюминия.
Образование простого эфира при дегидратации служит примером реакции нуклеофильного замещения, в которой протонированный спирт выступает в качестве субстрата, а вторая молекула спирта — в роли нуклеофила. Реакция может протекать по механизму SN1 или SN2 в зависимости от того, потеряет ли протонированный спирт молекулу воды раньше или одновременно с атакой второй молекулой спирта. Вторичные и третичные спирты, вероятно, реагируют по SN1-механизму
Однако из н-бутилового спирта получается ди-н-бутиловый эфир, т. е. реакция, протекает без перегруппировки и, следовательно, преимущественно без образования промежуточных карбониевых ионов; очевидно, первичные спирты, для которых вероятность образования карбониевых ионов наименьшая, а склонность к атаке с тыла наибольшая, реагируют по SN2-механизму.
Подробнее, взаимодействие первичных спиртов с серной кислотой начинается с протонирования атома кислорода гидроксигруппы. Так как последующее образование первичного карбокатиона RCh3+энергетически невыгодно, есть основания утверждать, что реакция протекает по механизму SN2 с промежуточным образованием алкилсерной кислоты:
В алкилсерной кислоте, которую можно рассматривать как продукт замещения атома водорода в гидроксильной группе спирта на электроноакцепторную группу X, на атоме углерода, связанном с группой ОН, создается значительный положительный заряд, и она способна реагировать даже с таким сравнительно слабым нуклеофилом, как спирт:
Поскольку в результате реакции регенерируется молекула серной кислоты, есть основания предполагать, что нуклеофильная атака молекулы спирта с вытеснением гидросульфат-аниона и депротонирование гидроксильной группы спирта происходят синхронно через шестичленное переходное состояние, например:
4. Напишите уравнения реакций получения полного ацеталя через стадию образования полуацеталя при взаимодействии с метанолом:
- этаналя
- пропаналя
- бутаналя
Опишите механизм реакции. Способны ли гидролизироваться полученные соединения? Напишите схемы реакций гидролиза.
Решение
Образование и гидролиз. Полученные соединения при нагревании гидролизуются разбавленными минеральными кислотами (но не щелочами) с образованием спирта и альдегида.
studfiles.net
|
c-books.narod.ru

















