Справочник химика 21. Ди втор бутиловый эфир
втор.-бутиловый эфир - Справочник химика 21
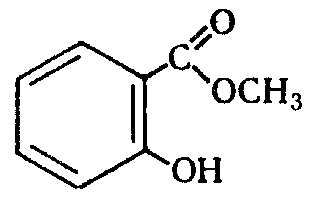
Циклогексиловый эфир 4-фторфенола. . . Втор.бутиловый эфир 2-хлорфенола. ... [c.217]
Втор.бутиловый эфир 2-втор.-бутил-4-бром-фенола. ....... 120—123/8 1,2011 1,5218 72,30 72,54 [c.218]
Тот факт, что продукты, получаемые при алкилировании бутенами-1 и -2 в присутствии серной кислоты и фтористого водорода, меньше различаются между собой, можно легко объяснить, если предположить, что при контактировании смеси изобутана и бутена-1 или -2 с жидким фтористым водородом или серной кислотой наиболее легко проходит реакция присоединения кислоты к олефиновому углеводороду с образованием втор-.бутилового эфира. В результате получается равновесная смесь [c.326]
Бутен-1 по своей активности немногим отличается от бутена-2 и со всеми кислотами дает тоже втор.бутиловые эфиры соответствующих кислот, но с более низкими выходами. Характер присоединения уксусной кислоты к этим двум нормальным бутиленам при одинаковых температурах имеет много общего. При 50° С выход втор.бутилацетата непрерывно возрастает, не достигая максимума в течение 48 час. При 97° С реакция эфирообразования вначале идет быстро, а затем замедляется. Выход втор.бутилаце-тата достигает 48% для бутена-1 в течение 8 час. и 62% для бутена-2, в течение 19 час. и остается таким на протяжении 24 час. [c.13]В отличие от реакции фенола с пропиленом [50] в данном случае из фенольных продуктов выделен только п-втор.бутилфенол с примесью небольших количеств о-втор.бутилфенола. Эфирные соединения представлены главным образом втор.бутиловым эфиром фенола. В небольших количествах выделены также втор, бутиловый эфир втор.бутилфенола. [c.171]
Втор.бутиловый эфир 2-бромфенола..... 86—87/1 1,2811 1,5312 55, 31 54,19 [c.218]
Втор.бутиловый эфир 4-бромфенола..... 95—97/3 1,28471 1,53101 55,15 54,19 [c.218]
Бромбензил-й-втор. бутиловый эфир. В колбу емкостью 500 мл, снабженную обратным холодильником, мешалкой и ка- [c.64]
Тетраметилбутан Дибутилсвый эфир Ди-втор-бутиловый эфир Ди-/прет-бутиловый эфир [c.439]
Б5086 —, втор-бутиловый эфир (транс) МеСН=СНСООСН(Ме)- -СНзМе 142,2 - [c.174]
Из трех бутиленов наиболее высокой химической активностью обладает изобутилен, но он легко полимеризуется в присутствии ВРз 0(С2Н5)2. Поэтому при 50 и 97° С вместо ожидаемых эфиров образуются маслообразные полимеры изобутилена. При комнатной температуре изобутилен с уксусной кислотой в течение 2 час. образует трет, бутилацетат с выходом 59% от теоретического. Такой выход эфира остается в течение нескольких часов, затем начинает падать и к 24 час. вследствии диссоциации эфира снижается до 25%- За изобутиленом но активности следует бутен-2. Этот углеводород в ряду нормальных олефинов наиболее активен к присоединению кислот. Нагревание его с уксусной и бензойной кислотами в присутствии ВРз-0(С2Н5)г в течение 24 час. при 97° С дает втор.бутиловые эфиры этих кислот с выходом 66 и 89% соответственно. Нагревание с трихлоруксусной кислотой при 97° С в течение 2 час. дает втор, бутилтрихлорацетат с выходом 91%. [c.13]
Нормальная масляная кислота менее активно реагирует с бутеном-2 в присутствии эфирата фтористого бора, чем иропионовая. Максимальный выход втор.бутилового эфира масляной кислоты составляет ири 51° С — 30% и при 97° С — 40%. Результаты опытов представлены в табл. 8. [c.27]
Изостроение изовалериановой кислоты при повышенной температуре способствует более легкой полимеризации бутена-2. Поэтому, хотя выход втор.бутилового эфира изовалериановой кислоты немного ниже, чем масляной кислоты, как это видно из результатов опытов, приведенных в табл. 9, свободного бутена-2 при температуре 97° С и времени 24 часа не остается, и реакционные ампулы вскрываются без заметного внутреннего давления. [c.28]
Образование максимума, связанного с диссоциацией эфира, в случае уксусной кислоты имело место лишь при применении в качестве катализатора смеси ВРз 0(С2Н5) 2 с HgO. Втор.бутиловые эфиры галоидозамещенных уксусных кислот претерпевают диссоциацию в присутствии только ВРз 0(С2Н5)г и при этом при более низкой температуре, через менее продолжительное время и тем легче, чем сильнее кислота. Так, втор.бутиловый эфир трихлоруксусной кислоты Частично диссоциирует в реакции даже при 52° С за 24 часа, а 1при 97° С диссоциация эфира начинается после [c.32]
Данные опытов, представленные в табл. 16, нам кажется, являются весьма интересными, в особенности при сопоставлении их с данными для этой кислоты и бутена-2. При температуре 50°С алкилирование хлоруксусной кислоты бутеном-1 вначале идет быстрее, и в первые два часа выход втор.бутилового эфира [c.37]
Втор.бутиловый эфир 4-втор. бутпл-2-бром-фепола. ....... 122—125/3 1,2008 1,5268 72, 54 72,91 [c.218]
Цианбензил-( -втор. бутиловый эфир. В сухую колбу емкостью 200 мл, снабженную обратным холодильником на шлифу и соединенную с хлоркальциевой трубкой для защиты от влаги, помещают 40 г 4-бромбензил- /-втор. бутилового эфира, 16 г порошкообразной цианистой меди, 40 2 сухого пиридина, 10 маленьких кристалликов медного купороса и 2 капли нитрила 4-толуиловой кислоты. Смесь нагревают в течение 15 час. при 215—225°. Получают 28 г 4-цианбензил- -втор. бутилового эфира с т. кип. 134—137 (9 ммУ, 1,5080 [a] + 10,9° (а 0,39° 0,1780г разбавлено 95 %-ным спиртом до 10 мл в трубке длиной 20 см) выход составляет 90% от теорет. Полученный 4-цианбензил-с(-втор. бутиловый эфир содержит бром, так как перегонкой не удается полностью освободиться от 4-бромбен-зил-d-BTop. бутилового эфира [89]. [c.65]
Ацетобензи л-4-в тор. бутиловый эфир. В колбу емкостью 300 мл, снабженную мешалкой, обратным холодильником и капельной воронкой, помещают9,26г магния в виде стружек и 30 мл сухого эфира затем при перемешивании прибавляют в течение получаса раствор 52 г иодистого метила в 120 мл сухого эфира. После того как прибавление иодистого метила закончено, смесь перемешивают еще 15 мин. и затем в течение 10 мин. прибавляют при перемешивании раствор 17 г 4-цианбензил- -втор. бутилового эфира в 100 мл сухого эфира. Смесь кипятят в течение [c.65]
Цианбензил- -втор.бутилсульфид. 20 г (0,077 моля) 2-бром-бензил-й-втор. бутилсульфида, 6,8 г (0,079 моля) безводной цианистой меди, 15 мл сухого пиридина, около 0,1 г безводной сернокислой меди и 0,1 г 4-цианбензойной кислоты нагревают в течение 17 час. при 210° реакционную смесь охлаждают до 100° и выливают в смесь из 125 мл воды и 2Ъ мл концентрированного раствора аммиака. Дают постоять 30 мин., после чего большую часть синего водного раствора сливают, а остаток экстрагируют бензолом и обрабатывают далее, как описано при синтезе 4-цианбензил- -втор. бутилового эфира [89] (см. стр. 65). Перегонкой выделяют 14,3 г 2-цианбензил- -втор.бутилсульфида с т. кип. 106° (0,5 мм) с1 1,0310 1,5474 [а] + 12,77°. Выход колеблется от 80 до 94% от теорет. [90]. [c.67]
К эфирному раствору прибавляют незначительное количество пикриновой кислоты для предотвращения полимеризации, сушат сернокислым магнием, фильтруют и отгоняют эфир. Остаток перегоняют в вакууме, применяя колонку высотой 15 см с насадкой из спиралей, и выделяют 5 г фракции с т. кип. 132°(5л1л ) 1,5310 происходит сильная полимеризация и колонка забивается твердым полимером. Вещество повторно перегоняют из колбы Кляйзена получают 4 г ii-втор.бутилового эфира 4-винилбензойной кислоты выход составляет 9,7% от теорет. [138]. [c.111]
Имеются все же работы, которые можно истолковать и как свидетельство в пользу сохранения тетраэдрической конфигурации радикалов. Так, при пиролизе оптически активной перекиси изовалерила, приводящем к образованию втор-бутилового эфира 2-метилмасляной кислоты, реакция протекает с сохранением конфигурации обоих асимметрических центров [c.279]
chem21.info
Бутилфенол - Справочник химика 21
Выделение 4-втор-бутилфенола. В термостойком стакане емкостью 250 мл растворяют 15 г полученного бутилфенола в 120 мл 57о-ного едкого натра, нагревают раствор до кипения, добавляют активированный уголь, кипятят в течение [c.49]
Динитро-втор-бутилфенол [c.298]
Диметил-б-втор. бутилфенол [c.70]
При кислотном разложении дает п-втор. бутилфенол и метилэтил-кетон. [c.362]
Диамино-9-р- >-рибофуранозил-р-пурин-2-С М14, II, 505. п-втор-Бутилфенол М7, XIX, 48. [c.184]
Ленин гидроперекисей в качестве основных продуктов получаются п-втор.бутилфенол и /г-вт р.бутилацетофенон. Следовательно, при окислении и-этилвтор.бутплбензола атака кислорода направлена преимущественно на вторичный альфа С-атом этильного радикала с образованием гидропв рекиси п-втор.бутил-а-метилбензила. [c.270]Они ацетилировали гидроксильную группу хлорангидридом уксусной кислоты и регистрировали спектр, обусловленный ме-тильным радикалом в ацетатной группе. Были получены интегральные спектры, однако наблюдалось некоторое наложение линий. Хотя число протонов в метильной группе в три раза больше, чем в гидроксильной, однако превраш.ение в ацетат связано с ограничениями вследствие пространственных затруднений. Для фенольных соединений определили отношение орто/пара-изомеров. Исследовали о-, л- и д-крезолы, о-, м- и п-этилфенолы, а также о- и п-втор-бутилфенолы. Из других алкилфенолов исследовали гептил-, октил-, но1шл-, децил-, С15—С20- и нолипропиленфенолы. [c.70]
Фенол, бутен-2 в/иор-Бутиловый эфир фенола (I), втор-бутилфенол (II) ВРз- 0(С2Н5)2 —20° С, 23 ч. Выход I — 61% II— 17,7%. С повышением т-ры растет выход продуктов фенольного характера [178]. См. также [202] [c.139]
При сернокислотном расщеплении гидроперекиси -втор.бутилизопропилбензола получаются ацетон, метилэтилкетон, гидрохинон и смесь /г-изопропилфенола и и-втор.бутилфенола. Наличие этих продуктов показывает, что при окислении д-втор.бутилизопропилбензола образуются гидроперекиси и-втор.бутил-а,а-диметилбензила (а), /г-изопропил-а-ме-тил-а-этилбензила (б) и дигидроперекись (в) [c.521]
Алкилариловые эфиры перегруппировываются в алкилфенолы [схема (23)] в присутствии различных катализаторов. Такие реакции могут индуцироваться фотохимически [24], например бензил-фениловый эфир дает главным образом и-бензилфенол, а из ди-фенилового эфира получается п-гидроксибифенил о- и/или п-алкилфенолы получаются также при катализе кислотами Льюиса [25]. Полагают, что при этом имеют место как меж-, так и внутримолекулярные миграции реакция зависит от растворителя и катализатора. Показано, что в случае втор-бутилфенилового эфира в присутствии хлорида алюминия протекает бимолекулярное алкилирование, что приводит к о- и п-втор-бутилфенолам с [c.438]
Метил-6-н. бутилфенол. ... 2-Метил-6-изобутил фенол. ... 2-.Мегил-6-втор. бутилфенол. . 2-Метил-4-н. бутилфенол. ... 2-Метил-4-изобутилфенол. ... 2-.Метил-втор. бутилфенол. . . 2-Мегил-4-трет. бутилфенол. . 2-н. Бутил-4-метилфенол. ... 2-Изобутил-4-метилфенол. ... 2-Изобутил-4-метилфенол. . . . 2-втор. Бутил-4-метйлфенол. . . 2-трет. Бутил-4-ме1Илфенол. . . [c.70]
Диметил-4-трет. бутилфенол 2-трет. Бутил-4-н. бутилфенол. 2-трет. Бутил-4-изобутилфенол. 2-трет. Бутил-4-втор. бутилфенол [c.70]
В водном элюенте (система И) значения Д/ уменьшаются с увеличением длины цепи замеш ающих групп. Этот случай аналогичен поведению этих фенолов в условиях обращеино-фазового распределительного процесса, следовательно, можно было бы считать, что полиамидная поверхность играет роль неполярной стационарной фазы. Барк и Грэхэм [270] такой трактовки не дают. Они считают, что полиамидный субстрат и в этом случае выступает как полярная протоноакцепторная поверхность. Но механизм сольватации, т. е. отрыва фенола от субстрата и перевод его в мобильную фазу, иной, чем в системе I. В системе II сольватируется гидрофильная часть фенола. Сольватация фенольных грунн будет затрудняться введением алкильных грунн во 2 положение и будет зависеть не только от величины молекулярного веса, но и от степени раз-ветвлениости алкильного радикала. Так, 2-втор-бутилфенол в системе II имеет значение Rf более высокое, чем 2 трет-бу-тилфенол (табл. 14). [c.37]
Мы нашли, прежде всего, что, судя по ИК-спектрам, перегруппировка н-бутил- и етор-бутилфениловых эфиров с хлористым алюминием давала идентичные продукты, которые были идентичны с полученными при бу-тилировании фенола егор-бутилхлоридом в присутствии хлористого алюминия. Сравнение ИК-спектров со спектрами аутентичных образцов показало, что продукты представляли собой смесь изомерных моно- и т-втор-бутилфенолов при полном отсутствии н-бутильных изомеров. Такие же результаты были получены при катализе смесью уксусной и серной кислот было также показано, что бутилирование фенола н- и вгор-бутилхлори-дами в присутствии хлористого алюминия приводит к идентичным продуктам. [c.240]
Фиг, 4. Разделение системы п — трет.-бутилфенал (А) — п — втор.-бутилфенол (Б) i —А —80% и Б - 20 /о 2 - X -, 5,W. и Б-45% [c.176]
chem21.info
метил втор-Бутил - Справочник химика 21
Проекционные формулы и конфигурации энантиомеров метил-втор-бутило-вого эфира [c.223]
Вопрос 2. 1. Какое соединение при окислении бихроматом калия в разбавленной серной кислоте образует метил-втор-бутил-кетон [c.78]
Хлористый ацетил, -бромбутан Хлористый бензоил, бромистый этил Метил-втор-бутил- кетон Этилфенилкетон АЬОз на асбестовой вате 425° С, 15 жл/ч. Выход 10,8% [526] Выход 18% [c.169]
СНз)зС-СН(СНз)-СН(СНз)-СН2-СНз метил-втор-бутил-шрет-изобутил-метан [c.118]
Напишите уравнения реакций получения альдегидов и кетонов, которые образуются, если подвергать дегидрированию спирты а ) изопропиловый б) втор-бутилкарбинол в) 3-метил-1-бутанол г) З-метил-2-бута-нол. Назовите образующиеся соединения (ср. 6.20). [c.46]
Напишите упрощенные структурные формулы спиртов а ) метил-этил-изопропил-карбинола б) ди-втор-бутил-карбинола в) метил-диизопропил-карбинола [c.32]
Второй стадией процесса извлечения изобутилена из фракции С4 с использованием ионообменных полимеров является каталитическое разложение метил-трег-бутил ового эфира на олефин и метанол [62 . [c.26]
Л-втор- бутил-1-метил- см, 1-Пеитен, 2, 3-диметил- [c.1138]
В связи с тенденцией использования бутиленов для производства метил-т/уе/п-бутилового эфира, алкилата или втор-бут-лового сппрта возрастает роль процессов получения высокооктановых компоненюв бензина из ППФ. [c.174]
Спектроскопические свойства гидроксильной группы представляют большой интерес для структурного анализа замеш,енных фенолов. Экспериментальные данные показывают влияние изомерии на сдвиг ДуОН, и, следовательно, энергию межмолекулярной водородной связи (МВС). В ряду орто-, мета- и пара-изомеров алкилфенолов частота у(ОН)мвс уменьшается, а смещение ДуОН увеличивается соответственно возрастает прочность водородной связи. При этом большее различие в величинах частот наблюдается у орто- и пара- и у орто- и мета-изомеров аналогичные параметры у мета- и пара-изомеров отличаются незначительно. Этот факт иллюстрирует наибольшее стери-ческое влияние на ОН-фуппу орто-заместителя. Влияние сказывается как на спектроскопических параметрах (частота, полуширина и интенсивность полосы поглощения), так и на физико-химических свойствах гидроксила (дипольный момент, способность к образованию водородной связи, константа ионизации). Так, последовательному ряду орто-заместителей 2—СНз 2-изопропил- 2-втор-бутил->2-трет-бутил соответствует следующий ряд значений уОН вс 3435-> ->3480->3485 3540 см->. Чем больше объем орто-радикала, тем больше степень экранирования ОН-фуппы и тем выше сдвиг ДуОН по сравнению с незамещенным фенолом. [c.13]
ИК-спектры [93] арилциклопропанов и арилциклобутанов удобны для целей характеристики отдельных соединений, но не Отражают специфического взаимодействия -малых циклов с ароматическим ядром. Вег арилциклопропаны имеют более или менее сильное поглощение в области 1022—1035 см . Полосы поглощения в этой области наблюдаются также и в спектрах всех исследованных арилциклобутанов, но имеют низкую интенсивность. В спектрах кумола и л- метил-втор-бутил-бензола также имеются полосы поглощения при 1020—1030 см . [c.195]
Оксигенаты. Во многих странах оксигенаты рассматриваются как основная альтернатива тетраэтилсвинцу. На практике используют метанол, этанол, трет-бути-ловый спирт, метил-от )е77 -бутиловый эфир (МТБЭ), метил-т/ еот-амиловый эфир (МТАЭ), этил-треот-бутиловый эфир (ЭТБЭ), этил-от/ ет-амиловый эфир (ЭТАЭ), диизопропиловый эфир (ДИПЭ), метил-втор-амиловый эфир (МВАЭ) (табл. 4.35). [c.359]
Эти данные создают трудности для любого простого объяснения. Большая разница в трудности переноса неопентила по сравнению с этилом дает основание предположить, что перенос идет по механиЗА1у бидюле-кулярного замещения. Сохранение структуры в группах / -пропила и втор-бутила также подтверждает такой механизм. С другой стороны, значительное увеличение легкости реакции переноса в ряду метил трет-бутил находится в противоречии с данными, которых следовало бы ожидать для этого механизма, и говорит в пользу карбоний-ионного механизма. [c.443]
При с0(рнокислотном расщеплении гидроперекиси -втор.бутил-изонропилбензола получаются ацетон, метилэтилкетон, гидрохинон и смесь и-изопропилфенола и -втор.бутилфенола. Наличие этих продуктов показывает, что при окислении тг-втор.бутилизопропилбензола образуются гидроперекиси га-втор.бутил-а,а-диметилбензила (а), я-изопропил-а-метил-а-зтилбензила (б) и дигидроперекись (в). Если судить по выходу ацетона, то атака молекулярного кислорода легче осуществляется на третичный углерод изопропильной группы. Окисление в црисутствии резината марганца и различных добавок цри темпе ратуре 113—115 и 120° С представлено на рис. 31, 32. [c.275]
Напишите формулы нижеследующих углеводородов и назовите их по заместительной номенклатуре а ) сижж-пропил-бутил-этилен б) триметил-перз-изобу-тил-этилен в ) иесимм-метил-втор-бутш-этилен] г) тетраэтил-этилен д) шжж-диизопропил-этилен е) симм-ди-/прет-изобутил-этилен. [c.17]
СНЗ-СН2-СН-СНЗ втор-Бутило- Бутанол-2 Метил эти лкар [c.105]
На нефтеперерабатывающем заводе в Эдмонтоне (Альберта, Канада) построена новая промышленная установка депарафинизации масел метил-к-пропил-кетопом [124]. Кетон применяется в этом случае без отдельного растворителя для масла, аналогичного толуолу, используемому в обычном процессе депарафинизации метилэтилкетон-толуолом. Установка депарафинизации производительностью 320 м /сутки, работающая на смеси метил-и-бутил- и метил-м-пропплкетонов, пущена на втором заводе в Канаде (в Сарнии) в конце 1938 г. [87]. [c.231]
Масляный альдегид Бромистый втор-бутил 3-Мет 1.1гептана 1 4 39 [c.269]
Алифатические или ароматические эфиры акриловой или метакриловой кислот Полимеры B(0R)3, где R — метил, изо- и втор-бутил, амил, гексил в полярных растворителях или в гексане, 0—100° С [110 [c.177]
Ацетаты 16 — метил 17 — этил 18 — изопропил 19 — к-пропил 20 — втор-бутил 21 — изобутил гг — -бутил. Спирты 23 метиловый 24 этиловыйз 2 — изопропиловый 26 — (-пропиловый 27 — изобутиловый 28 — к-бутиловый. [c.391]
Метил-(изопропил-, изобутил- или втор-бутил-)кротонат Полимеры иАШ4 [2832] [c.364]
Метил-(этил-, изопропил-, н-бутил-, втор-бутил-, трет-бутил-, 2-этилгек-СИЛ-, циклогексил-, бензил-)глицидило-вый эфир Полимер 2пС1а — А1( эо-СзН70)з или M uзo- HM)з. Оптимальное соотнощение А1 2п = 2 1 [434] [c.634]
Используя этот метод вычисления В12, Битти и Стокмейер [707] для смеси метана и бутана, а Реусс и Бенаккер [3424] для смесей Нг — СО и Нг — N2 получили результаты, хорошо согласующиеся с экспериментальными. В работах Горского и Миллера [1827] и Коттрелла с сотрудниками [1191, 1192, 4234] наряду с результатами, хорошо согласующимися с экспериментальными данными (смесь Ог с Ыг), получены результаты, значительно отличающиеся от экспериментальных (смеси СО2 с Оа). Кроме того, эти авторы установили, что для многих исследованных смесей температурная зависимость вычисленных вторых вириальных коэффициентов сильно отличается от температурной зависимости экспериментально найденных значений 8 - В настоящее время из-за недостаточного количества работ нельзя сделать окончательного вывода об области применимости данного метода. Однако, как показывают результаты работ, упоминаемых выше, применение метода комбинирования силовых постоянных для смесей газов, состоящих из приблизительно равных по размерам неполярных молекул, дает значения хорошо согласующиеся с экспериментальными. [c.1004]
Автоокисление 4-втор.бутил-о-ксилола изучалось при 110° в присутствии резината марганца, едкого натра, гидроокиси кальция соды, стеарата натрия и ацетата кобальта до образования максимальной концентрации гидроперекиси или до полного исчезновения ее из реакционной массы. Установлено, что при действии кислорода воздуха на 4-втор.бутил-о-кси-лол окислению подвергаются все три радикала с образованием смеси гидроперекисей 2-метил-4-втор.бутилбепзила, 2-метил-5-втор-бутилбензила и [c.527]
Первый из рассмотренных переходов является примером разрыва р-связи, второй показывает, как образующийся осколочный ион может дать ион с массой 30. Для вторичных и третичных аминов распад по Р-связи также является вероятным процессом, В общем случае с большой вероятностью осуществляется разрыв более длинной цепи. В спектрах этих аминов максимальные пики обычно соответствуют ионам с массой более 30. Например, в масс-спектре ди-н-амил-амина максимальный пик отвечает ионам с массой 100, которые образуются благодаря разрыву Р-связи в спектре триэтиламина максимальный пик соответствует ионам с массой 86, образованным аналогичным путем. Этот тип распада не обязательно приводит к ионам, образующим максимальный пик, однако ионы, возникающие таким путем, всегда дают интенсивные пики. Так, например, в масс-спектре диазоамиламина пик с массой 100 обладает интенсивностью только 40% от интенсивности максимального пика. Максимальные пики 44 или 58 обычно характеризуют первичные амины, если у ос-углеродного атома имеется разветвление в виде метильной, этильной и диметильной групп. В таких случаях разрыву р-связи способствует то, что она находится в месте большего разветвления. Однако для вторичных и третичных аминов, разветвленных у а-углеродного атома, приведенное выше направление распада становится менее вероятным с увеличением длины боковых цепей характерные перегруппировочные ионы часто образуются при двойном разрыве обеих а- и Р-свя-зей по обе стороны от функциональной группы с миграцией одного атома водорода. Например, в спектрах диизопропиламина и ди-втор-бутил-, амил- и гек-силаминов максимальный пик с массой 44 образуется благодаря этому процессу. Рассматриваемый процесс может также привести к ионам с массой 58 и 72 в том случае, если заместитель у а-углеродного атома тяжелее метила. Это направление распада может также иметь место, если у а-углеродного атома нет разветвления в этих случаях образуются ионы с массой 30, что иллюстрировалось выше примером с диэтиламином. [c.398]
chem21.info
Ди-н-бутиловый эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Ди-н-бутиловый эфир
Cтраница 1
Ди-н-бутиловый эфир был подвергнут действию концентрированной иодистоводородной кислоты. Полученная смесь была обработана влажной окисью серебра. [1]
Ди-н-бутиловый эфир оказывает раздражающее действие на глаза и слизистые оболочки носа и гортани. [2]
Технический ди-н-бутиловый эфир почти не содержит перекисей, если только он ие хранился в течение длительного времени. Тем не менее следует обязательно производить испытание на присутствие перекисей и, если они имеются, то удалять их, как описано для диэтилового эфира. После очистки от перекисей ди-н-бутиловый эфир высушивают безводным хлористым кальцием и перегоняют над натрием из колбы с дефлегматором, собирая фракцию с т, кип. [3]
Технический ди-н-бутиловый эфир почти не содержит перекисей, если только он не хранился в течение длительного времени. Тем не менее следует обязательно производить испытание на присутствие перекисей и, если они имеются, то удалять их, как описано для диэтилового эфира. [4]
Ди-н-бутиловый эфир изопропенилфосфоновой кислоты ( - С4Н9О) 2Р ( О) С ( СН3) СН2 [90], К раствору 13 4 г ( 0 053 моля) гри-и-бутилфосфи-та в 80 мл сухого диэтилового эфира при 20 - 22 С и перемешивании добавляют 4 5 г ( 0 052 моля) 1-нитро - 1-пропеиа. [5]
Пары ди-н-бутилового эфира оказывают раздражающее действие на глаза и слизистые оболочки носа и гортани. [6]
Раствор 5 г ди-н-бутилового эфира () - винной кислоты ( эфир L-тре-аровой кислоты) ( V) [14] в 25 мл сухого тетрагидрофурана осторожно прибавляют при перемешивании к раствору 3 г алюмогидрида лития в смеси 75 мл тетрагидрофурана и 25 мл эфира. На этой и на любой последующей стадии восстановления выпадение осадка не происходит. Смесь кипятят с обратным холодильником 4 час, охлаждают и осторожно выливают при перемешивании в 150 мл воды, прибавляют 10 мл ледяной уксусной кислоты и упаривают в вакууме досуха. К сухому остатку прибавляют 100 мл уксусного ангидрида, смесь нагревают на кипящей водяной бане 1 час и затем кипятят 2 час с обратным холодильником на масляной бане, чтобы осуществить одновременно ацетилирование и расщепление комплекса с металлом. После удаления большей части уксусного ангидрида отгонкой в вакууме остаток охлаждают и встряхивают с 100 мл воды и некоторым количеством соляной кислоты, достаточным для растворения неорганических солей. Ацетат ь-треита экстрагируют хлороформом, хлороформный экстракт промывают водой для удаления минеральной кислоты и высушивают сульфатом магния. [7]
В 300 мл сухого ди-н-бутилового эфира суспендируют 40 г магниевых стружек и нагревают в трехгорлой колбе, снабженной мешалкой, обратным холодильником, капельной воронкой и термометром. Для инициирования реакции добавляют 1 мл йодистого Метила и несколько кристалликов иода. Колбу помещают в охлаждающую баню и прибавляют 200 г бромистого метала, растворенного в 150 мл ди - - бутилового эфира, с таким расчетом, чтобы температура не поднималась выше 40 С. По окончании прибавления бромистого метила реакционную смесь нагревают при 40 С до полного растворения металлического магния. Затем реакционную смесь охлаждают до - 15 С и по каплям прибавляют раствор 48 г четыреххлористого германия в 50 мл ди - - бутилового эфира. По окончании прибавления температуру медленно поднимают до 80 С и нагревают при этой температуре в течение 2 час. После охлаждения прибавляют по каплям воду для разложения избытка реактива Гриньяра. Отгоняют реакционную смесь до тех пор, пока температура паров не достигнет температуры кипения ди-н-бутилового эфира. [8]
Металлический калий в ди-н-бутиловом эфире [86] расщепляет гексафенилдисилан, но этот метод не имеет преимуществ перед вышеописанным методом. Натрий, диспергированный в эфире, тетралине [179], ксилоле или диокса-не [86], не расщепляет гексафенилдисилана. Однако трифенилсилил натрий не нашел такого широкого использования, как трифе - нилсилиллитий или трифенилсилилкалий. [9]
По всем данным, ди-н-бутиловый эфир имеет столь низкую основность, что ее вообще невозможно измерить этими методами. [10]
Сложные эфиры - октилдециловый эфир, триметиладшшновый и ди-н-бутиловый эфир гептадекандикарбоновой кислоты, добавленные к нефтяным маслам, повышают индекс их вязкости, уменьшают испарение, улучшают адгезионные и моющие свойства. [11]
Приготавливают раствор хлористого - бутилмагния в ди-н-бутиловом эфире ( см. выше синтез тетрабутилолова, стр. К 751 2 г охлажденного до нуля реактива Гриньяра ( 0 3445 мг C4HeMgCl в 1 мл раствора) в той же аппаратуре при 0 С постепенно прибавляют 842 г ( 387 мл) хлорного олова так, чтобы температура не превышала 15 С. Затем реакционную смесь перемешивают еще час при комнатной температуре и при наружном охлаждении водой со льдом осторожно разлагают водой, а затем разбавленной ( 1: 1) соляной кислотой. Масляный слой отделяют, водный слой дважды экстрагируют дибутиловым эфиром, растворитель отгоняют. [12]
Получена также этилборная кислота в виде ее ди-н-бутилового эфира [ 721 при взаимодействии триэтилалюминия с три-м-бутилборатом. [13]
Разработан также вариант прямого анализа КОС после растворения пробы в ди-н-бутиловом эфире. [14]
Он вступает в реакцию с к-бутиловым эфиром ортомуравьиной кислоты и с ди-н-бутиловым эфиром сернистой кислоты, образуя ди-н-бутил-сульфат. [15]
Страницы: 1 2 3
www.ngpedia.ru
как из бутана получить соответствующий альдегид
БУТИЛОВЫЕ СПИРТЫ (бутанолы) С4Н9ОН, мол. м. 74,12. трет-бутиловые спирты (2-метил-2-пропанол, триметилкарбинол) -твердое в-во с запахом плесени; н-бутиловые спирты (1-бутанол, пропилкарбинол), втор-Б. с. (2-бутанол, метилэтилкарбинол) и изо-бутиловые спирты (2-метил-1-пропанол, изопропилкарбинол) - бесцв. жидкости (см. табл.) со спиртовым запахом, смешивающиеся со многими орг. р-рителями. Плотность паров бутиловые спирты по воздуху 2,56. По хим. св-вам - типичные алифатич. спирты. Напр., этерифицируются к-тами, при взаимод. с альдегидами (кетонами) образуют ацетали (кетали), дегидратируются в простые эфиры и олефины. Окисляются, кроме трет-бутиловые спирты, в карбонильные соед., напр. масляный альдегид получается из н-бутиловые спирты, метилэтилкетон - из втор-бутиловые спирты бутиловые спирты, кроме третичного, с ВС13 при — 10°С в пентане образуют соответствующие бораты (С4Н9О)3В, с Nh4-моно-, ди- и трибутиламины. Осн. пром. метод получения н-бутиловые спирты - оксосинтез из пропилена в присут. НСо(СО)4 при 120-160°С и 20-35 МПа: СВОЙСТВА БУТИЛОВЫХ СПИРТОВ Образующиеся на первой стадии масляный и изомасляный альдегиды разделяют, если первый используют для получения 2-этилгексанола. Из 1 т пропилена образуется 1185-1310 кг смеси масляного альдегида с н-бутиловые спирты и 305-320 кг изо-Б. с. Применение каталитич. системы HCo(CO)3L, где L-электронодонорный лиганд (триалкил-или триарилфосфины либо фосфиты), позволяет повысить выход продуктов нормального строения до 1390 кг, снизить давление до 5-10 МПа, а также проводить процесс в одну стадию. Эффективными катализаторами гидроформилирования м. б. карбонилы Rh. н-бутиловые спирты можно также получать: 1. Из пропилена в одну стадию под давл. 1,0-1,5 МПа (по Реппе): СН3СН=СН2 + ЗСО + 2Н2О -> н-бутиловые спирты + изо-бутиловые спирты + 2СО2. Процесс применяют за рубежом [кат.-предположительно h3Fe3 (CO)11]. Соотношение н-бутиловые спирты: изо-Б. с. = 84:16. Основной недостаток: низкая объемная скорость подачи сырья. 2. Из ацетальдегида через ацетальдоль и кретоновый альдегид, к-рый гидрируют на медных, меднохромовых или никелевых кат.: Процесс проводят при низких давлениях и умеренных т-рах, получая практически один н-бутиловые спирты Осн. недостатки: многостадийность, наличие агрессивных сред, большой расход ацетальдегида (примерно 1,3 т на 1т н-бутиловые спирты). 3. Ацетоно-бутиловым брожением пищ. сырья; соотношение образующихся при этом продуктов - ацетон : н-бутиловые спирты: этанол = 3:6:1. Недостаток: использование дефицитного и дорогого сырья. изо-бутиловые спирты содержится в значит. кол-ве в сивушных маслах, откуда выделяется фракционной перегонкой. Его получают также оксосинтезом (вместе с н-бутиловые спирты; см. выше) и из смеси СО + Н2 по схеме, аналогичной синтезу метанола, но при др. параметрах. Оксосинтез характеризуется лучшими технико-экономич. показателями как по себестоимости продукта, так и по удельным капиталовложениям. втор-бутиловые спирты получают взаимод. 70-85%-ной h3SO4 с бутенами, содержащимися во фракциях С4 термич. и каталитич. крекинга нефтепродуктов, пиролиза жидких углеводородов и одностадийного дегидрирования бутана. Из бутенов предварительно удаляют изобутен и бутадиен. Образующуюся втор-бутилсерную к-ту гидролизуют. Сырьевая база для синтеза втор-Б. с. может быть расширена за счет димеризации этилена в н-бутены или олигомеризации его с образованиембутена в кач-ве побочного продукта. В оптим. условиях из 1 т бутенов образуется 1,1 т втор-бутиловые спирты Его можно синтезировать также эпоксидированием бутенов орг. гидропероксидами с послед. гидрированием полученного эпоксида в спирт или прямой гидратацией бутенов. трет-Б. с. синтезируют взаимод. 40-65%-ной h3SO4 с изобутеном, содержащимся во фракциях С4, так же, как втор-бутиловые спирты (см. выше), и прямой гидратацией изобутена в присут. сульфокатионитов. Применяют н-бутиловые спирты, мзо-бу Источник: http://www.chemport.ru/chemical_encyclop...
touch.otvet.mail.ru
Тетраметилбутан - Справочник химика 21
Очевидно, эта реакция протекает настолько быстро, что трет--бутоксильный радикал не успевает разложиться с образованием трет-бутанола или ацетона. Третичный бутильный радикал, дис-пропорционируя, образует изобутан и изобутилен димери-зуясь, дает 2,2,3,3-тетраметилбутан, а при дальнейшей атаке продуктов реакции — триметилпентан и триметилпентен [c.264]
Тетраметилбутан Инкременты группы СНг к-алканов [c.471]Тетраметилбутан Дибутилсвый эфир Ди-втор-бутиловый эфир Ди-/прет-бутиловый эфир [c.439]
Метод кристаллизации применяется для выделения из нефтяных фракций индивидуальных углеводородов или групп углеводородов (например, нормальных алканов), имеющих наиболее высокие температуры кристаллизации. Температура кристаллизаций зависит от размеров молекул и, в еще большей степени, от симметрии молекул углеводородов. Так, температура кристаллизации нормальных алканов повышается с увеличелием их молекулярной массы и, начиная с гептадекана (т. крист. 22,5 °С), это твердые вещества при комнатной температуре. Температуры кристаллизации трех изомеров октана, расположенных в порядке повышения молекулярной симметрии, приблизительно следующие 2-метил-гептан — 109 °С октан —-57°С 2,2,3,3-тетраметилбутан 101 °С, Температура кристаллизации п-ксилола (13,26 °С) на 38,5 °С выше, чем о-ксилола и на 61 °С выше, чем у наиболее близкокипя-щего ж-ксилола. " [c.68]
Во всех трех реакци ях ориентировочно можно считать, что (Д529в)х.р 0, так как во всех трех процессах ДУх р=0. Следует указать, что энтропия весьма чувствительна к структуре, поэтому для заключения о величине Д5х.р не всегда можно ориентироваться только на знак и величину Д1 х,р. Так, например, в процессе изомеризации н-октана в 2, 2, 3, 3-тетраметилбутан ДУ1.р=0, но энтропия химической реакции не равна нулю Д5х.р 0, (Д5298)х.р= —18,5 э. е., Д5х.рупорядочивание структуры вещества сопровождается уменьшением энтропии. [c.210]
ВОЗМОЖНЫХ изомеров, 2,2,3,3-тетраметилбутан является наиболее ста-бильным нз октавов с ДЯ бр, pasHofi —53.99 ккал/моль. Подобные тенденции наблюдаются и в других сериях изомеров. [c.21]
chem21.info
Метил-вгор-бутиловый эфир - Справочник химика 21
Химия и химическая технология
Статьи Рисунки Таблицы О сайте Реклама Пользуясь в основном той же методикой, автор получил следующие втор-бутиловые эфиры егор-бутиловый эфир акриловой кислоты, т. кип. 127—129°, 1,4158 вгор-бутиловый эфир мет акриловой кислоты, т. кип. 59—62°/34 Лр 1,4161 вгор-бутиловый эфир тиглиновой кислоты, т. кип. 84,5°/27 [c.87]При выдерживании диэтилового эфира при 130—140 °С под давлением этилена в присутствии трет-бутилпероксида и соляной кислоты были получены несколько соединений (табл. 5, опыт26). Этилирование протекало по нормальной схеме, приводя к втор-бутилэтиловому эфиру, ди-вгор-бутиловому эфиру (этилирование по обоим вторичным углеродным атомам эфира), к 1-метил-1-этил-пропилэтиловому эфиру (этилирование по третичному углероду первичного продукта) и к этил-1-метилпентиловому эфиру, образующемуся в результате теломеризации первичного радикала с двумя молекулами этилена. Было получено, кроме того, некоторое количество простых эфиров Сю. Образующийся продукт [c.146]
Установлено, что различные сложные эфиры 6-метил-З-цик-логексен-1-карбоновой кислоты являются аттрактантами для самцов средиземноморской мухи. К ним относятся бутиловый, изопропиловый, 1-этилпропиловый, вгор-бутиловый эфиры этой кислоты [c.200]Синтетический продукт — вгор-бутиловый эфир 6-метил-З-циклогексен-1-карбоновой кислоты (сиглур)—заменил собой дягилевое масло в борьбе со средиземноморской мухой во Флориде и уже использован в количестве около 9 т. Полевые опыты показывают, что этот эфир действует более продолжительное время, чем средний образец дягилевого масла (см. раздел Замечания, сделанные в корректуре ). [c.75]
Смотреть страницы где упоминается термин Метил-вгор-бутиловый эфир: [c.254] Реакции нитрилов (1972) -- [ c.254 ]© 2018 chem21.info Реклама на сайте
chem21.info